UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA
JONALSON NOGUEIRA ARAÚJO
ATIVIDADE CITOTÓXICA, BACTERIOSTÁTICA E
AGLUTINANTE PARA
LEISHMANIA
DE ConM: UMA LECTINA
ISOLADA DAS SEMENTES DO FEIJÃO DE PRAIA -
Canavalia
maritima
(Aubl.) Thou. (1813).
JONALSON NOGUEIRA ARAÚJO
ATIVIDADE CITOTÓXICA, BACTERIOSTÁTICA E
AGLUTINANTE PARA
LEISHMANIA
DE ConM: UMA LECTINA
ISOLADA DAS SEMENTES DO FEIJÃO DE PRAIA -
Canavalia
maritima
(Aubl.) Thou. (1813).
Dissertação apresentada ao Programa de
Pós-Graduação em Bioquímica da
Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Bioquímica.
Orientadora: Adriana Ferreira Uchôa. Co-orientador: Elizeu Antunes dos Santos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Araújo, Jonalson Nogueira.
Atividade citotóxica, bacteriostática e aglutinante para leishmania de ConM: uma lectina isolada das sementes do feijão de praia – Canavalia
marítima (Aubl.) Thou. (1813) / Jonalson Nogueira Araújo. – Natal, RN,
2015.
96 f.: il.
Orientadora: Profa. Dra. Adriana Ferreira Uchôa. Coorientador: Prof. Dr. Elizeu Antunes dos Santos.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Bioquímica.
1. Leishmaniose. – Dissertação. 2. Aglutinina. – Dissertação. 3. Citotoxicidade. – Dissertação. I. Uchôa, Adriana Ferreira. II. Santos, Elizeu Antunes dos. III. Universidade Federal do Rio Grande do Norte. IV. Título.
Ao senhor nosso Deus.
À minha querida esposa Emanuella pelos empurrões e por ter me estendido a mão
em todas as horas que tropecei.
Aos meus filhos, Bianca e Ian, que sem ainda nem saber foram meus grandes
incentivadores.
À outra parte da minha família, meu sogro Josa, minha sogra Fátima, minha
cunhada Kyzis e minha tia/mãe Isaura, que me deram todo o suporte que precisei e
ainda minha mãe Socorro e minha irmã Gabi pelo apoio e compreensão.
AGRADECIMENTOS
Ao senhor nosso Deus, por ter me proporcionado todas as condições para que eu conseguisse chegar até este momento.
À minha família, por todo o apoio que me deram durante todo este tempo.
À minha graciosa e amada esposa Emanuella e aos meus amados filhos Bianca e Ian, que tanto me ajudam e me inspiram a seguir em frente.
Ao meu grande amigo Anderson Felipe (Negão), pela ajuda, pelas brincadeiras, pela honestidade e acima de tudo por ser uma pessoa que pude conversar e contar em
todos os momentos deste mestrado.
À minha querida amiga Luciana Rabêlo, que muitas vezes me deu uma direção quando me senti perdido, pela companhia e conversas matinais.
À querida Paula, pelos aperreios compartilhados em vários momentos e pela valorosa amizade.
À grande amiga Ticiana, pelo convívio e paciência no laboratório
Aos grandes amigos Antônio e Raphael, que além da amizade, me ajudaram muito na realização dos experimentos.
Aos novos amigos e colegas de laboratório Leandro e John que me deram uma grande força na reta final do meu trabalho
À minha grande amiga Isabela, que me ajudou muito durante este trabalho
Às amigas de laboratório Iana e Iane, Samily, Jacilene, Virgínia pela companhia e ajuda.
Aos amigos de laboratório Raphael Russi, Igor, pela companhia e ajuda.
À Vanessa, Fabiana e Amanda, da nutrição, pela disposição e amizade.
À Adeliana, que sempre me deu muita força e é uma pessoa que respeito muito.
Ao colega Norberto, pelos ensinamentos na iniciação cientifica que serviram muito no meu mestrado.
À minha fabulosa turma de mestrado e aos amigos que fiz neste período e que perduram até hoje: Demétrios, Paula, Diego, Sinara, Kahena, Romulo, Marina,
Evellyn, Mayara.
Aos amigos Ricardo, Rausito, Juliana, Dafiny, Diego (Rosa) Flávio e Everton pelas brincadeiras e ajuda.
Aos todos os colegas do Biopol (São muitos).
Aos colegas do IMT.
À Professora Adriana Ferreira Uchôa, por ter me aceito como seu aluno, por ser sempre gentil e acolhedora e por todo o apoio e incentivo durante a minha formação
na graduação e na pós-graduação.
Ao Professor Elizeu Antunes dos Santos, pela disponibilidade e pela sensibilidade, a qual é marca registrada de seu caráter, e por ter me adotado na co-oritentação deste
trabalho.
Ao professor Hugo Alexandre de Oliveira Rocha, pela amizade, por ter me acolhido e ter se preocupado em momentos essenciais em que necessitei.
Ao professor João Paulo Matos Santos Lima, pelos conselhos, explendorosas aulas e por ter me dado a honra de tê-lo em minha banca de defesa.
À Dra. Jailma Almeida de Lima, pelo carinho e atenção e por ter me dado o privilegio de tê-la em minha banca de defesa.
Aos professores da banca de qualificação Giulianna Paiva Viana De Andrade Souza, Rodrigo Juliani Siqueira Dalmolin e Alexandre Flavio Silva De Queiroz, pelas
valiosas contribuições e disponibilidade.
Ao Professor Ermeton Duarte, pelo apoio e conversas nos intervalos dos experimentos.
A todos os outros professores do departamentos de bioquímica e de outros departamentos da UFRN
À Sra. Margarita e Sr. Márcio (In memoriam), da secretaria da pós-graduação e ao Sr. Rogério e Sr. Ricardo, da secretaria do departamento, por todo o apoio.
Aos funcionários do Departamento de Bioquimica da UFRN.
Aos professores Marcello Porto Bemquerer (Embrapa), Guilherme Chaves (CCS –
UFRN) e Márcia Rosa de Oliveira (UFPB), pelo apoio na realização de experimentos.
Ao Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPQ), Financiadora de Estudos e Projetos (FINEP) e à Coordenação de Aperfeiçoamento
Vivemos o nosso quotidiano sem entendermos quase nada do mundo. Reflectimos pouco sobre o mecanismo que gera a luz solar e que torna a vida possível, sobre a gravidade que nos cola a uma Terra que, de outro modo, nos projectaria girando para o espaço, ou sobre os átomos de que somos feitos e de cuja estabilidade dependemos fundamentalmente. Exceptuando as crianças (que não sabem o suficiente para não fazerem as perguntas importantes), poucos de nós dedicamos algum tempo a indagar por que é que a natureza é assim; de onde veio o cosmos ou se sempre aqui esteve; se um dia o tempo fluirá ao contrário e se os efeitos irão preceder as causas; ou se haverá limites definidos para o conhecimento humano. Há crianças, e conheci algumas, que querem saber qual é o aspecto dos "buracos negros"; qual é o mais pequeno pedaço de matéria; por que é que nos lembramos` do passado e não do futuro; como é que, se inicialmente havia o caos, hoje existe aparentemente a ordem; e por que *há* um Universo.
RESUMO
Sementes de plantas são reservatórios de moléculas com grande potencial para elaboração de bioprodutos e por este motivo uma especial atenção tem sido direcionada na busca de proteínas bioativas com ação antimetabólica e propriedades farmacológicas. As lectinas de plantas são proteínas com atividades biológicas relacionadas a defesa, mas que podem ser utilizadas, heterologamente, como interferentes no metabolismo de outros organismos. Uma lectina das sementes de
Canavalia maritima (CML) foi purificada em dois passos, pelo fracionamento com
sulfato de amônio seguido pela cromatografia de afinidade em coluna Sephadex G-50. CML foi analisada por SDS-PAGE e parte de sua sequência de aminoácidos determinada por espectrometria de massas. Os 20 resíduos identificados apresentaram 100% de identidade com ConM. ConM foi testada contra eritrócitos do sangue periférico humano e foi constatado a ausência de toxicidade quando incubados com até 1000 µg/mL da proteína. Já contra células mononucleares, a lectina não foi significativamente tóxica nas concentrações de 1, 2,5 e 5 µg/mL, mas o foi a partir da concentração 7 µg/mL e contra a linhagem RAEC a proteína não apresentou toxicidade significante com 25 µg/ml da proteína. Outros ensaios de citotoxicidade revelaram que a ConM é tóxica para as linhagens tumorais A549, 786-0, HT-29 e HeLa no intervalo entre 24 e 72 horas, principalmente nas concentrações de 5, 7 e 10 µg/ml. ConM foi capaz de aglutinar as formas promastigotas de Leishmania spp na concentração de 6,25 µg/ml. Quanto a ação contra Candida spp, nenhuma das concentrações testadas (1 a 500 µg/ml) foi capaz de interferir no crescimento. Quando avaliada a atividade bacteriostática, a ConM nas concentrações variando de 0,39 a 400 µg/ml não inibiu o crescimento de Escherichia coli, já para Staphylococcus aureus a concentração de 25 µg/ml se mostrou ativa, reduzindo o
crescimento em 75 %. Com base nos dados obtidos, a lectina isolada corresponde a uma isolectina do tipo ConA, e suas propriedades anti-tumoral, bacteriostático e aglutinante para Leishmania precisam ser melhor investigados para que seu potencial biotecnológico seja explorado.
Palavras-chave: Aglutinina, Citotoxicidade, Leishmaniose, Escherichia
ABSTRACT
Plant seeds are reservoirs of molecules with great potential for development of bioproducts and for this reason special attention has been directed in the search of bioactive proteins with antimetabolic and pharmacological properties action. Plant lectins are proteins with biological activities related to defense, but that can be used, heterologously as interfering with the metabolism of other organisms. A Canavalia marítima seeds lectin (CML) was purified in two steps by ammonium sulfate fractionation followed by affinity chromatography on Sephadex G-50 column. CML was analyzed by SDS-PAGE and part of its amino acid sequence determined by mass spectrometry. The 20 resulting residues identified showed 100% identity with conm. ConM was tested against erythrocytes of human peripheral blood and it was observed absence of toxicity when incubated with up to 1000 µg/mL of protein. Since against mononuclear cells, the lectin was not significantly toxic at concentrations of 1, 2.5 and 5 µg/mL, but it was from concentration 7 µg/mL. Against RAEC lineage protein showed no significant toxicity with 25 µg/mL of protein. Other cytotoxicity assays revealed that CONM is toxic for the tumor cell lines A549, 786-0, HT-29 and HeLa in the range between 24 and 72 hours, particularly at concentrations of 5, 7 and 10 µg/mL. ConM was still able to agglutinate promastigotes of Leishmania spp at concentrations of 6.25 µg/mL. About action against Candida spp any of the tested concentrations (1 to 500 µg/ml) was able to interfere with growth. When evaluated bacteriostatic activity, ConM in concentrations ranging from 0.39 to 400 µg/mL did not inhibit the growth of Escherichia coli, but the concentration of 25 µg/mL proved active aganist Staphylococcus aureus, reducing its growth by 75%. Based on these data, the lectin corresponds to a isolectin ConA-like, and its anti-tumor properties, bacteriostatic and binder for Leishmania need to be further investigated for its biotechnological potential exploited.
LISTA DE FIGURAS
Figura 1. Canavalia maritima em seu local de coleta, fruto e
sementes...19
Figura 2. Representação esquemática de merolectinas, hololectinas, quimerolectinas e superlectinas...22
Figura 3. Contato entre os dímeros canônicos de ConM...30
Figura 4. O duplo sítio de ligação iônica na ConM nativa (A) e o potencial eletrostático na superfície do dímero canônico de ConM...31
Figura 5. Amostra de C. maritima...42
Figura 6. Esquema dos passos purificação e identificação da ConM...46
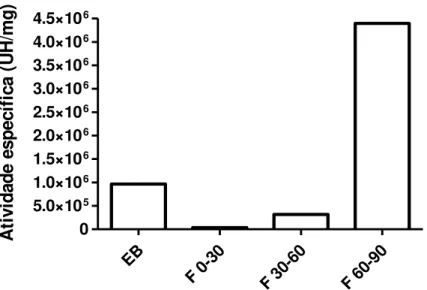
Figura 7. Atividade específica das frações proteicas de C. marítima...54
Figura 8. Perfil cromatográfico da F 60-90 em coluna Sephadex G50...55
Figura 9. Eletroforese (SDS-PAGE) da CML, em presença do agente redutor DTT...56
Figura 10. Alinhamento comparativo do sequenciamento da lectina de Canavalia maritima (CML)...57
Figura 11. Avaliação do efeito hemolítico de ConM sobre hemácias humanas.58 Figura 12.Efeito da ConM sobre a viabilidade das células mononucleares do sangue periférico humano...59
Figura 13. Efeito da ConM sobre a viabilidade da linhagen celular RAEC...60
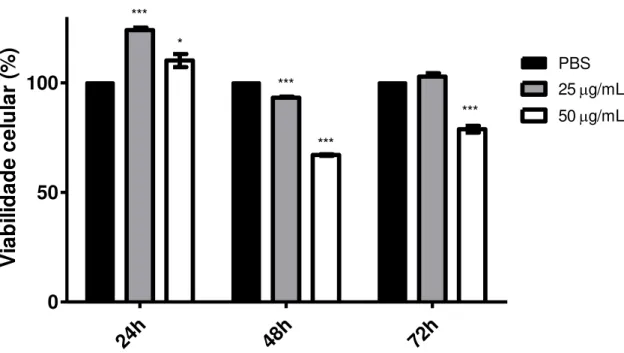
Figura 14. Efeito da ConM sobre a viabilidade da linhagen celular A549...62
Figura 15. Efeito da ConM sobre a viabilidade da linhagen celular 786-0...63
Figura 16. Efeito da ConM sobre a viabilidade da linhagen celular HT29...64
Figura 17. Efeito da ConM sobre a viabilidade da linhagen celular HeLa...65
Figura 18. Fotomicrografias em microscópio óptico da aglutinação das promastigotas de L. amazonensis tratadas com ConM...66
Figura 19. Fotomicrografias em microscópio óptico da aglutinação das promastigotas de L. (Viannia) braziliensis tratadas com ConM...67
Figura 20. Efeito da ConM sob o crescimento da cepa bacteriana E. coli...68
LISTA DE TABELAS
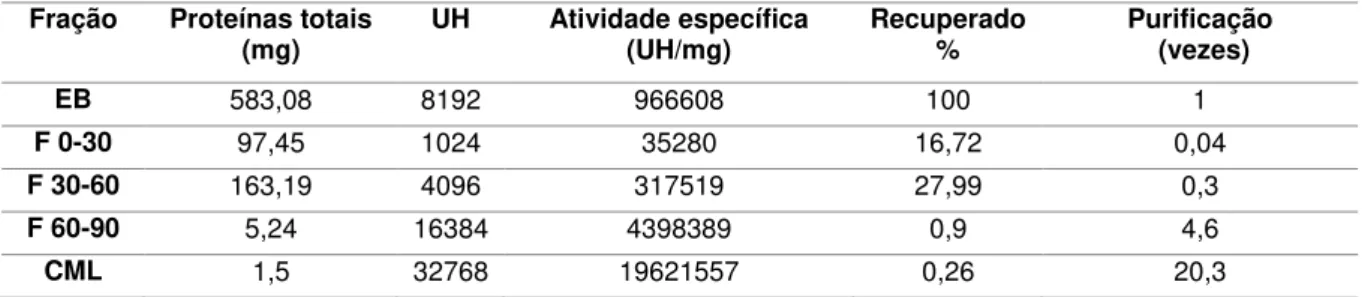
Tabela 1. Resultados da purificação da lectina da leguminosa Canavalia maritima
LISTA DE ABREVIAÇÕES/SIGLAS
786-0 - Adenocarcinoma renal humano
A375 - Melanoma
A549 - Carcinoma epitelial de pulmão humano
ATCC - American Type Culture Collection – Desenvolvedora e distribuidora de microrganismos e linhagens celulares
Bax - Promotor de apoptose
Bcl-2 - Inibidor de apoptose
BIOPOL - Laboratório de Biotecnologia de Polímeros Naturais
BSA - Albumina sérica bovina
CaCl2+ - Cloreto de Cálcio
CBM - Concentração bactericida mínima
CIM - Concentração Inibitória Mínima
CMN - Células mononucleares
ConA - Lectina isolada das sementes de Canavalia ensiformis ConBR - Lectina de Canavalia brasiliensis
ConM - Lectina isolada da semente de Canavalia maritima CR3 - Receptor do complemento do tipo 3
DGL - Lectina de Diocleia grandiflora
DMEM - Dulbecco’s Modified Eagle’s Medium - Meio para cultura celular
DNA - Ácido Desoxirribonucleico
DRC - Domínio reconhecedor de carboidratos
DTT - Ditiotreitol
G1 - Fases ciclo celular de crescimento 1
G2 - Fases ciclo celular de crescimento 2
gp63 - Glicoproteína 63
GPI - fosfatidil-inositol
HeLa - Adenocarcinoma de cólon uterino humano
Hepes - Ácido 1-piperazinoetanossulfónico-4-(2 hidroxietil)
HL60 –Leucemia promielocítica
HT29 - Adenocarcinoma coloretal humano
INCA -Instituto Nacional do Câncer
LCH - Leishmaniose cutânea humana
LCL - Leishmaniose cutânea localizada
LMC - Leishmaniose mucocutânea
LPG - lipofosfoglicano
LPS - lipopolissacarídeos
M - Fase M do ciclo celular (mitose)
MALDI-TOF/TOF - Ionização e dessorção a laser assistida por matriz – Tempo de voo
MCF7 - Câncer de mama
MDA MB 231 -
MHC - Caldo Mueller Hinton
MnCl2+ - Cloreto de Manganês MOLT-4 - Leucemia
MTT -3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazólio
Na2HPO4 - Fosfato de Sódio
NaH2PO4 - Di-hidrógeno fosfato de sódio
NF-Ƙb -Fator nuclear kappa B
NO - Óxido nítrico (NO)
NOS - Óxido nítrico sintase
PPG - Proteofosfoglicanos
RAEC - Célula epitelial de aorta de coelho
RCA I - Aglutinina de Ricinus communis
RPMI-1640 - Roswell Park Memorial Institute – 1640 - Meio para cultura celular SBA - Aglutinina de soja
SDS - Dodecilsulfato de Sódio
SFB -Soro Fetal Bovino
SLC - Sítio de ligação a carboidratos (SLC)
TEMED - N’, N’, N’, N’-Tetrametil-1-2-diaminometano
TNF-α - Fator de Necrose Tumoral - α
UFC - Unidades de formação de colônia
SUMÁRIO
1 INTRODUÇÃO E REVISÃO DE LITERATURA ... 17
1.1 CONSIDERAÇÕES GERAIS ... 17
1.2 FEIJÃO DE PRAIA - Canavalia maritima (Aubl.) Thou. (1813) ... 17
1.3 LECTINAS ... 19
1.3.1 CLASSIFICAÇÃO DAS LECTINAS ... 20
1.3.2 LECTINAS E SUAS FUNÇÕES ... 23
1.4 LECTINAS E PLANTAS... 24
1.4.1 LECTINAS E LEGUMINOSAE ... 25
1.4.2 LECTINAS E DIOCLEINAE ... 26
1.4.3 LECTINA E CANAVALIA ... 26
1.4.4 LECTINAS E Canavalia maritima ... 27
1.5 LECTINAS E CÂNCER ... 32
1.6 LECTINA E LEISHMANIA ... 33
1.7 LECTINAS E CANDIDA ... 35
1.8 LECTINA E BACTÉRIAS ... 36
1.9 JUSTIFICATIVA ... 37
2 OBJETIVOS ... 38
2.1 OBJETIVO GERAL ... 38
2.2 OBJETIVOS ESPECÍFICOS ... 38
3 MATERIAIS E MÉTODOS ... 39
3.1 MATERIAIS ... 39
3.1.1 EQUIPAMENTOS ... 39
3.1.2 REAGENTES ... 39
3.1.3 MATERIAIS BIOLÓGICOS ... 39
3.2.1 PURIFICAÇÃO E IDENTIFICAÇÃO DA LECTINA DO TIPO ConA DAS
SEMENTES DE C. Maritima (CML - ConM). ... 41
3.2.2 TESTES DE ATIVIDADES BIOLÓGICAS ... 47
3.2.3 ANÁLISES ESTATÍSTICAS ... 53
4 RESULTADOS ... 53
4.1 PURIFICAÇÃO E IDENTIFICAÇÃO DA LECTINA DO TIPO ConA DAS SEMENTES DE C. maritima. ... 53
4.2 DETERMINAÇÃO DE ATIVIDADES BIOLÓGICAS DA ConM ... 57
4.2.1 AVALIAÇÃO DA CITOTOXICIDADE SOBRE CÉLULAS DO SANGUE PERIFÉRICO HUMANO ... 57
4.2.2 EFEITOS DE ConM SOBRE A VIABILIDADE EM LINHAGEM NÃO TUMORAL ... 59
4.2.3 EFEITOS DE ConM SOBRE A VIABILIDADE EM CÉLULAS TUMORAIS ... 60
4.2.4 A AGLUTINAÇÃO DE PROMASTIGOTAS DE LEISHMANIA PELA ConM... 65
4.2.5 A ATIVIDADE FUNGISTÁTICA DA ConM CONTRA CANDIDA ... 67
4.2.6 AS ATIVIDADES BACTERICIDA E BACTERIOSTÁTICA DE ConM 68 5 DISCUSSÃO ... 70
6 SÍNTESE DOS RESULTADOS E CONCLUSÃO ... 79
17
1 INTRODUÇÃO E REVISÃO DE LITERATURA
1.1 CONSIDERAÇÕES GERAIS
As lectinas estão envolvidas em diversos eventos celulares (CAVALCANTE et al., 2011) e suas especificidades com relação aos diferentes carboidratos possibilitam a sua utilização em diversas pesquisas biológicas e médicas, pois as tornam poderosas ferramentas nos processos de purificação e caracterização de polissacarídeo ou glicoconjugados, caracterização de grupos sanguíneos, identificação de células malignas, diferenciação de células patogênicas e caracterização dos estágios de desenvolvimento de microrganismos (AKAHANI et al., 1997; DANGUY et al., 2002; SALES et al., 2000).
Nas duas últimas décadas os conhecimentos sobre lectinas têm contribuído para sua aplicação como um aparato essencial na análise de glicoconjugados presentes na superfície dos mais diferentes tipos celulares. O reconhecimento, por parte destas proteínas, das alterações dos padrões de glicosilação durante o desenvolvimento e diferenciação celular culminou em um grande número de modelos experimentais, permitindo assim a investigação de proteínas de superfície e sua relação com a perda ou comprometimento das funções celulares. (CAVADA et al., 2001).
Avanços significativos de novos fármacos, que intencionam o tratamento de doenças, se tornaram evidentes. E somando a isto os produtos naturais vêm se mostrando eficazes em condições terapêuticas. (REDDY et al., 2003). Estes compostos naturais, depois de provada sua eficácia, podem servir como um modelo para o desenvolvimento de outras gerações de agentes com características melhoradas. A obtenção de análogos é um processo comumente utilizado para descobrir os grupamentos essenciais à atividade biológica. E dentro desta perspectiva muito são os relatos que sugerem as lectinas vegetais como sendo eficazes quanto a suas propriedades terapêuticas (FAHEINA-MARTINS et al., 2012).
1.2 FEIJÃO DE PRAIA - Canavalia maritima (Aubl.) Thou. (1813)
Em inglês a espécie Canavalia maritima é conhecida como bay bean, seaside jackbean, costal jackbean e beach bean. É chamado de “feijão de praia” no Brasil,
18
Cuba e “Noumahlanga” em várias partes da África. Taxonomicamente possui a
seguinte sinônimia botânica: Canavalia rosea, Canavalia apiculata, Canavalia
arenicola, Canavalia obtusifolia, Dolichos emarginatus, Dolichos roseus e Dolichos
maritimus (MENDOZA-GONZÁLEZ; MARTÍNEZ; LITHGOW, 2014). Abaixo segue a
descrição taxonômica:
Reino: Plantae
Subreino: Tracheophytas
Super filo: Espermatóphyta
Filo: Magnoliophyta
Classe: Magnoliopsida
Subclasse: Rosidae
Ordem: Fabales
Família: Fabaceae
Subfamília: Faboideae (Papilionoideae)
Subtribo: Diocleinae
Gênero: Canavalia
Subgênero: Canavalia
Espécie: Canavalia rosea (Sw.) DC. / maritima
19 Figura 1–Canavalia maritima em seu local de coleta, fruto e sementes. Visualiza-se a flor característica
e as folhas arredondadas. Os frutos são vargens robustas, deiscentes, que possuem de três a sete sementes dormentes de cor marrom marmorizado. Fonte: autor e stuartxchange.org.
A espécie é encontrada nas linhas costeiras tropicais devido a dispersão de suas sementes pelas correntes oceânicas e a sua alta resistência a salinidade, ao enterro pela areia, aos poucos nutrientes e altas temperaturas. A planta é uma importante colonizadora de solos arenosos e desempenha um importante papel na geomorfologia de praias e dunas frontais. As folhas, caules e sementes possuem aplicações nutricionais e na medicina popular devido ao seu alto conteúdo proteico e outros ingredientes bioativos. (KITAJIMA et al., 2008; MENDOZA-GONZÁLEZ; MARTÍNEZ; LITHGOW, 2014).
1.3 LECTINAS
A característica que define todas as lectinas é sua capacidade de ligação a carboidratos e a preservação desta interação durante a evolução sugere que esta atividade é essencial para o papel funcional destas proteínas (GADELHA et al., 2004, 2005). O termo lectina é amplamente empregado para designar todas as proteínas, que não imunoglobulinas, que possuem pelo menos um domínio não catalítico, chamado de domínio reconhecedor de carboidratos (DRC) ou sítio de ligação a carboidratos (SLC).
20 lectinas podem promover a formação de ligações cruzadas entre células adjacentes, desencadeando o processo denominado aglutinação (ALONSO, et al., 2001;
PEUMANS & VAN DAMME, 1995).
No decorrer dos anos as lectinas têm se firmado como proteínas bastante atrativas devido seu uso extensivo como sondas para caracterização e isolamento de açúcares simples e complexos (RAMOS et al., 1996a, 1996b). A distribuição espacial dos sítios de ligação a carboidratos em proteínas oligoméricas determina suas habilidades de distinguir e de cruzar ligantes sacarídicos multivalentes ou arranjos de glicoconjugados específicos da superfície celular (DELATORRE et al., 2006). Estas interações celulares mediadas por lectinas podem ocorrer de duas maneiras: Quando lectinas da superfície celular transduzem um sinal depois da interação com um sacarídeo ligante ou quando lectinas solúveis se ligam a carboidratos de glicolipídios ou glicoproteínas na superfície da célula (BREWER et al., 2002).
Algumas famílias de lectinas apresentam sítios de ligação altamente conservados, mas exibem diferentes atividades biológicas assim como diferentes níveis de potência. A mutagênese, um processo evolucionário que causa alterações pontuais nos genes, que pode modificar a sequência de aminoácidos das proteínas e a interações existentes entre essas cadeias de aminoácidos podem aumentar ou reduzir a potência dos efeitos biológicos, até para aquelas proteínas que possuem estruturas muito similares (DELATORRE et al., 2006).
Sabendo dos efeitos biológicos das lectinas contra os mais diversos tipos de organismos, cientistas de todo o mundo estão investindo em pesquisas que possam, de alguma forma, utilizar estas proteínas como precursores na produção de novos medicamentos, na vetorização de fármacos de difícil absorção a sítios específicos no organismo ou até como marcadores na detecção de doenças e microrganismos; apresentando grande potencial para o diagnóstico e tratamento de doenças (GOMES-FILHO, 2014; THAYS et al., 2013).
1.3.1 CLASSIFICAÇÃO DAS LECTINAS
Baseado na arquitetura dos DRC das lectinas, quatro grupos principais podem ser distinguidos: merolectinas, hololectinas, quimerolectinas e superlectinas (figura 2).
21 capacidade de aglutinar células. Hololectinas são compostas por dois ou mais DRC idênticos ou bastante homólogos, sendo capazes de aglutinar células e/ou precipitar carboidratos. A maior parte das lectinas vegetais, que corriqueiramente são isoladas e caracterizadas, pertencem ao grupo das hololectinas. Superlectinas são compostas de pelo menos dois DRC com especificidade para açucares diferentes. O grupo das
22
Figura 2– Representação esquemática de merolectinas, hololectinas, quimerolectinas, superlectinas e multilectinas. As merolectinas são formadas de um único domínio de ligação a carboidratos (A –
Heveína). Hololectinas contém pelo menos dois domínios que são idênticos ou bastante homólogos que ligam-se a mesma estrutura de açucares ou a estruturas similares (B – ConA). Quimerolectinas são proteínas fusionadas que consistem de um ou mais domínio de ligação a carboidratos paralelamente ligado a outro domínio não relacionado (C – Ricina). Superlectinas consistem exclusivamente de pelo menos dois domínios de ligação a carboidratos (D – TxCL-I). Multilectinas possuem DRCs idênticos, mas são capazes de ligarem-se a açucares diferentes (E – Jacalina). Adaptado de Liu et al. (2009), Lima et al. (2013) e Helton C. da Silva, UFC (2013).
Merolectina
Superlectina Quimerolectina
Hololectina
TxLC-I Ricina
ConA Heveína
A
D C
B
E Multilectina
23
1.3.2 LECTINAS E SUAS FUNÇÕES
As lectinas estão presentes em quase todos os organismos, ou seja, microrganismos, plantas e animais. Entretanto essas proteínas são encontradas em maior quantidade em leguminosas e gramíneas (IORDACHE et al., 2015; PUSZTAI, 1989). O fato das lectinas terem larga distribuição em plantas sugere alguma importância fisiológica para estas moléculas (DIAS et al., 2015; ETZLER et al., 1985; LIENER et al., 1976). As funções das lectinas em vegetais podem ser variadas e parecem ter relação com os estágios de maturação e germinação das sementes (HAMID et al., 2013; HOWARD et al., 1972), assim como parecem estar relacionadas com os mecanismos de defesa da planta (DIAS et al., 2015; LIENER et al., 1976). As proteínas em plantas podem exercer papeis autólogos como reserva, na regulação de fitohormônios que controlam seu crescimento e desenvolvimento (DELATORRE et al., 2013), no armazenamento e transporte de carboidrato em sementes e na associação do vegetal a simbiontes (FERNANDES, 2008).
As plantas são excelentes fontes nutritivas para os organismos. Como tal, elas são constantemente desafiadas por herbívoros, vírus, bactérias, fungos, nematoides fitófagos e insetos que diretamente as utilizam como fontes de micro e macronutrientes (ARAÚJO-FILHO et al., 2010a; DELATORRE et al., 2013). Muitas lectinas de plantas mostraram-se específicas para glicoconjugados presentes em organismos fora deste reino, enquanto que estes glicoconjugados são pouco abundantes ou ausentes em vegetais (HOPKINS; HARPER, 2001; RIPOLL et al., 2003; WONG et al., 2010). Peumans e Van Damme (1995) propuseram que as lectinas de plantas desempenham um papel fundamental nas defesas gerais contra um grande número de fitoagressores.
24 Devido a habilidade das lectinas em decifrar glicocódigos, integrais de membrana ou solúveis, elas participam em inúmeros processos biológicos, que vão desde comunicação celular, reconhecimento de célula-alvo, adesão celular, interação célula-matriz, defesa dos hospedeiros, fertilização, na caracterização de grupos sanguíneos (DIAS et al., 2015; LIS; SHARON, 1998); na estimulação da mitogênese de linfócitos; e outros a infecções virais, bacteriana, micoplasmal e parasitaria, metástases, crescimento e diferenciação em cânceres (ASSREUY et al., 2009; BEZERRA et al., 2007; IORDACHE et al., 2015; JIANG et al. 2015; SHARON; LIS, 2004).
As lectinas ainda podem ser utilizadas na investigação de estrutura de proteína e carboidratos em células (SILVA; SILVA, 2000); na utilização em matrizes comerciais de afinidade, empregadas na purificação e caracterização de polissacarídeos e glicoconjugados (HAMID et al. 2013; LIMA et al., 1997); e como agentes defensivos na agricultura, em função de sua ação fungicida, bactericida e inseticida (GAIDAMASHVILI; VAN STADEN, 2002; HAMID et al., 2013; PEUMANS et al., 2000.).
1.4 LECTINAS E PLANTAS
Um grupo particular e heterogêneo, dentre o grande acervo destes tipos proteicos, é chamado de lectinas de plantas ou aglutininas de plantas. Análises genômicas e transcriptômicas mostram que as sequências de lectinas são ubíquas no reino das plantas e centenas de lectinas já foram purificadas de várias espécies (GADELHA et al., 2005a; VAN DAMME et al., 2008).
A classificação racional das lectinas é baseada nas suas especificidades de ligação a carboidrato. Entretanto mesmo em um grupo em particular as lectinas demonstram algumas diferenças nas ligações aos carboidratos e nas propriedades fisiológicas. Estas diferenças são menos pronunciadas quando as lectinas são extraídas a partir de plantas botanicamente relacionadas, refletindo relações evolucionarias entre espécies ou tribos da mesma família (DIAS et al., 2015; MOREIRA et al., 1983, 1990).
25 relacionados evolutivamente e estruturalmente (DIAS et al., 2015; VAN DAMME et al., 2008). Estes diferentes domínios de ligação a carboidratos foram nomeados: homólogos da aglutinina de Agaricus bisporus, amarantininas, homólogos da quitinase
classe V, família das cianovirinas, família das aglutininas de Euonymus europaeus,
Família das aglutininas de Galanthus nivalis, proteínas com domínios heveína,
jacalinas, proteínas com domínios lectínicos de leguminosas, domínios LysM, família das aglutininas de Nicotiana tabacum e família da ricina-B. Cada domínio lectínico tem
suas próprias características interagindo com um ou mais sítios de ligação a carboidratos (DIAS et al., 2015; IORDACHE et al., 2015; VAN DAMME et al., 2008, 1998).
1.4.1 LECTINAS E LEGUMINOSAE
As lectinas de leguminosas têm sido consideradas um sistema modelo para a investigação das interações proteína-carboidrato (ASSREUY et al., 2009) e constituem uma larga família de proteínas homólogas, estruturalmente similares e com distintas especificidades. Elas pertencem ao grupo das lectinas de plantas mais estudadas e melhor caracterizadas. Além disso, as lectinas de leguminosas possuem estruturas tridimensionais bastante similares e uma alta correspondência na sequência de aminoácidos e ainda apresentam uma considerável diversidade de oligomerização monomérica. Alterações na orientação relativa dos sítios de ligação a carboidratos na estrutura quaternária de lectinas homólogas têm sido especuladas como contribuinte nas diferenças das atividades biológicas e potência destas lectinas (CAVALCANTE et al., 2011; DELATORRE et al., 2006, 2013).
As lectinas de sementes de leguminosas mostram uma notável conservação em suas estruturas primárias, secundárias e terciárias. De fato, aproximadamente 85% de cada sequência de lectina de leguminosa é dedicada estruturalmente a regiões conservadas. Comparações destas sequências e estruturas estabeleceram que diferenças na especificidade por carboidratos parecem ser primariamente devido a diferenças nos resíduos de aminoácidos onde existem loops adjacentes ao sítio de
ligação de carboidratos. A conformação destes loops é determinado pela presença de
26
1.4.2 LECTINAS E DIOCLEINAE
As lectinas presentes nas sementes da subtribo Diocleinae são glicose/manose específicas e assim podem ser isoladas por cromatografia de afinidade em coluna Sephadex G-50 (ASSREUY et al., 2009; GADELHA et al., 2004; MOREIRA et al., 1993). Uma comparação nas sequências primárias de lectinas de Diocleinae revelam pequenas diferenças em seus resíduos de aminoácidos, na qual pode levar a mudanças na conformação das estruturas quaternárias e nas atividades biológicas. Diversos fatores contribuem para estas diferenças: por exemplo, a oligomerização pH dependente que algumas destas lectinas apresentam e a posição relativa do sítio de ligação ao carboidrato (ASSREUY et al., 2009; BEZERRA et al., 2007; PINTO et al., 2013).
Observa-se, em lectinas de algumas espécies desta subtribo, uma permutação circular nas sequências de aminoácidos quando comparado com outras lectinas de sementes pertencentes a outras tribos de Leguminosae, onde especula-se ser devido a um evento de transpeptidação durante o processamento pós-traducional de um precursor (PEREZ et al., 1991).
Foi demonstrado que lectinas desta subtribo agem como indutoras da proliferação de linfócitos e produção de interferon gama, estimulador de macrófagos, e migração de leucócitos e além disso, está claro que a interação de monossacarídeos com proteínas de Diocleinae estão envolvidas nas atividades biológicas do sistema imunológico (BEZERRA et al., 2007; PINTO et al., 2013; RAMOS et al., 1996a).
1.4.3 LECTINA E CANAVALIA
As plantas pertencentes ao gênero Canavalia são largamente distribuídas na
região tropical. Estudos mostraram que as sementes de plantas do gênero Canavalia
27
Collaea, Camptosema, Dioclea, Cratylia, Galactia, Cymbosena, Herpiza,
Calopogonium, Macropsichanthus e Luzonia. O gênero Canavalia é dividido em quatro
sub-gêneros: Catadonia, Wenderothia, Maunaloa e Canavalia. (MOREIRA et al.,
1993; NIVEDITHA; VENKATRAMANA; SRIDHAR, 2013; SEENA; SRIDHAR; RAMESH, 2005).
As lectinas que ocorrem em Canavalia são resultado do processamento de um
precursor glicosilado complexo durante a maturação das sementes. Observa-se que além da subunidade alfa principal, que corresponde a 237 resíduos de aminoácidos, duas outras subunidades chamadas beta e gama, que são fragmentos naturais da subunidade alfa e considerados moléculas incompetentes, ocorrem na estrutura quaternária destas lectinas (RAMOS et al., 1996a).
Lectinas dos gêneros Canavalia, Dioclea e Cratylia demonstram um alto grau de
similaridades estruturais. Elas são estruturas diméricas ou tetraméricas construídas a partir de monômeros em forma de cúpula que consiste em motivos beta interconectado por voltas e loops (GADELHA et al., 2005a, 2005b).
A ConA, isolada das sementes de Canavalia ensiformis é uma lectina bastante
estudada em termos da especificidade de ligação a carboidratos, propriedades ion-metálica e estrutura tridimensional (GADELHA et al., 2005a, 2005b). A ConA foi a primeira lectina a ser isolada, sequenciada e a ter sua estrutura tridimensional determinada por cristalografia de raios-x. Os muitos estudos bioquímico, biofísicos e estruturais realizados em ConA fazem desta proteína a lectina melhor compreendida até agora. Esta lectina possui uma estrutura multimérica na qual apresenta uma interconversão dímero-tetramero dependente de pH. Desde que ela foi isolada, diversas outras lectinas, com propriedades físicas semelhantes, foram purificadas e caracterizadas do mesmo táxon ao nível de gênero. Todas possuem estruturas multiméricas constituídas de monômeros de aproximadamente 25.5 kDa, são metaloproteínas na qual em cada subunidade existe um sítio de ligação a metal para os íons Ca2+ e Mn2+ e uma cavidade hidrofóbica na qual ligantes hidrofóbicos
interagem (CAVADA et al., 2001).
1.4.4 LECTINAS E Canavalia maritima
28 comumente conhecida como feijão de praia ou pela nomenclatura binária Canavalia
maritima (DELATORRE et al., 2013). É uma hemaglutinina de aproximadamente 25.5
kDa por monomêro, classificada como hololectina. O tetrâmero que forma a proteína consiste de dois dímeros canônicos de lectinas de leguminosa, sendo cada monômero formado por uma cadeia polipeptídica de 237 resíduos de aminoácidos (DELATORRE et al., 2013; MOREIRA E CAVADA, 1984).
A especificidade de ligação a carboidratos da ConM foi avaliada pela inibição dos haptenos na hemaglutinação, utilizando vários monossacarídeos e seus derivados como inibidores (RAMOS et al., 1996a). ConM é uma lectina do tipo ConA e apoiando este fato, foi relatado que esta proteína possui uma afinidade por diversos monossacarídeos que são comuns as lectinas de Diocleinae, inclusive glicose e manose, entretanto trealose e maltose inibem fortemente a atividade hemaglutinante da lectina (DELATORRE et al., 2006, 2013; GADELHA et al., 2005b).
Ao longo de vários anos diversos autores se propuseram a caracterizar esta lectina. A existência de isoformas menores foi confirmada pelos resultados de eletroforese em gel de poliacrilamida (PAGE) sobre condições acidas e alcalinas e focalização isoelétrica, e é típica de muitas outras lectinas de leguminosa (PEREZ et al., 1991). A sequência da ConM foi alinhada com as de outras lectinas de sementes de Dioclea grandiflora e Canavalia ensiformis. A análise deste alinhamento revelou
um alto nível de similaridade uma com as outras, com 71% dos resíduos sendo conservados (PEREZ et al., 1991).
Moreira e Cavada (1993) analisaram a influência do pH na solubilidade das proteínas e na atividade hemaglutinante e concluíram que a máxima atividade hemaglutinante em relação com a solubilidade ocorria em pH 8,0. Toda a estrutura nativa da ConM foi analisada e considerada tetramérica do tipo ConA e foi depositada no banco de dados de proteínas (PDB) com o código PDB 2CWM (GADELHA et al., 2005a, 2005b).
29 similaridade com ConA, entretanto, alguns resíduos foram corrigidos por Gadelha et al. (2005), resultando em um aumento na similaridade para 98%. Assim, apenas cinco resíduos de aminoácidos diferem a ConA (D58, A70, M129, E192 e P202) da ConM (G58, G70, S129, D192 e S202). O principal alvo dos estudos de afinidade das lectinas é como diferenças estruturais podem alterar a atividade biológica e melhorar a especificidade por glicanos na superfície celular. Em ConM, uma única modificação na sequência de aminoácidos observada em comparação com outras lectinas do tipo ConA amplifica suas propriedades. (DELATORRE et al., 2006).
A ConM difere da ConA também no sentido de formarem mais interações de Van der Waals e ligações de hidrogênio criando um grande superfície de contato e promovendo uma alta afinidade por dimanosídeos. Adicionalmente, o realocamento da prolina 202 (P202) pela serina202 (S202) na lectina de C. maritima é único dentre
as lectinas do tipo ConA já sequenciadas (GADELHA et al., 2004, 2005; PINTO et al., 2013). Delatorre et al. (2006) relatou que a estrutura cristalizada da ConM complexada com trealose e maltose revelou mutações pontuais relevantes, que explica a alta afinidade desta por dissacarídeos quando comparado com monossacarídeos. Esta análise estrutural comparativa entre ConM e outras lectinas de diocleinae, complexadas com diferentes dimanosídeos, criou novas perspectivas no entendimento do relacionamento da estrutura com a atividade biológica em lectinas de leguminosas (BEZERRA et al., 2007).
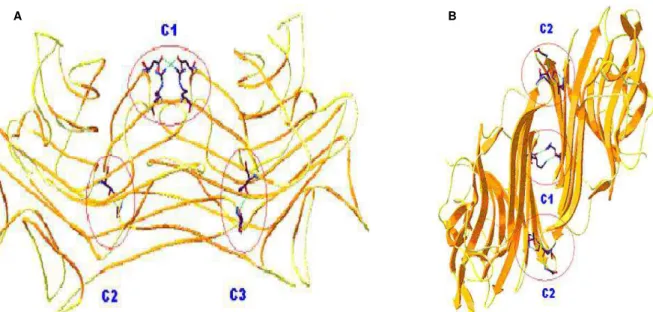
30 Figura 3– Contato entre os dímeros canônicos de ConM. Cada resíduo nos sítios C1 e C2 interconecta os dímeros (A) e as interações que estabilizam a estrutura estão na mesma linha (B). Adaptado de Gadelha et al. (2005b).
Na ConM, os aminoácidos envolvidos nas ligações metálicas são conservados, e as estruturas do sítio de ligação de Mn2+ e Ca2+ mostram similaridades com as determinadas para outras lectinas de leguminosas. Monômeros de ConM contem íons Mn2+ e Ca2+ na proximidade do sitio de ligação ao carboidrato (figura 4 - A) (GADELHA
et al., 2005b). Como notado em estruturas do tipo ConA, o sítio de ligação ao açúcar em ConM exibe um potencial eletrostático negativo. Após a ligação do sacarídeo, esta superfície eletrostática negativa se torna coberta por uma carga neutra (figura 4 - B) (GADELHA et al., 2005b).
31 Figura 4– O duplo sítio de ligação iônica na ConM nativa (A) e o potencial eletrostático na superfície do dímero canônico de ConM. Neste último o círculo amarelo aponta o potencial eletrostático negativo dos DRC. Adaptado de Gadelha et al. (2005b).
A ConM é amplamente estudada quanto a sua atividade anti-inflamatória, principalmente em eventos celulares mediados pela prostaglandina E2, óxido nítrico e TNF-α em ratos não sensibilizados e sensibilizados (PINTO et al., 2013). Foi mostrado que esta lectina relaxa aorta de ratos via ativação da enzima Oxido nítrico sintase (NOS) responsável pela formação de óxido nítrico (NO) e induzem também edema de pata (ASSREUY et al., 2009; GADELHA et al., 2005). A propriedade de liberação de histamina pela ConM, induzidas em mastócitos peritoneais de ratos, foi comparada com a da ConA e com outras lectinas purificadas a partir de sementes pertencentes à mesma família. Menor potência e eficácia foi observado para ConM (GOMES et al., 1993).
Uma outra atividade descrita para ConM está relacionada a sua interação com diferentes formas de Ácido acético 3 idoleico (IAA) é uma estratégia para tornar o este fitohormônio indisponível para a célula. Assim este papel fisiológico proposto para as lectinas de plantas pode ser um novo mecanismo pela qual os níveis de IAA são diminuídos além da destruição e formação de novos complexos em determinados estágio da germinação de sementes (DELATORRE et al., 2013).
32 conídios não germinados do fungo Colletotrichum gloeosporioides que causa doenças
em plantas (ARAÚJO-FILHO et al., 2010a, 2010b). ConM também é capaz de inibir o crescimento planctônico e a formação de biofilmes por Streptococcus mutans,
interferindo na expressão de genes que codificam enzimas relacionadas com a adesão formação e regulação dos biofilmes (CAVALCANTE et al., 2011; THAYS et al., 2013).
1.5 LECTINAS E CÂNCER
O câncer pode ser definido como uma proliferação anormal de células que são capazes de invadir e colonizar os mais diversos tecidos do organismo. Estas disfunções podem ser ocasionadas por mutações somáticas que modificam a expressão gênica estimulando a proliferação celular, alterando o balanço natural entre as células mutantes e não mutantes (FAHEINA-MARTINS et al., 2012; TEIXEIRA, 2012).
A carcinogênese corresponde a uma condição multicausal, entretanto, o estágio final de transformação maligna da célula envolve sempre um desequilíbrio em prol do processo de proliferação celular, em detrimento dos processos de diferenciação celular e apoptose. Para uma melhor compreensão do câncer se faz necessário compreender a importância de uma gama de fatores que contribui para o seu desencadeamento. Um destes fatores e o sistema imunológico, mediando processos fundamentais da resposta contra células neoplásicas. Outro fator, a oncogênese, envolve situações genéticas como lesão e reparo de DNA, mediados por três grupos de genes: os oncogenes, os genes supressores de tumor e os genes de estabilidade (PINTO et al., 2012)
33 As interações entre lectinas e carboidratos promove uma mudança na fisiologia da célula. As expressões gênicas são alteradas e como resultado pode-se observar, alterações metabólicas (FAHEINA-MARTINS et al., 2011). A alta especificidade de interação com carboidratos faz das lectinas potentes marcadores moleculares para glicoconjugados específicos de células tumorais. Além disso, estas proteínas podem ser conjugadas com uma série de agentes carreadores agindo pontualmente em células malignas (RABELO et al., 2012).
As lectinas de plantas representam um bem definido e não tradicional recurso acerca de componentes anticâncer, entretanto seu papel na morte celular programada ainda é pouco conhecido. Nos dias atuais existe um grande interesse em Lectinas de leguminosas, principalmente pela sua potencial aplicação como um agente antitumoral. Tem sido demonstrado que lectinas de plantas desencadeiam importantes processos celulares, além de atuarem como adjuvantes na quimioterapia e radioterapia (HAMID et al., 2013; JIANG et al., 2015; ZAROGOULIDIS et al., 2015) Estas proteínas têm atraído o interesse de pesquisadores devido as suas vastas atividades biológicas, da qual incluem a habilidade de parar o ciclo celular nas fases G1 e G2/M, alterar a expressão de caspases pró-apoptótica e aumentar a taxa de Bax/Bcl-2 em células neoplásicas (KLAFKE et al., 2013). Neste contexto, as lectinas de leguminosas têm sido amplamente destacadas por possuírem efeitos inibitórios específicos ou citotoxicidade e por induzir apoptose em uma ampla variedade de células tumorais (SILVA et al., 2014).
1.6 LECTINA E LEISHMANIA
Os parasitos do gênero Leishmania são organismos unicelulares que apresentam um ciclo heteroxênico, caracterizado por duas principais formas morfológicas: as formas promastigotas, encontradas no intestino do inseto vetor, apresentando um formato alongado e flagelo livre e as formas amastigotas, encontradas no interior dos macrófagos, que se apresentam ovaladas e possuem o flagelo incluso não exposto. Para que haja a infecção, este protozoário precisa contornar o sistema imunológico desde o início de sua inoculação (GOMES-FILHO, 2014).
34 membrana vem sendo identificados como mediadores da ligação parasito-célula, dentre estas moléculas destacam-se dois glicoconjugados: a protease gp63 (uma glicoproteína) e o lipofosfoglicano (LPG) que ligam-se ao receptor do complemento do tipo 3 (CR3), manose-fucose e fibronectina. A superfície celular dos tripanosomatídeos é revestida ricamente por moléculas glicosiladas, a maioria ancorada à membrana celular. Estes glicoconjugados formam uma densa camada superficial protetora, cobrindo por inteiro a superfície da célula, intermediando as interações do parasito com seus hospedeiros. (BARBOSA, 2012). Leishmania apresenta em sua superfície glicoconjugados ricos em manose que são críticos para virulência parasitária (GOMES-FILHO, 2014). Além disso, outros glicoconjugados estão presentes na superfifie celular deste protozoário, como os glicosil-fosfatidil-inositol (GPI), os proteofosfoglicanos (PPG) e outras glicoproteínas contendo âncoras GPI.
Leishmania (Viannia) brasiliensis é o princicipal agente etiológico da
leishmaniose cutânea nas américas sendo responsável por causar duas diferentes formas clínicas: a leishmaniose cutânea localizada (LCL) e a leishmaniose mucocutânea (LMC) (FARIAS et al., 2012).
Leishmania amazonensis é o agente causador da leishmaniose cutânea
humana (LCH) no novo mundo, na qual a maioria dos casos envolve uma severa leishmaniose cutânea difusa e anérgica (CHAVES et al., 2003).
Lectinas são frequentemente utilizadas para sondar os carboidratos de membrana de diferentes cepas de leishmania para discriminar entre cepas patogênicas e não patogênicas deste parasita e ainda distinguir entre diferentes estágios morfológicos (BARBOSA et al., 2012). Lectinas também tem sido utilizadas em purificação por afinidade de diferentes glicoconjugados de leishmania (ANDRADE; SARAIVA, 1999), identificação de cepas e espécies e composição do glicocálix (IORDACHE et al., 2015; MEDEIROS et al., 2010). Em algumas espécies de
Leishmania, promastigotas metacíclicas são purificadas por seleção negativa. Relatos
35
1.7 LECTINAS E CANDIDA
Os fungos do gênero Candida são patógeno comuns em humanos, sendo
componentes da microflora endógena da pele, mucosas, e trato digestório de hospedeiros sadios. Entretanto, quando as defesas imunológicas são comprometidas ou o balanço da microflora normal é perturbado, Candida transforma-se em um
patógeno oportunista potencialmente letal. De fato, a disseminação de Candida lidera
as causas de doenças fúngicas invasivas em diabéticos, nascidos prematuros, pacientes cirurgiados ou com doenças orofarígeas bem como pacientes com AIDS (WANG et al., 2013). Candida está classificada como a quarta entre os patógenos
nosocomial e a infecção por cândida tem um importante impacto na medicina e na economia ligado as dificuldades no diagnóstico clínico e biológico (DAMIENS et al., 2012). Nos últimos anos, a procura por novas moléculas antifúngicas tem recebido uma atenção especial tendo em vista o surgimento de casos de fungos oportunistas e de difícil tratamento. (CHARUNGCHITRAK et al., 2011; COELHO, 2011; ISLAM; KHAN, 2011).
Lectinas de plantas não são bem exploradas nas suas habilidades de inibir a atividade de fungos patogênicos em humanos. A respeito do grande número de lectinas e hemaglutininas que já foram purificados, apenas poucas manifestaram uma atividade antifúngica, o que é contraditório se levarmos em consideração o papel destas proteínas no mecanismo de defesa de plantas. (CHARUNGCHITRAK et al., 2011; ISLAM; KHAN, 2011; KLAFKE et al., 2013).
A inibição do crescimento fúngico pode ocorrer através das ligações das lectinas com as hifas, resultando em uma pobre absorção de nutrientes, assim como pela interferência no processo de germinação dos esporos. Relatos apontam lectinas que se ligam a quitina mostram um maior índice de interferência contra fungos, prejudicando na síntese e ou na deposição de quitina na parede celular (KLAFKE et al., 2013).
36 parede celular; outras lectinas de plantas também suprimem o crescimento fúngico, mas não causam a sua morte (ANG et al., 2014; COELHO, 2011).
1.8 LECTINA E BACTÉRIAS
Relatos apontam que as interações entre lectinas e membranas de microrganismos possibilitam a distinção entre espécies bem como demonstram a presença de um resíduo de açúcar em particular. Entre as bactérias que reagem com lectinas destacam-se além das Gram-negativas e positivas algumas espécies de micobacterias e actinomicetos (PISTOLE, 1981). Muitos patógenos humanos utilizam estes açúcares da superfície celular como receptores ou ligantes para iniciar a adesão e a infecção. Algumas bactérias por exemplo ligam-se aos manosídeos do hospedeiro, outras cepas demonstraram especificidades contra uma variedade de carboidratos da superfície da célula hospedeira, tais como galabiose. Cada interação hospedeiro-patógeno é multivalente e portanto estes eventos de ligação possuem uma alta afinidade e se tornam adequadas para a infeção. (AWOYINKA et al., 2013; HAMID et al., 2013; IORDACHE et al., 2015).
A atividade das lectinas contra bactérias Gram positivas e Gram negativas ocorrem por meio das interações entre a proteína e os componentes da parede celular, tais como peptídioglicanos e lipopolissacarídeos (LPS) (HAMID et al., 2013). Bactérias podem distinguir entre dois carboidratos praticamente idênticos, onde a única diferença está em apenas um grupo hidroxila, e baseado neste tipo de especificidade entre patógeno e hospedeiro, estratégias podem ser desenvolvidas para prevenir a adesão bacteriana (IORDACHE et al., 2015).
A habilidade dos microrganismos patogênicos em formar agregados é uma realidade preocupante. As indústrias farmacêuticas associadas com grupos de pesquisas trabalham para desenvolver novas opções para o tratamento de infecções causadas por bactérias organizadas em biofilmes. Moléculas capazes de se ligarem especificamente e seletivamente a carboidratos tem uma grande importância no desenvolvimento da pesquisa relacionada com biofilmes microbianos. Assim lectinas vêm se mostrando uma poderosa ferramenta para análise de estruturas glicídicas destes agregados de origem microbiana. Lectinas podem ser um agente antiaderente adequado para Streptococci, desde que mecanismos dependentes de lectinas
37 nas interferências contra biofilmes ainda são pouco explorados (TEIXEIRA, 2012). Um outro interessante mecanismo de ação é o bloqueio dos movimentos das bactérias, causando perda de motilidade e prevenindo a invasão pelos patógenos (DE SOUZA CANDIDO et al., 2011).
1.9 JUSTIFICATIVA
38
2 OBJETIVOS
2.1 OBJETIVO GERAL
Investigar o potencial bioativo de uma lectina (ConM) purificada de sementes da leguminosa Canavalia maritima (feijão de praia).
2.2 OBJETIVOS ESPECÍFICOS
Purificar e Identificar uma lectina do tipo ConA das sementes de Canavalia maritima (feijão de praia) conhecida como ConM.
Analisar a ação tóxica da ConM contra células do sangue periférico humano.
Avaliar a ação da ConM frente a viabilidade de linhagens celulares não tumoral, e tumoral.
Averiguar a capacidade aglutinante de ConM contra Leishmania sp.
Testar a capacidade fungistática de ConM contra Candida spp.
39
3 MATERIAIS E MÉTODOS
3.1 MATERIAIS
3.1.1 EQUIPAMENTOS
Além dos aparelhos usuais do laboratório, pode-se destacar: Banho Maria (Tecnal – Te 056)
Balança analítica eletrônica - BEL Engineering Balança eletrônica – Tecnal (mod. B-tec 2200) Centrífuga refrigerada HITACHI CR G
Cuba de eletroforese BIORAD
Espectrofotômetro Pharmacia Biotec (mod, ultrospec 2100 – pro) Purificador de água Milli-Q® Water System (Millipore Corp.)
Bancada de Fluxo Laminar (PACHANE Pa300)
Incubadora Thermoforma Serie II Water CO2 Incubator HEPA Filter Model
3110
Liofilizador TERRONI FAUVEL – LB 1500 TT Microcentrífuga para eppendorf 5410
Microcentrífuga para hematócrito (Modelo spin 1000) Microscópio invertido NIKON Eclipse TE300
Peagâmetro Analyser (pH 300)
3.1.2 REAGENTES
Todos os reagentes utilizados neste trabalho foram de grau analítico, adquiridos comercialmente, sendo manuseados segundo recomendação do fabricante, quando especificado.
40
3.1.3.1 Canavalia maritima (FEIJÃO DE PRAIA)
As sementes da leguminosa Canavalia maritima foram coletadas na praia do
Forte, localizada no litoral sul da região metropolitana de Natal, estado do Rio Grande do Norte (coordenadas: lat: -5.766228, long: -35.196658 WGS84). A exsicata da planta foi identificada e catalogada no herbário da Universidade Federal do Rio Grande do Norte (UFRN) sob o número de registro 16787 e pode ser visualizado no site do Instituto Nacional de Ciência e Tecnologia Herbário Virtual da Flora e dos Fungos (INCT-HVFF) em inct.florabrasil.net ou splink.org.br.
As vagens coletadas foram armazenadas em sacos plásticos, sendo em seguida transportadas para o Laboratório de Química e Função de Proteínas Bioativas (LQFPB) da UFRN, onde foram deixadas a temperatura ambiente e com humidade reduzida, até que as vagens estivessem completamente secas e as sementes atingissem uma coloração marrom e homogênea. Posteriormente as sementes foram separadas de suas vagens e armazenadas a temperatura de 20ºC.
3.1.3.2 ERITRÓCITOS HUMANOS
Os eritrócitos humanos foram obtidos através de doações de bolsas de sangue pelo HEMOCENTRO – RN. As bolsas fornecidas encontravam-se fora do prazo de validade para transfusões.
3.1.3.3 LINHAGENS CELULARES
As seguintes linhagens celulares foram utilizadas neste trabalho: A549, carcinoma epitelial de pulmão humano (ATCC® número CRM-CCL-185), 786-0,
adenocarcinoma renal humano (ATCC® número CRL-1932), HT29, adenocarcinoma
coloretal humano (ATCC® número HTB-38), HeLa, adenocarcinoma de cólon uterino
humano (ATCC® número CCL-2) e RAEC, célula epitelial de aorta de coelho
41
3.1.3.4 MICROORGANISMOS PATOGÊNICOS
Os testes realizados com Leishmania spp contaram com a parceria da profa.
Dra. Márcia Rosa de Oliveira, do laboratório de Leishmaniose, Departamento de Biologia Molecular da Universidade Federal da Paraíba. Foram utilizados formas promastigotas de Leishmania (Viannia) braziliensis (MHOM/BR/2011/AF) e
Leishmania amazonensis (IFLA/BR/67/PH8).
Os ensaios feitos com Candida spp só foram possíveis com a colaboração do
Professor Dr. Guilherme Chaves do Laboratório de Micologia Clínica, Departamento de Análises Clínicas e Toxicológicas da Universidade Federal do Rio Grande do Norte. Foram utilizadas as seguintes espécies de importância médica: Candida albicans (ATCC® número 90028), Candida dubliniensis (CBS® número 7987), Candida tropicalis (ATCC® número 13803), Candida parapsilosis (ATCC® número 22019), Candida glabrata (ATCC® número 2001), Candida rugosae (ATCC® número 10571) e Candida krusei (ATCC® número 6258).
As atividades bactericidas e bacteriostáticas foram realizadas em parceria com o prof. Ermeton Duarte do Nascimento do LaBMed - Laboratório de Bacteriologia Médica, Departamento de Microbiologia e Parasitologia, Universidade Federal do Rio Grande do Norte. Foram testadas cepas de Escherichia coli (ATCC® número 25922 )
e Staphylococcus aureus (ATCC® número 25932 ).
3.2 MÉTODOS
3.2.1 PURIFICAÇÃO E IDENTIFICAÇÃO DA LECTINA DO TIPO ConA DAS SEMENTES DE C. Maritima (CML - ConM).
O método utilizado neste trabalho para purificação da lectina do tipo ConA (CML – ConM) foi adaptado de Moreira et al. (1983), realizado conforme os passos relatados a seguir (figura 6).
3.2.1.1 PREPARO DA FARINHA DAS SEMENTES DE C. maritima
Os cotilédones de C. maritima livres de seus tegumentos foram triturados em
42 Figura 5 – Amostra de sementes de C. Maritima. Da esquerda para direita: semente ao natural,
cotilédones livres de seus tegumentos e farinha de C. maritima. Elaborada pelo autor.
3.2.1.2 PREPARO DO EXTRATO BRUTO
A farinha fina de C. maritima foi homogeneizada com tampão acetato de sódio
0,1 M, pH 5,0 na proporção 1:40 (p/v) sob agitação branda e constante por 4 horas a temperatura ambiente (25°C). O homogeneizado resultante foi centrifugado a 8000 x
g, por 30 minutos, a 4 °C. O sedimentado foi descartado e o sobrenadante, límpido e
translúcido de coloração amarelada, foi denominado extrato bruto e utilizado nos passos seguintes.
3.2.1.3 FRACIONAMENTO COM SULFATO DE AMÔNIO
O extrato bruto foi fracionado com três faixas de concentração de sulfato de amônio: 0-30%, 30-60% e 60-90% de saturação. Após cada etapa de fracionamento, a amostra foi mantida a uma temperatura de 4°C, por aproximadamente 16 horas e posteriormente centrifugada a 8000 x g durante 30 minutos, a 4°C. As frações foram
ressuspendidas e dialisadas em membrana, sob agitação, por aproximadamente 20 horas, contra água destilada. Após a diálise as frações foram denominadas de acordo com o grau de saturação (F0-30, F30-60 e F60-90), liofilizadas e armazenadas a temperatura ambiente para testes posteriores.
3.2.1.4 CROMATOGRAFIA DE AFINIDADE
43 cromatográfico. A fração de interesse, F60-90, foi redissolvida em NaCl 1 M, contendo 5 mM de CaCl2+ e 5 mM de MnCl2+ (chamada de solução de equilíbrio) e aplicado em
uma coluna Sephadex G-50, equilibrada com a mesma solução. A coluna foi primeiramente eluída com a solução de equilíbrio seguido da solução de Glicina-HCl, 0,1M, pH 3, contendo 1M NaCl e 5 mM de CaCl2+ e 5 mM deMnCl2+ (Chamada de
solução de eluição). Foi utilizado um coletor automático (Frac-920, Amersham
Biosciences), ajustado para um fluxo de 45 mL/hora em frações de 3 mL por tubo. A
análise do eluído foi feita em espectrofotômetro (Utrospec-2100 pro, Amersham Biosciences), no comprimento de onda de 280 nm e utilizando uma cubeta de quartzo.
O nível de proteína nas eluições foi considerado zerado quando as absorbâncias das frações atingiram um platô de 0,05.
3.2.1.5 DOSAGEM PROTÉICA
A determinação da concentração de proteínas das amostras foi realizada pelo método colorimétrico de BRADFORD (1976), utilizando albumina sérica bovina (BSA) como padrão. O ensaio foi feito em microplacas de 96 poços, à temperatura ambiente (25 ºC). Após a mistura do reagente com as amostras proteica, a placa foi incubada em ambiente escuro por no mínimo por 10 minutos e a leitura das amostras foi realizada em um leitor de microplaca (Epoch – Bio Tek) à absorbância de 595 nm.
3.2.1.6 ELETROFORESE EM GEL DE POLIACRILAMIDA DESCONTÍNUO E DESNATURANTE (SDS-PAGE)
Com o intuito de avaliar a purificação da amostra proteica, a mesma foi submetida à eletroforese em gel de poliacrilamida a 12% em presença de SDS, de acordo com a metodologia descrita por Laemmli (1970) em um sistema miniVE (sistema de eletroforese vertical - Amersham Biosciences). O gel de separação foi
44 Uma vez diluída em tampão de amostra (Tris-HCl 0,0625 M, SDS 2%, glicerol 10% v/v, 0,01% de azul de bromofenol e 1mM de DTT) num volume de 10 µL, a alíquota foi aplicada no gel (10 x 14 cm, com espaçadores de 0,75 mm), o qual foi submetido a uma amperagem constante de 30 mA por aproximadamente 2 h. O gel foi corado em solução de Coomassie Blue R. Para determinar a massa molecular da proteína isolada, foram utilizados marcadores padrão de proteína.
3.2.1.7 SEQUENCIAMENTO DE ConM
Para obtenção da sequência da lectina, a banda proteica do gel após processo de coloração com azul de coomassie foi excisada e transferida para tubo de microcentrifuga (BioRad). O corante foi retirado do gel após três lavagens com solução de etanol a 30% até descorar completamente, seguida de mais uma lavagem com solução de acetonitrila 50% e 25 mM de bicarbonato de amônio por 15 minutos, sendo retirados e acetonitrila foi adicionada e o gel foi incubado por 10 min sob agitação vigorosa.
Após esta etapa o gel foi seco em concentrador a vácuo por 20 min, sendo, em
seguida, adicionada solução de tripsina (33 ng/μL) em volume suficiente para cobrir o gel e foi mantido em banho de gelo por 30 min. Um volume de 40μL de solução de
bicarbonato de amônio a 50 mM foi adicionado e depois o material foi incubado por 19 horas a 37 ºC.
Os peptídeos gerados por hidrólise enzimática foram liofilizados e misturados
com uma solução de matriz de ácido α-ciano-4-hidroxicinâmico (5 mg em 250 μL de
acetonitrila, 200 μL de água ultrapura e 50 μL de solução aquosa de ácido
trifluoroacético a 3%) em proporção de 1/3 (v/v), depositadas em uma placa do tipo
Anchorchip (Bruker Daltonics, Bilerica, EUA) e cristalizadas à temperatura ambiente.
Os fragmentos foram analisados e sequenciados por espectrometria de massa do tipo MALDI-TOF/TOF em espectrômetro Ultraflex III (Bruker Daltonics, Billerica,
EUA). A estrutura primária dos peptídeos foi interpretada por sequenciamento de novo dos espectros obtidos nas análises de MS/MS, com fragmentação conduzida pela metodologia LIFT-TM (SUCKAU et al., 2003).
45 lectinas depositadas no banco de dados do NCBI (National Center for Biotechnology
Information, disponível em www.ncbi.nlm.nih.gov), usando BLASTp (ALTSCHUL et
46
Figura 6 - Esquema dos passos purificação e identificação da ConM.
Precipitação protéica com sulfato de amônio 60-90%
Reservados sob refrigeração a 8 °C Centrifugação: 8000 x g - 4ºC por 30 min Resuspensas em água destilada
Diálise contra água destilada Precipitação protéica com sulfato de amônio 30-60% Reservados sob refrigeração a 8 °C
Centrifugação: 8000 x g - 4ºC por 30 min Resuspensas em água destilada
Diálise contra água destilada Precipitação protéica com sulfato de amônio 0-30% Reservados sob refrigeração a 8 °C
Centrifugação: 8000 x g - 4ºC por 30 min Resuspensas em água destilada
Diálise contra água destilada
F 30-60 F 0-30
F 60-90
Precipitado Extrato bruto (EB)
Sobrenadante
Sobrenadante Sobrenadante
Extração: tampão Acetato de sódio, 0,1 M, pH 5,0 – 4 horas.
(1:40, p/v).
Centrifugação: 8000 x g – 30 min, 4ºC. Farinha de sementes de
Canavalia maritima
Cromatografia G50
Eletroforese
47
3.2.2 TESTES DE ATIVIDADES BIOLÓGICAS
3.2.2.1 ENSAIO DE HEMAGLUTINAÇÃO
A atividade hemaglutinante foi testada em placas de microtitulação de fundo em V de 96 poços, por meio de diluição seriada das amostras testes (DEBRAY, et al., 1981). Foram testados eritrócitos, lavados com solução de NaCl 0,15 M, sem tratamento e tratados enzimaticamente com tripsina e papaína (BENEVIDES et al., 1998). Em volume final de 50 µL foram adicionados 25 µL de uma suspensão de 4% de eritrócitos humanos dos tipos A, B e O e 25 µL de solução contendo proteínas. A reação foi incubada a temperatura ambiente (25 ºC). Após uma hora a aglutinação foi observada, e o título expresso em unidades de hemaglutinação (UH), que foi definido como o inverso da maior diluição da amostra que tenha apresentado nítida aglutinação (MOREIRA & PERRONE, 1997). A atividade hemaglutinante específica foi obtida pela razão entre UH e a quantidade de proteína (mg) existente na alíquota de 25 µL testada.
3.2.2.2 TESTE DE CITOTOXICIDADE SOBRE CÉLULAS DO SANGUE PERIFÉRICO HUMANO
3.2.2.2.1 ATIVIDADE HEMOLÍTICA
A atividade hemolítica da lectina foi avaliada sobre células do sangue periférico humano. Hemácias humanas foram separadas do plasma por sedimentação e lavadas três vezes com solução salina (NaCl 0,9%). A mesma solução foi utilizada para preparar uma suspensão 1% (v/v) de hemácias e solubilizar as amostras. Em tubos de 1,5 mL, 100 µL da suspensão de hemácias foram incubados com 100 µL da amostra por 60 minutos, à temperatura ambiente. As referências de 100% e de 0% de hemólise foram feitas incubando-se 100 µL da suspensão de hemácias com 100 µL Triton X-100 1% (v/v) ou com 100 µL da solução salina , respectivamente. Após a incubação, os tubos foram centrifugados a 3000 x g por 2 minutos e alíquotas de 100