Célio José de Castro Junior
EFEITO DA TOXINA PhTx3-4 DO
VENENO de
Phoneutria nigriventer
NA CONCENTRAÇÃO
INTRACELULAR Ca
2+
E NA
EXOCITOSE EM SINAPTOSOMAS
Belo Horizonte Setembro
Célio José de Castro Junior
EFEITO DA TOXINA PhTx3-4 DO
VENENO de
Phoneutria nigriventer
NA CONCENTRAÇÃO
INTRACELULAR Ca
2+
E NA
EXOCITOSE EM SINAPTOSOMAS
Dissertação submetida ao Curso de Pós-Graduação em Farmacologia Bioquímica e
Molecular do Departamento de Farmacologia da Universidade Federal de Minas Gerais como
requisito parcial para obtenção do grau Mestre em Ciências Biológicas: Farmacologia Bioquímica e
Molecular
Orientador: Marcus Vinícius Gomez
Co-orientadora: Cristina Guatimosim Fonseca
Belo Horizonte Setembro
2007
Este trabalho foi realizado no Laboratório de Neurofarmacologia do ICB-UFMG
com o auxílio das seguintes instituições:
-Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq)
-Coordenação de Aperfeiçoamento de Nível Superior (CAPES)
-Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG)
-Programa de Apoio ao Desenvolvimento Científico e Tecnológico (PADCT)
-Programa de Apoio a Núcleos de Excelência (PRONEX)
-Instituto do Milênio
Dedico este trabalho aos meus pais Célio e Edir e aos meus irmãos Lílian e Fabrício pelo apoio, carinho, afetividade e sobretudo por manter sempre vivo em mim o valor da família.
Agradecimentos
A Deus, pelo dom da vida e por colocar no meu caminho pessoas tão especiais.
Ao professor Marcus Vinícius Gomez. Porque orientar não é simplesmente ensinar e indicar rumos no trabalho, mas ser orientador é, sobretudo, ser exemplo. Obrigado pela oportunidade, pelos ensinamentos, pelo carinho, pela confiança e pelo exemplo.
À professora Cristina Guatimosim, grande profissional, pela acolhida, pelos ensinamentos, apoio, prestatividade e sobretudo pela confiança no meu trabalho.
Ao professor Marco Antônio, pelos ensinamentos, prestatividade e pelo exemplo.
Aos professores Marco Aurélio Romano, Luiz Armando de Marco, Helton José Reis, Vânia Prado, Grace Schenatto e André Massensini, pela prestatividade, apoio e pelo exemplo.
Ao Bráulio, pelo convite de voltar a trilhar os caminhos da ciência, pela cumplicidade e pela grande e verdadeira amizade.
À Ana Cristina, pela oportunidade, pelos ensinamentos, confiança e pela amizade.
Aos amigos e companheiros de laboratório Fabiana , Vinícius, Bruno Resende, Cristina, Magda, Cristiane, Patrícia, Daniela Valadão, Alessandra, Jomara, Nancy, Monalise, Xavier, Bruno Leles, Paulo, Eloah, Allan, Bernardo, Janice, Jarbas, Rafael (bolha), Bruno Pinheiro, pelo companheirismo, empenho, apoio científico, e pelos momentos agradáveis.
Aos amigos Danuza e Diogo, prestatividade e simpatia constantes.
Aos prezados amigos da morfologia, Bento, Ernani, Débora, Luciana, e Maíla, pelos momentos agradáveis, pelas ricas discussões semanais de artigos e pela simpatia.
Às amigas distantes Luciene e Lucimar, pelos ensinamentos e pela amizade.
À Wolfanga, pelo carisma, prestatividade e simpatia.
À Adriane, grande mãe, exemplo de humildade, e de compromisso com o laboratório, obrigado pela amizade e generosidade.
À Cris pelos bons valores que ficaram, pela consideração e pela fé, um especial muito obrigado!
Aos meus familiares em especial aos meus avôs Raimundo e Olinda, minhas tias Sânia, Ladica e Aide, pelo apoio incondicional e pelo incentivo.
Por fim, à UFMG e às entidades financiadoras CNPq, FAPEMIG, CAPES e Instituto do Milênio, por propiciarem uma pós-graduação de tão elevado nível no Brasil.
Índice
Lista de Figuras e Tabela ix Lista de Abreviaturas x
Resumo xii Abstract xiii 1 - INTRODUÇÃO 1
1.1 - Neurotransmissão - Aspectos gerais 2 1.2 - O ciclo de vesículas sinápticas 3
1.3 - Canais de Ca2+ neurais 7
1.4 - Antagonistas de canais de Ca2+ neuronais como ferramentas para
investigar a neurotransmissão 10 1.5 - Potencial terapêutico de neurotoxinas antagonistas de canais de Ca2+ 11
1.6 - Phoneutria nigriventer 13 1.7 - Ação das toxinas purificadas do veneno da Phoneutria nigriventer 14
1.8 – PhTx3-4 16 2 - OBJETIVOS 19
2.1 – Objetivo geral 20 2.2 – Objetivos específicos 20
3 - MATERIAL E MÉTODOS 21
3.1 – Equipamentos 22 3.2 - Soluções 22 3.3 - Drogas e toxinas 23
3.4 - Animais 23 3.5 - Preparação de sinaptosomas 23
3.6 - Ensaio de exocitose de vesículas sinápticas 24 3.7 - Medida do cálcio livre intrasinaptosomal 25
3.8 - Análise estatística dos resultados 25 3.9 - Uso de FM2-10 para monitorar a exocitose 26
4 - RESULTADOS 28 4.1 – PhTx3-4 e medidas de cálcio intrasinaptosomal 29
4.2 – Efeito comparativo da PhTx3-4 com o de toxinas bloqueadoras de
canais de cálcio nas medidas de cálcio intracelular 31
4.3 - Exocitose de vesículas sinápticas induzida por KCl 33
4.4 - Calcio e exocitose 35 4.5 - Efeito da toxina PhTx3-4 na exocitose 37
5 - DISCUSSÃO 40 6 - CONCLUSÕES 46 7 - REFERÊNCIAS BIBLIOGRÁFICAS 48
Lista de Figuras e Tabela
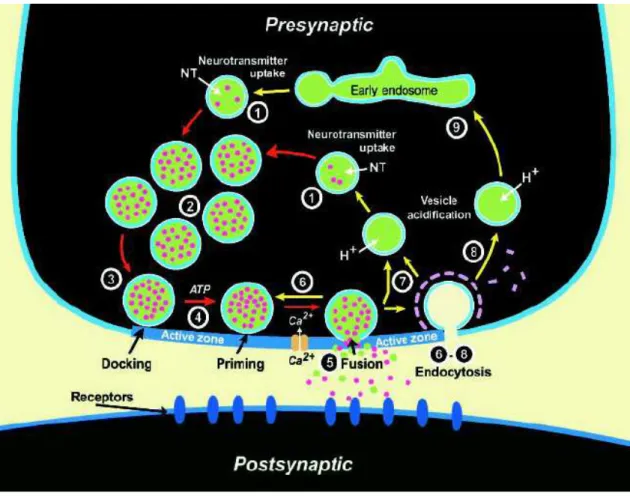
Figura 1: O ciclo das vesículas sinápticas 4
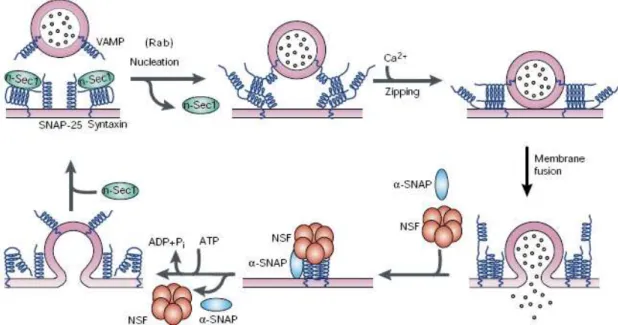
Figura 2: Modelo molecular da exocitose de vesículas sinápticas 6 Figura 3: Aspectos estruturais dos canais de Ca2+ regulados por voltagem 9
Figura 4: aranha Phoneutria nigriventer 15
Figura 5: Purificação das frações Tx1 a Tx3 do venenno de Phoneutria nigriventer 15
Figura 6: Estrutura química da molécula FM2-10 27
Figura 7: Monitoramento do ciclo de vesículas sinápticas por FM2-10 27
Figura 8: Efeito da PhTx3-4 na [Ca2+]i induzida por KCl 30mM 30
Figura 9: Efeito das ω-toxinas PhTx3-4, ω-CgTx MVIIC, ω-CgTx GVIA e ω-AgaIVA no aumento da [Ca2+]i induzido por KCl 32
Figura 10: Exocitose em sinaptosomas cérebrocorticais induzida por
despolarização de membrana 34
Figura 11: Liberação de FM2-10 é cálcio-dependente 36
Figura 12: Efeito da PhTx3-4, ω-Cgtx MVIIC, ω-Cgtx GVIA e ω-Aga IVA
na exocitose induzida por KCl 30 mM 39
Tabela 1: Localização, função e bloqueadores das diversas correntes de
cálcio neuronais 11
Lista de Abreviaturas
ACh Acetilcolina
DMSO Dimetil sulfóxido
Min Minuto mL Mililitro
SDS Dodecil sulfato de sódio
EGTA Etilenoglicol-bis-β-aminoetil éster EGTA-AM Etilenoglicol-bis(β
-aminoetil)-N,N,N´,N´-tetraacetoximetil Éster
Seg Segundo
KRH Krebs-Ringer-Hepes
SNC Sistema Nervoso Central
NO Óxido Nítrico
Cd2+ Íons cádmio
Ca2+ Íons cálcio
Na+ Ínos sódio
K+ Íons potássio
VGCC´s Canais de cálcio regulados por voltagem
EPM Erro padrão médio
EPP Potencial final de placa
MEPP Potencial final de placa em miniatura
BAPTA-AM bis-(o-aminofenoxi)etano-N,N,N’,N’-ácidotetracético SNARE Soluble NSF attachment protein receptor
SNF Proteína de fusão sensível à N-etil-maleimida α-SNAP Proteína associada ao sinaptosoma
EEEE Sequência de 4 aminoácidos ácido glutâmico DEKA Sequência de aminoácidos: ácido aspártico –ácido
glutâmico-Lisina-Alanina
RFPLC Cromatografia Líquida de Alta Eficiência em Fase Reversa
TTX Tetrodotoxina
HVA Canais de cálcio ativados por alta voltagem LVA Canais de cálcio ativados por baixa voltagem DHP’s Dihidropiridinas
Resumo
O influxo de cálcio e a exocitose de vesículas sinápticas no terminal nervoso são eventos chave na neurotransmissão. A entrada de cálcio, em resposta a um estímulo despolarizante, através de canais de cálcio regulados por voltagem é o principal sinal que dispara a ativação da maquinaria exocitótica e consequente liberação de neurotransmissores. A existência de diferentes subtipos de canais de cálcio regulados por voltagem com funções fisiológicas distintas motiva a busca de novos agentes farmacológicos atuantes sobre estes canais. O veneno da aranha brasileira Phoneutria nigriventer contém uma variedade de substâncias com ação predominantemente neurotóxica, dentre elas a fração PhTx3-4 foi recentemente descrita como uma potente bloquadora da neurotransmissão em diversos modelos experimentais. Para testar o efeito dessa toxina nas alterações intracelulares da concentração de cálcio (Δ[Ca2+]) induzidas por KCl, terminais nervosos centrais isolados (sinaptosomas) foram marcados com a sonda fluorescente Fura 2-AM. A PhTx3-4 reduziu a Δ[Ca2+] induzida por KCl de uma forma dependente da dose inibindo 53% desse efeito em concentrações saturantes. O IC50 encontrado
para o efeito inibitório da Tx3-4 na Δ[Ca2+] foi de 1,4 nM. As toxinas bloqueadoras de canais de cálcio ω-conotoxina MVIIC, ω-conotoxina GVIA e ω-agatoxina IVA reduziram por 47, 22 e 24%, respectivamente, o aumento na [Ca2+] induzida por KCl. Em associação à PhTx3-4, somente a ω-agatoxina IVA mostrou efeito inibitório aditivo no aumento da [Ca2+] induzida por KCl. Para investigar o efeito da PhTx3-4 na exocitose de vesículas utilizamos a sonda fluorescente FM2-10. A PhTx3-4 também reduziu com elevada potência (IC50 =
1,1 nM) a exocitose induzida por KCl, efeito comparativamente maior que o das toxinas ω-conotoxina MVIIC, ω-conotoxina GVIA e ω-agatoxina IVA. Tal como ocorreu nas medidas de cálcio intracelular, somente a ω-agatoxina IVA apresentou efeito aditivo inibitório com a PhTx3-4 na exocitose induzida por KCl. Juntos esses dados mostram que PhTx3-4 é um potente inibidor de canais de cálcio Tipo-P/Q envolvidos no controle da entrada de cálcio e exocitose de vesículas sinápticas em sinaptosomas cérebro-corticais.
Abstract
Calcium influx and synaptic vesicle exocytosis at nerve terminals are key events in the neurotransmission. Calcium entrance throughout voltage-gated calcium channels in response to a depolarizing stimulus is the main signal that triggers the exocytotic machinery leading to neurotransmitter release. Existence of multiple subtypes of voltage-gated calcium channels with distinct physiological functions has leading to the search for new pharmacological agents that act on these channels. Venom of the brazilian spider Phoneutria nigriventer contains several substances with action markedly neurotoxic. Amongst them the fraction PhTx3-4 has been show to be a potent blocker of neurotransmission at various experimental models. To test for the effect of PhTx3-4 on the calcium concentration changes (Δ[Ca2+]) induced by KCl, isolated central nerve endings (synaptosomes) were stained with the fluorescent probe Fura 2-AM. PhTx3-4 reduces the Δ[Ca2+] induced by KCl in a dose dependent way, reducing by 53% this effect at saturating concentrations. IC50 found for the PhTx3-4 effect on KCl induced changes in [Ca2+] was 1,4 nM.
The calcium blockers toxins ω-conotoxin MVIIC, ω-conotoxin GVIA and ω -agatoxin IVA reduced by 47, 22 e 24% respectively the changes in [Ca2+] induced by KCl. In association with PhTx3-4, only ω-agatoxin IVA showed an addictive inhibitory effect on the KCl induced [Ca2+] increase. To test for the PhTx3-4 effect on vesicle exocytosis, we used the fluorescent probe FM2-10. PhTx3-4 also reduces with great potency (IC50 = 1,1 nM) the KCl induced exocytosis. This effect was comparatively stronger than that observed with ω -conotoxin MVIIC, ω-conotoxin GVIA and ω-agatoxin IVA. As like as in the calcium measurements, only ω-agatoxin IVA showed an addictive inhibitory effect on the KCl induced exocytosis. Taken together these data show that PhTx3-4 is a potent inhibitor of P/Q calcium channels involved in controlling calcium entry and exocytosis of synaptic vesicles in brain cortical synaptosomes.
1.1 - Neurotransmissão - Aspectos gerais
Um grande progresso científico sobre o entendimento do sistema nervoso central foi alcançado nos dois últimos séculos. Páginas importantes desse progresso foram escritas por Ramón y Cajal (1911) que propôs a histologia básica do sistema nervoso central, e destacou a zona especializada de contato entre os neurônios que mais tarde Charles Serrington (1947) veio a denominá-la sinapse. Embora inicialmente pensava-se que as sinapses eram puramente elétricas e que houvesse sempre contato físico entre as mesmas, Otto Loewi (1926) em experimento clássico, mostrou que uma substância era capaz de transmitir sinais do nervo vago para o coração, sendo proposta então a primeira evidência sobre a sinapse química.
Sinapse química é uma junção célula-célula altamente especializada que é designada para a comunicação eficiente entre células nervosas e suas células-alvo, que podem ser um outro neurônio, uma célula muscular ou uma célula glandular (Gundelfinger et al., 2003). Apesar da existência de dois tipos de sinpases, a química e a elétrica, as sinapses químicas estão presentes em maior número do que as elétricas, sendo as primeiras a principal forma de comunicação entre neurônios no SNC (Eccles, 1976). Através das sinapses químicas, a exocitose de uma única vesícula sináptica pode desencadear a abertura de milhares de canais iônicos pós-sinápticos, o que caracteriza a propriedade de amplificação do sinal pré-sináptico nas sinapses químicas e ainda, devido a alterações na frequência e intensidade de uso dessas sinapses, elas se alteram respondendo de forma diferenciada a novos estímulos, caracterizando a plasticidade sináptica (Jessell and Kandel, 1993).
1.2 - O ciclo das vesículas sinápticas
Os terminais nervosos podem ser considerados verdadeiras máquinas secretórias preparadas para repetidos ciclos de liberação de neurotransmissores. Quando a vesícula sináptica se funde com a membrana do terminal pré-sináptico, os constituintes da vesícula são reciclados para garantir a liberação de neurotransmissores sempre que necessária e consequentemente impedir a interrupção desse processo. Todas as funções pré-sinápticas, direta ou indiretamente, envolvem vesículas sinápticas. As vesículas sinápticas seguem uma rota de tráfego cíclica no terminal nervoso a qual pode ser dividida em passos sequenciais (para revisão Sudhof, 2004; Ryan, 2006).
1.3 - Canais de Ca
2+neurnonais
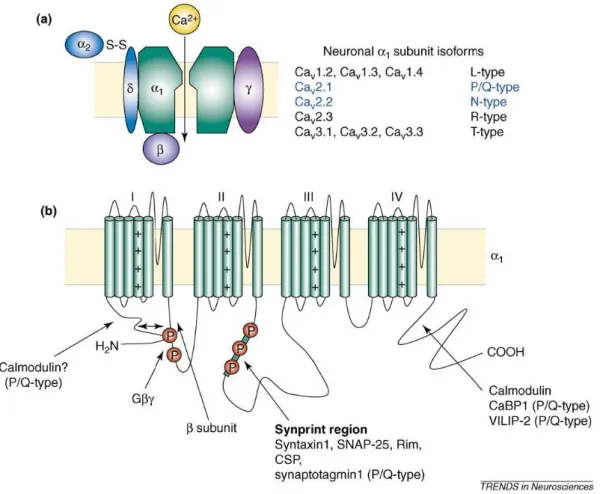
Não só em células neuronais, mas em diferentes tipos celulares, canais de cálcio se ativam e medeiam influxo de cálcio após potenciais de ação ou após despolarizações sublimiares de membrana. O cálcio que entra na célula através de canais de cálcio regulados por voltagem serve de segundo mensageiro na sinalização elétrica e na iniciação de eventos intracelulares como contração, secreção, transmissão sináptica e expressão gênica. Existe grande número de diferentes canais de cálcio no sistema nervoso e é comum haver confusão entre as diferentes nomenclaturas desses canais. Há, usualmente, três diferentes classificações para esses canais: por voltagem, farmacológica e molecular.
DHP-insensíveis (canais de cálcio Tipo-N). Os canais de cálcio LVA foram denominados Tipo-T (T de transiente) (Nowycky et al., 1985).
Um tipo adicional de canal de cálcio HVA, originalmente encontrado em células cerebelares de Purkinge, é o canal de cálcio Tipo-P, o qual é inibido pela toxina peptídica ω-agatoxina IVA (Scott et al., 1990). Quando canais de cálcio, expressos em oócitos, foram testados quanto à sua sensitividade à ω -agatoxina IVA, verificou-se que esses canais têm uma baixa sensitividade à ω -agatoxina IVA (~200 nM) (Sather et al., 1993), enquanto que a sensitividade aos canais Tipo-P é bem maior (~2 nM). Isso levou à proposta que havia ainda um outro tipo de canal de cálcio HVA: o canal de cálcio Tipo-Q (Zhang et al., 1993). A distinção entre canais de cálcio Tipo-P e Tipo-Q nem sempre é óbvia, daí então eles são frequentemente agrupados como canais de cálcio Tipo-P/Q.
Se os tipos T, L, N e P/Q compreendessem todos os canais dependentes de voltagem que permitem a entrada de cálcio no terminal após despolarização, logo seria possível abolir por completo a entrada de cálcio causada por uma despolarização pequena e prolongada (para inativar correntes de cálcio Tipo-T) e na presença de um “coquetel” contendo concentrações inibitórias de DHP, ω-conotoxina GVIA e ω-agatoxina IVA. Isso nem sempre acontece e alguma atividade residual de canais de cálcio permanece. Foi então proposto que essa entrada residual de cálcio fosse atribuída à canais de cálcio denominados Tipo-R. Sua voltagem de ativação é intermediária entre os canais HVA e LVA e sua atividade é bloqueada por baixas concentrações de níquel (Zhang et al., 1993).
Atualmente já foram identificados nove subtipos de canais de cálcio dependentes de voltagem (figura 3). Essa diversidade emana predominantemente da natureza da subunidade α1 formadora do poro principal.
Há três diferentes famílias de subunidades α1 dos canais de cálcio: genes Cav1
que codificam canais Tipo-L, genes Cav3 que codificam canais Tipo-T e genes
Cav2 que codificam canais Tipo-N, P/Q e R, com os canais Tipo-P e Tipo-Q
Figura 3: Aspectos estruturais dos canais de Ca2+ regulados por voltagem. (a) composição das subunidades dos canais de Ca2+. (b) Topologia transmembrana da subunidade α1. Sítios chave de interação protéica são indicados por setas. Os círculos vermelhos representam sítios importantes de fosforilação e os símbolos de adição denotam os sensores de voltagem nos domínios transmembrana. Subunidades ȕȖ da proteína G podem interagir com um macrosítio formado pela ligação do N-terminal ao loop do domínio I-II. Esta figura enfatiza a estrutura dos canais Cav2.1 e Cav2.2 destacados de azul no
1.4 - Antagonistas de canais de Ca
2+neuronais como
ferramentas para investigar a neurotransmissão
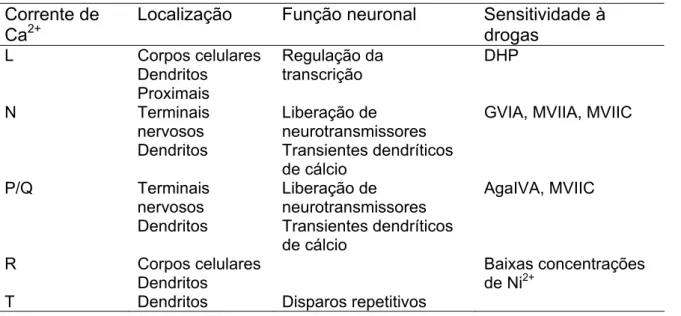
Dada a grande dificuldade prática de se fazer registros de correntes de Ca2+ diretamente em terminais sinápticos, com algumas exceções: (Stanley and Goping, 1991; Yawo and Chuhma, 1993; Borst and Sakmann, 1996), a maioria das informações sobre canais responsáveis pela liberação de neurotransmissores utilizam ferramentas farmacológicas específicas para bloquear ou ativar canais de cálcio sensíveis à voltagem. A existência de diferentes subtipos de unidades formadoras do poro confere a esses canais diferentes distribuições pelo sistema nervoso e também diferentes funções fisiológicas, tal como sumarizado na tabela 1.
Várias toxinas peptídicas obtidas de venenos animais bloqueiam diferentes tipos de canais de cálcio regulados por voltagem com diferentes seletividades (revisado porOlivera et al., 1994). Essas toxinas, comumente chamadas de ω-toxinas, são extraídas principalmente do veneno de dois organismos: de moluscos marinhos do gênero Conus (ω-conotoxinas) e da aranha Agelenopsis aperta (ω-agatoxinas).
Tabela 1: Localização, função e bloqueadores das diversas correntes de cálcio neuronais
Corrente de Ca2+
Localização Função neuronal Sensitividade à drogas
L Corpos celulares Dendritos Proximais Regulação da transcrição DHP N Terminais nervosos Dendritos Liberação de neurotransmissores Transientes dendríticos de cálcio
GVIA, MVIIA, MVIIC P/Q Terminais nervosos Dendritos Liberação de neurotransmissores Transientes dendríticos de cálcio AgaIVA, MVIIC R Corpos celulares
Dendritos
Baixas concentrações de Ni2+
T Dendritos Disparos repetitivos
AgaIVA, ω-agatoxina IVA de Agelenopsis aperta; MVIIC, ω-conotoxina MVIIC de
Conus magnus (também conhecida como SNX-230); GVIA, ω-conotoxina GVIA de
Conus geographus (SNX-124); MVIIA, ω-conotoxina MVIIA de Conus magnus (SNX-111); DHP, dihidropiridina (adaptado de Miljanich and Ramachandran, 1995).
1.5 - Potencial terapêutico das neurotoxinas antagonistas de
canais de Ca
2+A regulação da liberação de neurotransmissores é a base que rege o desenvolvimento de agentes terapêuticos seguros e eficazes, direcionados contra subtipos específicos de canais de Ca2+ sensíveis à voltagem. A liberação de neurotransmissores no SNC depende de múltiplos subtipos de canais de Ca2+ e a complementaridade de ação desses canais varia de uma população de sinapses para a outra (Wheeler et al., 1994).
prevenção da degeneração neuronal oriúnda de traumas cerebrais isquêmicos e na persistência da dor.
Antagonistas clássicos de canais de Ca2+ da classe das dihidropiridinas, fenilalquilaminas e benzotiazepinas são usados com sucesso no tratamento de uma variedade de distúrbios cardiovasculares, devido às suas ações em VGCC´s da musculatura lisa e cardíaca. Contudo esses antagonistas não são eficazes em proteger os neurônios das consequências da isquemia (Steen et al., 1984; Ohta et al., 1991). Em neurônios do sistema nervoso central há uma predominância de VGCC´s Tipo-N e Tipo P/Q enquanto que em terminações nervosas da musculatura lisa e cardíaca, observa-se marcante predomínio de canais Tipo-L, o que explica a eficácia das DHP´s no tratamento dos distúrbios cardiovasculares mas não no tratamento da isquemia. Logo, a especificidade dos bloqueadores de canais cálcio por determinados subtipos de canais norteia a busca de protótipos de fármacos clinicamente mais eficazes.
(Miljanich and Ramachandran, 1995). Consistente com essa hipótese, o antagonista de VGCC Tipo-N SNX-111 (derivado sintético da ω-conotoxina MVIIA, ver tabela 1) foi recentemente registrado como o primeiro fármaco de uso humando derivado de uma neurotoxina animal a ser empregado no tratamento da dor (Brose et al., 1997).
Diversos estudos vem sendo feitos em nosso laboratório e em outros grupos de colaboração, avaliando o efeito de uma nova classe de neurotoxinas, as toxinas isoladas do veneno da aranha brasileira Phoneutria nigriventer, sobre certas condições neuropatológicas como na isquemia in vitro e na nocicepção. Os resultados (Pinheiro et al., 2006 e dados ainda não publicados) apontam para novas toxinas eficazes no controle da degeneração neuronal após insultos isquêmicos e no controle da dor, vinda de diversos estímulos nóxicos.
1.6
- Phoneutria nigriventer
Aranhas do gênero Phoneutria, família Ctenidae, são amplamente distribuídas em regiões quentes da América do Sul. Várias espécies são descritas mas a P. nigriventer é a mais encontrada nas regiões centro e sul do Brasil. Essa espécie é frequentemente envolvida em acidentes com picadas de aranha, em humanos. A Phoneutria nigriventer é uma aranha extremamente agressiva, de hábitos noturnos, sendo predadora natural de uma variedade de insetos, outras aranhas, pequenos roedores, etc. Essa aranha não constrói teia e o seu sucesso como predadora pode, em parte, ser explicado pela diversidade de toxinas presentes no seu veneno (Rezende Junior et al., 1991; Gomez et al., 2002). Seu nome popular, Armadeira, advém da postura corporal que a aranha assume quando é molestada ou antes de atacar a presa, quando ela mantém erguidos os 2 dois pares de patas dianteiras (Fig. 4).
observados em humanos e nos resultados de injeções intracérebro-ventriculares em animais experimentais, viu-se que o veneno de Phoneutria é, sobretudo, neurotóxico.
Parte do efeito neurotóxico do veneno parece estar relacionado à sua ação sobre canais de Na+ regulados por voltagem (Araujo et al., 1993; Romano-Silva et al., 1993). Entretanto, outras atividades farmacológicas, relacionadas à ação em canais iônicos, podem ser encontradas em todo o veneno. Essa observação pode ser mais facilmente comprovada pelo fracionamento do veneno, em que se separa as frações com ações farmacológicas distintas.
1.7 - Ação das toxinas purificadas do veneno da Phoneutria
nigriventer
Rezende Junior et al., (1991) propuseram um método para o fracionamento do veneno da Phoneutria nigriventer, através do qual o veneno é processado por uma combinação de filtração em gel e RFPLC gerando 3 frações neurotóxicas distintas (PhTx1 a PhTx3) (Fig. 5).
Figura 4: aranha Phoneutria nigriventer
(b) (a)
Veneno PhTx1 PhTx2 PhTx3 Padrão Padrão
A outra fração tóxica, PhTx3, administrada i.c.v. em ratos causou paralisia flácida (Rezende Junior et al., 1991), possivelmente em consequência da ação inibitória sobre a liberação de neurotransmissores (Gomez et al., 1995; Prado et al., 1996). Seis diferentes toxinas (Tx3-1 a 6) foram purificadas a partir da fração PhTx3 (Cordeiro Mdo et al., 1993) e pelo menos 3 delas (3, Tx3-4 e Tx3-6) bloquearam o influxo de Ca2+ induzido por KCl, em terminais nervosos (Prado et al., 1996; Guatimosim et al., 1997; Miranda et al., 1998), sugerindo que essas toxinas bloqueiam canais de Ca2+ e são, portanto, novas ω-conotoxinas. Além de ter toxinas que interagem com canais de Na+ e Ca2+, uma das toxinas da Phoneutria, a toxina PhTx3-1 é uma bloqueadora potente e seletiva de canais de K+ Tipo-A, aumentando a frequência de oscilações de Ca2+ em células GH3 (Kushmerick et al., 1999). Outra toxina, a toxina PhTx3-2, é capaz de bloquear, ainda que parcialmente, canais de Ca2+ Tipo-L (Kalapothakis et al., 1998).
Das toxinas bloqueadoras de canais de Ca2+, isoladas do pool PhTx3, a toxina PhTx3-3 foi uma das primeiras a ser estudada. Dados farmacológicos iniciais sugeriram que essa toxina inibe a liberação de aceltilcolina em fatias de córtex e em neurônios do plexo mientérico, mas essa ação não possuia um efeito aditivo com a ω-agatoxina IVA na liberação de ACh (Gomez et al., 1995). Além disso a PhTx3-3 é uma bloqueadora eficaz da liberação de glutamato (Prado et al., 1996). Através do uso dos marcadores fluorescentes Fura2-AM e FM1-43 em sinaptosomas cérebro-corticais, para monitorar medidas de Ca2+ interno e de liberação de vesículas, respectivamente, foi observado que a PhTx3-3 inibe com alta potência (IC50 0,9nM) canais de Ca2+ que regulam a
entrada de Ca2+ em sinaptosomas e também bloqueia a exocitose de vesículas sinápticas, sendo que esse efeito se dá em canais de Ca2+ que também são inibidos pela ω-agatoxina IVA (Guatimosim et al., 1997).
1.8 – PhTx3-4
flácida geral seguida de morte em 10-30 min (Cordeiro Mdo et al., 1993). Seu efeito parece estar associado à uma ação antagonista sobre canais de Ca2+, já que ela bloqueou o influxo de 45Ca2+ radioativo em sinaptosomas cérebro-corticais estimulados com tityustoxina (Miranda et al., 1998). Em neurônios do gânglio da raiz dorsal, onde há uma alta prevalência de canais de Ca2+ Tipo-N, a PhTx3-4, em concentrações sub-nanomolares, bloqueou correntes de Ca2+ disparadas por alta voltagem, já em células β-pancreáticas (canais Tipo-L), o bloqueio exercido pela toxina foi 40 vezes menos potente (Cassola et al., 1998).
Ensaios utilizando linhagens celulares expressando canais de cálcio recombinantes (P/Q, N e R) mostraram que correntes de Ca2+ geradas por canais tipo P/Q e N são bloqueadas quase que irreversívelmente pela PhTx3-4, enquanto que correntes Tipo-R são parcialmente bloqueadas e de forma reversível pela mesma toxina. Além disso, a PhTx3-4 se liga a sinaptosomas cerebrais em múltiplos sítios de ligação já que a ω-conotoxina GVIA e ω -conotoxina MVIIC foram capazes de deslocar apenas parcialmente a 125 I-PhTx3-4 do seu sítio de ligação (Dos Santos et al., 2002). Confirmando esses dados, (Troncone et al., 2003), em elegante experimento com junção neuromuscular de rã, mostraram que de fato a PhTx3-4 se liga aos canais Tipo-N em um sítio distinto daquele ao qual se liga a ω-conotoxina GVIA e mostraram também que esse bloqueio é irreversível quando o meio contém baixa concentração de Ca2+ (0,5mM).
Na liberação de neurotransmissores, a PhTx3-4 bloqueia tanto a liberação de glutamato dependente de Ca2+ quanto a liberação independente, um efeito que nunca havia sido descrito para uma neurotoxina peptídica. Uma hipótese que explicaria esse efeito seria a de que a PhTx3-4 bloquearia carreadores de glutamato, além de VGCC´s. De fato essa hipótese foi confirmada quando mostrou-se que a PhTx3-4 bloqueia a captação de L-[3H]glutamato em sinaptosomas (Reis et al., 1999). Esses dados sugerem também que a inabilidade das ω-conotoxinas GVIA e MVIIC em deslocar completamente a PhTx3-4, se dê em razão da ação da PhTx3-4 sobre carreadores de glutamato.
2.1 – Objetivo geral
Avaliar a ação da toxina PhTx3-4 do veneno de Phoneutria nigriventer sobre os níveis de cálcio e sobre a exocitose de vesículas sinápticas em terminais nervosos cérebro-corticais de ratos (sinaptosomas).
2.2 – Objetivos específicos
- Investigar o efeito da PhTx3-4 sobre os níveis de cálcio intracelular em sinaptosomas após despolarização com KCl.
- Comparar o efeito da toxina PhTx3-4 com o de outros bloqueadores clássicos de canais de cálcio regulados por voltagem, associados ou isoladamente, sobre a dinâmica de cálcio intra sinaptosomal após despolarização com KCl .
-Avaliar o efeito e a potência da PhTx3-4 sobre a exocitose de vesículas sinápticas em sinaptosomas despolarizados por KCl e marcados com FM2-10.
3.1 – Equipamentos
- Banho-maria regulado na temperatura de 35oC Modelo: 1050/270 da Biomatic
- Homogeneizador Modelo: Glass Col 099C - Bomba peristáltica
Modelo 7533-80 – Cole Parmer - Centrífuga refrigerada
Modelo: HIMAC CR 21E da HITACHI KOKI CO, LTDA, japão. - Microcentrífuga refrigerada
Modelo 5415R, Eppendorf. - Espectrofluorofotômetro
Modelo RF-5301 PC. Shimadzu.
3.2 - Soluções
-Solução de sacarose
Composição: Sacarose 0,32M, EDTA 1,0 mM, DTT (ditiotreitol) 0,25 mM. O pH final foi ajustado para 7,4 com solução de NaOH 0,1N.
- Solução Krebs-Ringer-Hepes (KRH)
Composição: NaCl 124mM, KCl 4mM, MgSO4 1,2mM, HEPES 25mM, Glicose
10 mM. O pH final foi ajustado para 7,4 com solução de NaOH 5M.
- Soluções Percoll
Composição: 3, 10, 15, 23% (v/v) de Percoll ® diluídos em solução de sacarose.
- Solução KRH-albumina 1mg/mL
3.3 - Drogas e toxinas
Fura-2 acetoximetil éster (AM), sacarose, Percoll ® , SDS, EGTA, ω -conotoxina MVIIC, ω-aga IVA e ω-conotoxina GVIA foram adquiridos da Sigma Chemical Co., (Mo, USA). EGTA-AM foi adquirido da Calbiochem. FM2-10 da Molecular Probes (Oregon, USA). A PhTx3-4 foi purificada na FUNED de acordo com (Rezende Junior et al., 1991).
3.4 - Animais
Foram utilizados ratos Wistar machos, pesando entre 180-200 gramas, tratados sob ciclo 14/10h luz/noite, alimentação e água livre, fornecidos pelo CEBIO – ICB/UFMG. Para cada experimento, foi sacrificado um animal.
3.5 - Preparação de sinaptosomas
os sinaptosomas) foram recolhidas em conjunto e submetidas a outra centrifugação a 37000 g a 4oC, por 20 min, agora em solução KRH sem cálcio (ver Soluções) para a retirada do excesso de Percoll® e precipitação dos sinaptosomas. O precipitado (fração sinaptosomal purificada) foi ressuspendido e aliquotado em volumes que variaram conforme o tipo de experimento realizado, seja de exocitose ou seja de captação de cálcio. Para ensaios de exocitose de vesículas sinápticas, o precipitado foi ressuspendido e homogeneizado em 4 mL de solução KRH e dividido em alíquotas de 500 uL cada. Para ensaios de cálcio intracelular o precipitado foi ressuspendido e homogeneizado em 2400 μL de KRH sem cálcio e em seguida dividido em alíquotas de 200 μL. Em ambos os experimentos, as alíquotas eram transferidas para tubos cônicos de micro-centrífuga e mantidas no gelo até a realização dos experimentos (máximo 3 horas). Amostras de aproximadamente 50 μL eram reservadas e congeladas a -20oC para posterior dosagem de proteínas segundo método de (Lowry et al., 1951).
3.6 - Ensaio de exocitose de vesículas sinápticas
Após desprezar o sobrenadante, os sinaptosomas eram ressuspendidos agora em 2mL solução KRH sem albumina, transferidos para a cubeta de fluorímetro contendo agitador magnético. Iniciou-se a leitura em um espectrofluorímetro SHIMADZU RF-5301 PC, com a excitação ajustada num comp. de onda de 488nm e a emissão em 570nM, taxa de aquisição 4 pontos por seg. e tempo total de leitura 500 seg.
3.7 - Medida do cálcio livre intrasinaptosomal
Fura2-AM (solução estoque a 1mM em DMSO) foi adicionado à suspensão sinaptosomal para dar uma concentração final de 5 μM, a mistura incubada a 37oC por 30min e em seguida diluida para 1200μL, seguida por mais 30min de incubação. O marcador Fura2-AM isolado dos terminais nervosos foi lavado através de centrifugação e o sinaptosoma foi ressuspenso com 2mL de solução KRH sendo imediatamente transferido para cubeta fluorimétrica e usado para a quantificação fluorimétrica do cálcio intracelular em espectrofluorímetro. A emissão de fluorescência foi detectada a 510 nm usando como faixa de excitação média 340/380 nm sob temperatura controlada a 37oC e sob constante agitação. CaCl2 foi adicionado à suspensão sinaptosomal (1,0 mM
concentração final) no início de cada doseamento fluorimétrico. Toxinas bloqueadoras específicas de canais de cálcio e a PhTx3-4 foram adicionadas (separadamente ou em associação) à suspensão 6- segundos antes da despolarização dos sinaptosomas com KCl 30mM. O aumento de [Ca2+]i
induzido pela despolarização da membrana é estritamente dependente da presença de Ca2+ nestas condições (Romano-Silva et al., 1993). A calibração do sinal de fluorescência era feita pela adição de SDS 10% e EGTA 10 mM. A concentraçao em nanomolar de cálcio era calculada através da formula:
C = Kd*[(R-Rmin)/(Rmáx-R)]*Sf2/Sb2 (Grynkiewicz et al., 1985).
3.8 - Análise estatística dos resultados
pelo programa Graph Pad Prism versão 4.0, por ANOVA de uma via, após constatação que as variâncias entre grupos não diferiam significativamente, eram feitos testes T de student pareado para comparação entre grupos, considerando diferenças entre grupos estatisticamente significativas para valores de p < 0,05.
3.9 - Uso de FM2-10 para monitorar a exocitose
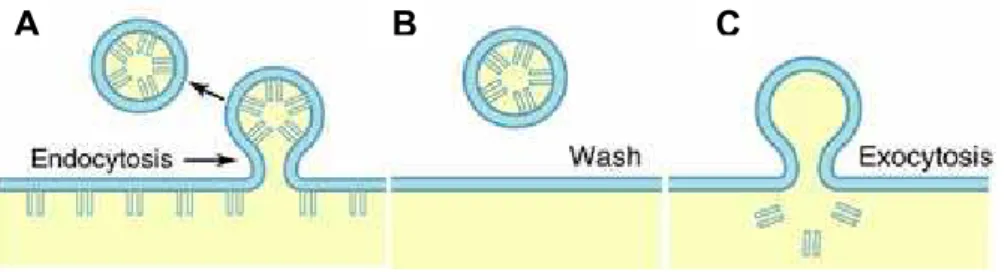
Com o desenvolvimento dos marcadores “FM”, tornou-se possível o estudo de vários aspectos da transmissão sináptica. Marcadores FM são comumente usados como indicadores da exocitose e, em associação com outras técnicas tal como indicadores fluorescentes de Ca2+ e técnicas eletrofisiológicas, ajudam a elucidar os mecanismos da homeostase pré-sináptica de Ca2+ (Cochilla et al., 1999). Esses marcadores foram inicialmente desenvolvidos para serem sensores de potencial de membrana mas com o passar do tempo, foram se tornando ferramentas úteis no estudo da transmissão sináptica e da reciclagem de vesículas sinápticas. A grande utilidade dos FM´s reside na observação de que essas moléculas se ligam reversivelmente a membranas, na incapacidade de atravessar as membranas e, principalmente, por emitir fluorescência consideravelmente maior quando ligadas do que quando desligadas das membranas (Betz et al., 1996). Moléculas FM tem caráter anfipático e consistem em uma calda lipofílica ligada (via uma ou múltiplas ligações duplas) a uma cabeça positivamente carregada (Fig. 6).
apesar da curta fração temporal que separa esses dois eventos (revisado por Cousin and Robinson, 1999).
Figura 6: Estrutura química da molécula FM2-10: A cabeça da molécula é um determinante chave que impossibilita o marcador de atravessar membranas biológicas. O comprimento da calda lipofílica da molécula determina as propriedades da cinética de marcação das membranas. Marcadores com uma longa cauda lipofílica marcam membranas com uma maior afinidade do que marcadores com calda curta. Por fim, as características espectrais de fluorescência desses marcadores é determinada pela quantidade de duplas ligações entre a cabeça e a calda (retirado de Brumback et al., 2004).
A B C
4.1 – PhTx3-4 e medidas de cálcio intrasinaptosomal
Medidas de cálcio livre intrasinaptosomal foram realizadas utilizando o marcador fluorescente de cálcio Fura2-AM. Esta substância tem a propriedade de atravessar membranas celulares e, após a quebra da ligação éster do grupamento acetoximetil (AM) por esterases celulares inespecíficas, o Fura2 fica livre no citoplasma. As propriedades de fluorescência do Fura 2 são modificadas em presença de cálcio, a quantificação da concentração da [Ca2+] é obtida pela medida ratiométrica da fluorescência emtida em 510 nm após excitação em duplo comprimento de onda (340/380 nm). Nessa experiência, sinaptosomas foram pré-incubados por 1 hora com Fura2-AM 5μM e em seguida, despolarizados com KCl 30mM.
A adição de KCl 30mM causou um aumento de 240 + 25 nM na [Ca2+]i
dos sinaptosomas corticais marcados com Fura-2 (Figura 8). A toxina PhTx3-4, incubada na suspensão sinaptosomal 60s antes da despolarização com KCl, diminuiu a [Ca2+]i induzida por KCl de uma maneira dependente da dose
(Figura 8A). O IC50 de inibição da toxina PhTx3-4 no aumento da [Ca2+]i
induzido pelo KCl foi de 1.4 nM (Figura 8C) e não houve diferença estatisticamente significativa entre o efeito inibitório da toxina a 5 e 10 nM, P > 0,05.
B 200 300 400 500 600 700
250 300 350 400 450 500
Tem po (s)
[C a 2 + ] (n M
) Tx3-4 0.5nM
Tx3-4 1nM Tx3-4 5nM Tx3-4 10nM Controle KCl 30mM A
KCl 30mM PhTx3-4 10nM 0 100 200 300 * Δ [C a 2+ ] (n M ) [Tx3-4] (nM)
0 2 4 6 8 10 1
% inibi ç ão 2 0 10 20 30 40 50 60 C
Figura 8: Efeito da PhTx3-4 na [Ca2+]i induzida por KCl 30mM: Após
marcação por 1 hora com Fura2-AM, os sinaptosomas eram despolarizados com KCl 30 mM na presença ou ausência da PhTx3-4 em várias concentrações. A toxina PhTx3-4 incubada 60 s antes da despolarização bloqueia o aumento da [Ca2+]i induzida por KCl de uma forma
dose-dependente. Gráfico representativo de no mínimo 3 experimentos independentes para cada concentração testada (A). O gráfico em barras mostra a [Ca2+]i após adição de KCl subtraído da [Ca2+]i basal (média + EPM)
(B). Os dados em cada ponto mostram a média + EPM da porcentagem de inibição da [Ca2+]i em no mínimo três experimentos independentes para cada
4.2 – Efeito comparativo da PhTx3-4 com o de toxinas
bloqueadoras de canais de cálcio nas medidas de cálcio
intracelular
Com o objetivo de testar se os canais de cálcio alvo da PhTx3-4 coincidem com conhecidas classes de canais de cálcio tais como aqueles bloqueados pelas ω-toxinas MVIIC, GVIA e AgaIVA, medimos as mudanças na concentração de cálcio induzida por KCl em sinaptosomas, na presença dessas diferentes toxinas. A figura 9 mostra que PhTx3-4 (10 nM), ω-CgTx MVIIC (2,5 μM), ω-CgTx GVIA (1 μM) e ω-Aga IVA (30 nM) diminuiram em aproximadamente 53, 47, 22 e 24%, respectivamente, as mudanças da [Ca2+]i
induzidas pela despolarização por KCl. Para testar a sobreposição dos canais de Ca2+ inibidos pelas ω-toxinas MVIIC, GVIA e AgaIVA, elas foram incubadas junto com a PhTx3-4 (10 nM) antes da despolarização da suspensão sinaptosomal com KCl 30 mM. A aplicação conjunta de PhTx3-4 (10 nM) com CgTx MVIIC (2,5 μM) ou com ω-CgTx GVIA (1 μM) inibiu em 46 e 50%, respectivamente, o aumento da [Ca2+] induzido por KCl, portanto, não causou inibição maior do que aquela observada com o uso da PhTx3-4 sozinha (53%). Entretanto, PhTx3-4 (10 nM) aplicada junto à ω-Aga IVA (30 nM), bloqueadora específica de canais de cálcio Tipo-P (Randal & Tsien, 1995), causou um efeito inibitório aditivo de 66 + 2,3% na variação da [Ca2+]i induzida por KCl nos
0 50 100 150 200 250 300
*
*
*
*
*
*
**
*
(53%) (47%) (22%) (24%) (46%) (50%) (66%)Δ
[C
a
2+]
i(nM
)
KCl 30 mM + + + + + + + +
Tx3-4 (10nM) + + + +
MVIIC (2.5µM) + +
GVIA (1µM) + +
AgaIVA (30nM) + +
Figura 9: Efeito das ω-toxinas PhTx3-4, ω-CgTx MVIIC, ω-CgTx GVIA e ω -AgaIVA no aumento da [Ca2+]i induzido por KCl. Sinaptosomas
cérebro-corticais de ratos foram marcados com Fura 2-AM tal como descrito em materiais e métodos e em seguida incubados na presença/ausência das toxinas 60 s antes da despolarização com KCl. Δ[Ca2+]i significa a variação da
4.3 - Exocitose de vesículas sinápticas induzida por KCl
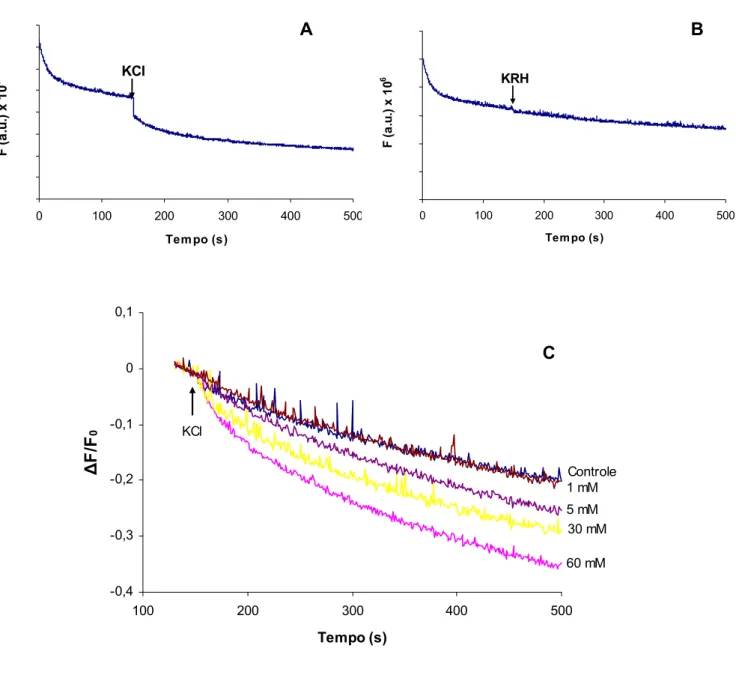
Inicialmente, padronizamos o método de liberação do corante fluorescente FM2-10 com o intuito de monitorar a exocitose de vesículas sinápticas em sinaptosomas cerebrocorticais. Para estes estudos usamos o FM2-10 ao invés do FM1-43 (Meffert et al., 1994; Guatimosim et al., 1997). Essa escolha baseia-se no fato do FM2-10 ser mais hidrofílico que o FM1-43 e portanto mais facilmente lavável de membranas (Betz et al., 1996) gerando linha de base de fluorescência menor (Marks and McMahon, 1998).
0 100 200 300 400 500
Tem po (s)
F ( a. u .) x 10 6 KCl
0 100 200 300 400 500
Tem po (s)
F ( a .u .) x 1 0 6 KRH
A B
-0,4 -0,3 -0,2 -0,1 0 0,1
100 200 300 400 500
Tempo (s) Δ F/ F 0 Controle 1 mM 5 mM 30 mM 60 mM KCl C
Figura 10: Exocitose em sinaptosomas cérebrocorticais induzida por despolarização de membrana. Sinaptosomas cérebro-corticais foram incubados na presença de FM2-10 (50μM) e Ca2+ (5mM), despolarizados com KCl (30mM), lavados em meio livre de FM2-10 e transferidos para cubeta de fluorímetro para medidas de fluorescência (materiais e métodos). A liberação de FM2-10 foi monitorada após adição de solução de KCl (várias concentrações) (A e C) ou de meio KRH à suspensão de sinaptosomas, contendo cálcio 1,3mM (B). Gráficos representativos de no mínimo 3 experimentos independentes. Setas indicam o momento da adição de KCl ou de KRH. a.u. – unidade arbitrária de fluorescência, ΔF/F0 – fluorescência
4.4 - Cálcio e exocitose
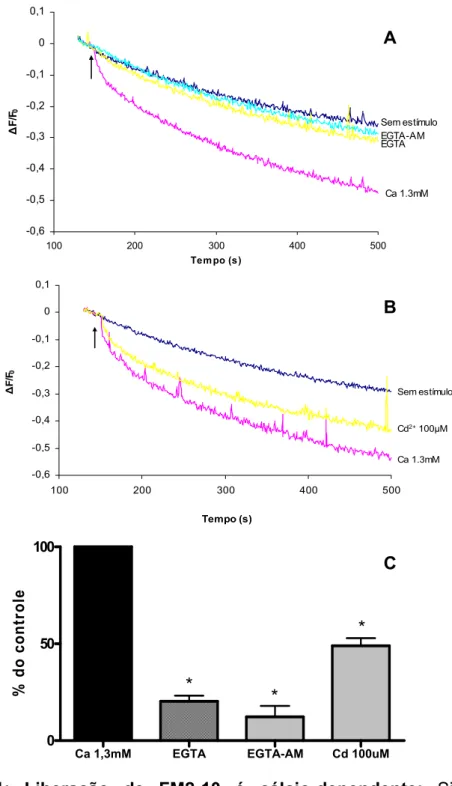
A queda da fluorescência induzida por KCl mostrou ser dependente da presença de cálcio no meio extra sinaptosomal. Em sinaptosomas despolarizados em meio sem cálcio e contendo EGTA 2mM, a queda da fluorescência foi de apenas 20,8 + 2,4%, quando comparada àquela na presença de cálcio 1.3 mM no meio de incubação (Fig. 11 - A e C). Logo, a maior fração da exocitose induzida por KCl está ligada à presença de um gradiente químico de Ca2+ no meio externo.
Para testar o efeito do cálcio interno na exocitose disparada por KCl, sinaptosomas marcados com FM2-10 foram pré-incubados com EGTA-AM 50 μM (um quelante de cálcio intracelular), 5 minutos antes do estímulo despolarizante com KCl. A queda da fluorescência foi drasticamente diminuída em relação à condição com cálcio no meio externo (Fig. 11 - A e C), contudo não foi mais acentuada que a queda dos experimentos com EGTA, e não mostrou diferença estatisticamente significativa entre esses dois grupos (P>0,05). Testamos também outro quelante de Ca2+ interno, o BAPTA-AM. Entretanto esse quelante causava queda significativa da fluorescência mesmo sem a adição de KCl (dados não mostrados), sugerindo que o BAPTA-AM interfere com a fluorescência do FM2-10, invalidando, portanto o uso dessa substância para esse protocolo experimental.
-0,6 -0,5 -0,4 -0,3 -0,2 -0,1 0 0,1
100 200 300 400 500
Tem po (s)
Δ F/F 0 EGTA-AM EGTA Ca 1.3mM Sem estímulo A -0,6 -0,5 -0,4 -0,3 -0,2 -0,1 0 0,1
100 200 300 400 500
Tempo (s) Δ F/ F0 Ca 1.3mM Sem estímulo
Cd2+100μM
B
Ca 1,3mM EGTA EGTA-AM Cd 100uM
0 50 100 * * * % d o c ont ro le C
4.5 - Efeito da toxina PhTx3-4 na exocitose
Com a finalidade de estudar o efeito da toxina PhTx3-4 na exocitose induzida por KCl, testamos concentraçoes de 0.1, 1, 4, 8 e 16nM da toxina incubadas 5 minutos antes do estímulo despolarizante, visando construir a curva de concentração da toxina. Em presença de 8 nM da toxina PhTx3-4, a queda de fluorescência induzida por KCl foi 37% menor (Fig. 10 – B) que o controle sem toxina. Não houve diferença no efeito inibitório da toxina entre as concentrações 8 e 16 nM (p > 0,05) (Fig 10 – A).
Usando concentrações progressivamente menores da toxina (16, 8, 4, 1.0 e 0.1 nM), construímos a curva de concentração da toxina PhTx3-4 sobre o efeito inibitório da exocitose (Fig. 12 – C). O IC50 encontrado foi de 1.1nM.
Tal como foi feito para as medidas de cálcio intrasinaptosomal, comparamos o efeito da PhTx3-4 com o efeito das ω-conotoxinas MVIIC, GVIA e AgaIVA na exocitose. Os resultados são mostrados na figura 13, PhTx3-4 (10 nM) reduziu em 37% a exocitose de vesículas sinápticas induzida por KCl, enquanto que a redução causada pela ω-AgaIVA (30 nM) e ω-MVIIC (2,5 μM) foram menores (10 e 22%, respectivamente, p < 0,05). A ω-conotoxina GVIA (1,0 μM), bloqueadora de canais Tipo-N, causou efeito pequeno, não estatisticamente significativo na exocitose induzida por KCl (P > 0,05). A aplicação conjunta de PhTx3-4 (10 nM) e AgaIVA (30 nM) causou efeito inibitório aditivo de 53 + 3,9% na exocitose induzida nos sinaptosomas (P < 0,05) comparado ao efeito inibitório da PhTx3-4 sozinha. Por outro lado, a PhTx3-4 mais GVIA (1,0 μM) causou inibição da exocitose ligeiramente maior porêm não significativamente diferente (P > 0,05) do que o efeito da PhTx3-4 sozinha.
B -0,7 -0,5 -0,3 -0,1 [Tx3-4] (nM)
0 5 10 15
% in ib iç ã o 0 10 20 30 40 50 0,1
100 200 300 400 500
Tempo (s)
Δ
F/
F
0 Sem estímulo
A
KCl 30 mM PhTx3-4 8nM 0 25 50 75 100 * % do c o n tr o le Sem Toxina 16 1 4 8 Tx3-4(nM)
C
Figura 12: Efeito da PhTx3-4 na exocitose: A suspensão sinaptosomal marcada com FM2-10 foi incubada com a PhTx3-4 (diferentes concentrações) 5 minutos antes da despolarização por KCl 30 mM. Concentrações diferentes de PhTx3-4 causaram diferentes efeitos sobre a queda da fluorescência KCl-evocada e um efeito máximo já era observado quando a toxina era usada em 8 nM (A) (gráfico representativo de pelo menos 3 experimentos independentes para cada concentração testada). Em (B) representação em barra da média + EPM do efeito da PhTx3-4 sobre a exocitose comparado à condições controle (sem antagonista). Em (C), curva dose-resposta do efeito inibitório da PhTx3-4 sobre a exocitose KCl-induzida (IC50 = 1.1 nM), símbolos representam a média
0 10 20 30 40 50 60 70 80 90 100 * * * * * * ** ** (37%) (21%) (5%) (10%) (33%) (41%) (53%) * E x o c it o s e ( % d o c o n tr o le )
KCl 30 mM + + + + + + + +
Tx3-4 (10nM) + + + +
MVIIC (2.5µM) + +
GVIA (1µM) + +
AgaIVA (30nM) + +
Sinaptosomas cérebro-corticais de ratos são modelos bem reconhecidos e amplamente utilizados no estudo de mecanismos pré-sinápticos envolvidos no processo de liberação de neurotransmissores. Métodos que utilizam preparações sinaptosomais possuem tanto vantagens como desvantagens quando comparados a medidas eletrofisiológicas convencionais da transmissão sináptica. A exocitose em sinaptosomas não pode ser evocada por potenciais de ação, já que os terminais nervosos estão isolados de seus axônios; além do mais, a resolução temporal é de certa forma restrita. Por outro lado, o uso de sinaptosomas oferece vantagens como poder controlar melhor a intensidade da despolarização da membrana pré-sináptica e a concentração de peptídeos antagonistas além de contornar problemas de medidas de correntes sinápticas vindas de membranas pós-sináticas (Turner and Dunlap, 1995).
Neste trabalho, foi investigado pela primeira vez a participação dos canais de cálcio sensíveis à PhTx3-4 no aumento interno da concetração de cálcio e na exocitose em sinaptosomas cérebro corticais. A toxina PhTx3-4 é potente bloqueadora das mudanças dos níveis intracelulares de cálcio e da exocitose, com valores de IC50 de 1.4 e 1.1 nM, respectivamente. ω
-conotoxinas, bloqueadores tradicionalmente conhecidos de canais de cálcio sensíveis à voltagem, também inibiram a exocitose, porém em menor extensão que a PhTx3-4.
quando o meio contém elevada concentração de cálcio (maior que 1,0 mM) porém quando meio contém baixa concentração de cálcio (menor que 0,5 mM), a inibição da liberação de transmissores, é irreversível. Ainda sobre junção neuromuscular, a PhTx3-4 exerce pouca ou nenhuma influência sobre a liberação espontânea de neurotransmissores (Troncone et al., 2003).
Em terminais nervosos, coexistem mútliplos tipos de canais de cálcio, os quais regulam não só a entrada de cálcio no terminal, mas também a exocitose de vesículas sinápticas. Os canais tipo N e P/Q além de suportar a transmissão sináptica, estão concentrados nos terminais nervosos. Os canais Tipo-P/Q são os de maior importância para a liberação de neurotransmissores nos terminais centrais (Takahashi and Momiyama, 1993; Guatimosim et al., 1997). Por outro lado, canais de cálcio Tipo-N são mais prevalentes em terminais nervosos periféricos e são fortemente responsáveis pela transmissão sináptica em terminais sensórios e autonômicos (Mochida et al., 1996).
Com o intuito de determinar os tipos de canais de cálcio bloqueados pela PhTx3-4 nos terminais nervosos, nós testamos a ação de toxinas que interferem com o aumento intracelular dos níveis de cálcio induzidos por despolarização com KCl. A toxina ω-AgaIVA (30 nM) afeta, predominantemente, canais de cálcio Tipo-P (Wheeler et al., 1994) e inibe em 24% o aumento da [Ca2+]i induzido por KCl em sinaptosomas cérebro-corticais
(Meder et al., 1997). Nós confirmamos esses dados mostrando que a ω -AgaIVA (30 nM) inibiu em 23% o aumento da [Ca2+]i induzido por KCl em
sinaptosomas. Nós observamos também que a aplicação conjunta da PhTx3-4 (10 nM) com a Aga IVA (30 nM) induziu efeito inibitório aditivo na [Ca2+]i e na
exocitose nos terminais nervosos. Esses dados podem sugerir que a PhTx3-4 age em outros canais de cálcio diferentes do P. A corrente de cálcio Tipo-Q é a principal corrente diferente da Tipo-P em células neuronais cerebelares e, junto às correntes de cálcio Tipo-P, representam quase metade do total das correntes de cálcio no sistema nervoso central (Randal & Tsien, 1995).
Ainda dependendo da concentração, a ω-AgaIVA bloqueia não somente canais de cálcio Tipo-P mas também canais Tipo-Q (Sather et al., 1993; Randall and Tsien, 1995). O IC50 da ω-AgaIVA para o bloqueio de correntes P
após o uso conjunto de ω-AgaIVA e PhTx3-4 deve envolver também uma contribuição significante de bloqueio em canais de cálcio Tipo-Q.
As correntes de cálcio Tipo-P (Mintz et al., 1992) e Tipo-Q são muito similares e ambas as correntes são completamente bloqueadas por concentrações saturantes da ω-conotoxina MVIIC. A falta de efeito aditivo no bloqueio da exocitose e das mudanças na [Ca2+]i induzidas por KCl após o uso
de MVIIC e PhTx3-4 é compatível com a idéia de que a PhTx3-4 possa bloquear seletivamente canais de cálcio Tipo-Q em terminais nervosos.
As ω-conotoxinas MVIIC e GVIA competem pelo mesmo sítio de ligação em canais de cálcio Tipo-N (McDonough et al., 2002) e a PhTx3-4 também pode afetar canais de cálcio Tipo-N. Dados obtidos de experimentos eletrofisiológicos prévios mostraram que a PhTx3-4 age em canais Tipo-N (Cassola et al., 1998; dos Santos et al., 2002; Troncone et al., 2003) além de canais Tipo-P/Q (dos Santos et al., 2002). Logo, é possível que a PhTx3-4 se ligue aos sinaptosomas em múltiplos sítios de ligação. A ω-AgaIVA se liga a canais de cálcio nativos Tipo-P em sítios diferentes aos quais se ligam a ω -AgaIIIA (Mintz et al., 1994) e a ω-CgTxMVIIC (McDonough et al., 2002), sugerindo que esses canais de cálcio possuem mais de um sítio de ligação para ω-conotoxinas. Logo, outra hipótese que não pode ser descartada é a de que a PhTx3-4 se ligue aos canais Tipo-P em um sítio diferente da ω-AgaIVA.
Vale ressaltar que com os presentes experimentos, não é possível excluir a participação de mais de um canal de cálcio envolvido na inibição causada pela PhTx3-4 na exocitose e nas mudanças da [Ca2+]i induzidas por
KCl nos terminais nervosos. Novos experimentos usando técnicas eletrofisiológicas serão necessários para explicar melhor o alvo de ação da PhTx3-4. É interessante notar que mesmo na presença de ambas, PhTx3-4 e ω-conotoxinas, nem a exocitose nem a [Ca2+]i foram completamente
bloqueadas, sugerindo a presença de canais de cálcio exocitóticos adicionais resistentes.
Experimentos anteriores confirmam a eficiência do KCl em induzir exocitose em terminais marcados com FM1-43 e também validam esse método como uma forma de obter medidas da secreção exocitótica em tempo real (Meffert et al., 1994). Nesse trabalho nós mostramos que o decaimento da fluorescência é marcadamente diminuída na ausência de um influxo de cálcio assim como na presença de Cd2+, EGTA, EGTA-AM ou de bloqueadores de canais de cálcio, portanto é dependente de exocitose ativa. Por essa técnica, nós mostramos que a PhTx3-4 causa uma inibição dose-dependente da exocitose. Tanto a ω -AgaIVA como a ω-CgTx MVIIC inibiram também as respostas exocitóticas induzidas pela despolarização por KCl em terminais nervosos. O efeito pequeno e não significante da ω-CgTx GVIA sugere que os canais de calcio Tipo-N tem pouco envolvimento com a exocitose em terminais nervosos cérebro-corticais.
Os dados obtidos para o bloqueio da exocitose com a PhTx3-4 apresentam alguma correspondência com a ação dessa toxina na liberação de glutamato. Tanto para o bloqueio da liberação de glutamato em sinaptosomas (Reis et al., 1999) como para o bloqueio da exocitose, o IC50 foi próximo de 1
nM. Embora a PhTx3-4 bloqueou 43% da exocitose ativa, ela bloqueou aproximadamente 75% da liberação de glutamato em sinaptosomas, tendo bloqueado não somente a liberação de glutamato dependente como também independente de cálcio (Reis et al., 1999), sugerindo que essa toxina bloqueia tanto a liberação exocitótica como não exocitótica de neurotransmissores.
Por fim, nós mostramos que a PhTx3-4 é uma nova e potente (age em concentrações nM) toxina eficaz no controle dos níveis de cálcio intracelular e da exocitose induzidos pela despolarização por KCl em sinaptosomas. PhTx3-4 pode representar uma nova ferramenta para o estudo da participação de canais de cálcio na dinâmica do cálcio intracelular bem como para o estudo da liberação de neurotransmissores do terminal nervoso.
também vem se mostrando eficaz no controle de alguns efeitos causados pela isquemia (dados não publicados).
• A toxina PhTx3-4 bloqueia, com elevada potência (IC50 = 1.4 nM) o
aumento dos de cálcio interno induzido por despolarização por KCl em sinaptosomas cérebro-corticais.
• O efeito inibítório da Tx3-4 sobre o cálcio sinaptosomal é maior que o efeito das ω-conotoxinas MVIIC, GVIA e agatoxina IVA. Esta última mostrou efeito inibitório aditivo com a Tx3-4, sugerindo que essas duas toxinas agem em alvos diferentes.
• Tx3-4 inibe, com elevada potência (IC50 = 1.1 nM) a exocitose induzida por KCl em sinaptosomas.
• Tx3-4 exerce bloqueio da exocitose comparativamente maior que o bloqueio da exocitose pelas ω-conotoxinas MVIIC, GVIA e agatoxina IVA, mostrando efeito inibitório aditivo somente com a ω-AgaIVA.
Aosaki T, Kasai H (1989) Characterization of two kinds of high-voltage-activated Ca-channel currents in chick sensory neurons. Differential sensitivity to dihydropyridines and omega-conotoxin GVIA. Pflugers Arch 414:150-156.
Araujo DA, Cordeiro MN, Diniz CR, Beirao PS (1993) Effects of a toxic fraction, PhTx2, from the spider Phoneutria nigriventer on the sodium current. Naunyn Schmiedebergs Arch Pharmacol 347:205-208.
Barker LA, Dowdall MJ, Whittaker VP (1972) Choline metabolism in the cerebral cortex of guinea pigs. Stable-bound acetylcholine. Biochem J 130:1063-1075.
Bean BP (1985) Two kinds of calcium channels in canine atrial cells. Differences in kinetics, selectivity, and pharmacology. J Gen Physiol 86:1-30.
Betz WJ, Bewick GS (1992) Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science 255:200-203.
Betz WJ, Mao F, Smith CB (1996) Imaging exocytosis and endocytosis. Curr Opin Neurobiol 6:365-371.
Borst JG, Sakmann B (1996) Calcium influx and transmitter release in a fast CNS synapse. Nature 383:431-434.
Bowersox SS, Singh T, Nadasdi L, Zukowska-Grojec Z, Valentino K, Hoffman BB (1992) Cardiovascular effects of omega-conopeptides in conscious rats: mechanisms of action. J Cardiovasc Pharmacol 20:756-764.
Brose WG, Gutlove DP, Luther RR, Bowersox SS, McGuire D (1997) Use of intrathecal SNX-111, a novel, N-type, voltage-sensitive, calcium channel blocker, in the management of intractable brachial plexus avulsion pain. Clin J Pain 13:256-259.
Brumback AC, Lieber JL, Angleson JK, Betz WJ (2004) Using FM1-43 to study neuropeptide granule dynamics and exocytosis. Methods 33:287-294. Cassola AC, Jaffe H, Fales HM, Castro Afeche S, Magnoli F, Cipolla-Neto J
(1998) omega-phonetoxin-IIA: a calcium channel blocker from the spider phoneutria nigriventer. Pflugers Arch 436:545-552.
Ceccarelli B, Hurlbut WP, Mauro A (1973) Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol 57:499-524.
Chapman ER (2002) Synaptotagmin: a Ca(2+) sensor that triggers exocytosis? Nat Rev Mol Cell Biol 3:498-508.
Chen YA, Scheller RH (2001) SNARE-mediated membrane fusion. Nat Rev Mol Cell Biol 2:98-106.
Clasbrummel B, Osswald H, Illes P (1989) Inhibition of noradrenaline release by omega-conotoxin GVIA in the rat tail artery. Br J Pharmacol 96:101-110. Cochilla AJ, Angleson JK, Betz WJ (1999) Monitoring secretory membrane with
FM1-43 fluorescence. Annu Rev Neurosci 22:1-10.
Cordeiro Mdo N, de Figueiredo SG, Valentim Ado C, Diniz CR, von Eickstedt VR, Gilroy J, Richardson M (1993) Purification and amino acid sequences of six Tx3 type neurotoxins from the venom of the Brazilian 'armed' spider Phoneutria nigriventer (Keys). Toxicon 31:35-42.
Cousin MA, Robinson PJ (1999) Mechanisms of synaptic vesicle recycling illuminated by fluorescent dyes. J Neurochem 73:2227-2239.
Dos Santos RG, Van Renterghem C, Martin-Moutot N, Mansuelle P, Cordeiro MN, Diniz CR, Mori Y, De Lima ME, Seagar M (2002) Phoneutria nigriventer omega-phonetoxin IIA blocks the Cav2 family of calcium channels and interacts with omega-conotoxin-binding sites. J Biol Chem 277:13856-13862.
Dunkley PR, Jarvie PE, Heath JW, Kidd GJ, Rostas JA (1986) A rapid method for isolation of synaptosomes on Percoll gradients. Brain Res 372:115-129.
Eccles J (1976) From electrical to chemical transmission in the central nervous system. Notes Rec R Soc Lond 30:219-230.
Evans RM, Zamponi GW (2006) Presynaptic Ca2+ channels--integration centers for neuronal signaling pathways. Trends Neurosci 29:617-624. Gomez MV, Kalapothakis E, Guatimosim C, Prado MA (2002) Phoneutria
nigriventer venom: a cocktail of toxins that affect ion channels. Cell Mol Neurobiol 22:579-588.
release of 3H-acetylcholine induced by tityustoxin and potassium in brain cortical slices and myenteric plexus. Neurosci Lett 196:131-133.
Grynkiewicz G, Poenie M, Tsien RY (1985) A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem 260:3440-3450.
Guatimosim C, Romano-Silva MA, Cruz JS, Beirao PS, Kalapothakis E, Moraes-Santos T, Cordeiro MN, Diniz CR, Gomez MV, Prado MA (1997) A toxin from the spider Phoneutria nigriventer that blocks calcium channels coupled to exocytosis. Br J Pharmacol 122:591-597.
Gundelfinger ED, Kessels MM, Qualmann B (2003) Temporal and spatial coordination of exocytosis and endocytosis. Nat Rev Mol Cell Biol 4:127-139.
Hagiwara S, Ozawa S, Sand O (1975) Voltage clamp analysis of two inward current mechanisms in the egg cell membrane of a starfish. J Gen Physiol 65:617-644.
Heuser JE, Reese TS (1973) Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol 57:315-344.
Hillyard DR, Monje VD, Mintz IM, Bean BP, Nadasdi L, Ramachandran J, Miljanich G, Azimi-Zoonooz A, McIntosh JM, Cruz LJ, et al. (1992) A new Conus peptide ligand for mammalian presynaptic Ca2+ channels. Neuron 9:69-77.
Hirning LD, Fox AP, McCleskey EW, Olivera BM, Thayer SA, Miller RJ, Tsien RW (1988) Dominant role of N-type Ca2+ channels in evoked release of norepinephrine from sympathetic neurons. Science 239:57-61.
Jahn R, Sudhof TC (1999) Membrane fusion and exocytosis. Annu Rev Biochem 68:863-911.
Jessell TM, Kandel ER (1993) Synaptic transmission: a bidirectional and self-modifiable form of cell-cell communication. Cell 72 Suppl:1-30.
Kushmerick C, Kalapothakis E, Beirao PS, Penaforte CL, Prado VF, Cruz JS, Diniz CR, Cordeiro MN, Gomez MV, Romano-Silva MA, Prado MA (1999) Phoneutria nigriventer toxin Tx3-1 blocks A-type K+ currents controlling Ca2+ oscillation frequency in GH3 cells. J Neurochem 72:1472-1481.
Loewi O, Navratil E. (1926) On the humoral propagation of cardiac nerve action. Communication X. The fate of the vagus substance. Cellular Neurophysiology: Asource Book, pp. 478-485.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ (1951) Protein measurement with the Folin phenol reagent. J Biol Chem 193:265-275.
Lucas S (1988) Spiders in Brazil. Toxicon 26:759-772.
Marks B, McMahon HT (1998) Calcium triggers calcineurin-dependent synaptic vesicle recycling in mammalian nerve terminals. Curr Biol 8:740-749. Martin-Moutot N, Haro L, Santos RG, Mori Y, Seagar M (2006) Phoneutria
nigriventer omega-Phonetoxin IIA: a new tool for anti-calcium channel autoantibody assays in Lambert-Eaton myasthenic syndrome. Neurobiol Dis 22:57-63.
Mattiello-Sverzut AC, Fontana MD, Diniz CR, da Cruz-Hofling MA (1998) Pathological changes induced by PhTx1 from Phoneutria nigriventer spider venom in mouse skeletal muscle in vitro. Toxicon 36:1349-1361. McCleskey EW, Fox AP, Feldman DH, Cruz LJ, Olivera BM, Tsien RW,
Yoshikami D (1987) Omega-conotoxin: direct and persistent blockade of specific types of calcium channels in neurons but not muscle. Proc Natl Acad Sci U S A 84:4327-4331.
McDonough SI, Boland LM, Mintz IM, Bean BP (2002) Interactions among toxins that inhibit N-type and P-type calcium channels. J Gen Physiol 119:313-328.
Meder W, Fink K, Gothert M (1997) Involvement of different calcium channels in K+- and veratridine-induced increases of cytosolic calcium concentration in rat cerebral cortical synaptosomes. Naunyn Schmiedebergs Arch Pharmacol 356:797-805.
Miljanich GP, Ramachandran J (1995) Antagonists of neuronal calcium channels: structure, function, and therapeutic implications. Annu Rev Pharmacol Toxicol 35:707-734.
Mintz IM (1994) Block of Ca channels in rat central neurons by the spider toxin omega-Aga-IIIA. J Neurosci 14:2844-2853.
Mintz IM, Bean BP (1993) Block of calcium channels in rat neurons by synthetic omega-Aga-IVA. Neuropharmacology 32:1161-1169.
Mintz IM, Venema VJ, Adams ME, Bean BP (1991) Inhibition of N- and L-type Ca2+ channels by the spider venom toxin omega-Aga-IIIA. Proc Natl Acad Sci U S A 88:6628-6631.
Miranda DM, Romano-Silva MA, Kalapothakis E, Diniz CR, Cordeiro MN, Santos TM, Prado MA, Gomez MV (1998) Phoneutria nigriventer toxins block tityustoxin-induced calcium influx in synaptosomes. Neuroreport 9:1371-1373.
Mochida S, Sheng ZH, Baker C, Kobayashi H, Catterall WA (1996) Inhibition of neurotransmission by peptides containing the synaptic protein interaction site of N-type Ca2+ channels. Neuron 17:781-788.
Nowycky MC, Fox AP, Tsien RW (1985) Three types of neuronal calcium channel with different calcium agonist sensitivity. Nature 316:440-443. Ohta S, Smith ML, Siesjo BK (1991) The effect of a dihydropyridine calcium
antagonist (isradipine) on selective neuronal necrosis. J Neurol Sci 103:109-115.
Olivera BM, Miljanich GP, Ramachandran J, Adams ME (1994) Calcium channel diversity and neurotransmitter release: the omega-conotoxins and omega-agatoxins. In: Annu Rev Biochem, pp 823-867.
Pinheiro AC, Gomez RS, Massensini AR, Cordeiro MN, Richardson M, Romano-Silva MA, Prado MA, De Marco L, Gomez MV (2006) Neuroprotective effect on brain injury by neurotoxins from the spider Phoneutria nigriventer. Neurochem Int 49:543-547.
Ramon y Cajal S. 1911. Histologie du Système Nerveus de l´Hommme & des Vertébrés, Vol. 2. L Azoulay (transl). Paris: Maloine; 1955. Reprint. Madrid: Instituto Ramón y Cajal.
Randall A, Tsien RW (1995) Pharmacological dissection of multiple types of Ca2+ channel currents in rat cerebellar granule neurons. J Neurosci 15:2995-3012.
Reis HJ, Prado MA, Kalapothakis E, Cordeiro MN, Diniz CR, De Marco LA, Gomez MV, Romano-Silva MA (1999) Inhibition of glutamate uptake by a polypeptide toxin (phoneutriatoxin 3-4) from the spider Phoneutria nigriventer. Biochem J 343 Pt 2:413-418.
Rezende Junior L, Cordeiro MN, Oliveira EB, Diniz CR (1991) Isolation of neurotoxic peptides from the venom of the 'armed' spider Phoneutria nigriventer. Toxicon 29:1225-1233.
Romano-Silva MA, Ribeiro-Santos R, Ribeiro AM, Gomez MV, Diniz CR, Cordeiro MN, Brammer MJ (1993) Rat cortical synaptosomes have more than one mechanism for Ca2+ entry linked to rapid glutamate release: studies using the Phoneutria nigriventer toxin PhTX2 and potassium depolarization. Biochem J 296 ( Pt 2):313-319.
Ryan TA (2006) A pre-synaptic to-do list for coupling exocytosis to endocytosis. Curr Opin Cell Biol 18:416-421.
Sather WA, Tanabe T, Zhang JF, Mori Y, Adams ME, Tsien RW (1993) Distinctive biophysical and pharmacological properties of class A (BI) calcium channel alpha 1 subunits. Neuron 11:291-303.
Scott RH, Dolphin AC, Bindokas VP, Adams ME (1990) Inhibition of neuronal Ca2+ channel currents by the funnel web spider toxin omega-Aga-IA. Mol Pharmacol 38:711-718.
Sherrington C. 1947. The integrative Action of the Nervous System, 2nd ed. New Haven: Yale Univ. Press.
Slepnev VI, De Camilli P (2000) Accessory factors in clathrin-dependent synaptic vesicle endocytosis. Nat Rev Neurosci 1:161-172.

![Figura 8: Efeito da PhTx3-4 na [Ca 2+ ] i induzida por KCl 30mM: Após marcação por 1 hora com Fura2-AM, os sinaptosomas eram despolarizados com KCl 30 mM na presença ou ausência da PhTx3-4 em várias concentrações](https://thumb-eu.123doks.com/thumbv2/123dok_br/15137604.14013/43.892.95.824.95.773/induzida-marcacao-sinaptosomas-despolarizados-presenca-ausencia-varias-concentracoes.webp)
![Figura 9: Efeito das ω-toxinas PhTx3-4, ω-CgTx MVIIC, ω-CgTx GVIA e ω- ω-AgaIVA no aumento da [Ca 2+ ] i induzido por KCl](https://thumb-eu.123doks.com/thumbv2/123dok_br/15137604.14013/45.892.122.821.140.769/figura-efeito-toxinas-mviic-gvia-agaiva-aumento-induzido.webp)