REVISTA BRAIIUIRA DE ZOOLOGIA
... ZooI .. 1(3) : 223-243 15/XH/91
DISTRIBUIÇÃO E CICW DE, VIDA DAS ESPtCIES DE peセ@ セais@
ABUNDANTES DA LAGUNA D,E mセendiN@ RIO DE JANEIRO. BRASIL
, . . 1
"
II
Luis R. R. Barbieri,l José V. Andreata, Man:os A. Santos, Maria H.C. da Sil;va, Andrés S.C. Sebilia, Ricardo P. dos Santos
ABSTRACT
Month/y sampling from morch 1981 to april 1983 using beach seines, cast nets and gill nets indicated su species, Xenomelaniris 「ョウセョウゥウN@ 8revoortia
'Pectinata:
Geo-phagus brasiliensis.
Gerres
aprion. Genidens genidens セョ、@ Achirus lineatus. as the most abundant fishes in the Mizrependi Lagoon, RioG、セ@
Janeiro, BraziL The sPecies presented a long reproductive period and the reeruitment distrihuted throughout the year. Ana/ysis of the mean catch per unit effort in relation to 'month" sampling areas, and environmental factors aJong with ana/ysis of the length frequency distribution by depth strata indicated that the spatial distribution, related to depth and occu"ence of submergedaquatic vegetation seem to be the fTlain factors regulating the species distri-bution. Alteration oFthe environmental conditiom in the lagoon due to the' opening of the Marapendi ,channel in 1984 caused significative modification in the distribution and abundance pattems of the main species. The impact of these a/terations in the Mara-pendi Lagoon fish community has yet to be detennined 'INTRQDUÇÃO
Os estuários representam ambientes altamente produtivos, constituindo importan-tes zonas de crescimento e alimentação para larvas e juvenis de diversas espécies de pei-xes e invertebrados (MiIler & Dunn, 1980; Chao et al., 1987; Himes et aI., 1987). Embo-ra muitas destas áreas não apresentem um potencial pesqueiro direto, o papel dos estuá-rios como criadouros de diversas espécies exploradas comercialmente toma o estudo des-tes ambiendes-tes extremamente importante para o manejo de recursos costeiros (Chao et aI., no prelo; Lenanton & Potter, 1987).
Apesar 4a abundância de estuários e lagunas costeiras no litoral do Rio de Janeiro, poucos estudos foram realizados especificamente sobre a ictiofauna estuarina da região e até o momento pouco se sabe sobre a importância destes ambientes no ciclo de vida das espécies locais. Este trabalho apresenta os padrões de distribuição espacial e tempo-ral, relação com parâmetros ambientais e a composição de comprimentos das seis espé-cies de peixes mais abundantes capturadas na Laguna de Marapendi, enfatizando-se o
Universidade Santa Úrsula, Departamento de Biologia Animal, Rua Fernando Ferrari, 75, Bo-tat"ogo, CEP 22231 - Rio de Janeiro, RJ - Brasil.
Endereço atual: Vilginia Institute of t.1alim Science School of Marine Science
The CoUege of William .l Mary Gloucester POint, V A 23062 - USA
ReYta bras. Zool.
papel do ambiente estuaIino no ciclo de yjda das ・セ」ゥ・ウN@ A re1açio do total de ・セ」ゥ・ウ@ capturadas durante o período de amostragem e uma descrição detalhada da ma estuda-da foram apretentados por Anelreata et alo (no prelo).
MATERIAL E MtrODOS
As amostras foram obtidas segUndo um programa de amostragem aleatório estrati-ficado, no qual a ma total estudada foi subdividida em quatro faixas longitudinais de-aproximadamente
2.5
km
de extensão, mas 1, 2, 3 e 4, dispostas seqüencia1mente atA! o interior da 1apna,com
o objetivo de refletir o gradiente de salinidade. Cada ma foi subdividida em tlfs resaões: margem norte, mugem sul e canal central (Fig. 1).Amostru meDSlil foram realizadas no período de muço de 1981 a abril de 1983 com redes de
arnsto
de praia, tarrafase
rede de espera em estações pontuais estabeleci-das aleatoriamente em cada regiio por mL Pua cada estação foram registrados 01 カ。ャセ@res de salinidade, temperatura e oxigênio dissolvido superficiais.
Para as mtOStDs com auasto de praia nas regiões muginais_ rasas foi オセ、。@ uma
rede de calões com 5 m de comprimento, 1,4 m de altura e malha de 15 mm, com um esforço de 3 unstos IJOr estação. Para as amOstras com tarrafa, realizadas nas regiões maiginais e zonas do canal, utilizou-se uma rede de 2 m de altura e malhade 18 mm,
com um esforço de 15 lances por estação. Uma rede de espera de 35 m de comprimento, 2 m de altura e malha de 25 mm foi utilizada nas zonas mais profundas do canal. Não foi utilizada nenhuma unidade de esforço para a rede de espera e as amostras foram utili-zadas apenas para fornecer dados de comprimento e oconência das ・セ」ゥ・ウN@
No laboratório todos os exemplares foram identificados, medidos no comprimen-to padrão (CP, do extremo dó focinho atA! o fmal do pedúnculo caudal) ao milímetro majs próximo, pesados e, sempre que pOSSÍwl, determinado o sexo e o peso das góna-das. Em-amostras demasiadamente grandes foram retiradas sub-amostras aleatórias de 30 indivíduos de cada セゥ・N@ Nestes casos era contada e pesada a captura total por
・セ」ゥ・N@
O índice gonadOSlOmátiCO (IGS) das fêmeas foi obtido 。セウ@ da relação: WgJ (Wt-Wg)
x
100, onde Wg セ@ o peso da gônada e Wt o peso total, ambos em gramas (Vazzoler,I981).A abundiocia relativa das ・セ」ゥ・ウ@ foi medida em termos de captura m6dia por unidade de esforço (CPUE), オエゥャゥコ。ョ、セウ・@ o número セ、ゥッ@ de indivíduos por arrasto para os arrastos de praia e número m6dio de indivíduos por lance para as amostras com tarrafa. As diferenças significativas entre as médias de CPUE foram testadas atrln'és de
análise de variiocia (ANOVA, p < 0,05) seguida do teste ua posteriori" de Scheffe
(p < 0,05). A . normalidade dos dados e a homogeneidade das variâncias dos grupos ヲセ@
ram testadas prmamente atr.r.és do teste de Bartlett (p < 0,05) (Sokal &: Rohlf, 1981) e realizadas, sempre que necessúio, transformações dos dados do tipo
Los •
(X + I), onde X conesponde ao CPUE m6dio. Todas as análises foram realizadas オエゥャゥコ。ョ、セウ・@ o pacote estatístico SPSS-X (SPSS, 1985).RESULTADOS E
DISCUSSAODo total de セゥ・ウ@ capturadas na Laguna de Marapendi durante o período amos.-trado, seis espkies, Xmomdmiris bnuiliensis. lJrewxJTtúz pectiNlta. Geoplutgw
Vol. 7(3), 1990
..,
..
.. ..
,<
!: '"
..
=
go .0; c
..
U
...
..
'O o
セ@ ii:
z ,.; :::I
cC ?t a.
..
...J
:
:; u..
セ@
...
..
C 'O :;
C ::l
?t
o セ@
o
z lo(
..
4( Q.
E o
セ@ U
.;
U 'O
:
..
O 'O
セ@
..
..
..
,<
I
.si
'"
.+.
;
•
N
セ@
_. ,
セ@ , CAPTURA COM TARRA'A
A
B
N" CAPTURA COM ARRASTO Of: PRAIAN=48 N'=2"7 N=,,5, N'=26
40.
セ ^@
セ@ ZLセセL@
2::
{ャセ{「セセ
Mセセ{セ Gセイョ{「@
,i; セZᄋセエAセ⦅jセセエN@ '1 ... , ...
C".«
s. セBBGLN@n]TTセ@ N'=" OC,,'''' -,-t",."
-:,:..1;
:::
ェセセセェjセェ
Zァセjェ@
セ]XX@
N'=87, ."'" ,.,:, .•. '. -r·⦅セMiヲ@
-_:. 1 ... Mセ@ .":1 • . ""'·,1 BBBセセ@ '- " • .d
, O . ',:,-,. •
IIJ
::l
Cl.
U
セZZ Zセセセセセセセセセセセセ@
',>20 • . ... "c', :;.,'
[ セ N⦅[@
.'''- -. __ '-. ".セ G@
""Z"'.,',;"」MFNᄋセ⦅ZNNᄋ|LセNN@
.',Nセ G@ BNLGセ@
,".':", ';";,'Mセ@
[セG@
'.n
r '11
O • • ",BlOzl
{エャゥセセ
G@ ャQィ。セ
G@
- セGL@
E
. ,
N=87 N'=64 10 - ,. N=236
F
f'- "..
N':7,4
I::
ェセセ セ セ{セ Gセセ セセセ [GB@
J F M A M J J
セセHI@
N D >I::
ヲセセセセセセセセセセセ@
MESES
セ@ TARRAFA
o
ARRASTO OE PRA.AFia. 2 - Distribuição mensal das média s de CPUE/arte de pesca pala cada uma das espécies; A
=
X.b,rasiliensis; B
=
B. pectinata; C=
G. brasiliensis; D=
G. aprion; E=
G, lenldenl; F '" A . li,neatus.
MESES
セ@
セ@
N セ@
...
t7
M セ@
a
1&1 ;:)o..
(,)
A
N=48 N'=2117 40
20
01
Ckm
C
[l[l[l
N=449 N'= 1100 20,
'::ca
セ@
CD
{jセ@
E
N=87 N'=64
10
5
o
セ@ヲwAセ」。@
セ@ 4ÁREAS
セ@ TARRAFA
N , CAP!U,RA COI!I TA,RRAfA
B
'.I' • CAPTURA COM ARRASTO oe: PRAIAN=1151 N'=26 40
jセ@
20
o
O
N'=871 N=88
20
[M[L
10
O
F
N=236
10 N' =74
5
O
caca
1 2o
ARRASTO DE PRAIAセMM
セLセ@
セヲTQ@
ÁREASFil. 3 - Disuibuição espacial das médias de CP UE/arte de pesca para cada uma das espécies : A .. X.
brasiliensis; B z B. pectinata; C : G. brasiliensis; O ., G. aprion: E - G. ,enident; f 2 A . Ii·
neatus.
セ@
-Õ
::--
....
::)Q.
U
A
N=48 N'=2117
30
{l{ャセ{l{ャ@
20
10
o
セ]TTY@
N'= 1100セZGセセ{「{「セ@
OE
N=87
10 N'=64
」ZZZヲRaセセセセ@
5
o
%0
セ@ TARRAFA
N ' CAPTURA COM TARRAFA
8
N' , CAPTURA COM ARRASTO DE PRAIAN=1151
30
2 0
10
O
o
N'=26
N=88 N'=871
30
20
10
oGセMM
F
N=236 N'=74
I o セ@
s. )
セ{jj@
cDュセセ@
0 .0
qュcjjセc[pセ@
%0
o
ARRASTO OE PRAIAFil· 4 - Distribuição das ml!dias de CPUE/llte de pesea por classes de salinidade para cada um. das elpl!cies: A • X. bralmlnns; B '" B. plet/nlltll; C • G. bralllllnn,; D • G. IIprlon; F • A. II. ';tlltu,.
f
fT
セ@
N
セ@
lU ;:) Q.
U
A
N=48 N' =2117
20
llセ{ャ{ャ@
10
o
C
N' =1100 N=449
20
{ャセ」N@
10
o
セ@
E
N=87
4 N' Bセ 「T@
cJ[)LlcI
30 352
o
Toe
セ@ TARRAFA
" CAPTURA COM TARRAFA
B
N' CAPTURA COM ARRASTO DE PRAIAN=1151 N'=26
20
セj」ャ」i@
10
O
D
N=88 N'=871
20
10
cォョュセ@
セ@O
F
N":236 N' 14
4
cd{j{jセ@
20 25 30 352
O
T °C
o
ARRASTO DE PRAIAFig. 5 - Distribuição das médias de CPUE/arte de pesca por classes de エ・セー・イ。エオイ。@ para cada uma
das espécies: A = X. brasiliensú'; B
=
8, セ」エゥョ。エ。[@ C= G. brastlteflns; D = G. aprion;. E = G.genidens; F = A. IintlltuL
セ@
-Õ
セ@
to.)
lN
O
A
N=96
ZセZ@
-
⦅iセiiiiiiii@
C
N=239
3 . 0
セ@
::
セQQQセセitPQQQQQ@
E
N=75
ZセZ@
III IT0
JF M A M
セ@
IT0 IT0
J Jセ@
A S O N D
1III
MESES
B ·
N=200 -.u
ZセZ@ セ@
I
セ@
I
セ@
II1I
セ@
I
セ@
D
N=21
ZセZ@ セ@
II11
セ@
1_1_1-F
N=121
ZZ[iiiiセitPQQQQQQ@
d
JF M A M
J JA S O N D
MESES
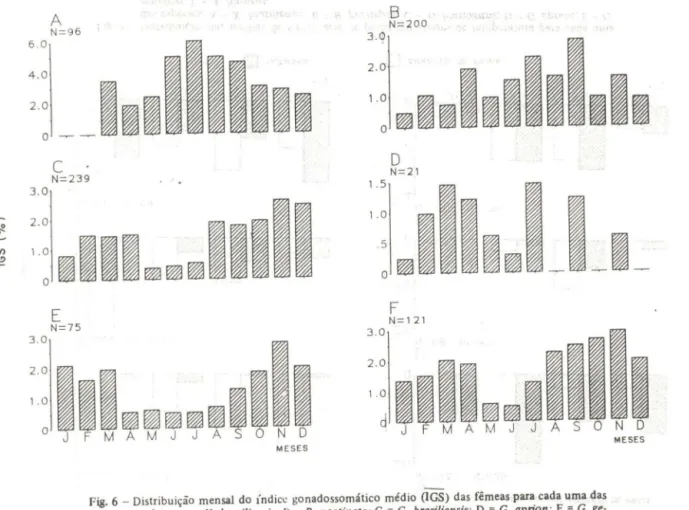
Fig. 6 - Distribuição mensal do índice gonadossomático médio (IGS) das fêmeas para cada uma das
espécies: A
=
X . brasiliensis; B=
B. pectinata; C=
G. brasiliensis; D=
G. aprion; E=
G. ge·nidens; F
=
A. lineatus. .セ@
S
セ@
c:r
セ@
セ@
セ@ o <I U z 'w
セ@
O
"-,
D:
N , CAPT URA COM TARRAFA
XENOMELANlRIS BRASILlENSIS N" CAPTURA COM ARRASTO DE PRAIA
JA N U RO N' =9
::1
ェAョセ
⦅@
FEVEREIRO N' ",
ZZi j セセセ@
M '\RLO N=b I-J c L 4
4°1
10O
⦅セ ッ@ ⦅セ qL@Bq セ「@
_ _ _{セ セ@
I
ABRIL N -=5 IJ' :96
4 0
1
':
ョセ セ{セセセ ャャuッ@
_____
___
11111
MAIO N =2 f,' 74
4°1
lO__
j{ャャ。
o{セ q BM
_____ {lnan __ __ _
JU NHO N = J N' - 12')
"I
-: ..
jセqqo@
______ . ___
.õl.
セ ョN@
-\) ::lO 1
セ@
jl..)JUL H O N=J N'=167
::1 ___
ullR.,Uo." __
JLJ
AGOSTO セj@ = . N' -C :> 2 O
4'1
20O
^サャャャセュョNB
⦅@
_ _
⦅NッエゥセqB⦅@
_
L __
_ _
L ______ _
SETEMl1R'o IJ 1 (1 セ@J I 3 セ@ '\
4°1
'0
O
j セ {BBqョ セ BM j@
.1111 _
OUTUBRO N I:'L
::1
,.Ii"" ..
LL. ::
4
'I
I "
.ióo---- - g) 'J
CP (mm )
t\JOVlMl1 )
Nセ セ@ セ@ セ u@
o.aL
UDEZf.MBP,)
I, 9
BuB l セ@
IJI
fi 11
" 61
1,'= 4 4
ャ⦅ Iw ャッョセセエゥB@
,
IオL セijjii@
ゥ セ M
-.
---c06·--·- -15 0 CP (mm )
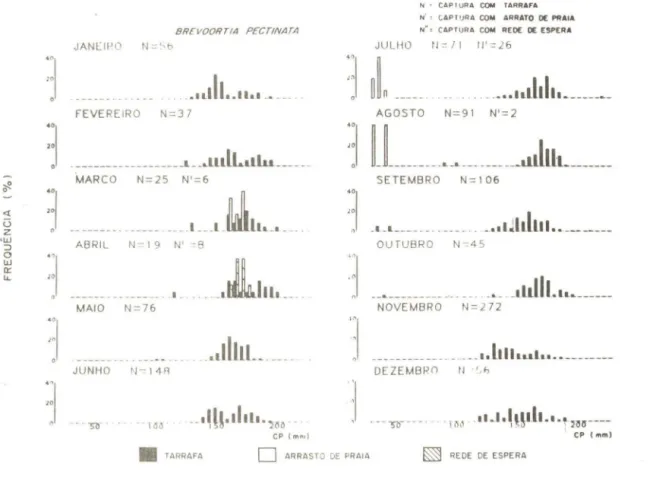
Fig. 7 - Dlstnbulção melhal de freqüênllJ por 」Q。Lウセウ@ 、セ@ CP para X. braslliensis_ N = número de indi
-vlduos capturados com (arrafa ; N' = número de Indlvlduos capturado s com arrasto de praia_
<! <i Ir 0-U) o 2 <J) <! a: Ir <!
D
<! U. <! a: a: <!..
•
セ@
-.)
.-.. w
' - '
\O \O
'01
'o o.01
'o Oセ@
o
.0
1
<1 'o
Ü
z o
'w :J
-..) C
"I
:.l w
-..) a:: t..
la
o ,° 1
,.
°"I
'o
oBREVOORTlA PECTlNATA
JANEIPO N
=
セQ「@FEVERE IRO
_
olL.h.o".'
__
0 __ N=37______________ ____ l __ lャャャlセャャャエャ@ ______
MARCO N=2 5 N' =6
- - - . ___
l ⦅ NlセィlMャ@
____ABRIL nセQY@ N' -8
_________________ I ______
lJ1..lll,
____
MAIO N=76
_______________ ______ .• Ihu .. _____
JUNHO N-:14f1
- - -51j- - - -1 ᅰセ ᄋ@
MM LセャセッャャGャLッセ
セMM
-CP (ml'lI)
40
1
'o
o
'ai
'oO
'ai
'oo
"'I
.0 o'"I
' n n :1• TARRAFA
D
ARRASTO DE PRAIAN • CAP 1 UR A COM TARRAFA
N' , CAPTIjRA COM ARRATO DE PRAIA
N" = CAPTUR A COM REDE OE ESPERA
JULHO ti ::: I I 11'-=26
セエ@
_____
____
_
ooollll.I.,. _______
AGOSTO N=91 N'=2
U
_________
L_L _________.dlluL _______
SETEMBRO N= 106
_L'-__ __ _ _ _ _ __ _ _ _ _ _0.1
Jhhllo
o _ __ _ _ ___OUrUBRO N--: 45
_________ _ _ _ _ _ _ _ _ _ _ 0- _ _
lllllI.tt. _______
NOVEMBRO N= 27 2
_________________ _
_
.. Lili
'-ui .. o . ___ ______DEZEMBRn ti -',1-,
- --
セM
-- - - - i 11<1 -ii N iNセ@
Ulh
01 °hlW-CP (""m'
セ@ REDE DE ESPE RA
Fig. 8 - Distribuição mensal de freqüên cia por classes de CP para B. pectinata. N = número de
indi-v{duos capturados com tarrafa ; N' = número de indivíduos cap tu rado s com arrasto de praia;
N セ@
=
número de indiv{duos capturados com rede de espera.ã
aoセ@
セ@
<t
t:l
,..,
Õ zw :::l
O
..,
Ir
"-CAPTURA COM TARRAFA
GEOPHAGUS BR/: 5/LlENS/S N'· CAPTUR A CO,"" ARRASTO DE PRAIA
JANE'I Rt") tI=IB 11 ' =13 JULHO N = 40 ',' =95
" 1
",
_[I1[L _OO_11011..11111
__
11 ___________ _"I
lO,
__ Nqセo@ ッNN ⦅セィセ イ£|LNNャエlB\iN。j セ N@__ _
• ___
セ@____ _
FEVERE11W N=21 N' =9 AGOSTO セQ MML T LI@ N' -= I 14
::1
"
___
l ⦅o ャャdセdd@ ⦅セ@
.11.. .. _
::1
Noセ{セqoNB@
. _"'o."' ..1I1Jl. •...
L •• _________ _MAR CO iセ]@ 1 O II ', 1 1 SETEMBRO 11 : 45 N' =52
'''1
__________
オセ セセャ@
" ,
O"I
lO
O
___ uoD.uOuiWlo ..
,"II!JJ",J •• _ . 1 ... - _. _ .• ..ABRIL N = ]2 N' セNL T@ OUTUBR O N セ TQ@ N'" 1 O
"I
"
_ _
Bセッ@
<lLo&ll_!WlO
1..
J I .. __,
_, A o_ h._
"1
",
______o{BiN⦅Nセ
iセ{@
II _O ••• __ . _, ___ _MAIO N = 52 N' 101 NOV[MBf.._) tI -+O QセGM]TW@
"I
i ',
_
ョセ{セiャ@
____
NNN、iQォiQNj
セ a@
• ___ •• _. ________ _"1
': Jl[OOlla,o.!Lno _o.J.Jlt. .... _____
L __ 0 __ _JUNHO N=21 iセ G@ =BO DE ZEMBRO tl-= l6 N' -= 106
::I
LjQ セセセo@
-uセjG@
- - ... JJ ...ゥGセG@
II ..
ᄋヲ セI@ • 200CP I mm}
::I
Ajセセオ@
LLQiセセLNNLN
セNiiセN「i@
.... -
I' \ • • • • -. lOoCP (mm)
II
TARRAFAo
ARRAS TO OE PRAIAFig. 9 - Distribuição mensal de freqüência por classes de CP para G_ brasiliensis. N
=
número deindi-vlduos capturados com tarrafa; N'
=
número de indivi'duos capturados com arrasto de praia.セ@
-..J
'Q
セ@
セ@ «
t;!
セ@
Ü
z
' w ::> o w a:
lL
---_. - ---_._- .".==-=".-=-,=====-=========
GERRES AP/?/ON
.I AIJlIRO II -I
:':1
, ) -. . -- - -
111_'--fEVERr:IR.1 rJ o l N' =4
::1
⦅セ@ セ@セ@
nL
MARCO N = 29 N' =27
::1
qセoセ セjャキN@
..
I . __ •ABRIL N = .! N' Rセ@
::1 ___
セ {{セ@
fi fi
J
_ Q • • • _ _ • _ _t ___
MAIO N=20 N' -: 174
"1
B セ o@
o __ O
セ@
n
セ@
u
セj オ@
11_ ... .
11111
JUlmn N--:7 U' 0.15
4°
1
Noセj セョ{セャ@
N
O SI, - . 1 íõ - T S"(i
I
",!JO -20 "CP (m m )
II
TARRAFAN : CAPl URA COM TAARAFA
CAPTURA COM ARRASTO セ@ PRAIA
JUllI.' ャj セイャ@ IJ c 7
"I
. '
,
.
⦅セセセッ ョ ji N ii ⦅N⦅@
..
agoセ@ rn N' H
::1
oセセセセ@
J
SETEMBRO n セ ij@ nG ]セs@
.) 1111
"I
o __ _ N ⦅ \ャN、セQ@. 1_1
OU r U UR O I, · ' I [,
::1 ___ . ____
00ョセセoo No@
. .NOVEMBRO ll eo J セj G]V@
:]
セ@ セ@ セ@ セ@
11 OI .11
DEZLM1W" I I
:] 1)0---
-f4IJ
セ@
b"
O
ARRA S TO lJ( PRAIA4 rJ'= 12
M ャ ゥゥ セ MM -'5"0 - - -MQセ\y M BGRPャj@
CP (Iftm)
Fig. 10 - Distribuição mensal de freqüência por classes de CP para A. aprion. N = número de
indiví-duos capturados com tarrafa ; N' = número de indivíduos capturados com arrasto de praia.
セ@
""
CT
ii!
!"
N
o
セi@
-<l
セ@ Ü z
-lU
V\ :J
O
lU
Q:
\L
GENIOENS GEN/OENS N : CAP TURA COM TARRAFA N' : CAPrURA COM ARRASTO DE PRAIA
J,\I It: IRO II ; ,IUI H,I N I. I.
Zセ i@
I
II
II ..
B セGi@
'0
II
セ@
1111 .. 1 1 .1 .
° n
FE '/EREIRO 11-=2
! "\
AGOS1O tJ., O N'= 4
"I
"I I
lOIII
セl@
I JIII
n °
M ARCO II J N' =5 SErt:MBPO 11-=5 I,' = J
"'I
,0
,°1セセ N@
ー ョョ セ ャ@
Oセ j@
OI
"
I
.
,ABRIL t J.: / II' I OU IllLJfi,', II j.
l-,°
1
. ___ t
I,
, °
1
'0
.1
'0
1.1.
.,
° "
M AIO fJ 9 ti' = 3 NO VU 11 li' O II c I ;> N' セ@ ,\
"\
"
___ ___
N セiセiiN@
L_o..
.0\
'0
.
duuu オij{ャj セ オij@
° °
fluiu ...
I. ..I
JU NH O N = 5 N'=20 DLLt:MBRO 1-1=12 N' = 7
.,',
ゥoセ@ オj iBョ セ セセ Q@
.0\
iセ iAセ@
,.
セ@ iセj@
rir . iOO セエ@ ., ': I,' セ セLャ@ IU H セ@
CP ( mm ) CP ( m m)
III
T A RRAFAO
ARRA<;lO OE PRA IAFia. 11 - Distribuição mensal de freqü ência por classes de CP para G. genidens. N
=
número de indi·viduos capturados com tarrafa ; N' = número de individuos capturados com arrasto de
praia .
<
e.
-.j
,-.
....
セ@
....
セ@
セ@
IV
W Q\
セ@
..
ü z
,"-' :>
O
"-'
'"
...
ACHIRUS UNEATUS
JANE IRO Nc- 7
セ@
. _______ I ______________ _
J
J
FEvEREIR O N -,6 n Gセj@
'" セ@
':
[[tLJIIL ._ .
MAR CO N= 13 N'=15
:] __
{ャjセセ」ャjャNML@
___ . ___ .
ABRIL N = 22 N' = 2::, __ . ___
ljjセNセ
MM
.. --.. -___ _
MAIO N = 36. N'= 11
,-
L
'°1
, ___
Ijイャooセj@
.. _____________ _
JUNHO N-= 18 N'
=
1 ,) '"':
sャッ{ャ セ{jエャ o@ セ LL {jj@
1_
lO)
_ .
i :'6 - --Miセo@CP f mm )
_ rllR RAF"A
N : CAPT'JR 4 COM TARRAFA N ': C APTURA COM ARRASTO OE セaia@
"J lIlO N =23 N' -' S
'°1
".
_ ..
セセセイiセ」ャj@
I . ___ .. _. __ .. ___ _
,·GOSTO N=2 0 N'=6
'"
"
__
{セ、ィャエ@
___ . __
o
セ etem br o@ N =23 N'=6
"I
"
. __ J ..
JJJt .. ___ .
OU TUBRO N=2 4 N' = 9
"I
" , . II [[lo ...
セjセイャャ@
__ __
o _ .
1< 0V EM BRO N= 2' N' = J
"I
セセ@
': ______ ...
jセセjNj@
.. ______ ._.
セ{ zembro@ N=15 N'=3
'"
':
セ@ MMMM セ jセエail
M
i1"6-o
ARRAS TO OE PRAIA•
---
.
_. - -iS'"·) CP (mm )
Fig. 12 - Distribuição mensal de ヲイ・アセョ」ゥ。@ por classes de CP para A . lineatus. N = número de
indi-vlduos capturados com tarrafa; N'
=
número de indivlduos capturados com arrasto depraia.
セ@
S
O>
O-セ@
セ@
t} W
-...I
;,!? o
<l U
Z ·W
=>
o w
a::
LI.
A
N=48
20
4°l
O 40 セGヲmqqGiGGGセセセ@ q GャVセセ Rッ@
C
N=449 20
10
E
N=87 20
10
GョセAjQnア@
ti 'ioH'.1.,!-o
CP (mm)
o
MARGEMB
N= 1151
15
10
5
O
oo NGoiセG@
o
N=88 30
20
10
O' セiイGャ@ '1'1''''''''''''11.'1 Q セNBNNBNB@ '!II." .. Q . . .
F
N=236 30
20
10
O' '..IL I I
!.',.,,., .' ....
I!' ,.,"q ..,
BNセ@CP (mm)
• CANAL
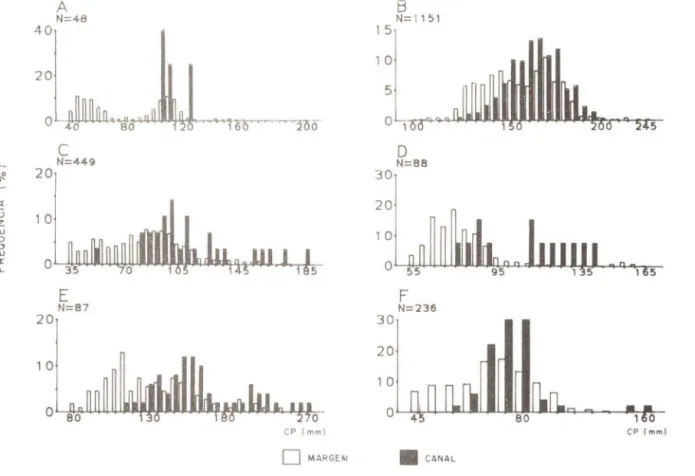
Fig. 13 - Distribuição de freqüência de CP por estratos de profundidade (margem ou canal) para
cada uma das espécies : A
=
X. brasiliensis; B=
B. pectinata; C=
G. brasiliensis; D=
G.aprion; E
=
G. genidens; F=
A. lineatus.セ@
-...I
-
WRevta bras. Zoo!.
o
peixe-rei, X brasiliensis, foi a espécie mais abundante nas regiões marginaisra-sas amostradas pelos arrastos de praia. Embora não tenha apresentado diferenças estatis-ticamente significativas nas abundâncias espacial e temporal, os maiores valores de CPUE ocorreram no período de abril até outubro (final do outono até a primavera) e em áreas mais internas da laguna (Figs. 2A e 3A). Os valores de abundância em função de salini-dade e temperatura também não apresentaram diferenças significativas, mas as médias de CPUE se concentram nas salinidades intermediárias e aumentam gradativamente em direção às temperaturas mais elevadas (Figs. 4A e 5A).
A distribuição mensal das médias do IGS indicou que a reprodução do peixe-rei na área se estendeu por um longo período (Fig. 6A), apresentando um pico no começo do outono (março), mas concentrando-se principalmente nos meses de inverno e início da primavera Gulho, agosto e setembro), quando a temperatura da água variou entre 200C
e 26°C. Valores máximos e mínimos similares foram observados por 8emvenuti (1984) durante os meses de outubro a dezembro para o período reprodutivo de X brasiliensis
no estuário da Lagoa dos Patos, RS. Isso indica que mesmo em latitudes tropicais, onde as variações sazonais sllo menos evidentes, o período reprodutivo desta espécie ainda é fortemente influenciado pela temperatura.
Em função da reprodução extensa, juvenis-do-ano menores que 50 mm CP foram capturados no estuário o ano todo (Fig. 7). Durante o primeiro semestre observou-se o crescimento dos indivíduos na laguna, mas a partir de julho, quando se inicia o período principal de recrutamento, não foi possível distinguir os diferentes grupos modais. O longo período reprodutivo e o recrutamento em levas sucessivas observado em diversas espécies de Atherinidae tem sido atribuído a desova seriada (Hubbs, 1976; Gonover &
Kynard, 1984; Middaugh & Hemmer, 1987). Prince & Potter (1983) afirmam que este padrão reprodutivo constituiria uma estratégia oe aumento da fecundidade altamente adaptativa para as espécies de Atherinidae, geralmente sujeitos a altas taxas de predação.
A savelha, B. pectinata, capturada quase que exclusiva!nente pelas amostragens com tarrafa, foi a espécie mais abundante nas zonas de canal. Não foram registradas dife-renças significativas na abundância temporal, mas os maiores valors de CPUE foram re-gistrados durante os meses de maio, junho, julho (inverno) e um pico isolado em novem-bro (final da primavera) (Fig. 28). A abundância espacial foi significativamente mais ele-vada (p < 0,05) nas áreas 1 e 2, mais próximas à desembocadura da laguna (Fig. 38). Em relação aos fatores ambientais, a espécie demonstrou significativa preferência por salinidades mais eíevadas (p < 0,05), mas distribuiu-se independentemente da tempera-tura (Figs. 48 e 58).
O período reprodutivo foi longo, concentrando-se principalmente do outono ao início da primavera (Fig. 68). A análise da distribuição de freqüência de comprimentos (Fig. 8) sugere que o período de recrutamento ocorre de julho a outubro, mas o baixo número de indivíduos menores que 50 mm CP capturados neste período indica que pro-vavelmente as artes de pesca utilizadas foram ineficientes na captura das classes de me-nor tamanho. Um grupo modal entre 120 e 200 mm CP foi consistente nas amostras du-rante o ano todo e parece constituir a classe etária principal que utiliza a laguna.
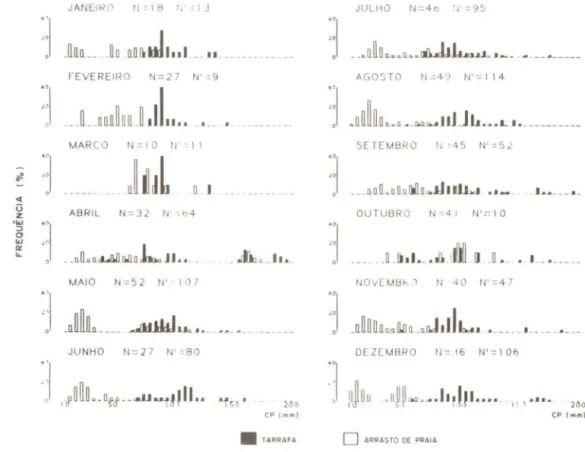
O acará, G. brasiliensis, foi bem representado tanto nas amostras com tarrafa
como nos arrastos de praia. A abundância temporal não apresentou diferenças significa-tivas (Fig. 2C), entretanto os indivíduos capturados com arrasto de praia (em geral < 50 mm CP) foram significativamente mais abundantes (p < 0,05) em áreas mais internas da laguna (Fig. 3C).
Yol. 7(3),1990
A abundância dos indivíduos capturados com tarrafa (em geral> 50 mm CP) não apresentou diferenças significativas em relação ao regime de salinidade e temperatura no estuário, mas os indivíduos capturados com arrastos de praia foram significativamen-te mais abundansignificativamen-tes em salinidades e significativamen-temperaturas mais baixas (Figs_ 4C eSC).
A variação do IGS médio (Fig. 6C) indicou que a reprodução é extensa e concen-trada em dois períodos principais, um de menor intensidade no outono e outro mais evidente e mais extenso do final do invemo até o início do verão. Através da distribui-ção mensal de freqüência de comprimento (Fig. 9), observa-se que o primeiro período reprodutivo é responsável pelos grupos de recrutamento de abril até julho, enquanto o segundo relaciona-se com os grupos de agosto até janeiro. Barbieri et al_ (1980) demons-traram que a desova de C. brasiliensis ocorre de forma parcelada e os ovos são liberados
em grupos ou lotes_ Este tipo de estratégia reprodutiva explica o recrutamento em ondas sucessivas e as oscilações observadas na abundância temporal dos juvenis capturados pelos arrastos de praia (Fig. 2C).
O carapicu, C. aprion, foi amostrado principalmente pelos arrastos de praia e
apre-sentou abundãncias significativamente mais elevadas (p < 0,05) durante os meses de março , maio e setembro (Fig. 20) e na área 2 (Fig. 30). A preferência.do carapicu por esta área da laguna parece estar relacionada com a distribuição de recursos alimentares explorados por esta espécie . A área 2 apresenta bancos de areia e zonas de baixio onde grupos de C. aprion e outros gerreídeos eram comumente observados alimentando-se de
organismos do bentos.
Cerres aprion ocorreu somente em salinidades superores a 100 /00, apresentando
um pico na classe de 200/00 (Fig. 40). Não foram observadas diferenças significativas da abundância em função de temperatura (Fig. 50), mas as capturas foram maiores na classe de 30°e. Segundo Leon et aI. (1982), esta espécie suporta amplas variações de salinidade e temperatura. Cyrus & 8laber ( 1982), estudando a distribuição e abundância da famllia Gerreidae em estuários da África do Sul, encontraram que a salinidade cons-titui o fator principal determinando a dominância de cada uma das espécies em diferen-tes estuários, porém sugerem a importância da turbidez da água como um fator limitante na distribuição e abundância. Em trabalhos mais recentes (Cyrus & Blaber, 1987a,b), estes autores classificam a famma Gerreidae como característica de águas claras e con-cluem que a turbidez desempenha um papel importante , isoladamente ou em combina-ção com outras variáveis, na determin acombina-ção da distribuicombina-ção e abundância das espécies. A distribuição de recursos alimentare s, apesar de importante. desempenharia um papel se-cundário ao da turbid·ez na distribuição dos ge rreídeos, já que todas as espécies da famí-lia oco rreram somente em águas claras. enquanto as maiores densidades das presas explo-radas pelas espécies foram encontexplo-radas em águas túrbid as.
A distribuição do lGS médio (Fig. 6D) indicou que a reprodução de C. aprion na
região é longa e concentrada em dois períodos, um no final do verão e outro do inverno até o início da primavera. O recrutamento também ocorreu de forma parcelada (Fig. 10). Jovens-do-ano menores que 50 mm CP aparecem nas amostras com arrasto de praia a partir de fevereiro, tornando-se mais abundantes em março É possível acompanhar a progressão deste grupo até julho, quando a moda principal atmge os 80 mm CP. Outros grupos mais fracos de recrutamento ocorreram durante os meses de agosto e novembro.
Revta bras. Zoo!. que, em ge!al, grupos de larvas penetram no estuário com 10 mm de comprimento-pa-drão, permanecendo na área até a maturidade sexual, quando retornam para reproduzir no ambiente marinho.
O bagre-urutu, G. genidens, apresentou para as capturas com arrastos de praia valores de CPUE significativamente mais elevados (p < 0,05) nos meses de junho e no-vembro (Fig. 2E) e na área I (Fig. 3E). As amostras com tarrafa não apresentaram dife-renças significativas de abundância.
A distribuição em função de salinidade e temperatura não apresentou diferenças significativas, mas as maiores abundâncias ocorreram, tanto para tarrafa como para os arrastos de praia, na classe oe 200/00 (Fig. 4E) e em temperaturas mais elevadas (Fig.
SE). Mishima & Tanji (1983) e Araujo (no prelo), estudando a distribuição e abundância de G. genidens, respectivamente nos estuários de Cananéia, SP, e Lagoa dos Patos, RS, encontraram que a espécie se distribui preferencialmente em áreas internas do estuário, tem maiores abundâncias nos meses de verão, mas também não identificaram nenhuma relação de dependência entre as flutuações na abundância da espécie e as variações de sa-linidade e temperatura.
A biologia reprodutiva do bagre-urutu na região do complexo lagunar de Jacapaguá está sendo estudada em detalhe por Santos et alo (em preparação). O período re-produtivo se extende do começo da primavera ao fim do verão, coincidindo com o pe· ríodo de chuvas responsável pelas baixas salinidades na região. Embora a reprodução ocorra no ambiente estuarino e se extenda por um amplo período, em função do hábito de incubação oral dos ovos e larvas, indivíduos menores que 70 mm CP não foram capturados na laguna e o primeiro grupo de recrutas foi capturado pelos arrastos de praia somente a partir do mês de março (Fig. 11). De abril até outubro, a classe de ta-manhos predominante foi composta por indivíduos com comprimentos entre 100 e 200 mm CP e somente a partir de novembro um novo grupo de jovens-do·ano voltou a ser capturado na laguna.
O linguado-tapa, A lineatus, demonstrou grande adaptabilidade ao ambiente es-tuarino, distribuindo-se de forma bastante uniforme tanto em relação às abundâncias espacial e temporal (Figs. 2F e 3F), como em relação aos fatores ambientais (Figs. 4F e 5F), não apresantando diferenças significativas de abundância em relação a nenhum des. tes fatores.
A reprodução ocorreu durante um longo período, com um pequeno pico no outo-no e um período mais extenso na primavera (Fig. 6F). O recrutamento também foi par-celado, distribuindo-se pelos meses de fevereiro, junho e outubro (Fig. 12). Durante to-dos os meses do ano uma classe de comprimentos entre 50 e 100 mm CP constituiu a classe de tamanhos predominante na laguna e a captura de indivíduos maiores que 100 mm CP ocorreu apenas nos meses de setembro e outubro, possivelmente em função do pico do período reprodutivo.
A figura 13 apresenta a distribuição de freqüência por classes de comprimento
to-tal das seis espécies em função de estratos de profundidade (regiões de margem ou canal) para as amostras com tarrafa. É' possível observar que apesar de indivíduos de quase todas as classes de tamanho terem sido capturados nas regiões marginais, as menores classes de comprimento estiveram em geral ausentes das zonas do canal. Esta tendência a uma distribuição diferencial das classes de tamanho em relação aos estratos de profun· didade já havia sido observada para o conjunto total de espécies capturadas na Laguna de Marapendi (Andreata et al., no prelo) e, apesar de nenhum experimento específico
Vol. 7(3),1990
ter sido realizado neste sentido, observações no local sugerem uma relação com a distri-buição da vegetação aquática submersa. Estudos comparando áreas com e sem cobertura vegetal em regiões estuarinas tem demonstrado a importância das pradarias de vegetação submersa para juvenis de peixes (Livingston, 1975; Weinstein et al., 1977; Orth & Heck, 1980), influenciando principalmente a distribuição das classes de tamanho (Stoner, 1984; Stoner & Livingston', 1984). Na laguna de Marapendi, as regiões marginais rasas, geralmente apresentando pradarias de Ruppio maritima e bancos de macroalgas, ofere-cem abrigo para espécies de pequeno porte e para os juvenis-do-ano das espécies que uti-lizam a laguna como área de recrutamento. Para espécies como B. pectinata, cujos juve-nis foram pouco abundantes ou restritos a períodos específicos, a distribuição batimé-trica das classes de tamanho não foi tão evidente (Fig. 138).
Weinstein (1982) destaca três dimensões de nichos particularmente importantes nos mecanismos de repartição entre juvenis de espécies estuarinas: batimetria, salinidade e componentes temporais. Para a Laguna.de Marapendi, uma laguna costeira localizada na regmo tropical, caracterizada durante o período estudado por apresentar pequenas va-riações de salfnidade, sazonalidade pouco evidente e cujo grupo de espécies dominantes foi rotrnado basicamente por espécies residentes do estuário (Andreata et aI., no prelo), a distribuição espacial, relacionada secundariamente com a profundidade (regiões 'de margem ou canal) e a presença de vegetação aquática submersa, parecem ser os fatores principais regulando a distribuição das espécies. A influência da salinidade foi mais evi-dente apenas para espécies como B. pectinata e G. aprion, que se reproduzem no am-biente marinho e permanecem i"elacionadas ao estuário apenas durante uma etapa do ciclo de vida, ou para G. brasiliensis, que por constituir uma espécie primária de água
do-ce, demonstrou preferir baixas salinidades durante os estágiosjuvenis.
A pequena importância de componentes temporais e da temperatura foi devida provavelmenté à sazonalidade pouco evidente na região e ao fato de todas as espécies te, rem apresentado um amplo período reprodutivo e o recrutamento distribuído ao longo do ano. Hines et aI. (1987) destaca que o recrutamento de estágios larvais mais sensíveis de várias espécies de"invertebrados e peixes pode ser o fator principal na determinação de flutuações na abundância relacionadas com variações de parâmetros ambientais. Por-tanto, em situações em que o recrutamento se distribui por um longo período, flutua-ções sazonais nos fatores ambientais teriam pouca importância na sobrevivência e abun-dância das diferentes coortes.
Os resultados de campo e laboratório encontrados por Cyrus & B1aber (1987a, b) sobre o papel da turbidez na distribuição e abundância de juvenis de peixes marinhos em estuários da África do Sul indicam que esta variável pode constituir um fator ecológico importante em outros ambientes estuarinos tropicais, principalmente onde a descarga fluvial de sedimentos é significativa. Embora dados de turbidez da água não sejam dispo-níveis para a Laguna de Marapendi, a ausência de um aporte massivo de águas fluviais セ。@ laguna sugere um papel secundário para este fator. Entretanto, turbidez provavelmente desempenha um papel importante em outras lagunas do sistema lagunar de J acarepaguá.
Embora algumas das hipóteses apresentadas neste trabalho tenham que ser avalia-das cautelosamente em função de limitações evidentes relacionaavalia-das com as artes de pes-ca utilizadas, foi possível identifipes-car que a Laguna de Marapendi constitui uma região importante no ciclo de vida de várias espécies de peixes, principalmente as residentes do estuário. A distribuição e abundância das espécies principais na laguna durante o perío-do estudaperío-do foi influenciada ーイゥョ」ゥー。ャュ・セエ・@ por fatores relacionados com a distribuição
Revta bras. Zoo!.
espacial, como área de coleta, zonas de margem ou canal e a presença de vegetação aquá-tica submersa. Entretanto, como foi destacado em trabalho anterior (Andreata et aI., no prelo), coni a abertura do Canal Marapendi em 1984, e conseqüente alteração das con-dições ambientais na laguna, o padrão de distribuição e abundância das espécies foi sen-sivelmente alterado. O impacto destas alterações na comunidade ictiofaunística da La2u-na de Marapendi precisa ainda ser determiLa2u-nado.
agradecimentoセ@
Gostaríamos de agradeeer a todos que contribuíram para a realização deste traba-lho. Ao Professor Ivo C. de Lima (USU) pelas determinações de salinidade e oxigênio dissolvido. A João P. Vieira (FURG) e Cassiano M. Neto (VIMS) pelas críticas e suges-tões apresentadas. Ning L. Chao (FURG) prestou valiosas sugestões durante o desenvol-vimento deste estudo e na preparação do manuscrito.
REFERÊNCIAS
ANDREATA, J.V., LR.R. BARBIERI, A.S.C SEBILlA, M.H.C DA SILVA & R.P. DOS SANTOS, (no prelo). Relação dos peixes da Laguna de Marapendi, Rio de Janeiro, Brasil . Atlântica, Rio Grande.
ARAUJO, F.G. (no prelo). Distribuição, abundância e movimentos sazonais de bagres marinhos (Si-luriformes, Ariidae) no estuário da Lagoa dos Patos (RS), Brasil . Rev. Bras. Zoo!.
BARBIERI, G., M.C BARBIERI & M.A. MARINS, 1980. Biologia de Ceophagus brasi/iensis (Quoy & Gaimard, 1824) na Represa do Lobo , Estado de São Paulo. 1II: aspectos quantitativos da reprodução. I. Simpósio Brasileiro de Aquicultura. Academia Brasileira de Ciências, Rio de Janeiro, p. 347-359.
OEMVENUTl, セiNaNL@ 1984. Abundância, distribuição, reprodução e hábitos alimentares de peixes·rel (Atherinidae) na região estuarial da Lagoa dos Patos, RS, Brasil. Tese de Mestrado, Fundação Universidade do Rio Grande, 93 p.
CHAO, LN., LE. PEREIRA & J.P. VIEIRA, 1987. bゥッセ」ッャッァケ@ of fishes in the estuary and adjacent coastal areas ofThe Patos Lagoon, Brazil:a baseline study. Chapter 20, 26 p. ln: Fish Commu-nity ecology in the estuaries and coutai lagoons - Towards an ecosystem integratin. A. Yanez-Arancibia (Ed.). UNAM, D.F., México, 429-450 p.
CHAO, L.N., J.P. VIEIRA & L.R.R. BARBIERI (no prelo). Lagoa dos Patos as a nursery ground for shore fishes off southern Brazi!. 7 p. ln: IOC/UNESCO Proceedings oI IREP/OSLR workshop on reeruitment in tropical coas tal demersal communities, México.
CONOVER, D.O. & B.E. KYNARD, 1984. Experimental and field analysis of spawning periodicity and behavior of a northern population of the Atlantie silverside, Menidia menidia (Pisces:
Atherinidac). Environ. Biol. Fishes, 11: 161-171.
CYRUS, D.P. & S.J.M. BLABER, 1982. Species identification, distribution and abundance of Ger-reidae (Teleostei) Bleeker, 1859 in the estuaries of Natal. S. Afr. J. Zool., 17:105-116. - , 1983. Diet of Cerres fry in the Kosi system. S. Afr. J. Zool., 18(4 ):403406.
- , 1984. The reproductive biology of Ce"es in Natal estuaries. J. Fish Biol., 24 :491-504. - , 1987a. The influence of turbidity on juvenile marine fishes in estuaries. Part I - Field studies
at Lake St. Lucia on the Southeastem coast of Afriea. J. Exp. Mar. Biol. Ecol., 109:53-70. - , 1987b. The influence of turbidity on juvenile marine fishes in estuaries. Part II - Laboratory
studies, comparisons with field data and eondusions. J. Exp. Mar. Bio!. Ecol., 109:71-91. HINES, A.H., P.J. HADDON, J.J. MIKLAS, L.A. WIECHERT & A.M. HADDON, 1987. Estuarine
mvertebrates and fish: sampling design and constraints for long-term measurements of popu-lation dynamics. pp. 140-164 ln: New approaehes to monitoring aquatie eeosystems, ASTM. STP 940. T-P. Boyle (Ed.). American Society of Testing Materiais, Philadelphia.
HUBBS, C, 1976. The diel reproductive pattem and fecundity of Menidia menidia. Copeia, 1976: 386-388.
LENANTON, R.CJ. & I.C POTTER. 1987. Contribution of estuaries to commercial fisheries in temperale Westem Australia and the concept of estuarine dependence. Esruaries. 10 (l):
28-35 .
Vol. 7(3),1990
LEON, A.A., A. Y ANEZ-ARANCIBIA & F.A. LINARES, 1982. Taxonomia, diversidad, distribui-cion y abundancia de las mojarras de la Laguna de Terminos, Campeche (Pisces, Gerreidae).
An. Inst. Cienc. dei Mar y Limnol. Univ. Auton. Mexico, 9(1 ):213- 250.
LIVINGSTON, R.l., 1975. Impact of kraft pulp-milk efluents on estuarine and coastal fishes in Apa-lachee Bay, Florida, USA. Mar. Bio!. (Ber!.), 32:19-48.
MIDDAUGH, D.P. & M.l . HEMMER, 1987. Repraductive ecology of the tidewater silverside Meni· dÍIJ peninsulae (Pisces: Atherinidae) fram Santa Rosa Island, Florida. Copeia, 1987 (3):727-732.
MILLER, J.M. & M.L OUNN, 1980. Feeding strategies and patterns of movement injuvenile estua-rine fishes. p. 437-448, ln: Estuaestua-rine perspectives, V.S . Kennedy (Ed.), Academic Press, New York.
MISHIMA, M. & S. TANJI, 1983. Fatores abióticos relacionados a distribuição e ablUldância de ba-gres marinhos (Osteichthyes, Ariidae) no complexo estuarino laglUlar de Cananeia (250 S,
480 W). B. Inst. Pesca, 10 (único): 17-27.
ORTH, R.J. & K. L HECK, lr., 1980. Structural components of eelgrass (Zostera marina) meadows in the lower O1esapeake Bay - Fishes. Estuaries, 3 :278-288.
PRINCE, 1.0. & I.c. POTTER, 1983. Life-cycle duration, growth and spawning times of five species of Atherinidae (Teleostei) fOlDld in a Western Australia estuary. Aust. J. Mar. Freshw. Res., 34:278-301.
SOKAL, R.R. & F.J . ROHLF, 1981. Biometry - the principies and practice of statistics in biological research. W.H. Freeman and CO., San Francisco, (2nd. edition), 776 p.
SPSS, Inc., 1985. SPSSx User'sGuide, 2nd edn. McGraw-HiU, New York.
STONER, A.W., 1984. Oistribution of fishes in seagrass meadows: role of macrophyte biomass and species composition. Fisl\. BuU. US, 81(4):837-846.
STONER, A.W. & R.l. LIVINGSTON, 1984. Ontogenetic patterns in the diet and feeding morpho-logy in sympatric sparid fishes fram seagrass meadows. Capeia, 1984: 174-187.
VAZZOLER, A.E.A. de M., 1981. Manual de métodos para estudos biológicos de populações de pei· xes; reprodução e crescimento. CNPq, Programa Nacional de Zoologia, BrasI1ia, 108 p. WEINSTEIN, M.P., 1982. Commentary: a need for more experimental work in estuarine fisheries
ecology. North. Gulf Sci., 5(2):59-64.
WEINSTEIN, M.P., C.M. COURTNEY & 1.C. KINCH, 1977. The Marco Island estuary: a summary of physicoche mical and biological parameters. Fia. Sci., 4 0:97 -124.