Reus Tiago Rigo
Síntese e caracterização de membranas zeolíticas tipo MFI e aplicação
em separação de aromáticos
__________________________
Dissertação de Mestrado
Natal/RN, julho de 2013
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
Reus Tiago Rigo
SÍNTESE E CARACTERIZAÇÃO DE MEMBRANAS ZEOLÍTICAS TIPO MFI E APLICAÇÃO EM SEPARAÇÃO DE AROMÁTICOS
NATAL, RN 2013
Dissertação apresentada ao Programa de Pós – Graduação em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mestre em Química.
Rigo, Reus Tiago.
Síntese e caracterização de membranas zeolíticas tipo MFI e aplicação em separação de aromáticos. / Reus Tiago Rigo. – Natal, RN, 2013. 127 f. : il.
Orientadora: Profª. Dra. Sibele B. C. Pergher.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Instituto de Química. Programa de Pós-Graduação em Química.
1. Zeólitas Dissertação. 2. Silicalita Dissertação. 3. Permeação -Química - Dissertação. 4. Cristais – Dissertação. 5. Filme zeolítico – Dissertação. 6. Membrana – Dissertação. I. Pergher, Sibele B. C. II. Universidade Federal do Rio Grande do Norte. III. Título.
Quero agradecer de forma especial toda minha família pelo apoio e suporte, tanto emocional como financeiro, por acreditarem que tenho potencial.
A Dra. Sibele por ter acreditado e dado o maior incentivo para a realização do mestrado.
Ao Dr. Miguel por ceder o espaço do laboratório G-BIS que situa-se na UAM – Azcapotzalco na cidade do México, onde pude realizar meus experimentos bem como caracterizações e também por esclarecimentos sobre os procedimentos a serem adotados na realização deste estudo.
A Dra. Mirella pela ajuda nos experimentos bem como discussão de resultados.
Ao pessoal do LABPEMOL pela amizade e apoio. Aos amigos que fiz no México, de alguma forma também colaboraram com esse trabalho.
Ao PPGQ da UFRN. À CAPES pela bolsa.
Quero agradecer a todos que contribuíram diretamente ou indiretamente na realização dessa dissertação, sem citar nomes para ninguém se sentir esquecido.
"Nós não temos a chance de fazer muitas coisas, e cada uma deve ser realmente excelente. Porque esta é a nossa vida. A vida é breve, e então você morre, sabe? E todos nós escolhemos o que fazer com as nossas vidas. Então é melhor que seja muito bom.
A síntese de membranas zeolíticas do tipo MFI foi realizada pelo processo de cristalização in situ ou hidrotérmica. Foi estudado o tempo de homogeneização do gel em temperatura ambiente e filtração do mesmo antes da etapa de cristalização efetuada em estufa, obtendo-se um filme zeolítico uniforme. O pó da zeólita sintetizada (estrutura tipo MFI, Silicalita) foi caracterizado por diversas técnicas complementares, como: difração de raios X (DRX), microscopia eletrônica de varredura (MEV), análise térmica, dessorção a temperatura programada (TPD), infravermelho por transformada de Fourier (FTIR) e análise textural por adsorção de nitrogênio (área específica). Com a finalidade de avaliar a qualidade da camada suportada sobre o suporte cerâmico, testes de permeação com N2
foram efetuados partindo da temperatura ambiente até 600 °C, onde foram observados valores mais adequados de permeação a partir dos 200 °C. Com os dados obtidos confeccionou-se um gráfico em função da temperatura versus a permeação, a curva encontrada foi de difusão superficial. Por microscopia eletrônica de varredura, observou-se a formação de cristais homogêneos e que o filme zeolítico não apreobservou-sentava fissuras ou rachaduras, indicando que o processo de síntese e tratamentos posteriores não danificaram a camada de zeólita sobre o suporte. Realizando estudos de permeação foram verificados valores que variam entre 3,64x10-6 a 3,78x10-6 e 4,71x10-6 a 5,02x10-6, para pressões de
20 e 25 psi, respectivamente. Para a mistura xilenos/N2 os valores foram de 5,39x10-6 a
5,67x10-6 e 8,13x10-6 a 8,36x10-6, também para pressões de 20 e 25 psi. Os valores
encontrados para o fator de separação foram de 15,22 em 400 °C no primeiro experimento e 1, 64 para o segundo experimento em uma temperatura de 150 °C. Conclui-se que a membrana Silicalita foi sintetizada com sucesso e que a mesma é efetiva na separação de misturas binárias de xilenos.
Reus Tiago Rigo
ABSTRACT
The synthesis of MFI-type zeolite membranes was carried by the process in situ or hydrothermal crystallization. We studied the homogenization time of the room temperature and gel filtration just before the crystallization step performed out in an oven, thus obtaining a more uniform zeolite film. The powder synthesized zeolite (structure type MFI, Silicalite) was characterized by several complementary techniques such as X-ray diffraction (XRD), scanning electron microscopy (SEM), thermal analysis, temperature programmed desorption (TPD), Fourier Transform infrared spectroscopy (FTIR) and textural analysis by nitrogen adsorption (specific surface area). For the purpose of evaluating the quality of the layer supported on the ceramic support, N2
permeation tests were carried starting from room temperature to 600 °C, where values were observed values more appropriate permeation from 200 °C. With the data obtained, it was made into a graph of temperature versus permeation function, the curve of surface diffusion was found. For scanning electron microscopy, we observed the formation of homogeneous crystals and the zeolite film showed no fissures or cracks, indicating that the process of synthesis and subsequent treatments not damaged the zeolite layer on the support. Carried permeation studies were found values ranging from 3.64x10-6 to
3.78x10-6, 4.71x10-6 to 5.02x10-6, to pressures 20 and 25 psi, respectively. And the
mixture xylenes/N2 values were between 5.39x10-6 to 5.67x10-6 and 8.13x10-6 to
8.36x10-6, also for pressures of 20 and 25 psi. The values found for the separation factor
were 15.22 at 400 °C in the first experiment and 1.64 for the second experiment at a temperature of 150 °C. It is concluded that the Silicalite membrane was successfully synthesized and that it is effective in the separation of binary mixtures of xylenes.
LISTA DE FIGURAS
Figura 3.1: Unidades secundárias de construção, (SBU). (PACE; RENDÓN; FUENTES, 2000). ... 21 Figura 3.2: Representação de um cristal único de MFI, mostrando seu cristal típico e estrutura de poros. (CARO et al, 1993). ... 22 Figura 3.3: Etapas do processo de cristalização hidrotérmica. Adaptada de MABANDE, (2005). ... 23 Figura 3.4: Estrutura da zeólita Silicalita. (fonte: iza-online.org). ... 25 Figura 3.5: Membranas internas e externas decorrentes de diferentes tamanhos de sementes. Adaptada da referência YAMPOLSKII et al, (2006). ... 27 Figura 3.6: Visão global das diferentes estratégias de cristalização para a preparação de membranas zeolíticas suportadas. Adaptada de CARO et al, (2000). ... 29 Figura 3.7: Membrana de separação de gás com um gradiente de concentração constante transversal da membrana L. Adaptada da referência YAMPOLSKII, FREEMAN, (2010).
... 38 Figura 3.8: Mecanismos de transporte. Adaptada da referência YAMPOLSKII, FREEMAN, (2010). ... 40 Figura 3.9: Comparação entre o tamanho de poros efetivos de diferentes zeólitas e o diâmetro cinético das moléculas dos gases. Adaptado da referência ERNST et al, (2009).
... 47 Figura 3.10: Permeação dos componentes únicos através de uma membrana de Silicalita com largura de poro de 0,55 nm como uma função do tamanho molecular das moléculas
provas à 105 °C em ∆p = 1 bar. (CARO et al, 2000; NOACK et al, 2000) (DMB, MTBE), adaptada da referência ERNST et al, (2009). ...48 Figura 3.11: Fluxos de permeação de misturas binárias (50%/50%) do n-heptano e vários compostos aromáticos de diferentes volumes e o fator de separação correspondente (n-heptano/compostos aromáticos) em uma membrana modelo com cristais únicos de AlPO4 -5. Adaptada da referência ERNST et al, (2009). ... 50
Figura 3.12: Simulação do comportamento da permeação de uma mistura
metano/propano de 95%/5%, através de uma membrana Silicalita suportada à 30 °C de acordo com o modelo GMS completo. Adaptada da referência ERNST et al, (2009). .. 52 Figura 3.13: O fator de separação α da mistura para H2/i-butano (composição de
Reus Tiago Rigo
Figura 3.16: Dependência da distribuição molar do equilíbrio dos isômeros de xileno com a temperatura. Adaptada das referências (CHIRICO; STEELE, 1997; MABANDE,
2005). ... 62
Figura 3.17: Representação esquemática da posição do o-xileno e p-xileno na estrutura da Silicalita em condições de carga elevada. Adaptada da referência OYAMA; STAGG-WILLIAMS, (2011). ... 66
Figura 3.18: Representação esquemática da posição do p-xileno e o-xileno na estrutura MFI, em condições de carga alta e baixa. Adaptada da referência OYAMA; STAGG-WILLIAMS, (2011). ... 68
Figura 4.1: Esquema da carcaça do reator de membrana para efetuar experimentos de permeação e separação. (Figura adaptada da referência MEDINA, 2012). ... 71
Figura 4.2: Esquema do módulo de membrana para realizar os testes de verificação de fissuras ou defeitos na membrana. (Figura adaptada da referência MEDINA, 2012)... 72
Figura 4.3: Fotografia da montagem do reator de membrana, onde realizou-se os testes de permeação, afim de verificar fissuras ou defeitos... 72
Figura 4.4: Membrana tubular (4.4 a). Vista do corte transversal do suporte tubular empregado, mostrando suas diferentes camadas (4.4 b). (Figura adaptada das referências FUENTES, 2013, MEDINA, 2012). ... 73
Figura 4.5: Digrama da Lei de Bragg, interferência construtiva (esquerda) ou destrutiva (direita). ... 75
Figura 5.1: Difração de raios X das amostras sintetizadas: (a) MFI com agente direcionador de estrutura e (b) MFI calcinada... 81
Figura 5.2: Espectro de radiação infravermelho por transformada de Fourier do pó de Silicalita. ... 82
Figura 5.3: Microscopia eletrônica de varredura das amostras sintetizadas. (a) sílica Ludox HS 40% e (b) sílica aerosil. ... 83
Figura 5.4: Curvas TGA da zeólita Silicalita. ... 84
Figura 5.5: TPD de NH3 para a zeólita Silicalita calcinada. ... 84
Figura 5.6: Isoterma de adsorção/dessorção da zeólita Silicalita. ... 85
Figura 5.7: DRX pó de Silicalita e membrana sintetizada. ... 86
Figura 5.8: MEV da superfície da membrana de Silicalita (M1). ... 87
Figura 5.9: MEV da seção transversal da membrana (M1)... 87
Figura 5.10: DRX da membrana sintetizada com quatro camadas (M2). ... 88
Figura 5.11: MEV corte transversal (a) e dos cristais na superfície do suporte (b) (M2). ... 88
Figura 5.12: Teste de permeação em diferentes temperaturas de 22 – 600 °C (suporte com duas camadas de zeólita (membrana 2), utilizou-se sílica HS 40%). ... 89
Figura 5.13: Teste de permeação em diferentes temperaturas de 200 °C – 600 °C (suporte com quatro camadas de zeólita (membrana 2), empregou-se sílica aerosil degusa 200). ... 90
Figura 5.15: Estudos de permeação de N2 em diferentes temperaturas e pressões. ... 92
Figura 5.16: Configuração principal de uma célula Wicke-Kallenbach. ... 93
Figura 5.17: Estudos de permeação da mistura xilenos/N2. ... 94
Figura 5.18: Mecanismo de separação de gases em membranas zeolíticas. (Figura adaptada da referência FUENTES, 2013). ... 95
Figura 5.19: Fator de separação da mistura xilenos/N2 em função da temperatura. .... 95
Figura 5.20: Tempos de retenção das amostras padrão de xilenos. ... 97
Figura 5.21: Tempos de retenção da mistura de xilenos. ... 98
Figura 5.22: Teste de separação da mistura de xilenos. ... 98
Figura 5.23: Configuração (1) do reator... 99
Figura 5.24: Configuração (2) do reator... 100
Figura 5.25: Fator de separação versus temperatura. ... 100
Figura 5.26: Teste de separação realizado a 150 °C. ... 101
Reus Tiago Rigo
LISTA DE TABELAS
LISTA DE SIGLAS
AFI Fosfato de alumínio orientado 5 (AlPO4-5)
Al-ZSM-5 Zeolite Socony Mobil – estrutura tipo MFI com alumínio em sua estrutura
ANA Nomenclatura IZA para a zeólita Analcime
BEA Nomenclatura IZA para a zeólita Beta
BTX Benzeno, Tolueno e Isômeros de xileno
CHA Nomenclatura IZA para a zeólita Chabazita
CMS Peneiras moleculares de carbono
DD3R Decadodecasils 3R
DDR Deca – Dodecasil 3R
DMB 2,2-dimetil butano
DSC Calorimetria Diferencial da Varredura
FAU Estrutura faujasita. As zeólitas X e Y apresentam está estrutura
FER Nomenclatura IZA para a zeólita ZSM-35 (Ferrierita)
FTIR Espectroscopia de Infravermelho com Transformada de Fourier
HDA Hidrodealquilação
IR Infravermelho
IUPAC International Union of Pure and Applied Chemistry (União Internacional de Química Pura e Aplicada)
LTA Nomenclatura IZA para a zeólita A
MEL
MeOH
MFI
Mobil Eleven – denominação topológica da IZA para a zeólita ZSM-11 Metanol
Mobil Five – denominação topológica da IZA para a estrutura zeolítica
Silicalita
Nomenclatura IZA para a zeólita Mordenita Metil-tert-butil éter
MOR
MTBE
Reus Tiago Rigo
MX meta-xileno
OFF Nomenclatura IZA para a zeólita Ofretita
OX orto-xileno
PET Tereftalato de polietileno
PX para-xileno
RMN Ressonância Magnética Nuclear
RMZ Reatores de membranas zeolíticas
SAPO-34 Estrutura Chabazita
SBU Unidades secundárias de construção
SDA Agente direcionador de estrutura
TGA Análise Térmica Gravimétrica
TPAOH Hidróxido de Tetrapropilamônio
TPD Dessorção com temperatura programada
ZSM Zeolite Socony Mobil – dentre as quais se encontram as zeólitas ZSM-5, ZSM-11 e ZSM-48
SUMÁRIO
1 – INTRODUÇÃO ... 15
2 – OBJETIVOS ... 18
2.1-OBJETIVOSESPECÍFICOS ... 18
3 - FUNDAMENTOS E ESTADO DA ARTE ... 19
3.1 – ZEÓLITAS ... 19
3.2-CRISTALIZAÇÃODEZEÓLITAS ... 21
3.3 - TRATAMENTOS PÓS – SÍNTESE ... 23
3.4 - ZEÓLITA TIPO MFI ... 24
3.5-MEMBRANAS ... 25
3.5.1 - MEMBRANAS ZEOLÍTICAS ... 25
3.5.2 - EFEITO DO SUPORTE ... 26
3.5.3-TÉCNICASDESÍNTESEPARAAPREPARAÇÃODEMEMBRANAS ... 28
3.5.3.1 - CRISTALIZAÇÃO ASSISTIDA COM SEMENTES PARA PREPARAÇÃO DE MEMBRANAS ZEOLÍTICAS DE CAMADA ÚNICA ... 29
3.5.3.2 - MEMBRANAS ZEOLÍTICAS BI-CAMADA ... 30
3.5.3.3-MEMBRANASZEOLÍTICASORIENTADAS ... 31
3.5.4 - CALCINAÇÃO PÓS – CRISTALIZAÇÃO ... 33
3.6 - QUALIDADE DA MEMBRANA ... 35
3.7–TAMANHODOSDEFEITOSEFRAÇÃODEVOLUME ... 37
3.8 – MODELOS PARA SEPARAÇÃO DE GASES EM MEMBRANAS POROSAS .... 37
3.8.1 – DIFUSÃO ATIVADA ... 40
3.8.2–DIFUSÃOSUPERFICIAL ... 40
3.8.2 – DIFUSÃO KNUDSEN ... 42
3.9 – COMPORTAMENTO DE SEPARAÇÃO DAS MEMBRANAS ZEOLÍTICAS ... 43
3.9.1 - DEFINIÇÕES ... 43
3.9.2–CARACTERIZAÇÃODASMEMBRANASZEOLÍTICASPOR PERMOPOROSIMETRIA ... 44
3.10–PERMEAÇÃODECOMPONENTESÚNICOS ... 46
3.11 – SEPARAÇÃO DE MISTURAS BINÁRIAS ... 49
3.12 – SEPARAÇÃO DO HIDROGÊNIO ... 52
3.13–TRANSPORTEDEMASSAEMMEMBRANASMICROPOROSAS ... 56
3.14 – REATORES À MEMBRANA ... 58
3.14.1 – MEMBRANAS ZEOLÍTICAS EXTRATORAS ... 59
Reus Tiago Rigo
3.15-XILENOS ... 61
3.15.1 – PRODUÇÃO DE XILENOS ... 61
3.15.2 – ISOMERIZAÇÃO DE XILENOS ... 61
3.15.3–SEPARAÇÃODEXILENOSCOMMEMBRANASMFI ... 63
4 - EXPERIMENTAL ... 68
4.1 – PREPARAÇÃO DA ZEÓLITA VIA SÍNTESE HIDROTÉRMICA ... 69
4.2–PREPARAÇÃODASMEMBRANASZEOLÍTICAS ... 70
4.3 - REATOR DE AÇO INOXIDÁVEL ... 70
4.4 – VERIFICAÇÃO DE FISSURAS OU DEFEITOS NO FILME ZEOLÍTICO ... 71
4.5–SUPORTEINORGÂNICOMESOPOROSO... 72
4.6 – TÉCNICAS DE CARACTERIZAÇÃO ... 74
4.6.1 – DIFRAÇÃO DE RAIOS X (DRX) ... 74
4.6.2–MICROSCOPIAELETRÔNICADEVARREDURA(MEV) ... 75
4.6.3 – ANÁLISE TÉRMICA ... 76
4.6.4 – DESSORÇÃO A TEMPERATURA PROGRAMA (TPD) ... 77
4.6.5–INFRAVERMELHOPORTRANSFORMADADEFOURIER(FTIR)... 78
4.6.6 – ANÁLISE TEXTURAL POR ADSORÇÃO DE NITROGÊNIO ... 78
4.7 – CROMATOGRAFIA GASOSA... 78
5–RESULTADOSEDISCUSSÕES ... 80
5.1 – CARACTERIZAÇÃO DA ZEÓLITA SILICALITA (pó) ... 80
5.2 –CARACTERIZAÇÃO DA MEMBRANA 1 (M1) ... 85
5.3 – CARACTERIZAÇÃO DA MEMBRANA 2 (M2) ... 87
5.4 – TESTES DE PERMEAÇÃO ... 89
5.5 – ESTUDOS DE PERMEAÇÃO DE GÁS ÚNICO (N2) E DA MISTURA XILENOS/N2 ... 91
5.6 – FATOR DE SEPARAÇÃO DA MISTURA XILENOS/N2 ... 95
5.7 – TESTES DE SEPARAÇÃO DE XILENOS ... 95
6 – CONCLUSÕES ... 102
1–INTRODUÇÃO
As zeólitas são materiais ideais para membranas, porque possuem poros de tamanho moleculares e uniformes (geralmente 0,2 – 2 nm) e excelentes estabilidades; térmica, mecânica e química. Uma vez que os poros das zeólitas usualmente são de tamanho molecular, um espaço entre os cristais de apenas 2 ou 3 nm é o suficiente para diminuir drasticamente as propriedades de separação da membrana, porque a difusividade molecular diminui exponencialmente à medida que suas dimensões se aproximam do tamanho dos poros (YU; NOBLE; FALCONER, 2011). A preparação de membranas zeolíticas de alta qualidade é um desafio. Excelente desempenho de separação foi demonstrado para várias misturas, incluindo misturas difíceis de separar através de outros métodos, tais como isômeros orgânicos (BAERTSCH et al, 1996; FUNKE et al, 1996b; CORONAS; NOBLE; FALCONER, 1998; GUMP; NOBLE; FALCONER, 1999; FLANDERS et al, 2000) e misturas com ponto de ebulição próximos (FUNKE et al, 1996a). Separações sob condições de alta temperatura e pressão (HONG et al, 2005; LI; FALCONER; NOBLE, 2006) e condições desafiadoras quimicamente (KALIPCILAR; FALCONER; NOBLE, 2001) demonstraram o potencial e a versatilidade das membranas zeolíticas.
Reus Tiago Rigo 16
combustível, células solares e baterias avançadas podem ser observadas. No entanto, ações menos revolucionárias são necessárias quando os processos de separação que utilizam intensivamente energia térmica são substituídos por aqueles à base de membranas. A energia requerida para alcançar algumas tarefas de separação em larga escala, podem ser da ordem de baixa magnitude, utilizando membranas versus separações térmicas tradicionais (KOROS, 2004).
Nos últimos anos, camadas zeolíticas suportadas atraíram esforços intensivos, devido às suas aplicações potenciais, como membrana de separação, reator catalítico de membrana, sensores químicos, eletrodos, materiais com constante dielétrica baixa para utilização como isolante elétrico, camada de proteção ou isolante ou como hospedeiro para a organização de moléculas hospedeiras funcionais. Vários trabalhos pioneiros sobre as perspectivas das camadas zeolíticas além do campo da separação para a montagem de novos e complexos materiais funcionais, incluindo, sensores moleculares dielétricos mecanicamente estáveis, e novos dispositivos de reação-difusão apareceram (LI et al, 2005; LI et al, 2005; VILASECA et al, 2003; CORONAS; SANTAMARIA, 2004; ZABALA; CALZAFERRI, 2006; KIM et al, 2004; SNYDER; TSAPATSIS, 2007). Camadas de peneiras moleculares porosas ordenadas são materiais importantes na era da nanotecnologia com novas aplicações emergentes (DAVIS et al, 2002; TSAPATSIS, 2002).
Membranas zeolíticas tipo MFI suportadas são consideradas candidatas ideais para a separação dos isômeros de xilenos (GU et al, 2006; LAI; TSAPATSIS, 2004; TARDITI, HOROWITZ, LOMBARDO, 2006a, TARDITI, IRUSTA, LOMBARDO, 2006b; XOMERITAKIS; LAI; TSAPATSIS, 2001) devido à sua capacidade de separação. Atualmente, os isômeros de xilenos são separados por processos que utilizam intensivamente energia, como a cristalização criogênica ou o processo Parex de adsorção seletiva (YEONG et al, 2011). Dado o tamanho médio de poro de uma membrana zeolítica MFI de alta qualidade é esperado que possa separar p-xileno (PX, diâmetro cinético dc = 0,59 nm), excluindo os isômeros o- e m-xileno (OX, MX, dc = 0,68 nm). A
estrutura dos poros da zeólita tipo MFI consiste de dois canais: canais retos com aberturas circulares de 0,53 x 0,56 nm ao longo do eixo b e canais sinusoidais com aberturas elípticas de 0,51 x 0,55 nm ao longo do eixo a. O transporte também é possível através das intersecções dos canais ao longo do eixo c (O’BRIEN-ABRAHAM; LIN, 2010).
Dois fatores influenciam a seletividade de separação: (i) as diferenças entre as características de adsorção de cada espécie, e (ii) as diferenças nas mobilidades (difusividade) dos componentes (KRISHNA, 2001). Assim, as características da membrana zeolítica dominam o transporte das moléculas de xilenos através da membrana (TARDITI; LOMBARDO; AVILA, 2008). Para descrever o equilíbrio de adsorção da membrana Silicalita, a forma molecular e o tamanho do componente afeta significativamente a localização molecular nos canais e intersecções da Silicalita, resultando em diferentes comportamentos de adsorção (ZHU; KAPTEIJN; MOULIJN, 2000a).
A quantificação dos parâmetros de adsorção e difusão é a informação básica necessária para modelar o mecanismo de transporte dos isômeros de xilenos através da membrana de Silicalita. As energias de interação entre os isômeros de xilenos e membrana irão proporcionar uma estimativa da fácil adsorção de cada componente na membrana (MOHANTY; DAVIS; McCORMICK, 2000).
Reus Tiago Rigo 18
2–OBJETIVOS
Sintetizar membranas zeolíticas tipo MFI (Silicalita) pelo método in situ, com a finalidade de aplicá-las em processos de separação.
2.1-OBJETIVOSESPECÍFICOS
Avaliar a qualidade das membranas através de testes de permeação.
Caracterizar as membranas zeolíticas com diferentes técnicas, afim de avaliar os materiais sintetizados.
3-FUNDAMENTOSEESTADODAARTE
Neste capítulo será apresentado um estudo bibliográfico referente à síntese de membranas zeolíticas e sua aplicação em separação de xilenos.
3.1–ZEÓLITAS
Zeólitas são materiais com estruturas que apresentam poros bem definidos na faixa de 0,2 a 2 nm. Estruturalmente e quimicamente, as zeólitas são classificadas como aluminosilicatos cristalinos com estrutura tridimensional baseada na rede tetraédrica [AlO4]5- e [SiO4]4- (BRECK, 1974). Uma vez que os átomos de oxigênio se ligam aos
tetraedros, isto é, são partilhados, o tetraedro de Al contribui com uma carga negativa líquida, enquanto que o tetraedro de Si possui uma carga líquida neutra. Essa carga negativa da estrutura é balanceada pelos cátions (cátions de compensação) que não ocupam posições na rede estrutural, mas estão compensando cargas da estrutura. Uma fórmula representativa para a célula unitária da zeólita pode ser escrita como:
Mn+ x/m[((AlO-2)x (SiO2)y]• mH2O
Onde M representa os cátions trocáveis de valência na estrutura, que podem ser metais ou não – metais (por exemplo, prótons no caso de uma zeólita com acidez de Brønsted) e cátions orgânicos. Estes cátions são introduzidos durante a cristalização ou através da troca iônica. O valor de y/x representa a relação Si/Al que é igual ou maior que 1, devido aos íons Al3+ não ocuparem sítios tetraédricos adjacentes de acordo com a regra
de Loewnstein (segundo a regra de Loewenstein não existe Al-O-Al na rede cristalina, portanto apenas 50% dos átomos de Si da estrutura cristalina, podem ser substituídos por átomos de Al (BRECK, 1974). A soma x + y representa o número de átomos T e m representa o número de moléculas de água por célula unitária.
Reus Tiago Rigo 20
zeolítica é atribuído um código de três letras de acordo com as regras estabelecidas pela IUPAC e a Comissão sobre Nomenclatura de Zeólitas de 1978.
Para a maioria das aplicações ainda é comum classificar as zeólitas devido ao tamanho dos poros da estrutura cristalina, a abertura dos poros esta relacionada com o número de tetraedros T (T = Si ou Al) que formam a mesma. A Tabela 3.1 apresenta a classificação das zeólitas de acordo com o tamanho dos poros (PACE; RENDÓN; FUENTES, 2000).
Tabela 3.1: Classificação das zeólitas de acordo com o tamanho dos poros. (PACE; RENDÓN; FUENTES, 2000).
Zeólita Átomos de O que
formam a abertura Diâmetro de poro (Å) Exemplos
Poro extragrande >12 D > 9 AlPO4-8, VPI-5
Poro grande 12 6 < 0 < 9 Y, β, Ω, Mordenita
Poro médio 10 5 < 0 < 6 ZSM-5, ZSM-11
Poro pequeno 8 3 < 0 < 5 Erionita, A, SAPO-34
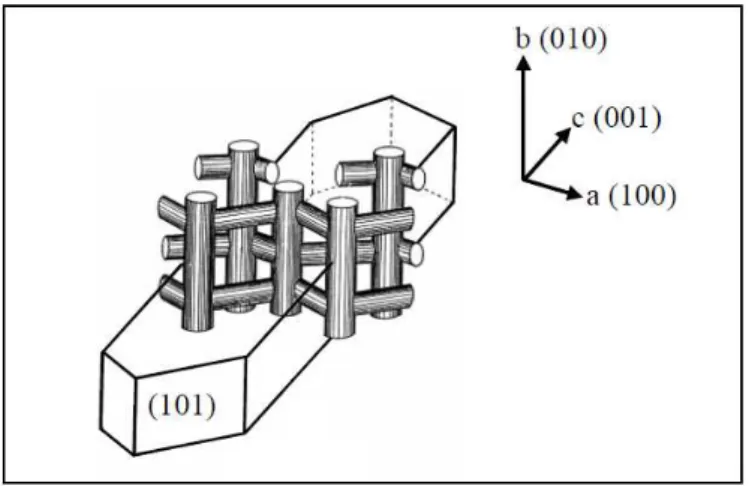
Figura 3.1: Unidades secundárias de construção, (SBU).
3.2-CRISTALIZAÇÃODEZEÓLITAS
As zeólitas sintéticas foram introduzidas em 1940 para aplicações comerciais, ampliando o processo de formação de zeólitas em comparação com as encontradas na natureza, mas, utilizando condições de maior alcalinidade e temperatura, a fim de acelerar o processo de cristalização (MILTON, 1989). Atualmente, as zeólitas continuam sendo amplamente preparadas sob condições hidrotérmicas. Características de produto podem ser influenciadas principalmente pela composição da mistura reacional, tempo e temperatura.
Reus Tiago Rigo 22
um papel de modelo quando adicionado sob a forma de hidróxido. Teores elevados de SiO2 e concentração de hidróxido de tetrapropilamônio (TPAOH) nas misturas de síntese
favorecem a formação de pequenos cristais em forma cúbica. Variando o tipo de agente direcionador de estrutura, tem-se o controle mais pronunciado da forma dos cristais. Com a utilização de saís de trímeros de TPA como agente direcionador de estrutura, sabe-se que aumenta o crescimento na direção cristalográfica b (veja Figura 3.2), devido ao processo de oclusão preferencial dessas moléculas longas nos canais retos durante a cristalização da MFI (LAI et al, 2003).
Figura 3.2: Representação de um cristal único de MFI, mostrando seu cristal típico e estrutura de poros. (CARO et al, 1993).
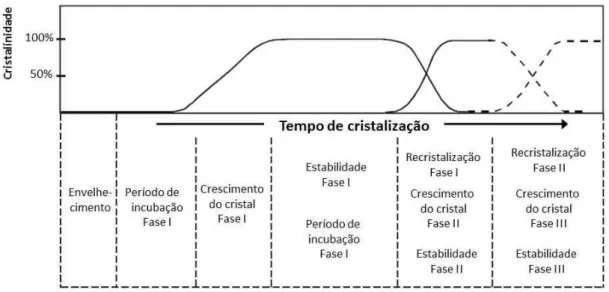
Figura 3.3: Etapas do processo de cristalização hidrotérmica. Adaptada de MABANDE, (2005).
Depois da homogeneização e envelhecimento das matérias primas, os precursores zeolíticos são formados através de complexos processos físico – químicos no período de indução. Após a supersaturação, a nucleação é alcançada podendo ocupar todos os espaços. O crescimento dos cristais conduz a uma fase cristalina I, que pode recristalizar para formar outras fases (fase II e fase III). Por exemplo, Al-ZSM-5 tem sido observada
pela recristalização em mordenita, que por sua vez recristaliza em α-quartzo em uma síntese livre de agente direcionador de estrutura (DAI et al, 1986).
3.3-TRATAMENTOSPÓS–SÍNTESE
Diversos procedimentos de modificação podem ser aplicados, a fim de produzir as características necessárias do material para uma determinada aplicação. Quando um agente direcionador de estrutura é utilizado durante a síntese, ele continua ocluído nos poros da zeólita. Assim, a calcinação em temperaturas elevadas removerá o agente direcionador de estrutura. A troca iônica pode ser aplicada para introduzir H+ ou íons
metálicos (Pt2+, Cu2+, Co2+, Fe2+), não na rede estrutural mas nas posições de
Reus Tiago Rigo 24
A relação Si/Al da estrutura pode ser aumentada por um processo térmico, hidrotérmico, vapor ou desaluminização ácida da zeólita ou substituição do alumínio por silício utilizando uma reação com hexafluorosilicatos ou haletos de silício. Inversamente, a inserção de alumínio também é possível, por exemplo, pela inclusão de haletos de alumínio voláteis ou durante a moagem úmida e extrusão da ZSM-5 puro silício com óxido de alumínio. Estas medidas modificam as propriedades ácidas, estabilidade térmica, propriedades de troca catiônica e hidrofobicidade (ZHOLOBENKO et al, 1991; NAYAK; CHOUDHARY, 1984; CHANG et al, 1984; SHIHABI et al, 1985).
3.4-ZEÓLITATIPOMFI
Um tipo de estrutura zeolítica estudada largamente e com grande importância industrial é a MFI, que pode ser sintetizada com relação Si/Al variando de 7 ao infinito, contendo alumínio e na forma sem alumínio, sendo comumente referidas como Al-ZSM-5 e Silicalita, respectivamente (ARGAUER; LANDOLT, 1972; GROSE; FLANIGEM, 1977).
A variabilidade na relação Si/Al da zeólita tipo MFI, permite uma variedade de propriedades desta zeólita, partindo da hidrofílica para a hidrofóbica cataliticamente ativa (na forma ácida, H+) para inerte. Assim, esta zeólita é amplamente utilizada em escala
Figura 3.4: Estrutura da zeólita Silicalita. (fonte: iza-online.org).
3.5–MEMBRANAS
Uma membrana pode ser definida como sendo uma barreira seletiva entre duas fases. As membranas são classificadas em membranas sintéticas e biológicas. Membranas sintéticas ainda são subdivididas em membranas inorgânicas e orgânicas (KOROS et al, 1996). Dentro das membranas inorgânicas temos as membranas zeolíticas, que serão o foco desse trabalho.
3.5.1-MEMBRANASZEOLÍTICAS
Reus Tiago Rigo 26
em inúmeros processos industriais de separação/adsorção, sendo estas as mesmas características empregadas nas separações de misturas de substâncias com camadas de membrana zeolítica. Separações baseadas em membranas tem a grande vantagem de estar em processos de estado estável, em oposição a processos baseados em efeitos de temperatura ou separações baseadas no balanço da pressão, levando a redução dos custos de operação e consumo de energia (AUERBACH; CARRADO; DUTTA, 2003).
3.5.2-EFEITODOSUPORTE
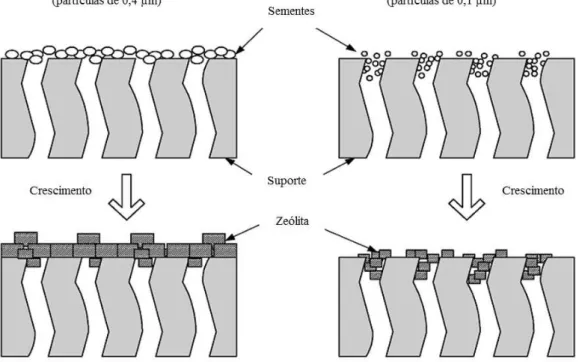
Quase todas as preparações da membrana MFI, têm sido realizadas utilizando suporte de alumina porosa ou aço inoxidável sob a forma de tubos ou discos. Os tubos são adequados para eventuais aplicações, mas os discos são facilmente fabricados em laboratório. Membranas com poucos defeitos e com rendimentos maiores são adequadas para a caracterização (YAMPOLSKII et al, 2006). A consideração mais importante é a distribuição do tamanho dos poros no suporte. Para avaliar a importância da estrutura física do suporte, é necessário primeiro examinar a geometria da camada zeolítica em relação ao suporte. A zeólita pode ser nucleada e crescer em qualquer ponto da superfície do poro no suporte.
Figura 3.5: Membranas internas e externas decorrentes de diferentes tamanhos de sementes. Adaptada da referência YAMPOLSKII et al, (2006).
A deposição de um material cristalino ou amorfo, as vezes, pode bloquear parcialmente os poros de várias dezenas de micrometros, abaixo da camada seletiva e afetando negativamente a permeância e a seletividade. Vários esforços foram feitos para limitar o crescimento interno indesejado, através da introdução de uma substância de barreira antes do crescimento da membrana e removê-lo após o crescimento. O carbono tem sido utilizado como uma substância de barreira com pouco sucesso (YAN; DAVIS; GAVALAS, 1997). HEDLUND et al, (2002), utilizaram cera como uma substância de barreira, tornando-se possível a obtenção de membranas com fluxo muito maior.
Uma complicação encontrada quando se utiliza alumina como suporte é a dissolução lenta do sólido na mistura com pH elevado. Mesmo em concentrações muito baixas de acúmulo de alumínio na proximidade imediata do suporte e no interior dos poros, podem ter uma influência profunda sobre o crescimento da membrana, tendo em vista, o papel do alumínio na formação do gel, nucleação e crescimento de cristais (LAI; YAN; GAVALAS, 2000). Com a concentração de alumínio dissolvido variando com o padrão da mistura e o posicionamento do suporte no recipiente da reação, é difícil de obter
reprodutibilidade das propriedades da membrana. Entre os suportes de alumina, a γ-Al2O3
Reus Tiago Rigo 28
suporte de membrana, com algumas exceções notáveis (CORONAS; FALCONER; NOBLE, 1997).
Para promover uma boa aderência da camada da membrana, os suportes são submetidos a tratamentos de limpeza diferentes (tais como; lavagem com água, acetona, ácidos, bases e ainda misturas oxidantes) para remover partículas soltas, sais adsorvidos, hidrocarbonetos ou outros compostos orgânicos. Subsequentemente a lavagem, os suportes podem ser armazenados em água para evitar a adsorção de compostos orgânicos a partir do ambiente de laboratório (YAMPOLSKII et al, 2006).
No caso das membranas internas, o tamanho de poro tem um significado diferente. Uma camada seletiva interna (intra-poro) pode ser formada, os cristalitos devem crescer seus poros circundantes. Os poros maiores, na cauda da distribuição do tamanho de poro, irão levar mais tempo, talvez requerendo períodos de crescimento repetidos (utilizando cada vez misturas frescas). O tamanho de poro pequeno é favorável do ponto de vista da formação de defeitos, pois aumenta a resistência à permeação (YAMPOLSKII et al, 2006).
LAI et al, (2003), utilizaram um suporte de alumina macroporosa, que foi revestida com uma camada de sílica mesoporosa (tamanho de poro 2 nm) antes da semeadura e tratamento hidrotérmico. Esta camada intermediária proporciona um substrato adequado para a semeadura e parece suprir a lixiviação da alumina e reduzir a formação de defeitos durante a calcinação.
3.5.3-TÉCNICASDESÍNTESEPARAAPREPARAÇÃODEMEMBRANAS
Figura 3.6: Visão global das diferentes estratégias de cristalização para a preparação de membranas zeolíticas suportadas. Adaptada de CARO et al, (2000).
As primeiras tentativas de cristalizar membranas zeolíticas em suportes porosos inorgânicos foram reportadas no final dos anos 80 por SUZUKI, (1987), utilizando uma etapa de cristalização hidrotermal in situ. Este método envolve a nucleação heterogênea sobre a superfície do suporte e/ou deposição de cristais homogêneos nucleados sobre o suporte, seguido pelo crescimento dos cristais. Ciclos de cristalização podem ser repetidos a fim de eliminar os defeitos e melhorar a seletividade da membrana (VROON et al, 1998). Geralmente, as camadas resultantes não são uniformes e necessitam ser espessas, a fim de minimizar os defeitos, e a dificuldade de reprodutibilidade dos resultados pode ser um problema (NOACK et al, 2001).
3.5.3.1-CRISTALIZAÇÃOASSISTIDACOMSEMENTESPARAPREPARAÇÃO DEMEMBRANASZEOLÍTICASDECAMADAÚNICA
Reus Tiago Rigo 30
elevado de intercrescimento de cristais, mesmo para camadas muito finas, por exemplo, 0,5 µm (HEDLUND et al, 2002). A maioria dos pesquisadores de membranas aplicam os métodos de semeadura que empregam sementes de zeólita cristalizadas in situ, em pó (AOKI; KUSAKABE; MOROOKA, 1998) ou, mais comumente, utilizam cristais coloidais de zeólita (HEDLUND et al, 2002; LOVALLO; TSAPATSIS; OKUBO, 1996; LAI; GAVALAS, 1998). Estes têm que ser separados a partir da água mãe após a cristalização, lavados, ressuspensos e em seguida ligados à superfície do suporte antes do crescimento hidrotermal na membrana, por exemplo, utilizando revestimento por imersão (WONG et al, 2001; BERNAL; XOMERITAKIS; TSAPATSIS, 2001) e atração eletrostática, (HEDLUND et al, 2002; LOVALLO; TSAPATSIS; OKUBO, 1996). Muitas vezes, a camada depositada de sementes necessita ser subsequentemente calcinada, a fim de melhorar sua fixação ao suporte ou para remoção dos agentes direcionadores de estrutura utilizados durante a semeadura (NOACK et al, 2000).
Em contraste, ALGIERI et al, (2001), empregaram duas etapas de cristalização para suportes cerâmicos semeados in situ com a zeólita Silicalita. A semeadura in situ oferece uma possibilidade simples de reduzir o número de etapas requeridas para a preparação da membrana, mantendo as vantagens oferecidas pela semeadura. Assim, as sementes pequenas com tamanho nanométrico serão produzidas diretamente sobre a superfície do suporte utilizando condições de cristalização adequadas para a nucleação. Sem qualquer necessidade de etapas intermediárias de processamento, o suporte semeado é colocado em uma mistura de cristalização diferente para o crescimento da camada da zeólita sob condições adequadas para o crescimento dos cristais. Tendo em vista os custos de produção, métodos tecnicamente simples produzem membranas de alta qualidade empregando algumas etapas que são altamente atrativas.
3.5.3.2-MEMBRANASZEOLÍTICASBI-CAMADA
membranas Al-, Fe-, B-, Ge-ZSM-5, (TUAN et al, 2002; TUAN; FALCONER; NOBLE, 2000) variando-se a relação Si/Al (JAREMAN; HEDLUN; STERTE, 2003; NOACK et al, 2005b; MABANDE et al, 2004b) e por troca iônica (AOKI et al, 2000). Estas inúmeras possibilidades permitem um ajuste fino nas características da membrana para resolver diferentes problemas na separação de líquidos e gases.
Membranas zeolíticas multicamadas com gradientes de composição química ou estrutura das camadas da zeólita apresentam um potencial de expansão ainda maior para suas aplicações. Tais membranas possibilitam uma combinação de diferentes funções ou características em uma única membrana, por exemplo, atividade catalítica/inércia, caráter hidrofóbico/hidrofílico e diferente tamanho de poros (MABANDE, 2005).
LAI; CORCORAN Jr. (2000) patentearam a fabricação de membranas zeolíticas multicamadas e demonstraram que é possivel à semeadura e o crescimento epitaxial da Al-ZSM-5 suportada em camadas de Silicalita em alumina porosa e suportes de aço inoxidável. Também relataram que o crescimento das camadas de Al-ZSM-5 ou camadas de Silicalita calcinada, conduzem a erosão parcial da camada de Silicalita subjacente e que esta erosão poderia ser evitada se a camada de Silicalita não tivesse passado pelo processo de calcinação antes da cristalização da segunda camada. GORA et al, (2001) relataram que a cristalização das camadas de Silicalita na camada superior da zeólita A em um suporte poroso Trumen, pelas condições de identificação permitem o crescimento da segunda camada sem a dissolução da primeira. Bi – camadas de Silicalita/Al-ZSM-5 foram preparadas em quartzo não poroso e em substratos de silício (LI et al, 2001; LI et al, 2002).
3.5.3.3-MEMBRANASZEOLÍTICASORIENTADAS
Reus Tiago Rigo 32
que a permeação através das membranas MFI c-orientadas é menos favorável (CARO et al, 1993). Uma camada MFI b-orientada é esperada para exibir altos fluxos. O crescimento das camadas zeolíticas a partir da monocamada de sementes orientadas utilizando crescimento secundário e a orientação da camada de sementes pode ser mantida dentro da membrana final (CARO; NOACK, 2008). Por este caminho, membranas MFI b- (LAI et al, 2003) e a- (CHOI et al, 2006) orientadas, podem ser preparadas com sucesso.
Tanto o crescimento in situ, bem como o crescimento secundário podem dar uma orientação diferente da camada de zeólita. Pela semeadura no suporte, as camadas da membrana MFI de diferentes orientações cristalográficas podem ser obtidas, mas na maioria das vezes as membranas de zeólita tipo MFI mostram uma orientação cristalográfica do eixo c- da camada zeolítica perpendicular ao plano da superfície do suporte (LAI et al, 2003; WONG et al, 2001). A orientação c- pode ser explicada pelo modelo do crescimento competitivo (WONG et al, 2001). Normalmente, os nanocristais utilizados como sementes não apresentam faces cristalinas desenvolvidas e, consequentemente, estes cristalitos são orientados aleatoriamente. Se o crescimento dos cristais é anisotrópico, os cristalitos com suas direções de crescimento mais rápidos, que apontam a partir da superfície semeada irão crescer mais rapidamente do que os cristalitos em outras orientações. Finalmente, os cristais com crescimento mais rápido na direção perpendicular ao plano da membrana irão dominar. Para cristais de MFI, geralmente, o eixo c- é a dimensão mais longa e, consequentemente, é a direção de crescimento mais rápida. Sob certas condições de crescimento outras orientações cristalográficas foram observadas como orientação a- (HEDLUND; MINTOVA; STERTE, 1999b; WANG; YAN, 2001a), orientação b- (KOEGLER; VAN BEKKUM; JANSEN, 1997) ou orientações intermediárias (TANAKA, 2002; BONS; BONS, 2003).
LAI et al, (2003) prepararam uma membrana Silicalita b-orientada. Eles utilizaram sementes relativamente grandes (0,50 x 0,2 x 0,1 µm3) com as faces de cristais
desempenho de separação superior, o que foi demonstrado para a separação de isômeros de xilenos (LAI et al, 2003). O desenvolvimento de membranas MFI de alto fluxo e elevada seletividade para a separação de xilenos (LAI et al, 2003), revelou a importância de uma certa orientação dos canais e o significado de um crescimento de sementes em uma monocamada de partículas orientadas. Em baixas temperaturas os poros da zeólita são preenchidos e o p-xileno mais móvel não pode mover-se mais rapidamente através da rede de poros do que o o-xileno com menor mobilidade. Esta situação muda drasticamente o enchimento dos poros menores que é encontrado em temperaturas superiores e pressões parciais baixas. Agora, o p-xileno pode deslocar-se mais ou menos independentemente da presença do o-xileno (LAI et al, 2003).
3.5.4-CALCINAÇÃOPÓS–CRISTALIZAÇÃO
Durante a cristalização da zeólita tipo MFI é utilizado um agente direcionador de estrutura, e com isso, faz-se necessário uma calcinação para removê-lo. Durante a calcinação da membrana a camada da zeólita diminui devido a queima do agente direcionador de estrutura, e em alguns casos ocorrem transições de fases ortorrômbicas e monoclínicas (DONG et al, 2000; PARK et al, 1997; EXTER et al, 1997). Em geral, o suporte se expande continuamente durante o aquecimento. Isto poderá conduzir à tensões térmicas na camada da zeólita causando a formação de rachaduras na membrana.
A decomposição térmica do tetrapropilamônio na MFI foi estudado, utilizando várias técnicas, tais como; TGA e DSC (SOULARD et al 1987; PARKER; BIBBY; PATTERSON, 1984; BILGER et al, 1991; GEUS; VAN BEKKUM, 1995), espectrometria de massa acoplada com análise termogravimétrica (PARKER; BIBBY; PATTERSON, 1984; BILGER et al, 1991), espectroscopia na região do infravermelho (GEUS; VAN BEKKUM, 1995; NOWOTNY; LERCHER; KESSLER, 1991; SOULARD et al, 1991) e RMN do 13C (SOULARD et al, 1991). Geralmente, é
estabelecido que a degradação térmica do cátion tetrapropilamônio ocorre inicialmente via a reação de eliminação de Hoffmann, resultando em tripropilamina, dipropilamina, propilamina, amônia e propeno (MABANDE, 2005).
Reus Tiago Rigo 34
termogravimétrica. Eles propuseram que a decomposição do TPAOH na Silicalita ocorre
passa a passo via eliminação tipo Hoffmann seguida pela β - eliminação sucessiva:
1 (CH3CH2CH2)4NOH → (CH3CH2CH2)3N + CH3CH=CH2 + H2O
2 (CH3CH2CH2)3N → (CH3CH2CH2)2NH + CH3CH=CH2
3 (CH3CH2CH2)2NH → CH3CH2CH2NH2 + CH3CH=CH2
4 CH3CH2CH2NH2→ NH3 + CH3CH=CH2
A decomposição do TPAOH na Al-ZSM-5 é proposto para prosseguir via a formação de íons tripropilamônio devido a presença da acidez de Brønsted na zeólita (MABANDE, 2005):
1 (CH3CH2CH2)4N+Z-→ (CH3CH2CH2)3NH+Z- + CH3CH=CH2
2 (CH3CH2CH2)3NH+Z-→ (CH3CH2CH2)2NH2+Z- + CH3CH=CH2
3 (CH3CH2CH2)2NH2+Z-→ CH3CH2CH2NH3+Z- + CH3CH=CH2
4 CH3CH2CH2NH3+Z-→ H+Z- + NH3 + CH3CH=CH2
Onde Z- representa a estrutura da zeólita carregada negativamente. Assim, a
cristalização alcalina livre da Al-ZSM-5 deve dar H-Al-ZSM-5 após a calcinação da zeólita sintetizada como um produto sem a necessidade de troca iônica pós síntese.
Dependendo da composição química da zeólita e das condições de calcinação, ocorrem várias reações secundárias acompanhadas da decomposição do agente direcionador de estrutura, incluindo, oligomerização, ciclização, transferência e adição de hidrogênio, conduzindo a formação de uma variedade de alifáticos e aromáticos (BILGER et al, 1991; NOWOTNY; LERCHER; KESSLER, 1991; WILSHIER et al, 1987).
NOWOTNY; LERCHER; KESSLER, (1991) estudaram a decomposição de fluretos de tetrapropilamônio em cristais únicos de ZSM-5 (com relação Si/Al variando entre 31 e > 1000), utilizando o tempo resolvido durante a espectroscopia de infravermelho à 10 K.min-1 em atmosfera de nitrogênio. Eles concluíram que até 360 °C
eliminação de Hoffmann. Em temperaturas mais elevadas o agente direcionador de estrutura degrada-se mais e os poros são esvaziados. LIN; FALCONER; NOBLE, (1998), detectaram nas membranas MFI preparadas com o agente direcionador de estrutura TPAOH uma permeação sem impedimentos para o n- e i-butano, após a decomposição do agente direcionador de estrutura à 400 °C.
Para evitar danos sérios na membrana, tal como, rachaduras temperaturas de calcinação moderadas (400 °C) e taxas de aquecimento/arrefecimento baixas (1 K.min-1),
são recomendadas para a calcinação da membrana (GEUS; VAN BEKKUM, 1995). Além disso, JAREMAN; ANDERSSON; HEDLUND, (2005), demonstraram que para membranas com uma espessura de 0,5 µm suportadas em α-alumina, a calcinação à 500 °C, empregando taxas de até 5 K.min-1 em comparação com 0,2 K.min-1, conduziu a
depreciação da qualidade da membrana de acordo com a permeação de gás único, permoporosimetria e separação dos isômeros de xilenos.
3.6-QUALIDADEDAMEMBRANA
Infelizmente, os critérios para quantificar a integridade da membrana diferem de artigo para artigo e muitas vezes comparar trabalhos de grupos diferentes é difícil. A técnica mais utilizada para a caracterização das membranas MFI é a medida da permeação do gás H2 (ou N2) e SF6 e a determinação da permesseletividade ideal, definida como a
relação da permeância do H2 (ou N2) e SF6. O SF6 tem um diâmetro de 0,55 nm, que é um
tamanho comparável com as dimensões dos poros da MFI (0,51 – 0,56 nm) BAERLOCHER; McCUSKER; OLSON, 2007). Os diâmetros cinéticos do H2 (0,29 nm)
e N2 (0,36 nm), são relativamente pequenos e consequentemente, com isso, sua
permeação intraporo deve ser significativamente mais rápida do que a do SF6. Portanto,
para que uma membrana seja considerada de boa qualidade, deverá apresentar uma permesseletividade ideal elevada, isto é, uma relação da alta permeação do H2 ou N2 à
SF6. FUNKE et al, (1996b) definiram em seu trabalho uma permesseletividade para
N2/SF6 entre 80 - 140 à temperatura ambiente, e este foi considerado um indicador da boa
qualidade da membrana MFI.
Reus Tiago Rigo 36
são empregados para avaliar a qualidade da membrana. As permeações do H2 e SF6
possuem dependências diferentes com a temperatura (BAKKER et al, 1997), a presença de gás de arraste (LIN; FALCONER; NOBLE, 1998; BAI et al, 1995; VAN de GRAAF; KAPTEIJN; MOULIJN, 1998b) e as moléculas adsorvidas na camada da zeólita (FUNKE et al, 1997). Além da adição e condições das medidas de permeação, a espessura da camada da membrana zeolítica e do teor de alumínio têm efeitos profundos na permesseletividade ideal do H2/SF6. Assim, ocorre o aumento da permesseletividade com
a espessura da camada da zeólita e o teor de alumínio nas membranas (MABANDE et al, 2004b; NOACK et al, 2005a). Permeação de gás único (n- ou i-butano) e a separação de misturas, também são utilizadas para avaliar a qualidade das membranas sintetizadas. Segundo YAN; DAVIS; GAVALAS, (1995), membranas MFI de boa qualidade devem separar estes gases com base na maior difusividade da molécula de n-butano linear (diâmetro cinético 0,43 nm), comparada com a de i-butano ramificado (diâmetro cinético 0,50 nm).
GUMP et al, (2000) mostraram através de variações sistemáticas da configuração experimental que os resultados da permeação e de separação de n-/i-butano, também variam drasticamente de acordo com as condições de permeação. Por exemplo, membranas com quantidades significativas de poros não zeolíticos foram capazes de separar misturas de n-/i-butano com fator de separação elevado (140), devido à adsorção preferencial do n-butano, quando a pressão é diminuída, sendo que nesse caso o modo de permeação foi aplicado em baixas temperaturas. No entanto, em temperaturas acima de 190 °C estas membranas perderam sua seletividade.
Em uma membrana de boa qualidade o fluxo de gás não condensável é bloqueado em pressões parciais muito baixas, devido ao preenchimento dos poros da zeólita. Para a caracterização da membrana MFI, o H2 (ou N2) são tipicamente utilizados como gases
3.7–TAMANHODOSDEFEITOSEFRAÇÃODEVOLUME
A condensação capilar durante as medidas de permeação, combinada com modelos físicos apropriados (equações de Kelvin e Horvath – Kawazoe (H - K), é utilizada para estimar o tamanho dos defeitos. Dois métodos, permeação de vapor e permoporosimetria, são empregadas para determinar os tamanhos dos defeitos nas membranas zeolíticas MFI (YU et al, 2007a; YU et al, 2007b; YU; FALCONER; NOBLE, 2008a). LEE et al, (2008) utilizaram moléculas que eram muito grandes para adsorver nos poros da MFI em uma taxa mensurável e foram consideradas como apenas permeadas através dos defeitos. A queda da pressão total através da membrana foi de zero durante as medidas de permeação a vapor, porque a perda de pressão do vapor de condensação é inibida nos defeitos e, portanto, os tamanhos dos defeitos são sobrestimados. YU et al, (2008b), realizaram experimentos utilizando isooctano e 2,2-dimetil butano (DMB), pois os mesmos apresentam pressão de vapor razoáveis, mas possuem diâmetro cinético de 0,70 e 0,63 nm e, portanto, não são facilmente adsorvidos nos poros da MFI (0,6 nm), particularmente à temperatura ambiente.
3.8–MODELOSPARASEPARAÇÃODEGASESEMMEMBRANASPOROSAS
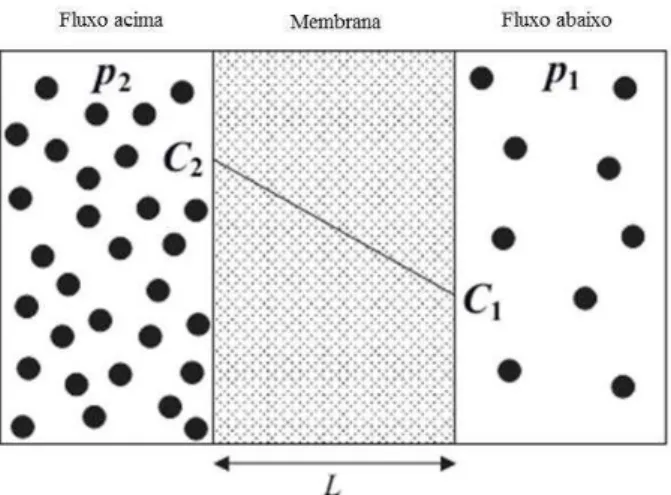
Uma medida quantitativa do transporte de gás é o fluxo (ou taxa de permeação), que é definida como o número de moléculas que passam através de uma unidade de área por unidade de tempo (YAMPOLSKII et al, 2006). Acredita-se que este fluxo molecular J segue a primeira lei de Fick. O fluxo é proporcional ao gradiente de concentração através da membrana, isto é, há um movimento do gás a partir das regiões de alta concentração para as regiões de baixa concentração, o que pode ser expresso na forma:
� = −� ��
�� (1)
onde D é a difusividade (ou coeficiente de difusão), c(x) é a concentração e x é a posição transversal da membrana (YAMPOLSKII, FREEMAN, 2010). Ao assumir um gradiente de concentração linear através da membrana, o fluxo pode ser aproximado como:
Reus Tiago Rigo 38
onde C1 = c(0) e C2 = c(L) são as concentrações de fluxo abaixo e fluxo acima (correspondendo as pressões p1 e p2 via isotermas de adsorção c(p)), respectivamente, e L é a espessura da membrana, como mostrada na Figura 3.7.
Figura 3.7: Membrana de separação de gás com um gradiente de concentração constante transversal da membrana L. Adaptada da referência YAMPOLSKII,
FREEMAN, (2010).
O desempenho da membrana de vários materiais é geralmente comparada utilizando a espessura, independente das propriedades do material, ou seja, a permeabilidade P, a qual esta relacionada com o fluxo J da seguinte maneira:
�= ��
�2− �1 =�
�2− �1
�2− �1� � (3)
No caso em que a pressão de fluxo acima é muito maior do que a pressão de fluxo abaixo (p2 >> p1 e C1 e C2), a permeabilidade pode ser simplificada para dar:
�= �2
�2� (4)
Pela introdução de um coeficiente de solubilidade S, isto é, a relação da concentração sobre a pressão C2/p2, quando a isoterma de adsorção pode ser representada pela lei de Henry, o coeficiente de permeabilidade pode ser expresso simplesmente como:
� =�� (5)
▪solubilidade, S, o qual é um componente de equilíbrio que descreve a concentração das moléculas de gás dentro da membrana, que é a força motriz, e
▪ difusividade, D, que é um componente dinâmico que descreve a mobilidade das moléculas de gás no interior da membrana.
A separação de uma mistura de moléculas A e B é caracterizada pela seletividade
ou fator de separação ideal αA/B = P(A)/P(B), isto é, a relação entre a permeabilidade da
molécula A sobre a permeabilidade da molécula B. De acordo com a equação P = S D, é possível fazer separações pela difusividade seletiva D(A)/D(B) ou solubilidade seletiva S(A)/S(B) (YAMPOLSKII et al, 2006; WIJMANS; BAKER, 1995). Este formalismo é conhecido na ciência das membranas como o mecanismo da solução – difusão. Uma vez que a fase de limitação da transferência de massa é ultrapassar a barreira de difusão de energia, este mecanismo implica na difusão ativada. Devido a isto, as dependências da temperatura dos coeficientes de difusão e os coeficientes de permeabilidade são descritos pelas equações de Arrhenius (YAMPOLSKII, FREEMAN, 2010).
A forma mais comum da dependência de Arrhenius para o coeficiente de difusão, pode ser expressada como:
�� = ��∗ exp (−∆�a/��) (6)
Para o coeficiente de solubilidade a equação de van’t Hoff tem:
�� = �a∗ exp (−∆�a/��) (7)
Onde ∆Ha < 0 é a entalpia de adsorção.
Tendo em mente a equação (5)
�A = �A∗ exp (−∆�p/��) (8)
onde ∆Ep = ∆Ea + ∆Ha
Reus Tiago Rigo 40
Figura 3.8: Mecanismos de transporte. Adaptada da referência YAMPOLSKII, FREEMAN, (2010).
3.8.1 – DIFUSÃO ATIVADA
Para os poros muito estreitos, o tamanho do mecanismo de peneiramento é realizado, e pode ser considerado como um caso de difusão ativada. Este mecanismo de difusão é comum em estudos extensivos em membranas poliméricas não porosas. Para poros maiores, a difusão de superfície (também um processo de difusão ativada) e a difusão de Knudsen são observadas.
3.8.2–DIFUSÃOSUPERFICIAL
consistente com os parâmetros de transporte de gás e vapor em membranas poliméricas porosas (nucleoporos). Quando o tamanho do poro é reduzido abaixo de um determinado nível, o que depende tanto do material da membrana quanto do gás de permeação, o coeficiente de permeabilidade do gás excede o valor para o fluxo molecular livre (difusão Knudsen), especialmente no caso de vapores orgânicos. Nota-se que a difusão superficial, normalmente, ocorre simultaneamente com a difusão de Knudsen, mas é o mecanismo dominante dentro de uma determinada região do tamanho de poro. Uma vez que a difusão
superficial é também uma forma de difusão ativada, a barreira de energia ∆ES é a energia
necessária para a molécula saltar de um local de adsorção para outro através da superfície do poro. Ao permitir que a barreira de energia seja proporcional à entalpia de adsorção, GILLILAND et al, (1974), estabeleceram uma equação para o coeficiente de difusão superficial expressa como:
�� = �S∗exp�−���� �(9)
onde DS* é um fator pré – exponencial, dependendo da frequência de vibração da
molécula adsorvida normal para à superfície e a distância a partir de um sítio de adsorção para o outro. A quantidade q( > 0) é o calor de adsorção e a é uma constante proporcional (0 < a < 1) de tal modo que aq é a barreira de energia que separa os sítios de adsorção adjacentes. Uma importante observação é que as moléculas adsorvidas mais fortemente são menos móveis do que as moléculas adsorvidas fracamente (DE LANGE; KEIZER; BURGGRAAF, 1995b).
No caso da difusão superficial, a concentração do gás é bem descrita pela lei de Henry’s c = Kp, onde K é a constante que depende da temperatura dependente do coeficiente da lei de Henry K = K0exp(q/RT), onde K0 é uma constante proporcional (DE
VOS; VERWEIJ, 1998b; DE LANGE; KEIZER; BURGGRAAF, 1995b). Uma vez que a solubilidade é a razão da concentração do equilíbrio com a pressão, a solubilidade é equivalente ao coeficiente na lei de Henry,
�S = �0exp����� (10)
o que implica que a solubilidade é uma função da diminuição da temperatura.
Reus Tiago Rigo 42
�S = ��∗exp�
(1− �)�
�� �(11)
onde Ps* é uma constante e uma vez 0 < a < 1, a permeabilidade total irá diminuir com o
aumento da temperatura, significa que qualquer aumento na difusividade é contrariada por um decréscimo na concentração superficial (DE LANGE; KEIZER; BURGGRAAF, 1995b).
3.8.2–DIFUSÃOKNUDSEN
A difusão Knudsen (DE LANGE; KEIZER; BURGGRAAF, 1995b; RAO; SIRCAR, 1996; HINDS et al, 2004; STECKELMACHER, 1986; HOLT et al, 2006), depende da pressão do gás e do caminho livre médio na fase gasosa que se aplica aos poros com tamanho entre 10 e 500 Å. Nesta região, o caminho livre médio das moléculas
na fase gás λ é muito maior do que o diâmetro d. É comum utilizar o modo chamado número de Knudsen Kn= λ/d para caracterizar o regime de permeação através dos poros.
Quando Kn << 1, o fluxo viscoso é realizado. A condição para a difusão de Knudsen é Kn
>> 1. Um regime intermediário é realizado quando Kn ~ 1.
O coeficiente de difusão de Knudsen pode ser expresso da seguinte forma:
�K = 3�� ū (12)
onde τ é a tortuosidade do poro e ū é a velocidade molecular média. Esta expressão mostra que os resultados da separação, deverão depender das diferenças da velocidade molecular
(ou massa molecular). A velocidade molecular média ū é calculada utilizando a
distribuição da velocidade de Maxwell,
ū= √8��
�� (13)
onde m é a massa molecular, e portanto, o coeficiente de difusão pode ser apresentado como:
Para o fluxo no regime Knudsen tem-se a seguinte equação (JULBE; RAMSAY, 1996):
�= ���2∆��K 4��� (15)
onde n é a concentração superficial dos poros com diâmetro d, ∆p é a queda da pressão através da membrana e L é a espessura da membrana. Depois da substituição na Equação (14) na Equação (15), tem-se as seguintes expressões para o fluxo J e coeficiente de permeabilidade P:
�= (��12�3∆�/6��) (2/���)12 (16)
�= (��12�3∆�/6��) (2/���)12 (17)
Duas importantes conclusões podem ser feitas a partir da análise das Equações (16) e (17). Em primeiro lugar, a seletividade de separação no regime Knudsen é caracterizada pela relação αij = (Mj/Mi)1/2. Isso significa que as membranas onde
predomina a difusão Knudsen, são seletivamente pobres. Por exemplo, o fator de separação do O2/N2 é 1,07. A seletividade de separação de gás elevada pode ser observada
na separação de gases leves e pesados, por exemplo, hidrogênio e butano: neste caso α = 5,4. Uma outra característica incomum da difusão de Knudsen é que o aumento da temperatura resulta em ligeiras reduções do fluxo e coeficiente de permeabilidade, como J e P dependem da temperatura como T1/2.
3.9–COMPORTAMENTODESEPARAÇÃODASMEMBRANASZEOLÍTICAS
3.9.1-DEFINIÇÕES
Reus Tiago Rigo 44
necessária e uma camada de zeólita fina de 1 – 20 µm para fluxos elevados. Dependendo do tipo de membrana, camadas intermediárias são utilizadas para estabelecer as propriedades de superfície necessárias (suavidade da superfície, poros suficientemente pequenos, coeficientes de expansão térmica entre o suporte e a camada superior) para o revestimento bem sucedido da membrana (ERNST et al, 2009).
Testes de permeação são realizados para determinar os seguintes parâmetros de permeação cruciais: a partir de experimentos de permeação de componentes únicos os fluxos Ni e a permesseletividade (seletividade ideal) como uma relação dos fluxos de componente únicos (Tabela 3.2) (KOROS; MA; SHIMIDZU, 1996).
Tabela 3.2: Definições de fluxo, permeância, permeabilidade, permesseletividade e fator de separação (IUPAC). (KOROS; MA; SHIMIDZU, 1996).
Fluxo, Ni mol m-2 h-1 ou m3(STP)m-2 h-1
Permeância, Πi = fluxo normalizado de pressão
mol m-2 h-1 Pa-1 ou m3(STP)m-2 h-1bar-1
Permeabilidade Pi = permeância normalizada da espessura (permeância multiplicada pela espessura da membrana)
mol m m-2 h-1 Pa-1 ou m3(STP)mm-2 h-1bar-1
Permesseletividade (seletividade ideal)
PS(i,j) Calculada como a relação de fluxo do componente único PS (i,j) = Πi/ Πj
Fator de separação da mistura α (i,j) Medidas como α (i,j) = (γi.γj)/(xi.xj) com γ e x como frações molares, i e j no permeado (γ) e alimentação (x)
Para misturas binárias, o fator de separação α da mistura e os fluxos dos
componentes permeados a partir de uma alimentação são determinados (Tabela 3.2).
3.9.2 – CARACTERIZAÇÃO DAS MEMBRANAS ZEOLÍTICAS POR
PERMOPOROSIMETRIA
O conceito básico de permoporosimetria é que um gás inerte e não condensável é menos adsorvido (He, N2) e um vapor que prefere encher os microporos regulares
regulares da membrana e bloqueia a passagem dos gases de menor adsorção (He ou N2).
O fluxo remanescente de He e N2 indica a presença de poros com defeitos na região
mesoporosa.
A permoporosimetria é semelhante aos termos permoporometria (ASH; BARRER; POPE, 1963; ASH; BARRER; LOWSON, 1973; KATZ; BARUCH, 1986; MEY-MAROM; KATZ, 1986; CUPERUS; BARGEMAN; SMOLDERS, 1992; CAO et al, 1993), porometria de condensação capilar dinâmica (GALLAHER; LIU, 1994; LIN; FLOWERS; LIU, 1994), ou a técnica de distribuição do tamanho de poro de fluxo dinâmico (ERNST et al, 2009). A permoporisimetria foi originalmente desenvolvida para a caracterização dos poros, onde a equação de Kelvin é válida (r > 1,5 nm). Posteriormente, a permoporosimetria foi estendida para as membranas microporosas (BURGGRAAF; COT, 1996; KANELLOPOULOS, 2000), e logo começaram a ser aplicadas nas membranas zeolíticas. Normalmente, para membranas zeolíticas reais, uma sobreposição dos dois fluxos é observada: o fluxo de forma seletiva intracristalina através dos poros regulares da zeólita e um fluxo adicional não seletivo, através dos mesoporos defeituosos que são maiores do que os poros da zeólita. O fluxo através destes poros defeituosos na faixa de mesoporos pode diminuir completamente qualquer seletividade de forma e resultar em fatores de separação muito baixos. Para uma avaliação quantitativa do fluxo através dos poros com defeitos, a permoporosimetria pode ser utilizada.
Alguns estudos verificaram que a adsorção do n-hexano faz com que o tamanho dos defeitos diminua nas membranas MFI (YU et al, 2007c; YU et al, 2007b). Portanto, a utilização do n-hexano na permoporosimetria é questionável e outras moléculas inertes, tais como, o benzeno podem ser utilizadas. A condensação capilar do dimetilbutano pode ser utilizada para estimar os tamanhos relativos dos poros não zeolíticos (YU et al, 2007c; YU et al, 2007b).
Após o preenchimento dos microporos regulares de uma membrana zeolítica, com o aumento de p/ps também os mesoporos estreitos podem ser preenchidos. Assumindo a
molhabilidade perfeita (isto é, ângulo de contato ~ 0°), que pode ser estimada pela equação de Kelvin, em que p/ps é um poro fechado pela condensação capilar (ERNST et
Reus Tiago Rigo 46
sua distribuição do tamanho de poros e pode prever o comportamento de separação de uma membrana.
3.10–PERMEAÇÃODECOMPONENTESÚNICOS
Figura 3.9: Comparação entre o tamanho de poros efetivos de diferentes zeólitas e o diâmetro cinético das moléculas dos gases. Adaptado da referência ERNST et al,
(2009).
Reus Tiago Rigo 48
moléculas provas à 105 °C em ∆p = 1 bar. (CARO et al, 2000; NOACK et al, 2000) (DMB, MTBE), adaptada da referência ERNST et al, (2009).
O fluxo não zerado restante do MTBE é devido as imperfeições na membrana ou o resultado de uma vedação imperfeita da membrana no módulo. Nota-se que, devido à baixa pressão de vapor à temperatura ambiente, no caso dos líquidos com ponto de ebulição elevada, a utilização do espectrômetro de massa para a detecção do permeado é recomendada: trietil amina (σ = 0,74 nm, p = 91 mbar), trimetil benzeno (σ = 0,79 nm, p = 3 mbar), tri-ise-propil benzeno (σ = 0,74 nm, p < 1 mbar) (NOACK et al, 2000).
O diâmetro cinético (ou diâmetro de colisão), σ, é a medida mais utilizada, normalmente, do tamanho das moléculas prova (WEITKAMP, 2000; KORESH; SOFFER, 1980; SOFFER et al, 1987). O diâmetro cinético é a distância intermolecular de maior aproximação para duas moléculas colidindo com a energia inicial zero. Valores numéricos para σ podem ser calculados a partir da viscosidade ou dados críticos ou a partir do segundo coeficiente virial.
Um valor elevado do fator de separação α não é exclusivo, devido a um efeito do peneiramento molecular e podem também resultar a partir da interação da adsorção da mistura e difusão da mistura. Uma forte dependência da temperatura de fluxo e separação é observada, com alguns microporos sol-gel à base de membranas de óxido metálico (DE VOS; VERWEIJ, 1998a; DE LANGE et al, 1995a; RAMAN; BRINKER, 1995; DE VOS; VERWEIJ, 1998b). No entanto, como demonstrou WEITKAMP, (2000), a relação entre as dimensões moleculares e o tamanho de poro é bastante complicada. O transporte
através de um meio microporoso é determinado pela forma molecular (mais do que o diâmetro cinético) em relação à forma e o tamanho das janelas dos poros, canais e intersecções. Assim, apesar do ciclohexano e 2,2-dimetil butano (DMB) terem o mesmo diâmetro cinético, devido à sua seção transversal elíptica o ciclohexano apresenta uma cinética de adsorção muito mais rápida do que o DMB para os poros da zeólita elíptica ZSM-5, ZSM-11 e ZSM-48 (ERNST et al, 2009).
Além disso, deve-se considerar que as vibrações térmicas de ambos os adsorventes hospedeiros (flexibilidade da estrutura) e as moléculas hóspedes quando se comparam os resultados de diferentes experimentos de exclusão em determinada temperatura e condições de pressão. Geralmente, estruturas de zeólitas rígidas são consideradas. Acredita-se geralmente que não há influência de moléculas pequenas relativas ao diâmetro dos poros da zeólita (FRITZSCHE et al, 1998; KOPELEVICH; CHANG, 2001). Simulações por dinâmica molecular mostraram que os efeitos podem ser maiores, de fato, se o hidrocarboneto se encaixa bem nos canais da zeólita. Por exemplo, a difusividade de aromáticos na Silicalita altera sua ordem de grandeza, a magnitude da flexibilidade da estrutura é levada em conta (FORESTER; SMITH, 1997). BOUYERMAOUEN; BELLEMANS, (1998) observa-se um efeito semelhante para o n- e i-butano na zeólita Silicalita. Também para adsorção, acredita-se que a flexibilidade da estrutura é importante apenas se as moléculas hóspedes se encaixam firmemente dentro dos poros da zeólita. Exemplos de hidrocarbonetos leves em DD3R (decadodecasils 3R) (ZHU et al, 2000b), aromáticos em Silicalita (CLARK; SNURR, 1999), e naftaleno em Silicalita (KLOETSTRA et al, 1996). Neste último caso, o naftaleno com um tamanho de 0,72 x 0,38 nm2 é adsorvido pela Silicalita com área de seção transversal de 0,53 x 0,56 nm2 e
0,51 x 0,55 nm2 dos poros retos e sinusoidais, respectivamente (KLOETSTRA et al,
1996).
3.11–SEPARAÇÃODEMISTURASBINÁRIAS