UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE PRÓ-REITORIA DE PÓS-GRADUAÇÃO
CENTRO DE BIOCIÊNCIAS DEPARTAMENTO DE FISIOLOGIA
PPG-PSICOBIOLOGIA
CLARISSA LOUREIRO DAS CHAGAS CAMPÊLO
EFEITOS DA ESTIMULAÇÃO AMBIENTAL SOBRE OS ASPECTOS MOTORES, COGNITIVOS E NEURONAIS EM UM MODELO FARMACOLÓGICO
PROGRESSIVO DA DOENÇA DE PARKINSON.
CLARISSA LOUREIRO DAS CHAGAS CAMPÊLO
EFEITOS DA ESTIMULAÇÃO AMBIENTAL SOBRE OS ASPECTOS MOTORES, COGNITIVOS E NEURONAIS EM UM MODELO FARMACOLÓGICO
PROGRESSIVO DA DOENÇA DE PARKINSON.
Dissertação apresentada ao Programa de Pós-graduação em Psicobiologia da Universidade Federal do Rio Grande do Norte, como requisito para a obtenção do título de Mestre em Psicobiologia (Área Psicologia Fisiológica)
Orientadora: Profª Drª Regina Helena da Silva Co-orientadores: Profª Drª Alessandra Mussi Ribeiro Dr Jóse Ronaldo dos Santos
AGRADECIMENTOS
Vitória! Chegado esse momento, como não olhar para traz e relembrar tudo o que vivi. Os desafios, as dificuldades, o medo, a insegurança, mas também todo o amor, força e vibração positiva eu recebi dos que estavam comigo ao longo desta caminha, e que assim merecem os meus agradecimentos por terem me ajudado a chegar neste lugar.
À Deus, fonte primária de toda a minha força;
Aos meus pais Roberto e Graça, responsáveis por me tornarem quem eu sou e sempre me apoiarem, cada um a sua maneira, nas escolhas que fiz;
Às minhas irmãs Camila e Cinthia, que me lembram que os melhores amigos eu posso encontrar dentro da minha casa,
Ao meu namorado Danilo, pelo amor, pela atenção, pela força e pela compreensão, por conseguir me convencer de que eu estava no caminho certo e sempre me apoiar, por mais difícil que isto fosse;
À minha orientadora Regina Helena da Silva, que confiou em mim e me deu a oportunidade de viver tudo isto, e à minha co-orientadora Alessandra Mussi Ribeiro, que me tranquilizou quando eu achava tudo difícil no início, eu não achava que ia conseguir. Vocês são exemplos de amor e doação ao que fazem;
Ao meu co-orientador e amigo José Ronaldo dos Santos, exemplo de que ensinar é mesmo um dom. Sem a sua ajuda e disponibilidade eu não teria conseguido;
À todos do Leme, com os quais aprendi diariamente e espero aprender sempre mais;
À Aline Dierschinabel, Écliton Pereira, João Antônio, Thiago Bozena que participaram dos meus experimentos e os tornaram mais divertidos, mas especialmente à Anatildes Feitosa que, prontamente, sempre me ajudou;
Aos amigos da minha cidade Campina Grande, que sempre demonstraram interesse
Às minhas companheiras de apartamento Priscila e Raquel, com as quais partilhei as alegrias e tristezas desta vida de pós-graduação e que se tornaram minhas irmãs aqui em Natal;
Aos demais, que direta ou indiretamente me ajudaram a realizar este trabalho.
RESUMO
A doença de Parkinson (DP) é uma doença crônica e progressiva que acomete principalmente os neurônios dopaminérgicos da substância negra parte compacta (SNpc) e é caracterizada pela presença de sintomas motores , alterações cognitivas e depressão. Estudos com modelos animais da DP permitem ampliar o conhecimento dos mecanismos neuropatológicos e bioquímicos e auxiliar no desenvolvimento de novas abordagens terapêuticas. A estimulação ambiental é uma
estratégia neuroprotetora em diferentes modelos animais de dano
neurodegenerativo, inclusive na DP. Os estudos realizados até o momento priorizam as repercussões da estimulação ambiental sobre os aspectos motores e em modelos farmacológicos agudos desta patologia. O presente estudo teve como objetivo avaliar as repercussões da exposição ao ambiente enriquecido nos aspectos motores, cognitivos e neuronais (níveis de tirosina hidroxilase (TH) e fator neurotrófico derivado do encéfalo (BDNF)) no modelo progressivo da DP pela administração repetida de reserpina (RES) em camundongos. Foram utilizados 76 camundongos machos tratados repetidamente com veículo ou 0,1 mg/kg de RES (s.c), divididos em duas condições de alojamento: padrão e ambiente enriquecido. Nos animais mantidos na condição padrão, o tratamento com RES foi capaz de provocar alterações motoras (teste de catalepsia, atividade motora no campo aberto e movimentos orais) e alterações cognitivas nos teste de reconhecimento do objeto novo (RON) e na tarefa da esquiva discriminativa no labirinto. Quando iniciada antecedendo o tratamento (mas não quando iniciada concomitantemente), a estimulação ambiental retardou o aparecimento dos déficits motores avaliados pela catalepsia e facilitou a recuperação destes déficits após o final do tratamento. Além disso, a estimulação ambiental preveniu o aparecimento do déficit cognitivo no teste de RON. Na avaliação histoquímica, o tratamento com RES reduziu o número de células positivas para TH na SNpc e em VTA dos animais eutanasiados ao final das injeções. Contudo, 30 dias após o final do tratamento esse déficit foi revertido. Apesar da ANOVA ter apontado efeito do ambiente neste parâmetro, essa diferença não foi detectada pelo teste post hoc. O tratamento com RES reduziu os níveis de BDNF no estriado e na região CA3 do hipocampo e a exposição ao ambiente enriquecido impediu esse efeito no estriado. Desta forma, o protocolo de estimulação ambiental utilizado no presente estudo, quando iniciado previamente ao tratamento, foi eficiente em retardar o aparecimento dos déficits motores e acelerar a recuperação destes, além de prevenir o déficit de memória de curto prazo e evitar a redução dos níveis de BDNF. Esses resultados corroboram estudos prévios sugerindo que alterações plásticas cerebrais induzidas pelo enriquecimento ambiental promovem efeitos benéficos sobre a progressão de doenças neurodegenerativas.
ABSTRACT
Parkinson's disease (PD) is a chronic and progressive disorder that primarily affects the dopaminergic neurons of the substantia nigra pars compacta (SNpc) and is characterized by the presence of motor symptoms, cognitive impairment and depression. Studies with animal models of PD can extend current knowledge of the neuropathological and biochemical mechanisms involved in this disease, as well as contribute to the development of new therapeutic approaches. The environmental stimulation has shown neuroprotective effects in various animal models of neurodegenerative damage, including PD. Nevertheless, the previous studies focused on the effects of environmental stimulation on motor parameters, and were performed using acute pharmacological models of this disease. The present study aimed to assess the effects of exposure to an enriched environment on motor, cognitive and neuronal aspects (levels of tyrosine hydroxylase (TH) and brain derived neurotrophic factor (BDNF)) in a progressive model of Parkinson's disease by repeated administration of reserpine (RES) in mice. Male mice were repeatedly treated with vehicle or 0,1mg/kg of RES (s.c) and kept under two housing conditions: standard environment and enriched environment (EE). In animals kept in standard condition, the treatment with RES induced changes in motor function (catalepsy test, open field and oral movements) and deficits in novel object recognition (NOR) and plus-maze discriminative avoidance tasks. When initiated prior to treatment (but not when initiated concomitantly to treatment), the environmental stimulation delayed the onset of motor deficits assessed by catalepsy test and facilitated the recovery of these deficits after the end of treatment. In the histochemical evaluation, treatment with RES reduced the number of TH positive cells in SNpc and VTA of animals euthanized at the end of the injections. However, 30 days after the end of treatment this deficit was reversed. Although ANOVA has indicated an effect of environmental enrichment for this parameter, this difference was not detected by the post hoc analysis. Treatment with RES reduced levels of BDNF in the striatum and in the CA3 region of hippocampus. Exposure to the enriched environment prevented this effect in the striatum. Thus, the environmental stimulation protocol used in this study, when started before treatment, was effective in delaying the beginning and accelerating the recovery of motor deficits. Additionaly, the enriched environment prevented the deficit in short-term memory and the reduction of BDNF levels in mice. These results support previous studies which suggest that plastic brain changes induced by environmental enrichment promote beneficial effects on the progression of neurodegenerative diseases.
SUMÁRIO
LISTA DE FIGURAS ... i
LISTA DE TABELAS ... iv
LISTA DE ABREVIATURA E SIGLAS ... v
1.1. Doença de Parkinson ... 13
1.2. Mecanismos patogênicos envolvidos com a DP ... 18
1.3. Sintomas não-motores na doença de Parkinson ... 21
1.4. Modelos animais da doença de Parkinson ... 24
1.4.1. Administração de reserpina como modelo animal da doença de Parkinson .... 25
1.5. Doença de Parkinson e a influência ambiental... 28
1.5.1. Fatores neurotróficos e o enriquecimento ambiental ... 32
2. OBJETIVOS ... 35
2.1. Objetivo Geral ... 35
2.2. Objetivos específicos ... 35
3. MÉTODO ... 36
3.1. Animais ... 36
3.2. Droga ... 36
3.3. Condições de alojamento ... 37
3.4. Procedimentos gerais ... 37
3.5. Delineamento experimental ... 38
3.6. Testes Comportamentais ... 40
3.6.1. Avaliação Motora ... 40
3.6.1.1. Comportamento de Catalepsia ... 40
3.6.1.2. Movimentos Orais ... 40
3.6.1.3. Atividade motora no Campo aberto ... 41
3.6.1.4. Teste de Rotarod ... 41
3.6.2. Avaliação Cognitiva ... 42
3.6.2.1. Teste de Reconhecimento do Objeto Novo (RON) ... 42
3.6.2.2. Esquiva Discriminativa no Labirinto em Cruz Elevado (EDL)... 43
3.6.2.3. Teste de Alternação Espontânea ... 44
3.7. Análises Histológicas ... 44
3.7.1. Perfusão e processamento do cérebro ... 44
3.7.2. Imunohistoquímica para tirosina hidroxilase (TH) e fator neurotrófico derivado do encéfalo (BDNF)... 45
3.7.4. Avaliação da Densitometria Óptica Relativa (DOR) ... 47
3.8. Análise estatística ... 47
4. Resultados ... 49
4.1. Experimento I ... 49
4.1.1. Comportamento de Catalepsia ... 49
4.1.2. Fases da Catalepsia ... 50
4.1.3. Movimentos Orais ... 52
4.1.4. Atividade motora no Campo Aberto... 54
4.2. Experimento II ... 55
4.2.1. Comportamento de catalepsia ... 55
4.2.2. Fases da Catalepsia ... 57
4.2.3. Movimentos Orais ... 58
4.2.4. Atividade motora no Campo Aberto... 61
4.2.5. Teste do Rotarod ... 62
4.2.6. Reconhecimento do Objeto Novo ... 63
4.2.7. Alternação espontânea ... 66
4.2.8. Esquiva Discriminativa no Labirinto em Cruz Elevado ... 67
4.3. Contagem de Células TH+... 70
4.4. Correlações ... 73
4.5. Densidade Óptica Relativa (DOR) para BDNF... 74
5. Discussão ... 77
6. CONSIDERAÇÕES FINAIS ... 94
LISTA DE FIGURAS
Figura 1. Representação esquemática dos circuitos dos núcleos da base.... 17 Figura 2. Ilustração esquemática do delineamento experimental do
Experimento I... 39
Figura 3. Ilustração esquemática do delineamento experimental do Experimento II...
40
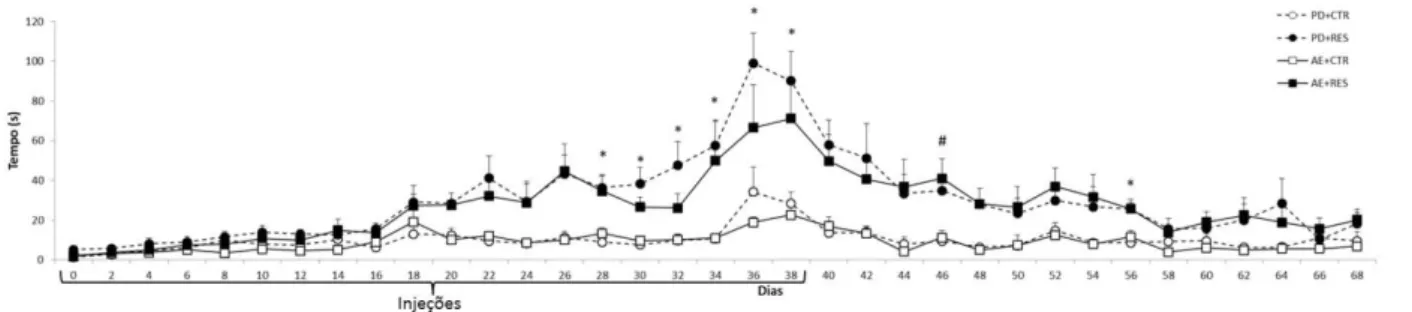
Figura 4. Duração do comportamento de catalepsia em animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
50
Figura 5. Fases da catalepsia para animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
51
Figura 6. (A) Número de movimentos mastigações no vácuo, (B) tempo de tremor oral de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
53
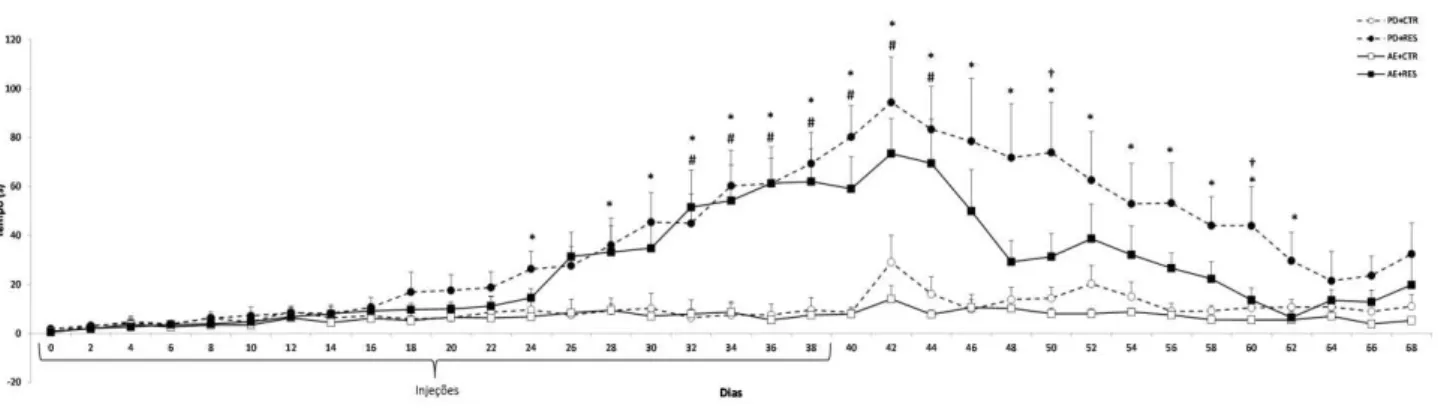
Figura 7. Duração do comportamento de catalepsia em animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
56
Figura 8. Fases da catalepsia para animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente
com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)... 58
Figura 9. (A) Número de movimentos mastigações no vácuo, (B) tempo de tremor oral de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
60
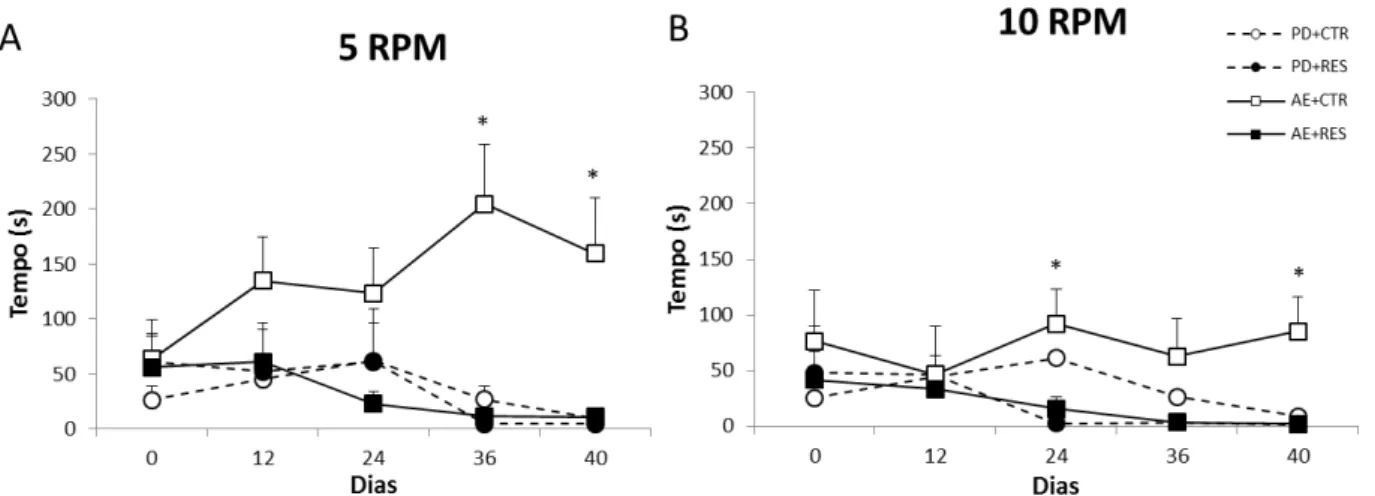
Figura 10. Latência para a queda nas velocidades de (A) 5 rpm e (B) 10 rpm de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
63
Figura 11. (A) A atividade motora nas sessões de habituação, treino e teste e (B) exploração na tarefa de reconhecimento de objetos de animais mantidos no alojamento padrão (PD) ou com ambiente
enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)... 64
Figura 12. Porcentagem de exploração na tarefa de reconhecimento de objetos nos dias (A) 10 (48 horas após a 5ª injeção) e (B) 14 (48 horas após a 7ª injeção) de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
66
Figura 13. (A) Atividade motora, (B) Taxa de alternação e (C) número de alternações de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
67
Figura 14. Distância percorrida de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
68
Figura 15. Tempo total de exploração do braço aversivo e não-aversivo nas sessões de (A) treino e (B) teste e a análise da exploração do braço aversivo em blocos de 2 minutos na sessão de teste (C) de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
69
Figura 16. (A) Porcentagem (%TAB) e (B) distância percorrida nos braços abertos na sessão de teste da tarefa da EDL de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)... 70
Figura 17. Número de células TH+ na SNpc, VTA e LC, 48 horas após a 20ª injeção (A) e 30 dias após o final do tratamento (B) de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)... 71
Figura 18. Imagens representativas da marcação para TH em VTA (A e B),
SNpc (C e D) e Locus ceruleus (E e F) de animais mantidos no
alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES) em diferentes momentos do tratamento: 48h após a 20ª injeção (A, C e E) e 30 dias após o final do tratamento (B, D e F)... 72
Figura 19. Densidade óptica relativa dos níveis de BDNF no córtex pré-frontal (CPF), estriado (EST), CA1, CA3 e giro denteado (GD) 48 horas após a 20ª injeção de animais mantidos no alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de reserpina (RES)...
75
Figura 20. Imagens representativas da marcação para BDNF no córtex
Pré-frontal (A), estriado (B) e hipocampo (C) de animais mantidos no
alojamento padrão (PD) ou com ambiente enriquecido (AE) e tratados repetidamente com veículo (CTR) ou 0,1 mg/kg de
reserpina (RES) 48h após a 20ª injeção... 76
LISTA DE TABELAS
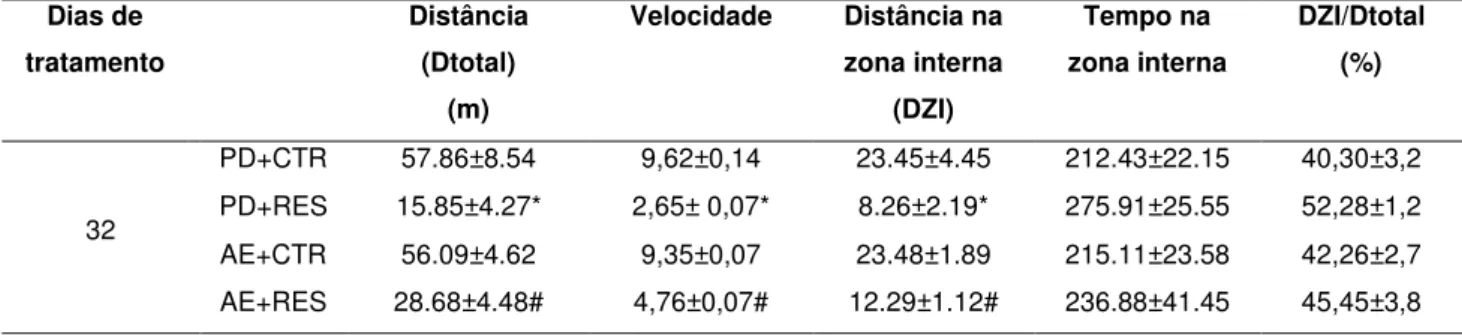
Tabela 1. Efeito do alojamento e do tratamento repetido com reserpina ou veículo na atividade motora no campo aberto, no dia 32 no Experimento I...
55 Tabela 2. Efeito do alojamento e do tratamento repetido com reserpina ou
veículo na atividade motora no campo aberto, no dia 32 no Experimento II...
62 Tabela 3. Correlações entre o número de células TH+ na SNpc, VTA e LC
e os comportamentos de catalepsia, número de mastigações no
vácuo, tempo de tremor oral e distância no CA... 74
LISTA DE ABREVIATURA E SIGLAS
Ach: Acetilcolina
AE: Ambiente enriquecido
ANOVA: Análise de variância
BDNF: Fator neurotrófico derivado do encéfalo CEUA: Comitê de ética para uso de animais
CTR: Grupo controle
DA: Dopamina
DAB: Diaminobenzidina
DAT: Transportador de dopamina
DOR: Densidade óptica relativa
DP: Doença de Parkinson
EDL: Esquiva Discriminativa no Labirinto
EPM: Erro padrão da média
ERO: Espécies reativas de oxigênio
EST: Estriado
GD: Giro denteado
GDNF: Fator neurotrófico derivado da célula glial
GSH: Glutationa peroxidase
HC: Hipocampo
MTPT: 1-metil-4-fenil-1,2,3,6-tetrahidropiridina MPP+: 1-metilfenilpiridina
PD: Padrão
LC: Locus ceruleus
L-DOPA: L-3,4-dihydroxyphenylalanine
MAO: Monoamina oxidase
NT-3: Neurotrofina 3 NT-4/5: Neurotrofina 4
PF: Pré-frontal
RES: Reserpina
RPM: Rotações por minuto
S.c.: Subcutânea
TH: Receptor para Tirosina Hidroxilase
Trk: Tirosina quinase
VMAT: Proteína transportadora vesicular
VTA: Área tegumentar ventral
6-OHDA: 6-hidroxidopamina
13 1. INTRODUÇÃO
O envelhecimento populacional é um dos maiores desafios da saúde pública
contemporânea e nos países em desenvolvimento o envelhecimento da população
tem ocorrido de forma acentuada (LIMA-COSTA; VERAS, 2003). O processo de
envelhecimento caracteriza-se pela diminuição da reserva funcional que somada aos
anos de exposição a diversos fatores de risco tornam os indivíduos vulneráveis às
doenças (COSTA, PORTO, SOARES, 2003). Dentre as enfermidades decorrentes
do envelhecimento populacional as doenças neurodegenerativas, entre elas a
Doença de Parkinson (DP), vêm se destacando devido ao aumento da incidência e
impacto negativo sobre a qualidade de vida dos indivíduos. Apesar de ser conhecida
principalmente como uma doença de ordem motora, outros sintomas comumente se
associam a DP como as alterações das funções cognitivas, endócrinas,
neurovegetativas e do comportamento (PONZONI; GARCIA-CAIRASCO, 1995)
Em vista da relevância do comprometimento físico, mental, social e
econômico decorrentes dos sintomas e das complicações secundárias da DP,
estudos utilizandomodelos experimentais com animais têm sido desenvolvidosa fim
de aumentar a compreensão das suas características clínicas, neuropatológicas e
bioquímicas, bem como auxiliar no desenvolvimento de novas abordagens
terapêuticas.
1.1. Doença de Parkinson
A Doença de Parkinson (DP) é o mais frequente distúrbio do movimento e a
segunda doença neurodegenerativa mais comum depois da doença de Alzheimer
14 como síndrome neurológica por James Parkinson, em 1817, recebendo a
denominação de “paralisia agitante” e caracterizada pela presença de movimentos
tremulantes involuntários, diminuição da força muscular, tendência à inclinação do
corpo para frente e alterações na marcha (GOETZ, 2011). Contudo, relatos
históricos como textos indianos tradicionais de aproximadamente 1000 a.c.
(MANYAM, 1990) e fontes chinesas antigas (ZHANG et al., 2006) também oferecem
descrições que sugerem casos desta doença.
Apesar da descrição de casos de início precoce, a incidência da DP aumenta
com o envelhecimento, sendo a idade o fator de risco mais consistente (LAU;
BRETELER, 2006; WIRDEFELDT et al., 2011). A DP afeta 1% da população
mundial entre 50 e 70 anos e risco de desenvolvimento da doença aumentado em
cinco vezes a partir dos 70 anos (HALD; LOTHARIUS, 2005).
A etiologia da DP é desconhecida, porém inúmeros fatores têm sido
relacionados ao processo etiopatogênico. De forma geral, é apontada como
importante fator etiológico a combinação entre os efeitos da predisposição genética
e a exposição a diversos fatores ambientais (LAU; BRETELER, 2006; WIRDEFELDT
et al., 2011).
O histórico familiar positivo para DP tem sido identificado, em estudos
epidemiológicos, como um importante fator de risco para a doença (ALLAM et al.,
2005). A descoberta de mutações monogenéticas envolvidas na DP tem permitido
atribuir o caráter hereditário da DP a mutações nos genes PINK1, parkin (PARK2),
DJ1, alfa-sinucleína (SNCA) e LRRK2 (SCHAPIRA, 2011). Tais mutações são
capazes de causar danos sobre a função mitocondrial, um dos principais eventos
envolvidos no processo patogênico da DP. Contudo, estas mutações explicam
15 dos casos aparentemente esporádica, nos quais o processo de adoecimento é
induzido por fatores não-genéticos, mas provavelmente associados a
susceptibilidade genética (LAU; BRETELER, 2006).
Os fatores ambientais capazes influenciar a expressão da DP são
reconhecidamente difíceis de identificar. A associação da exposição a toxinas
ambientais como fator de risco ao desenvolvimento da DP foi enfatizada pelo
achado de Langston, em 1983, demonstrando que a administração sistêmica de
uma toxina, o MPTP, era capaz de provocar o aparecimento da sintomatologia da
DP (LANGSTON et al., 1984; GOEDERT, 2001). Atualmente, estudos
epidemiológicos têm apontado a exposição ocupacional a pesticidas, herbicidas e
metais pesados como fatores de risco para desenvolvimento da DP, enquanto
evidenciam o potencial protetor do tabagismo, consumo de café e da prática de
atividade física e estimulação cognitiva (ANDERSEN, 2004; LAU; BRETELER, 2006;
WIRDEFELDT et al., 2011).
Fisiopatologicamente, a DP constitui-se em uma doença neurodegenerativa e
progressiva que acomete principalmente os neurônios dopaminérgicos da
substância negra, parte compacta (SNpc), resultando na redução dos níveis de
dopamina (DA) na via dopaminérgica nigroestriatal. A perda de 50 a 60% dos
neurônios dopaminérgicos na SNpc, juntamente com possíveis disfunções nos
neurônios dopaminérgicos remanescentes acarretam a redução de 70 a 80% nos
níveis de DA no estriado (ZIGMOND et al., 1993). É através desta diminuição
expressiva dos níveis de DA na via nigroestriatal que os sintomas motores, principal
caracterização da doença, se tornam manifestos (MARSDEN, 1990). Clinicamente, a
16 instabilidade postural (BLONDER; SLEVIN, 2011; MARSDEN, 1990; WIRDEFELDT
et al., 2011).
A DA possui afinidade por cinco subtipos principais de receptores
metabotrópicos, organizados nas famílias D1 (subtipos D1 e D5) e D2 (subtipos D2,
D3 e D4). Ambas as famílias de receptores dopaminérgicos possuem larga
distribuição no estriado, com ações complexas sobre os neurônios espinhosos
médios (neurônios de projeção) e efeitos opostos sobre a excitabilidade neuronal.
Os receptores da família D1 estão ligados à proteína G excitatória e possuem ação
estimulante sobre enzima adenil-ciclase, levando ao aumento da produção de
AMPcíclico e maior abertura dos canais de cálcio (BEDIN; FERRAZ, 2003); os
receptores da família D2 estão ligados à proteína G inibitória e ao serem
estimulados causam a inibição da enzima adenil–ciclase, além da diminuição da
entrada de cálcio e aumento da saída de potássio, resultando na redução da taxa de
AMPcíclico, limitando a excitabilidade da célula (BEDIN; FERRAZ, 2003; MEYER;
QUENZZER, 2005).
Em condições normais, a aferência dopaminérgica nigral modula os efeitos
glutamatérgicos dos impulsos corticoestriatais por meio da ativação da via direta
através da estimulação dos receptores do tipo D1 (excitatórios) e a simultânea
inibição da via indireta, através da estimulação dos receptores do tipo D2 (inibitórios)
(BEDIN; FERRAZ, 2003; PONZONI; GARCIA-CAIRASCO, 1995). Na via direta
(Figura 1a), a ativação dos receptores D1 no estriado (EST) leva a excitação dos
neurônios gabaérgicos que resultam na inibição dos núcleos de saída (substância
negra, zona reticulada e globo pálido interno - GPi) e, consequente, desinibição do
tálamo (TAL) e estimulação do córtex motor. Já na via indireta (Figura 1b), a
17 pálido externo (GPe) sobre o núcleo subtalâmico (NST), reduzindo a estimulação
deste último sobre os núcleos de saída (GPi), o que também leva a uma redução da
atividade inibitória sobre o tálamo. Na DP, a depleção da DA, causa a redução da
atividade destas duas vias. Há então a diminuição da ativação da via direta e a
redução da inibição da via indireta, resultando na ativação excessiva dos núcleos de
saída e excessiva inibição do tálamo, diminuindo a atividade de suas aferências para
o córtex motor, resultando nos sintomas motores (Figura 1c).
Figura 1. Representação esquemática dos circuitos dos núcleos da base. O primeiro e segundo esquemas representam o funcionamento normal das via direta e indireta. O terceiro representa o desequilíbrio da neurotransmissão na doença de Parkinson. Flechas em azul representam projeções excitatória e as em vermelho representam projeções inibitórias. Figura adaptada de Alexander e Crutcher (1990). Abreviaturas:
SN – Substância negra, EST –Estriado, GPe –Globo Pálido externo, GPi – Globo
Pálido interno, NST – Núcleo Subtalâmico, Dop – Dopamina, Glu – Glutamato.
Apesar de ser consenso o enfoque da perda de dopamina como principal fator
para os prejuízos motores na DP, alguns estudos associam a manifestação destes
prejuízos ao desequilíbrio entre os sistemas dopaminérgico e colinérgico, em vista
18 (ZHAO-SHEA et al., 2010). Em condições normais, o sistema dopaminérgico exerce
influência inibitória sobre a liberação da Ach, e com a perda dos terminais de DA há
uma redução deste controle, ocasionando a hiperatividade dos interneurônios
colinérgicos sobre o estriado, contribuindo para os movimentos anormais (PISANI,
2003).
1.2. Mecanismos patogênicos envolvidos com a DP
A principal característica neuropatológica da DP é a presença dos corpos de
Lewy, inclusões citoplasmáticas formadas por deposição proteica, ricas em α
-sinucleína, nos neurônios remanescentes (BRAAK et al., 2003). Normalmente, a
proteína α-sinucleína é expressa em todo o sistema nervoso central, com particular
abundância nos terminais pré-sinápticos, e tem ação inibitória sobre a enzima
tirosina hidroxilase reduzindo a síntese das catecolaminas (PEREZ et al., 2002). A
presença de genes mutantes de α-sinucleína provoca uma superexpressão da
proteína e disfunção do sistema ubiquitina-proteossoma, resultando em um processo
de intoxicação celular e aumento do estresse oxidativo (KOO, LEE, 2008).
Em 1919, Tretiakoff mostrou que estas inclusões são particularmente
numerosas na SN (GOEDERT, 2001). Contudo, a presença dos corpos de Lewy não
se restringe a esta estrutura, sendo também encontrados no núcleo motor do nervo
vago, hipotálamo, núcleo basal de Meynert, locus ceruleus, córtex cerebral, bulbo
olfatório e no sistema autonômico (GIBB, SCOTT, LEES,1991). Braak et al (2003)
em um estudo clínico–patológico evidenciaram que a deposição destas formações
na DP segue uma distribuição progressiva, predeterminada, com direcionamento
caudorostral. Desta forma, diferentes regiões cerebrais distinguem-se quanto a
19 corpos de Lewy pode vir a ocorrer anos antes da degeneração dos neurônios
dopaminérgicos nigrais.
Além dos corpos de Lewy, outros processos têm sido implicados na
degeneração neuronal da DP, incluindo o estresse oxidativo, disfunção mitocondrial
e a deficiência de fatores neurotróficos (WIRDEFELDT et al., 2011).
A disfunção mitocondrial e o estresse oxidativo parecem desempenhar um
papel central na patogênese da DP (SCHAPIRA, 2007, 2011). A mitocôndria tem
como principais atividades a produção de ATP pela fosforilação oxidativa e a
sinalização intracelular para apoptose (SCHAPIRA, 2007). A diminuição da
disponibilidade de ATP dificulta o armazenamento do neurotransmissor nas
vesículas sinápticas pela VMAT2, causando o aumento do nível de DA no
citoplasma, o que provavelmente resulta numa produção indireta de estresse
oxidativo gerada pelos subprodutos da DA (ANDERSEN, 2004). Na DP, a disfunção
mitocondrial parece se restringir ao complexo I, não afetando outras partes da
cadeia respiratória, e os neurônios da SNpc apresentam um prejuízo de 35% na
atividade deste complexo (SCHAPIRA, 2007).
A atividade da cadeia transportadora de elétrons mitocondrial acaba por
produzir grande quantidade de espécies reativas de oxigênio (ERO) que, em
condições normais, não resultam em dano celular, sendo estes compostos reduzidos
à água e oxigênio. Com a inibição do complexo I da cadeia respiratória, há uma
produção excessiva de ERO, a qual excede a capacidade antioxidante da célula,
levando ao estresse oxidativo. O estresse oxidativo causa dano e subsequente
morte celular devido à oxidação de componentes celulares vitais como lipídeos,
20 Características do tecido cerebral como a capacidade reduzida de
regeneração celular, a sua grande atividade energética mitocondrial e os baixos
níveis de enzimas antioxidantes torna-o bastante susceptível ao dano oxidativo
(AGUIAR; PINHO, 2007; ANDERSEN, 2004; EMERIT; EDEAS; BRICAIRE, 2004;
TER-MINASSIAN, 2006). Associado a estas características do tecido cerebral, a
elevada concentração de ferro livre no córtex frontal, hipocampo e núcleos da base
pode atuar como catalizador para a formação de novos radicais livres,
principalmente nos neurônios nigrais, onde o acúmulo de metais pesados é facilitado
pela presença da neuromelanina (SIMONIAN; COYLE, 1996; JELLINGER, 1991).
Além disso, a própria DA pode ser fonte de oxidação, especialmente sob
condições de aumento do turnover deste neurotransmissor e diminuição das defesas
antioxidantes (BERMAN; HASTINGS, 1999). A atividade das enzimas tirosina
hidroxilase e monoamina oxidase, envolvidas na produção e metabolismo da DA,
respectivamente, produzem peróxido de hidrogênio como um subproduto normal.
Além disto, a DA pode reagir não-enzimaticamente com o oxigênio formando
quinonas e semiquinonas e produção de superóxido, peróxido de hidrogênio e
radicais hidroxila (FORNSTEDT; BRUN; ROSENGREN, 1989).
Dados de estudos pos mortem dos tecidos cerebrais de pacientes com DP
mostraram a presença de altos índices de ERO nas áreas cerebrais lesionadas,
assim como apontaram diminuição dos níveis do sistema enzimático antioxidante
glutationa peroxidase (GSH) e aumento da glutationa oxidase na substância negra
(GILGUN-SHERKI; MELAMED; OFFEN, 2001; ILUNDÁIN et al., 2001; SIMONIAN;
COYLE, 1996).
Na DP, as neurotrofinas têm demonstrado importante papel neuroprotetor de
21 patologia. Modelos de dano neurodegenerativo, utilizando animais, têm mostrado
que as neurotrofinas inibem ou retardam a neurodegeneração (BEZARD et al.,
2003). Outros estudos sugerem a associação entre os altos níveis de citocinas e a
diminuição de algumas neurotrofinas como uma das causa da morte dos neurônios
dopaminérgicos na via nigroestriatal (FAHERTY et al., 2005; MOGI et al., 1999). O
BDNF parece ser um importante fator trófico para o funcionamento dos neurônios
dopaminérgicos mesencefálicos, aumentando, por exemplo, a atividade de
recaptação da DA e sua sobrevivência, inclusive para células em processos
degenerativos como o da DP (HYMAN et al., 1991; MOGI et al.,1999).
1.3. Sintomas não-motores na doença de Parkinson
Apesar do diagnóstico para a DP ser baseado na presença dos sinais
motores, ocasionados principalmente pelo prejuízo na via nigroestriatal, é cada vez
mais evidente que esta patologia apresenta-se acompanhada de manifestações
não-motoras como disfunções psiquiátricas, cognitivas, sensoriais, do sono e
autonômicas (WOOD et al., 2010).
A fisiopatologia destas manifestações não-motoras ainda não está totalmente
esclarecida, contudo sabe-se que as vias dopaminérgicas mesolímbica e
mesocortical, com neurônios originados na área tegumentar ventral (VTA), e a via
tuberoinfundibular, com neurônios originados no núcleo arqueado do hipotálamo,
também estão afetadas na DP e podem contribuir para a manifestação dos
distúrbios emocionais e cognitivos e distúrbios do sono, respectivamente,
evidenciados na patologia (BLONDER; SLEVIN, 2011; LINDGREN; DUNNETT,
22 satisfatoriamente a terapias dopaminérgicas, o que ressalta a necessidade da
investigação do envolvimento de outros sistemas de neurotransmissão nesta
sintomatologia (TAYLOR; GREENE; MILLER, 2011). Evidências sugerem que a
disfunção das vias noradrenérgica (degeneração do locus ceruleus), serotonérgica
(degeneração dos núcleos da rafe) e colinérgica (degeneração do núcleo basal de
Meynert) desempenham papéis importantes na etiologia dos sintomas não-motores
(SUZUKI et al., 2010).
Os sintomas depressivos são os mais frequentes achados psiquiátricos em
pacientes com DP, ocorrendo em cerca de 40% dos pacientes. Porém outros
transtornos neuropsiquiátricos também são frequentes como apatia (54%),
ansiedade (49%) e fobia social (FERRER et al., 2012; WOOD et al., 2010).
Alterações na neurotransmissão central, como o desbalanço entre os sistemas
dopaminérgico e serotonérgico, o aumento da estimulação dos receptores
dopaminérgicos na via mesocorticolímbica e a desregulação de conexões
fronto-subcorticais têm sido apontados como elementos envolvidos nas bases biológicas
dos transtornos neuropsiquiátricos na DP (BLONDER; SLEVIN, 2011; FRISINA;
HAROUTUNIAN; LIBOW, 2009; REMY et al., 2005).
A presença de déficits cognitivos em indivíduos com DP é outro achado
frequente. As alterações cognitivas estão presentes em, possivelmente, mais de
85% dos pacientes após 15 anos de evolução e há risco de desenvolvimento de
demência em aproximadamente 30 a 40% dos pacientes (EMRE, 2003). Os
primeiros indicativos da existência de comprometimento cognitivo na DP foram
apontados pelo neurologista francês Charcot, no final do século XIX (GOETZ, 2011).
As manifestações clínicas cognitivas na DP podem variar desde déficits sutis e
23 como dificuldade de planejamento, formação de conceito, uso de regras e memória
operacional (KEHAGIA; BARKER; ROBBINS, 2010) e a perda progressiva de
memória com risco de desenvolvimento de demência seis vezes maior que a
população geral (KEHAGIA; BARKER; ROBBINS, 2010; VOON; FOX, 2007;
OSANA-NUNEZ; GUISADO-MACIAS; PONS, 2011).
Evidências têm relacionado os déficits cognitivos à reduzida inervação
dopaminérgica nos sistemas nigroestriatal e mesocortical comprometendo assim a
função do córtex pré-frontal. Desta forma, pequenas perturbações na transmissão
dopaminérgica levariam a déficits cognitivos, enquanto que um alto nível de
alteração nessa neurotransmissão levaria a déficits motores, os quais poderiam até
sobrepor prejuízos cognitivos pré-existentes (SCHNEIDER, POPE-COLEMAN, 1995;
PILLON et al., 1997; OWEN et al., 1998). Entretanto, além das alterações na
transmissão dopaminérgica, a deficiência de inervação monoaminérgica,
serotonérgica e colinérgica no neocórtex de pacientes com DP têm sido propostos
como fatores concomitantes à patogênese dos déficits cognitivos (FERRER et al.,
2012). As alterações não-motoras citadas, parecem preceder o aparecimento dos
sintomas motores e costumam se agravar com a progressão da doença, fato este
demosntrado em estudos com humanos (COOPER et al., 1991; OWEN et al., 1992)
e em modelos animais de DP (SCHNEIDER; POPE-COLEMAN, 1995; CARVALHO
et al., 2006; SANTOS et al., 2013 dados submetidos).
Em vista do exposto e considerando as implicações negativas da
sintomatologia motora e não-motora sobre a qualidade de vida dos indivíduos
portadores da DP, evidencia-se o número crescente de estudos que buscam
compreender os mecanismos neuropatológicos e bioquímicos da doença, assim
24 importância do desenvolvimento de modelos pré-clínicos que permitam expandir tais
conhecimentos.
1.4. Modelos animais da doença de Parkinson
Os modelos experimentais com animais são considerados excelentes
ferramentas de investigação por serem capazes de recriar eventos patogênicos
específicos e resultados comportamentais semelhantes ao das patologias estudadas
em humanos. Na DP, o uso destes modelos tem ampliando a compreensão da sua
fisiopatologia e características clínicas, neuropatológicas e bioquímicas, bem como
permitido o desenvolvimento de novas abordagens terapêuticas (BETARBET;
SHERER; GREENAMYRE, 2002).
Os atuais modelos animais para DP baseiam-se no uso de agentes
farmacológicos (ex: reserpina e haloperidol) e neurotoxinas (ex: MPTP, 6-OHDA e
rotenona), capazes de causar a disfunção da via dopaminérgica nigroestriatal e
mimetizar a deficiência de dopamina no estriado, replicando muitos dos episódios
patológicos ou fenotípicos da DP em animais como camundongos (MEREDITH et
al., 2008), ratos (SONSALLA; ZEEVALK; GERMAN, 2008) ou primatas não humanos
(EMBORG, 2007, BLANDINI; ARMENTERO, 2012). Na área da genética, avanços
têm permitido o desenvolvimento de modelos transgênicos para a DP,
destacando-se a utilização de alterações gênicas associados a vetores virais (superexpressão da
alfa-sinucleína) (SCHNEIDER et al., 2008).
A aplicação de drogas que promovem lesão neuronal seletiva, como a
6-hidroxidopamina (6-OHDA) e a 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP)
(SCHOBER, 2004), produzem efeitos neurotóxicos específicos e irreversíveis. A
25 seletiva do complexo I mitocondrial de neurônios dopaminérgicos. Após a exposição
ao MPTP, o MPTP é metabolizado pela MAO-B glial em MPP+. O MPP+ é
transportado para dentro nos neurônios através do transportador de dopamina
(DAT), onde interfere no complexo I da cadeia respiratória. Já a administração local
da 6-OHDA, também resulta na inibição deste mesmo complexo, porém com
atuação tanto sobre os neurônios dopaminérgicos quanto noradrenérgicos. Como
exposto anteriormente, a inibição do complexo I reduz a função mitocondrial e
geração de ATP, contribuindo para produção de ERO e o dano por estresse
oxidativo (SCHAPIRA, 2007, 2011).
O modelo de MPTP tem sido considerado, atualmente, o mais congruente em
mimetizar a sintomatologia motora da DP, devido a sua capacidade de causar, em
uma administração aguda, a lesão específica nos neurônios dopaminérgicos nigrais.
Contudo, Lindgren e Dunnett (2012) ressaltam a necessidade de reavaliar os
modelos atuais de forma a alcançar modelos mais progressivos da DP e com uma
neuropatologia mais ampla do que apenas a perda dos neurônios dopaminérgicos.
Como não é possível mimetizar todos os aspectos da DP em animais, pois
ambas as classes dos modelos experimentais (tóxicos ou transgênicos) possuem
suas próprias especificidades e limitações, nenhum modelo único é adequado a
todos os estudos desenvolvidos sobre a DP. A indicação para a escolha do modelo
a ser utilizado deve ser guiada em função dos objetivos específicos propostos pelo
estudo (BLANDINI; ARMENTERO, 2012; LINDGREN; DUNNETT, 2012).
1.4.1. Administração de reserpina como modelo animal da
26 Carlsson (1957) foi o primeiro a observar que a administração sistêmica de
reserpina causava a depleção de catecolaminas cerebrais, levando a estados
acinéticos em coelhos. Depois disto, demostraram que a administração de L-DOPA
reduzia o estado acinético induzido pela reserpina, dando indícios de que este
comportamento era dependente de dopamina (CARLSSON et al., 1957). Estes
achados contribuíram para a hipótese, que veio a se confirmar em humanos, de que
os sintomas motores da DP resultavam da depleção de dopamina no sistema
nervoso central, permitindo o emprego da administração de reserpina como um
modelo animal da DP (BETARBET; SHERER; GREENAMYRE, 2002).
A reserpina é um fármaco, retirado da raiz da planta Rauwolfia serpentina,
que bloqueia a proteína transportadora vesicular (VMAT) nos terminais
pré-sinápticos monoaminérgicos (LIU et al., 1996; VERHEIJ, COOLS, 2007). Isto reduz a
disponibilidade das monoaminas nos terminais nervosos causando a depleção dos
neurotransmissores no sistema nervoso, central e periférico, o que desencadeia
sintomas como hipomobilidade, hipotermina, catalepsia, tremor e rigidez muscular
transitória (COLPAERT, 1987). Os transportadores vesiculares podem ser
diferenciados quanto a sua localização, VMAT1 é expresso na periferia e VMAT2 é
expresso primariamente no SNC. Sendo assim, a VMAT2 é essencial para a
redução da DA citoplasmática, o seu bloqueio leva ao aumento concentração deste
neurotransmissor no citosol, a qual sofre metabolização pela enzima monoamina
oxidase (MAO). Este metabolismo aumentado da DA pode levar a formação de
metabólitos reativos e peróxido de hidrogênio, os quais estão associados com o
processo de estresse oxidativo nos neurônios dopaminérgicos (ABÍLIO et al., 2004;
27 metabólitos pode causar alterações na função de proteínas e na dinâmica dos
lipídeos, eventualmente, levando a neurodegeneração (VERGO et al., 2007).
A administração aguda de reserpina foi um dos primeiros modelos animais
empregados nas pesquisas sobre DP (DUTY; JENNER, 2011), utilizado
principalmente para avaliar potenciais tratamentos farmacológicos como os efeitos
terapêuticos da L-DOPA e agonistas de receptores dopaminérgicos (CARLSSON et
al.,1957). Os efeitos da reserpina na atividade locomotora espontânea são
frequentemente utilizados como modelo dos transtornos motores na DP
(BETARBET; SHERER; GREENAMYRE, 2002; DUTY; JENNER, 2011). Além disto,
reserpina também tem sido utilizada para mimetizar a depressão (SKALISZ et al.,
2002) e déficits cognitivos, à medida que as alterações na neurotransmissão
dopaminérgica, noradrenérgica e serotonérgica têm sido implicadas nas bases
biológicas da sintomatologia não-motora da DP.
A partir da administração aguda de doses menores que as usualmente
empregadas, a reserpina promove um déficit de memória sem alterar a atividade
motora (CARVALHO et al., 2009; FERNANDES et al., 2008), e a administração
crônica de baixas doses é capaz de promover o aparecimento de alterações
cognitivas e motoras no mesmo animal (FERNANDES et al., 2012; SANTOS et al.,
2013 dados submetidos), apontando este esquema de administração como um
possível modelo animal progressivo da DP.
Entretanto, algumas limitações são apontadas ao modelo de reserpina, tais
como: os déficits motores produzidos são temporários, não ocorrem danos ao trato
nigroestriatal e a administração do fármaco causa efeitos não específicos sobre a
neurotransmissão monoaminérgica (LINDGREN; DUNNETT, 2012; NAKAGAWA et
28 fisiopatologia da DP não é restrita a danos na transmissão dopaminérgica, estando
afetados também os sistemas noradrenérgicos e serotonérgicos (JELLINGER,1991),
o que argumenta a favor do modelo de reserpina como um bom modelo em
mimetizar a neuroquímica da doença. Além disto, há relatos de que a depleção
apenas da DA em modelos animais falhou em mimetizar, simultaneamente, os
déficits motores e não-motores da doença (DELAVILLE; DEURWAERDÈRE;
BENAZZOUZ, 2011).
Adicionalmente, além da depleção monoaminérgica, já foi demonstrado que a
administração de reserpina promove dano por estresse oxidativo nos núcleos da
base (ABÍLIO et al., 2003, 2002). Dessa forma, levanta-se a hipótese de que a
indução de tais efeitos por um período longo e contínuo poderia promover alterações
motoras progressivas permanentes. Por fim, modelos com administração de
reserpina são de aplicação fácil e de baixo custo.
1.5. Doença de Parkinson e a influência ambiental
Sabe-se atualmente que o sistema nervoso, jovem ou adulto, possui a
capacidade de se modificar estrutural e funcionalmente em resposta a estímulos
externos. Contudo, a concepção do cérebro adulto como uma estrutura rígida e não
susceptível a modificações por influências ambientais permaneceu vigente por anos.
As observações de Donald Hebb (1940) contribuíram para a mudança desta
concepção. Este pesquisador observou que ratos criados como animais de
estimação em sua casa apresentavam um melhor desempenho em tarefas de
29 base nisto, Hebb foi o primeiro a propor a concepção de enriquecimento ambiental
em um contexto neurocientífico (NITHIANANTHARAJAH; HANNAN, 2006).
Bennet e colaboradores, em 1960, demostraram que ratos de laboratório
expostos a um ambiente enriquecido com estímulos sensoriais apresentavam
mudanças neurais estruturais e bioquímicas. Estudos posteriores demonstraram que
tal tipo de estimulação provocava mudanças na densidade e comprimento de
dendritos (GLOBUS et al, 1973; DIAMOND et al., 1976). Estes achados motivaram
o interesse por investigar característica plástica do sistema nervoso e a influência do
enriquecimento ambiental em diferentes aspectos do comportamento e funções
cerebrais
O ambiente enriquecido (AE) é um protocolo largamente utilizado, definido
como o aumento da estimulação cognitiva e sensorial sustentada e progressiva, com
a possibilidade de agregação de atividade física voluntária e interações sociais
complexas, visando potencializar o desenvolvimento motor e cognitivo
(KAZLAUCKAS et al., 2011; VAN PRAAG; KEMPERMANN; GAGE, 1999). Tal
estratégia permite investigar mudanças comportamentais e neuroplásticas pelo
aumento da atividade física, aumento das experiências de aprendizagem, entradas
visuais e interações sociais, ao combinar convívio social (alojamento em grupo) e
equipamentos na gaiola (brinquedos coloridos, escadas, túneis, rodas de atividade
para exercício físico voluntário) (HOFFMANN et al., 2009; KAZLAUCKAS et al.,
2011).
A contribuição isolada dos distintos elementos utilizados no enriquecimento
ambiental já foi alvo de investigação. Apesar do componente social e da
complexidade estrutural do ambiente ter participação em componentes específicos
30 completamente as alterações cerebrais e comportamentais provocadas pelo AE
(GOLDBERG et al., 2012; MADROÑAL et al., 2010; VAN PRAAG; KEMPERMANN;
GAGE, 1999). Entretanto, sabe-se que a estimulação promovida pela atividade
física, seja através do exercício voluntário ou por meio de programas de
treinamento, é capaz de promover mudanças funcionais e estruturais ao sistema
nervoso central como a melhora das funções cognitivas, aumento dos níveis de
neurotrofinas e expressão gênica, proliferação celular e recrutamento de novos
neurônios no giro denteado (VAN PRAAG; KEMPERMANN; GAGE, 1999).
Contudo, o uso isolado destes elementos falhou em reproduzir todos os
efeitos do enriquecimento ambiental. Sendo assim, parece ser a complexidade da
interação entre os elementos que compõe o AE o fator responsável por todos os
benefícios desta estratégia de estimulação, cada um desempenhando efeitos
importantes sobre componentes específicos da plasticidade cerebral (VAN PRAAG;
KEMPERMANN; GAGE, 1999).
As mudanças plásticas induzidas pelo AE ocorrem particularmente no
hipocampo e córtex cerebral (KAZLAUCKAS et al., 2011; VAN PRAAG;
KEMPERMANN; GAGE, 1999). De forma geral, longos períodos de estimulação
promovem a neurogênese, produção de fatores neurotróficos, respostas
neuroprotetoras, mudanças sinápticas estruturais (aumento das ramificações e
densidade dendrítica, expressão de proteínas sinápticas) (DINIZ et al., 2010;
ECKERT; BILKEY; ABRAHAM, 2010; HOFFMANN et al., 2009; TEATHER et al.,
2002; ZHU et al., 2011). No hipocampo, em especial, observa-se o aumento da
neurogênese e da potencialização de longo prazo, integração de novos neurônios
gerados a circuitos neuronais já existentes, fortalecimento da rede neuronal do giro
31 aprendizagem e tarefas de memória hipocampo-dependentes (MADROÑAL et al.,
2010; VAN PRAAG; KEMPERMANN; GAGE, 1999; TEATHER et al., 2002).
Todas as mudanças plásticas induzidas pelo AE possibilitam uma maior
eficiência das redes neuronais já existentes ou ainda o recrutamento de novas,
estendendo os efeitos do AE do nível celular ao funcionamento cerebral. Os
roedores expostos ao AE apresentam benefícios nas funções cognitivas observadas
pela melhora do desempenho em testes de memória espacial e não-espacial como o
labirinto aquático de Morris e o teste de reconhecimento de objetos
(BRUEL-JUNGERMAN; LAROCHE; RAMPON, 2005; VAN PRAAG; KEMPERMANN; GAGE,
1999; ZHU et al., 2011; WIDMAN; ROSELLINI, 1990). Outro efeito frequentemente
relatado da exposição ao enriquecimento ambiental é a melhora da função motora
com o aumento da atividade locomotora, exploratória e melhora da coordenação
(ANASTASÍA et al., 2009; PIETROPAOLO et al., 2006; VAN WAAS; SOFFIÉ, 1996).
Apesar dos efeitos do AE sobre a aprendizagem, memória e função motora
estarem bem documentados, os dados são menos consistentes no que se refere aos
efeitos do AE sobre a emocionalidade, sendo apontada em alguns estudos a
redução do medo e de traços de ansiedade no labirinto em cruz elevado e no campo
aberto, e uma adaptação emocional mais rápida a novas situações
(BENAROYA-MILSHTEIN et al., 2004; CHAPILLON et al., 1999; LARSSON; WINBLAD;
MOHAMMED, 2002; PIETROPAOLO et al., 2006).
Sendo assim, a exposição contínua ao AE induz desde mudanças
bioquímicas e morfológicas quanto funcionais no cérebro de animais em condições
normais, mas também em condições patológicas como em modelos animais para
32 doença de Alzheimer, Huntington e Parkinson (ver revisão NITHIANANTHARAJAH;
HANNAN, 2006).
Embora a etiologia da doença de Parkinson e os fatores envolvidos em sua
progressão não estejam bem esclarecidos, variáveis ambientais como estilos de vida
envolvendo a prática de atividades físicas e intelectuais são apontados, em estudos
epidemiológicos, como capazes de influenciar no transcorrer da doença (MORRIS,
2000; OLANOW; TATTON,1999). Clinicamente, o exercício físico e a exposição a
novas experiências têm-se mostrado efetivos na melhora das funções motoras e
cognitivas de indivíduos que sofrem com doenças neurodegenerativas (TOOLE et
al., 2000).
Estudos com modelos experimentais da doença de Parkinson mostraram
efeitos benéficos nos animais exposto ao AE, como resistência à lesão por MPTP e
melhora da função motora no modelo de 6-OHDA (BEZARD et al., 2003; FAHERTY
et al., 2005; GOLDBERG et al., 2012). Nos modelos analisados, o AE associado à
atividade física resultou, em nível celular, na diminuição da morte dos neurônios
dopaminérgicos, menor perda de dopamina estriatal, aumento das células gliais e da
expressão do fator neurotrófico derivado da glia (GDNF). Entretanto, em relação aos
aspectos funcionais, os estudos realizados até o momento priorizam as
repercussões da estimulação ambiental sobre os aspectos motores e em modelos
farmacológicos agudos desta patologia (ANATÁSIA et al., 2009; BEZARD et al.,
2003; FAHERT et al., 2005; STEINER et al., 2006; GOLDBERG et al., 2012).
33 Entre os vários mecanismos envolvidos na plasticidade neuronal, destacam-se
os fatores neurotróficos como um grupo de substância com estruturas moleculares e
mecanismos de sinalização diferentes, mas com papéis semelhantes no que se
refere ao crescimento e sobrevivência neuronal (REICHARDT, 2006). Fazem parte
dos fatores neurotróficos a família das neurotrofinas, a família do fator neurotrófico
derivado da célula glial (GDNF) e as citocinas neuropoiéticas. Entretanto,
envolvimento das neurotrofinas no desenvolvimento neuronal é o mais bem
caracterizado (GARY; BARDE, 1996; KERSCHENSTEINER et al., 2003).
As principais neurotrofinas são o fator de crescimento nervoso (NGF),
neurotrofina 3 (NT-3), neurotrofina 4 (NT-4/5) e o fator neurotrófico derivado do
encéfalo (BDNF). Exercem seus efeitos através da ligação com duas classes de
receptores transmembranais, os receptores da família tirosina quinase (Trk) e com
menor afinidade ao receptor p75 relacionado a fatores de necrose tumoral
(REICHARDT, 2006).
As neurotrofinas regulam o crescimento e sobrevivência neuronal,
plasticidade morfológica dos neurônios pela formação ou regressão da arborização
dendrítica, e os protege contra diferentes injúrias (MCALLISTER, 2000;
REICHARDT, 2006). Possuem maior expressão no desenvolvimento do sistema
nervoso em momentos de ativação de crescimento neuronal e diferenciação
(MCALLISTER, 2000), porém, apesar deste aspecto ser o mais bem caracterizado,
os efeitos dos fatores neurotróficos não estão restritos ao desenvolvimento neural.
No sistema nervoso maduro e saldável, neurotrofinas regulam mudanças
celulares adjacentes à plasticidade neuronal. Provocam mudanças adaptativas na
morfologia neuronal adulta (MCALLISTER, 2000), modulam propriedades funcionais
34 sinápticas rápidas (KAFITZ et al., 1999). Podem, ainda, atuar nos neurônios após
um dano ou durante um processo degenerativo como agente antiapoptótico,
mediando plasticidade, prevenção e redução da morte neuronal (MOHAPEL et al.,
2005; LINDVALL et al., 1994).
O BDNF é largamente expresso no hipocampo e devido a esta abundância sua
presença tem sido relacionada ao funcionamento normal desta estrutura e a
mecanismos de neuroplasticidade da aprendizagem e memória, como o LTP e a
transcrição génica via CREB(SIMPSON; KELLY, 2011; ZHU et al., 2009).
Os níveis de neurotrofinas no sistema nervoso são suscetíveis a variações
ambientais. Já foi demonstrado que manipulações ambientais como a restrição
alimentar, atividade física e as condições de alojamento causam variações nos
níveis de BDNF nas diversas áreas cerebrais como hipocampo, prosencéfalo e
rombencéfalo, córtex cerebral e, concomitantemente, alterações nas funções
cognitivas (ANASTASÍA et al., 2009; KAZLAUCKAS et al., 2011; ZHU et al., 2009).
Estudos demonstraram a expressão de RNA mensageiro para o receptor TrkB
para BDNF nos neurônios dopaminérgicos da SN (MOGI et al., 1999), e que a
exposição ao enriquecimento ambiental promoveu o aumento da expressão do
BDNF no estriado (BEZARD et al., 2003) e o aumento RNAm para o GDNF na SN
no modelo animal da DP por MPTP (FAHERTY et al., 2005).
Apesar das diferenças nos protocolos de distintos laboratórios resultarem em
variações nos dados sobre os efeitos do AE, é consenso que os animais expostos a
este paradigma são beneficiados. Tal conclusão aponta o AE como uma estratégia
promissora para conter a progressão dos danos motores e cognitivos presentes nas
desordens cerebrais e passível de uso para guiar o desenvolvimento de novas
35 2. OBJETIVOS
2.1. Objetivo Geral
Avaliar as repercussões da exposição ao ambiente enriquecido sobre
aspectos motores, cognitivos e neuronais no modelo progressivo da doença de
Parkinson, em camundongos, induzidos pela administração repetida de reserpina.
2.2. Objetivos específicos
a) Avaliar os efeitos da administração repetida de uma baixa de dose de reserpina
sobre a atividade motora e memória em camundongos;
b) Avaliar as repercussões da exposição a um ambiente enriquecido sobre a
memória e a atividade motora ao longo do tratamento repetido com reserpina e após
o final dele;
c) Avaliar os efeitos do tratamento repetido com reserpina sobre os níveis de tirosina
hidroxilase (TH) em diferentes regiões cerebrais, a curto e longo prazo;
d) Avaliar os efeitos do tratamento repetido com reserpina sobre os níveis do fator
neurotrófico derivado do cérebro (BDNF) em diferentes regiões cerebrais;
e) Investigar possíveis correlações entre as alterações comportamentais e aspectos
36 3. MÉTODO
3.1. Animais
Foram utilizados 76 camundongos Swiss machos (22 animais no Experimento I e
54 animais no Experimento II), com peso variando entre 35 e 50 gramas, idade de
cinco meses, os quais foram mantidos no biotério setorial acondicionados em
número de três a seis animais em gaiolas plásticas, medindo 33 x 40 x 17 cm, sob
ventilação e temperatura controladas (25 ± 1 ºC), com ciclo claro/escuro de 12h/12h
(luzes acesas às 06h30) e acesso livre à água e comida. Os animais utilizados neste
estudo foram tratados de acordo com a lei brasileira para uso de animais em
pesquisas (Lei nº 11.794). O estudo obteve a aprovação da Comissão de Ética no
Uso de Animais – CEUA (Protocolo nº 042/2011) da Universidade Federal do Rio
Grande do Norte.
3.2. Droga
Reserpina (ácido ester metil reserpato 3,4,5-trimetotoxicinamico, Sigma
Chemical, USA) foi dissolvida em ácido acético glacial e posteriormente diluída em
água destilada. Para o correção do pH (pH≈7) foi utilizada uma solução de NaOH
0,1M. A dose utilizada foi de 0,1 mg/kg, e a solução foi administrada em um volume
10ml/kg, por via subcutânea. O veículo (solução administrada ao grupo controle)
consistiu na mesma solução utilizada na diluição de reserpina (água destilada e
37 3.3. Condições de alojamento
Os animais foram divididos e mantidos em duas condições de alojamento
experimentais, a condição padrão (PD) ou a condição de ambiente enriquecido (AE).
Na condição de ambiente enriquecido, os animais foram estimulados através da
oferta de diferentes objetos nas gaiolas como túneis, brinquedos coloridos, locais
protegidos da luz, nidificações e rampas. Os objetos eram constituídos de materiais
como PVC, PET, borracha e papelão. Tais objetos foram trocados duas vezes por
semana e rearranjados dentro da gaiola entre as trocas. Não foram utilizadas rodas
de correr para minimizar o efeito do exercício físico. Na condição padrão não foi
oferecido nenhuma tipo de objeto de estimulação.
3.4. Procedimentos gerais
Os animais foram submetidos a um período de 5 minutos de manipulação
diariamente durante 3 dias antes do início do tratamento. Durante os procedimentos
experimentais, todas as sessões, exceto as referentes a catalepsia, movimentos
orais e rotarod, foram filmadas por uma câmera posicionada acima dos aparatos
comportamentais. Em todos os experimentos, os animais foram observados
alternadamente entre grupos. Entre as sessões comportamentais, os aparelhos
foram limpos com uma solução de etanol a 5% para evitar possíveis pistas de
odores deixados por outro animal. Os parâmetros comportamentais do teste de
reconhecimento do objeto novo, atividade motora no campo aberto e alternação
espontânea foram quantificados através do programa de rastreamento de animais
38 3.5. Delineamento experimental
Foram realizados dois experimentos. Em ambos os experimentos, os animais
foram incialmente divididos em dois grupos de alojamento, Padrão (PD) e Ambiente
Enriquecimento (AE), e estes grupos foram novamente divididos de acordo com o
tratamento, controle (CTR) e reserpina (RES).
No Experimento I (n = 22), os animais foram submetidos à estimulação ambiental
na ocasião do início da administração do tratamento farmacológico, e
permaneceram por 30 dias após o final do tratamento (Figura 2), formando assim
quatro grupos experimentais: grupo Padrão – Controle (PD+CTR: n=4), grupo
Padrão – Reserpina (PD+RES: n=6), grupo Ambiente Enriquecido – Controle
(AE+CTR: n=6) e Ambiente Enriquecido – Reserpina (AE+RES: n=6). No
Experimento II, a estimulação ambiental teve início três meses antes do início do
tratamento farmacológico (quando os animais estavam com dois meses de idade),
permanecendo durante todo este tratamento e por 30 dias após o final do mesmo
(Figura 3). Assim como no Experimento I, os animais foram divididos em quatro
grupos: PD+CTR (n=16), PD+RES (n=13), AE+CTR (n=11) e AE+RES (n=14).
O tratamento farmacológico constituiu-se em um total de 20 injeções
subcutâneas de veículo (CTR) ou reserpina (RES) ao volume de 10 ml/kg de peso
corporal, administradas em dias alternados (uma a cada 48 horas). Após o final do
tratamento farmacológico, todos os animais do Experimento I permaneceram vivos
até a reversão dos efeitos deste tratamento, quando então foram eutanasiados. No
Experimento II, parte dos animais foram eutanasiados ao final do tratamento
farmacológico (PD+CTR n=9, PD+RES n=7, AE+CTR n=5 e AE+RES n=6) e os
demais permaneceram vivos até a reversão dos efeitos deste tratamento e, então,
39 Todos os animais que participaram deste experimento foram eutanasiados,
perfundidos e os cérebros submetidos à análise imunohistoquímica para TH e
BDNF.
No Experimento I, os animais foram avaliados através dos testes
comportamentais: (1) Catalepsia (realizada diariamente); (2) Movimentos Orais
(realizado nos dias 8, 16, 24, 32, 40 e 68); (3) Atividade locomotora em Campo
aberto (realizado no dia 32), conforme o delineamento experimental mostrado na
figura 2:
Figura 2. Ilustração esquemática do delineamento experimental do Experimento I.
No experimento II os testes comportamentais utilizados foram: (1) Catalepsia
(realizada diariamente); (2) Movimentos Orais (realizado nos dias 8, 16, 24, 32, 40 e
68); (3) Atividade motora no Campo aberto (realizado nos dias 20, 30 e 40); (4)
Rotarod (realizado dia 0 - antes de iniciar o tratamento, e dias 16, 32 e 40); (5)
Reconhecimento do Objeto Novo (realizado nos dias 10 e 14); (6) Teste de
Alternação espontânea (realizado no dia 18) (7) Esquiva Discriminativa no Labirinto
em Cruz Elevado (realizado no dia 18). Delineamento experimental na figura 3.
40 Figura 3. Ilustração esquemática do delineamento experimental do Experimento II.
3.6. Testes Comportamentais 3.6.1. Avaliação Motora
3.6.1.1. Comportamento de Catalepsia
O comportamento de catalepsia foi avaliado colocando-se o animal com
ambas as patas dianteiras sobre uma barra horizontal de vidro elevada 5,0 cm da
superfície de apoio das patas traseiras. Foi medido o tempo que cada animal
permaneceu nesta posição até sair da barra. Os animais foram submetidos três
vezes consecutivas ao aparato, com um limite de 180 segundos por exposição à
barra e, então, feita a média das três mediadas. A média a cada dois dias de
tratamento (observações 24 e 48 horas após cada injeção) foi utilizada na análise
dos resultados.
3.6.1.2. Movimentos Orais
A avaliação dos parâmetros relacionados aos movimentos orais foi realizada
colocando o animal em um aquário de vidro (15 cm de altura X 10 cm largura X 15