Geovane Chacon de Carvalho
Validação de metodologia para análise de aminas bioativas em camarão
utilizando cromatografia de íons
______________________________________
Dissertação de Mestrado
Natal/RN, junho de 2014
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
Geovane Chacon de Carvalho
VALIDAÇÃO DE METODOLOGIA PARA ANÁLISE DE AMINAS BIOATIVAS EM CAMARÃO UTILIZANDO CROMATOGRAFIA DE ÍONS
Dissertação apresentada ao programa de Pós- Graduação em Química da Universidade Federal do Rio Grande do Norte como requisito à obtenção do título de Mestre em Química.
Orientadora: Profª. Drª. Maria de Fátima Vitória de Moura
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Carvalho, Geovane Chacon de
Validação de metodologia para análise de aminas bioativas em camarão utilizando cromatografia de íons / Geovane Chacon de Carvalho. – Natal, RN, 2013.
84 f.: il.
Orientadora: Maria de Fátima Vitória de Moura
Dissertação (Mestrado) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Cromatografia iônica – Dissertação. 2. Litopenaeus Vannamei – Dissertação. 3. Camarão – Dissertação. 4. Aminas Bioativas – Dissertação. I. Moura, Maria de Fátima Vitória de. II. Universidade Federal do Rio Grande do Norte. III. Título.
AGRADECIMENTOS
A Deus pelo dom da vida e pela oportunidade de mais uma conquista em minha vida.
À Universidade Federal do Rio Grande do Norte – Programa de Pós-Graduação em Química, pela oportunidade e apoio neste conquista.
A Professora Dra. Maria de Fátima Vitória de Moura pela dedicação, amizade, compreensão durante este trabalho e em toda vida acadêmica.
Ao Prof. Dr. Djalma Ribeiro Silva pelos materiais.
Aos meus tios João e Emanuel por cederem os camarões para esta pesquisa.
Ao técnico Joadir Humberto pela paciência nos ensinamentos durante o manuseio do equipamento.
À Angela Maria Fagundes da Cruz e Denise Porfirio Emerenciano pela amizade e ensinamentos durante toda minha vida acadêmica.
À Camila, Rusceli, Denise, Ângelo, Heloiza entre outros amigos que me acompanharam ao longo desta jornada.
Aos meus amigos de laboratório Heloísa, Leonardo, Genickson, Santana, Alessandra, Janaina pelos momentos agradáveis e sugestões ao longo desta pesquisa.
Aos meus pais, Ana Maria e Carlos Magno, irmão, George, e a minha noiva, Renata que com paciência e companheirismo me incentiva em todos os projetos de vida.
Aos amigos e irmãos em Cristo, Moisés, Lorena, Jonathas, Felipe, Marcella, Caio, Camilla, Rogério e Laisa agradeço a vocês pelo apoio e orações.
As coisas que o olho não viu, e o ouvido não ouviu, e não subiram ao coração do homem são as que Deus preparou para os que o amam.
Resumo
Neste trabalho trabalhou-se com a validação de uma metodologia para análise de
aminas bioativas em camarão, considerando ser este um dos principais produtos da balança
comercial norte-riograndense, mantendo o Estado do Rio Grande do Norte no topo da lista
de exportação brasileira deste produto na última década. O setor da carcinicultura brasileira
trabalha exclusivamente com o camarão cinza Litopenaeus Vannamei desde o final da
década de 1990. Este trabalho utilizou a cromatografia líquida com detector
condutimétrico, usando como fase móvel o ácido metilsulfônico 3 mM (MSA) com
gradiente e coluna C18 com fase reversa para o desenvolvimento da metodologia para
análise de aminas bioativas em camarão. Na preparação da amostra utilizou-se como
solução extrativa ácido tricloroacético a 5% (TCA). Na validação da análise das aminas
biotativas (putrescina - PUT, histamina - HIT, agmatina - AGM, espermidina - EPD e
espermina - EPN) em camarão, a faixa linear de trabalho foi de 0,1 a 2,0 mg L-1 que se
mostrou sensível, homoscedástico, com efeito de matriz, seletivo, exato e preciso. Dessa
maneira, considerada viável para determinações dessas aminas bioativas nessa matriz.
Determinou-se a concentração destas aminas em camarões frescos (AGM = 0,61 ± 0,05 mg
Kg-1, EPD = 2,57 ± 0,14 mg Kg-1 e EPN = 1,79 ± 0,11 mg Kg-1), e com tempo de
congelamento pré-determinados, no camarão cozido (AGM = 6,28 ± 0,18 mg Kg-1, EPD =
12,72 ± 0,02 mg Kg-1 e EPN = 22,30 ± 0,60 mg Kg-1), no camarão com vinte e quatro
horas de permanência à temperatura ambiente (PUT = 879,52 ± 28,12 mg Kg-1 , AGM =
848,13 ± 19,40 mg Kg-1, EPD = 13,59 ± 0,97 mg Kg-1 e ESPN = 18,47 + 1,57 mg Kg-1).
No camarão submetido a congelamento por uma semana, por duas semanas, por três
semanas e por quatro semanas, os resultados apresentaram que há um aumento no teor de
agmatina (7,31 ± 0,21 mg Kg-1) enquanto que na espermina (1,22 ± 0,14 mg Kg-1) e na
espermidina (menor que o limite de quantificação) o houve uma diminuição com o tempo
de congelamento, enquanto que há diminuição no teor de espermidina chegando a não ser
detectad. A putrescina só foi encontrada no camarão que permaneceu por 24 horas à
temperatura ambiente e a histamina não foi encontrada em nenhuma das amostras
analisadas.
Palavras-chave: Aminas Bioativas. Litopenaeus Vannamei. Camarão. Cromatografia
Abstract
In this study, we worked with the validation of a methodology for analysis of
bioactive amines in shrimp, considering it to be one of the main products of the
north-riograndense trade balance, maintaining the state of Rio Grande do Norte topped the list of
Brazilian exports of this product the last decade. The sector of the Brazilian shrimp works
exclusively with gray shrimp Litopenaeus Vannamei since the late 1990s. This study used
liquid chromatography with conductimetric detector, using as the mobile phase
methylsulfonic 3 mM acid (MSA) with gradient and phase C18 column with reverse the
development of methodology for the analysis of bioactive amines in shrimp. In the sample
preparation was used as 5% trichloroacetic acid (TCA) extraction solution. Validation
analysis of biotativas amines (putrescine - PUT, histamine - HIST, agmatine - AGM,
spermidine - EPD and spermine - EPN) in shrimp, the linear working range was 0.1 to 2.0
mg L-1 to was sensitive, homoscedastic, in effect, selective, accurate and precise array.
Thus, considered feasible for these determinations bioactive amines in this array.
Determined the concentration of these amines in fresh shrimps (AGM = 0.61 ± 0.05 mg kg
-1
EPD = 2.57 ± 0.14 mg kg-1 and EPN = 1.79 ± 0.11 mg kg-1), and freezing weather
predetermined in cooked shrimp (AGM = 6.28 ± 0.18 mg kg-1, EPD = 12.72 ± 0.02 mg kg
-1
and EPN = 22.30 ± 0.60 mg kg-1), the shrimp with twenty-four hour stay at room
temperature (PUT = 879.52 ± 28.12 mg kg-1, AGM = 848.13 ± 19.40 mg kg-1, ESPD =
13.59 ± 0.97 mg kg-1 and ESPN = 18.47 + 1.57 mg kg-1). In shrimp subjected to freezing
for a week, two weeks, three weeks and four weeks, the results showed that there is an
increase in the content of agmatine (7.31 ± 0.21 mg kg-1) while in spermine ( 1.22 ± 0.14
mg kg-1) and spermidine (below limit of quantification) there was a decrease in the freeze
time, while there is a decrease in the level of spermidine not reaching detectad. The
putrescine was only found in shrimp that remained for 24 hours at room temperature and
histamine was not found in any of the samples.
LISTA DE FIGURAS
Figura 1 - Desempenho das exportações de camarão cultivado entre janeiro e fevereiro de 2003 a
2014... 15
Figura 2 - Morfologia do Litopenaeus
vannamei... 18
Figura 3 - Algumas aminas e os seus aminoácidos
precursores... 20
Figura 4 - Classificação e estruturas químicas de algumas aminas
bioativas... 21
Figura 5 - Descarboxilação da histidina a
histamina... 23
Figura 6 - A formação de aminas por descarboxilação de aminoácidos (1), e
por aminação aldeídica
(2)... 24
Figura 7 - Esquema do cromatógrafo de
íons... 43
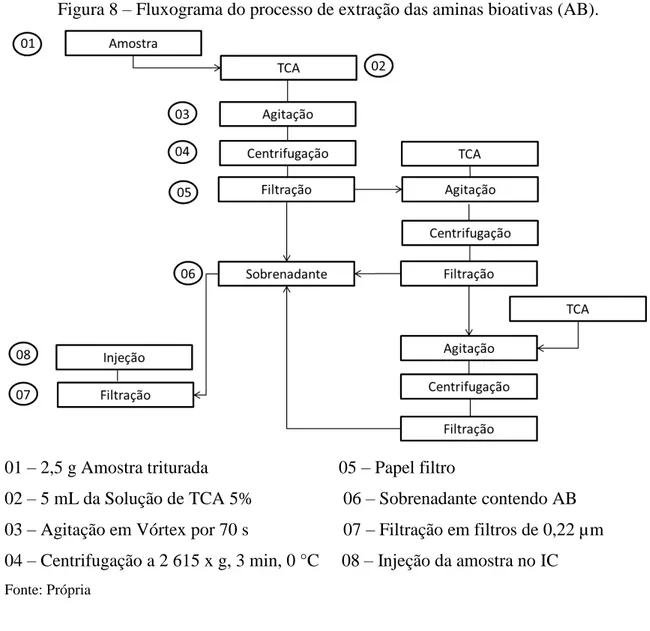
Figura 8 - Fluxograma do processo de extração das aminas biogênicas
(AB)... 45
Figura 9 - Cromatogramas dos tratamentos 1, 2 e
3... 48
Figura 10 - Cromatógrafo da matriz pura, da matriz fortificada e do padrão puro em
solvente... 49
Figura 11 - Curvas analíticas das aminas bioativas obtidas em diferentes dias de análises... 50
Figura 12 - Resíduos da regressão para as três curvas analíticas da putrescina no solvente. À esquerda as respostas dos resíduos sem o ajuste e
direita considerando o ajuste polinomial... 53
Figura 13 - Resíduos da regressão para as três curvas analíticas da histamina
no solvente... 54
Figura 14 - Resíduos da regressão para as três curvas analíticas da agmatina no solvente. À esquerda as respostas dos resíduos sem o ajuste e
direita considerando o ajuste polinomial... 55
Figura 15 - Resíduos da regressão para as três curvas analíticas da espermidina no solvente. À esquerda as respostas dos resíduos sem o ajuste e
direita considerando o ajuste polinomial... 56
Figura 16 - Resíduos da regressão para as três curvas analíticas da espermina no solvente. À esquerda as respostas dos resíduos sem o ajuste e direita considerando o ajuste
polinomial... 57
Figura 17 - Média das curvas analíticas obtidas em três dias
diferentes... 58
Figura 18 - Curvas analíticas das aminas bioativas, obtidas em diferentes dias de análises, pela fortificação do extrato da
matriz... 60
Figura 19 - Curvas analíticas do analito em solução (CAAS) e curvas
bioativas...
Figura 20 - Resíduos da regressão para as três curvas analíticas da putrescina no solvente. À esquerda as respostas dos resíduos sem o ajuste e direita considerando o ajuste
polinomial... 65
Figura 21 - Resíduos da regressão para as três curvas analíticas da histamina no solvente. À esquerda as respostas dos resíduos sem o ajuste e
direita considerando o ajuste polinomial... 66
Figura 22 - Resíduos da regressão para as três curvas analíticas da agmatina no solvente. À esquerda as respostas dos resíduos sem o ajuste e
direita considerando o ajuste polinomial... 67
Figura 23 - Resíduos da regressão para as três curvas analíticas da matriz
branca fortificada da espermidina... 68
Figura 24 - Resíduos da regressão para as três curvas analíticas da matriz
branca fortificada da espermina... 69
Figura 25 - Avaliação semanal da concentração das aminas na
amostra... 73
Figura 26 - Concentração das aminas no camarão fresco, cozido e 24 h a temperatura
LISTA DE TABELAS
Tabela 1 - Critérios de aceitação de reprodutibilidade. ... 37
Tabela 2 - Condições experimentais utilizadas no processo de extração das aminas. .... 47
Tabela 3 - Recuperação (%) das aminas em diferentes tratamentos. ... 48
Tabela 4 - Equações lineares e R2 das curvas analíticas obtidas em dias diferentes. ... 51
Tabela 5 - Equações polinomiais e R2 utilizadas para ajuste dos resíduos de regressão das aminas bioativas. ... 52
Tabela 6 - Teste de Cochran para as curvas no solvente. ... 58
Tabela 7 - Médias das equações lineares. ... 59
Tabela 8 - Média das equações polinomiais. ... 59
Tabela 9 - Equações polinomiais e R2 utilizadas para ajuste dos resíduos de regressão das aminas bioativas. ... 61
Tabela 10 - Resultado do teste F para o intercepto (b) e para a inclinação (a) das curvas analíticas. ... 62
Tabela 11 - Resultado do teste t para o intercepto (b) e para a inclinação (a) das curvas analíticas. ... 62
Tabela 12 - Médias das equações lineares das curvas analíticas da matriz branca fortificada. ... 64
Tabela 13 - Equações polinomiais e R2 usados nos ajustes dos resíduos das aminas. ... 64
Tabela 14 - Teste de Cochran para as curvas analíticas das matrizes brancas fortificada...70
Tabela 15 - Limites de detecção e quantificação em mg L-1. ... 70
Tabela 16 - Coeficiente de Variação (CV%) das aminas bioativas. ... 71
LISTA DE ABREVIATURAS E NOMENCLATURAS
TCA – Ácido tricloro acético
WSSV – White Spot Syndrome Virus
FDA – United States Food and Drug Administration ANVISA – Agencia Nacional de Vigilância Sanitária INMETRO – Instituto de Metrologia
CAAS – Curva Analítica de Analíto em Solvente
CCEMBF – Curva Analítica da Matriz Branca Fortificada CLAE/HPLC - Cromatografia Líquida de Alta Eficiência ppm – Partes por milhão
LD – Limite de Detecção LQ – Limite de Quantificação
LDM – Limite de Detecção do Método LDE - Limite de Detecção do Equipamento LQM – Limite de Quantificação do Método LQE – Limite de Quantificação do Equipamento CF – Camarão Fresco
CC – Camarão Cozido
CS1 – Camarão Congelado por uma Semana CS2 – Camarão Congelado por duas Semanas CS3 – Camarão Congelado por três Semanas CS4 – Camarão Congelado por quatro Semanas
C24 – Camarão Deixado a Temperatura Ambiente por 24 Horas CCF - Cromatografia em Camada Fina
CFG - Cromatografia em Fase Gasosa EC - Eletroforese Capilar
IUPAC - International Union of Pure and Applied Chemistry
CDC – Center for Deseases Control / Centros de Controle e Prevenção de Doenças AB – Aminas Bioativas
SUMÁRIO
1 INTRODUÇÃO... 14
2 OBJETIVOS... 17
2.1 OBJETIVOS GERAIS... 17
2.2 OBJETIVOS ESPECÍFICOS... 17
3 REVISÃO DA LITERATURA... 18
3.1 CARACTERÍSTICA DO CAMARÃO LITOPENAEUS VANNAMEI... 18
3.1.1 Classificação... 18
3.1.2 Habitat... 18
3.1.3 Melhoramento genético do camarão Cultivado... 18
3.2 AMINAS BIOGÊNICAS... 19
3.2.1 Classificação... 19
3.2.2 Importância Fisiologica... 19
3.2.3 Síntese... 24
3.2.4 Aminas bioativas em alimentos... 25
3.2.5 Aminas bioativas em pescados... 25
3.2.6 Aspectos toxicológicos das aminas biogênicas... 26
3.2.7 Legislação... 29
3.2.8 Análises químicas para determinação de aminas bioativas... 30
3.3 VALIDAÇÃO DE MÉTODOS ANALÍTICOS... 31
3.3.1 Seletividade... 32
3.3.2 Efeito de Matriz... 33
3.3.3 Linearidade... 34
3.3.4 Precisão... 35
3.3.4.1 Precisão intermediária ou reprodutibilidade intralaboratorial... 37
3.3.4.2 Critérios de aceitação da precisão´... 37
3.3.5 Exatidão... 38
3.3.5.1 Ensaios de recuperação... 38
3.3.6 Limite de detecção e limite de quantificação... 39
3.3.7 Sensibilidade... 41
3.4 CROMATOGRAFIA... 41
3.4.1 Cromatografia de íons... 41
3.4.2 Detector e sistemas de supressão... 42
4 MATERIAL E MÉTODOS... 44
4.1 REAGENTES E SOLVENTES... 44
4.2 MÉTODO... 44
4.2.1 Condições do cromatógrafo... 45
5 RESULTADOS E DISCUSSÃO... 47
5.1 PROCESSO DE EXTRAÇÃO DE AMINAS EM CAMARÃO... 47
5.2 VALIDAÇÃO DO MÉTODO... 49
5.2.1 Seletividade... 49
5.2.2 Linearidade... 50
5.2.3 Efeito de Matriz... 59
5.2.4 Limites de detecção e quantificação... 70
5.2.5 Precisão... 71
5.2.6 Ensaios de recuperação... 71
5.3 DETERMINAÇÃO DAS AMINAS BIOGÊNICAS EM CAMARÃO... 72
1 INTRODUÇÃO
O setor de carcinicultura brasileira trabalha exclusivamente com camarão cinza
Litopenaeus Vannamei desde o final de 1990, basicamente, quando o país começou a
expandir sua produção em termos comerciais. Apesar de em 2010 ter usado apenas
2,0% (20.000 ha) de área apropriada à produção adequada (1.000.000 ha), a
carcinicultura já é uma atividade firmemente estabelecida no cenário brasileiro,
principalmente na Região Nordeste, onde tem demonstrado a sua técnica, economia e
viabilidade ambiental, contribuindo ativamente para a redução da pobreza rural por
meio da geração de negócios oportunidades, renda e criação de postos de trabalho
permanentes (ROCHA, 2013).
Um estudo realizado pelo Ministério do Meio Ambiente em 2007
mostrou que a carcinicultura teve uma produção de 65.000,0 t, sendo esta a atividade
mais expressiva da maricultura brasileira, tendo uma participação de 82,9%. Os
camarões marinhos têm sua maior produção concentrada na região nordeste, embora
ocorra nas regiões sudeste e sul. Os estados do Rio Grande do Norte, Ceará, Bahia e
Pernambuco são os maiores produtores de camarão cultivado do Brasil (MMA, 2007).
O Rio Grande do Norte, em 2007, foi o principal estado exportador, sendo
responsável por 17,97% (US$ 55,8 milhões) das exportações globais do setor pesqueiro.
A quantidade exportada representou 27,42% da produção total do estado, isto é, 51.326
t (MMA, 2007).
O Rio Grande do Norte é um dos estados brasileiros em que a pesca e demais
atividades ligadas à obtenção de alimentos das águas têm grande impacto para sua
economia, tanto no que diz respeito ao consumo interno quanto à exportação. Em
relação ao camarão, o Rio grande do Norte foi o estado com a maior exportação de
Figura 1 - Desempenho das exportações de camarão cultivado entre janeiro e fevereiro de 2003
a 2014.
t – Toneladas Total1– Total dos principais estados exportadores do Brasil. Fonte: ABBC, 2014.
Enfermidades virais têm provocado sérios impactos econômicos nos cultivos de
camarões peneídeos nos principais países produtores, deste se destaca a doença da
mancha branca causada pelo vírus da síndrome da mancha branca (WSSV – White Spot
Syndrome Virus) (LIGHTNER, 2005). O WSSV é um patógeno que tem devastado a
indústria da carcinicultura em diversos países (LIGHTNER et al., 1998) e recentemente
é considerado o patógeno viral mais danoso de camarões no mundo (FLEGEL, 2009). A
Figura 1 ainda mostra um grande decréscimo na exportação, fato que pode ser
explicado pelos inúmeros casos de perda de camarão com relação à síndrome da
mancha branca, a qual vem atacando os viveiros de carcinicultura na última década.
A degradação dos camarões ocorre mais rapidamente do que nos peixes por
causa de alguns fatores: a alta concentração de metabólitos de baixo peso molecular
oriundos da autólise do hepatopâncreas (MADRI, 1998); substâncias não nitrogenadas e
aminoácidos livres que servem como substrato para o aumento de microrganismos e as
alterações físico-químicas degradativas como oxidação de lipídios e hidrólise de
proteínas, que formam compostos voláteis como amônia e gás sulfídrico, e não voláteis
como as aminas bioativas (MONTEIRO, 2012).
A determinação das concentrações de histamina, agmatina, tiramina, putrescina,
cadaverina, espermidina e espermina são de grande importância, não só do ponto de
alimentos que está associado com condições sanitárias inadequadas durante os
procedimentos de produção (HALÁSZ et al, 1994; BUENO-SOLANO, 2012).
Os métodos analíticos mais amplamente utilizados para identificação e
quantificação de aminas bioativas e aminoácidos são de cromatografia líquida de alta
eficiência (CLAE/HPLC) e eletroforese capilar, que são combinados com diferentes
técnicas de detecção como espectrofotometria, espectrofluorimetria, condutumetri,
amperometria e espectrometria de massa (BUENO-SOLANO, 2012). Desta maneira,
este trabalho utilizou a cromatografia liquida com detector iônico usando como solvente
para extração das aminas o ácido tricloroacético a 5% (TCA), pois possui uma
metodologia mais simples e tão eficiente quanto o HPLC de fase reversa. Para peixes e
seus produtos, o ácido tricloroacético (TCA) 5% foi mais eficiente do que o HCl 35%
2 OBJETIVOS
2.1 OBJETIVOS GERAIS
Este trabalho tem como objetivo geral validar uma metodologia para determinação de
aminas bioativas no camarão da espécie Litopenaeus vannamei.
2.2 OBJETIVOS ESPECÍFICOS
Determinar as figuras de méritos. Determinar putrescina, histamina, agmatina,
espermidina e espermina em camarão. Estudar a influência do tempo de congelamento
3 REVISÃO DA LITERATURA
3.1 CARACTERÍSTICAS DO CAMARÃO LITOPENAEUS VANNAMEI
3.1.1 Classificação
A espécie Litopenaeus vannamei pertence ao Reino Animália e é
taxonomicamente classificada segundo esquema abaixo:
Figura 2 - Morfologia do Litopenaeus vannamei.
Filo Arthropada
Sub-filo Crustacea
Classe Malacostraca
Subclasse Eumalacostraca
Superordem Eucarida
Ordem Decapoda
Subordem Dendrobranchiata
Superfamília Penaeoidea
Família Penaeidae
Gênero Litopenaeus
Espécie Litopenaeus vannamei
Fonte: Adaptado de SILVA, 2007.
3.1.2 Habitat
O Litopenaeus vannamei encontra-se naturalmente em alto mar, no Pacífico
leste, desde Sonora no México, até Tumbes no norte do Peru. Esta espécie é vastamente
cultivada em todo o hemisfério ocidental, apresentando ótimo desempenho sob o ponto
de vista produtivo (BARBIERI e OSTRENSKY NETO, 2001).
3.1.3 Melhoramento genético do camarão cultivado
O cultivo do L. vannamei é largamente disseminado nos países do ocidente. Por
resistência às doenças, os produtores têm se favorecido conseguindo matrizes com alta
eficácia de produção (CEDEÑO, 1998). A menor dependência de linhagens selvagens e
maior utilização de animais selecionados têm contribuído para a sustentabilidade da
atividade.
Segundo Preston e Clifford (2002), as preferências das fazendas que realizam
melhoramento genético em peneídeos são: desenvolver linhagens de camarão resistentes
aos vírus que tem incidência mais elevadas nos camarões; prevenir a introdução de
patógenos de animais domésticos; aumentar o número de linhagens domesticadas;
melhorar o crescimento e a uniformidade dos camarões; estudar parâmetros ideais para
seleção; analisar a variabilidade genética mediante marcadores moleculares e
desenvolver linhagens selecionadas de camarão resistentes a condições ambientais
extremas (baixa salinidade, renovação de águas não renovadas, entre outros).
3.2 AMINAS BIOATIVAS
3.2.1 Classificação
Aminas bioativas são compostos nitrogenados alcalinos de peso molecular
baixo, que existem naturalmente nas plantas, animais e microrganismos e desempenham
efeitos biológicos (Bruckner, et al., 2011). Estas são formadas pela descarboxilação
através de varias vias durante os processos metabólicos de animais, plantas e
microrganismos (BARDÒCZ, 1995).
A denominação das aminas bioativas, em grande parte, é em relação aos
aminoácidos precursores (Figura 3), como por exemplo, a histamina, tiramina e
triptamina, as quais se originam da histidina, tirosina e triptofano, respectivamente.
Outras têm seus nomes originados dos materiais onde foram encontrados pela primeira
vez, como a putrescina e cadaverina encontradas em estado de decomposição ou
putrefação. Já a espermina e espermidina se referem ao fluido seminal, de onde foram
Figura 3 - Algumas aminas e seus aminoácidos precursores.
Fonte: GLÓRIA, 2005; NAGATSU, 1991.
Aminas bioativas ainda são classificadas com base no número de grupos amina,
a estrutura química, a biosíntese ou as funções fisiológicas (BARDOCZ, 1995;
SILLAS-SANTOS, 1996; SMITH, 1981). De acordo com o número de grupos amina,
estas podem ser monoaminas (tiramina, feniletilamina), diaminas (histamina,
serotonina, a triptamina, putrescina e cadaverina), ou poliaminas (espermina,
espermidina e agmatina). Com base na estrutura química, as aminas podem ser
classificadas em alifáticas (putrescina, cadaverina, espermina, espermidina e agmatina),
aromáticas (tiramina e feniletilamina) e heterocíclicas (histamina, triptamina e
Figura 4 - Classificação e estruturas químicas de algumas aminas bioativas.
Fonte: GLÓRIA, 2005; NAGATSU, 1991.
Em função da via biossintética, as aminas podem ser naturais (espermina,
espermidina e histamina) ou biogênicas (histamina, serotonina, tiramina, fenietilamina,
triptamina, putrescina, cadaverina e agmatina). Estas são formadas por descarboxilação
bacteriana de aminoácidos livres. Enquanto as primeiras são formadas durante a
biossíntese, por exemplo, in situ, como requerido a partir dos seus precursores
(BARDOCZ, 1995; HALÁSZ et al., 1994). A histamina pode ser natural (armazenada
nos mastócitos ou basófilos) ou biogênica. Com base nas funções fisiológicas, as
aminas são classificadas em poliaminas, que desempenham um papel importante no
3.2.2 Importância fisiológica
As aminas bioativas desempenham importantes funções metabólicas e
fisiológicas em organismos vivos. As aminas biogênicas são geralmente psicoativa,
neuroativas ou vasoativas. A histamina e a serotonina são aminas psicoativas as quais
afetam o sistema nervoso, agindo sobre transmissores neurais no sistema nervoso
central. As aminas vasoativas atuam direta ou indiretamente no sistema vascular. As
aminas pressoras (tiramina, triptamina e feniletilamina) causam um aumento na pressão
arterial por constrição do sistema vascular, aumentando a frequencia cardíaca e a força
de contração do coração. Entretanto, a tiramina faz indiretamente, causando a liberação
da noradrenalina a partir do sistema nervoso simpático (SHALABY, 1996; SMITH,
1981). A serotonina e a histamina também são fortemente vasoativas (RICE et al,
1976).
A histamina é uma substância biologicamente ativa poderosa que pode exercer
muitas funções fisiológicas. Embora os mastócitos e os basófilos do sangue contenham
grandes quantidades de histamina armazenada em grânulos especiais, os efeitos da
histamina não parecem exercer reações alérgica. A histamina exerce os seus efeitos
ligando-se a receptores nas membranas celulares, que são encontrados no sistema
cardiovascular e em várias glândulas secretoras (JOOSTEN, 1988). A histamina causa
uma forte dilatação capilar e pode produzir efeitos hipotensores. Pode estimular
diretamente o coração, causando contração ou relaxamento do músculo liso
extravascular estimulam o músculo liso do útero, do intestino e do trato respiratório,
estimulando ambos os neurônios sensoriais e motores, e controle da secreção de ácido
gástrico. Ela também é mediadora dos sintomas primários e imediatos nas respostas
alérgicas (RICE et al, 1976; SHALABY, 1996; SMITH, 1981; STRATTON et al.,
1991; TAYLOR, 1996).
A histamina é o produto da degradação microbiana da histidina devido à ação da
enzima histidina descarboxilase. As bactérias que sintetizam a histamina são em grande
parte mesófilas, a Food and Drug Administration - FDA (FDA, 2001a) diz que as
origens bacterianas que comumente são associadas com o aumento da histamina estão
Figura 5 – Reação de descarboxilação da histidina a histamina.
Fonte: CINQUINA et al, 2004
A formação de elevados níveis de histamina está correlacionada fortemente com
o número de microrganismos existentes nos alimentos ricos em histidina (legumes,
alimentos fermentados e certos pescados) (CINQUINA et al., 2004).
A serotonina é uma amina vaso e bronco-constritora, que reduz o volume e a
acidez do suco gástrico, tem um efeito antidiurético, estimula o músculo liso, e afeta o
metabolismo de hidratos de carbono (GARCIA e MARINÉ, 1983). Quando introduzida
na circulação aferente, a serotonina provoca a liberação de prostaglandina e de outras
substâncias vasoativas. A serotonina é um neurotransmissor que atua, em particular, no
sistema nervoso central. Ela está envolvida na regulação de um número de funções
importantes, incluindo o sono, a sede, a fome, o humor, a atividade sexual (GLÓRIA,
2005).
A tiramina provoca uma liberação maciça de noradrenalina. Ela tem um efeito
acentuado sobre a liberação do neurotransmissor putativo das aminas dopamina,
noradrenalina e serotonina a partir de terminais nervosos (COUTTS et al, 1986 apud
GLÓRIA, 2005).
Feniletilamina e triptamina são constituintes endógenos de vários tecidos,
incluindo o cérebro. Ambas podem atravessar a barreira hemato-cefálica com facilidade.
Grandes quantidades de feniletilamina e triptamina de comida para animais podem
entrar no sistema nervoso central e levar a efeitos colaterais de natureza psiquiátrica
(GLÓRIA, 2005). Foi relatado que a feniletilamina pode inibir a absorção de triptamina
e estimular a liberação de catecolaminas e serotonina a partir de uma variedade de
preparações de tecidos de cérebro e coração. Tem sido demonstrado que a feniletilamina
pode afetar a ligação da serotonina aos seus locais receptores no cérebro humano e de
rato. Introdução de triptamina na circulação aferente pode causar a liberação de
prostaglandinas e de outras substâncias vasoativas para a circulação sistêmica
De acordo com Drolet et al. (1986) e Bardocz (1995) espermina e espermidina,
bem como as diaminas putrescina e cadaverina, são eficientes varredores de radicais
livres em um certo número de produtos químicos e em sistemas de enzima in vitro. Eles
poderiam inibir a peroxidação lipídica e prevenir a senescência. Nível de radical
superóxido formada quer por via enzimática com a xantina oxidase ou quimicamente a
partir de riboflavina ou pirogalol foi inibida significativamente. O radical hidroxilo mais
reativo gerado pela reação de Fenton foi também eficazmente eliminado pela espermina
e espermidina. A eficácia de varrimento das poliaminas parece estar correlacionada com
o número de grupos amino (Drolet et al, 1986).
3.2.3 Sínteses
A síntese das aminas biogênicas histamina, tiramina, triptamina, feniletilamina, e
cadaverina ocorrere através de descarboxilação dos aminoácidos precursores histidina,
tirosina, triptofano, fenilalanina e lisina, respectivamente. Na síntese de serotonina, o
triptofano é transformado por hidrolase triptofano em 5-hidroxitriptofano, que é
descarboxilado por descarboxilase aminoácido aromático em 5-hidroxitriptamina ou
serotonina. A tirosina é o precursor das aminas fenólicas octopamina e sinefrina em
cítricos (SMITH, 1981).
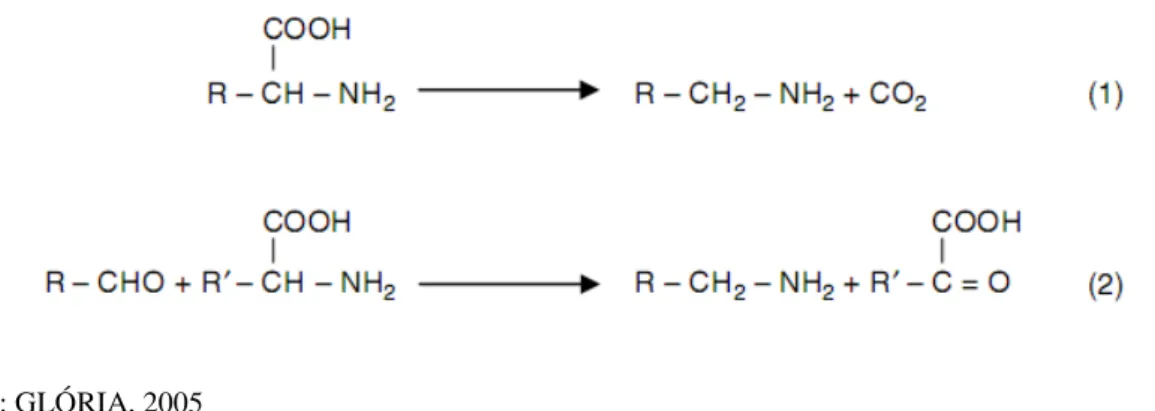
A reação geral para a descarboxilação de aminoácidos está indicada na Figura 6
Aminação aldeídica pode ser outra via de síntese, efetuada por transaminases do aldeído
(GLÓRIA, 2005).
Figura 6 – Reação de formação de aminas por descarboxilação de aminoácidos (1), e por aminação aldeídica (2).
Fonte: GLÓRIA, 2005
As condições para a formação de aminas nos alimentos dependem da
da presença de microrganismos que causam a descarboxilação, e as condições
favoráveis para o crescimento microbiano e da atividade de descarboxilase (GLÓRIA,
2005).
3.2.4 Aminas bioativas em alimentos
Aminas bioativas são inerentes aos organismos vivos e, portanto, estão presentes
em plantas, carne e produtos lácteos. A quantidade e o tipo de aminas em alimentos
dependerão da natureza e da origem do alimento. No entanto, elas podem mudar sua
concentração durante a produção, processamento, fermentação, armazenamento e
também poderá ser afetada pelas condições de higiene (SMITH, 1981; (GLÓRIA,
2005).
As aminas são resistentes a tratamento térmico utilizado no processamento de
alimentos. Com base nestes resultados, as aminas têm sido consideradas bons
indicadores do frescor, deterioração, e do grau de qualidade de produtos alimentares
frescos e processados, refletindo a qualidade da matéria-prima utilizada e das condições
higiênicas prevalentes durante o processamento (GLÓRIA, 2005).
3.2.5 Aminas bioativas em pescados
Pequenas quantidades de aminas bioativas ocorrem naturalmente em peixes. Sob
condições fisiológicas normais, o músculo de peixe contém níveis elevados de
espermina e espermidina e baixos níveis de histamina e putrescina (BARDOCZ,1995;
GLÓRIA e IZQUIERDO-PULIDO, 1999; MIETZ e KARMAS, 1977). Vários fatores
influênciam a formação de histamina em pescados: o método de pesca, práticas de
manejo pós-captura, temperatura do peixe, sistemas de refrigeração e de congelamento
durante armazenamento, tempo de armazenamento antes e pós-pesca provocando assim
uma deterioração e perda de qualidade do pescado (GLÓRIA e IZQUIERDO-PULIDO,
1999).
Os métodos de captura possuem influência em relação ao intervalo de tempo
necessário para que o rigor mortis se instale. Assim, o pescado quando submetido a um
forte estresse ao longo do processo, que antecede sua morte, terá o período de rigor
mortis reduzido devido ao gasto excessivo de glicogênio. Alguns peixes de hábitos
capturados por redes ou anzóis, prejudicando assim a sua qualidade e o tempo de
estocagem em gelo (VIEIRA, 2004).
A decomposição bacteriana apresenta-se como um dos fatores para a
deterioração do pescado. Tanto nos peixes marinhos como nos de água doce, as
bactérias distribuem-se no intestino, nas brânquias e no muco superficial. Segundo
TAYLOR (1985), o habitat aquático em que vivem influencia esta microbiota. Após a
captura, há novas fontes de contaminação (gelo, manuseio, equipamentos, pessoa) que
modificam ou aumentam a microbiota. Após a morte do animal as defesas baixam e as
bactérias começam a invadir o corpo (BERAQUET e LINDO, 1985 apud SILVA,
2008).
Segundo VIEIRA (2004) existe trinômio tempo x higiene x temperatura que é
fundamental para garantir a qualidade do pescado. O tempo refere-se à rapidez com o
qual se desencadeiam reações autolíticas e/ou bacterianas, as quais estão relacionadas
com o grau de higienização do barco, instalações frigoríficas e dos manipuladores do
pescado.
No retardamento da deterioração bacteriana, são indispensáveis: a correta
conservação do pescado sob temperaturas baixas pelo uso de gelo ou de câmaras de
refrigeração; o tratamento e filtração da água; o cuidado durante a estocagem para evitar
o esmagamento do pescado; a eliminação de resíduos; a higiene e saúde dos
manipuladores; a higienização adequada de equipamentos e das instalações
(HATHCOCK, 1982; LISTON, 1990; LUCAS, 1995; PANETTA et al., 1995).
3.2.6 Aspectos toxicológicos das aminas biogênicas
Aminas bioativas têm sido implicadas como os agentes causadores de uma série
de episódios de intoxicação alimentar, particularmente a toxicidade da histamina e da
tiramina (SHALABY, 1996; TAYLOR, 1986).
Aminas secundárias nitrosáveis (agmatina, espermina, espermidina) podem
formar nitrosaminas por reação com nitrito e produzir compostos carcinogênicos
(SMITH, 1981; HALÁSZ, 1994). Em geral, os compostos N-nitroso podem ser
formados pelas interações de aminoácidos com reagentes, tais como nitrito de
nitrificantes e óxidos de nitrogênio durante a armazenagem, conservação e cozimento de
pode afeta a coagulação do sangue, pressão arterial, batimento cardíaco e a respiração
(MAGA, 1978).
Com relação a putrescina e cadaverina, mesmo tendo menos atividade
farmacológica do que as aminas aromáticas, após a ingestão de grandes quantidades
destes compostos, os efeitos tóxicos são observados. Sintomas de intoxicação relatados
são hipotensão, bradicardia, dispnéia, tétano e paralisia das extremidades do corpo
humano. Contudo, a consequência mais importante destes compostos nos alimentos é
provavelmente o efeito de potenciação da toxicidade de outras aminas (GLÓRIA, 1999;
JOOSTEN, 1988).
Feniletilamina, como a tiramina, provoca um aumento na pressão sanguínea por
liberação noradrenalina. Feniletilamina pode ser o agente precipitante da enxaqueca
(JOOSTEN, 1988; RICE, 1976; SMITH, 1981). Níveis de 3 mg de feniletilamina
causam enxaqueca em indivíduos suscetíveis.
A intoxicação de origem alimentar mais frequente causada por aminas envolve a
histamina. A doença causada por escombrotoxinas é chamado envenenamento por
escombrotoxinas ou intoxicação por histamina. O tratamento com anti-histamínicos é
garantido quando se suspeita de envenenamento por escombrotoxinas (FDA, 2001a).
Intoxicação por histamina é também referida como "envenenamento scombrideos",
devido à sua associação com o consumo de peixe scombroid, no entanto, a intoxicação
não ocorre somente pelo consumo do peixe scombroid, o comsumo de queijo e outros
produtos alimentares, também têm sido associados em alguns casos (STRATTON et
al.,1991). Após ingerir carne de pecados que contenha altas concentrações de histamina,
em poucos minutos, desenvolve-se um quadro tóxico conhecido como
escombrotoxicose (XAVIER, RIGHI e BERNARDI, 2007).
Na maioria dos casos, os níveis de histamina causadoras de doenças excederam
200 mg kg-1 em peixes (scombrotoxic), muitas vezes acima de 500 mg kg-1. No entanto,
há alguma evidência de que outras aminas biogênicas podem também desempenhar um
papel na doença. Outras aminas biogênicas vasoativos resultantes da decomposição dos
peixes, tais como putrescina e cadaverina, também são consideradas como componentes
de escombrotoxinas (FDA, 2001a).
A determinação exata do limite de toxicidade de aminas é extremamente difícil
de ser estabelecida. A dose tóxica dependente da eficácia do mecanismo de
de tiramina, e 3 mg de 2-feniletilamina em 100 g de alimentos têm sido sugerido
(HALÁSZ, 1994).
Surtos de intoxicação por histamina também têm sido observadas em pacientes
em terapia antituberculose. Esses surtos foram associados com a interação de peixe ou
queijo contendo altos níveis de histamina com derivados de nicotinamida isoniazida e
outros (SENANAYAKE e VYRAVANATHAN, 1981, TAYLOR, 1984). A doença
manifesta-se alguns minutos a algumas horas após a ingestão da comida contendo
histamina (HUI, 1985). Em primeiro lugar, um rubor do rosto e do pescoço é
geralmente observado, acompanhado por uma sensação de calor e desconforto geral.
Muitas vezes, é seguido de uma dor de cabeça latejante intensa. Palpitações cardíacas,
tonturas, fraqueza, sede, inchaço dos lábios, urticária, pulso rápido e fraco, e queixas
gastrointestinais (cólicas abdominais, náuseas, diarréia) podem ser outros sintomas
decorrente da intoxicação.
Entretanto, os sintomas comumente detectados são pruridos, diarréia, sudorese e
dor de cabeça. Em casos graves são relatados broncoespasmos, asfixia e desconforto
respiratório grave. A recuperação é geralmente concluída no prazo de 8 h
(BARTOLOMEW, 1987; RICE et al, 1976, SHALABY, 1996; SMITH, 1981). Os
sintomas geralmente desaparecem em poucas horas, mas podem durar dias, nos casos
mais graves. As pessoas que estão fazendo uso de alguns medicamentos, incluindo
medicamentos para a tuberculose ou que têm outras condições médicas, são mais
propensos a ter reações graves (FDA, 2001a).
Duas hipóteses são utilizadas para justificar o efeito de potenciadores na
intoxicação da histamina: o rompimento da barreira e inibição de enzimas
metabolizadoras de histamina (TAYLOR, 1984 apud GLÓRIA, 2005). Na primeira
hipótese, os potenciadores iriam interferir com as ações de proteção da mucina
intestinal, que se liga à histamina e impede a sua passagem através da parede intestinal.
Tais compostos são espermina, espermidina, cadaverina, e putrescina (GLÓRIA, 2005).
Os efeitos tóxicos da histamina também podem ser potencializados pela presença de
etanol, forma direta ou indireta, inibindo a amino-oxidase (GLÓRIA et al., 1998;
RADLER-FATH, 1991).
Casos de intoxicação por histamina foram relatados nos Estados Unidos, Japão e
Reino Unido. O envenenamento por escombrotoxinas é uma das formas mais comuns
de envenenamento de peixes nos Estados Unidos (FDA, 2001a). De 1990 a 2007, surtos
acordo com os relatórios dos Centros de Controle e Prevenção de Doenças (CDC).
Acredita-se que o número efetivo dos surtos de ser muito maior do que o relatado. Vale
salientar que surtos e casos de intoxicação por histamina, muitas vezes não são
relatados, uma vez que é relativamente leve, tem curta duração e muitos pacientes não
procuram atendimento médico. Além disso, muitos médicos permanecem inconscientes
da intoxicação por histamina e não a consideram como um possível diagnóstico. Mesmo
quando o médico é procurado e um diagnóstico correto é feito, apenas alguns países
mantêm registros oficiais de intoxicação (TAYLOR, 1986).
A intoxicação por histamina transformou-se em um problema médico em quase todo
o mundo, sendo possivelmente a causa mais corriqueira da intoxicação por peixes e
outros alimentos de origem aquática, embora repetidamente seja erroneamente
diagnosticado como “infecção por Salmonella” e o mecanismo da intoxicação não esteja
totalmente esclarecido (LEHANEA e OLLEYB, 2000; RUSSEL e MARETÍC, 1986).
Xavier et al. (2007) relatam que quando há a liberação histamina, suas consequência
fisiológicas ou patológicas são causadas através da ligação com vários receptores de
superfície encontrados em diversas células-alvo. A ligação com estes diferentes
receptores pode ocasionar várias funções, como:
Vasodilatação arteriolar (onde estão envolvidos os receptores H1 e H2);
Aumento da permeabilidade dos capilares (receptor H1 é o principal envolvido); Secreção ácida gástrica (receptor H2);
Broncoconstrição (receptor H1);
Bradicardia ou Taquicardia (receptor H2);
Participação em reações alérgicas como rinites, alergia alimentar, picada de
insetos ou medicamentos, atopia e também reações anafiláticas.
3.2.7 Legislação
A United States Food and Drug Administration (FDA) estabeleceu diretrizes
regulatórias que consideram peixe contendo histamina a 50 mg kg-1 ou superior para
estar em um estado de decomposição e de peixe contendo histamina em 500 mg kg-1 ou
superior para ser um perigo para a saúde pública. A União Europeia publicou a Diretiva
do Conselho (91/493/CEE), em 1991, a qual afirma que, quando nove amostras colhidas
não deve ultrapassar 100 mg kg-1; duas amostras podem ter um valor de mais a 100 mg
kg-1, mas menos do que 200 mg kg-1, e nenhuma amostra deve ter um valor superior a
200 mg kg-1.
A dose tóxica limite de histamina nos alimentos não é conhecido com precisão,
devido à existência de potencializadores poderia influenciá-lo de forma dramática. Com
base na experiência adquirida na investigação de centenas de casos de intoxicação
histaminica, a FDA estabeleceu 10 mg/100 g como o nível de ação de risco para
histamina em atum (FDA, 1996).
No Brasil só existe a PORTARIA Nº 185, DE 13 DE MAIO DE 1997 do MAPA
(BRASIL, 1997) que diz que nas espécies pertencentes das famílias Scombridae,
Scombresocidae, Clupeidae, Coryyphaenidae o nível máximo de histamina é de 100
mg kg-1 no músculo.
3.2.8 Análises químicas para determinação de aminas bioativas
O método oficial (AOAC 977,13) para análise de histamina em frutos do mar
emprega uma extração alcoólica simples e quantificação por espectroscopia de
fluorescência. Putrescina e cadaverina podem ser analisados pela AOAC Official
Method (FDA, 1993).
FDA (2001a) descreve que as análises químicas são eficazes para determinar a
histamina na carne do pescado, contudo a quantidade de amostras requeridas para
validar as análises é grande. FDA (1998) e FDA (2001a) indicam que como a histamina
não está uniformemente espalhada na carne dos pescados decompostos, foi instituído
um nível de orientação de 50 mg kg-1, indicando que se uma porção contém este valor, é
possível que outras porções excedam 500 mg kg-1.
Vários métodos foram desenvolvidos para a análise de aminas bioativas em
alimentos: cromatografia em camada fina (CCF), cromatografia em fase gasosa (CFG),
o método de eletroforese capilar (EC) e cromatografia líquida de alta eficiência (CLAE)
(ÖNAL, 2007). No entanto, alguns deles possuem limitações, tais como a detecção de
apenas algumas aminas e a baixa resolução na detecção (VIDAL-CAROU et al., 1996).
Existem duas razões para a determinação de aminas nos alimentos: a primeira é
o seu potencial de toxicidade, a segunda é a possibilidade de utilizá-las como
marcadores de qualidade alimentar. Algumas das principais aplicações da análise de
intermediários e produtos finais, monitoramento de processos de fermentação, controle
de processos, pesquisa e desenvolvimento (ÖNAL, 2007).
Por causa da elevada seletividade e sensibilidade, a maioria dos analistas prefere
cromatografia líquida de alta eficiência de fase reversa para separação e quantificação
das aminas bioativas (BRUCKNER, 2000).
A determinação analítica de aminas biogênicas não é simples devido à
complexidade das matrizes reais a serem analisadas. A extração adequada para todas as
aminas a partir de matrizes reais é o ponto mais crítico em termos de aquisição e de
recuperação de aminas. O máximo da análise inclui o passo de derivatização que faz
com que consuma tempo no processo analítico. É preciso desenvolver métodos
analíticos mais sensíveis, menos demorados e mais fáceis para a determinação e
detecção de aminas bioativas em alimentos (ÖNAL, 2007).
3.3 VALIDAÇÃO DE MÉTODOS ANALÍTICOS
A necessidade de se estabelecer a qualidade de medidas químicas, através de sua
comparabilidade, rastreabilidade e confiabilidade, está sendo cada vez mais adotada e
exigida. Dados analíticos não confiáveis podem conduzir a decisões desastrosas e a
prejuízos financeiros irreparáveis. Para garantir que um novo método analítico gere
informações confiáveis e interpretáveis sobre a amostra, ele deve sofrer uma avaliação
denominada validação. A validação de um método é um processo contínuo que começa
no planejamento da estratégia analítica e continua ao longo de todo o seu
desenvolvimento. Para registro de novos produtos, todos os órgãos reguladores do
Brasil e de outros países exigem a validação de metodologia analítica e, para isso, a
maioria deles tem estabelecido documentos oficiais que são diretrizes a serem adotadas
no processo de validação (CAC, 1995 e WHO, 1992). Um processo de validação bem
definido e documentado oferece às agências reguladoras evidências objetivas de que os
métodos e os sistemas são adequados para o uso desejado.
Para verificar a competência de laboratórios de ensaios existe, no Brasil, duas
agencias credenciadoras: a ANVISA (Agencia Nacional de Vigilância Sanitária) e o
INMETRO (instituto Nacional de Metrologia, Normalização e Qualidade Industrial).
analíticos, tais como, a ANVISA RE nº 899 de 29/05/2003 (ANVISA, 2003), e o
documento IMETRO COO-CGCRE-008, de março/2003 (IMETRO, 2003).
A ISO também utiliza um documento técnico que define um guia para validação
de métodos analíticos que foi redigido pela IUPAC (International Union of Pure and
Applied Chemistry). A norma internacional ISO/IEC 17025 é uma norma exclusiva
para laboratórios de ensaio e de calibração, no item 5.4.5, expõe a “validação de
métodos” como um dos requisitos técnicos importantes na qualidade assegurada dos
laboratórios de ensaio, bem como a documentação do trabalho de validação (ISO/IEC
17025, 1999). O US-FDA (United States Food and Drug Administration) também
propuseram guias sobre validação de métodos (FDA, 1987 e FDA, 1993).
O laboratório está incumbido de estabelecer quais parâmetros de desempenho do
método precisam ser caracterizados a fim de validar o método (EURACHEM, 1998).
Os parâmetros de desempenho analítico, também denominados de parâmetros
analíticos, características de desempenho ou figuras analíticas de mérito, devem ser
baseados na intenção do uso do método. Desta forma, os experimentos podem ser
limitados para o que realmente é necessário. É essencial que os estudos de validação
sejam representativos e conduzidos de modo que a variação da faixa de concentração e
os tipos de amostras sejam adequados. Os parâmetros analíticos normalmente
encontrados para validação de métodos de separação são: seletividade, linearidade e
faixa de aplicação; precisão; exatidão; limite de detecção; limite de quantificação e
robustez (MAPA, 2011).
3.3.1 Seletividade
A matriz da amostra pode conter componentes que interferem no desempenho da
medição pelo detector selecionado, sem causar um sinal visível no teste de
especificidade. Os interferentes podem aumentar ou reduzir o sinal, e a magnitude do
efeito também pode depender da concentração (INMETRO, 2003).
Para os métodos cromatográficos, o desenvolvimento de uma separação envolve
a demonstração de seletividade que é a capacidade do método medir com precisão a
repostas do analito na presença de todos os componentes da amostra, a qual é
comparada com a resposta de uma solução contendo apenas o padrão (SHABIR, 2003).
A especificidade e seletividade estão relacionadas com a detecção. Um método
específico. Um método de validação de respostas com várias espécies químicas, mas
que é capaz de distinguir a resposta do analito a partir dos outros, pode ser chamado
seletivo (BRUCE, MINKKINEN, RIEKKOLA, 1998).
A seletividade garante que o pico de resposta seja unicamente do composto de
interesse (SHABIR, 2003). Se a seletividade não for assegurada, a linearidade e a
precisão estarão seriamente comprometidas (INMETRO, 2003). A seletividade é a
extensão na qual um procedimento analítico pode determinar analito(s) particular(es)
em mistura(s) ou matriz(es) sem a interferência de outros componentes de
comportamento semelhante. Portanto, é a capacidade do procedimento analítico de
discriminar entre a substância a analisar e substâncias análogas (MAPA, 2011).
A averiguação da seletividade do procedimento analítico deve ser realizada a
partir da comparação entre os sinais (resposta instrumental) oriundos do processamento
da matriz, do extrato/digerido da matriz fortificada e do analito puro em solvente
(MAPA, 2011).
Existem varias maneiras de obter a seletividade. A primeira maneira de se
avaliar a seletividade é relacionando a matriz isenta da substância de interesse e a matriz
adicionada com esta substância (padrão), sendo que, neste caso, nenhum interferente
deve eluir no tempo de retenção da substância de interesse, que deve estar bem separada
dos demais compostos presentes na amostra (CAC, 1995; ICH, 1995).
Outro método que pode ser aplicado para os estudos de seletividade é o método
de adição padrão, porém este método é utilizado quando não é possível obter a matriz
isenta da substância de interesse. Neste caso, é feita uma curva analítica com adição da
substância de interesse na amostra e comparada com uma curva analítica sem a presença
da matriz. Comparam-se, então, as duas curvas analíticas e caso elas sejam paralelas,
pode-se dizer que não há interferência da matriz na determinação da substância de
interesse, portanto o método é seletivo (JENKE, 1998).
3.3.2 Efeito de matriz
Efeito Matriz é um estudo de seletividade que objetiva averiguar possíveis
interferências causadas pelas diversas substâncias que compõem a matriz amostral,
gerando, basicamente, fenômenos de diminuição ou ampliação do sinal instrumental ou
Nem sempre se pode assumir que a matriz estar isenta de analito. Tal pode ser o
caso, por exemplo, em análises de metal por espectrofotometria de absorção atómica de
uma matriz alimentar. No entanto, é permitido supor que estas tendências serão
constantes e a curva de analítica é construída usando adições padrão em diferentes
níveis de concentração (BRUCE, MINKKINEN, RIEKKOLA, 1998).
A partir das curvas de calibração de analito puro (CCAS) e das curvas de
calibração matrizadas obtidas da fortificação de extrato (CCEMBF) deve-se verificar a
existência do efeito de matriz comparando-se os interceptos e as inclinações de cada
curva analítica (MAPA, 2011).
Após a obtenção das curvas CAAS e CAMBF deve-se aplicar o teste F
(Fischer-Snedecor), homogeneidade de variâncias, para verificar se as variâncias dos interceptos
das curvas CAAS e CAMBF são estatisticamente iguais, e logo após, verificar então o
efeito de matriz com a distribuição t Student. Se o valor de ta,cal for menor que o ta,crit,α,ν,
pode-se concluir que as curvas analíticas com as duas matrizes tem o mesmo intercepto
(b1 = b2) ou se o valor de ta,cal for maior que o ta,crit,α,ν, pode-se concluir que as curvas
analíticas com as duas matrizes tem interceptos diferentes (b1 ≠ b2). Para verificar se as
inclinações (a1 e a2) são iguais deve-se repetir os teste F e t para as inclinações (MAPA,
2011).
3.3.3 Linearidade
A linearidade corresponde à competência do método em fornecer resultados
diretamente proporcionais à concentração da substância em exame, dentro de uma
determinada faixa de aplicação (ICH, 1995).
A maioria dos equipamentos de medição existentes estabelece a sua faixa
dinâmica linear. É necessário, entretanto, verificar até que ponto a faixa de concentração
do analito coincide com a faixa dinâmica linear e assegurar que nenhum outro
fenômeno tenha impacto indesejável na resposta.
A quantificação requer que se conheça a dependência entre a resposta medida e a
concentração do analito. A linearidade é obtida por padronização interna ou externa e
formulada como expressão matemática usada para o cálculo da concentração do analito
a ser determinado na amostra real. A equação da reta que relaciona as duas variáveis é:
sendo:
y = resposta medida (absorbância, altura ou área do pico, etc.);
x = concentração;
a = interseção com o eixo y, quando x = 0;
b = inclinação da curva analítica = sensibilidade.
Matematicamente, a estimativa dos coeficientes de uma curva analítica a partir
de um conjunto de medições experimentais pode ser efetuada usando o método
matemático conhecido como regressão linear (CASSIANO et al, 2009). Além dos
coeficientes de regressão a e b, também é possível calcular, a partir dos pontos
experimentais, o coeficiente de correlação R. Este parâmetro permite uma estimativa da
qualidade da curva obtida, pois quanto mais próximo de 1,0, menor a dispersão do
conjunto de pontos experimentais e menor a incerteza dos coeficientes de regressão
estimados. A ANVISA (2003) sugere um coeficiente de correlação igual a 0,99 e o
INMETRO (2003) um valor acima de 0,90.
3.3.4 Precisão
Representa a dispersão de resultados entre ensaios independentes, repetidos de
uma mesma amostra, amostras semelhantes ou padrões, sob condições estabelecidas. As
três maneiras de expressá-la são por meio da repetitividade, da precisão intermediária
(ou reprodutibilidade interna ou reprodutibilidade intralaboratorial) e da
reprodutibilidade. Sendo que a reprodutibilidade de um procedimento analítico somente
pode ser estimada mediante a participação de um ensaio interlaboratorial colaborativo
(EC), raramente disponível (MAPA, 2011).
A precisão, comumente, é expressa como desvio padrão ou desvio padrão
relativo. Ambas repetitividade e reprodutibilidade são geralmente dependentes da
concentração do analito e, deste modo, devem ser determinadas para um diferente
número de concentrações e, em casos relevantes, a relação entre precisão e a
concentração do analito deve ser estabelecida.
Avalia-se a precisão pelo desvio padrão absoluto (σ), que utiliza um número
validação de métodos, o número de determinações é geralmente pequeno o que se
calcula é a estimativa do desvio padrão absoluto (s):
√∑ ̅
Em que ̅ é a média aritmética de um número pequeno de medições (média das
determinações), sendo uma estimativa de , a média verdadeira (média da população);
xi é o valor individual de uma medição e n é o número de medições. A precisão também
pode ser expressa através do intervalo de confiança da média, que é uma faixa de
valores no qual existe uma determinada probabilidade de se encontrar um certo valor de
uma variável, calculada pela equação:
̅ √
em que: tn-1 = valor crítico da distribuição de Student com n-1 graus de liberdade. O
valor t é tabelado e apresenta valores para diferentes níveis de confiança (INMETRO,
2003; ICH, 1995).
3.3.4.1Precisão intermediária ou reprodutibilidade intralaboratorial
O desvio padrão relativo (RSD), também conhecido como coeficiente de
variação (CV), pode ser mais útil neste caso, pois foi normalizado com base na
concentração e, deste modo, ele é praticamente constante ao longo da faixa de interesse,
contanto que esta não seja muito grande.
Onde: sr é o Desvio-padrão amostral (experimental) calculado de resultados gerados sob
condições de repetitividade; e X é o valor médio obtido dos padrões. Normalmente,
2%. Em métodos de análise de traços ou impurezas, são aceitos RSD de até 20%,
dependendo da complexidade da amostra (HUBER, 1998).
Também denominada de reprodutibilidade interna, a precisão intermediária é
avaliada sobre a mesma amostra, amostras idênticas ou padrões, utilizando o mesmo
método, mesmo laboratório, mas alterando algumas condições, tais como: dias de
análise, analistas, equipamentos e condições ambientais, entre outras, se necessário
(MAPA, 2011).
3.3.4.2Critérios de aceitação da precisão
No caso de análises repetidas de uma amostra em condições de reprodutibilidade
intralaboratorial, o coeficiente de variação intralaboratorial da média não deve exceder
aos valores da Tabela 1 (MAPA, 2011).
Tabela 1 - Critérios de aceitação de reprodutibilidade.
Concentração (c) Coeficiente de Variação (CV) (%)
C < 1 µg/Kg 35
1 µg/Kg ≤ C < 10 µg/Kg 30
10 µg/Kg ≤ C < 100 µg/Kg 20
100 µg/Kg ≤ C < 1 mg/Kg 15
1 mg/Kg ≤ C < 10 mg/Kg 10
10 mg/Kg ≤ C < 100 mg/Kg 7,3
Fonte: MAPA, 2011.
3.3.5 Exatidão
O grau de concordância entre os resultados individuais obtidos em um
determinado ensaio e um valor de referência aceito como verdadeiro representa a
exatidão (INMETRO, 2003; ICH, 1995). É importante observar que um valor exato ou
verdadeiro é o valor obtido por uma medição perfeita e este valor é indeterminado por
natureza (ISO 3534-1, 1993).
A ICH institui que deve ser obedecido um mínimo de nove determinações
em triplicata para três níveis de concentração. Esta indicação é também adotada pela
ANVISA.
Os processos mais utilizados para avaliar a exatidão de um método são:
materiais de referência; comparação de métodos; ensaios de recuperação; adição de
padrão (INMETRO, 2003).
3.3.5.1Ensaios de recuperação
A recuperação (ou fator de recuperação), R, é determinada como sendo a
proporção da quantidade da substância de interesse, presente ou adicionada na amostra
analítica do material teste, que é extraída e passível de ser quantificada (THOMPSON et
al,. 1999).
Pode-se determinar a recuperação através da fortificação de matriz branca, onde
o fator de recuperação é calculado pela equação:
Onde:
Cf = Teor medido após fortificação da matriz branca
Cnf = Teor medido na matriz branca não fortificada, i. e., antes da fortificação;
Cad = Teor do analito puro adicionado à matriz branca.
A percentagem de recuperação aceitável depende do intervalo de concentração
de amostra na matriz e do cliente relacionado e com o nível de qualidade exigido do
método. Em análises de alimentos a FDA recomenda uma faixa aceitável de 80-110%
para concentrações de analito maior que 0,10 mg kg-1 e 60-100% para concentrações de
analito abaixo de 0,1 mg kg-1 (HORWITZ, 1982). AOAC sugere um intervalo de 70 a
3.3.6 Limite de detecção e limite de quantificação
Os termos limite de quantificação (LQ) e limite de detecção (LD) são utilizados
para evidenciar a capacidade do método em quantificar/detectar baixas concentrações de
um analito.
O menor conteúdo que pode ser medido com uma certeza estatística razoável, ou
seja, a menor concentração de analito em uma amostra que pode ser detectado, mas não
necessariamente, quantificada de acordo com as condições indicadas no teste
(EURACHEM, 1998).
A ANVISA sugere que o LD seja de 2 a 3 vezes superior ao ruído da linha de
base. Entretanto, é comum o registro de vários picos cromatográficos nas amostras do
branco, o qual pode ocasionar interferência no sinal de fundo ou, até mesmo, uma
estimativa errada do ruído da linha de base e, por conseguinte, do valor de LD,
dificultando a comparação dos valores obtidos para limites de detecção entre diferentes
laboratórios.
A importância desta determinação e os problemas relacionados a ela provém do
fato de que a probabilidade de detecção não muda rapidamente de zero para um quando
seu limiar é ultrapassado. Os problemas têm sido investigados, estatisticamente, e
diversos critérios de decisão têm sido propostos. Muitas controvérsias são ocasionadas
devido ao fato de não haver atualmente uma concordância da terminologia aplicável. O
termo “limite de detecção” não é aceito por todos, apesar de ser usado em alguns
documentos setoriais (INMETRO, 2003).
O limite de detecção do equipamento (LDE) é definido como a concentração do
analito que produz um sinal de três a cinco vezes a razão ruído/sinal do equipamento. O
limite de detecção do método (LDM) é definido como a concentração mínima de uma
substância medida e declarada com 95% ou 99% de confiança de que a concentração do
analito é maior que zero. O LDM é determinado através de análise completa de uma
dada matriz contendo o analito (INMETRO, 2003).
Para a validação de um método analítico, é suficiente fornecer uma indicação do
nível em que a detecção do analito começa a ficar problemática, ou seja, “Branco + 3s”
e “ 0 + 3s “, considerando análise de sete ou mais amostras de branco e de brancos com
adição, respectivamente (INMETRO, 2003).
A partir de um número maior ou igual 7 replicatas do branco da amostra pode-se