Universidade Federal do Rio Grande do Norte Centro de Biociências
Programa de Pós-graduação em Ecologia
Borboletas no semiárido: sazonalidade e padrões de
diversidade de borboletas frugívoras em um ambiente extremo
Larissa Nascimento dos Santos
Larissa Nascimento dos Santos
Borboletas no semiárido: sazonalidade e padrões de diversidade de borboletas frugívoras em um ambiente extremo
Dissertação apresentada ao Programa de Pós-graduação em Ecologia do Centro de Biociências da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mestre em Ecologia.
Orientador: Profº. Dr. Márcio Zikán Cardoso
Comissão avaliadora:
Profº. Dr. Alexandre Fadigas Souza Profº. Dr. Onildo João Marini Filho
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Santos, Larissa Nascimento dos.
Borboletas no semiárido: sazonalidade e padrões de diversidade de borboletas frugívoras em um ambiente extremo/ Larissa Nascimento dos Santos. – Natal, RN, 2015.
60 f.: il.
Orientador: Prof. Dr. Márcio Zikán Cardoso.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Ecologia.
1. Borboletas frugívoras. – Dissertação. 2. Diversidade. – Dissertação. 3. Sazonalidade. – Dissertação. I. Cardoso, Márcio Zikán. II. Universidade Federal do Rio Grande do Norte. III. Título.
AGRADECIMENTOS
Gostaria de agradecer a todos que, de uma maneira ou de outra, contribuíram para o sucesso desse trabalho e acreditaram em mim.
Agradeço ao Profº. Márcio Zikán por ter me orientado desde a graduação, pela paciência e pelos ensinamentos acadêmicos e para a vida, inclusive por me ensinar a dirigir.
Ao José Elieudo Dias pelas instruções e auxílio no laboratório e nas coletas. Como também à Daniela Costa, Márjore Lorena, Isabela Oliveira e Profª. Priscila Moreira pelo auxílio e companhia nas coletas. Sem essas pessoas seria quase impossível realizar esse trabalho.
Aos demais atuais e ex-integrantes do Laboratório de Ecologia e Conservação da Biodiversidade (Ananda Silva, Giesta Krishna, Leonardo Machado, Marcos Brito, Marilia Lion, Priscila Lins, Vanessa Morais, Vandir Villar) pela amizade e aprendizado conjunto.
Ao técnico de laboratório Victor Hugo Gurgel pela amizade e auxílio na organização do material de coleta.
Ao pessoal do Laboratório de Ornitologia, principalmente Guilherme Lima e João Paulo Tavares, pela amizade e companhia na estrada e na ESEC Seridó.
Aos professores que compõem a banca avaliadora pela disponibilidade e contribuições. E, especificamente, ao Profº. Alexandre Fadigas pelo auxílio estatístico, e ao Profº. Onildo João Marini Filho por ter aceitado ser o avaliador externo.
Aos professores, colegas e ao Programa de Pós-graduação em Ecologia pelos ensinamentos e apoio no decorrer do curso.
À ESEC Seridó, nas pessoas dos diretores George Batista e Paulo Roberto, pela permissão das coletas e apoio. Como também, aos funcionários e seguranças pelo apoio e cuidado comigo na ESEC.
Ao Instituto Nacional do Semiárido e ao Instituto Nacional de Meteorologia pela disponibilidade dos dados meteorológicos.
Ao Profº. André Freitas pelo auxílio na identificação das borboletas.
Ao CNPQ pela bolsa e à RedeLep pelo apoio financeiro para o combustível.
Não poderia deixar de agradecer à minha família e amigos, que sempre me apoiaram e torceram pelo meu sucesso, principalmente minha mãe e irmãs também pelo auxílio com os dados. À minha mãe, em especial, por me ensinar a importância dos estudos e a lutar pela vida, e ser a principal responsável por tudo que sou. E a Levi Ramon pelo carinho, paciência e força para processeguir.
Resumo
A distribuição espaço-temporal das populações reflete o ajuste de suas características biológicas às condições ambientais e interações bióticas, conforme elementos precursores adaptativos e filogenéticos. A heterogeneidade de habitat e o clima estacional tendem a causar padrões de atividade dos organismos e de diversidade de espécies. Porém, esses padrões sazonais e espaciais em comunidades de borboletas em ambientes secos ainda não são claros. Estudamos uma comunidade de borboletas frugívoras na ESEC Seridó, no nordeste do Brasil, com o intuito de caracterizar a guilda no semiárido e verificar a contribuição relativa de variáveis climáticas e vegetacionais sobre a sua composição, diversidade e fenofaunística. As borboletas foram amostradas mensalmente, durante um ano, e a distribuição das espécies foi associada às características estruturais de três fitofisionomias (ex. riqueza e abundância de espécies arbóreo-arbustivas, cobertura de dossel, cobertura de herbáceas, serapilheira) e a dados climatológicos (temperatura, pluviosidade e umidade). Foram capturados 9580 indivíduos de 16 espécies de borboletas, pertencentes a quatro subfamílias (Biblidinae, Charaxinae, Nymphalinae e Satyrinae). A riqueza, abundância e diversidade variaram em diferentes escalas, principalmente no tempo, sendo maiores na estação chuvosa, enquanto a β-diversidade e turnover foram maiores na seca. A distribuição das espécies seguiu principalmente as mudanças de umidade, pluviosidade e fenologia vegetacional, não havendo limites definidos entre habitats. O período de voo foi compartilhado dentro das subfamílias, as quais devem ter resposta distinta aos estímulos ambientais, como também responder à fenologia de plantas hospedeiras e ter estratégias de reprodução distintas. Havendo inclusive, indícios de adaptações fisiológicas e comportamentais como reprodução sazonal e estivação. Portanto, houve controle ambiental sobre a distribuição e diversidade de espécies, com o papel chave da associação do clima e estrutura da vegetação na diferenciação da comunidade em estações do ano, e da disponibilidade e qualidade de recursos sobre a variação de abundância das espécies, em pequenas escalas. Tais resultados podem dar suporte ao biomonitoramento e conservação de áreas preservadas, sobretudo em ambientes sob pressão antrópica e de condições ambientais extremas como o semiárido.
Abstract
The spatial and temporal distribution of the population reflects the adjustment of their biological characteristics to environmental conditions and biotic interactions as adaptive and phylogenetic precursors elements. The habitat’s heterogeneity and alternating seasons tend to cause patterns of activity of organisms and species diversity. However, these seasonal and spatial patterns in butterfly communities in dry environments are not yet clear. We studied a community of frugivorous butterflies in ESEC Seridó, in northeastern Brazil, aiming to characterize the guild in semiarid and check the relative contribution of climate and vegetation variables on its composition, diversity and phenofaunistic. The butterflies were sampled monthly during one year, and the distribution of species was associated with structural characteristics of three vegetation types (eg. richness and abundance of tree and shrub species, canopy cover, herbaceous cover, litter) and climatological data (temperature, rainfall and humidity). We captured 9580 individuals of 16 species of butterflies belonging to four subfamilies (Biblidinae, Charaxinae, Nymphalinae and Satyrinae). The richness, abundance and diversity varied in different scales, especially in time, being higher in the rainy season, while the β-diversity and turnover was higher in the dry. The distribution of species mainly followed the changes in humidity, rainfall and vegetation phenology, with no defined boundaries between habitats. The flight period was shared within subfamilies, which should have distinct response to environmental stimuli, as well as respond to the phenology of host plants and have different reproductive strategies. There is even evidence of physiological and behavioral adaptations as seasonal reproduction and aestivation. So there was environmental control over the distribution and diversity of species, with the key role climate Association and vegetation structure in the community of differentiation in the seasons, and the availability and quality of resources on the variation of species abundance in small scales. These results may support the biomonitoring and conservation preserved areas, particularly in environments under human pressure and extreme environmental conditions such as semi-arid.
SUMÁRIO
INTRODUÇÃO ... 1
Distribuição de espécies e padrões de diversidade ... 1
Sazonalidade e a distribuição de espécies em ambientes secos ... 2
Borboletas no semiárido ... 3
PERGUNTAS E HIPÓTESES ... 5
MATERIAIS E MÉTODOS ... 6
Caracterização da área de estudo ... 6
Universo amostral ... 7
Organismos e metodologia de coleta... 8
Caracterização de habitat ... 10
Dados climatológicos ... 11
Análise de dados... 13
Variação das fisionomias ... 13
Descrição da comunidade ... 13
Diversidade espaço-temporal da comunidade ... 14
Influência climática e vegetacional sobre a dinâmica da comunidade ... 16
RESULTADOS ... 19
Variação das fisionomias ... 19
Descrição da comunidade ... 21
Influência climática e vegetacional sobre a dinâmica da comunidade ... 28
DISCUSSÃO ... 37
Diversidade da comunidade de borboletas ... 37
Influência climática e vegetacional sobre a dinâmica da comunidade ... 40
CONCLUSÃO ... 45
REFERÊNCIAS ... 47
1
INTRODUÇÃO
Distribuição de espécies e padrões de diversidade
Conhecer a distribuição das espécies e os elementos de história de vida em comunidades naturais é fundamental na investigação dos padrões de diversidade (Wolda 1988, DeVries et al. 2012). Os elementos da diversidade tem sido base no estudo de variações na paisagem (DeVries et al. 1999b, Crist et al. 2003), padrões entre habitats (DeVries et al. 1997, 1999b, DeVries & Walla 2001) e em escala temporal (Grøtan et al. 2012, Ribeiro 2010). Em vários contextos, os componentes da diversidade (γ, α e β) podem refletir processos passados e atuais da manifestação da variação espacial e temporal das condições climáticas, e consequente heterogeneidade ambiental sobre a distribuição das espécies (Whittaker 1972, Lande 1996, Veech et al. 2002).
A dinâmica das assembleias no espaço e no tempo reflete o ajuste de suas características biológicas às condições ambientais e interações bióticas, conforme elementos precursores adaptativos e filogenéticos (Whittaker 1972, Begon et al. 2007). Considerando os elementos da composição de habitat e paisagem, a sobrevivência e distribuição das espécies em áreas distintas e em mosaicos de habitat são determinadas predominantemente pela estrutura física e disponibilidade de recursos (Whittaker 1972, DeVries et al. 1997, Schultz et al. 2012). Já considerando os elementos abióticos, tanto em ambientes temperados como em tropicais, o clima e estações alternadas tendem a traduzir-se em padrões sazonais na atividade dos organismos (Wolda 1988). NO estudo de comunidades, esses elementos tem sido relacionados às estratégias de reprodução, competição, forrageio, antipredação, e aos mecanismo de dispersão e diapausa dos organismos (Janzen 1967, Wolda 1988, DeVries et al. 1997, Davis et al. 2007, Pozo et al. 2008), os quais, em diferentes escalas e proporções, promovem a agregação ou segregação de espécies no tempo e/ou espaço (DeVries et al. 1997, Veech et al. 2002, Hill & Hamer 2004, Begon et al. 2007, Pozo et al. 2008).
2 ambientais, sobretudo em áreas fragmentadas (Brown 1997b, Webb et al. 2002, Zanella 2003, Hill & Hamer 2004, Tylianakis et al. 2005, Uehara-Prado et al. 2005, Barlow et al. 2007b). Assim, à medida que, a combinação de processos determinísticos e estocásticos pode explicar os padrões de distribuição de espécies (Broadhead et al. 2003a, Chave 2004, Hubbell 2006, Diamond et al. 2011), estes, por sua vez, contribuem para o entendimento dos padrões de diversidade (Veech et al. 2002, Webb et al. 2002, Broadhead et al. 2003a).
Sazonalidade e a distribuição de espécies em ambientes secos
A sazonalidade é uma característica marcante das florestas secas tropicais (Broadhead et al. 2003a, Prado 2003). As formações sazonais dominantes na América fazem parte da Floresta Tropical Seca das Américas (Olson et al. 2001, Portillo-Quintero & Sánchez-Azofeifa 2010), cujos fragmentos são encontrados do México à Argentina. Na América do Sul, essa floresta seca é representada pelo Cerrado, Caatinga e Chaco Argentino-Paraguaio-Boliviano, fitofisionomias originadas a partir de mudanças climáticas durante o Pleistoceno Superior (Prado 2000, 2003). Logo, similaridade biótica e nos padrões de sazonalidade podem ocorrer nesses ambientes secos (Prado 2003).
A Caatinga, especificamente, é uma savana estépica brasileira que abrange a maior parte da região Nordeste do Brasil e a porção nordeste de Minas Gerais (Prado 2003), representando 22% da Floresta Tropical Seca das Américas (Portillo-Quintero & Sánchez-Azofeifa 2010). A ocupação humana nesta região é muito antiga, desde o período colonial, resultando em extensa modificação e redução de sua área original (MMA 2010). As formações vegetacionais da Caatinga são caracterizadas por vegetação caducifólia espinhosa e não espinhosa, brejos de altitude, corpos d’água perenes e sazonais (Prado 2003, Araújo et al. 2010), com alto grau de endemismos, inclusive de insetos (Leal et al. 2003).
3 espécies podem ocorrer em apenas uma época do ano (sazonal retrita), ocorrer durante o ano com um ou mais picos (sazonal), ou ainda não ter uma dinâmica que permita prever possíveis picos (assazonal). Nos trópicos, isso é mais complexo e pouco entendido, embora seja claro que a pluviosidade tem maior influência do que qualquer outro fator, sobretudo em regiões com estações seca e chuvosa bem distintas (Wolda 1988), como nos cerrados e caatingas da América do Sul (Prado 2003).
Ambientes secos também tendem a criar desafios adaptativos para os animais em geral. Insetos herbívoros, por exemplo, são limitados não somente pela própria fisiologia, mas também pela disponibilidade de recursos e distribuição de plantas hospedeiras (Janzen 1967, Scott 1986, Davis et al. 2007), e por limites impostos pelas adaptações das plantas às condições extremas, tais como perda de folhas, dureza foliar e espinhos (Leal et al. 2003, Pozo et al. 2008).
Estudos na Caatinga revelaram que a dinâmica da cobertura vegetal está fortemente correlacionada à sazonalidade das chuvas (Juaréz & Liu 2001, Machado et al. 1997), e, consequentemente, afeta os organismos, principalmente herbívoros (Araújo et al. 2010, Vasconcellos et al. 2010a). Como reflexo disso, o pico de abundância da maioria das espécies ocorre na estação chuvosa, como, por exemplo, abelhas, besouros e borboletas (Zanella 2003, Tylianakis et al. 2005, Nobre et al 2008, Araújo et al. 2010, Vasconcellos et al. 2010a). Além disso, a existência de manchas de habitat em pequenos fragmentos de floresta revela a predominância de insetos generalistas e a possível existência de áreas de refúgio, principalmente durante a estação seca, cuja origem pode ser histórica na formação das caatingas (Machado et al. 1997, Araújo et al. 2010, Prado 2003).
Borboletas no semiárido
4 monitoramento de mudanças na paisagem. Em geral, são bons preditores devido à sua abundância, riqueza de espécies, ciclo de vida curto, sensibilidade a distúrbios, e importância no funcionamento dos sistemas naturais (Janzen 1967, Brown 1997b, Hill & Hamer 2004, Thomas 2005, Uehara-Prado et al. 2005, Barlow et al. 2007b).
As borboletas neotropicais têm sido modelo para estudos de similaridade entre habitats e de flutuação temporal de populações e diversidade em florestas úmidas (ex. Brown 1997b, DeVries et al. 1997, 1999b, DeVries & Walla 2001, Uehara-Prado et al. 2005, Barlow et al. 2007b, Ribeiro et al. 2010, Grøtan et al. 2012). No entanto, poucos trabalhos falam dos padrões de comunidades de borboletas em semiárido, salvo, por exemplo, trabalhos no Equador (Checa et al. 2014), no México (Pozo et al. 2008, Maya-Martínez et al. 2009), na Venezuela (Shahabunddin & Terborgh 1999) e no Brasil (Pinheiro & Ortiz 1992, Nobre et al. 2008, 2012 e Zacca & Bravo 2012).
Estudos têm indicado que variáveis locais de habitat, tais como distribuição e quantidade de recurso floral, presença de hospedeira e qualidade de habitat são alguns dos determinantes da diversidade de borboletas em fragmentos florestais (Shahabunddin & Terborgh 1999, Barlow et al. 2007b, Checa et al. 2014). Por outro lado, a presença de borboletas e a atividade de cada geração tem sido associada aos fatores climáticos e vegetacionais em escala de paisagem, como pluviosidade e disponibilidade de recursos (Wolda 1988, Hamer et al. 2005, Pozo et al. 2008). Adicionalmente, a temperatura e umidade, determinantes para a taxa de desidratação de plantas e animais terrestres, são limitantes em especial para borboletas, cujas asas dependem do equilíbrio entre essas variáveis para um melhor desempenho de voo (Scolt 1986, Checa et al. 2014).
5 Em virtude da grande lacuna de conhecimento e ainda poucos esforços para a conservação no semiárido brasileiro, várias questões ecológicas permanecem sem resposta. Assim, as borboletas da Caatinga oferecem oportunidades únicas para entender a dinâmica de comunidades em ambientes extremos e ajudar a elucidar o papel da sazonalidade na estruturação dessas comunidades. Portanto, o presente trabalho tem como objetivo caracterizar a comunidade de borboletas frugívoras de uma área do semiárido brasileiro (Estação Ecológica do Seridó, Serra Negra do Norte), e compreender a sua dinâmica espaço-temporal, identificando os principais fatores ambientais e bióticos determinantes da sua composição, diversidade e fenofaunística.
PERGUNTAS E HIPÓTESES
i) Diferentes habitats e estações do ano tem diferente composição e abundância de espécies? Há complementariedade na diversidade ente habitats e ao longo do tempo?
Considerando a variação climática e da produtividade vegetal, esperamos que a riqueza, abundância e diversidade de borboletas sejam maiores na estação chuvosa e em áreas abertas (Pozo et al. 2008, Nobre et al. 2012, Checa et al. 2014). A similaridade de composição e diversidade de borboletas será baixa entre as maiores escalas de tempo e de espaço, havendo complementariedade da diversidade β (Lande 1996).
ii) As variáveis climáticas e vegetacionais contribuem diferentemente para a composição e distribuição das espécies?
As espécies serão distribuídas no tempo seguindo o gradiente climático, principalmente a pluviosidade (Wolda 1988), e no espaço seguindo a disponibilidade de recursos, concentrando-se em áreas mais abertas ricas em herbáceas (Nobre et al. 2012).
6
MATERIAIS E MÉTODOS
Caracterização da área de estudo
O estudo foi desenvolvido na Estação Ecológica do Seridó, unidade de conservação permanente, localizada no município de Serra Negra do Norte, ao sudoeste do Estado do Rio Grande do Norte (Figura 1). A ESEC Seridó (6°33’50’’ a 6°36’40’’ S, 37°14’20’’ a 37°17’10’’ W) possui área de 1.166,38 ha (IBAMA 2004) e está a aproximadamente 170 m de altitude. Antes de sua transformação em unidade de conservação, a ESEC fez parte da Fazenda Solidão, onde eram desenvolvidos pecuária e cultivo de algodão. Atualmente, é uma área de preservação permanente, com 32 anos de regeneração (IBAMA 2004).
7 A média anual de temperatura da região é de 27.5±1 °C e a precipitação é de 744.7±56 mm (Amorim et al. 2005, INSA 2014). As temperaturas médias mensais não variam muito ao longo do ano, oscilando entre 25.8 °C no mês mais frio (maio) e 31.0 °C nos meses mais quentes (novembro e dezembro) (Zanella 2003). Em anos mais chuvosos, a precipitação pode ultrapassar os 1000 mm, mas em anos secos pode ser inferior a 300 mm. Normalmente, o período de chuvas mais intensas se estende de fevereiro a abril. Além disso, contribui para o déficit hídrico a alta taxa de evapotranspiração, de 2062 mm/ano (Zanella 2003).
A vegetação da ESEC Seridó é classificada como caatinga hiperxerófila arbóreo-arbustiva (Amorim et al. 2005), com um estrato herbáceo de gramíneas do gênero Aristida, bem desenvolvido apenas na estação chuvosa (Zanella 2003). Foram registradas 164 espécies de plantas, predominantemente Leguminosae e Euphorbiaceae (IBAMA 2004). As fisionomias predominantes dentro da Estação Ecológica são savanas abertas e floresta decídua, na parte mais elevada (Serra Verde, 250-350 m de altitude). Corpos d’água (açude, riachos sazonais), ambientes rupestres e áreas ainda degradadas com manchas de solo exposto completam o restante da reserva (IBAMA 2004).
Universo amostral
8
1. Floresta aberta (FAb) - Floresta associada ao solo massapê, um tipo de solo (organossolo) caracterizado pela grande quantidade de matéria orgânica e argila, predominando áreas abertas com herbáceas e arbustos (IBAMA 2004). Parte desta fisionomia continha afloramentos rochosos.
2. Floresta arbóreo-arbustiva (FAa) - Vegetação arbóreo-arbustiva que ocorre em topografia plana, variando desde ambientes abertos, onde o estrato rasteiro é dominante e as árvores esparsas, até ambientes mais fechados com maior densidade do estrato arbóreo. Essa área é pedregosa e com solo de textura média/argilosa (luvissolo) (IBAMA 2004).
3. Floresta arbórea (FAr) - Essa classe não é distinta da vegetação savânica adjacente fisionomicamente, mas apresenta algumas espécies típicas e é a maior parte da vegetação pioneira (primária) (IBAMA 2004), com arbustos e árvores de grande porte. Há alguns cursos d’água temporários e o tipo de solo é luvissolo.
Figura 2 - Aspectos gerais das fitofisionomias na estação chuvosa (a, b, c) e estação seca (d, e, f). Floresta arbórea (a, d), Floresta aberta (b, e) e Floresta arbóreo-arbustiva (c, f).
Organismos e metodologia de coleta
9 decomposição, excrementos, exsudatos) (DeVries 1997). Essas últimas incluem as borboletas de um grupo não-monofilético formado pelas subfamílias Satyrinae, Charaxinae, Biblidinae, e a tribo Coeini (Nymphalinae), todas pertencentes à família Nymphalidae (Freitas & Brown 2004, Wahlberg et al. 2009).
As borboletas frugívoras podem ser facilmente coletadas através de armadilhas de isca fermentada (banana e caldo-de-cana) (Uehara-Prado 2005), de modo que a amostragem pode ser simultânea e padronizada em várias áreas e épocas do ano (DeVries & Walla 2001). As armadilhas consistiram em um cilindro de filó preso a uma base de madeira com um pequeno prato de plástico, onde foram colocadas as iscas (Figura 3). As armadilhas foram armadas a cerca de 1 m de altura do solo e presas em galhos onde a corda de sustentação pudesse ser amarrada. As armadilhas ficaram abertas por quatro dias/mês, com monitoramento e reposição diária das iscas. Cada unidade amostral foi constituída por quatro armadilhas dispostas em formato de cruz, distando em média 30 m entre si, totalizando 60 armadilhas (15 unidades amostrais).
10 No decorrer de doze meses de coleta, entre dezembro de 2013 e novembro de 2014, somou-se 240 horas de esforço amostral ou 20 horas por mês de coleta efetiva, salvo o mês de fevereiro, com 40h. Os indivíduos capturados foram identificados individualmente e liberados, após devidas anotações. Dois a três exemplares de cada espécie foram sacrificados para serem testemunhos na Coleção de Lepidoptera da UFRN. As identificações seguiram a nomenclatura de Lamas (2004) e foram confirmadas consultando o site (“Butterflies of America” butterfliesofamerica.com) e o especialista Prof. Dr. André Victor Lucci Freitas (UNICAMP). As identificações foram em nível de subespécie, com apenas uma até gênero, a Fountainea sp.1 – ainda não identificada.
Caracterização de habitat
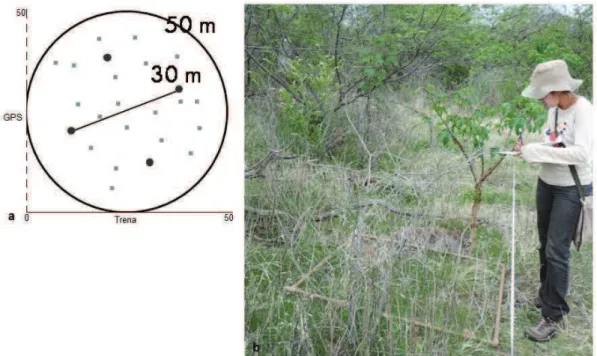
A partir do centro de cada unidade amostral foram estabelecidos buffers de 50 m de diâmetro (1962.5 m²), dentro dos quais foram aleatorizados 20 quadrantes de 1 x 1 m através de valores (x, y) de um plano cartesiano fixado com uma trena de 50 m (eixo x) e GPS (Figura 4). Os quadrantes foram monitorados trimestralmente, em janeiro, abril, julho e outubro (Tabela 1).
Em cada quadrante foram coletados os dados referentes à cobertura de herbáceas, cobertura de dossel (ambos de forma qualitativa, em proporção de 0-100%), profundidade de serapilheira (mm, média de três pontos), a riqueza (em morfoespécies - Mi) e abundância das plantas arbustivas, altura e diâmetro à altura do solo (DAS) dessas arbóreo-arbustivas, considerando os indivíduos com altura ≥ 1 m, cujo caule estivesse vivo e dentro do quadrante. As medidas de estimativa visual foram feitas sempre pelo mesmo observador. Calculamos a média dessas variáveis dos 20 quadrantes para cada unidade amostral. Estimamos o índice de equitabilidade de Pielou das espécies arbóreo-arbustivas (J' = H'/Hmax), entre os 20 quadrantes dentro de cada UA. Assim, obtivemos 15 valores de cada variável por mês amostrado (Tabela 8, anexa). O tipo de solo (organossolo ou luvissolo) também foi associado às unidades amostrais.
11 (Davis et al. 2007), influência no microclima e complexidade ambiental (todas as variáveis) e possível substrato para estivação (serapilheira) (Scott 1986).
Figura 4 –(a)Esquema de uma unidade amostral com disposição de armadilhas (pontos), buffer de 50 m e quadrantes de 1 x 1m. (b) Coleta das variáveis de habitat (Autor: José Elieudo Dias).
Dados climatológicos
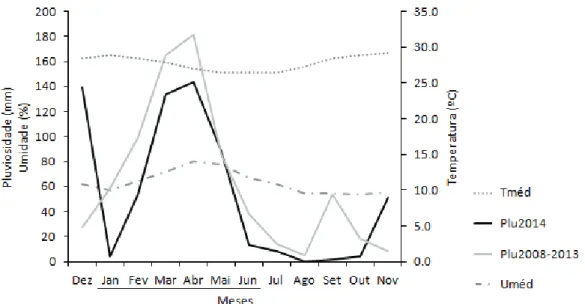
12 Figura 5 - Variação mensal das variáveis climatológicas na ESEC Seridó. Em destaque os meses da estação chuvosa. Tméd = temperatura média, Plu2014 = pluviosidade de dez/2013 a nov/2014, Plu2008-2013 = média anual de pluviosidade de 2008 a 2013, Uméd = umidade relativa do ar média.
Tabela 1 - Resumo das variáveis estudada e as análises nas quais foram usadas: DC: Descrição da comunidade, DET: Diversidade espaço-temporal da comunidade, ICV: Influência climática e vegetacional sobre a dinâmica da comunidade, VF: Variação das fisionomias. *Coleta entre dez-2013 e nov-2014.
Elemento Descrição das variáveis Coleta Análise
Faunístico Riqueza e abundância de borboletas frugívoras Mensal* DC, DET, ICV
Habitat
Riqueza e abundância de arbóreo-arbustivas (altura ≥ 1 m)
Altura de arbóreo-arbustivas (m) DAS de arbóreo-arbustivas (mm)
Trimestral* VF, ICV
Índice de equidade de arbóreo-arbustivas (J') Serapilheira (mm)
Cobertura de dossel (proporção) Cobertura de herbáceas (proporção)
Tipos de solo (luvissolo e organossolo) IBAMA 2004
Climático Pluviosidade passada (2008-2013) Mensal (INMET 2014) ICV
Pluviosidade (mm) Mensal (INSA 2014)*
Temperatura (ºC, média e máxima)
13 Análise de dados
Variação das fisionomias
A variação multivariada das fisionomias foi feita através de NMDS (Non-metric Multidimensional Scaling), o qual busca representar o conjunto de objetos ao longo de um predeterminado número de eixos, enquanto preserva as relações de ordenação entre eles. A análise leva em conta o ranque das distâncias, onde os escores dos eixos são gerados pela correlação entre a matriz de distância dos dados originais e uma matriz obtida com a aleatorização dos escores (1000x), visando minimizar o STRESS (Standard Residuals Sum of Squares), que varia de 0 a 1 (Bocard et al. 2011). As variáveis explanatórias (climáticas e vegetacionais) foram adicionadas como vetores e testadas por aleatorização (1000x) (Bocard et al. 2011). O NMDS multivariado foi construído com a função metaMDS e a adição dos vetores ambientais através da função envfit, ambas do pacote vegan (Oksanen 2013), no programa R (R Development Core Team 2011).
O NMDS foi gerado a partir da matriz de habitat trimestral (namostral = 60), composta pelas nove variáveis explanatórias (serapilheira, cobertura de herbáceas e de dossel, riqueza, abundância, DAS e altura de arbóreo-arbustivas, equitabilidade (J) e solo), associada à matriz de abundância dos 19 morfoespécies de arbóreo-arbustivas identificados, usando distância de Bray-Curtis (Bocard et al. 2011).
Descrição da comunidade
De forma a descrever os atributos da comunidade de borboletas foram quantificados e analisados riqueza, abundância, composição e estrutura (distribuição das abundâncias entre espécies), em níveis taxonômico, espacial e temporal.
14 > 10), e espécies raras aquelas que foram encontradas somente em uma amostra (mês) - uniques - ou em apenas duas amostras - duplicates (Gotelli e Colwel 2010). E a contribuição diferencial dos grupos taxonômicos, particionada por subfamílias.
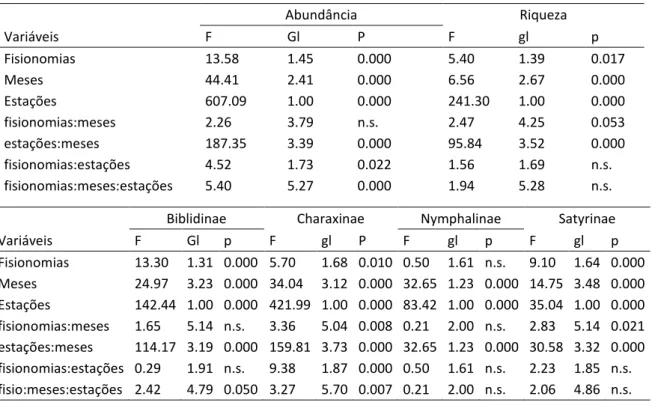
Para testar a homogeneidade da distribuição da riqueza e da abundância totais entre os subconjuntos (estações, fisionomias e subfamílias) fizemos análise de variância (ANOVA Fatorial de Medidas Repetidas). As variáveis dependentes foram o número de espécies, número total de indivíduos e número de indivíduos por subfamília, dentro de cada unidade
amostral por mês, considerando espécies com N ≥ 5. Fisionomias (3 níveis), meses (12 níveis)
e estações (2 níveis) foram tratamentos fixos, e unidade amostral foi o fator de
randomização (1000x), seguindo design “F1LDF2” – um grupo (fisionomia) e duas unidades de tempos (mês e estação) – da função nparLD do pacote nparLD. Tal função é não-paramétrica e analisa dados com medidas repetidas e fatores interunidades amostrais, testando as hipóteses com interações entre os fatores e como eles afetam a abundância (Noguchi et al. 2012).
Para visualizar o efeito do tamanho amostral sobre a riqueza e comparar os estações do ano e fisionomias, construímos curvas de acúmulo de espécies por indivíduos, usando dados de abundância com aleatorizações de 1000x sem reposição (Gotelli e Colwel 2010). As curvas foram estimadas no programa EstimateS v.9 (Colwell 2013).
Em razão de problemas logísticos para finalização do último dia de coleta em abril e novembro, fizemos interpolação do 4º dia de coleta (y) para cada espécie em cada unidade
amostral, usando a equação da reta de regressão linear (y = αx + β) dos dias anteriores (Gotelli & Ellison 2011).
Diversidade espaço-temporal da comunidade
15 como o número equivalente (Jost 2006, 2007). Tais métodos de medição devem ser aplicados dependendo da questão particular em estudo e do objetivo desejado (Veech et al. 2002). Aqui, dados de riqueza e abundância são relevantes, de forma que consideramos índices de diversidade verdadeira (Jost 2006, 2007) e a partição aditiva (Lande 1996).
No conceito de “diversidade verdadeira” usa-se no cálculo o valor de “q” (diversidade de ordem q - qD), tendo como resultado o número equivalente dos índices tradicionais (Jost 2006). No cálculo da diversidade de ordem zero (0D) usa-se dados de presença das espécies e equivale à riqueza (eq. 1). Na diversidade de ordem um (1D) usa-se dados de abundância, ou seja, o índice é influenciado pela frequência relativa das espécies, mas não favorece raras ou dominantes, equivalendo ao índice de Shannon-Wiener (equação 2, Jost 2006, 2007).
As fórmulas para os cálculos dos índices são as seguintes: Riqueza 0D = σ
ௌ
ୀଵ (eq.1)
DiversidadeShannon1D = ݁ݔሺെ σௌୀଵ݈݊ ሻ (eq.2)
Dβ = Dγ/Dα (eq.3)
O valor Dγ = exp (H’ acumulado) é obtido da abundância acumulada de cada espécie
através de todas as unidades (α), e ܦȽ ൌ σேୀଵሺԢ୧ሻ Ȁ é a média exponencial do índice
calculada para cada amostra nível α, sendo N o número de amostras (Jost 2006, Anderson et al. 2011). Pela equação 3 pode ser fornecido um modelo aditivo com o índice de Shannon-Winer (Jost 2007).
Para comparar a riqueza e diversidade de espécies entre as amostras, a partição da diversidade (α, β e γ) foi verificada entre as fisionomias e estações do ano. Avaliamos também a complementariedade em níveis hierárquicos (Lande 1996). Na escala temporal, os dados foram agrupados em meses, trimestres e semestres, resultando em uma hierarquia de três níveis com 12, 4 e 2 unidades, respectivamente (Figura 6). Na escala espacial, considerando as UAs e correspondentes fisionomias, com hierarquia de 15 e 3 unidades. Na partição aditiva, a β-diversidade total é, portanto, a soma dos níveis (ver equação 1 de Crist et al. 2003). E, sendo α e β de mesma unidade e em médias, β é a média do número de
espécies adicionado ao próximo nível (Lande 1996, Crist et al. 2003).
-16 diversidade observada foi estimada através de testes de permutação (bootstrap 1000x) separados em cada nível hierárquico, gerando o erro padrão entre as amostras (SE), abordagem probabilística que permite comparar simultaneamente várias comunidades (Chao et al. 2008).
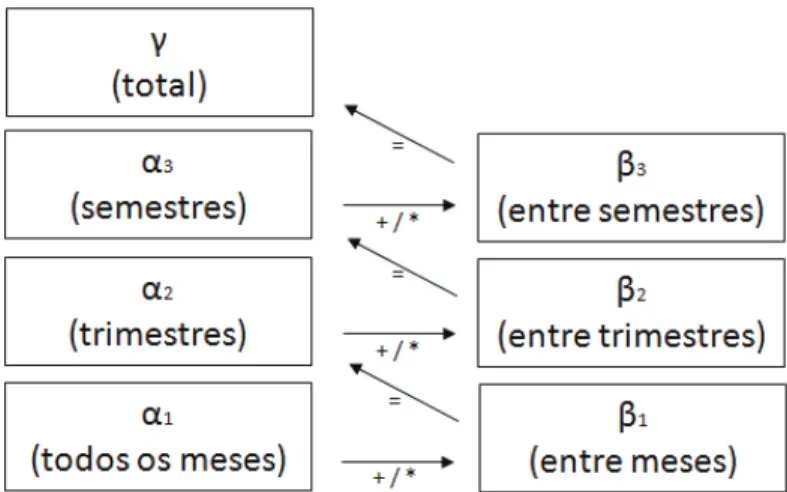
Figura 6 - Relação entre os níveis hierárquicos na partição aditiva/multiplicativa de diversidade em escala temporal.
Influência climática e vegetacional sobre a dinâmica da comunidade
Para testar a hipótese que a riqueza e abundância da comunidade de borboletas nas estações chuvosa e seca variam sob contribuição distinta das variáveis de habitat e do clima, foram gerados modelos de equações estruturais (SEM) para investigar as relações entre as variáveis dependentes (abundância e riqueza das espécies de borboletas com N ≥ 5) e as variáveis independentes (vegetação e clima). Para isso, considerando UAs como réplicas (n = 180, para um modelo robusto), usamos as variáveis de habitat de cada UA nas quatro coletas (janeiro, abril, julho e outubro) repetidas dentro dos meses do trimestre (jan-mar, abr-jun, jul-set e out-dez), e as variáveis climatológicas mensais, repetidas dentro do determinado mês.
17 Com base em um modelo inicial que inclui todas as variáveis e ligações possíveis entre elas, examinamos modelos alternativos, eliminando ou adicionando (passo-a-passo - stepwise) alguns dos caminhos e variáveis a partir da significânica na matriz de covariância anterior. A importância relativa de cada regressão parcial é indicada pelo valor de z e p-valor, o que também permite comparar a importância de cada variável explicativa nos modelos (Gotelli & Ellison 2011). Para rejeitar ou aceitar um modelo foi usado o índice da qualidade do ajuste CFI (Comparative Fit Index), que considera o tamanho da amostra e força das covariâncias entre as variáveis envolvidas e o índice de Loglikelihood, que avalia a parcimônia de modelo mantendo os parâmetros restritos na variância (H0) (Rosseel 2012). A validação foi realizada através de permutação bootstrap (1000x). A análise foi conduzida com o pacote lavaan (Rosseel 2012), e os gráficos construídos no semPlot (Epskamp 2014).
Para visualizar a distribuição das amostras e a influência das variáveis ambientais, construímos um NMDS com a matriz de distância (Bray-Curtis) da abundância (espécies com N ≥ 5) acumulada do respectivo trimestre (n = 60). Ou seja, os dados foram agrupados com base no mês amostragem de vegetação associado aos dois meses posteriores, assim, temos: 1º trimestre (janeiro-março), 2º (abril-junho), representando a estação chuvosa, e 3º (julho-setembro) e 4º semestre (dezembro/2013 e outubro-novembro), a estação seca (Anderson et al. 2011). Usamos a matriz de vegetação e a matriz climatológica, cujas médias foram inseridas dentro de cada trimestre. A amostra da UA15 no 1º trimestre (outlier) foi retirada da análise. Fizemos também o mesmo NMDS considerando apenas as espécies, para visualizar a sua distribuição no gradiente ambiental.
Testamos a multicolinearidade entre as variáveis explanatórias para adequada interpretação nas análises acima, usando o Fator de inflação da variância (VIF), índice
calculado para cada variável “x” em relação à entrada de outras (Graham 2003). O valor aceito foi VIF ≤ 10 como multicolinearidade relativamente baixa.
Para relacionar a distribuição das espécies com sua fenologia, observa-se o padrão de emergência de adultos, ou número de gerações, e sua relação com as estações e como flutua a sua abundância (Pozo et al. 2008). Assim, o tipo de sazonalidade das subfamílias e
das espécies de N ≥ 10 foi determinado seguindo a classificação de Wolda (1988). Segundo
18 através do ano, sendo chamado de sazonal com essas variações de pico (2A-C), (iii) ser imprevisível ou assazonal, sendo mais ou menos constante durante o ano (3A), de irregular variação sazonal (3B) ou com claro pico sem relação com estações (3C). Tal classificação em gráfico é apenas visual; para testar a significância da ocorrência dos picos aliamos os resultados com os valores temporais da ANOVA para cada espécie.
Para avaliar se houve retardo na resposta de recrutamento das borboletas, utilizamos sua relação com os dados climáticos como indicadores dessa resposta (Grotan et al. 2012). Através do índice de Spearman (rs), correlacionamos a abundância total e de cada subfamília com as variáveis climáticas, as mais significativas nas análises anteriores, usando dados do mês corrente (t), e de um (t-1) e dois (t-2) meses anteriores. A significância das correlações foi testada por randomização (1000x).
Uma análise de agrupamento foi realizada para testar a similaridade de composição de espécies dos grupos (fisionomias e trimestres). Usamos o método hierárquico UPGMA (Unweighted Pair Group Method with arithmetic), no qual a maior similaridade (ou menor distância) entre os objetos identifica os agrupamentos a serem formados, e todos os objetos recebem pesos iguais no cálculo (Legendre & Legendre 1998). A avaliação foi feita pelas métricas do coeficiente de correlação cofenética (Cof) e/ou pela distância de Gower, soma dos quadrados da diferença entre as matrizes de distâncias cofenéticas e a original (Borcard et al. 2011). Para gerar o dendograma usamos distância de Bray-Curtis da matriz de abundância das espécies nas fisionomias em trimestres (n=12), usando a função hclust do pacote cluster do R (Maechler et al. 2015). O estabelecimento do nível de corte de grupos foi através da média da silhueta e a detecção de grupos significativos por randomização (1000x), pelo pacote pvcluster (Suzuki 2014).
Posteriormente, a existência de espécies indicadoras dos grupos formados foi testada através do IndVal como proposto por Dufrene & Legendre (1997). Neste método, tem-se então a abundância média de cada espécie j nos sítios k agrupados (Nindivíduoskj) e a soma
das médias de abundância da espécie j dentro dos vários grupos (Nindivíduos+k). São
emitidos valores de 0 a 100%, onde 100 indica máxima associação da espécie com o ambiente, ou seja, alta especificidade Akj, quando a espécie ocorre somente naquele grupo,
e uma alta fidelidade Bkj, quando a espécie ocorre em todos os sítios do grupo (eq. 4). A
19 Akj = Nindivíduoskj / Nindivíduos+k
Bkj = Nsítioskj / Nsítios+k
IndValkj = 100 x Akj x Bkj eq.4
As abundâncias foram transformadas em raiz quadrada, para contribuição equitativa de espécies raras e comuns (Gotelli & Ellison 2011), exceto para o IndVal e a diversidade, onde os dados usados foram não foram transformados. Os dados ambientais seguiram transformação conforme sua natureza: em raiz para dados de contagem, arcoseno para dados de proporção e lognatural para dados contínuos (Gotelli & Ellison 2011). Consideramos o R² ajustado segundo Legendre & Legendre (1998), para valores de regressão e scores, p-valores corrigidos por FDR (False Discovery Rate) para evitar erros tipo I nas análises (Waite & Campbell 2006). As aleatorizações foram usadas como teste de significância (95%) por ser um procedimento robusto para minimizar o efeito da variação entre o tamanho das amostras (Crist et al. 2003).
RESULTADOS
Variação das fisionomias
20 Figura 7 - NMDS do gradiente ambiental determinado pelas variáveis vegetacionais significativas (linhas azuis) e morfoespécies arbóreo-arbustivos (Mi) em cada unidade amostral (pontos) da ESEC Seridó, formando fisionomias distintas: FAr = Fisionomia arbórea, FAb = Fisionomia aberta e FAa = Fisionomia arbóreo-arbustiva. A influência das variáveis é proporcional ao comprimento dos vetores. As UAs réplicas estão interligadas. a.arb = abundância de arbóreo-arbustivas, s.arb = riqueza de arbóreo-arbustivas, alt = altura de arbóreo-arbustivas, c.her = cobertura de herbáceas, das = DAS, J = equitabilidade, solo = tipo de solo.
A associação das variáveis no quadrante 1 (superior esquerdo) na Figura 7 está determinando principalmente a formação da fisionomia arbórea, fisionomia mais homogênea na abundância de espécies (equitabilidade média = 0.92), constituída de mais espécies arbóreo-arbustivas (riqueza média = 6,2) e mais altas (altura média = 3,4 m e DAS médio = 86,5 mm), principalmente por Angico (Anadenanthera colubrina – Mimosoideae, M8 na Figura 7), Catingueira (Poincianella bracteosa – Caesalpinioideae, M4) e Imburana (Amburana cearensis – Faboideae, M6) (Lima 2012). As principais características da fisionomia arbóreo-arbustiva são a maior variação na cobertura de herbáceas (média = 0.45% na estação chuvosa, média = 0.03% na seca) e abundância de árvores de médio e pequeno porte e arbustos (altura média = 2.7 m), como Pereiro (Aspidosperma pyrifolium –
21 mais aberto, dominado por gramíneas (cobertura de herbáceas média = 0.64% na estação chuvosa) e por poucas espécies de habito arbóreo-arbustivo (média = 10.7 de abundância), como Pião (Jatropha mollissima – Euphorbiaceae, M1) e Jurema preta (Tabela 9 anexo).
Embora não significativas na discriminação das fisionomias, a serapilheira (média±dp = 1.01±0.49 mm) e a cobertura de dossel (0.14±0.10 %) foram as medidas que mais variaram conforme a fenologia das espécies arbóreo-arbustivas. A primeira foi crescente no decorrer do ano com auge no último trimestre, enquanto a segunda teve pico ao fim da estação chuvosa. A cobertura de herbáceas foi marcante na distinção das estações do ano, com picos no fim da chuvosa (média = 0.47±0.19 %) e quase nula na seca (média = 0.04±0.03 %).
Descrição da comunidade
Coletamos 9.580 indivíduos de 16 espécies e 10 gêneros de borboletas frugívoras distribuídas entre quatro subfamílias: Biblidinae (8 espécies, 5.589 indivíduos), Charaxinae (5 espécies, 3.443 indivíduos), Nymphalinae (2 espécies, 33 indivíduos) e Satyrinae (1 espécies, 515 indivíduos), sendo 11.2% a taxa de recaptura.
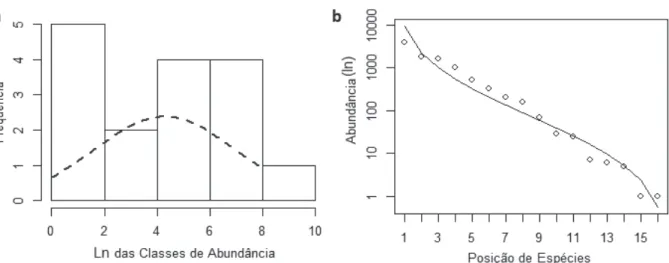
Figura 8 - (a) Distribuição das classes de abundâncias e (b) curva de abundância das espécies. A distribuição Poisson lognormal (histograma) foi ajustada usando log natural das amostras, com parâmetros de média 3.74 e variância de 3.03 (Engen et al. 2002). O modelo Poisson lognormal (LL = 211.88 p < 0.01) foi mais bem ajustado do que a lognormal (LL = 212.90 p < 0.01) e a logseries (LL = 209.40 p = 0.19).
22 representada por menos de 70 indivíduos e duas espécies foram raras Eunica bachina magnipunctata (unique) e Hamadryas feronia feronia (unique). Três espécies foram dominantes (Hamadryas februa februa - 3.853 indivíduos, Fountainea halice moretta - 1.762, Eunica tatila bellaria - 1.628) que, juntas, representaram 75,6% da amostra (Tabela 2).
Os representantes de Biblidinae e de Charaxinae representaram a maioria das capturas em todos os habitats. A maioria das espécies capturadas pertenceu à subfamília Biblidinae, cuja abundância relativa dos seus representantes foi de 58% da comunidade. O gênero Fountainea e a espécie Hypna clytemnestra forbesi, representaram a subfamília Charaxinae, compondo 36% da comunidade. Apenas uma espécie da subfamília Satyrinae foi encontrada, Pharneupthychia phares. Ela representou 5,4% da comunidade, sendo a quinta espécie com mais indivíduos (n=515). Duas espécies representaram a subfamília Nymphalinae, Historis odius odius e Historis acheronta acheronta.
A comunidade foi significativamente diferente em composição e abundância tanto temporal quanto espacialmente (ANOVA gl = 179, p ≤ 0.01, Tabela 3). Houve dramática variação na abundância das espécies ao longo do ano, com valores nove vezes maiores na estação chuvosa do que na estação seca, independente de subfamília (ANOVA p < 0.001 para todas as subfamílias) (Tabela 3). Como esperado, a estação chuvosa foi mais rica em espécies e abundante em indivíduos. Nessa estação foram capturadas mais de 8,5 mil borboletas de 15 espécies, a maioria pertencente à subfamília Biblidinae (61.5%). Já na estação seca, apenas 910 indivíduos de 12 espécies foram capturados, dos quais 52% eram pertencentes à família Charaxinae.
23 Tabela 2 - Abundância das espécies coletadas na ESEC Seridó (dez/2013 a nov/2014) e teste de hipótese nula de igual abundância (espécies de N ≥ 5) entre fisionomias e estações. ESEC = abundância na ESEC. %= frequência relativa do total, %subf = frequência relativa dentro da subfamília. FAr = Fisionomia arbórea, FAb = Fisionomia aberta e FAa = Fisionomia arbóreo-arbustiva.
Estação chuvosa Estação seca
Subfamília/Espécie FAr FAb FAa Total FAr FAb FAa Total ESEC % % subf
Biblidinae (n=5.589)
Biblis hyperia nectanabis (Fruhstorfer, 1909) 16 1 2 19 1 3 1 5 24 0.25 0.4 Callicore sorana sorana (Godart, [1824]) 0 1 1 2 0 3 1 4 6 0.06 0.1 Dynamine postverta postverta (Cramer, 1779) 0 5 1 6 0 0 1 1 7 0.07 0.1 Eunica bechina magnipunctata Talbot, 1928 1 0 0 1 0 0 0 0 1 0.01 0.02 Eunica tatila bellaria Fruhstorfer, 1908 601 641 337 1579 30 12 7 49 1628 17.0 29.1 Hamadryas februa februa (Hübner, [1823]) 1229 1541 903 3673 80 46 54 180 3853 40.2 68.9 Hamadryas feronia feronia (Linnaeus, 1758) 0 0 0 0 0 1 0 1 1 0.01 0.02 Mestra dorcas hypermestra Hübner, 1825 46 2 6 54 9 1 5 15 69 0.7 1.2
Charaxinae (n=3.443)
Fountainea sp.1 34 34 9 77 143 50 52 245 322 3.4 9.4
Fountainea glycerium cratais (Hewitson, 1874) 43 86 62 191 0 11 5 16 207 2.2 6.0 Fountainea glycerium glycerium (Doubleday, [1849]) 236 464 265 965 12 13 8 33 998 10.4 29.0 Fountainea halice moretta (H.Druce, 1877) 645 463 475 1583 80 52 47 179 1762 18.4 51.2 Hypna clytemnestra forbesi Goldman & Salvin, 1884 34 71 49 154 0 0 0 0 154 1.6 4.5
Nymphalinae (n=33)
Historis acheronta acheronta (Fabricius, 1775) 8 11 9 28 0 0 0 0 28 0.3 84.8 Historis odius odius (Fabricius, 1775) 3 2 0 5 0 0 0 0 5 0.05 15.2
Satyrinae (n=515)
Pharneupthychia phares (Godart, 1824) 201 65 67 333 105 19 58 182 515 5.4 100
Abundância total 3097 3387 2186 8670 460 211 239 910 9580 100 Riqueza total 13 14 13 15 8 11 11 12 16
Observamos 11 espécies ocorrentes em ambas as estações e outras 11 que ocorreram em todas as fisionomias. A abundância total da comunidade diferiu entre as fisionomias somente devido à interação com a estação do ano (ANOVA, F1,73 = 4.52, p = 0.01) e, em riqueza, somente dentro dos meses (F4,25 = 4.25, p = 0.05) (Tabela 3). Na fisionomia aberta foram registrados mais de três mil indivíduos em 15 espécies, enquanto nas outras se registrou 13 espécies em cada. A fisionomia arbóreo-arbustiva foi a com menor abundância (N = 2.425) e que atingiu a assíntota no acúmulo de espécies mais rápido (Figura 9). A fisionomia arbórea foi a área de maior abundância de indivíduos (N = 460) e riqueza (S = 5) durante a seca.
24 encontrada no ano inteiro. Os representantes dos Biblidinae variaram em pequena escala de tempo entre as fisionomias, em cada estação (F =2.424.79, p = 0.05), sendo mais abundantes (40.4%) na fisionomia aberta, e menos na fisionomia arbórea (Tabela 2).
Tabela 3– Resultados da análise de variância fatorial para o teste da homogeneidade da distribuição de riqueza e abundância da comunidade e subfamílias entre fisionomias, meses e estações. gl = grau de liberdade do numerador para a distribuição do F central, n.s. = não significativo.
Abundância Riqueza
Variáveis F Gl P F gl p
Fisionomias 13.58 1.45 0.000 5.40 1.39 0.017
Meses 44.41 2.41 0.000 6.56 2.67 0.000
Estações 607.09 1.00 0.000 241.30 1.00 0.000
fisionomias:meses 2.26 3.79 n.s. 2.47 4.25 0.053
estações:meses 187.35 3.39 0.000 95.84 3.52 0.000
fisionomias:estações 4.52 1.73 0.022 1.56 1.69 n.s.
fisionomias:meses:estações 5.40 5.27 0.000 1.94 5.28 n.s.
Biblidinae Charaxinae Nymphalinae Satyrinae
Variáveis F Gl p F gl P F gl p F gl p
Fisionomias 13.30 1.31 0.000 5.70 1.68 0.010 0.50 1.61 n.s. 9.10 1.64 0.000 Meses 24.97 3.23 0.000 34.04 3.12 0.000 32.65 1.23 0.000 14.75 3.48 0.000 Estações 142.44 1.00 0.000 421.99 1.00 0.000 83.42 1.00 0.000 35.04 1.00 0.000 fisionomias:meses 1.65 5.14 n.s. 3.36 5.04 0.008 0.21 2.00 n.s. 2.83 5.14 0.021 estações:meses 114.17 3.19 0.000 159.81 3.73 0.000 32.65 1.23 0.000 30.58 3.32 0.000 fisionomias:estações 0.29 1.91 n.s. 9.38 1.87 0.000 0.50 1.61 n.s. 2.23 1.85 n.s. fisio:meses:estações 2.42 4.79 0.050 3.27 5.70 0.007 0.21 2.00 n.s. 2.06 4.86 n.s.
25 Diversidade espaço-temporal da comunidade
A riqueza e diversidade totais estimadas diferem entre as estações, sendo ambas maiores no fim da chuvosa e início da seca (Tabela 4, Figura 10). Vale salientar que os picos de abundância, riqueza e diversidade não coincidem.
Figura 10 – Diversidade temporal, mostrando a abundância de indivíduos e os índices de riqueza (0D) e diversidade de Shannon-Wiener (1D).
26 Como principal resultado, a homogeneidade espacial da comunidade (similaridade que varia de 0 a 1, Jost 2007) foi maior na estação chuvosa, e o turnover (considerando que o turnover total entre as amostras seria igual 1, Jost 2007) e a β-diversidade foram um pouco maiores na estação seca.
Tabela 4 - Comparação espaço-temporal da abundância, riqueza e diversidade de borboletas frugívoras por estação do ano. Índices de riqueza (0D) e diversidade de Shannon-Wiener (1D) em números equivalentes (Jost 2006). Valores e respectivos erros-padrão. N = abundância.
Chuvosa Seca
Componente de diversidade N Riqueza Diversidade N Riqueza Diversidade Fisio. Assoc. a curso d'água 3097 11.00(0.28) 5.05(0.11) 460 6.80(0.19) 4.97(0.09) Fisio. Aberta 3387 10.60(0.21) 4.66(0.09) 211 8.60(0.21) 5.92(0.12) Fisio. Arbóreo-arbustiva 2186 9.80(0.19) 4.90(0.10) 239 6.80(0.41) 5.10(0.23) Entre Fisionomias (β) 1.13(0.04) 1.02(0.01) 1.20(0.06) 1.05(0.11) Similaridade 0.93(0.02) 0.98(0.01) 0.90(0.03) 0.95(0.01)
Turnover 0.06(0.02) 0.01(0.01) 0.10(0.03) 0.03(0.01)
Estação (γ) 8670 15.00(0.61) 6.24(0.17) 910 12.00(0.68) 5.09(0.05)
27 A partição da diversidade é mais evidente em escala temporal. A diversidade da comunidade foi devido principalmente à diferença de espécies entre unidades amostrais e meses (Tabela 5, Figura 12). A riqueza média (0D) estimada nas unidades amostrais foi de 11 espécies, ao passo que ao longo dos meses o número médio de espécies foi 8. A diversidade média (1D) foi de 5.32 espécie-equivalentes nas unidades amostrais, e 3.69, nos meses. A diversidade regional (γ) foi 6.8.
Na partição espacial, os índices de β-diversidade são bem baixos. Mas considerando somente a presença das espécies, os índices aumentam levemente, sendo a β-diversidade entre unidades amostrais (0D
β1 = 1.45±0.19) um pouco maior do que entre fisionomias (0Dβ2
= 1.17±0.18). Já na partição temporal, as diferenças tanto na composição quanto na distribuição de abundâncias são maiores e influem igualmente nos índices. A β-diversidade é maior em unidades menores de tempo (0D
β1 = 2.00±0.32, 1Dβ1 = 1.92±0.04), ou seja, 1,92
espécies foram adicionadas ao próximo nível (trimestres).
Tabela 5 – Partição espaço-temporal da β-diversidade de espécies na comunidade de frugívoras da ESEC Seridó. A diversidade é indicada pelos índices de riqueza (0D) e diversidade de Shannon-Wiener (1D), similaridade e turnover entre as amostras. Valores e respectivos erros-padrão (SE), Sim S = similaridade de Sorensen, Sim H = similaridade de Horn, Tur S = turnover de Sorensen e Tur H = turnover de Horn.
Diversidade Riqueza Sim S Tur S Diversidade Sim H Tur H Espacial
Dentro das UAs (α) 11.06(0.24) 5.32(0.12)
Entre UAs (β1) 1.44(0.11) 0.96(0.01) 0.03(0.01) 1.05(0.01) 0.98(0.01) 0.01(0.01) Entre Fisionomias (β2) 1.17(0.13) 0.91(0.07) 0.08(0.07) 1.02(0.01) 0.98(0.01) 0.01(0.01) Temporal
Dentro de meses (α) 8(0.66) 3.69(0.31)
28 Figura 12 –Partição da diversidade na escala espacial e temporal. Foi usado o índice de entropia de Shannon-Wiener (Jost 2007).
A similaridade global das amostras (Sim S e Sim H), tanto no nível espacial (unidades amostrais e fisionomias) quanto no nível temporal foi muito alta (Tabela 5). A homogeneidade espacial é marcante, tendo em vista os valores de similaridade de espécies de 0.91 para as fisionomias e 0.96 para as unidades amostrais. A similaridade mais baixa foi da ordem de 0.68 (entre trimestres), em diversidade. Consequentemente o turnover de espécies foi baixo. Apenas nas escalas temporais maiores (trimestre e semestres) observamos valores consideráveis de turnover. Isso significa que, mesmo com a grande mudança na abundância ao longo do ano, as espécies componentes (ou mais importantes) não variaram muito.
Influência climática e vegetacional sobre a dinâmica da comunidade
O modelo SEM inicial (Figura 14a) (LL = 792.53, gl = 55, CFI = 0.94) foi construído com as ligações possíveis entre as variáveis que inicialmente geraram coeficientes expressivos. Ele então foi melhorado até chegar ao modelo mais ajustado (Figura 14b), que mostra os efeitos dos fatores climatológico e vegetacionais sobre a riqueza e abundância das borboletas frugívoras (LL = 109.89, gl = 21, CFI = 0.97, considerando o valor de referência x ≥
29 coeficientes de regressão associados, de acordo com o peso da regressão de cada fator e termos de erro da covariância (Gotelli & Ellison 2011).
30 Figura 14 - Variação na riqueza e abundância de borboletas e dos indicadores de vegetação dentro das fisionomias (a) e de clima (b), mais significantes conforme SEM e NMDS. Foram usados dados brutos de monitoramento trimestral. No Box são indicados a mediana e valores máximos e mínimos.
31 juntas, embora inversamente, sobre a abundância de espécies. Esse efeito negativo da pluviosidade deve indicar que a pluviosidade defasada explica bem a dinâmica das espécies (ver tabela 6). A heterogeneidade sazonal de habitat, representada pela serapilheira (b = 0.27) e cobertura de herbáceas (b = 0.16), correlacionam fracamente com a riqueza de espécies. Já a umidade (b = 1.33) e pluviosidade (b = -0.76) associam-se fortemente com o aumento da riqueza de espécies (Figura 13b e 14).
No NMDS, a distribuição da comunidade de borboletas segue um gradiente temporal, em quatro trimestres dentro das estações (chuvosa e seca), associado à variação dos indicadores vegetacionais e climáticos (Figura 15a). As amostras nos dois primeiros trimestres são mais correlacionadas à variável umidade máxima (r² = 0.91, p<0.001), e a alta abundância reflete as condições mais amenas na estação chuvosa. Enquanto as amostras durante a seca são agrupadas em um só grupo associado à variação na serapilheira (r² = 0.64, p < 0.001), cobertura de herbáceas (r² = 0.63, p < 0.001) e cobertura de dossel (r² = 0.27, p < 0.001). Tal mudança reflete o fim do pico do crescimento vegetacional, mostrando máximo de acúmulo de folhas caídas no 3º e 4º trimestres, e, consequentemente, menos indivíduos. A variação da temperatura máxima (r² = 0.85, p < 0.001) possuiu maior variação na estação seca e no início da chuvosa. A abundância de borboletas é decrescente no decorrer do ano. Vemos uma leve distinção entre fisionomias apenas no 1º trimestre, e a abundância varia mais expressivamente na seca, onde mais indivíduos ocorreram nas fisionomias mais arbóreas (fisionomias arbórea e arbóreo-arbustiva).
Considerando as espécies e grupos taxonômicos (Figura 15b e 16), há associação previsível de espécies sob o conjunto de condições climáticas e vegetacionais, distintamente no tempo e espaço ao longo do ano estudado.
33 Figura 16 - Contribuição de indivíduos de cada subfamília nas estações (chuvosa e seca)em cada fisionomia. Estão expressas as abundâncias relativas em porcentagem. Valores em log natural devido à assimetria das abundâncias.
A subfamília Charaxinae foi mais associada às áreas com pouca variação na cobertura de dossel (fisionomia aberta). As espécies Fountainea g. glycerium e Fountainea h. moretta ocorreram em todas as fisionomias e todo o ano. Enquanto a Fountainea sp.1, dominante na seca, foi 80% encontrada em áreas densas de árvores e serapilheira (fisionomia arbórea e arbóreo-arbustiva). Os Nymphalinae (gênero Historis) tiveram maior abundância também nessas áreas.
Analisando essa distribuição das espécies segundo os critérios de classificação de sazonalidade de Wolda (1988), o tipo de dinâmica sazonal mais comum, tanto ao nível de espécies quanto de subfamília foi a sazonal (55%), com único pico (2A, representantes da Biblidinae) ou amplo máximo (2C, representantes da Charaxinae) (Figura 17). Isso indica que a maioria das espécies da comunidade ocorre em boa parte do ano, mas são sazonais porque exibem um pico pronunciado na estação chuvosa. Outra dinâmica relativamente comum foi a classe 1A-C, representada por 33% das espécies que são restritas a poucos meses do ano, de março a julho (Figura 17c).
34 (rs (t-1) = 0.51, rs (t-2) = 0.60), e a segunda com a temperatura (rs (t-2) = 0.53), ambas refletindo na abundância total. Esse retardo explica parcialmente o efeito negativo da pluviosidade na análise SEM (Figura 13).
35 Tabela 6– Explanação das variáveis climatológicas locais (ESEC Seridó) sobre a abundância e riqueza total das borboletas. Índice de Spearman (rs) no tempo t, t-1 e t-2. * significância do rs < 0.05.
Temperatura máx. Umidade máx. Pluviosidade
t t-1 t-2 T t-1 t-2 t t-1 t-2
Biblidinae -0.39 0.17 0.29 0.66* 0.31 0.13 0.69 0.12 0.28 Charaxinae -0.75 -0.39 0.10 0.81* 0.79* 0.50 0.46 0.51* 0.60* Nymphalinae -0.25 0.09 0.53* 0.56* 0.31 -0.09 0.56* 0.31 -0.09 Satyrinae -0.33 0.04 0.29 0.56* 0.31 0.13 0.48 0.47 0.33 Ntotal -0.65 -0.13 0.17 0.89* 0.63* 0.39 0.71* 0.44 0.60*
O dendograma do gradiente de similaridade temporal e de habitat (Cof = 0.94, Gower = 0.20, média da silhueta= 0,62) confirmou o agrupamento das amostras em três grupos (Figura 18), aos quais cada espécie foi mais fortemente relacionada (IndVal, Tabela 7). A similaridade na distribuição das espécies de borboletas e o número de espécies indicadoras são maiores na estação chuvosa (grupos 1 e 2), somando seis espécies indicadoras significativas. Houve separação nos 1º e 2º trimestres de chuvas, enquanto os dois últimos trimestres agruparam-se em um único grupo (estação seca) de maior dissimilaridade entre as fisionomias. Não houve significância em espécies indicadoras para as fisionomias, mesmo analisando as estações separadamente. Mas, observamos associação distinta da comunidade nas fisionomias em cada estação, destacando a fisionomia aberta na estação chuvosa, e associação entre as fisionomias arbórea e arbóreo-arbustiva, na estação seca, áreas com mais indivíduos (Tabela 7).
36 Fountainea g. cratais, Fountainea g. glycerium, Hamadryas f. februa, Eunica t. bellaria e Pharneupthychia phares, ocorreram durante o ano inteiro, mas indicam períodos e classes de sazonalidade específicas pela concentração de suas abundâncias (Tabela 8 anexa).
Figura 18 – Distribuição das amostras por análise de agrupamento UPGMA, usando dissimilaridade de Bray-Curtis. Mostra agrupamento temporal dos trimestres. Menores valores representam maior similaridade.
Tabela 7 - Distribuição das abundâncias das espécies coletadas em trimestres e fisionomias. IndVal = valor indicador e respectivo grupo em parêntese. * significância p ≤ 0.05. FAr = Fisionomia arbórea, FAb = Fisionomia aberta e FAa = Fisionomia arbóreo-arbustiva.
1º Trimestre 2º Trimestre 3º Trimestre 4º Trimestre
Espécie FAr FAb FAA FAr FAb FAA FAr FAb FAA FAr FAb FAA IndVal
Biblis h. nectanabis 3 0 0 13 1 2 1 3 1 0 0 0 0.74 (2)
Callicore s. sorana 0 0 0 0 1 1 0 1 1 0 2 0 0.33 (2)
Dynamine p. postverta 0 0 0 0 5 1 0 0 1 0 0 0 0.62 (2)
Eunica t. bellaria 579 633 325 22 8 12 23 6 4 7 6 3 0.33 (1)*
Hamadryas f. februa 1115 1422 794 114 119 109 47 30 33 33 16 21 0.96 (1)*
Eunica b. magnipunctata 1 0 0 0 0 0 0 0 0 0 0 0 0.88 (1)
Hamadryas f. feronia 0 0 0 0 0 0 0 1 0 0 0 0 0.17 (3)
Mestra d. hypermestra 43 2 6 3 0 0 6 0 2 3 1 3 0.83 (1)
Fountainea sp.1 0 0 0 34 34 9 111 40 36 32 10 16 0.61 (3)
Fountainea g. cratais 3 9 7 40 77 55 0 9 3 0 2 2 0.86 (2)*
Fountainea g. glycerium 52 103 36 184 361 229 9 13 4 3 0 4 0.79 (2)
Fountainea h. moretta 118 36 27 527 427 448 78 52 46 2 0 1 0.84 (2)*
Hypna c. forbesi 2 0 0 32 71 49 0 0 0 0 0 0 0.99 (2)*
Historis a. acheronta 8 11 9 0 0 0 0 0 0 0 0 0 1.00 (1)*
Historis o. odius 3 1 0 0 1 0 0 0 0 0 0 0 0.53 (1)
37
DISCUSSÃO
Diversidade da comunidade de borboletas
Em termos gerais, a comunidade de borboletas frugívoras mostrou flutuação na composição e abundância de espécies ao longo do ano, seguindo a mudança sazonal do ambiente, assim como em outras áreas tropicais secas (Pinheiro & Ortiz 1992, Shahabunddin & Terborgh 1999, Maya-Martínez et al. 2009, Zacca & Bravo 2012, Nobre et al. 2012, Checa et al. 2014).
Os resultados obtidos na ESEC Seridó mostram que a riqueza de 16 subespécies de borboletas frugívoras foi similar à outra área de caatinga, o Parque Nacional do Catimbau em Pernambuco, onde foram catalogadas 15 espécies (Nobre et al. 2012). Mas a ESEC Seridó teve riqueza baixa quando comparada às 30-35 espécies dos ecossistemas vizinhos de floresta úmida Nordestina (Mata Atlântica; França 2006, Barbosa 2009, Zacca & Bravo 2012), e às 23 espécies de áreas na caatinga da Chapada Diamantina, em meio a mosaico de Cerrado e Mata Atlântica (Zacca & Bravo 2012).
Comparando os resultados do presente estudo com outros estudos no semiárido, vê-se que das 16 subespécies encontradas na ESEC Seridó, treze (81%) são compartilhadas com as duas áreas de caatinga supracitadas, e 9 (56%) também são encontradas no Cerrado (Emery et al. 2006), enquanto 31% das espécies (Callicore s. sorana, Historis o. odius, Hamadryas f. februa e Hamadryas f. feronia, Mestra d. hypermestra) são encontradas tanto na Mata Atlântica quanto no Cerrado (Zacca & Bravo 2012, Emery et al. 2006). Há compartilhamento de espécies, mas com diferença de subespécies, em relação a outros ambientes secos da América (Shahabunddin & Terborgh 1999, Pozo et al. 2008, Maya-Martínez et al. 2009). E as subespécies Hypna c. forbesi e Fountainea h. moretta são tidas como exclusivas da Caatinga (Zacca & Bravo 2012).
38 estação chuvosa, e do gênero Fountainea na seca, tem sido confirmada para a área, segundo dados prévios de monitoramento em 2012 e 2013 (JED Barbosa & MZ Cardoso, dados não publicados), e em Pernambuco (Nobre et al. 2012).
Especialmente nos trópicos, pequenas variações sazonais podem afetar a biodiversidade em curto prazo (DeVries et al.1997, Shahabuddin & Terborgh 1999, Hamer et al. 2005). Essa forte variação ambiental pode levar à super ou subestimativas da diversidade em diferentes habitats e deve ser avaliada com cautela (Tylianakis et al. 2005). Para tentar diminuir esse viés foi que utilizamos os índices de diversidade verdadeira (Jost 2006).
A riqueza e diversidade foram maiores na estação chuvosa, com influência da abundância relativa das espécies e contribuição para diversidade α pelas espécies dominantes (Crist et al 2003), principalmente dentro das UAs e meses dessa estação. Em contrapartida, na estação seca houve menor riqueza e reduzida abundância de indivíduos, além de espécies mais similares em fitness, com distribuição um pouco distinta entre fisionomias e maior β-diversidade. Temos como resultado a diferença na diversidade entre as estações.
A presença de mais espécies incomuns e raras após as chuvas contribuiu para a maior diversidade nos 2º e 3º trimestres, e sugere agregação temporal de espécies, o que tem pouco efeito em pequena escala (UA), mas positivo para a diversidade em maiores escalas (Veech et al. 2003, Bossart et al. 2006).