Universidade de Trás-os-Montes e Alto Douro
Cardiotoxicidade induzida pela doxorrubicina em cães
Dissertação de Mestrado Integrado em Medicina Veterinária
Helena Maria Moutinho Pereira
Orientador:
Professora Doutora Maria João Pires
Universidade de Trás-os-Montes e Alto Douro
Coorientador:
Professor Doutor Luís Lima Lobo
Hospital Veterinário do Porto
Universidade de Trás-os-Montes e Alto Douro
Cardiotoxicidade induzida pela doxorrubicina em cães
Dissertação de Mestrado Integrado em Medicina Veterinária
Helena Maria Moutinho Pereira
Orientador:
Professora Doutora Maria João
Universidade de Trás-os-Montes e Alto Douro
Coorientador:
Professor Doutor Luís Lima Lobo
Hospital Veterinário do Porto
Composição do júri:
Profª Doutora Cristina Maria Teixeira Saraiva
Profª Doutor Luis Miguel Joaquim Marques Antunes
Profº Doutor José Manuel de Melo Henriques de Almeida
Profª Doutora Maria João Miranda Pires
Para os devidos efeitos, declaro que esta Dissertação é resultado da minha pesquisa e trabalho pessoal, sob orientação científica da Prof.ª. Dr.ª Maria João Pires e Prof. Dr. Luís Lima Lobo, sendo o seu conteúdo original, não tendo sido apresentado em nenhuma outra Instituição para obtenção de qualquer grau académico, ou em alguma publicação de uso restrito.
“To leave the world a little better than you found it.
That's the best a man can ever do.”
Agradecimentos
O meu agradecimento a todos aqueles que, de alguma forma, contribuíram para o enriquecimento do meu percurso académico e pessoal, bem como para a concretização deste momento tão importante e especial para mim.
À Professora Maria João Pires pela sua orientação, por todos os conselhos e apoio prestado, pela disponibilidade, pela paciência e dedicação.
Ao Dr. Luís Lobo, pelo acompanhamento ao longo do estágio. Por nos impulsionar e incentivar todos os dias a ser melhores. Por ter acreditado na realização deste trabalho e por ter cedido meios para que o mesmo fosse possível. Pela paciência, conhecimentos transmitidos e disponibilidade.
Ao Dr. Gonçalo Petrucci, por ter auxiliado na obtenção dos dados e por ter proporcionado o acompanhamento do animal do estudo. Por toda a paciência e por todos os conselhos.
À proprietária do animal que acompanhei pela sua cooperação, compreensão e generosidade.
Às Professoras Isabel Pires e Susana Pires pela sua contribuição para este trabalho, pelo carinho e disponibilidade.
À grande equipa do Hospital Veterinário do Porto e grupo de estagiários pelos seis meses incríveis. Quer pela partilha de conhecimentos e impulsionamento para crescimento a nível profissional, como pela amizade, cumplicidade e carinho inalcançáveis demonstrados. Pela alegria, boa disposição e encorajamento. Pelas importantes amizades que ficaram. É tão bom regressar e ainda me sentir em casa.
Aos meus pais por todo o amor e dedicação. Por acreditarem, confiarem e permitirem a realização deste sonho. Por respeitarem aquilo em que acredito e por me apoiarem.
Aos meus avós pelas bases, pelas brincadeiras, pelo entusiasmo demonstrado nas conquistas. Pelos passeios pelo parque e pelas conversas intermináveis.
Ao Gui, o grande responsável pelo caminho percorrido. A essência da força e vontade, o coração cheio, sempre.
À maravilhosa família 5º Direito, que tive a sorte de encontrar. Pela amizade incondicional, pela genuinidade de todos os momentos partilhados, pelas palavras certas nos momentos certos. Por serem fé, confiança e pó de fada.
Aos meus amigos, à velha guarda e àqueles que entraram na minha vida mais recentemente. Por terem percorrido este percurso comigo, sem nunca esmorecer, pelo encorajamento, força e momentos de descontração partilhados.
Resumo
A doxorrubicina é um agente antineoplásico bastante utilizado em Medicina Veterinária, integrando a escolha no tratamento de uma série de tumores sólidos e hematopoiéticos. Contudo, está descrito que o seu uso poderá estar associado ao desenvolvimento de cardiotoxicidade em cães, que pode ser classificada como aguda ou crónica, diferindo entre si pela apresentação clínica e prognóstico. Em cães, são vários os estudos que relatam o desenvolvimento de cardiomiopatia secundária ao uso do fármaco, que é em tudo semelhante a cardiomiopatia dilatada canina. A cardiotoxicidade crónica é considerada dose dependente e surge, mais comumente, quando é atingida a dose cumulativa de 240 mg/m2, contudo já foi descrita com dose de apenas 90mg/m2. O prognóstico é considerado grave, dado que a progressão poderá induzir insuficiência cardíaca congestiva refratária e/ou arritmias fatais.
Desta forma, o objetivo deste trabalho incidiu na avaliação das implicações da doxorrubicina a nível cardíaco, avaliando uma série de parâmetros no decorrer do protocolo de quimioterapia, por forma a permitir o diagnóstico precoce de cardiotoxicidade, otimizando o uso do fármaco, antes do desenvolvimento de disfunção cardíaca.
No trabalho prático foram avaliados 5 casos clínicos (1 prospetivo e 4 retrospetivos) de cães submetidos a tratamento simples ou combinado com doxorrubicina no Hospital Veterinário do Porto. A dose cumulativa máxima atingida no trabalho foi de 120mg/m2 e a mínima de 30mg/m2. Apenas 2 dos 5 cães manifestaram alterações consideradas significativas e sugestivas de cardiotoxicidade induzida pela doxorrubicina. Neste trabalho foi possível depreender que a cardiotoxicidade pode iniciar a sua manifestação em fases muito precoces do tratamento, com dose cumulativa de apenas 30 mg/m2. Curiosamente, os animais que foram submetidos a dose cumulativa menor manifestaram alterações mais significativas, quando comparados com os animais que receberam dose mais elevada. Não foi verificada maior predisposição dos animais com doença cardíaca pré-existente para desenvolvimento de cardiotoxicidade. Da mesma forma, não foi denotado desenvolvimento de alterações de condução ou ritmo, sugestivas de cardiotoxicidade aguda.
Este trabalho demonstrou que a monitorização dos cães, com recurso à associação de ecocardiografia e biomarcadores cardíacos, tornou possível a deteção precoce de alterações cardíacas, sugestivas de cardiotoxicidade induzida pela doxorrubicina.
Abstract
Doxorubicin is an antineoplastic agent widely used in Veterinary Medicine for the treatment of a high number of solid and hematopoietic tumors. However, its use has been associated with the development of cardiotoxicity in dogs, which can be classified as acute or chronic. The difference between them is the clinic presentation and prognosis. In dogs, there are several studies that report the development of secondary cardiomyopathy due to this drug, which is similar to canine dilated cardiomyopathy. Chronic cardiotoxicity is considered to be dose dependent and it comes up more commonly when the cumulative dose reaches 240mg/m2; however, it has been reported with dose as low as 90mg/m2. The prognosis is poor, because the progression can induce refractory congestive heart failure and / or life threatening arrhythmias.
Thus, this study focused on the evaluation of the cardiac implications of doxorubicin, through the evaluation of a number of parameters during the course of the chemotherapy, leading to the early diagnosis of cardiotoxicity, in order to optimize the use of the drug, before the development of cardiac dysfunction.
In the practical work 5 cases of dogs (1 prospective and 4 retrospective), subjected to simple or combinated treatment with doxorubicin at the Hospital Veterinário do Porto, were assessed. The maximum cumulative dose reached in the study was 120 mg / m2 and the minimum was 30 mg / m2. Only 2 of the 5 dogs showed changes that were considered significant and suggestive of cardiotoxicity induced by doxorubicin. With this work it was possible to conclude that the cardiotoxicity can start its demonstration at very early stages of the treatment, with cumulative dose as low as 30 mg/m2. Interestingly, animals that underwent the lowest cumulative dose expressed the most significant changes, compared to animals that received the highest dose. There was no greater susceptibility for the animals with pre-existing heart disease to the development of cardiotoxicity. Likewise, it has not been denoted the development of conduction or rhythm cardiac changes that would suggest acute cardiotoxicity.
This study showed that through the monitoring of dogs, using the combination of echocardiography and cardiac biomarkers, it was possible to achieve early detection of cardiac abnormalities, suggestive of doxorubicin induced cardiotoxicity.
Índice geral
Agradecimentos ... ix
Resumo ... xi
Lista de Figuras ... xvii
Lista de Esquemas ... xvii
Lista de abreviaturas e siglas ... xix
Capítulo 1 ... 1
Revisão Bibliográfica ... 1
1. Introdução ... 3
1.1 Doxorrubicina ... 3
1.1.1 Indicações terapêuticas, posologia e modo de administração ... 4
1.1.2 Mecanismo de ação ... 5 1.1.3 Farmacodinamia e farmacocinética ... 6 2. Mecanismos de Cardiotoxicidade ... 7 2.1 Stresse oxidativo ... 7 2.2 Disfunção mitocondrial ...10 2.3 Apoptose ...11 2.4 Metaloproteinases da matriz ...12
2.5 Supressão da expressão genética ...13
2.6 Aminas vasoativas ...14 2.7 Doxorrubicinol ...14 2.8 Reação imunológica ...14 3. Cardiotoxicidade ...15 3.1 Cardiotoxicidade aguda ...16 3.2 Cardiotoxicidade crónica ...17 3.2.1 Remodelação cardíaca ...18
4. Incidência e fatores predisponentes ...20
5. Métodos de diagnóstico para a deteção de cardiotoxicidade ...21
5.1 Radiografia torácica ...21
5.2 Eletrocardiograma ...22
5.3 Holter ...24
5.4 Ecocardiografia ...24
5.5.1 Péptidos Natriuréticos ...28
5.5.2 Troponinas cardíacas ...29
5.6 Biópsia endomiocárdica ...32
5.7 Histopatologia ...32
6. Monitorização de cães submetidos a tratamento com doxorrubicina ...34
7. Estratégias de prevenção de cardiotoxicidade ...37
8. Tratamento ...40 Capítulo 2 ...41 Casos clínicos ...41 1. Objetivo ...43 2. Introdução ...45 3. Casos clínicos ...47
3.1 Identificação dos animais ...47
3.2 Informação clínica e diagnóstico ...47
3.3 Tratamento e evolução ...49 3.3.1 Caso prospetivo ...49 3.3.2 Casos retrospetivos ...60 4. Discussão ...75 5. Limitações do Trabalho ...81 6. Conclusão ...83 7. Referências bibliográficas ...85
Lista de Figuras
Figura 1 - Estrutura da doxorrubicina ... 3
Figura 2 - Processo de intercalação. ... 6
Figura 3 - Mecanismo stresse oxidativo enzimático e não enzimático ...10
Figura 4 - Mecanismos de cardiotoxicidade da doxorrubicina.. ...15
Figura 5 - Alterações histológicas secundárias à administração de doxorrubicina ...33
Figura 6 - Radiografias torácicas laterais do animal 1 na projeção lateral esquerda ...51
Figura 7 - Imagens ecocardiográficas do animal 1. ...52
Figura 8 - Holter - Primeira sessão. ...55
Figura 9 - Holter - Segunda sessão. ...57
Figura 10 - Glândula mamária do animal 1 ...58
Figura 11 - Radiografia torácica na projeção lateral esquerda do animal 1...59
Figura 12 - Radiografia torácica na projeção ventrodorsal do animal 1. ...59
Figura 13 - Radiografia torácica na projeção lateral esquerda do animal 2...61
Figura 14 - Radiografia torácica na projeção dorsoventral do animal 2. ...61
Figura 15 - Imagem de tomografia computorizada do animal 3. ...63
Figura 16 - Radiografia torácica na projeção lateral esquerda do animal 3...65
Figura 17 - Imagens ecocardiográficas do animal 3. ...66
Figura 18 - Reconstrução em 3 dimensões da massa ...67
Figura 19 - Radiografias torácicas do animal 4. ...70
Figura 20- Imagem ecocardiográfica do controlo efetuado antes da 4ª sessão ...71
Figura 21 - Imagem ecocardiográfica do controlo efetuado antes da 4ª sessão ...71
Lista de Esquemas
Esquema 1 - Sugestão de monitorização de cães, sem doença cardíaca, submetidos a tratamento com doxorrubicina. ...37Esquema 2 - Tratamento e controlo a que o animal 1 foi submetido. ...49
Esquema 3 - Tratamento e controlo a que o animal 2 foi submetido. ...60
Lista de Tabelas
Tabela 1 – Classificação do grau de toxicidade. ...26
Tabela 2 - Alteração dos parâmetros ecocardiográficos secundários ao uso crónico de doxorrubicina ...28
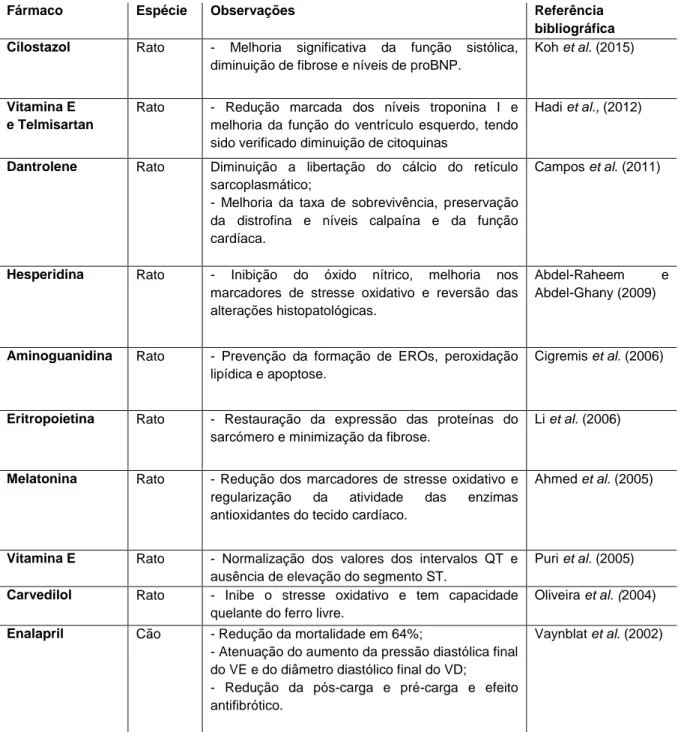
Tabela 3 - Agentes farmacológicos que demonstraram ação cardioprotetora ...39
Tabela 4 - Classificação do grau de lesão do miocárdio ...46
Tabela 5 - Identificação dos animais incluídos no trabalho. ...47
Tabela 6 - Informação clínica relevante, exames complementares e diagnóstico definitivo dos cães avaliados. ...48
Tabela 7 - Hemogramas de controlo do animal 1, no decorrer do tratamento. ...50
Tabela 8 - Parâmetros bioquímicos avaliados no animal 1, no decorrer do tratamento. ...50
Tabela 9 - Parâmetros ecocardiográficos controlados no animal 1, no decorrer da quimioterapia. ...53
Tabela 10 - Controlo de biomarcadores cardíacos efetuado no animal 1. ...53
Tabela 11 - Registo de atividade do animal durante o Holter na primeira sessão. ...54
Tabela 12 - Registo de atividade do animal duranteo Holter na segunda sessão. ...56
Tabela 13 - Hemogramas realizados no decorrer do protocolo de quimioterapia do animal 2. ...61
Tabela 14 - Parâmetros ecocardiográficos avaliados no animal 2, no decorrer na quimioterapia. ...62
Tabela 15 - Hemogramas realizados do decorrer do protocolo de quimioterapia do animal 3 ………64
Tabela 16 - Parâmetros bioquímicos avaliados no decorrer do protocolo de quimioterapia do animal 3. ...65
Tabela 17 - Parâmetros ecocardiográficos avaliados no animal 3 no decorrer da quimioterapia. ...66
Tabela 18 - Protocolo CHOP e controlos a que o animal 4 foi submetido. ...68
Tabela 19 - Hemogramas de controlo realizados ao animal 4, no decorrer da quimioterapia. ...69
Tabela 20 Parâmetros bioquímicos controlados no decorrer da quimioterapia. ...69
Tabela 21 - Parâmetros ecocardiográficos avaliados no animal 4, no decorrer do protocolo de quimioterapia. ...71
Tabela 22 - Protocolo CHOP e controlos a que o animal 5 foi submetido. ...72
Tabela 23 - Hemogramas de controlo realizados ao animal 5, no decorrer do protocolo CHOP. ...73
Tabela 24 – Parâmetros bioquímicos avaliados ao longo do protocolo de quimioterapia do animal 5. ...74
Tabela 25 - Parâmetros ecocardiográficos controlados no animal 5, no decorrer da quimioterapia. ...74
Lista de abreviaturas e siglas
ADN - Ácido desoxirribonucleico ANP – Péptido natriurético atrial ARN - Ácido ribonucleico
CM – Cardiomiopatia
CMD – Cardiomiopatia dilatada DC – Dose cumulativa
DOX – Doxorrubicina
DOX-Fe2+ - Complexo doxorrubicina-ião ferroso DOX-Fe3+ - Complexo doxorrubicina-ião férrico ECG – Eletrocardiograma
EROs – Espécies reativas de oxigénio FE – Fração de encurtamento
Fe2+ - Ião ferroso Fe3+ - Ião férrico
FEVE – Fração de ejeção ventricular esquerda H2O2 – Peróxido de hidrogénio
HO• - radical hidroxilo
HVP – Hospital Veterinário do Porto i.e. - Por exemplo
IC – Insuficiência cardíaca
ICC – Insuficiência cardíaca congestiva MMPs – Metaloproteinases da matriz Ms – milissegundos
O2 – Oxigénio
O2●− - Radical superóxido PO – Via oral
proBNP – Péptido natriurético do tipo B
Protocolo CHOP – Ciclofosfamida, Doxorubicina, Vincristina, Prednisolona SRAA – Sistema-renina-angiotensina-aldosterona
TDI – Doppler tecidular
TEI - Índice de desempenho do miocárdio VHS – Sistema de unidade vertebral
Capítulo 1
1. Introdução
1.1
Doxorrubicina
A Doxorrubicina (DOX) é um antibiótico com propriedades antineoplásicas, pertencente ao grupo das antraciclinas, isolado a partir de culturas fúngicas de
Streptomyces peucetius var. caesius. Esta é constituída por uma porção aglicónica e uma
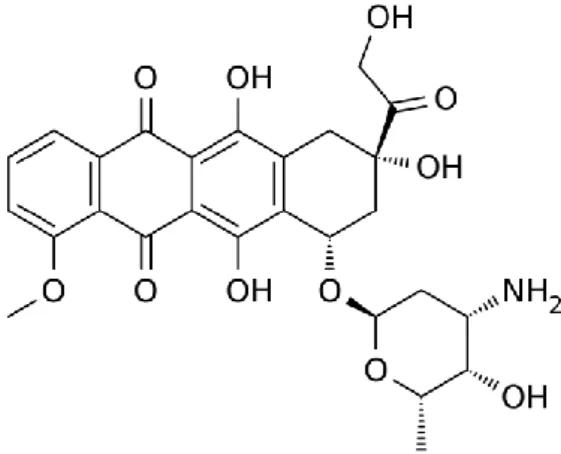
glicónica. A porção aglicónica é constituída por um anel tetracíclico, com grupos quinona-hidroquinona ao nível dos anéis adjacentes (Takemura e Fujiwara, 2007; Meredith e Dass, 2016), que lhes permite quer receber, como doar eletrões (Menna et al., 2012). A porção glicónica, por sua vez, é constituída por um açúcar denominado daunosamida e encontra-se unido por uma ligação glicosídica a um dos anéis (Meredith e Dass, 2016) (Figura 1).
Figura 1 - Estrutura da doxorrubicina (adaptado de Carvalho et al., 2013).
A DOX possui regiões hidrofílicas e hidrofóbicas, o que lhe permite ligar-se tanto a proteínas plasmáticas, como à membrana celular. Por se tratar de uma molécula anfotérica, tem a capacidade de atuar em meios ácidos e alcalinos. Estas características garantem a sua extrema versatilidade funcional, sendo possível a sua entrada em diferentes compartimentos celulares, incluindo o núcleo e mitocôndrias. No meio intracelular a DOX é reduzida a doxorrubicinol, que também possui atividade biológica (Mitry e Edwards, 2016).
1.1.1 Indicações terapêuticas, posologia e modo de administração
A DOX é um dos agentes antineoplásicos mais utilizados em Medicina Veterinária. A sua eficácia como quimioterápico já foi comprovada em diversos casos e as suas indicações terapêuticas são consideradas bastante amplas (Morris e Dobson, 2001). Este fármaco pode ser utilizado como terapia simples ou combinada, para tratamento de diversas doenças nas quais se incluem o linfoma, a leucemia, os adenocarcinomas mamários, os carcinomas, os sarcomas de tecidos moles, os osteossarcomas e o tumor venéreo transmissível (Morris e Dobson, 2001; Gava, 2014).
A DOX é considerada o fármaco mais eficaz, quando usado como agente único, no tratamento do linfoma canino. Os protocolos combinados utilizando DOX, ciclofosfamida, vincristina e prednisona, conhecidos por protocolos CHOP, são frequentemente utilizados na prática clínica e, geralmente, resultam numa taxa de remissão de 80-90 % e num período médio de sobrevivência de 12 meses (Argyle, 2008).
Os cães com tumores mamários têm, também, indicação para tratamento com DOX, como forma de terapia adjuvante, ou no caso de existência de metástases. Quando comparados a animais que apenas foram submetidos a cirurgia, os animais que receberam terapia adjuvante com DOX, manifestaram controlo da recidiva durante um período mais longo e a taxa de sobrevida obtida foi superior (Simon et al., 2006).
A DOX é considerada como tratamento quimioterápico de eleição no caso de carcinoma de tiróide em cães, especialmente quando a extirpação cirúrgica é passível de ser executada com margens limpas (Slensky et al., 2003).
Relativamente aos sarcomas de tecido mole, assume-se que a DOX tem uma boa ação no controlo local e sistémico da doença, sendo considerada como o agente único mais eficaz para o seu tratamento (Selting et al., 2005).
No caso de resistência a vincristina, considerada o fármaco de eleição para o tratamento de tumor venéreo transmissível, a DOX tem demonstrado ser uma boa alternativa (Brandão, 2002).
Tal como sucede com os restantes fármacos citotóxicos, a sua administração deve ser realizada, e repetida, em intervalos regulares, para que seja possível a recuperação dos tecidos afetados, entre os tratamentos. Desta forma, é necessário equilibrar o tempo entre administrações, permitindo a recuperação desses tecidos, sem que ocorra replicação das células tumorais (Morris e Dobson, 2001).
No caso concreto da DOX, a supressão máxima da medula óssea ocorre sete a dez dias após a sua administração, com recuperação ao vigésimo primeiro dia. Esta é a razão
Dobson, 2001). A dose recomendada, e mais frequentemente utilizada na prática clínica, é de 30mg/m2, para animais com mais de 15 kg, a cada 21 dias, por via intravenosa (Morris e Dobson, 2001), sendo recomendado não ultrapassar a dose cumulativa (DC) de 240mg/m2 (Tilley et al., 2008). Para animais com um peso inferior a 15 kg a dose instituída deverá ser de 1mg/kg (Ratterree et al., 2012). Contudo, é importante referir que a dose e intervalo de administração podem ser modificados pelo Médico Veterinário, de acordo com o caso clínico em questão e com a sua progressão. Está, ainda, descrita a administração de 10 mg/m2, a cada 7 dias (Morris e Dobson, 2001), bem como 30mg/m2, como agente único, a cada 2 semanas. De fato, estudos demonstraram diferenças significativas na eficácia da DOX no tratamento de osteossarcoma apendicular, sendo realizado tratamento a cada 2 semanas, verificando-se o aumento do tempo de sobrevida médio dos animais (Madewell et al., 1978; Berg et al., 1995).
A administração de DOX está associada a efeitos adversos, pela sua fraca seletividade para as células tumorais, provocando lesão ao nível dos tecidos saudáveis (Šimûnek et al., 2009). Entre os efeitos mais frequentes encontram-se as reações de hipersensibilidade, a atrofia testicular, a alopécia, a mielossupressão, a toxicidade gastrointestinal, a cardiotoxicidade e a necrose tissular perivascular, em caso de extravasamento durante a sua administração (Withrow et al., 2013).
A DOX apenas está disponível para administração intravenosa, dado que não é absorvida ao nível do trato gastrointestinal (Neuwald, 2009). A infusão do fármaco deverá ser feita ao longo de, pelo menos, 15 minutos (Morris e Dobson, 2001).
1.1.2 Mecanismo de ação
A quimioterapia baseia-se na utilização de fármacos com ação citotóxica contra células que apresentam elevadas taxas de proliferação, com o objetivo de atrasar ou interromper a progressão do tumor primário ou da metástase (Morris e Dobson, 2001).
A DOX é considerada um agente não-específico do ciclo celular, podendo atuar quer nas células em divisão (fases G1,S,G2 e M), como nas células em fase de repouso (G0) (Ratterree et al., 2012). Contudo, a sua ação citotóxica mais marcada é observada no decorrer da fase S do ciclo celular, a fase de síntese, onde ocorre replicação do ácido desoxirribonucleico (ADN) (Nascimento e Martins, 2005).
O fato de a DOX ter a capacidade de reagir com vários componentes celulares, faz com que possua um mecanismo multimodal de toxicidade celular (Withrow et al., 2013). A molécula de DOX entra na célula, por difusão passiva, e difunde-se para o núcleo, onde intercala com os pares de bases do ADN (Hole, 2015). Desta forma, inibe as polimerases de
ADN e de ácido ribonucleico (ARN) (Figura 2), interrompendo a síntese de proteínas e a replicação. Esta intercalação conduz a quebras na cadeia dupla de ADN e à fragmentação do núcleo com cromatina condensada, ocorrendo a indução de apoptose (Takemura e Fujiwara, 2007; Yang et al., 2015; Meredith e Dass, 2016). Ocorre ainda a inibição da enzima topoisomerase II, necessária à rutura, enrolamento e reagrupamento dos segmentos da molécula de ADN (Carvalho et al., 2013) para a transcrição e replicação, sem alterar a sua estrutura e sequência (Carvalho et al., 2009). O ADN é, então, incapaz de prosseguir no processo de replicação e ocorre morte celular (Meredith e Dass, 2016).
1.1.3 Farmacodinamia e farmacocinética
São vários os fatores que influenciam a distribuição de fármacos no organismo, como o fluxo de sangue para os diferentes órgãos, a difusão do mesmo a partir de vasos sanguíneos, a ligação às proteínas e a lipossolubilidade (North e Banks, 2009).
Após a sua administração, por via intravenosa, a DOX distribui-se pelo organismo em geral, mas com concentrações mais elevadas no coração, rins, pulmão, fígado e baço. Posteriormente, ocorre a redistribuição lenta a partir desses locais. De referir que a DOX
Figura 2 - Processo de intercalação; a) A doxorrubicina forma uma ligação covalente (assinalada a
vermelho) com a guanina numa das cadeias de ADN, mediada pelo formaldeído e o hidrogénio liga-se à guanina na cadeia oposta; b) Estrutura de intercalação da doxorrubicina no ADN (adaptado de Yang
Este fármaco possui uma grande afinidade para os cardiomiócitos, onde a sua concentração chega a ser 40 vezes superior à existente no sangue (Staszczyk et al., 2013). A sua ligação ao ADN das células e à cardiolipina, presente no interior das mitocôndrias, faz com que a fração livre seja muito pequena (North e Banks, 2009). A sua semi-vida plasmática inicial é de, aproximadamente, 60 minutos (Viéra, 2015). É metabolizada a nível hepático e eliminada 50 a 60% por via biliar, até sete dias após a sua administração (North e Banks, 2009).
A DOX não interage de forma antagónica com outros quimioterápicos geralmente utilizados. Assim, devido à sua ampla atividade antineoplásica e flexibilidade das dosagens e protocolos, este é considerado um fármaco muito útil, não só isoladamente, mas também em protocolos combinados (Neuwald, 2009).
2. Mecanismos de Cardiotoxicidade
A cardiotoxicidade induzida pela DOX é considerada um processo multifatorial e distinto do mecanismo terapêutico (Thorn et al., 2011), uma vez que os miócitos cardíacos não se replicam ativamente (Salvatici et al., 2014).
O mecanismo responsável pela toxicidade cardíaca da DOX é considerado controverso, sendo inúmeras as hipóteses propostas e estudadas. A produção de espécies reativas de oxigénio (EROs) constitui o principal mecanismo responsável pela cardiotoxicidade induzida pela DOX. Este resulta na remodelação da matriz extracelular, na morte celular dos cardiomiócitos e na redução da contratilidade cardíaca. Assim, poderá ocorrer um processo de disfunção ventricular agudo ou crónico (Angsutararux et al., 2015).
2.1
Stresse oxidativo
A teoria do stresse oxidativo envolve a produção de EROs a nível do miocárdio, quer de forma aguda como crónica. Este mecanismo causa lesões irreversíveis em múltiplos componentes celulares, como nos lípidos da membrana celular, nas proteínas e nos ácidos nucleicos (Salvatici et al., 2014; Polegato et al., 2015), induzindo também a disfunção mitocondrial (Green e Leeuwenburgh, 2002). Este foi o primeiro mecanismo proposto e o mais estudado para explicar a cardiotoxicidade induzida pela DOX (Angsutararux et al., 2015).
Torna-se importante destacar que a oxidação é uma parte fundamental do metabolismo celular e que os radicais livres são produzidos quer em condições normais, como em caso de disfunção biológica. Estes são considerados espécies químicas altamente
reativas, que diferem das demais por terem um, ou mais eletrões, sem par nas órbitas externas. Os radicais livres podem originar EROs, que incluem o radical superóxido (O2●-).
Estes são produzidos como produtos intermediários e são necessários numa série de reações bioquímicas normais, onde atuam como moléculas de sinalização intracelular. Sob condições fisiológicas, as EROs são mantidas em equilíbrio, através dos sistemas antioxidantes. Contudo, quando esse equilíbrio é alterado ocorre stresse oxidativo (Hole, 2015). As consequências incluem a peroxidação dos lipídios da membrana, a lesão a nível das proteínas dos tecidos e membranas, assim como das enzimas e do ADN (Barreiros et
al., 2006).
A capacidade de formação de EROs associada à DOX advém da sua estrutura química. Esta contém uma porção quinona, que é reduzida a uma semiquinona, numa reação catalisada por uma série de redutases (i.e. citocromo P450 redutase, NADH desidrogenase ou xantina oxidase), a nível da mitocôndria. A semiquinona tem a capacidade de transferir os seus eletrões não emparelhados, a um aceitador de eletrões, que geralmente é uma molécula de oxigénio (O2). Como consequência, as células são expostas
a elevados níveis de EROs, como o anião superóxido (O2●−) (Menna et al., 2012). Por sua vez, este anião tem a capacidade de reduzir o ião férrico (Fe3+) a ião ferroso (Fe2+), bem como facilitar a libertação de ferro livre, a partir de moléculas que contêm ferro (Angsutararux et al., 2015):
Fe3++ O2●− → Fe2+ +O2
Green e Leeuwenburgh (2002) demonstraram que ocorre aumento dos níveis de ferro no plasma após o tratamento com DOX, o que suporta a teoria supracitada.
Assim, ocorre oxidação da semiquinona, que volta à sua forma inicial de quinona, completando o ciclo redox, amplificando o desenvolvimento do stresse oxidativo. Este é considerado o mecanismo enzimático de formação de EROs (Angsutararux et al., 2015) (Figura 3).
O anião superóxido formado é convertido, através da via superóxido dismutase, a peróxido de hidrogénio (H2O2). Esta é considerada uma molécula estável em condições
normais, passível de ser eliminada pelo sistema antioxidante, através das enzimas catalase e glutationa peroxidase. Contudo, pode reagir com metais de transição, como o ferro, produzindo o radical hidroxilo (HO•), que é altamente reativo e resistente à da ação das enzimas antioxidantes (Angsutararux et al., 2015):
A formação do radical hidroxilo também pode ocorrer através da reação entre o peróxido de hidrogénio e o radical superóxido, formado na sequência do ciclo redox, através da reação Haber-Weiss (Salazar-Mendiguchia et al., 2014; Angsutararux et al., 2015):
O2●−+ H2O2 → OH−+OH●+O2
Uma outra via responsável pela produção de radicais livres é a não enzimática (Figura 3). Esta envolve a reação entre o ferro e a DOX. Assim, é originado um complexo DOX-ião férrico (DOX – Fe3+), no interior da célula, que é tóxico para as proteínas e para os
lípidos da membrana (Jain, 2000; Šimunek, et al., 2009). Na presença de agentes redutores (i.e. NADPH, o citocromo P450 redutase ou a glutationa), o complexo DOX – Fe3+ é convertido em complexo DOX-ião ferroso (DOX – Fe2+), podendo reagir com o oxigénio e originar radicais superóxido (Keizer et al., 1990; Tokarska-Schlattner et al., 2006; Angsutararux et al., 2015) (Figura 3). Ichikawa et al. (2014) verificaram que corações de ratos com CM induzida por DOX apresentavam níveis de ferro sensivelmente mais elevados a nível mitocondrial, quando comparado com outros tipos de CMs ou com função cardíaca normal.
O coração é particularmente sensível à ação da DOX, existindo uma ativação exacerbada do fármaco, devido à importante acumulação que ocorre no tecido cardíaco (Pereira et al., 2011). Isto porque este órgão possui um grande volume de mitocôndrias, que tanto são fonte, como alvo de EROs, pela sua elevada taxa de consumo de oxigénio (North e Banks, 2009). Assim, o coração possui níveis elevados de enzimas com propriedades redutase e desidrogenase (i.e. NADPH desidrogenase), que desempenham um papel importante na transferência de eletrões, responsável pela produção de agentes oxidantes (Green e Leeuwenburgh, 2002).
Como o coração possui uma quantidade reduzida de enzimas antioxidantes torna-se mais sensível ao stresse oxidativo, quando comparado com órgãos como os rins ou o fígado (Jain, 2000; Rochette et al., 2015). Está descrito que a DOX diminui a atividade da enzima glutationa peroxidase, acentuando a sensibilidade do coração ao stresse oxidativo. Este fato verifica-se pela exposição a níveis elevados de peróxido de hidrogénio, que pela baixa atividade da enzima não é corretamente eliminado (Schimmel et al., 2004).
As mudanças no estado antioxidante do miocárdio, assim como o stresse oxidativo, diminuem o metabolismo energético cardíaco. Desta forma são denotados efeitos prejudiciais na estrutura e função cardíacas (Ahmed et al., 2005; Hadi et al., 2012).
As consequências das EROs a nível da contratilidade cardíaca estão bem documentadas, contudo são poucos os estudos relativos aos efeitos destes agentes na
excitabilidade cardíaca. Esta depende da função dos sarcolemas cardíacos e dos canais iónicos mitocondriais, que se apresentam alterados após ação das EROs. Assim, sugere-se que o potencial de repouso poderá ser alterado, originando possíveis arritmias (Rochette et
al., 2015).
Figura 3 - Mecanismo stresse oxidativo enzimático e não enzimático. OH•: Radical hidroxilo; SOD: Enzima superóxido dismutase; O2●−: Anião superóxido; Fe3+: Ião férrico; Fe2+: Ião ferroso; H2o2: Peróxido de hidrogénio; GSSG: Glutationa oxidada; GSH: Glutationa (adaptado de Šimùnek et al., 2009).
2.2
Disfunção mitocondrial
O tecido cardíaco é abundante em mitocôndrias, pela exigente necessidade de energia, sendo dependente do fornecimento contínuo de ATP para sustentar a sua função contrátil. Cerca de 95 % do ATP cardíaco deriva da fosforilação oxidativa (Wallace, 2007). Assim, qualquer interferência a nível da produção de energia afeta toda a fisiologia e contração do músculo cardíaco (Pereira et al., 2011).
O fato de as mitocôndrias serem alvo de toxicidade das EROs induzidas pela DOX deve-se à sua elevada afinidade com a cardiolipina, um fosfolípido aniónico presente na membrana mitocondrial interna (Tokarska-Schlattner et al., 2006; Rochette et al., 2015). O stresse oxidativo conduz à dissociação das proteínas periféricas da membrana mitocondrial
interna associadas à cardiolipina, como o citocromo c e a creatina quinase mitocondrial, sendo iniciado o processo de apoptose (Abdel-Raheem e Abdel-Ghany, 2009).
As mitocôndrias do miocárdio desempenham um papel fulcral na regulação fisiológica da homeostase intracelular de iões cálcio (Hole, 2015). Os canais transportadores de cálcio e os miofilamentos são considerados sensíveis ao stresse oxidativo (Rochette et
al., 2015). Como consequência da peroxidação lipídica e redução do ATP celular, da
glutationa e do NADPH ocorre destruição dos lípidos da membrana. Desta forma, ocorre alteração da permeabilidade mitocondrial (Hole, 2015; Rochette et al., 2015). Esta alteração tem como consequência o edema osmótico e a lesão estrutural da mitocôndria (Carvalho et
al., 2013). Consequentemente, ocorre uma alteração do influxo do cálcio do compartimento
extracelular para os cardiomiócitos, devido à perda de capacidade de armazenamento da mitocôndria (Hole, 2015). Esta alteração é considerada tanto consequência, como origem de mais EROs (Rochette et al., 2015). A rápida libertação de cálcio do reticulo sarcoplasmático tem como consequência o aumento de cálcio intracelular e poderá resultar em disfunção mitocondrial (Olson e Mushlin, 1990; Nascimento e Martins, 2005). Zhou et al. (2001) demonstraram que, 5 semanas após o término do tratamento com DOX, a capacidade de armazenamento de cálcio por parte da mitocôndria não melhorou. Assim, os autores sugerem que estes efeitos são cumulativos e irreversíveis depois de iniciado o tratamento. Desta forma, ocorre alteração da função adrenérgica do miocárdio, lesão ao nível dos tecidos e morte celular, fazendo com que a contração cardíaca seja prejudicada (Schimmel
et al., 2004).
2.3
Apoptose
Recentemente, a apoptose das células miocárdicas tem sido sugerida como um mecanismo de cardiotoxicidade da DOX. Uma vez que é causada a lesão, os cardiomiócitos estão destinados a sofrer apoptose ou necrose, que poderá ocorrer meses, ou anos após a terapia ser terminada. Assim, inicia-se o processo de remodelação do miocárdio (Zuppinger
et al., 2007).
As EROs produzidas pelo metabolismo deste fármaco, ao nível dos cardiomiócitos, conduzem à libertação de substâncias pró-apoptóticas que iniciam a ativação da cascata das caspases, essenciais para ativação e execução da morte celular programada (Green e Leeuwenburgh, 2002). Assim, são ativadas as caspases 9 e 3 e ocorre libertação de citocromo c no citosol, ocorrendo apoptose dos cardiomiócitos (Volkova e Russel, 2011; Octavia et al., 2012).
Arola et al. (2000) observaram que a DOX em ratos, induzia a apoptose dos cardiomiócitos 24 a 48 horas após a sua administração. O estudo demonstrou ainda que,
com apenas uma administração (2,5mg/kg), se verificavam mudanças a nível do citosqueleto, nomeadamente a alteração estrutural do disco Z, a desorganização e despolimerização dos filamentos de actina, como também a diminuição da densidade das miofibrilas e dos elementos contráteis dos cardiomiócitos. Os autores defendem que o fato de a lesão ser tão aguda induz a disfunção do miocárdio. As implicações a nível da organização dos cardiomiócitos e indução da apoptose foram consideradas, pelos mesmos autores, dose dependentes e cumulativas, contudo não aditivas. Assim, no estudo referido, a percentagem de apoptose dos cardiomiócitos aumentou com a administração de DOX, atingindo o pico às 24 horas, tendo, posteriormente, diminuído. Com a nova dose administrada verificou-se, novamente, o seu aumento (Arola et al., 2000).
2.4
Metaloproteinases da matriz
A ocorrência de apoptose dos cardiomiócitos tem como consequência a remodelação do miocárdio e a matriz extracelular é considerada o compartimento mais afetado. Os miofibroblastos são células implicadas no processo de remodelação do miocárdico, após a lesão. Estes são responsáveis pela produção de fibronectina e colagénio. Uma alteração ao nível da sua distribuição e da sua quantidade poderá afetar a complacência do miocárdio, com consequente alteração da função sistólica e diastólica (Gava, 2014). Gava (2014) demonstrou que o aumento na quantidade de miofibroblastos no miocárdio que sofreu lesão, manteve a complacência miocárdica, evitando a rutura da área cardíaca afetada. No entanto, quando a lesão causada pela DOX supera a capacidade do miocárdio em sustentar a reparação dos tecidos, a função sistólica não é preservada (Gava et al., 2016).
A DOX induz, ainda, a produção de óxido nítrico, um radical livre instável, mediador de múltiplas funções fisiológicas, que pode também estar implicado em processos de inflamação local e destruição de tecidos. No entanto, poderá ser potencialmente tóxico, em caso de stresse oxidativo e deficiência do sistema antioxidante. Assim, o óxido nítrico, na presença de anião superóxido, forma peroxinitrito, um potente oxidante de proteínas (Tokarska-Schlattner et al., 2006; Abdel-Raheem e Abdel-Ghany, 2009). Este tem a capacidade de atravessar as membranas lipídicas, permitindo-lhe a entrada quer no núcleo, como nas mitocôndrias, potenciando os efeitos do stresse oxidativo nos cardiomiócitos (Mitry e Edwards, 2015). Induz, ainda, a ativação de precursores metaloproteinases da matriz (MMPs) (Takemura e Fujiwara, 2007). Estas estão presentes em condições normais ao nível do miocárdio e aumentam com a lesão cardíaca, sendo responsáveis pela degradação dos componentes da matriz extracelular. Está descrito que, após o tratamento crónico com DOX, há um aumento da atividade destas enzimas (Polegato et al., 2015).
troponina I e miosina), induzindo a disfunção sistólica aguda (Angsutararux et al., 2015; Polegato et al., 2015). Polegato et al. (2011) demonstraram que a ativação das metaloproteinases 2 e 9 ocorre precocemente, com apenas uma dose de DOX, em ratos. Este fato sugere que o processo de remodelação, que culmina em dilatação ventricular esquerda, é iniciado em fase precoce do tratamento (Polegato et al., 2011).
2.5
Supressão da expressão genética
A DOX influencia negativamente a expressão de várias proteínas específicas do músculo cardíaco. Assim, está descrita a capacidade de inibição de proteínas contráteis, provocando a redução da contratilidade cardíaca e perda de miofibrilas do músculo cardíaco (Dudnakova et al., 2003; Chatterjee et al., 2010).
Num estudo realizado por Campos et al. (2011) verificou-se que a administração de DOX, em ratos, conduziu a uma redução acentuada, ou mesmo perda de distrofina na membrana dos cardiomiócitos, juntamente com disfunção do ventrículo esquerdo. A distrofina, uma proteína estrutural do miocárdio, assume importância na contração dos cardiomiócitos, na integridade do sarcolema e das miofibrilas e na ligação entre o citoesqueleto e a matriz extracelular. Os mesmos autores demostraram que há um aumento significativo da expressão de calpaína, uma protease dependente do ião cálcio, em cardiomiócitos de ratos submetidos a tratamento com DOX. Esta é ativada pelo aumento da concentração de cálcio intracelular que ocorre como consequência do tratamento com DOX e é responsável pela proteólise da distrofina. Assim, a calpaína tem a capacidade de digerir a distrofina muito rapidamente, quando a concentração de cálcio é favorável à sua ativação (Campos et al., 2011).
Ocorre, também, alteração a nível da integridade mitocondrial e, consequentemente, a deterioração energética deste organelo, através da inibição das suas proteínas (Pereira et
al., 2011).
A DOX, tendo capacidade de inibição de proteínas do retículo sarcoplasmático, interfere com a homeostasia do cálcio, levando a redução na concentração do ião no pico da contração muscular, causando disfunção sistólica (Nascimento e Martins, 2005).
Conclui-se que a inibição de cada tipo de proteínas está associada a determinadas características atribuídas à CM induzida pela DOX (Pereira et al., 2011).
2.6
Aminas vasoativas
Após administração de DOX ocorre a libertação de fatores de ativação plaquetários e de aminas vasoativas (i.e., histamina, catecolaminas e prostaglandinas), que resultam na quimiotaxia ao local afetado. Desta forma, esta contribui para a progressão da lesão miocárdica, através da ligação a recetores ao nível do miocárdio (Schimmel et al., 2004; Gava et al., 2013). Guo et al. (2013) demonstraram que a DOX induz um aumento significativo nos níveis de citoquinas inflamatórias específicas. Nelson e Couto (2009) defendem que a libertação das aminas vasoativas desencadeia o processo de cardiotoxicidade aguda. Contrariamente, Polegato et al. (2015) sugerem que estas não estão relacionadas com a disfunção cardíaca aguda.
2.7
Doxorrubicinol
Como resultado do metabolismo da DOX, a nível hepático, surge o doxorrubicinol. Este é um metabolito hidroxilado de maior polaridade, o que favorece a sua retenção, em grande quantidade e durante mais tempo, no interior da célula. Deste modo assume importância na cardiotoxicidade crónica (Gammella et al., 2014). Está descrito que este metabolito poderá alterar os processos de homeostase do ferro, bem como inibir as trocas iónicas de cálcio, sódio e potássio, inclusivamente a nível mitocondrial (Salazar-Mendiguchia
et al., 2014). Consequentemente, ocorrem alterações energéticas no miocárdio, sendo
alterado o ciclo de contração-relaxamento e prejudicando a função sistólica (Angsutararux et
al., 2015). Por esta razão Torres e Simic (2012) sugerem que o doxorrubicinol será
responsável pela cardiotoxicidade crónica, enquanto que a lesão oxidativa, segundo os autores, promoverá a cardiotoxicidade aguda.
O doxorrubicinol, por favorecer a libertação de histamina, poderá estar implicado no desenvolvimento de arritmias cardíacas (Steffenon, 2014).
2.8
Reação imunológica
Um outro mecanismo de cardiotoxicidade sugerido está relacionado com o desencadear de uma reação imunológica após a ocorrência do stresse oxidativo e consequente lesão dos miócitos cardíacos. Foi realizado um estudo em ratos hipertensos, no qual se verificou o aumento de antigénios que apresentam células dendríticas após tratamento com DOX, sugerindo que ocorre uma estimulação da expressão de antigénios (Schimmel et al., 2004).
Após a análise das alíneas anteriores, conclui-se que a cardiotoxicidade induzida pela DOX resulta de um processo multifatorial, ainda correntemente em estudo. A figura 4 demonstra a interação entre os diferentes mecanismos.
Figura 4 - Mecanismos de cardiotoxicidade da doxorrubicina. A produção de espécies reativas de
oxigénio tem como consequência a lesão a nível das proteínas, das membranas e do material genético, alterando, permanentemente, o equilíbrio redox ao nível dos diferentes compartimentos, como a mitocôndria, o núcleo, e o retículo sarcoplasmático. Compromete a atividade enzimática e os vários processos metabólicos e, posteriormente, resulta em stresse oxidativo (adaptado de Carvalho
et al., 2013).
3. Cardiotoxicidade
Cada vez que se pondera o início de um protocolo de quimioterapia é crucial avaliar o risco-beneficio de cada caso em particular, de modo a tomar uma decisão adequada. Quando os efeitos secundários de um tratamento conduzem a uma diminuição mais marcada na qualidade de vida do que a doença em si, a terapia deverá ser repensada (Withrow et al., 2013).
O efeito cardiotóxico da DOX está descrito quer em humanos, como em animais e poderá ocorrer em qualquer fase do tratamento (Souza e Camacho, 2006). Vleet et al.
(1980) sugerem que o cão é menos suscetível a cardiotoxicidade secundária a DOX do que o coelho e o rato. No entanto é mais suscetível do que o ser humano (Sorenmo et al., 2004).
É importante salientar que a cardiotoxicidade induzida por DOX se categoriza em aguda e crónica. As diferenças entre ambas centram-se na apresentação clínica e no prognóstico (Wojtacki et al., 2000).
3.1
Cardiotoxicidade aguda
Mitry e Edwards (2015) sugerem que os efeitos agudos, induzidos pela DOX, podem resultar da alteração na dinâmica do cálcio, do desenvolvimento do stresse oxidativo e da alteração energética do miocárdio. Contrariamente, Nelson e Couto (2009) e Souza e Camacho (2006) defendem que a cardiotoxicidade aguda resulta da desgranulação dos mastócitos, ao nível do tecido cardíaco. Esta desgranulação traduz-se na libertação de histamina e catecolaminas, responsáveis pelas alterações hemodinâmicas verificadas. Segundo Polegato et al. (2011) a libertação de catecolaminas e histamina facilita a entrada de cálcio nos cardiomiócitos e induz alterações no transporte de sódio e potássio, favorecendo desta forma o desenvolvimento de arritmias.
A cardiotoxicidade aguda, em cães, traduz-se no desenvolvimento de hipotensão, taquicardia sinusal, arritmias supraventriculares e ventriculares, bloqueios atrioventriculares e de ramos. Estão, ainda, descritas alterações a nível do segmento ST e onda T e aumento ou diminuição da amplitude da onda R (Souza e Camacho, 2006). Segundo Zambelli (2014) as alterações no complexo QRS são frequentemente observadas.
As alterações supracitadas ocorrem durante a administração ou horas após a mesma, essencialmente se a administração da DOX for realizada rapidamente (Souza e Camacho, 2006; Tilley et al., 2008). Estas são consideradas transitórias e não são dose dependentes. Por esta razão, Souza e Camacho (2006) e Šimúnek et al. (2009) consideram que a cardiotoxicidade aguda não constitui uma preocupação clínica. Contudo, há autores que defendem que a frequência e ritmo cardíacos devem ser monitorizados durante a administração para que, caso se verifiquem alterações, seja possível interromper a mesma, ou realizá-la mais lentamente (Morris e Dobson, 2001; Tilley et al., 2008; Zambelli, 2014).
Puri et al. (2005) e Polegato et al. (2015) sugerem que a administração de DOX induz disfunção ventricular esquerda aguda em ratos. Polegato et al. (2011) descrevem que ocorrem uma série de alterações 48 horas, após a administração de uma única dose de DOX em ratos, nomeadamente diminuição da fração de encurtamento (FE), da fração de ejeção do ventrículo esquerdo (FEVE), do volume sistólico e do débito cardíaco, sugerindo
cardíaca, bem como o aumento do tempo de relaxamento isovolumétrico, sugerindo também a ocorrência de disfunção diastólica. Assim, no estudo referido verificou-se alteração aguda das funções sistólica e diastólica do ventrículo esquerdo.
A cardiotoxicidade aguda é considerada pouco frequente em cães. Souza e Camacho (2006) defendem que, este fato se deverá à administração de anti-histamínicos H1 que é rotineiramente realizada, antes da infusão de DOX. A própria preocupação em moderar a velocidade de administração poderá contribuir para a baixa ocorrência de eventos agudos (Gillings et al., 2009).
Torna-se importante referir que o fato de ocorrer cardiotoxicidade aguda num animal, não implica necessariamente o desenvolvimento de cardiotoxicidade crónica (Mitry e Edwards, 2015).
3.2
Cardiotoxicidade crónica
Souza e Camacho (2006) defendem que a cardiotoxicidade crónica se deve à libertação de histamina, fatores de ativação plaquetária e libertação de radicais livres no músculo cardíaco, com consequente lesão funcional e remodelação do miocárdio. Desta forma, a cardiotoxicidade crónica surge como consequência da exposição continuada dos cardiomiócitos à DOX. Cada dose resultará na morte de miócitos cardíacos adicionais, sendo este tipo de cardiotoxicidade considerado dose dependente (Barret-Lee et al., 2009). Por esta razão, quanto maior a DC aplicada, maior é o grau de disfunção miocárdica observada (Silva et al., 2004). O coração possui mecanismos compensatórios, contudo quando estes são ultrapassados, poderá ocorrer CM secundária à DOX. Esta é considerada irreversível e refratária ao tratamento e poderá surgir semanas, meses, ou mesmo anos após o início da quimioterapia (Israël, 2003; Souza e Camacho, 2006). É importante ressalvar que, assim como existe uma variação considerável na suscetibilidade à cardiotoxicidade, também existe variação nos mecanismos compensatórios entre os animais (Barret-Lee et al., 2009).
A CM secundária a DOX caracteriza-se pela remodelação cardíaca. Inicialmente verifica-se dilatação ventricular progressiva e, posteriormente, atrial. Deste modo, ocorre a deterioração da função sistólica. Com a perda progressiva da capacidade contrátil, ocorrem alterações hemodinâmicas, como a diminuição do débito cardíaco e da pressão arterial, sendo, por isso, ativados vários mecanismos de compensação, como o aumento do tónus simpático e a libertação de vasopressina (Gava, 2014).
Poderá, também, ocorrer algum grau de disfunção diastólica (Israël, 2003), dado que a diástole é extremamente dependente de ATP, produzido pelas mitocôndrias, que sofrem
alterações importantes secundariamente à DOX (Kapila e Mahajan, 2009). As características da CM induzida por DOX, em termos de morfologia e a nível funcional, são semelhantes às da cardiomiopatia dilatada primária (CMD) (Tilley et al., 2008). Neste sentido, o cão tem sido utilizado como modelo experimental para diversos estudos de medicina humana, pelas semelhanças nas características clínicas e patológicas (Nascimento e Martins, 2005). A administração de DOX, através de via intracoronária, permitiu o desenvolvimento de um modelo crónico de disfunção ventricular esquerda, permitindo o uso dos animais para cirurgia cardíaca, nomeadamente para a técnica da plicatura da parede livre do ventrículo esquerdo. Esta técnica é utilizada como tratamento de CM, através da redução do diâmetro do mesmo (Astra et al., 2003).
Torna-se importante referir que a CM secundária ao uso de DOX poderá também cursar com arritmias persistentes, bloqueios atrioventriculares e outras alterações de ritmo (Souza e Camacho, 2006). Assim, poderá ocorrer morte súbita, sem sintomatologia associada, por desenvolvimento de arritmias (Souza e Camacho, 2006). Num estudo realizado por Neuwald et al. (2009) um animal submetido a DC de 150 mg/m2 desenvolveu complexos ventriculares prematuros e teve morte súbita. Apesar de não ter sido possível confirmar a presença de CM, por não ter sido autorizada a necropsia, os autores acreditam que se terá desenvolvido, dado que, também, se verificou o aumento das troponinas cardíacas I e T.
Como consequência do desenvolvimento de CM, poderá ocorrer ICC (Wojtacki et al., 2000), mesmo após a descontinuação do fármaco. Segundo Silva et al. (2004) as taxas de morbilidade e mortalidade relativas a ICC, em cães tratados experimentalmente com DOX até DC de 240 mg/m2, foram de 71% e 43%, respetivamente. Num estudo realizado por Ratterree et al. (2012) no qual foram utilizadas DC de DOX que variavam entre 90 e 265mg/m2, o tempo de sobrevida médio, após o diagnóstico de ICC, foi de 48 horas a 90 dias. Assim, é possível concluir que nenhuma DC de DOX pode ser considerada absolutamente segura e que o prognóstico, uma vez desenvolvida ICC é considerado reservado (Angelis et al., 2016). Contudo, a DC máxima recomendada é de 240mg/m2, apesar da maioria dos protocolos ser considerado completo com doses entre os 150 e os 180 mg/m2 (Ratterree et al., 2012). Acima dos 240 mg/m2 mais do que 2-3% dos animais desenvolvem CM (Zambelli, 2014).
3.2.1 Remodelação cardíaca
colagénio que ligam as diferentes células, contribui para a redução progressiva de contratilidade do miocárdio (Koh et al., 2015). Os miócitos não têm a capacidade de substituir as células que sofreram lesão, sendo substituídos por tecido fibroso (Salvatici et
al., 2014). Assim, como a capacidade de regeneração cardíaca é limitada, o número de
cardiomiócitos irá diminuir progressivamente, conduzindo à remodelação ventricular (Olson e Mushlin, 1990; Rochette et al., 2015).
A perda celular origina paredes ventriculares com uma menor espessura, cursando com o aumento do stresse a que estas estão sujeitas, sendo prejudicada a função sistólica (Chatterjee et al., 2009). Secundariamente também é observada disfunção diastólica, por dilatação ventricular, tal como sucede na CMD (O'Grady e O'Sullivan, 2004).
A perda de contratilidade miocárdica traduz-se num maior volume residual no ventrículo esquerdo, no final da sístole, tendo como repercussão a redução do volume de ejeção ventricular. Deste modo, ocorre diminuição da pressão arterial sistémica, que desencadeará os mecanismos de compensação de baixo débito cardíaco, através da estimulação simpática. Desta forma ocorre o aumento da frequência cardíaca, o aumento da resistência vascular periférica e a ativação do sistema-renina-angiotensina-aldosterona (SRAA), contribuindo para a retenção de sódio e de água. No entanto, com a cronicidade do processo, estes mecanismos tornam-se contraproducentes, surgindo a acumulação de fluídos e o aumento da resistência vascular periférica (pré-carga e pós-carga), contribuindo para remodelação cardíaca. Esta remodelação ocorre, não só pelo aumento da pré-carga e da pós-carga, mas também pela ativação do sistema nervoso simpático, ou devido a alterações intersticiais originadas pela resposta à ativação do SRAA (Tilley et al., 2008; Yin, 2010).
O ventrículo, sendo sujeito a sobrecarga de volume, adapta-se desenvolvendo hipertrofia ventricular excêntrica, que se traduz num aumento da espessura da parede, associada a dilatação das câmaras cardíacas. A tensão requerida pelo miocárdio, por forma a sustentar determinada pressão intraventricular, aumenta à medida que a câmara cardíaca dilata (Tilley et al., 2008).
Pontes et al. (2010) descreveram a ocorrência de uma média de 33% de aumento do diâmetro interno do ventrículo esquerdo em ratos submetidos a tratamento com DOX, acompanhada de uma média de 24% de diminuição da espessura interna do ventrículo esquerdo, comparativamente aos animais controlo, sendo estes fatores sugestivos de dilatação cardíaca. Como consequência da dilatação ventricular, poderá aumentar o diâmetro dos anéis valvulares atrioventriculares, resultando numa válvula mitral insuficiente e num aumento das dimensões do átrio esquerdo (Yin, 2010).
No decorrer da fase oculta da CM, o fato de os vários mecanismos compensatórios atuarem em conjunto, permite que os animais se mantenham assintomáticos, mesmo na presença de disfunção sistólica do ventrículo esquerdo evidente. Numa última fase poderá ocorrer ICC, com desenvolvimento de sinais clínicos (Tilley et al., 2008).
4. Incidência e fatores predisponentes
Segundo Gallay-Lepoutre et al. (2016) a incidência de cardiotoxicidade em cães tratados com DOX varia entre 8-64%, sendo dependente do protocolo de quimioterapia utilizado, bem como dos critérios considerados para o seu diagnóstico.
A sensibilidade ao fármaco depende do indivíduo, podendo, as lesões de cardiotoxicidade, ser manifestadas em grau e tempo de desenvolvimento distinto (Souza e Camacho, 2006).
São vários os fatores predisponentes para o desenvolvimento de cardiotoxicidade induzida pela DOX em cães. Entre eles incluem-se a velocidade de administração do fármaco, DC igual ou superior 240mg/m2, doença cardíaca pré-existente, especialmente as que cursam com baixa FE, e raças predispostas a CMD (Tilley et al., 2008; Gillings et al., 2009; Wypij, 2014).
Considera-se que o tempo de administração é um fator importante, por ter relação com a concentração sérica atingida. Assim, a administração deverá ser realizada lentamente, por forma a evitar o desenvolvimento de arritmias (Withrow et al., 2013). Segundo Gillings et al. (2009) o fato de se realizar a infusão contínua de DOX durante uma hora é suficiente para reduzir significativamente a incidência de alterações, a nível de condução. Assim, é importante realizar sessões de quimioterapia com duração entre 30 a 60 minutos, com o objetivo de prevenir arritmias (Barrett-Lee et al., 2009; Wypij, 2014).
A lesão cardíaca é dose-dependente, aumentando com o incremento da DC. Desta forma, as administrações repetidas resultam em lesão adicional dos cardiomiócitos e interstício. Assim, DC superiores poderão aumentar a probabilidade de desenvolvimento de CM secundária a DOX (Filho et al., 2011).
Segundo Wypij (2014), raças que sejam predispostas a CMD, (i.e. Doberman, Boxer, Labrador Retriever) ou animais com doença cardíaca concorrente terão maior predisposição para o desenvolvimento de cardiotoxicidade. Contrariamente, num estudo realizado por Gillings et al. (2009) não foi verificado risco acrescido em animais com arritmias pré-existentes, sopros cardíacos, FE diminuída, ou que tivessem sido submetidos a radioterapia antes de ser iniciado o tratamento. Da mesma forma, não foi verificada relação entre a
neste estudo, a infusão de DOX teve a duração de uma hora, o que poderá ter tido influência nos resultados obtidos.
Zordoky et al. (2016) demonstraram que existe uma forte correlação positiva entre a lesão renal, a nível histopatológico, e a disfunção cardíaca, ambas induzidas por DOX em ratos. Assim estes autores sugerem que doentes com alteração renal são mais suscetíveis aos efeitos cardiotóxicos da DOX. Em cães não existem estudos neste sentido.
O tratamento concomitante com morfina poderá, também, ter influência na cardiotoxicidade manifestada. Este fármaco está associado a um efeito cardiodepressivo, tendo sido verificado um aumento da libertação de peróxido de hidrogénio e troponina T em animais tratados concomitantemente com DOX. Assim, o aumento da quantidade de radicais livres intracelulares potencia a lesão cardíaca (Hole, 2015).
Panjrath et al. (2007) demonstraram que, em ratos, a suplementação com ferro, na dieta, resultou num aumento substancialmente marcado da cardiotoxicidade. Assim, os autores sugerem que os animais que receberam suplementação na dieta, múltiplas transfusões de sangue ou que possuam mutações no gene regulador de ferro, têm uma maior predisposição para o desenvolvimento de cardiotoxicidade. Este fato está relacionado com o relevante papel do ferro no mecanismo de stresse oxidativo, uma vez que contribui para a formação de EROs (Panjrath et al., 2007).
5. Métodos de diagnóstico para a deteção de cardiotoxicidade
5.1
Radiografia torácica
Tilley et al. (2008) sugerem que a radiografia torácica é relativamente insensível a aumentos ligeiros do tamanho cardíaco e, em geral, as alterações em fases precoces de CM induzida por DOX são mínimas. Contrariamente, a avaliação radiográfica em fase avançada pode, inclusivamente, ter um valor clínico importante, auxiliando no diagnóstico de ICC (Tilley et al., 2008). Deverão ser avaliadas as dimensões das câmaras cardíacas bem como os grandes vasos. O tamanho do coração poderá ser avaliado segundo o sistema de unidade vertebral (VHS). A média do VHS deverá ser entre 8,5 e 10,5 vértebras, contudo, a raça do animal deverá ser tida em consideração (Tilley et al., 2008). Em caso de ICC esquerda poderá observar-se distensão das veias pulmonares com perda da definição das dos vasos pulmonares, aumento da densidade pulmonar intersticial e alveolar, essencialmente nas regiões do hilo e dorso-caudal, o que sugere a presença de edema pulmonar (Tilley et al., 2008).
Este é um exame complementar que não tem sido incluído em estudos que avaliam as repercussões cardíacas da DOX, pela sua limitação diagnóstica. Segundo Boon (2002)
as alterações ecocardiográficas tendem a preceder as radiográficas. Contudo, alguns autores recomendam a realização de radiografia torácica antes do início da quimioterapia com DOX (Silva e Camacho, 2005; Neuwald, 2009).
5.2
Eletrocardiograma
O eletrocardiograma (ECG) é considerado uma ferramenta útil para a determinação do tipo, origem e gravidade das arritmias cardíacas. Poderá ainda sugerir alteração do tamanho das câmaras cardíacas (Tilley et al., 2008).
Torna-se importante destacar que as alterações no ECG poderão surgir quer durante a administração do fármaco, de forma aguda, mas também, secundariamente às alterações cardíacas morfológicas, decorrentes do uso crónico de DOX (Vleet et al.,1980).
As alterações mais frequentemente descritas, na cardiotoxicidade aguda, incluem a alteração ao nível do segmento ST, onda T e diminuição da amplitude do complexo QRS (Tilley et al., 2008). O aumento do intervalo ST poderá estar relacionado com o prolongamento do potencial de ação. Le Marec et al. (1986) demonstraram que o potencial de ação prolonga-se ao nível das células de Purkinje como consequência da administração de DOX, pela libertação de radicais livres. A administração de DOX poderá ainda induzir, de forma aguda, arritmias supraventriculares e ventriculares, alterações na condução intraventricular e taquicardia sinusal (Pereira Neto et al., 2006). Neuwald et al. (2009) reportaram que em dezasseis cães, nos quais não foram verificados sinais clínicos sugestivos de cardiotoxicidade, 43,75% apresentaram alterações no ECG. Neste estudo o controlo eletrocardiográfico foi feito imediatamente após a administração de DOX, durante um minuto e uma semana após cada sessão. A DC máxima efetuada de DOX foi de 90mg/m2. Três animais desenvolveram complexos prematuros ventriculares, um deles imediatamente após a primeira administração de DOX. Nos restantes as alterações ocorreram após a terceira sessão de DOX (DC de 90mg/m2) e um mês após o término do tratamento. Dois cães apresentaram bloqueio atrioventricular de segundo grau do tipo Mobitz II, que se desenvolveu uma semana após a primeira sessão, tendo regularizado um mês após o tratamento. Deste modo, conclui-se que o ECG é um meio útil para identificar a cardiotoxicidade aguda (Souza e Camacho, 2006).
Relativamente à monitorização da cardiotoxicidade crónica induzida pela DOX, as alterações eletrocardiográficas podem ser consideradas não específicas, pelo fato de poderem estar relacionadas com a progressão da doença neoplásica e de não se observar correlação entre o aparecimento ou gravidade da CM (Gallay-Lepoutre et al., 2016).