Avaliação do risco de contaminação por bactérias,
no paciente submetido à broncoscopia, após
o reprocessamento do broncoscópio
*NANCY SPEKLA GRANDE1, ROMILDA APARECIDA NAKAYAMA2,
ANTONIA MARIADE OLIVEIRA MACHADO3, FÁBIO AKIO YAMAGUTI4, CESAR UEHARA5
Introdução: A broncoscopia é um procedimento diagnóstico e terapêutico realizado com a introdução nas vias aéreas de um tubo flexível que permite visualizar até as menores delas. Para evitar
ou reduzir o risco de infecções, o broncoscópio deve ser adequadamente desinfetado com, pelo menos, desinfecção de alto nível. Objetivo: Verificar se há risco de contaminação bacteriana para os
pacientes submetidos à broncoscopia do Hospital São Paulo da Unifesp, Estado de São Paulo.
Métodos: No período de 1997 a 1998, o reprocessamento do broncoscópio incluiu limpeza e enxágüe com água estéril ou potável, seguida de rinsagem com glutaraldeído a 2% por 20 minutos,
novo enxágüe com água estéril ou potável e rinsagem com álcool etílico a 70% e secagem com ar forçado pelo canal de sucção. Foram colhidas amostras de 65 pacientes para exames microbiológicos,
instalando-se soro fisiológico estéril pelo canal de sucção do broncoscópio. Resultados: Após o reprocessamento foram encontrados nas amostras Staphylococcus epidermidis, Enterobacter sp,
Acinetobacter baumanni, Streptococcus viridans, Staphylococcus aureus, Streptococcus beta hemoliticus A, Staphylococcus coagulase negativa e em cinco amostras houve crescimento de microbactéria na cultura. Conclusões: A desinfecção do broncoscópio com glutaraldeído a 2% não
foi suficiente para garantir a desinfecção do aparelho e a presença de Staphylococcus epidermidis
indica que houve contaminação do broncoscópio pela manipulação após a desinfecção.
(J Pneumol 2002;28(5):250-60)
Evaluation of the risk of bacterial contamination in the patient
submitted to bronchoscopy, after reprocessing the bronchoscope
Introduction: Bronchoscopic is a diagnostic and therapeutic procedure performed by introducing a flexible tube in the airways that allows for the visualization even of the smallest airways. In order to prevent or reduce the risk of infection, the bronchoscope must be adequately
disinfected with at least high level disinfection. Purpose: Check for the risk of bacterial contamination for patients submitted to bronchoscopy at the Hospital São Paulo of Unifesp
University, State of São Paulo. Methods: From 1997 to 1998, bronchoscope reprocessing included cleaning, rinsing with sterile or potable water, followed by rinsing with 2% glutaraldehyde for 20 minutes, rinsing again with sterile or potable water, and rinsing with 70%
ethyl alcohol, and forced-air drying through the suction channel. Samples of 65 patients were collected for microbiologic tests by instilling sterile saline solution through the suction channel of
the bronchoscope. Results: After reprocessing, the following were found in the samples:
Staphylococcus epidermidis, Enterobacter sp, Acinetobacter baumanni, Streptococcus viridans,
Staphylococcus aureus, Streptococcus beta hemoliticus A, Staphylococcus coagulase negative, and mycobacterial growth was found in the culture of five samples. Conclusions: Bronchoscope disinfection with 2% glutaraldehyde was not sufficient to assured disinfection of the scope and the presence of Staphylococcus epidermidis shows that there was bronchoscope contamination due
to handling after disinfection.
* Trabalho realizado na Universidade Federal do Estado de São Paulo (Unifesp/EPM), São Paulo, SP.
1. Enfermeira da Unidade de Pneumologia do HSP. Mestre em Ciên-cias Pneumológicas.
2. Médica Broncoscopista do Hospital São Paulo.
3. Médica Responsável pelo Setor de Microbiologia do Laboratório Central do HSP.
4. Médico Assistente da UTI do HC-FMB-Unesp. 5. Professor Adjunto da Disciplina de Pneumologia.
Endereço para correspondência – Nancy Spekla Grande, Rua Botuca-tu, 740, 3º and. – Disciplina de Pneumologia – 04023-062 – São Pau-lo, SP.
I
NTRODUÇÃOAntigamente, acreditava-se que a broncoscopia tivesse baixo ou nenhum risco de infecção, mas, com os adven-tos da SIDA e da tuberculose epidêmica, começou-se a
pensar em infecção pelo broncoscópio(1,2). Existe risco
potencial de transmissão de infecção durante a broncos-copia e o espectro dessas infecções vai da colonização assintomática à morte(1,3).
Rotineiramente, durante seu uso, os broncoscópios são contaminados por microorganismos. Técnica desapropria-da ou falhas durante o reprocessamento do broncoscó-pio podem causar infecção nosocomial, principalmente em pacientes imunocomprometidos(4).
As vias aéreas superiores são colonizadas por floras bacterianas que vão escasseando até chegar aos brôn-quios, que, usualmente, são estéreis. Pereira et al.(5)
en-contraram em um estudo com 66 pacientes, pós-bron-coscopia, um com pneumonia, em quem foi isolado microorganismo da flora oral.
Na literatura são relatados casos de aumento da tempe-ratura até oito dias após a broncoscopia(6-14). Esse aumento
da temperatura pode estar relacionado à toxina das bacté-rias, quando há infecção, ou mesmo ao aumento do fator de necrose tumoral no lavado broncoalveolar(15), o que
torna difícil a elucidação de infecção via broncoscópio. Há relatos que sugerem que o broncoscópio pode trans-mitir infecção via transbrônquica. Os achados foram: piora do infiltrado preexistente ou desenvolvimento de novos infiltrados(16), um caso de pneumonia estreptocócica e
septicemia nas 24 horas após a broncoscopia com bióp-sia endobrônquica(17), aspiração de um abscesso
pulmo-nar(18), lobectomia de um abscesso pulmonar
desenvolvi-do sete dias após biópsia transbrônquica(19), pneumonia
bacteriana progressiva em dois pacientes e um abscesso pulmonar por anaeróbios em um paciente com criptoco-cose, após broncoscopias(20). Há vários relatos de
tuber-culose progredindo dias a semanas após a broncoscopia, culminando com a morte em alguns casos(19-22).
O broncoscópio é um artigo semicrítico, por estar em contato com a mucosa íntegra. Devido a sua estrutura complexa e frágil, que inclui partes constituídas de mate-riais sensíveis ao calor, o broncoscópio impõe restrições a certos métodos de reprocessamento. Os mais apropria-dos para esse aparelho (item semicrítico) são a esteriliza-ção por óxido de etileno, que leva um tempo de aeraesteriliza-ção de 24h ou a esterilização com soluções quimioesterilizan-tes (glutaraldeído a 2%) em imersão por 8 a 10h. Estas técnicas são inviáveis aos serviços de grande movimento, como é o caso do Serviço de Broncoscopia do Hospital São Paulo. Ou, ainda, pode-se realizar a desinfecção de alto nível com glutaraldeído a 2% por 20 minutos, sendo este tempo o mínimo recomendado(23,24).
As técnicas usualmente recomendadas para o repro-cessamento do broncoscópio são a desinfecção com so-lução de glutaraldeído a 2% ou esterilização com óxido de etileno(25). Segundo Dawson et al.(26) e Leers(27), o
ins-trumento deve ser imerso na solução de glutaraldeído por 20 a 30 minutos; ou exposto a óxido de etileno durante 90 minutos, seguido de aeração por 10 horas. A desin-fecção química com glutaraldeído a 2%, na temperatura de 25oC com tempo de exposição por 45 minutos, é 100%
efetiva para destruir M. tuberculosis e cai para 99,8%, se o tempo de exposição baixa para 10 minutos.
O Centers for Disease Control (CDC), assim como o
Ministério da Saúde e a Secretaria de Saúde do Estado de São Paulo, recomendam como procedimento mínimo uma desinfecção de alto nível para esse aparelho(28-35).
Com vistas no que foi exposto até agora, resolvemos realizar este trabalho, objetivando verificar se há risco de contaminação por bactérias para o paciente que se sub-mete a broncoscopia, após a desinfecção do broncoscó-pio na Unidade de Broncoscopia do Hospital São Paulo, no período de 1997 a 1998.
C
ASUÍSTICA E MÉTODOEste trabalho baseou-se na experiência diária do servi-ço e em relatos de outro serviservi-ço de broncoscopia, em que se observaram exames falso-positivos de BK no lavado brônquico, devido à contaminação do broncoscópio. Ape-sar de não termos relatos no nosso serviço, optamos por realizar controle laboratorial no sentido de verificar se o procedimento de limpeza e desinfecção do aparelho es-tava sendo eficiente.
As amostras foram coletadas entre 1997 e 1998, de exames broncoscópicos de 65 pacientes que vinham en-caminhados para diagnóstico de sua doença através do material colhido de rotina, durante o exame. São colhi-dos de rotina, durante a broncoscopia, lavado brônquico ou broncoalveolar e biópsia brônquica ou transbrônquica. O aparelho utilizado foi o broncoscópio Olympus P 20. As patologias e/ou doenças de base constituíam-se de hipóteses diagnósticas; a maioria dos pacientes veio para elucidação diagnóstica, ou seja, havia suspeita de câncer de pulmão, tuberculose, infecções oportunistas em pa-cientes soropositivos para HIV, infecções bacterianas, mi-coses pulmonares, fibrose pulmonar; não estavam em uso de antibioticoterapia os pacientes.
Siglas e abreviaturas utilizadas neste trabalho SIDA – Síndrome da imunodeficiência adquirida CDC – Centers for Disease Control
Vinte e três pacientes (35,4%) eram do sexo feminino e 42 (64,6%) do masculino. A idade variava de dois a 83 anos, sendo a média de 49 anos.
No Hospital São Paulo, as broncoscopias são realiza-das rotineiramente, em um local reservado para este pro-cedimento, em pacientes internados e ambulatoriais. En-tre um paciente e outro, o aparelho é submetido a uma desinfecção de alto nível com glutaraldeído a 2% por 20 minutos realizado por profissional não médico treinado, ou pelo médico broncoscopista, e que segue o seguinte protocolo(36-40).
• A limpeza deve ser realizada após cada procedimen-to, com o uso de água corrente e detergente neutro, de-vendo-se escovar e lavar todos os canais e conexões do aparelho, deixando-o previamente submerso em deter-gente enzimático (Endozime) por um período de três a cinco minutos.
• Secar o aparelho antes de ser colocado no glutaral-deído a 2%, para evitar a rediluição do desinfetante.
• Altos níveis de desinfecção devem ser obtidos com o uso do glutaraldeído a 2%. Após o uso do aparelho em cada paciente, e antes do primeiro exame do dia, este deve ser submetido a uma submersão em glutaraldeído a 2% por 20 minutos.
• Após desinfecção, o aparelho e seus canais devem ser enxaguados com água estéril, ou com água potável, seguida com rinsagem com álcool a 70%.
• O canal deve ser seco através de fluxo de oxigênio. • A estocagem do aparelho deve ser feita em ambien-te seco, na posição vertical e com ventilação adequada.
Durante a introdução do aparelho, podemos levar ma-terial da orofaringe, inclusive as bactérias residentes, para a árvore traqueobrônquica. Estas bactérias, do ponto de vista de infecção, têm pouca importância. Apenas po-dem confundir quando se deseja identificar o agente etio-lógico da infecção bacteriana utilizando-se apenas cultura qualitativa.
Durante a realização da broncoscopia em pacientes infectados há acúmulo de secreção e de agentes patogê-nicos no canal de aspiração e, se não realizarmos limpe-za e desinfecção adequadas, podemos levar infecção a outros pacientes.
Como pré-medicação, foi rotineiramente usado 0,5mg de sulfato de atropina e 50mg de meperidina ou 5mg de diazepam ou midazolam por via endovenosa, minutos antes do início do exame.
Com o paciente em decúbito dorsal foi aplicada anes-tesia tópica na orofaringe com lidocaína spray a 10%, em três séries de três borrifadas, que corresponderam a cerca de 90mg de lidocaína base, no total. Cada série de
sprays foi feita a intervalo de um minuto, aproximada-mente.
Para a introdução do aparelho foi utilizada a via nasal, sendo que as narinas haviam sido untadas previamente com lidocaína geléia a 2%, com a finalidade anestésica e lubrificante; ou a via endotraqueal, quando o paciente estava intubado.
Através do canal de aspiração do broncofibroscópio locado na orofaringe, foi instilada lidocaína a 2%, em porções de 1ml, nas paredes das laringe, até que se tives-se obtido adequada inibição do reflexo da tostives-se. A dotives-se utilizada, em geral, foi de 5 a 8ml(41,42).
Ultrapassada a laringe, o aparelho era deslizado para as vias aéreas inferiores, alternando avanço do aparelho e instilação de 1ml de lidocaína líquida a 2%, evitando exceder a dose total de 400mg.
Com o broncoscópio posicionado, para a coleta do la-vado broncoalveolar, eram instilados lotes de 20ml de soro fisiológico estéril e, em seguida, aspirado com sucção controlada, para evitar o colapso das vias aéreas, direto a um tubo de Lukens estéril. O volume total do soro fisioló-gico administrado era de 100 a 180ml.
Coletamos do canal do broncoscópio material para pesquisa de BK, bacterioscopia, cultura bacteriana e de micobactéria em três fases:
– antes da realização da broncoscopia, para verificar se o broncoscópio estava contaminado ou não antes de entrar em contato com o paciente. Este era enumerado frasco 1.
– imediatamente após a realização da broncoscopia, para saber qual a flora retida no broncoscópio após o término do exame. Este era enumerado frasco 3.
– após a desinfecção de alto nível, para avaliar se esta foi realmente eficaz. Este era enumerado frasco 4.
Para enriquecer os resultados aproveitamos os resulta-dos do lavado brônquico ou broncoalveolar do paciente, que fazia parte do procedimento habitual do exame. Este era enumerado frasco 2.
Logo em seguida, os tubos devidamente identificados eram encaminhados para o Laboratório Central do Hos-pital São Paulo, Setor de Microbiologia, onde eram ma-nipulados em fluxo laminar, preparadas lâminas para de-tecção do bacilo de Koch e feita a coloração para gram, preparadas placas de Teague, ágar sangue e ágar choco-late e encaminhada parte da amostra para cultura de mi-cobactéria. Tudo segundo normas internacionais da NCCLS
(National Committee for Clinical Laboratory Stan-dard)(43).
Foram tabuladas todas as amostras e atribuídos sinais (+) quando houve crescimento nesse frasco ou (–) quando não houve crescimento; e feitas tabelas para cada pesqui-sa gram, BK, aeróbios e micobactérias.
ausência de cada microorganismo, nos quatro tubos estu-dados.
Fixamos em 0,05 ou 5% (α < 0,05) o nível de rejeição da hipótese de nulidade, assinalando-se com um asteris-co os valores significativos.
R
ESULTADOSOs resultados de BAAR foram negativos em todos os
frascos das amostras; portanto, o G de Cochran mos-trou-se não-significativo. O BAAR foi o exame para
detec-ção de BK de mais rápido resultado (Tabela 1).
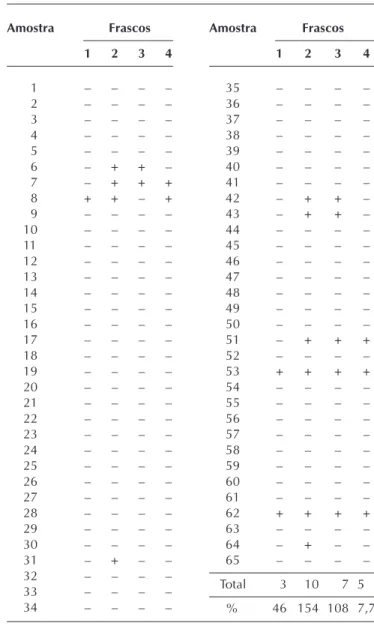
Na cultura de micobactérias houve crescimentos em vários frascos. Somente Mycobacterium tuberculosis
cresceu na cultura.
O cálculo do G de Cochran mostrou-se significante no frasco 1, por este apresentar menor índice de contamina-ção que os demais frascos (4,6%) (Tabela 2).
Houve também crescimento em 15,4% dos frascos 2, 10,8% dos frascos 3 e 7,7% dos frascos 4.
Houve crescimento de Mycobacterium tuberculosis nos frascos 2 e 3 em três amostras. Houve crescimento nos frascos 2, 3 e 4 em duas amostras. Em duas amostras houve crescimento em todos os frascos. Em uma amos-tra houve crescimento no frasco 2; e em uma amosamos-tra houve crescimento nos frascos 1, 2 e 4.
Para os resultados de gram mostraram-se significantes os frascos 1 e frascos 4 (Tabela 3).
TABELA 1 BAAR
Amostra Frascos
1 2 3 4
01 – – – –
02 – – – –
03 – – – –
04 – – – –
05 – – – –
06 – – – –
07 – – – –
08 – – – –
09 – – – –
10 – – – –
11 – – – –
12 – – – –
13 – – – –
14 – – – –
15 – – – –
16 – – – –
17 – – – –
18 – – – –
19 – – – –
20 – – – –
21 – – – –
22 – – – –
23 – – – –
24 – – – –
25 – – – –
26 – – – –
27 – – – –
28 – – – –
29 – – – –
30 – – – –
31 – – – –
32 – – – –
33 – – – –
34 – – – –
Amostra Frascos
1 2 3 4
35 – – – –
36 – – – –
37 – – – –
38 – – – –
39 – – – –
40 – – – –
41 – – – –
42 – – – –
43 – – – –
44 – – – –
45 – – – –
46 – – – –
47 – – – –
48 – – – –
49 – – – –
50 – – – –
51 – – – –
52 – – – –
53 – – – –
54 – – – –
55 – – – –
56 – – – –
57 – – – –
58 – – – –
59 – – – –
60 – – – –
61 – – – –
62 – – – –
63 – – – –
64 – – – –
65 – – –
Total 0 0 0 0
% 0 0 0 0
Os resultados de BAAR dispensam análise
TABELA 2 Micobactérias
Amostra Frascos
1 2 3 4
01 – – – –
02 – – – –
03 – – – –
04 – – – –
05 – – – –
06 – + + –
07 – + + +
08 + + – +
09 – – – –
10 – – – –
11 – – – –
12 – – – –
13 – – – –
14 – – – –
15 – – – –
16 – – – –
17 – – – –
18 – – – –
19 – – – –
20 – – – –
21 – – – –
22 – – – –
23 – – – –
24 – – – –
25 – – – –
26 – – – –
27 – – – –
28 – – – –
29 – – – –
30 – – – –
31 – + – –
32 – – – –
33 – – – –
34 – – – –
Amostra Frascos
1 2 3 4
35 – – – –
36 – – – –
37 – – – –
38 – – – –
39 – – – –
40 – – – –
41 – – – –
42 – + + –
43 – + + –
44 – – – –
45 – – – –
46 – – – –
47 – – – –
48 – – – –
49 – – – –
50 – – – –
51 – + + +
52 – – – –
53 + + + +
54 – – – –
55 – – – –
56 – – – –
57 – – – –
58 – – – –
59 – – – –
60 – – – –
61 – – – –
62 + + + +
63 – – – –
64 – + – –
65 – – – –
Total 03 010 007 50,
% 46 154 108 7,7
Teste G de Cochran
Não houve crescimento nos frascos 1, como era espe-rado. Mas houve um caso (1,5%) de contaminação no frasco 4, isto é, após a desinfecção de alto nível.
Foram encontrados 35,4% de casos positivos no lava-do broncoalveolar lava-do paciente, que se mantiveram positi-vos em 20% antes da desinfecção de alto nível (frasco 3). A grande maioria desses era gram+.
Na cultura de aeróbios, o cálculo do G de Cochran mostrou-se significativo nos frascos 1 (9,2%) e 4 (16,9%), por estes apresentarem o menor número de amostras positivas (Tabela 4).
Houve crescimento no frasco 1 de seis amostras: uma com Streptococcus viridans e cinco com
Staphylococ-cus coagulase negativa. O broncoscópio chegou conta-minado em 9,2% das amostras.
Houve crescimento no frasco 2 de 62 amostras. A flo-ra encontflo-rada nos pacientes foi a seguinte:
Streptococcus viridans 35 (53,8%)0
Staphylococcus aureus 13 (20%),00
Staphylococcus coagulase negativa 9 (13,8%)0
Pseudomonas aeruginosa 8 (12,3%)0
Klebsiella pneumoniae 8 (12,3%)0
Enterobacter sp 4 0(6,2%)0
Enterococcus sp 3 0(4,6%)0
Escherichia coli 2 0(3,1%)0
Streptococcus betahemolitic A 2 0(3,1%)0
TABELA 3 GRAM
Amostra Frascos
1 2 3 4
01 – + – –
02 – + – –
03 – + + –
04 – + – –
05 – – – –
06 – – – –
07 – + – –
08 – + + +
09 – – – –
10 – – – –
11 – – – –
12 – + + –
13 – + – –
14 – – – –
15 – – – –
16 – – – –
17 – – – –
18 – – – –
19 – – – –
20 – – – –
21 – – – –
22 – + + –
23 – – – –
24 – + – –
25 – – – –
26 – – – –
27 – + – –
28 – – – –
29 – – – –
30 – – – –
31 – + + –
32 – – – –
33 – – – –
34 – – – –
Amostra Frascos
1 2 3 4
35 – – – –
36 – – – –
37 – – – –
38 – – – –
39 – + – –
40 – – – –
41 – – – –
42 – – – –
43 – – – –
44 – + – –
45 – – – –
46 – + + –
47 – – – –
48 – + – –
49 – + + –
50 – + + –
51 – – – –
52 – – – –
53 – – + –
54 – – – –
55 – – – –
56 – + + –
57 – + – –
58 – – – –
59 – – + –
60 – – – –
61 – + – –
62 – – + –
63 – – + –
64 – + – –
65 – – – –
Total 0 230, 13 01 % 0 35,4 20 15
Teste G de Cochran
G calculado: 48,1* – G crítico: 7,82
TABELA 4 Cultura de aeróbios
Amostra Frascos
1 2 3 4
01 – + + –
02 – + + –
03 – + + +
04 – + + –
05 – + + –
06 – + + –
07 – + + –
08 + – + –
09 – + + +
10 – + + –
11 – + + –
12 – + + –
13 – + + –
14 – + + –
15 – + + +
16 – + + –
17 – + + +
18 – + + –
19 – + + –
20 – + + –
21 – + + –
22 – – + –
23 – + + –
24 – + + +
25 – + + –
26 – + + –
27 – + + +
28 – + + –
29 – + + –
30 – + + –
31 – – + –
32 – + + +
33 – + + –
34 – + – –
Amostra Frascos
1 2 3 4
35 – + – +
36 + + + –
37 – + + –
38 – + + –
39 – + + –
40 – + + –
41 – + + –
42 – + + –
43 – + + –
44 – + + –
45 – + + +
46 + + + –
47 – + + –
48 – + + –
49 – + + –
50 – + + –
51 – + + –
52 – + + –
53 – + + –
54 – + + –
55 + + + –
56 – + + +
57 – + + –
58 – + + +
59 + + + –
60 – + + –
61 – + + –
62 + + + +
63 – + + +
64 – + + +
65 – + + +
Total 06 620, 063 011 % 92 95,4 969 169
Teste G de Cochran
Acinetobacter baumanni 2 0(3,1%)0
Corinebacterium sp 1 0(1,54%)
Citrobacter sp 1 0(1,54%)
Proteus mirabilis 1 0(1,54%)
Houve crescimento no frasco 3 de 63 amostras. Isto é: após o exame, o broncoscópio reteve microorganismos em 96,9% das amostras. Foram achados:
Pseudomonas aeruginosa 23 (35,4%)0
Streptococcus viridans 22 (33,9%)0
Klebsiella pneumoniae 9 (13,8%)0
Enterobacter sp 8 (12,3%)0
Staphylococcus aureus 8 (12,3%)0
Acinetobacter baumanni 5 0(7,7%)0
Enterococcus sp 4 0(6,2%)0
Staphylococcus coagulase negativa 3 0(4,6%)0
Staphylococcus epidermidis 3 0(4,6%)0
Streptococcus pneumoniae 2 0(3,1%)0
Escherichia coli 2 0(3,1%)0
Providencia rett-geri 2 0(3,1%)0
Corinebacterium sp 1 0(1,54%)
Stenotrophomonas (xant. Maltophilia) 1 0(1,54%)
Streptococcus betahemolit. A 1 0(1,54%)
Após a desinfecção, o broncoscópio manteve-se con-taminado em 11 amostras (16,9%), nas quais foram acha-dos:
Staphylococcus coagulase negativa 4 (6,2%)0
Staphylococcus epidermidis 3 (4,6%)0
Enterobacter sp 2 (3,1%)0
Acinetobacter baumanni 1 (1,54%)
Streptococcus viridans 1 (1,54%)
Staphylococcus aureus 1 (1,54%)
Pseudomonas aeruginosa 1 (1,54%)
Streptococcus betahemolit. A 1 (1,54%) Quando comparamos a bacterioscopia com a bacterio-logia, no frasco 1, verificamos que, apesar de a bacterios-copia ter se apresentado negativa em todas as amostras, houve crescimento de microorganismos na cultura de seis amostras (casos 8, 36, 46, 55, 59 e 62).
Houve três casos de gram positivo e cultura negativa no frasco 2 (casos 8, 22, 31). Em 42 amostras, gram foi negativo nesse frasco, mas teve a cultura positiva.
Houve 13 casos de gram positivo (casos 3, 8, 12, 22, 31, 46, 49, 50, 53, 56, 59, 62 e 63) e dois de cultura negativa, no frasco 3 (casos 33 e 34).
No frasco 4 houve um caso de gram positivo e cultura negativa (caso 8), que pode indicar que a bactéria não resistiu até ser semeada. No frasco 4 foram encontrados três casos de Staphylococcus epidermidis.
D
ISCUSSÃOTeoricamente, o broncoscópio apresenta grande risco de causar complicações porque o instrumento atravessa a orofaringe e carrega microorganismos para as vias aé-reas inferiores e para o parênquima pulmonar.
Nos Estados Unidos da América, as infecções de trato respiratório baixo somam aproximadamente 20% das infecções hospitalares, com 200.000 casos por ano. Mais da metade dessas infecções são polimicrobianas por or-ganismos gram –, como Pseudomonas aeruginosa, Kle-bsiella sp, Enterobacter sp, Escherichia coli, Serratia sp, Proteus sp.; 70% são aeróbios gram+ e a maioria é
Staphylococcus coagulase positiva(45).
O lavado broncoalveolar tem benefício confirmado no diagnóstico de patógenos pulmonares oportunistas; en-tretanto, a contaminação do lavado pela flora da orofa-ringe pode falsear os resultados das culturas do material coletado por essa técnica.
O reprocessamento do broncoscópio deve abranger as seguintes etapas, segundo Rutala(46):
– A limpeza mecânica com água e detergente neutro e enzimático tem como objetivo a retirada da matéria orgâ-nica da superfície externa e dos canais do broncoscópio. O uso de detergente diminui a tensão superficial da maté-ria orgânica, permitindo a suspensão de suas partículas. As enzimas proteolíticas no detergente enzimático que-bram as proteínas da matéria orgânica, removendo-a e facilitando a limpeza.
– Enxágüe e drenagem dos canais, permitindo a reti-rada do detergente com a sujeira e escoamento da água e secagem do canal, impedindo a alteração do pH e a redi-luição do desinfetante.
– Desinfecção em alto nível com glutaraldeído a 2% por 20 minutos, para eliminar microorganismos como o
Mycobacterium tuberculosis. O glutaraldeído é um de-sinfetante ou esterilizante químico, dependendo do tem-po em contato com a superfície do objeto a ser reproces-sado. Sua ação depende do período de validade (14 ou 28 dias), das condições de uso (temperatura, por exem-plo), rediluição e contato com a matéria orgânica(24). Tem
amplo espectro de atuação, atividade mesmo em presen-ça de matéria orgânica, embora esta a lentifique.
– Finda a desinfecção, novo enxágüe com água estéril ou potável seguida, neste caso, de rinsagem com álcool a 70%. Objetiva a retirada de desinfetante.
– Secagem dos canais com ar comprimido e estoca-gem em local apropriado para não haver contaminação ou dano ao aparelho.
Alguns fatores podem interferir na qualidade do repro-cessamento do broncoscópio. São elas:
• A configuração do aparelho e sua composição. • O uso de água ou soluções contaminadas. • Presença de matéria orgânica.
• Qualidade da limpeza.
• Concentração e tempo de exposição ao desinfetante. • Temperatura e pH durante o processo de desinfec-ção.
• O tipo e o nível de contaminação. • Resistência microbiana ao desinfetante.
Estudos controlados têm avaliado a eficácia de diferen-tes desinfetandiferen-tes para uso no broncoscópio. Dos três de-sinfetantes testados, glutaraldeído a 2%, álcool etílico e clorexidina, o mais efetivo foi a clorexidina seguido pelo glutaraldeído a 2% e o álcool etílico em terceiro lugar.
Segundo Penco e Martin(47), a probabilidade de haver
transmissão de infecção por artigos esterilizados parece pequena, mas quando são utilizadas soluções químicas ger-micidas em artigos que não podem ser submetidos a mé-todos físicos, essa possibilidade passa a existir. Já para Rutala(46), esterilização é um conceito absoluto e não
rela-tivo.
A primeira indicação de seu potencial de ação veio de um estudo de Pepper e Lieberman(48), em 1962, de
dial-deídos saturados.
Em 1963, Stonehill et al.(49) defendiam que a solução
alcalina de glutaraldeído era rapidamente esporicida e no fim daquele ano, o glutaraldeído já começava a ser co-mercializado como quimioesterilizante seguro e com tem-po de contato mais aceitável na rotina dos hospitais.
Spaulding(50), em 1968, classificou o glutaraldeído como
um germicida de alto nível, capaz de produzir esteriliza-ção se o tempo de exposiesteriliza-ção for suficientemente longo. Seu poder de destruir esporos é considerado excelente quando comparado com outros germicidas.
Stonehill et al.(49) e Borick et al.(51) encontraram o
tem-po de três horas para o glutaraldeído a 2% destruir estem-po- espo-ros de Bacillus sp e Clostridium sp. Rubbo et al.(52)
rela-taram que 99,99% de esporos de Bacillus anthracis e
Clostridium tetani foram eliminados com o tempo de 15 e 30 minutos, respectivamente. Muitos fabricantes, no entanto, têm recomendado de 10 a 12 horas para a esterilização com o glutaraldeído, no caso de haver fato-res adversos, como esporos fato-resistentes ou rediluição da solução germicida ou, ainda, inativação desta por maté-ria orgânica(53).
Na pesquisa de BAAR, deste estudo, não houve resulta-dos positivos. Nos frascos 1, que representam a condição de desinfecção do broncoscópio antes do exame e nos frascos 4, que representam a eficácia ou não da desinfec-ção do broncoscópio, como era esperado, não foi detec-tado o bacilo de Koch.
Foram negativos também os resultados dos frascos 2, que representam o lavado broncoalveolar do paciente, e dos frascos 3, que indicam se o broncoscópio reteve al-gum microorganismo antes de ser encaminhado para a desinfecção de alto nível.
Neste trabalho, em cultura de micobactérias, o cálculo do G de Cochran mostrou-se significante nos frascos 1, por estes apresentarem o menor índice de crescimento que os demais frascos (4,6%). No entanto, por estes fras-cos representarem o bronfras-coscópio antes do exame, de-veriam apresentar culturas negativas, para não haver ris-co de ris-contaminação do paciente.
Dentre as 65 amostras de lavado broncoalveolar dos pacientes, houve crescimento para micobactéria em 10 amostras (15,4%).
Houve crescimento em 10,8% dos frascos 3, após o término do exame; este número caiu para 7,7% após a desinfecção de alto nível, por 20 minutos.
Houve três casos em que o aparelho ia desinfetado para o paciente, cujo lavado broncoalveolar apresentou cresci-mento, ou seja o paciente era portador de tuberculose; o aparelho após o exame retinha o microorganismo, mas a desinfecção mostrou-se eficiente. Dois casos, no entan-to, embora o broncoscópio fosse desinfetado para o pa-ciente, também apresentou crescimento no lavado; o bron-coscópio retinha o microorganismo, a desinfecção não foi eficiente e houve crescimento no frasco 4.
Em dois casos houve crescimento em todos os frascos, representando ineficiência do processo de desinfecção tanto antes do exame, como ao final da desinfecção de alto nível.
Em duas amostras, somente no frasco 2 houve cresci-mento, mostrando que o broncoscópio não reteve mi-croorganismos ao final do exame e antes de ir para a desinfecção. Provavelmente, o paciente era paucibacilar. Em uma amostra, não houve crescimento somente no frasco 3 (após o término do exame), indicando que o bron-coscópio não apresentava microorganismos antes de ir para a desinfecção. Curiosamente, no frasco 4 (após a desinfecção de alto nível) dessa mesma amostra, houve crescimento. Talvez houvesse maior diluição da amostra 3, reduzindo proporcionalmente a quantidade de bacté-rias, resultando na cultura negativa.
Esses achados também foram observados por Cortese e Prakash(45), quando três pacientes investigados durante
re-sultados de cultura de material obtido por escovados, la-vagens e biópsia em pacientes com tuberculose, terá um sucesso de 58 a 96% em isolar micobactéria.
Baughman et al.(54) relataram incidência de 68% de
BAAR positivo em material colhido na broncoscopia.
Davis et al.(55) relatam culturas negativas para M.
gor-donae e M. tuberculosis após 15 minutos de desinfec-ção em glutaraldeído a 2% ou iodóforo.
Segundo Hanson et al.(23), a limpeza mecânica
minu-ciosa é suficiente para remover virtualmente todos os agen-tes infecciosos presenagen-tes no aparelho e a não realização eficiente desta permite a secagem de matéria orgânica, impossibilitando a penetração do desinfetante, mesmo durante imersão prolongada. Estudo de Davis et al.(55)
in-dicou que limpeza mecânica seguida de 15 minutos de imersão no glutaldeído a 2% e enxágüe em água estéril foram suficientes para eliminar efetivamente M. tubercu-losis e M. gordonae do broncoscópio contaminado artifi-cialmente.
Carson et al.(56) mostraram que cepas TM de
Mycobac-terium chelonei sobreviveram à exposição por 60 minu-tos em glutaraldeído a 2%. Enquanto cepas ATCC não sobreviveram à exposição por dois minutos ao mesmo desinfetante. Isso demonstra a vulnerabilidade de certas cepas de microorganismo, enquanto outras são resisten-tes ao mesmo desinfetante.
A desinfecção química com glutaraldeído a 2%, à tem-peratura de 25°C, com tempo de imersão de 45 minutos, permite eficácia de 100% na eliminação do M. tubercu-losis. Essa eficácia cai para 99,8%, se o tempo de expo-sição baixar para 10 minutos. A expoexpo-sição por 10 minu-tos é eficiente para matar organismos vegetativos e HIV(55).
Mas neste trabalho avaliamos o método de reprocessa-mento que é utilizado no dia-a-dia do serviço de broncos-copia, isto é, a desinfecção de alto nível com glutaraldeí-do a 2% por 20 minutos, que, como já foi mencionaglutaraldeí-do, é o mínimo recomendado por vários órgãos. Em 65 amos-tras de lavado broncoalveolar do paciente, houve cresci-mento de Mycobacterium tuberculosis em 10 amostras. Após o término do exame o broncoscópio reteve microor-ganismos em sete amostras; destes, a desinfecção foi efi-ciente em apenas três amostras. A confrontação destes achados com a literatura mostra que o glutaraldeído por 20 minutos não foi suficiente para a desinfecção do M. tuberculosis e isso pode acarretar diagnósticos falso-po-sitivos.
Neste trabalho, tanto na coloração para gram, quanto na cultura de aeróbios, o G de Cochran foi significativo nos frascos 1 e 4.
A coloração para gram mostrou-se negativa no frasco 1 de todas as amostras, como era esperado, pois esse representa o broncoscópio antes de ser utilizado no
pa-ciente, devendo estar, portanto, desinfetado. No entan-to, houve um caso (1,5%) de contaminação no frasco 4, isto é, depois da desinfecção de alto nível.
Chamam a atenção na cultura de aeróbios os frascos 1 e 4, porque estes apresentaram crescimento de microor-ganismos em 9,2% e 16,9% das amostras. Nesses fras-cos não deveria haver crescimento, pois eles representam o broncoscópio, quando este deveria estar desinfetado, isto é, antes do exame e após a desinfecção de alto nível, respectivamente. Em suma, o broncoscópio não estava chegando desinfetado ao paciente e o processo de desin-fecção não foi eficiente nesses casos. Devemos sempre ressaltar que a apropriada limpeza e desinfecção do bron-coscópio são obrigatórios para prevenir infecções e pseu-do-infecções.
Está, também, evidente a contaminação do broncoscó-pio pelas vias aéreas superiores, devido à presença de bactérias características da microbiota normal da boca e fossas nasais, e de outras, presentes em pacientes que recebem antibioticoterapia, pois esta inibe a flora nor-mal, permitindo que microorganismos como Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa
e Staphylococcus aureus cresçam em seu lugar(57,58).
Chama-nos também a atenção a contaminação do bron-coscópio por Staphylococcus epidermidis, presente na microbiota normal das mãos, o que pode representar má manipulação do aparelho após a sua desinfecção.
Quando comparamos a bacterioscopia com a bacterio-logia, chama a atenção a presença de quatro casos de gram positivo e cultura negativa, que pode indicar que o microorganismo não estivesse mais hábil quando foi se-meado.
Bactérias vegetativas são suscetíveis à ação do glutaral-deído. A 2% é capaz de destruir muitas espécies vegetati-vas incluindo Staphylococus aureus, Proteus vulgaris,
Escherichia coli e Pseudomonas aeruginosa em dois minutos. O glutaraldeído mostra-se como uma solução para os equipamentos que não podem ser esterilizados com método físico. Vários trabalhos demonstram a sua boa ação micobactericida(59).
Leers(27), em 1980, recomenda tratamento com
gluta-raldeído a 2% por 10 a 30 minutos para desinfecção de endoscópios fibroópticos, precedido de adequada limpe-za. Um grande número de trabalhos, também, demons-trou a atividade antiviral efetiva do glutaraldeído a 2%, mesmo em presença de matéria orgânica, embora esta a lentifique(53,60).
Ringrose(61), Bassett(62) e Ayliffe e Deverill(63)
associa-ram a resistência do microorganismo ao glutaraldeído ao tempo de contato menor que o recomendado para desin-fecção.
Scheidt(64), em 1980, encontrou contaminação de
bron-cofibroscópios por Serratia e Pseudomonas, após de-sinfecção com glutaraldeído por 10 minutos. Somente depois de 45 minutos de imersão na solução foram en-contradas as culturas negativas. Esse autor sugeriu que o tempo para esterilização fosse preferido ao tempo de desinfecção. Na rotina diária, isso é difícil, devido ao gran-de número gran-de exames dos serviços gran-de broncoscopia.
Spach et al.(40), em um levantamento bibliográfico,
re-ferem ter encontrado 96 infecções transmitidas pelo bron-coscópio, em que foram encontrados: Serratia marces-cens, Pseudomonas aeruginosa, P. pseudomallei, M. tuberculosis, M. chelonae e avium.
Fraser et al.(65) relatam 17% de cultura positiva após
desinfecção do broncoscópio com glutaraldeído a 2%. Já Suratt et al.(2) não encontraram crescimentos de cultura
de vários microorganismos após a desinfecção do bron-coscópio.
O pH e a concentração também são determinantes da atividade do glutaraldeído. A solução do glutaraldeído é a 2%, na qual foi adicionado um ativador que torna o pH próximo a 8. Esse pH oferece um número ideal de dial-deídos livres, que são responsáveis pela atividade germi-cida desse desinfetante. Após 14 dias de uso contínuo a solução fica rediluída e o pH cai, diminuindo a atividade biocida.
Devido a seu arranjo complexo com canais e válvulas, o broncoscópio pode permanecer contaminado, a des-peito de adequada limpeza e desinfecção.
Cortese e Prakash(45) sugerem que estudos sejam feitos
para avaliar a eficácia da limpeza e desinfecção dos com-ponentes internos de endoscópios, inclusive separando os canais internos do equipamento para melhor avaliar a desinfecção.
Pappas et al.(66) relatam que em seu serviço, em
Illi-nois, os broncoscópios eram limpos, enxaguados com água potável, desinfetados com glutaraldeído a 2% e no-vamente enxaguados com água potável. Após surto de infecções associadas à broncoscopia, com um óbito, os equipamentos começaram a ser esterilizados em óxido de etileno. Quando dois broncoscópios foram abertos para reparos, o canal de sucção de ambos estava danificado e a porção do interior do broncoscópio, que era usualmen-te selada, estava cheia de matéria orgânica, em cuja cul-tura cresceram M. chelonei e Pseudomonas aerugino-sa. Esse local não era atingido durante a limpeza e desinfecção ou esterilização. Duas possibilidades foram levantadas pelos autores para a contaminação do bron-coscópio: a água potável usada para o enxágüe ou o
glu-taraldeído estavam contaminados. Isso talvez explique as culturas positivas encontradas no presente.
Segundo Rutala(24), esterilização é um termo absoluto e
não relativo. Neste trabalho, tratamos com desinfecção de alto nível, que é o mínimo recomendado para garantir segurança aos pacientes submetidos à broncoscopia. Comparando os resultados obtidos com a literatura, con-cluímos que a desinfecção do broncoscópio em glutaral-deído a 2% por 20 minutos não foi eficiente em garantir a segurança de um procedimento invasivo sem riscos de contaminação aos pacientes, pois houve crescimento de
Mycobacterium tuberculosis em 4,6% dos frascos 1 e 7,7% dos frascos 4 e de bactérias aeróbicas em 9,2% e 16,9% dos frascos 1 e 4, respectivamente.
Ficou evidente, também, a contaminação pela manipu-lação após a desinfecção, devido à presença de S. epi-dermidis no frasco 4 de algumas amostras (casos 3, 9 e 15).
R
EFERÊNCIAS1. Prakash UBS. Pseudoepidemics of infections caused by bronchosco-py. Journal of Bronchology 1998;5:43-8.
2. Suratt PM, Smiddy JF, Gruber B. Deaths and complications associated with fiberoptic bronchoscopy. Chest 1976;69:747-51.
3. Rutala WA. Disinfection and sterilization of patient-care items. Infect Control Hosp Epidemiol 1996;17:377-84.
4. Costa MLM. Levantamento de rotinas de reprocessamento de endos-cópio gastrintestinal em hospitais do município de São Paulo, 1996 (Tese de Mestrado, Escola Paulista de Medicina).
5. Pereira W Jr, Kovnat DM, Khan MA, Lacovino JR, Spivack ML, Sni-der GL. Fever and pneumonia after flexible fiberoptic bronchoscopy. Am Rev Respir Dis 1975;112:59-64.
6. Berman SO. Bronchoscopy and bacteremia. J Thorac Cardiovasc Surg 1960;40:635-9.
7. Burns DM, Shure D, Francoz R, Kalafer M, Harrell J, Witztum K, Moser KM. The physiologic consequences of saline lobar lavage in healthy human adults. Am Rev Respir Dis 1983;127:695-701. 8. Credle WF Jr, Smiddy JF, Elliot RC. Complications of fiberoptic
bron-choscopy. Am Rev Respir Dis 1974;109:67-72.
9. Pereira W Jr, Kovnat DM, Khan MA, Lacovino JR, Spivack ML, Sni-der GL. Fever and pneumonia following fiberoptic bronchoscopy [abs-tract]. Am Rev Respir Dis 1974;109:692.
10. Pingleton SK, Harrison GF, Stechschulte DJ, Wesselius LJ, Kerby GR, Ruth WE. Effect of location, pH and temperature of instilate in bron-choalveolar lavage in normal volunteers. Am Rev Respir Dis 1983; 128:1035-7.
11. Pugin J, Suter PM. Diagnostic bronchoalveolar lavage in patients with pneumonia produces sepsis like systemic effects. Intensive Care Med 1992;18:6-10.
12. Titche LL. Postbronchoscopic reactions. Ann Otol 1945;54:568-9. 13. Van Gundy K, Boylen CT. Fiberoptic bronchoscopy. Indications,
com-plications, contraindications. Postgrad Med 1988;83:289-94, 14. Witte MC, Opal SM, Gilbert JG, Pluss JL, Thomas DA, Olsen JD, et
al. Incidence of fever and bacteremia following transbronchial needle aspiration. Chest 1986;89:85-7.
15. Standiford TJ, Kunkel SL, Strieter RM. Elevated serum levels of tumor necrosis factor alpha after bronchoscopy and bronchoalveolar lavage. Chest 1991;99:1529-30.
17. Hsu JT, Barrett CR Jr. Lung abscess complicating transbronchial biop-sy of a mass lesion. Chest 1981;80:230-2.
18. Hammer DL, Aranda CP, Galati V, Adams FV. Massive intrabronchial aspiration of contents of pulmonary abscess after fiberoptic bronchos-copy. Chest 1978;74:306-7.
19. Aelony Y, Finegold SM. Serious infectious complications after flexible fiberoptic bronchoscopy. West J Med 1979;131:328-33.
20. Radner DD. Post bronchoscopic reactions in pulmonary tuberculosis. Ann Rev Tuberc 1943;47:370-8.
21. Rimmer J, Gibson P, Bryant DH. Extension of pulmonary tuberculosis after fiberoptic bronchoscopy. Tubercle 1988;69:57-61.
22. Sesma P, Sanchez F, Deben FM. Tuberculous pneumonia: a complica-tion of bronchoscopy. Rev Clin Esp 1984;173:185-6.
23. Hanson PJV, Gor D, Clarke JR, Chadwick MV, Gazzard B, Jeffries DJ, et al. Recovery of the human immunodeficiency virus from fiberoptic bronchoscopes. Thorax 1991;46:410-2.
24. Rutala WA. Draft APIC guideline for selection and use of disinfectants. Am J Infect Control 1995;23:35A-67A.
25. Oho K, Amemiya R. Practical fiberoptic bronchoscopy. Tokyo: Igaku-Shoin, 1980.
26. Dawson DJ, Armstrong JG, Blacklock ZM. Mycobacterial cross-con-tamination of bronchoscopy specimens. Am Rev Respir Dis 1982; 126:1095-7.
27. Leers WD. Disinfection endoscopies: how not to transmit Mycobacte-rium tuberculosis by bronchoscopy. Can Med Assoc J 1980;123:275-80.
28. Brasil – Portaria Nº 15, de 27 de agosto de 1988. Expede normas, na forma de anexo, para registro dos saneantes domissanitários com ação antimicrobiana. Diário Oficial da União, Brasília, p. 17.041, 5 set. 1988. Seção 1.
29. Brasil – Portaria Nº 930, de 27 de agosto de 1992. Expede normas, na forma de anexos, para o controle de infecções hospitalares. Diário Oficial da União, Brasília, p. 1279, 4 set. 1992. Seção 1.
30. Brasil – Ministério da Saúde. Coordenação de Controle de Infecção Hospitalar. Processamento de Artigos e Superfícies em Estabelecimento de Saúde. Brasília, 1993, p. 15.
31. Centers for Disease Control and Prevention – Recommendations for preventing transmission of human immunodeficiency virus and hepati-tis B virus to patients during exposure-prone invasive procedures. MMWR 1991;40(RR-8):1-9.
32. Centers for Disease Control and Prevention – Nosocomial infection and pseudo-infection from contaminated endoscopies and broncho-scopes – Wisconsin and Missouri. MMWR 1991;40:675-8.
33. Centers for Disease Control and Prevention – Prevention and control of tuberculosis in US communities with risk minority populations and prevention and control of tuberculosis among homeless persons: rec-ommendations of the Advisory Council for Elimination of Tuberculo-sis. Morb Mortal Wkly Rep 1992;41:1-23.
34. Centers for Disease Control and Prevention – Draft guideline for isola-tion precauisola-tions in hospitals. Federal Register 1994;59:55552-70. 35. São Paulo (Estado). Secretaria da Saúde. Centro de Apoio ao
Desen-volvimento de Assistência Integral à Saúde (CADAIS) – Organização do Centro de Material e Noções de Esterilização. São Paulo, 1993, p. 36-41 (Cadernos de Saúde).
36. Kaczmarek RG, Moore RM. Multi-state investigation for the actual dis-infection and sterilization of endoscopies in health care facilities. Am J Med 1991;92:257-61.
37. Mayhall CG. Hospital epidemiology and infection control. Williams & Wilkins, 1996;47:680-93.
38. Mehta AC, Curtis PS. The high price of bronchoscopy. Maintenance and repair of flexible fiberoptic bronchoscope. Chest 1990;98:448-54.
39. Rodrigues E. Infecções hospitalares: prevenção e controle. São Paulo: Sarvier, 1997;634.
40. Spach DH, Silverstein FE, Stamm WE. Infections transmitted by gas-trintestinal endoscopy and bronchoscopy. Ann Intern Med 1993;118: 117-28.
41. Strange C, Barbarash RA, Heffner JE. Lidocaine concentrations in bronchoscopic specimens. Chest 1988;93:547-9.
42. Wimberley N, Willey S, Sullivan N, Bartlett JG. Antibacterial proper-ties of lidocaine. Chest 1979;76:37-40.
43. NCCLS (National Committee for Clinical Laboratory Standard), M100-S9, 1999.
44. Siegel S, Castellan Jr NJ. Nonparametric Statistics. 2nd ed. New York: McGraw-Hill Int. Ed., 1988;399p.
45. Cortese DA, Prakash UBS. Bronchoscopy in pulmonary infections. In: Prakash UBS, editor. Bronchoscopy. Mayo Foundation. New York: Raven Press Ltd., 1994;183-94.
46. Rutala WA. FDA Labeling requirements for disinfection of endoscopes: a counterpoint. Infect Control Hosp Epidemiol 1995;16:231-5. 47. Penco JCF, Martin MA. Chemical germicide treatment of flexible
en-doscopes: the risk of infection transmission from errors in disinfection practices. In: Rutala WA, editor. Chemical germicides in health care – International symposium. APIC. Washington DC, 1995;61-71. 48. Pepper RE, Lieberman ER. Dialdehyde alcoholic sporicidal
composi-tions. US Patent No. 1962;3,016,328.
49. Stonehill AA, Krop S, Borick PM. Buffered glutaraldehyde – A new chemical sterilizant solution. Am J Hosp Pharmacol 1963;20:458-65. 50. Spaulding EH. Chemical disinfection of medical and surgical materials. In: Lawrence CA, Block SS, editors. Disinfection, sterilization and pres-ervation. Philadelphia, PA: Lea & Febiger, 1968;517-31.
51. Borick PM, Dondershine FH, Chandler JL. Alkalinized glutaraldehyde, a new antimicrobial agent. J Pharm Sci 1964;53:1273-5.
52. Rubbo SD, Gardner JF, Webb RL. Biocidal activities of glutaraldehyde and related compounds. J Appl Bacteriol 1967;30:78-87.
53. Sammartino MT, Israel RH, Magnussen CR. Pseudomonas aeruginosa contamination of fiberoptic bronchoscopes. J Hosp Infect 1982;3:65-71.
54. Baughman RP, Dohn MN, Loudon RG, Frame PT. Bronchoscopy with bronchoalveolar lavage in tuberculosis and fungal infections. Chest 1991;99:92-7.
55. Davis D, Bonekat HW, Andrews D, Shigeoka JW. Disinfection of the flexible fiberoptic bronchoscope against Mycobacterium tuberculosis and M. gordonae. Thorax 1984;39:785-8.
56. Carson LA, Petersen NJ, Favero MS. Growth characteristics of atypi-cal mycobacteria in water and their comparative resistance to disinfec-tants. Appl Environ Microbiol 1978;36:839-46.
57. Nelson KE, Larson PA, Schraufnagel DE, Jackson J. Transmission of tuberculosis by flexible fiberbronchoscope. Am Rev Respir Dis 1983; 127:97-100.
58. Wanner A, Amikam B, Robinson MJ, Anandam EJ, Sackner MA. Comparison between the bacteriologic flora of different segments of the airways. Respiration 1973;30:561-9.
59. Scott EM, Gorman SP. Glutaraldehyde. In: Block SS, editor. Disinfec-tion, sterilization and preservation. 4th ed. Philadelphia: Lea, 1991; 596-614.
60. Borick PM, Pepper RE. The spore problem. In: Bernarde MA, editor. Disinfection. New York: Marcel Dekker Inc., 1970;85-102. 61. Ringrose RE. A hospital outbreak of Serratia marcescens associated
with ultrasonic nebulizers. Ann Intern Med 1968;69:719-29. 62. Bassett DJC. Common-source outbreaks. Proc R Soc Med 1971;64:
18-24.
63. Ayliffe GA, Deverill CEA. Decontamination of gastroscopes. Health Soc Serv J 1979;538-40.
64. Scheidt A. Persistent contamination of the flexible fiber-bronchoscope following disinfection in aqueous glutaraldehyde. Chest 1980;78:352-2.
65. Fraser V, O’Rourke S, Jones M, Murray P, Clouse RE, Klasner J, et al. Gastrointestinal endoscope disinfection: a prospective randomized tri-al comparing automated and manutri-al disinfection [Abstract 12]. Gas-trointest Endosc 1992;38:277.
ANEXO
Comparação dos resultados de coloração para gram e cultura de aeróbios
Amost. Fr. 1 Gram Fr. 1 Cultura Fr. 2 Gram Fr. 2 Cultura Fr. 3 Gram Fr. 3 Cultura Fr. 4 Gram Fr. Cultura
01 – – + SV/SA – SV/S A – –
02 – – + SV – SV – –
03 – – + SV/EC/Esp + SV/KP – SE
04 – – + SV – SV – –
05 – – – SV/S A – SV – –
06 – – – C sp – C sp – –
07 – – + S A/SV – SV – –
08 – SV + – + Esp/ABh + –
09 – – – SV – SV/SE – SV/SE
10 – – – SV – SV – –
11 – – – SV/Esp – SV/Esp – –
12 – – + S A/SV + PA – –
13 – – + S A/KP – PA – –
14 – – – Ec sp – SV – –
15 – – – SV – SE/PA – SE
16 – – + SV – SP – –
17 – – – SV/S A – PA/S A – S A
18 – – – SV/AB h – SV – –
19 – – – PA – PA/SP – –
20 – – – EC – EC – –
21 – – – SV – SV – –
22 – – + – + Esp – –
23 – – – S A/SV – SA – –
24 – – + PA – S A/AB h – PA
25 – – – SV – SE – –
26 – – – SV – Esp/KP – –
27 – – + KP – KP – Esp
28 – – – AB h – A Bh – –
29 – – – SV – Stenotrop. – –
30 – – – KP – KP – –
31 – – + – + Esp – –
32 – – – SBH-A – SBH-A – SBH-A
33 – – – SV – – – –
34 – – – CBsp/SV – – – –
35 – – – PA – PA – –
36 – SCneg. – SV – PA – –
37 – – – SV/S A – S A/SV – –
38 – – – PA – PA – –
39 – – + PA – PA – –
40 – – – SV/SC neg – PR – –
41 – – – Ec sp – PA – –
42 – – – PA/KP – PA – –
43 – – – PA/SV – SV – –
44 – – + SCneg/SV – SCneg/SV – –
45 – – – SV – EC/PA – SCneg.
46 – SCneg. + PM/KP + PA/Ec sp – –
47 – – – SCneg/SV – SV/PA – –
48 – – + S A – SV/PA/Ec sp – –
49 – – + KP + PA/KP – –
50 – – + S A/SV + KP/PA – –
51 – – – SCneg/SV – KP – –
52 – – – SCneg – KP/PA – –
53 – – – SV/KP + SV/KP – –
54 – – – SV – Ec sp/PA – SCneg
55 – SCneg. – Ec sp/SCneg – S A/PA – –
56 – – + S A + Ec sp/S A/AB – SCneg
57 – – + PA/Esp – Esp – –
58 – – – SV – SV – SCneg
59 – SCneg – Esp/SBH-B + Esp/SBH-B – –
60 – – – S A/SV – S A – –
61 – – + SV – SV/SCneg – –
62 – SCneg – SCneg + Esp/PA/AB – –
63 – – – SCneg + PA/Esp – –
64 – – + SCneg/SV – SCneg/SV – –
65 – – – KP – PR/SV – –