ROSILEY BERTON PACHECO
ANÁLISE CITOGENÉTICA EM DUAS ESPÉCIES DO
GÊNERO
Astyanax
DE DIFERENTES BACIAS
HIDROGRÁFICAS:
LOCALIZAÇÃO DOS GENES RIBOSSÔMICOS 18S E 5S
Tese apresentada ao Programa de Pós– Graduação, em Ciências Biológicas (área de concentração – Biologia Celular e Molecular), da Universidade Estadual de Maringá, para a obtenção do grau de Doutor em Ciências Biológicas.
ROSILEY BERTON PACHECO
ANÁLISE CITOGENÉTICA EM DUAS ESPÉCIES DO
GÊNERO
Astyanax
DE DIFERENTES BACIAS
HIDROGRÁFICAS:
LOCALIZAÇÃO DOS GENES RIBOSSÔMICOS 18S E 5S
Orientador: Prof. Dr. Horácio Ferreira Júlio Júnior
Dados Internacionais de Catalogação-na-Publicação (CIP) (Biblioteca Central - UEM, Maringá – PR., Brasil)
Pacheco, Rosiley Berton
P116a Análise citogenética em duas espécies do gênero Astyanax
de diferentes bacias hidrográficas : localização dos genes ribossômicos 18S e 5S / Rosiley Berton Pacheco. -- Maringá : [s.n.], 2008.
57 f.
Orientador : Prof. Dr. Horácio Ferreira Júlio Júnior. Tese (doutorado) - Universidade Estadual de Maringá,
Programa de Pós-Graduação em Ciências Biológicas (área de concentração - Biologia Celular e Molecular), 2008. 1. Citogenética de peixes. 2. Astyanax jacuhiensis. 3.
Astyanax altiparanae. 4. Hibridação in situ com
fluorescência (FISH). I. Universidade Estadual de Maringá. Programa de Pós-Graduação em Ciências Biológicas. II. Título.
BIOGRAFIA
Rosiley Berton Pacheco, nascida em Umuarama/PR no dia 24/01/71. É Professora pela SEED há 17 anos no Ensino Médio e 6 anos no Ensino Superior.
AGRADECIMENTOS
À Profa. Dra. Ana Lúcia Dias, a maior responsável pelo meu crescimento, por toda orientação, confiança e principalmente pela compreensão em todos os momentos de dificuldades, muito obrigada e minha eterna gratidão, jamais esquecerei tudo o que fez por mim, você é muito mais do que orientadora.
À amiga e companheira Profa. Dra. Lúcia Giuliano Caetano por toda ajuda desde que me conheceu inclusive pelas coletas e preparação de materiais, pelas dicas, sugestões e críticas para que este trabalho fosse concluído.
Ao Prof. Dr. Horácio Ferreira Júlio Júnior por me orientar e por toda a confiança depositada em mim.
Ao Dr. Alberto Sergio Fenocchio, Dra. Ana Cláudia Swarça e ao Dr.
Mário Sérgio Mantovani pela amizade e pela ajuda prestada.
Ao laboratório do LABRE, principalmente ao Prof. Dr. André Luís Laforga Vanzela, por disponibilizar equipamentos do laboratório.
À Profa. Dra. Isabel Cristina Martins dos Santos, à Profa. Dra. Ana Luiza Brito Portela Castro e ao Prof. Dr. Carlos Alexandre Fernandes por toda atenção.
Ao programa de Mestrado em Genética e Biologia Molecular e ao
Laboratório de Citogenética de Peixes da Universidade Estadual de Londrina, pelo apoio e principalmente aos técnicos: Dário, Melissa e Carlos.
Aos companheiros de laboratório Renata, Larissa Lacerda, Tatiane, Tamara, Vitor, Gabriel, Tatiana, Larissa Pires, Rafael, Treco, Marceléia, Tatiana,
Vivian e Michelli, pelo companheirismo.
Aos meus colegas de doutorado, em especial ao meu amigo Rafael e amiga
Renata, os quais estavam sempre prontos para me ajudar.
Aos meus filhos, Thiago, Thais e Juninho e aos meus sobrinhos José Henrique e Laisa, aos meus amados pais Aparecido e Izabel, minhas irmãs Ivani e Roseli por todo amor.
Ao meu cunhado Humberto e ao grande amigo Agnel por todo incentivo e apoio em todas as horas.
À minha grande amiga Tânia Aparecida pela hospedagem e principalmente por ouvir e compartilhar as horas difíceis.
Aos meus colegas de trabalho e amigos Pedro, Rosana, Maria Olita, Danila, Davis, Edner, Cristina, Tânia Regina, Daniela, Márcia, Raquel e Ricardo
e a todos que contribuíram para que eu pudesse concluir este trabalho. Ao Angelo, por tudo que você fez por mim.
Não é no silêncio que os homens se fazem, mas na palavra, no trabalho, na ação-reflexão
APRESENTAÇÃO
Esta Tese é composta de dois artigos científicos, onde foram analisados citogeneticamente exemplares do gênero Astyanax de diferentes localidades e
bacias hidrográficas, contribuindo assim com mais informações sobre este grupo de peixes. Em consonância com as regras do Programa de Pós graduação em Ciências Biológicas.
Inicia com o artigo
Caracterização citogenética de
Astyanax jacuhiensis
(Characidae) da bacia do lago Guaíba/RS
R.B. Pacheco1,2, L.Giuliano-Caetano1, L.R. Malabarba3, A.L. Dias1 e H.F.Julio Junior2
1
Departamento de Biologia Geral, Universidade Estadual de Londrina, CCB, Londrina, PR, Brasil
2
Departamento de Biologia Celular e Genética, Universidade Estadual de Maringá, DBC, Maringá, PR, Brasil
3
Departamento de Zoologia, Instituto de Biociências, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil
Revista BIOLOGICAL RESEARCH.
Tem continuidade com o artigo
Citogenética comparativa entre três
diferentes populações de
Astyanax altiparanae
, com ênfase à localização do
DNAr 18S e 5S
R.B. Pacheco1,2, L.Giuliano-Caetano1, A.L. Dias1 e H.F.Julio Junior2
1
Departamento de Biologia Geral, Universidade Estadual de Londrina, CCB, Londrina, PR,
Brasil
2
Departamento de Biologia Celular e Genética, Universidade Estadual de Maringá, DBC,
Maringá, PR, Brasil
PACHECO, Rosiley Berton. Análise citogenética em duas espécies do gênero
Astyanax de diferentes bacias hidrográficas: localização dos genes
ribossômicos 18S e 5S. 2008. 55p. Tese (Doutorado em Ciências Biológicas – Área de Concentração, Biologia Celular e Molecular) – Universidade Estadual de Maringá.
RESUMO
Foram estudados citogeneticamente exemplares de Astyanax jacuhiensis cuja
localidade tipo é Jacuhy, Rio Grande do Sul, coletados em três diferentes pontos da bacia do lago Guaíba: Gasômetro, Arroio do Ribeiro e Barra do Ribeiro e Astyanax altiparanae de três diferentes localidades: rio Monjolinho (bacia do rio
Monjolinho/SP), Água dos Patos (bacia do Paranapanema/SP) e Lago Igapó (bacia do rio Tibagi/PR). Todos os exemplares de A. jacuhiensis apresentaram número
diplóide igual a 50 cromossomos com 8m+30sm+4st+8a (NF=92). Todas as populações de A. altiparanae também apresentaram 2n=50, mas com diferentes
fórmulas cariotípicas: a população do rio Monjolinho com 10m+28sm+4st+8a (NF=92), a do rio Água dos Patos com 8m+24sm+6st+12a (NF=88) e a população do Lago Igapó com 8m+28sm+4st+10a (NF=90). Através da técnica de AgNORs nas duas espécies, foi evidenciada uma variação de 1 até 5 cromossomos nucleolares, localizadas em regiões teloméricas do braço curto ou longo de diferentes cromossomos, mostrando também um heteromorfismo de tamanho. Entretanto, através da hibridação in situ com fluorescência (FISH) com sonda de DNAr 18S foi
observado nas populações de A. altiparanae do rio Monjolinho, Lago do Igapó e A jacuhiensis do Lago Guaíba apenas um par de cromossomos com marcações
fluorescentes, enquanto que a população do rio Água dos Patos apresentou 4 marcações fluorescentes. Através da hibridação fluorescente in situ (FISH) utilizando
sonda de DNAr 5S, foi visualizado um par de cromossomos com sinais fluorescentes na posição intersticial em A altiparanae. A coloração com cromomicina A3 (CMA3)
em A. jacuhiensis e A. altiparanae mostrou correspondência com alguns sítios
AgNORs, sendo estes ricos em bases GC. A coloração com DAPI não evidenciou nenhuma região rica em bases AT. A técnica de banda C utilizada somente na população A. jacuhiensis do Lago Guaíba, revelou blocos de heterocromatina nas
regiões pericentroméricas na maioria dos cromossomos, sendo observadas algumas marcações intersticiais, e um par cromossômico (sm), com marcação heterocromática mais evidente na porção terminal do braço curto. BC+CMA3 em A.
jacuhiensis confirmou que a heterocromatina se encontra associada à NOR, além de
outras marcações fluorescentes em regiões pericentroméricas e intersticiais. Estes são os primeiros dados citogenéticos de Astyanax jacuhiensis e os dados obtidos
nas 3 populações de A. altiparanae confirmam uma variabilidade cromossômica
PACHECO, Rosiley Berton. Análise citogenética em duas espécies do gênero
Astyanax de diferentes bacias hidrográficas: localização dos genes
ribossômicos 18S e 5S. 2008. 55p. Tese (Doutorado em Ciências Biológicas – Área de Concentração, Biologia Celular e Molecular) – Universidade Estadual de Maringá.
ABSTRACT
A cytogenetic study was conducted on specimens of two species of Astyanax in
Brazil. A. jacuhiensis whose type-locality is Jacuhy, RS, was collected at three
different points in the Guaíba stream basin: Gasômetro, Arroio do Ribeiro and Barra do Ribeiro. A. altiparanae was obtained from three different localities: Monjolinho
river (Monjolinho river basin/SP), Água dos Patos river (Paranapanema river basin/SP) and Igapó stream (Tibagi river basin/PR). All of the specimens of A. jacuhiensis showed a diploid number of 50 chromosomes with a karyotype of
8m+30sm+4st+8a (NF=92). All the populations of A. altiparanae also had a
chromosome number of 2n=50, but with different karyotype formulas: the population of the Monjolinho river with 10m, 28sm, 4st and 8a (NF=92), that of the Água dos Patos river with 8m, 24sm, 6st and 12a (NF=88) and the population of Igapó stream with 8m, 28sm, 4st and 10a (NF=90). Using the AgNOR technique in the two species, a variation of 1 to 5 nucleolar chromosomes was demonstrated, showing localization in the telomeric regions of the short arm of different chromosomes along with size heteromorphism. Meanwhile, using fluorescence in situ hybridization (FISH)
with an 18S rDNA probe, populations of A. altiparanae from the Monjolinho river and
Igapó stream and of A. jacuhiensis from Guaíba stream were found to have only one
chromosome pair with fluorescent staining, whereas the population from the Água dos Patos river showed 4 fluorescent regions. FISH utilizing 5S rDNA showed one chromosome pair with fluorescent signals in the interstitial region in A. altiparanae.
Staining with chromomycin A3 (CMA3) in A. jacuhiensis and A. altiparanae
corresponded with some AgNOR sites, these being rich in GC bases. Treatment with DAPI showed negative staining of chromosomes that were CMA3 positive, where no
AT-rich region was observed. C banding was used only in the population of A. jacuhiensis from Guaíba stream, and revealed heterochromatin blocks in the
pericentromeric regions in the majority of the chromosomes, where some interstitial staining was observed, and one chromosome pair (sm) with heterochromatic staining more evident in the terminal portion of the short arm. CB+CMA3 in A. jacuhiensis
LISTA DE FIGURAS
Figura 1 - a) Exemplar de Astyanax jacuhiensis; b) Foto satélite do
Lago Guaíba mostrando os diferentes pontos de coletas (*); c) Gasômetro;
d) Arroio do Ribeiro; e) Barra do Ribeiro ... 17
Figura 2 - a) Exemplar de Astyanax altiparanae; b) Rio Monjolinho; c) rio
Água dos Patos; d) lago Igapó ... 18
CAPÍTULO I
Figura 1 - a)Cariótipo de Astyanax jacuhiensis; b) Cromossomos com AgNORs;
c) Metáfases com FISH evidenciando sítios de DNAr 18S (setas);
d) Metáfases evidenciando cromossomos com CMA3/DAPI (setas) ... 32
Figura 2 – a) Cariótipo de banca C de Astyanax jacuhiensis; b) par cromossômico
8 com AgNORs, C) par cromossômico 8 com banda C; d) metáfase com
BC + CMA3 com as setas indicando o par cromossômico 8 com heteromorfismo
de tamanho ... 33
CAPÍTULO II
Figura 1 - Cariótipos de Astyanax altiparanae das populações: a) do rio
Monjolinho; b) do rio Água dos Patos; c) do lago Igapó ... 51
Figura 2 - AgNORs, FISH com sonda de DNAr 18 S e CMA3/DAPI em
Astyanax altiparanae, respectivamente: a, d, g) rio Monjolinho; b, e,
h) rio Água dos Patos; c, f, i) lago Igapó... 52
Figura 3 - Metáfases de Astyanax altiparanae evidenciando os sítios de
DNAr 5S nas populações: a) do rio Monjolinho; b) do rio Água dos Patos;
SUMÁRIO
1 INTRODUÇÃO ... 12
1.1 Considerações Gerais e Citogenéticas sobre o Gênero Astyanax com Ênfase à Localização dos Genes Ribossômicos 18S e 5S... 12
2 OBJETIVOS ... 15
Objetivo Geral... 15
2.2 Objetivos Específicos...15
3 MATERIAL ... 16
3.1 Espécies Estudadas e Locais de Coleta... 16
4 REFERÊNCIAS ... 19
CAPÍTULO I CARACTERIZAÇÃO CITOGENÉTICA DE Astyanax jacuhiensis (CHARACIDAE) DO LAGO GUAÍBA/RS ... 23
Resumo ... 24
Introdução ... 25
Material e Métodos ... 26
Resultados e Discussão ... 28
Referências ... 34
CAPÍTULO II CITOGENÉTICA COMPARATIVA ENTRE TRÊS DIFERENTES POPULAÇÕES DE Astyanax altiparanae, COM ÊNFASE À LOCALIZAÇÃO DO DNAR 18S E 5S ... 39
Resumo ... 40
Introdução ... 41
Material e Métodos ... 42
Resultados ... 43
Discussão ... 46
1 INTRODUÇÃO
1.1 Considerações Gerais e Citogenéticas sobre o Gênero Astyanax com
Ênfase à Localização dos Genes Ribossômicos 18S e 5S
Incertae Sedis é um termo usado para definir um grupo taxonômico em que
as suas relações filogenéticas são indefinidas ou desconhecidas. Vários gêneros da família Characidae constituem um grupo heterogêneo de peixes de pequeno a grande porte e têm sido incluídos na subfamília Tetragonopterinae. Entretanto, devido a falta de evidências que esta subfamília constituia um grupo monofilético, Lima et al. (2003) listaram 88 gêneros como “Incertae Sedis” que incluem 620
espécies. Dentre estas, 399 (64%) são taxonomicamente pouco definidas e constituem, provavelmente, grupos não monofiléticos de Characidae:
Hyphessobrycon (97 espécies), Astyanax (86 espécies), Moenkhausia (58 espécies), Bryconamericus (51 espécies) e Hemigrammus (43 espécies). Além disso, mais de
47 gêneros (53%) incluídos como Incertae Sedis são monotípicos e 25 gêneros
(26%) contêm somente duas ou três espécies (Lima et al., 2003).
O gênero Astyanax é considerado relativamente comum, sendo o mais
diversificado da família Characidae, segundo Lima et al. (2003), revelando também várias formas semelhantes, formando um complexo, do ponto de vista taxonômico (Garutti e Britski, 2000), possui ampla distribuição geográfica e seus representantes são facilmente encontrados em rios neotropicais (Britski, 1972).
13
nua, com escamas apenas na base (Britski, 1972), e habitam diversos ambientes, inclusive as águas de cabeceiras de rios e riachos.
O gênero Astyanax é o que possui maior número de dados citogenéticos
dentro da subfamília Tetragonopterinae, onde são relatados alguns aspectos citogenéticos de diferentes espécies, demonstrando uma extensa variabilidade cromossômica. Os Astyanax caracterizam-se por apresentar número diplóide
variando de 2n=36 cromossomos em Astyanax schubarti (Morelli et al., 1983;
Daniel-Silva e Almeida-Toledo, 2001) à 2n=50 cromossomos em Astyanax altiparanae, A.
scabripinnis, A. eigenmanniorum, A. mexicanus, entre outros (Oliveira et al. 1988;
Moreira-Filho e Bertollo, 1991; Fauaz e Moreira-Filho, 1991; Fauaz et al., 1994; Daniel-Silva e Almeida-Toledo, 2001; Fernandes e Martins-Santos, 2003).
As regiões organizadoras de nucléolos (NORs) têm sido usualmente evidenciadas através da impregnação pelo nitrato de prata para identificar as regiões de atividade gênica, onde foi caracterizado um sistema de NORs múltiplas em diferentes espécies: Astyanax altiparanae (Pacheco et al, 2001; Daniel-Silva e
Almeida-Toledo, 2001; Fernandes e Martins-Santos, 2004; 2006a), em Astyanax
scabripinnis (Mantovani et al. 2000; Ferro et al. 2001; Mantovani e Moreira-Filho,
2005; Fernandes e Martins, 2005), em Astyanax fasciatus (Daniel-Silva e
Almeida-Toledo, 2001; Pazza et al., 2006). Entretanto, a técnica de hibridação in situ com
fluorescência (FISH), com sonda de DNAr 18S, têm sido utilizada principalmente em
Astyanax scabripinnis (Souza et al., 2001; Mantovani e Moreira-Filho, 2005;
Fernandes e Martins-Santos, 2006b) assim como em Astyanax altiparanae
14
O gene RNAr 5S possui uma seqüência em torno de 120pb, menor que o gene RNAr 45S (18S, 5,8S e 28S), podendo ser localizado através da técnica de hibridação in situ. Resultados de alguns estudos no gênero Astyanax, têm revelado
que os genes de DNAr 5S apresentam uma alta estabilidade no posicionamento e no número dos sítios (Almeida-Toledo et al., 2002; Mantovani e Moreira-Filho, 2005; Fernandes e Martins-Santos, 2006a; 2006b). A localização intersticial pode ser responsável pela conservação destes sítios nos cromossomos (Mantovani e Moreira-Filho, 2005).
A utilização de fluorocromo cromomicina A3 (CMA3) evidencia regiões ricas
em bases GC, sendo portanto empregado em diversas espécies de peixes, onde evidenciaram sítios coincidentes com a AgNORs, como por exemplo: Astyanax
bimaculatus em Paganelli (1990); A. altiparanae, A. schubarti, A. fasciatus; A. scabripinnis em Daniel-Silva (1996); Bryconamericus, Moenkhausia sanctafilomenae, Moenkhausia intermedia e Hemigrammus marginatus em Castro
(1999); Markiana nigripinnis em Myiazawa (1997); Bryconops affinis e Moenkhausia
costae em Pfister (1997), A. altiparanae em Pacheco (2001) e Fernandes e
Martins-Santos (2004).
2 OBJETIVOS
2.1 Objetivo Geral
O presente trabalho teve como objetivo geral, analisar citogeneticamente exemplares do gênero Astyanax de diferentes bacias hidrográficas, contribuindo na
caracterização deste grupo de peixes.
2.2 Objetivos Específicos
• Estudar a macroestrutura cariotípica de Astyanax altiparanae e Astyanax
jacuhiensis de diferentes localidades.
• Localizar as Regiões Organizadoras de Nucléolos;
• Analisar o padrão de distribuição da heterocromatina de A. jacuhiensis;
• Determinar as regiões cromossômicas ricas em pares de bases GC e AT;
3 MATERIAL
3.1 Espécies Estudadas e Locais de Coleta
Vinte e quatro exemplares de Astyanax jacuhiensis (figura 1a) cuja localidade
tipo é Jacuhy, Rio Grande do Sul, foram coletados em três diferentes pontos do lago Guaíba (figura 1b), no Rio Grande do Sul: Gasômetro (três machos e duas fêmeas), Arroio do Ribeiro (três machos e uma fêmea) e na Barra do Ribeiro (nove machos e seis fêmeas), no período de janeiro à setembro de 2006 (figura 1c, d, e respectivamente).
Astyanax altiparanae (figura 2a), foram coletados no rio Monjolinho/São
17
Figura 1: a) Exemplar de Astyanax jacuhiensis; b) Foto satélite do lago Guaíba
18
Figura 2: a) Exemplar de Astyanax altiparanae; b) Foto do ponto de coleta no rio
4 REFERÊNCIAS
Almeida-Toledo LF, Ozouf-Costaz C, Foresti F, Bonillo C, Porto-Foresti F e Daniel-Silva MFZ (2002). Conservation of the 5S-bearing chromosome pair and co-localization with major rDNA clusters in five species of Astyanax (Pises,
Characidae).Cytogenetic. Genome Res. 97 (3-4):229-233.
Britski HA (1972). Peixes de água doce do Estado de São Paulo: Sistemática. In: Poluição e Psicultura. São Paulo: Faculdade de Saúde Pública da USP-Instituto de Pesca da CPRN da Secretaria de Agricultura. 78-108.
Castro ALB (1999). Citogenética de peixes da subfamília Tetragonopterinae (Pisces, Characidae): Aspectos Citotaxonômicos e Evolutivos. Tese de Doutorado. Ecologia de Ambientes Aquáticos Continentais. Univesidade Estadual de Maringá. 76p.
Daniel-Silva MFZ (1996). Estudos citogenéticos comparativos em quatro espécies do gênero Astyanax (Pisces, Characidae). Dissertação de Mestrado. Departamento
de Biologia do Instituto de Biociências da Universidade de São Paulo (SP). 176p.
Daniel-Silva MFZ e Almeida-Toledo LF (2001). Chromosome R-banding pattern and conservation of a marker chromosome in four species, genus Astyanax
(Characidae, Tetragonopterinae). Caryologia, 54: 209-215.
Fauaz G e Moreira Filho, O. (1991). Triploidia natural em Astyanax eigenmanniorum
(Pisces, Characidae). Rev. Bras. Genet. Sup. 14(3): 56.
Fauaz G, Vicente VE e Moreira Filho O. (1994). Natural triploidy and B-chromosomes in the neotropical filh genus Astyanax (Characidae). Rev. Bras.
20
Fernandes CA e Martins-Santos IC (2003). Cytogenetic characterization of two populations of Astyanax scabripinnis (Pisces, Characiformes) of the Ivaí basin
PR Brazil. Cytologia, v. 68: 289-293.
Fernandes CA e Martins-Santos IC (2004). Cytogenetic studies in two populations of
Astyanax altiparanae (Pisces, Characiformes). Hereditas, v.141: 328-332.
Fernandes CA e Martins-Santos IC (2005). Sympatric occurrence of three cytotypes and four morphological types of B chromosomes of Astyanax scabripinnis
(Pisces, Characiformes) in the river Ivaí basin, state of Paraná, Brazil. Genetica,
v.124: 301-306.
Fernandes CA e Martins-Santos IC (2006a). Mapping of the 18S and 5S ribosomal RNA genes in Astyanax altiparanae Garutti & Britski, 2000 (Teleostei,
Characidae) from the upper Paraná river basin, Brazil. Genetics and Molecular
Biology, 29: 1-5.
Fernandes CA e Martins-Santos IC (2006b). Chromosomal location of 5S and 18S rRNA genes in three sympatric cytotypes of Astyanax scabripinnis
(Characiformes, Characidae) from the Ivaí river basin, state of Paraná, Brazil.
Caryologia (Firenze), Itália, v. 59, 253-259.
Ferro DAM, Néo DM, Moreira Filho O e Bertollo LAC ( 2001). Nucleolar organizing regions, 18S and 5S rDNA in Astyanax scabripinnis (Pisces, Characidae):
population and functional diversity. Genetica, 110: 55-62.
Garutti V e Britski HA (2000). Descrição de uma espécie nova de Astyanax
(Teleostei: Characidae) da bacia do alto rio Paraná e considerações sobre as demais espécies do gênero na bacia. Comn. Mus. Ciênc. Tecnol. PUCRS. Sér.
21
Lima FCT, Malabarba LR, Buckup PA, Silva JFP, Vari R P, Harold A, Benine R, Oyakawa OT, Pavanelli CS, Menezes NA, Lucena CAS, Malabarba MCSL, Lucena ZMS, Reis RE, Langeani F, Cassati L, Bertaco VA, Moreira C e Lucinda PHF (2003). Genera Incertae Sedis in Characidae. Pp. 106-113. In: Reis RR, Kullander SO e Feraris Jr.(Eds.). Check list of the freshwater fishes of South
and Central America. Porto Alegre, Edipucrs.
Mantovani M, Abel LDS, Mestriner CA e Moreira-Filho O (2000). Acentuated polymorfhism of heterochrimatin and nucleolar organizer regions in Astyanax
scabripinnis (Pisces, Characidae): tools understanding karyotypic evolution. Genetica, 109: 161-168.
Mantovani M, Abel LDS e Moreira Filho O (2005). Conserved 5S and variable 45S rDNA chromosomal localization revealed by FISH in Astyanax scabripinnis
(Pisces, Characidae).Genetica, 123: 211-216.
Miyazawa CS (1997). Citogenética de caracídeos da bacia do rio Paraguai: Análises citotaxonômicas evolutivas e considerações biogeográficas. Tese de Doutorado. Universidade de São Carlos (SP). 175p.
Moreira-Filho O e Bertollo LAC (1991). Astyanax scabripinnis (Pisces, Characidae): a
species complex. Rev. Bras. Genet. 14: 331-357.
Morelli, S; Bertollo, LAC; Foresti, F; Moreira-Filho, O e Toledo-Filho, AS (1983) Cytogenetics considerations on the genus Astyanax (Pisces, Characidae), I
Karyotypic variability. Caryologia,36(3):235-244.
Oliveira C, Almeida-Toledo LF; Foresti F, Britski HA e Toledo-Filho SA (1988). Chromosome formulae of Neotropical freshwarter fishes. Rev. Bras. Genet.,
22
Pacheco RB. (2001). Estudos citogenéticos em diferentes populações de Astyanax
altiparanae (Pisces, Tetragonopterinae). Dissertação de Mestrado.
Universidade Estadual de Londrina. 97p.
Pacheco RB, Giuliano-Caetano L e Dias AL (2001). Occurrence of cytotypes and multiple NORs in an Astyanax altiparanae population (Pisces,
Tetragonopterinae). Chromosome Science, 5: 109-114.
Paganelli HH (1990). Diversidade cromossômica no gênero Astyanax, com especial
referência a A. bimaculatus. (Linnaeus, 1758). Considerações citotaxonômicas
e evolutivas. Dissertação de Mestrado. Departamento de Ciências Biológicas. Universidade Federal de São Carlos. 108p.
Pfister SC (1997). Contribuição aos estudos cariotípicos da família Characidae da bacia do rio São Francisco – Três Marias (MG). Dissertação Mestrado. Universidade Federal de são Carlos. São Carlos (SP). 109p.
Pazza R, Kavalco KF e Bertollo LAC (2006). Chromosome polymorphism in
Astyanax fasciatus (Teleostei, Characidae).1. Karyotype analysis, Ag-NORs
and mapping of the 18S and 5S ribosomal genes in sympatric karyotypes and their possible hybrid forms. Cytogenet Genome Res.112:313-319.
Souza IL, Galiann J, Rúa PDL, Bertollo LAC e Moreira-Filho O (2001). Non-radom distribution of the GC-rich heterochromatin and nuclear rDNA sites on Astyanax
CAPÍTULO I
CARACTERIZAÇÃO CITOGENÉTICA DE Astyanax jacuhiensis (CHARACIDAE) DO LAGO
GUAÍBA/RS. *
24
CARACTERIZAÇÃO CITOGENÉTICA DE Astyanax jacuhiensis (CHARACIDAE) DO LAGO
GUAÍBA/RS.
RESUMO
Análises citogenéticas realizadas em 24 exemplares de Astyanax jacuhiensis,
mostraram que o número diplóide é igual a 50 cromossomos distribuídos em 8m+30sm+4st+8a, sendo o número fundamental igual a 92. As regiões organizadoras de nucléolos (AgNORs) foram observadas em 2 a 5 cromossomos evidenciando uma variação intra e interindividual nesta espécie, sendo constante a ocorrência do par 8 (sm), com heteromorfismo de tamanho destas regiões entre os homólogos. Através da hibridação in situ com fluorescência (FISH), com sonda de
DNAr 18S, cístrons ribossômicos foram localizados em apenas um par de cromossomos sm, na região terminal mostrando também um heteromorfismo de tamanho entre os homólogos. O tratamento com o fluorocromo CMA3 mostrou vários
cromossomos com leves marcações fluorescentes terminais e intersticiais, sendo sempre observado um par com forte marcação terminal, evidenciando o mesmo heteromorfismo encontrado em AgNOR e FISH. A coloração com DAPI não evidenciou nenhuma região rica em bases AT. A técnica de banda C revelou heterocromatina nas regiões pericentroméricas da maioria dos cromossomos, com algumas marcações intersticiais e o par sm 8 apresentou evidente marcação heterocromática terminal no braço curto. A associação de BC+CMA3 revelou leves
25
descrição de Astyanax jacuhiensis contribuindo com a citogenética do gênero
Astyanax.
Palavras chave: Astyanax jacuhiensis, AgNOR, Banda C, fluorocromos, DNAr 18S.
INTRODUÇÃO
A bacia do lago Guaíba abrange o maior contingente populacional, sendo um dos mais importantes recursos hídricos do Rio Grande do Sul. Ela é dividida em 8 sub-bacias interligadas por grandes rios como Vacacaí-Jacuí, Caí, Sinos, Gravataí e diversos arroios, possuindo uma área de 500 km2, com cerca de 50 km de comprimento por 12 km de largura, drenando uma área de 85.950 km2. Pela sua
extensão, o Guaíba possui profundidades variando de 5 a 6 metros e alguns trechos no canal de navegação de 20 e 50 metros (Lopes 2006).
Nos anos de 2002 a 2004 foi realizado um monitoramento deste lago em relação a ictiofauna incluindo seus tributários, onde foram identificadas 66 espécies distribuídas em 21 famílias, sendo Astyanax fasciatus e Cheirodon ibicuihensis,
pertencentes a família Characidae, as que ocorreram numa freqüência maior (Lopes 2006).
Segundo Reis et al. (2003), a família Characidae apresenta 952 espécies válidas e 400 espécies ainda não descritas, totalizando 1352 espécies. Destas, o gênero Astyanax forma um grupo complexo e sua identificação tem sido difícil por
26
Vários gêneros desta família constituem um grupo heterogêneo de peixes de pequeno a grande porte e têm sido incluídos na subfamília Tetragonopterinae. Entretanto, devido a falta de evidências que esta subfamília constitui um grupo monofilético, Lima et al. (2003) listaram 88 gêneros como “Incertae Sedis” que
incluem 620 espécies sendo que, dentre estas, 399 (64%) são taxonomicamente pouco conhecidas e constituem, provavelmente, grupos não monofiléticos de Characidae: Hyphessobrycon (97 espécies), Astyanax (86 espécies), Moenkhausia
(58 espécies), Bryconamericus (51 espécies) e Hemigrammus (43 espécies). Além
disso, mais de 47 gêneros (53%) incluídos com Incertae Sedis são monotípicos e 25
gêneros (26%) contêm somente duas ou três espécies (Lima et al., 2003).
A espécie Astyanax jacuhiensis foi primeiramente descrita como
Tetragonopterus jacuhiensis por Cope em 1894, sendo transferida ao gênero Astyanax por Fowler (1906) e considerado sinônimo de Astyanax bimaculatus por
Eigenmann (1921). Recentemente, Lima et al. (2003), passaram a nomear tal espécie como Astyanax jacuhiensis conhecida apenas na localidade tipo (rio Jacuí)
sendo, portanto, endêmica desta região (Lima et al., 2007).
O presente estudo mostra a primeira descrição cariotípica de Astyanax
jacuhiensis, através de coloração convencional e diferentes técnicas de bandamento
cromossômico: AgNOR, fluorocromos, FISH com sonda DNAr 18S e banda C.
27
Vinte e quatro exemplares de Astyanax jacuhiensis, foram coletados em três
diferentes pontos do lago Guaíba, no Rio Grande do Sul, sendo três machos e duas fêmeas no Gasômetro, três machos e uma fêmea no Arroio do Ribeiro e nove machos e seis fêmeas na Barra do Ribeiro, totalizando quinze machos e nove fêmeas entre janeiro e setembro de 2006.
As preparações cromossômicas foram obtidas segundo a técnica de preparação direta, a partir do rim anterior, descrita por Bertollo et al. (1978). As análises cariotípicas foram realizadas com coloração convencional e os cromossomos foram classificados em metacêntricos (m), submetacêntricos (sm), subtelocêntricos (st) e acrocêntricos (a), segundo a metodologia proposta por Levan et al. (1964). Os acrocêntricos foram considerados com um braço e os demais com
dois braços para cálculo do número fundamental (NF).
A detecção da região organizadora de nucléolos foi realizada através da impregnação por nitrato de prata, proposta por Howell e Black (1980).
O padrão de distribuição da heterocromatina foi evidenciado segundo a técnica proposta por Sumner (1972). O tratamento com os fluorocromos cromomicina A3 (GC específico) e DAPI (AT específico), foi realizado de acordo com
Schweizer (1980).
A localização dos sítios de DNAr 18S foi obitda pela hibridação in situ com
fluorescência (FISH), utilizando-se sondas de DNAr 18S obtido do peixe
28
recombinante utilizada foi a E. coli JM 109 (Promega), os fragmentos foram isolados
através da técnica de “mini-prep”, e marcados com Biotina-14-dUTP por “nick translation” conforme especificações do Kit utilizado (Gibco cat N 18247-015). A técnica de FISH foi realizada segundo Swarça et al. (2001).
RESULTADOS E DISCUSSÃO
Esta é a primeira descrição cariotípica de Astyanax jacuhiensis, da bacia do
lago Guaíba/RS, que apresentou número diplóide igual a 50 cromossomos distribuídos em 8m+30sm+4st+8a com número fundamental (NF) igual a 92, tanto para machos quanto para fêmeas (figura 1a). Este número diplóide de 2n = 50 cromossomos foi observado em outras espécies do gênero Astyanax, como em
Astyanax bimaculatus (Morelli et al.,1983; Paganelli, 1990; Alberdi e Fenocchio,
1997; Jorge e Moreira-Filho, 2001), Astyanax altiparanae (Pacheco et al., 2001;
Daniel-Silva e Almeida-Toledo, 2001; Fernandes e Martins-Santos, 2004; 2006a),
Astyanax scabripinnis (Mantovani et al., 2000; Ferro et al., 2001; Mantovani e
Moreira-Filho, 2005; Fernandes e Martins-Santos, 2005), sendo, portanto, uma característica comum dentro do gênero. A constituição cariotípica observada em
Astyanax jacuhiensis é similar a Astyanax altiparanae (citado como A. bimaculatus)
do rio Mogi Guaçu analisada por Paganelli (1990) e do ribeirão Três Bocas por Pacheco (2001).
Após impregnação pelo nitrato de prata foram observados em Astyanax
jacuhiensis entre 2 a 5 cromossomos portadores das regiões organizadoras de
29
tamanho entre os cromossomos homólogos, sendo este o par AgNOR mais freqüente, visualizado em todas as metáfases, um outro par subtelocêntrico 20, com marcação no braço curto e um cromossomo metacêntrico do par 4 com marcação no braço longo (figura 1b).
A hibridação in situ com fluorescência (FISH) utilizando-se a sonda de DNAr
18S mostra exatamente a localização e o número de cístrons ribossômicos de uma espécie. Em Astyanax jacuhiensis, apesar da observação de até 5 cromossomos
AgNORs, a utilização da sonda de DNAr 18S, através da técnica de FISH, evidenciou apenas um par de cromossomos sm com marcações fluorescentes no braço curto, mostrando também um heteromorfismo de tamanho (Figura 1c), coincidindo com o par 8, frequentemente identificado pelo nitrato de prata caracterizando, portanto, um sistema de NORs simples, com apenas 1 par de cromossomos carregando os genes ribossômicos. As demais marcações observadas após a impregnação pelo nitrato de prata provavelmente são regiões apenas heterocromáticas, com proteínas ácidas que têm afinidade pelo nitrato de prata.
O heteromorfismo de AgNOR confirmado pela técnica de FISH, é devido a variação no número de cópias de cístrons ribossômicos entre os homólogos, que pode ter ocorrido por meio de mecanismos de crossing-over desigual, transposição ou rearranjos, como deleções e duplicações (Galetti-Jr et al., 1995).
Apesar de ser comum o sistema de NORs mútiplas no gênero Astyanax
Almeida-30
Toledo et al., 2002; Mantovani e Moreira-Filho, 2005; Fernandes e Martins-Santos, 2006a,b) também já foi evidenciado sistema de NORs simples em Astyanax
bimaculatus dos rios São Francisco, Doce e Paraguai (Paganelli,1990) e Astyanax altiparanae do rio Paraná (Fernandes e Martins-Santos, 2004) e rio Monjolinho
(Peres et al., 2008).
A utilização do fluorocromo CMA3 nas preparações cromossômicas de
Astyanax jacuhiensis (figura 1d) mostrou até 4 cromossomos com marcações
terminais provavelmente correspondentes ao par AgNOR e às regiões heterocromáticas com afinidade pela prata, sendo estes portanto, ricos em bases GC. A sobreposição CMA3/DAPI não mostrou nenhuma banda DAPI positiva (figura
1d), não sendo observada nenhuma região rica em bases AT em Astyanax
jacuhiensis.
A técnica de banda C revelou blocos de heterocromatina nas regiões pericentroméricas na maioria dos cromossomos, sendo observadas algumas marcações intersticiais nos pares 6, 9, 11 e 13 e o par cromossômico 8 (sm), com marcação heterocromática mais evidente na porção terminal do braço curto (figuras 2a, c). Este par cromossômico é o mesmo anteriormente evidenciado pelo nitrato de prata (figura 2b), FISH e CMA3, portanto pode-se dizer que os cístrons ribossômicos
em Astyanax jacuhiensis estão intercalados com heterocromatina rica em bases GC.
31
populações de A. altiparanae (Daniel-Silva e Almeida-Toledo, 2001; Fernandes e
Martins-Santos, 2004) e de Astyanax bimaculatus dos rios São Francisco e Paraguai
analisadas por Paganelli (1990), onde também foram observados blocos de heterocromatina em regiões intersticiais.
Resultado obtido com BC+CMA3 confirmou que a heterocromatina se
encontra associada a NOR, que esteve sempre ativa nas intérfases anteriores, pois foi observado um par de cromossomos submetacêntricos com marcações terminais bem evidente, mostrando o mesmo heteromorfismo evidenciado pelo CMA3, além de
outras marcações fluorescentes em regiões pericentroméricas e intersticiais (figura 2d) mostrando, portanto, que uma classe de heterocromatina neste estudo é composta de bases GC.
Os resultados obtidos no presente estudo representam uma importante contribuição à citogenética do gênero Astyanax, uma vez que relata a primeira
descrição de Astyanax jacuhiensis, mostrando que esta espécie possui
características cromossômicas comuns a algumas populações de A. altiparanae e A.
bimaculatus, evidenciando uma maior similaridade com esta última espécie,
tornando-se este fato interessante pois Astyanax jacuhiensis já foi definido
32
Figura 1 - a) Cariótipo de Astyanax jacuhiensis; b) Cromossomos com AgNORs; c)
33
Figura 2 - a) Cariótipo de banda C de Astyanax jacuhiensis; b) par cromossômico 8
com AgNORs; c) par cromossômico 8 com banda C; d) metáfase com BC + CMA3
34
REFERÊNCIAS
ALBERDI AJ e FENOCCHIO AS (1997). Karyotypes of five Tetragonopterinae species (Pisces, Characidae) from Argentina.Cytologia 62(2):171-176.
ALMEIDA-TOLEDO LF, OZOUF-COSTAZ C, FORESTI F, BONILLO C, PORTO-FORESTI F e DANIEL-SILVA MFZ (2002). Conservation of the 5S-bearing chromosome pair and co-localization with major rDNA clusters in five species of Astyanax (Pisces, Characidae).Cytogenetic Genome Res. 97(3-4):229-233. BERTOLLO LAC, TAKAHASHI CS e MOREIRA-FILHO O (1978) Cytotaxonomic
considerations on Hoplias lacerdae (Pisces, Erythrinidae). Brazilian Journal of Genetics 1(2):103-120.
DANIEL-SILVA MFZ e ALMEIDA-TOLEDO LF (2001). Chromosome R-banding pattern and conservation of a marker chromosome in four species, genus
Astyanax (Characidae, Tetragonopterinae). Caryologia 54:209-215.
EIGENMANN CH (1921). The American Characidae; III. Memoirs of. Museum of. Conwarative Zoology of Harvard College, Cambridge, Mass. 43:209-310.
FOWLER HW (1906). Further Knowledge of some heterognathous part 2. Proceedings of the Academy of Natural Sciences of Philadelphia. Philadelphia 58;431-83.
FERNANDES CA e MARTINS-SANTOS IC (2004). Cytogenetic studies in two populations of Astyanax altiparanae (Pisces, Characiformes).
Hereditas.141:328-332.
FERNANDES CA e MARTINS-SANTOS IC (2005). Sympatric occurrence of three cytotypes and four morphological types of B chromosomes of Astyanax
scabripinnis (Pisces, Characiformes) in the river Ivaí basin, state of Paraná,
35
FERNANDES CA e MARTINS-SANTOS IC (2006a). Mapping of the 18S and 5S ribosomal RNA genes in Astyanax altiparanae Garutti & Britski, 2000 (Teleostei,
Characidae) from the upper Paraná river basin, Brazil. Genetics and Molecular Biology 29: 1-5.
FERNANDES CA e MARTINS-SANTOS IC (2006b). Chromosomal location of 5S and 18S rRNA genes in three sympatric cytotypes of Astyanax scabripinnis
(Characiformes, Characidae) from the Ivaí river basin, state of Paraná, Brazil. Caryologia (Firenze), Itália 59: 253-259.
FERRO DAM, NÉO DM, MOREIRA FILHO O e BERTOLLO LAC (2001). Nucleolar organizing regions, 18S and 5S rDNA in Astyanax scabripinnis (Pisces,
Characidae): population and functional diversity. Genetica 110: 55-62.
GALETTI-JR. PM; MESTRINER, CA, MONACO, PJ e RASH, EM (1995), Post-zygotic modifications and intra and interindividual nucleolar organizing region variations in fish: report of a case involving Leporinus friderici. Chromosome
Research 3: 285-290.
HOWELL WM e BLACK DA (1980). Controlled silver-staining of nucleolus organizer regions with the protective coloidal developer: a 1-step method. Experientia 36:1014-1015.
JORGE LC e MOREIRA-FILHO O (2001). Estudios citogenéticos en Astyanax
bimaculatus (Pisces, Characidae) del río Paraná, Argentina. Revista de
Ictiologia 9 (1/20):21-24.
LEVAN A, FREDGA K e SANDBERG AA (1964). Nomenclature for centromeric position on chromosome. Hereditas 52:201-220.
36
MALABARBA MCSL, LUCENA ZMS, REIS RE, LANGEANI F, CASSATI L, BERTACO VA, MOREIRA C e LUCINDA PHF (2003). Genera Incertae Sedis in Characidae. In: REIS RR, KULLANDER SO E FERRARIS JR. (Eds.). Check list of the freshwater fishes of South and Central America. Porto Alegre, Edipucrs. 106-113.
LIMA FCT; BUCKUP PA, MENEZES NA; LUCENA CAS; LUCENA ZMS; TOLEDO-PIZA M e ZANATA A (2007). Família Characidae: Gêneros Sedis in Characidae. In: BUCKUP PA; MENEZES NA; GHAZZI MS (Eds.). Catálogo das espécies de peixes de água doce do Brasil. Rio de Janeiro. Museu Nacional. 44-62.
LOPES FF (2006). Monitoramento ambiental da bacia hidrográfica do lago Guaíba-RS – Brasil, através da utilização de diferentes metodologias aplicadas a taxocenoses de peixes. Tese, Universidade Federal do Rio Grande do Sul, Rio Grande do Sul. 228p.
MANTOVANI M, ABEL LDS, MESTRINER CA e MOREIRA-FILHO O (2000). Acentuated polymorfhism of heterochrimatin and nucleolar organizer regions in
Astyanax scabripinnis (Pisces, Characidae): tools understanding karyotypic
evolution. Genetica 109:161-168.
MANTOVANI M, ABEL LDS e MOREIRA FILHO O (2005). Conserved 5S and variable 45S rDNA chromosomal localization revealed by FISH in Astyanax
scabripinnis (Pisces, Characidae).Genetica 123:211-216.
37
MORELLI, S; BERTOLLO, LAC; FORESTI, F; MOREIRA-FILHO, O e TOLEDO-FILHO, AS (1983) Cytogenetics considerations on the genus Astyanax (Pisces,
Characidae), I Karyotypic variability. Caryologia36(3):235-244.
PACHECO, RB. (2001). Estudos citogenéticos em diferentes populações de
Astyanax altiparanae (Pisces, Tetragonopterinae). Dissertação de Mestrado.
Universidade Estadual de Londrina. 97p.
PACHECO RB, GIULIANO-CAETANO L e DIAS AL (2001). Occurrence of cytotypes and multiple NORs in an Astyanax altiparanae population (Pisces,
Tetragonopterinae). Chromosome Science 5:109-114.
PAGANELLI, HH, (1990) Diversidade cromossômica no gênero Astyanax, com especial referência a A. bimaculatus. (Linnaeus, 1758). Considerações
citotaxonômicas e evolutivas. Dissertação de Mestrado. Departamento de Ciências Biológicas. Universidade Federal de São Carlos. 108 p.
PERES WAM, BERTOLLO LAC e MOREIRA-FILHO O (2008). Physical mapping of the 18S and 5S ribosomal genes in nine Characidae species (Teleostei, Characiformes). Genetics and Molecular Biology, 31,1 (suppl), 222-226.
REIS RR, KULLANDER SO E FERARIS JR. (org). (2003). Check list of the freshwater fishes of south and central América. Porto Alegre: Edipucrs.
SOUZA IL, GALIANN J, RÚA PDL, BERTOLLO LAC e MOREIRA-FILHO O (2001). Non-radom distribution of the GC-rich heterochromatin and nuclear rDNA sites on Astyanax scabripinnis chromosomes. Cytologia66:85-91.
38
SCHWEIZER D (1980). Simultaneous fluorescent staining of R-bands and specific heterochromatic regions (DA-DAPI bands) in human chromosomes. Citogenet. Cell. Genet. 27:190-193.
CAPÍTULO II
CITOGENÉTICA COMPARATIVA ENTRE TRÊS DIFERENTES POPULAÇÕES DE Astyanax
altiparanae, COM ÊNFASE À LOCALIZAÇÃO DO DNAR 18S E 5S.*
40
CITOGENÉTICA COMPARATIVA ENTRE TRÊS DIFERENTES POPULAÇÕES DE Astyanax
altiparanae, COM ÊNFASE À LOCALIZAÇÃO DO DNAR 18S E 5S
Palavras-chave: AgNOR, cariótipo, CMA3, DAPI, DNAr 18S, DNAr 5S, Astyanax
altiparanae
R
REESSUUMMOO
Foram analisadas três populações de Astyanax altiparanae pertencentes aos rios
Monjolinho/SP e Água dos Patos/SP e lago Igapó/PR, com todos indivíduos apresentando número diplóide igual 50 cromossomos entretanto, com diferentes fórmulas cariotípicas. A população do rio Monjolinho apresentou 10m, 28sm, 4st e 8a (NF=92), a do rio Água dos Patos 8m, 24sm, 6st e 12a (NF=88) e a população do lago Igapó 8m, 28sm, 4st e 10a (NF=90). As AgNORs foram observadas em regiões terminais do braço curto ou longo de diferentes cromossomos, em todas as populações sendo evidenciada uma variação de 1 até 5 cromossomos, caracterizando um sistema de AgNORs múltiplas nesta espécie. Através da hibridação fluorescente in situ (FISH) utilizando sonda DNAr 18S, foi visualizado
41
mostrou-se coincidente com alguns sítios da AgNORs, evidenciadas pelo nitrato de prata e não foi observada nenhuma região rica em pares de bases AT.
INTRODUÇÃO
O gênero Astyanax possui ampla distribuição geográfica na América do Sul e
representa um grande grupo de peixes de água doce, sendo o gênero mais comum e diversificado da família Characidae, segundo Lima et al. (2003), revelando estreitamente várias formas semelhantes, formando um complexo, do ponto de vista taxonômico (Garutti e Britski, 2000).
Em Astyanax altiparanae da bacia do alto Paraná (Garutti e Britski, 2000),
previamente identificados como Astyanax bimaculatus, todos os estudos
citogenéticos até o momento, apresentam número diplóide igual a 50 cromossomos, com diferenças na fórmula cariotípica entre as populações analisadas, sendo uma característica da espécie as regiões organizadoras de nucléolos apresentarem-se variáveis em relação ao número e posição das AgNORs (Daniel-Silva e Almeida-Toledo, 2001; Pacheco et al., 2001; Fernandes e Martins, 2004; entre outros). A técnica de hibridação in situ fluorescente (FISH), com sonda de DNAr 18S, foi
utilizada em Astyanax altiparanae por Almeida-Toledo et al. (2002) e Fernandes e
Martins-Santos (2006a) confirmando a presença e a variabilidade de múltiplos sítios com cístrons ribossômicos nesta espécie.
42
Almeida-Toledo et al. (2002) e Fernandes e Martins-Santos (2006a), mostrando um par cromossômico com marcação intersticial.
O presente trabalho teve como objetivo caracterizar e comparar os cariótipos de três populações de Astyanax altiparanae, com ênfase na localização dos genes
ribossômicos 18S e 5S.
MATERIAL E MÉTODOS
Foram analisadas citogeneticamente três populações de Astyanax
altiparanae, sendo oito exemplares (dois machos e seis fêmeas) do rio Monjolinho,
São Carlos/SP, doze exemplares (três machos e nove fêmeas) do rio Água dos Patos/Iepê/SP e dezesseis exemplares (nove machos e sete fêmeas) do lago Igapó, Londrina/PR.
As preparações cromossômicas foram obtidas segundo a técnica de preparação direta, a partir do rim anterior, descrita por Bertollo et al. (1978). As análises cariotípicas foram realizadas com coloração convencional e os cromossomos foram classificados em metacêntricos (m), submetacêntricos (sm), subtelocêntricos (st) e acrocêntricos (a), segundo a metodologia proposta por Levan et al.(1964) com modificações. Os acrocêntricos foram considerados com um braço e os demais com dois braços para cálculo do número fundamental (NF).
43
com os fluorocromos cromomicina A3 (GC específico) e DAPI (AT específico), foi
realizado de acordo com Schweizer (1980). A localização dos sítios de DNAr 18S foi obtida pela hibridação in situ com fluorescência (FISH), segundo Swarça et al.
(2001), utilizando-se sonda de DNAr 18S contendo cerca de 1700pb obtida do peixe
Oreochromis niloticus, e o segmento de DNAr 5S contendo 200pb obtido do peixe Leporinus elongatus. Os fragmentos foram isolados através da técnica de
“mini-prep”, e marcados com Biotina-14-dUTP por “nick translation” conforme especificações do Kit utilizado (Gibco cat N 18247-015).
R
REESSUULLTTAADDOOSS
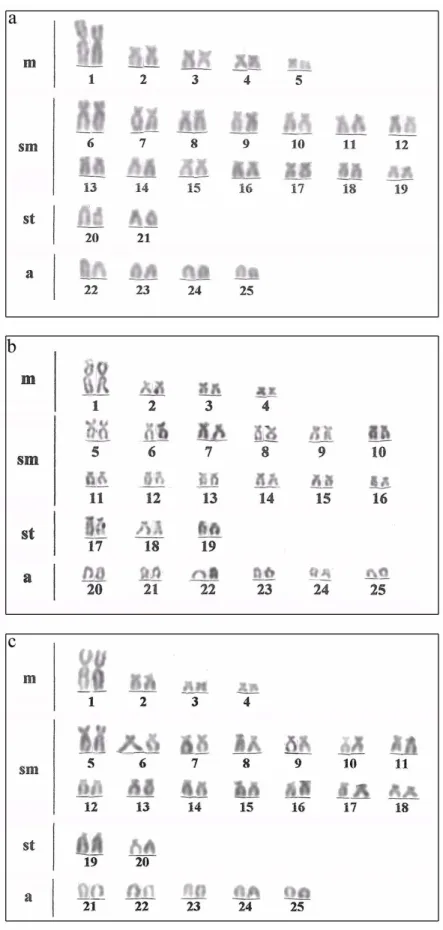
Todas as populações de Astyanax altiparanae apresentaram número diplóide
igual a 50 cromossomos porém, diferentes fórmulas cariotípicas foram evidenciadas. A população do rio Monjolinho apresentou 10m, 28sm, 4st e 8a (NF=92) (figura 1a), a do rio Água dos Patos 8m, 24sm, 6st e 12a (NF=88) (figura 1b) e a população do lago Igapó 8m, 28sm, 4st e 10a (NF=90) (figura 1c).
44
Através da hibridação fluorescente in situ (FISH), utilizando sonda de DNAr
18S, foi visualizado na população do rio Monjolinho apenas um par de cromossomos submetacêntricos de tamanho pequeno, com marcação no braço curto, apresentando heteromorfismo de tamanho dos sítios ribossômicos entre os homólogos (figura 2d).
A população do rio Água dos Patos apresentou de 2 a 4 AgNORs no braço curto, em dois pares subtelocêntricos de tamanho médio, com heteromorfismo de tamanho desta região em um destes pares, sendo este par visualizado em todas as metáfases (figura 2b).
Através da hibridação fluorescente in situ (FISH), utilizando sonda de DNAr
18S, a população do rio Água dos Patos apresentou 4 marcações fluorescentes, sendo dois pares de cromossomos subtelocêntricos medianos, com marcação no braço curto (figura 2e).
Na população do lago Igapó foram detectadas de 1 a 3 AgNORs: um cromossomo submetacêntrico de tamanho médio, com marcação no braço longo e um par subtelocêntrico também mediano com marcação no braço curto, apresentando um pequeno heteromorfismo de tamanho, sendo este par observado em quase todas as metáfases (figura 2c).
Através da hibridação fluorescente in situ (FISH), utilizando sonda de DNAr
45
cromossomos subtelocêntricos, de tamanho médio, apresentando sinais fluorescentes no braço curto (figura 2f).
O tratamento com cromomicina A3 (CMA3) mostrou várias marcações
fluorescentes terminais em diferentes cromossomos, nas 3 populações de Astyanax
altiparanae. A do rio Monjolinho mostrou de 1 a 5 cromossomos CMA3 positivos: um
cromossomo acrocêntrico e um par submetacêntrico, todos pequenos, e um outro par cromossômico submetacêntrico mediano com marcação no braço longo, sendo um dos cromossomos com marcação em ambas regiões terminais (figura 2g); o par submetacêntrico pequeno apresentou um heteromorfismo de tamanho no braço curto entre os homólogos e foi quase sempre evidenciado (figura 2g).
Na população do rio Água dos Patos foram evidenciados de 2 a 4 cromossomos com marcações CMA3 terminais onde foram evidenciadas: um par
subtelocêntrico de tamanho mediano e com heteromorfismo de tamanho dos sinais no braço curto, sendo o mais frequentemente visualizado nas metáfases, um cromossomo acrocêntrico de tamanho pequeno com marcação no braço curto, e um cromossomo subtelocêntrico mediano com marcação no braço longo (figura 2h).
Na população do lago do Igapó foram evidenciadas marcações CMA3 do
braço curto de apenas um par de cromossomos subtelocêntricos de tamanho médio, e com heteromorfismo de tamanho (figura 2i).
46
bases AT, como pode ser observado pela sobreposição destes fluorocromos nas figuras 2g, h, i.
Através da hibridação fluorescente in situ (FISH), utilizando sonda de DNAr
5S, foi visualizado um par de cromossomos com sinais fluorescentes em posição intersticial em todas as populações de A. altiparanae analisadas (figura 3a, b, c).
DISCUSSÃO
Os estudos citogenéticos em Astyanax altiparanae do rio Monjolinho, rio Água
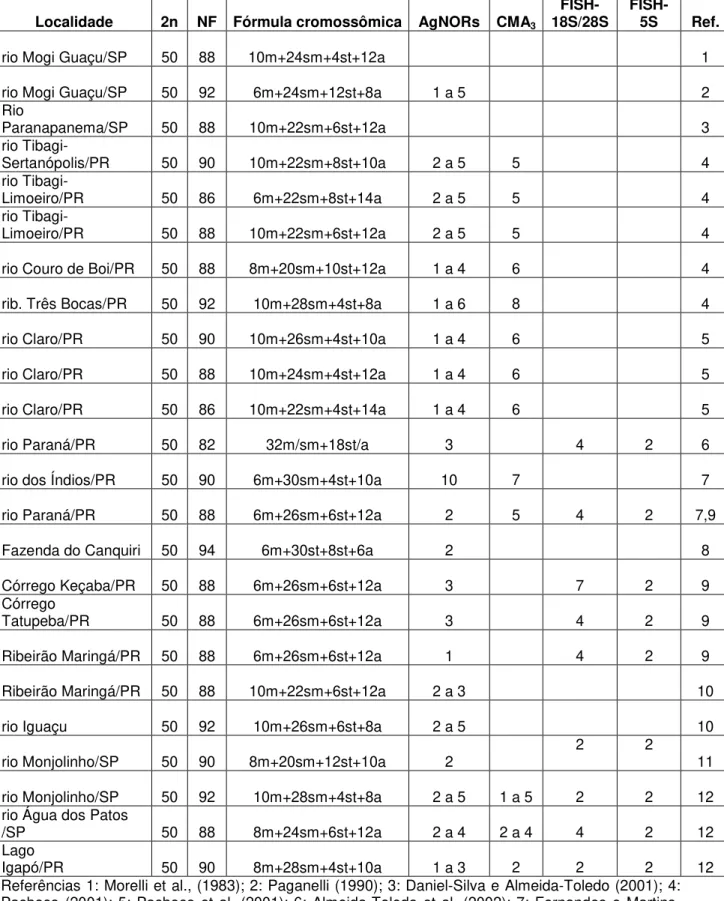
dos Patos e lago Igapó, revelam uma conservação do número diplóide igual a 50, característico da espécie, sendo observado até o momento em todas as populações analisadas desta espécie porém, diferenças na fórmula cariotípica e no número fundamental encontradas entre algumas destas populações, provavelmente devido a eventos como as inversões pericêntricas, revelam uma variabilidade na macroestrutura cariotípica neste grupo de peixes (tabela 1).
Peres et al. (2008) também estudaram indivíduos de A. altiparanae do rio
Monjolinho, encontrando uma fórmula cariotípica diferente da observada no presente estudo, com 8m+20sm+12st+10a.
As três populações analisadas mostraram um sistema de AgNORs múltiplas, freqüentemente evidenciado em Astyanax altiparanae (tabela 1), ocorrendo
47
submetacêntrico na população do rio Monjolinho. Interessante notar, que este par AgNOR foi o mais frequentemente encontrado nas preparações cromossômicas das três populações, que pode ser considerado um par principal, com a NOR sempre ativa, junto com sítios secundários, como observado por Pazza et al. (2006) em
Astyanax fasciatus.
A hibridação in situ com fluorescência (FISH) utilizando a sonda de DNAr 18S
nas populações de A. altiparanae do rio Monjolinho e lago Igapó evidenciou apenas
um par de cromossomos com marcações fluorescentes no braço curto, coincidindo com o par frequentemente identificado pelo nitrato de prata, caracterizando, portanto, um sistema de NORs simples. As demais marcações observadas após a impregnação pelo nitrato de prata provavelmente são regiões heterocromáticas, com proteínas ácidas que tem afinidade pela prata.
Peres et al. (2008) também observaram apenas um par com cístrons ribossômicos nos indivíduos de A. altiparanae do rio Monjolinho correspondendo ao
único par AgNOR observado. Mais uma diferença encontrada entre as duas análises, pois no presente estudo foram encontradas 5 marcações após a impregnação pelo nitrato de prata.
Na população de Água dos Patos, foram encontrados dois pares cromossômicos com marcações fluorescentes nos braços curtos, após a hibridação, coincidindo com os sítios detectados pela prata, confirmando um sistema de AgNORs múltiplas, assim como na maioria das populações analisadas de Astyanax
altiparanae, onde até 7 cromossomos foram evidenciados com sonda de DNAr 18S
ou 28S (tabela 1).
48
gênero Astyanax, como por exemplo em Astyanax scabripinnis (Souza et al., 2001;
Mantovani et al., 2005; Fernandes e Martins-Santos, 2006b) e em Astyanax
fasciatus (Pazza et al., 2006), sendo portanto uma característica deste grupo de
peixes.
O heteromorfismo de AgNOR, nas três populações aqui estudadas, foi confirmado pela hibridação apenas na população do rio Monjolinho, provavelmente devido a variação no número de cópias de cístrons ribossômicos entre os homólogos, que pode ter ocorrido por meio de mecanismos de crossing-over desigual, transposição ou rearranjos, como deleções e duplicações (Galetti-Jr et al., 1995). Este tem sido um evento comum nesta espécie, como evidenciado por Fernandes e Martins-Santos (2006a) em populações de A. altiparanae do córrego
Tatupeba. O heteromorfismo AgNOR encontrado nas outras duas populações do presente trabalho, deve estar relacionado a expressão do gene ou devido a uma maior quantidade de heterocromatina entre os genes, uma vez que foi detectado pelo CMA3 e pela impregnação de nitrato de prata.
O tratamento com fluorocromo CMA3 nas preparações cromossômicas de
Astyanax altiparanae do presente estudo, mostrou correspondência com alguns
sítios marcados pela prata, inclusive um cromossomo subtelocêntrico com marcação nos dois telômeros na população do rio Monjolinho, sendo portanto, estes sítios, ricos em bases GC. Entretanto, AgNORs não visualizadas através do CMA3, talvez
sejam tão pequenas que não foram detectadas por este fluorocromo ou então, nem todas são ricas em GC, como sugerido por Fernandes e Martins-Santos (2004), analisando A. altiparanae do rio do Índio, no qual observaram um número maior de
49
O tratamento com fluorocromo DAPI não apresentou nenhuma marcação nos cromossomos nas 3 populações, não possuindo, portanto nenhuma região rica em bases AT, sendo este o primeiro relato com DAPI no gênero Astyanax.
As preparações cromossômicas nas 3 populações de Astyanax altiparanae
com sonda de DNAr 5S, evidenciou um par de cromossomos com sinais fluorescentes em posição intersticial, demonstrando uma alta estabilidade deste sítio, corroborando com os dados de outras populações de Astyanax altiparanae
(tabela 1) e de outras espécies do gênero Astyanax (Almeida-Toledo et al., 2002;
Fernandes e Martins-Santos, 2006b; Almeida-Toledo et al., 2002, Pazza et al., 2006). A conservação deste padrão pode ser devido à localização intersticial destes sítios nos cromossomos, estando o DNAr 5S protegido dos eventos de dispersão que pode ocorrer com DNAr 45S, como proposto por Mantovani et al. (2005).
Os dados obtidos nas três populações de A. altiparanae mostram que, apesar
da conservação do número diplóide e da localização do DNAr 5S, foram encontradas diferenças na distribuição do DNAr 18S e nas fórmulas cariotípicas entre as populações, facilmente identificadas pelo número de pares acrocêntricos, corroborando os dados existentes sobre a variabilidade cromossômica de Astyanax
altiparanae, sugerindo a existência de várias espécies que poderiam constituir um
50
Tabela 1: Dados citogenéticos de diferentes populações de Astyanax altiparanae.
NF: número fundamental; m: metacêntrico; sm: submetacêntrico; st: subtelocêntrico; a: acrocêntrico; NORs: região organizadora de nucléolos; FISH: hibridação in situ; Ref: Referências.
Localidade 2n NF Fórmula cromossômica AgNORs CMA3
FISH-18S/28S FISH-5S Ref.
rio Mogi Guaçu/SP 50 88 10m+24sm+4st+12a 1
rio Mogi Guaçu/SP 50 92 6m+24sm+12st+8a 1 a 5 2
Rio
Paranapanema/SP 50 88 10m+22sm+6st+12a 3
rio
Tibagi-Sertanópolis/PR 50 90 10m+22sm+8st+10a 2 a 5 5 4
rio
Tibagi-Limoeiro/PR 50 86 6m+22sm+8st+14a 2 a 5 5 4
rio
Tibagi-Limoeiro/PR 50 88 10m+22sm+6st+12a 2 a 5 5 4
rio Couro de Boi/PR 50 88 8m+20sm+10st+12a 1 a 4 6 4
rib. Três Bocas/PR 50 92 10m+28sm+4st+8a 1 a 6 8 4
rio Claro/PR 50 90 10m+26sm+4st+10a 1 a 4 6 5
rio Claro/PR 50 88 10m+24sm+4st+12a 1 a 4 6 5
rio Claro/PR 50 86 10m+22sm+4st+14a 1 a 4 6 5
rio Paraná/PR 50 82 32m/sm+18st/a 3 4 2 6
rio dos Índios/PR 50 90 6m+30sm+4st+10a 10 7 7
rio Paraná/PR 50 88 6m+26sm+6st+12a 2 5 4 2 7,9
Fazenda do Canquiri 50 94 6m+30st+8st+6a 2 8
Córrego Keçaba/PR 50 88 6m+26sm+6st+12a 3 7 2 9
Córrego
Tatupeba/PR 50 88 6m+26sm+6st+12a 3 4 2 9
Ribeirão Maringá/PR 50 88 6m+26sm+6st+12a 1 4 2 9
Ribeirão Maringá/PR 50 88 10m+22sm+6st+12a 2 a 3 10
rio Iguaçu 50 92 10m+26sm+6st+8a 2 a 5 10
rio Monjolinho/SP 50 90 8m+20sm+12st+10a 2 2 2 11
rio Monjolinho/SP 50 92 10m+28sm+4st+8a 2 a 5 1 a 5 2 2 12 rio Água dos Patos
/SP 50 88 8m+24sm+6st+12a 2 a 4 2 a 4 4 2 12
Lago
Igapó/PR 50 90 8m+28sm+4st+10a 1 a 3 2 2 2 12
51
Figura 1 - Cariótipos de Astyanax altiparanae das populações: a) do rio Monjolinho,
52
Figura 2 - AgNORs, FISH com sonda de DNAr 18S e CMA3/DAPI em Astyanax
altiparanae, respectivamente: a, d, g) rio Monjolinho; b, e, h) rio Água dos Patos; c, f,
53
Figura 3 - Metáfases de Astyanax altiparanae evidenciando os sítios de DNAr 5S
54
REFERÊNCIAS
ABELINI E (2007), Análise citogenética em três espécies do gênero Astyanax
(Pisces, Characiformes). Dissertação de Mestrado da Universidade
Estadual de Maringá. 67p.
ALMEIDA –TOLEDO LF, OZOUF-COSTAZ C, FORESTI F, BONILLO C, PORTO-FORESTI F e DANIEL-SILVA MFZ (2002), Conservation of the 5S-bearing chromosome pair and co-localization with major rDNA clusters in five species of
Astyanax (Pisces, Characidae).Cytogenetic. Genome Res. 97 (3-4):229-233.
BERTOLLO LAC, TAKAHASHI CS. e MOREIRA-FILHO O (1978). Cytotaxonomic considerations on Hoplias lacerdae (Pisces, Erythrinidae). Brazilian Journal of
Genetics, v. 1, n 2, p.103-120.
DANIEL-SILVA MFZ e ALMEIDA-TOLEDO LF (2001). Chromosome R-banding pattern and conservation of a marker chromosome in four species, genus
Astyanax (Characidae, Tetragonopterinae). Caryologia, 54: 209-215.
DOMINGUES MS (2005). Citogenética comparativa de Astyanax altiparanae Garutti
e Britski, 2000 do alto rio Tibagi e alto rio Iguaçu. Dissertação de mestrado. Curitiba: Universidade Federal do Paraná. 66p.
FERNANDES CA e MARTINS-SANTOS IC (2004). Cytogenetic studies in two populations of Astyanax altiparanae (Pisces, Characiformes). Hereditas, v.141:
328-332.
FERNANDES CA e MARTINS-SANTOS IC (2006a). Mapping of the 18S and 5S ribosomal RNA genes in Astyanax altiparanae Garutti & Britski, 2000 (Teleostei,
55
FERNANDES CA e MARTINS-SANTOS IC (2006b). Chromosomal location of 5S and 18S rRNA genes in three sympatric cytotypes of Astyanax scabripinnis
(Characiformes, Characidae) from the Ivaí river basin, state of Paraná, Brazil. Caryologia (Firenze), Itália, v. 59, p. 253-259.
GALETTI JR PM, MESTRINER CA, MONACO PJ e RASH EM (1995). Post-zygotic modifications and intra and interindividual nucleolar organizing region variations in fish: report of a case involving Leporinus friderici. Chromosome Research, 3:
285-290.
GARUTTI V e BRITSKI HA (2000). Descrição de uma espécie nova de Astyanax
(Teleostei: Characidae) da bacia do alto rio Paraná e considerações sobre as demais espécies do gênero na bacia. Comn. Mus. Ciênc. Tecnol. PUCRS. Sér. Zool. Porto Alegre. v. 13. p 65-88.
GROMICHO M, OZOUF-COSTAZ C e COLLARES-PEREIRA MJ (2005). Lack of correspondence between CMA3-, Ag-positive signals and 28S rDNA loci in two
Iberian minnows (Teleostei, Cyprinidae) evidenced by sequential banding. Cytogenetic and Genome Research, 109:507-511.
HOWELL, W.M. e BLACK, D.A. (1980), Controlled silver-staining of nucleolus organizer regions with the protective coloidal developer: a 1-step method. Experientia, 36:1014-1015.
LEVAN A, FREDGA K. e SANDBERG AA (1964), Nomenclature for centromeric position on chromosome. Hereditas, 52:201-220.