Inst
itu
to
P
o
litécnico
d
e V
iseu
E
s
c
ol
a
S
u
per
ior
A
grá
ri
a
de
V
is
e
u
Inst
itu
to
P
o
litécnico
d
e V
iseu
Ricardo Alexandre Figueiro Russo
"Aproveitamento de Subproduto de Maçã da Indústria Agroalimentar"
Dissertação
Mestrado em Qualidade e Tecnologia Alimentar
Instit
ut
o P
olit
éc
nico d
e
V
ise
u
E
s
c
ol
a
S
u
per
ior
A
grá
ri
a
de
V
is
e
u
Ricardo Alexandre Figueiro Russo
"Aproveitamento de Subproduto de Maçã da Indústria
Agroalimentar "
Dissertação
Mestrado em Qualidade e Tecnologia Alimentar
Trabalho efetuado sob orientação de Prof. Doutora Dulcineia Ferreira Wessel
Trabalho co-orientado por
Doutora Susana Cardoso (CERNAS- ESA-IPC)
IV
AGRADECIMENTOS
Em primeiro lugar agradeço à minha família por todo o apoio e força que me deram ao longo do meu percurso académico.
À Prof. Doutora Dulcineia Maria de Sousa Ferreira Wessel, minha orientadora interna, pela amizade demonstrada, apoio, dedicação, disponibilidade e contributo na concretização deste trabalho.
À Doutora Susana Maria Almeida Cardoso, minha co-orientadora, pela simpatia, disponibilidade, atenção, e conhecimento transmitido. Ainda agradecer à sua equipa de investigação da Escola Superior Agrária de Coimbra pela ajuda, nomeadamente ao Marcelo, Vasco e Ana.
Aos meus colegas de laboratório Tânia Loureiro, Susana Matos e Helena Ramoa, que sempre me apoiaram e me ajudaram a ultrapassar os problemas que fui encontrando ao longo deste trabalho.
Um especial obrigado à minha namorada Sofia por toda a compreensão, paciência e incentivo.
A todos os meus colegas da Escola Superior Agrária de Viseu, em especial para o Rui, João, Eduardo, Christian, Raquel e Hugo que sempre estiveram ao meu lado, nos bons e maus momentos ao longo dos meus anos de formação académica.
V
RESUMO
Neste trabalho foi estudado um subproduto derivado da indústria agroalimentar produtora de sumo concentrado de maçã, conhecido por bagaço de maçã, com o objetivo de avaliar condições de extração de compostos fenólicos, o teor de compostos fenólicos totais, flavonóides e proantocianidinas e ainda a atividade antioxidante.
Foram efetuadas extrações a partir do bagaço de maçã variando as condições de tempo, temperatura, razão massa:volume e solvente e os extratos obtidos avaliados quanto ao seu teor em compostos fenólicos totais pelo método Folin-Ciocalteu. O extrato aquoso do bagaço de maçã para uma temperatura de 100 ºC a um tempo de 2x4h e concentração de 50 mg/mL, apresentou o teor de compostos fenólicos mais elevado (9,37 mgEAG/g de bagaço de maçã, na base seca) em relação a todas as outras temperaturas, tempos de extração e solventes utilizados, como etanol (50% e 70%) e metanol.
O doseamento de flavonóides totais baseou-se no método espetrofotométrico, usando o reagente cloreto de alumínio e a rutina como padrão. Os melhores resultados foram obtidos usando etanol (70%) como solvente à temperatura ambiente, cerca de 4,35 mgER/g.. A amostra extraída com água apresentou valores bastante similares ao etanol, cerca de 4,27 mgER/g, usando uma temperatura de 100 ºC durante 2x4h.
O conteúdo em proantocianidinas foi determinado pelo método 4-dimetilamino cinamaldeído (DMAC). O bagaço de maçã estudado demonstrou ser pobre no seu conteúdo de proantocianidinas, obtendo valores de 0,77 mgEEC/g.
A atividade antioxidante do bagaço de maçã foi avaliada através de dois métodos distintos: 2,2-difenil-1-picril-hidrazilo (DPPH∙) e método do poder redutor (FRAP). O extrato aquoso obtido a 100 ºC a um tempo de 2x4h, demonstrou ser aquele com maior potencial, com uma capacidade antioxidante mais elevada que os restantes extratos, com valores de IC50 de 0,48 mg/mL e 0,65 mg/mL, para os métodos
de DPPH∙ e FRAP, respetivamente.
Palavras-chave: bagaço de maçã, compostos fenólicos, proantocianidinas,
VI
ABSTRACT
In the present work a by-product derived from the agrifood industry of apple juice concentrate, named apple pomace, has been studied in order to evaluate extraction conditions of phenolic compounds, the content of phenolic compounds, flavonoids and proanthocyanidins and yet the antioxidant activity.Extractions from apple pomace were performed varying the conditions of time, temperature, ratio mass:volume and solvent and the extracts evaluated for their content of phenolic compounds by the Folin-Ciocalteu method. The aqueous extract obtained at 100 °C for 2x4h and concentration of 50 mgmL, showed the highest level of phenolic compounds (9.37 mgEAG/g of apple pomace, on dry basis) compare to the other temperatures, extraction times and solvents used, such as ethanol (50% and 70%) and methanol.
The determination of total flavonoids was based on the spectrophotometric method using the aluminum chloride as reagent and rutin as a standard. The best results were obtained using ethanol (70%) as a solvent at room temperature, 4.35 mgER/g. The aqueous extract obtained at 100 ºC during 2x4h showed values very similar to ethanol, about 4.27 mgER/g.
The content of proanthocyanidins was determined by 4-dimethylamino cinnamaldehyde method (DMAC). The apple pomace studied proved to be poor in content of proanthocyanidins, obtaining values of 0.77 mgEEC/g.
The antioxidant activity of apple pomace extracts was evaluated by two different methods: 2,2-diphenyl-1-picryl-hydrazyl (DPPH∙) and reducing power method (FRAP). The aqueous extract at 100 °C, 2x4h proved to be the one with the highest antioxidant capacity, with IC50 values of 0.48 mg/mL and 0.65 mg/mL, for DPPH∙ and
FRAP methods, respectively.
Keywords: apple pomace, phenolic compounds, antioxidant, DPPH∙, FRAP,
VII
ÍNDICE GERAL
Agradecimentos ... IV Resumo ... V Abstract ... VI Índice geral ... VII Índice de Figuras e Quadros ... X
1. Introdução ... 14
2. Revisão bibliográfica ... 15
2.1. Processamento da maçã e subproduto ... 15
2.2. Valorização do bagaço de maçã ... 20
2.2.1. Biotransformação ... 20
2.2.2. Alimentação animal ... 20
2.2.3. Produção de etanol ... 21
2.2.4. Extração da pectina ... 22
2.2.4.1. Produção de geleia ... 23
2.3. Valor nutricional e compostos bioativos do bagaço de maçã ... 24
2.4. Compostos fenólicos ... 26 2.4.1. Ácidos fenólicos ... 28 2.4.2. Flavonóides ... 29 2.4.2.1. 3-Flavanóis ... 30 2.4.2.2. Dihidrocalconas ... 32 2.4.2.3. Antocianinas ... 32 2.4.2.4. Flavonóis ... 33
2.4.3. Compostos fenolicos da maçã ... 34
2.4.3.1. Distribuição de compostos fenólicos na casca, semente e polpa de maçã……….. ... ………..36
2.4.3.2. Compostos fenolicos do bagaço de maçã ... 38
VIII
2.5.1. Atividade antioxidante nas maçãs ... 42
2.5.2. Benefícios para a saúde ... 43
3. Material e métodos ... 45
3.1. Amostragem ... 45
3.2. Determinação da humidade ... 46
3.3. Extração de compostos fenólicos totais ... 46
3.4. Determinação do teor de compostos fenólicos totais ... 47
3.5. Determinação do teor de flavonóides ... 48
3.6. Determinação do teor de proantocianidinas ... 49
3.7. Determinação da atividade antioxidante ... 50
3.7.1. Método de captação de radicais livres (DPPH∙) ... 50
3.7.2. Método do poder redutor (FRAP). ... 51
3.8. Análise estatística ... 52
4. Apresentação e discussão de resultados ... 53
4.1. Humidade ... 53
4.2. Otimização de extração de compostos fenólicos... 53
4.2.1. Efeito da temperatura de extração ... 53
4.2.2. Estudo da razão massa:volume de extração ... 56
4.2.3. Efeito do tempo de extração ... 57
4.2.4. Efeito da liofilização ... 61
4.2.5. Efeito do solvente de extração ... 62
4.3. Rendimento da liofilização ... 65
4.4. Teor de flavonóides totais ... 66
4.5. Teor de protoantocianidinas ... 69
4.6. Atividade antioxidante ... 71
4.6.1. Captação de radicais livres (DPPH∙) ... 71
4.6.2. Poder redutor (FRAP)... 77
IX 6. Referências bibliográficas ... 85
X
ÍNDICE DE FIGURAS E QUADROS
Figura 1. Produção mundial de maçã ... 15
Figura 2. Produção mundial total de produtos de maçã. ... 16
Figura 3. Processo de produção industrial do sumo de maçã ... 17
Figura 4. Morfologia e composição do bagaço de maçã) ... 18
Figura 5. Estrutura química do ácido clorogénico (ácido 5-cafeoilquínico) ... 28
Figura 6. Estrutura básica dos flavonóides ... 29
Figura 7. Estrutura geral dos 3-flavanóis ... 30
Figura 8. Estrutura dos 3-flavanóis mais abundantes em alimentos. ... 31
Figura 9. Estrututa da floridzina e floretina. ... 32
Figura 10. Estrutura de flavonóis. ... 33
Figura 11. Teor total de compostos fenólicos de 70 frutos, incluindo várias variedades de maçã. As barras verdes indicam as diferentes variedades de maçã ... 34
Figura 12. Compostos bioativos da maçã... 35
Figura 13. Distribuição de compostos fenólicos na casca, semente e polpa. – Não medido... 37
Figura 14. Capacidade antioxidante de frutos comuns. ... 42
Figura 15. Balança de halogénio usada para determinar a humidade. ... 46
Figura 16. Efeito da temperatura no teor de compostos fenólicos totais mgEAG/g do lote de bagaço de maçã de outubro de 2013, expresso em equivalentes de ácido gálico, na base seca, após extração em meio aquoso, com uma concentração de amostra de 75 mg/mL... 54
Figura 17. Efeito da temperatura no teor de compostos fenólicos totais mg/g do lote de bagaço de maçã de março de 2013, expresso em equivalentes de ácido gálico, na base seca, após extração em meio aquoso, com uma concentração de amostra de 75 mg/mL. ... 55
Figura 18. Teor de compostos fenólicos totais expresso em equivalente de ácido gálico, na base seca, para extrações realizadas a 100 ºC e a 80 ºC a diferentes concentrações no lote de outubro de 2013. ... 56
Figura 19. Comparação do teor de TPC (mgEAG/g, na base seca) obtido para os diferentes tempos de extração à temperatura de 100 ºC, com uma concentração de amostra de 50 mg/mL no lote de outubro de 2013. ... 57
XI
Figura 20. Comparação do teor de TPC (mgEAG/g, na base seca) obtido para os
diferentes tempos de extração à temperatura de 100 ºC e 80 ºC, com uma proporção de amostra de 50 mg/mL no lote de outubro de 2013. ... 58
Figura 21. Teor de compostos fenólicos totais (mgEAG/g, na base seca) obtidos para
1 hora mais 1 hora de extração, 1º e 2º fase, à temperatura de 80 ºC e concentração de amostra de 50 mg/mL no lote de outubro de 2013. ... 59
Figura 22. Comparação do teor de TPC (mgEAG/g, na base seca) obtido para os
diferentes tempos de extração à temperatura de 100 ºC, com uma concentração de amostra de 75 mg/mL no lote de outubro de 2013. ... 60
Figura 23. Teor de compostos fenólicos totais (mgEAG/g, na base seca) em extratos
líquidos e liofilizados, a uma temperatura de 80 ºC e proporção de 50 mg/mL no lote de outubro de 2013. ... 61
Figura 24. Teor de compostos fenólicos totais (mgEAG/g de bagaço, na base seca)
em extratos líquidos e liofilizados, para os diferentes tempos de extração à temperatura de 100 ºC e 80 ºC, e concentração de amostra de 75 mg/mL no lote de outubro de 2013. ... 62
Figura 25. Comparação do teor de TPC (mgEAG/g de bagaço, na base seca) de
extratos aquosos, que foram obtidos a uma temperatura de 80 ºC e 100 ºC durante 1 e 2x4h, com extratos de etanol (50% e 70%) e de metanol obtidos à temperatura ambiente durante 1 hora. Concentração de amostra de 75 mg/mL. ... 63
Figura 26. Teor de flavonóides (mgER/g de bagaço de maçã, na base seca) dos
extratos aquosos e dos de etanol 50% e 70% e de metanol, para os diferentes tempos e temperatura de extração, e concentração de amostra de 75 mg/mL.. ... 66
Figura 27. Comparação do teor de flavonóides (mgER/g de bagaço de maçã, na base
seca) com razões massa:volume 50 e 75 mg/mL a temperaturas de extração de 100 ºC durante 2x4h... 67
Figura 28. Teor de protoantocianidinas (mgEEC/g de bagaço de maçã, na base seca),
em extratos aquosos, de etanol 50% e 70% e de metanol, para os diferentes tempos e temperatura de extração, e concentração de 75 mg/mL.. ... 69
Figura 29. Comparação do teor de protoantocianidinas (mgEEC/g de bagaço de
maçã, na base seca) a diferentes razões m:v (50 e 75 mg/mL), a temperaturas de extração de 100 ºC durante 2x4h. ... 70
XII
Figura 30. Comparação da atividade antioxidante pelo método DPPH∙ de extratos
obtidos às temperaturas de 80 ºC e 100 ºC durante 1h com concentração 75 mg/mL a partir do lote de outubro de 2013 e março de 2013. ... 71
Figura 31. Atividade antioxidante quantificada pelo método DPPH∙ para extratos
obtidos à temperatura de 80 ºC e 100 ºC e diferentes tempos de extração com concentração da amostra de 75 mg/mL a partir do lote de outubro de 2013.. ... 72
Figura 32. Atividade antioxidante quantificada pelo método DPPH∙ na amostra do lote
de outubro de 2013, à temperatura de extração de 100 ºC durante 2x4 horas, com diferentes razões massa:volume (50 e 75 mg/mL). ... 73
Figura 33. Atividade antioxidante quantificada pelo método DPPH∙ em % de inibição
vs concentração de extrato, para as temperaturas de extração de 80 ºC e 100 ºC, a diferentes tempos de extração. ... 74
Figura 34. Correlação entre o teor de compostos fenólicos (TPC) e capacidade
antioxidante pelo método DPPH∙ (IC50 mg/mL), nas amostras extraídas em água,
etanol (70%) e metanol, com diferentes razões m:v (50 e 75 mg/mL). ... 75
Figura 35. Correlação entre o teor de flavonóides totais e capacidade antioxidante
pelo método DPPH∙ (IC50 mg/mL), nas amostras extraídas em água e etanol (50 e
70%), com uma razão de 75 mg/mL. ... 75
Figura 36. Correlação entre o teor de protoantocianidinas e capacidade antioxidante
pelo método DPPH∙ (IC50 mg/mL), nas amostras extraídas em água, etanol (70%) e
metanol, com uma razão de 75 mg/mL. ... 76
Figura 37. Comparação da atividade antioxidante pelo método FRAP, de extratos
obtidos às temperaturas de 80 ºC e 100 ºC durante 1h com concentração 75 mg/mL a partir do lote de outubro e de março de 2013. ... 77
Figura 38. Atividade antioxidante quantificada pelo método FRAP para extratos
obtidos à temperatura de 80 ºC e 100 ºC e diferentes tempos de extração, com concentração da amostra de 75 mg/mL a partir do lote de outubro de 2013.. ... 78
Figura 39. Atividade antioxidante quantificada pelo método FRAP, a temperaturas de
extração de 80 ºC e 100 ºC, a diferentes tempos de extração, em % de inibição vs concentração de extrato. ... 79
Figura 40. Atividade antioxidante quantificada pelo método FRAP para extratos
obtidos à temperatura de 100 ºC e durante 2x4h, com diferentes razões m:v (50 e 75 mg/mL) a partir do lote de outubro de 2013. ... 80
XIII
Figura 41. Correlação entre o teor de compostos fenólicos (TPC) e capacidade
antioxidante pelo método FRAP (IC50 mg/mL), nas amostras extraídas em água, etanol
(70%) e metanol, com diferentes razões m:v (50 e 75 mg/mL). ... 81
Figura 42. Correlação entre o teor de flavonóides totais e capacidade antioxidante
pelo método FRAP (IC50 mg/mL), nas amostras extraídas em água e etanol (50% e
70%), com uma razão de 75 mg/mL. ... 81
Figura 43. Correlação entre o teor de protoantocianidinas e capacidade antioxidante
pelo método FRAP (IC50 mg/mL), nas amostras extraídas em água, etanol (70%) e
metanol, com uma razão de 75 mg/mL. ... 82
Quadro 1. Composição da maçã e do bagaço de maçã.. ... 25 Quadro 2. Algumas das classes maioritárias de compostos fenólicos encontrados nas
plantas. ... 27
Quadro 3. Compostos fenólicos identificados no bagaço de maçã ... 39 Quadro 4. Valores da literatura do teor de compostos fenólicos totais no bagaço de
maçã de acordo com determinadas condições de temperatura, tempo de extração e tipo de solvente. ... 40
Quadro 5. Identificação das amostras analisadas no presente trabalho. ... 45 Quadro 6. Valores de humidade dos dois lotes de bagaço utilizados neste estudo. Os
valores são expressos como média ± desvio padrão. ... 53
Quadro 7. Efeito da temperatura no teor de compostos fenólicos totais mg/g dos lotes
de bagaço de maçã de março e outubro de 2013, expresso em equivalentes de ácido gálico, na base seca, após extração em meio aquoso. ... 55
Quadro 8. Rendimento dos extratos liofilizados obtidos a partir do bagaço de maçã
do lote de outubro de 2013 e teor de compostos fenólicos expresso em mgEAG/g de extrato. ... 65
14
1. INTRODUÇÃO
Na indústria de sumo de maçã produz-se uma elevada quantidade de resíduos, originando dois subprodutos, o bagaço de maçã (resíduo sólido) e o retentato (resíduo líquido). O processamento do sumo de maçã utiliza aproximadamente 70 - 75% da massa fresca do fruto, enquanto 25% é o bagaço de maçã que consiste em cascas, sementes, polpa e pedúnculos.
O bagaço de maçã é considerado uma fonte em nutrientes, como hidratos de carbono, proteínas, minerais e compostos fenólicos, possibilitando a produção de produtos de valor acrescentado (Mahawara et al., 2012).
Encontrar um modo de aproveitar subprodutos é cada vez mais uma necessidade, pois torna-se algo de extrema importância atualmente, originando uma mais-valia financeira para o fabricante de sumo e um benefício para o meio ambiente. É necessário um estudo aprofundado da composição de cada subproduto, para assim se poder avaliar o potencial para uso futuro. Os resíduos da indústria agroalimentar representam assim uma necessidade e um desafio para a indústria, que procura maneiras de tornar estes subprodutos viáveis financeiramente, através da reciclagem ou conversão em produtos úteis de valor acrescentado de modo a melhorar a rentabilidade e reduzir os custos sem comprometer o meio ambiente (Domingez-Perles et al., 2010).
O presente trabalho tem como objetivo valorizar o bagaço de maçã no que diz respeito aos seus compostos bioactivos, avaliando-o ao nível do seu conteúdo em compostos fenólicos totais, flavonóides, protoantocianidinas e capacidade antioxidante. Através destas determinações pretendeu-se demonstrar que o bagaço pode ser uma boa fonte destes compostos, abrindo caminho para um melhor aproveitamento dos mesmos. Deve salientar-se que os compostos fenólicos presentes no bagaço de maçã são principalmente ácidos fenólicos e flavonóides, onde se incluem os 3-flavanóis, os flavonóis, as dihidrocalconas. No que concerne à saúde humana, alguns dos compostos que constituem os flavonóides são responsáveis pela diminuição do risco de várias doenças associadas ao stress oxidativo, sendo compostos com atividade antioxidante (Nogueira et al., 2003).
15
2. REVISÃO BIBLIOGRÁFICA
2.1. Processamento da maçã e subproduto
A maçã é um dos frutos melhor distribuído em todo o mundo. A macieira que foi cultivada e valorizada pelos seus frutos pelo povo da Roma antiga, é hoje em dia cultivada maioritariamente no hemisfério norte. Cerca de 95% das maçãs são cultivadas entre os 35 N e 50 N latitudes e entre o 30 S e 45 S latitudes (Root & Barrett, 2004).
Mundialmente a maçã constitui uma parte importante na produção de sumo, existindo atualmente uma tendência crescente na sua produção e consumo. No ano de 2012, a produção de maçã foi de aproximadamente 37 milhões de toneladas, com a China e os Estados Unidos da América na liderança, sendo estes os principais produtores no mundo, com aproximadamente 56% e 6% da produção (Figura 1), respetivamente (FAOSTAT, dados de 2012).
Figura 1. Produção mundial de maçã (Adaptado de FAOSTAT, dados de 2012).
Em Portugal, em 2010, segundo o Observatório dos Mercados Agrícolas e das Importações Agroalimentares, a produção de maçã foi aproximadamente de 220 mil toneladas. Os pomares de maçã encontram-se distribuídos por todo o território continental, sendo o Ribatejo e o Oeste as regiões mais importantes, com 40% da produção total. A região de Trás-os-Montes contribui com 30% da produção total, a Beira Litoral com 13% e a Beira Interior com 12%.
56% 6% 5% 4% 3% 3% 23% China
Estados Unidos da América Turquia
Polonia India Italia
16 Das variedades com maior expressão de cultivo em Portugal destacam-se: a Golden Delicious, a Gala (Royal Gala), a Red Delicious ou Starking, as Jonagold e Jonagored, a Reineta (Parda e Branca) e a Bravo de Esmolfe. Com menor expressão surgem a Riscadinha de Palmela, a Casa Nova, a Granny Smith e a Pink Lady (MA, 2007).
Normalmente maçãs que não são adequadas para o consumo natural por terem algum tipo de defeito ou por serem de baixa qualidade, são processadas em outros produtos. Do total da produção mundial, cerca de 70% é comercializado como maçã em fresco, enquanto 25% a 30% é normalmente transformado em sumo, cidra e produtos congelados e secados (Figura 2) (Bhushan et al., 2008).
O sumo concentrado de maçã constitui aproximadamente 64% do total de todos os produtos da maçã processados e é por isso o principal produto produzido em todo o mundo a partir de variedades de fruto cuja qualidade não é de alguma forma adequada para o mercado de produtos frescos (Bhushan et al., 2008). Dados bibliográficos indicam que a produção global de sumo de maçã foi de aproximadamente 1,54 milhões de toneladas no ano de 2012, sendo a China, Europa e América os principais produtores, com aproximadamente 49%, 32% e 12% da produção, respetivamente (Charkow, 2012).
Figura 2. Produção mundial total de produtos de maçã (adaptado de Bhushan et al., 2008). 70% Mercado de maçã não processada 30% Produto processado
Produção mundial total de maçã (45 milhões de toneladas) 35% vinho de maçã, sidra, purê de maçã, doces etc 65% Sumo de maçã concentrado
17 A Figura 3 representa um esquema do processo de produção industrial do sumo de maçã. Deve notar-se que neste processo há uma recuperação total de sumo de aproximadamente 70 - 75%, com a produção simultânea de dois subprodutos, o bagaço de maçã (25 a 30%) e o retentato i.e., o resíduo líquido obtido após clarificação e sedimentação com bentonite (5 a 11%) (Bhushan et al., 2008).
Produtos de maçã Escolha e Lavagem Extração do Sumo Sumo bruto Clarificação 1 Clarificação 2 Filtração e Concentração Sumo de maçã Concentrado Ramos, maçãs estragadas Prensagem Bagaço de maçã Tratamento Enzimático Tratamento com Bentonite Sumo Clarificado Retentato Sumo de maçã e Bentonite
Figura 3. Processo de produção industrial do sumo de maçã (adaptado de Bhushan et al., 2008).
O bagaço é o resíduo da maçã que permanece após o processo de extração do seu sumo - que envolve etapas como o esmagamento e prensagem - e que
18 consiste numa mistura heterogénea de cascas, sementes, polpa e pedúnculos (Figura 4) (Kołodziejczyk et al., 2007).
Figura 4. Morfologia e composição do bagaço de maçã (Kołodziejczyk et al., 2007).
Por sua vez, o retentato contém sumo de maçã (5-6 ◦Brix de teor de sólidos solúveis) e partículas de bentonite (adicionado durante a clarificação do sumo). Este processo pode originar uma perda direta de sumo na ordem dos 10%, que pode ser facilmente recuperado adotando diferentes técnicas de processamento (Bhushan et al., 2008).
A produção de bagaço de maçã tem vindo a aumentar durante as últimas décadas, principalmente devido ao aumento da quantidade de fruto que tem vindo a ser utilizada na indústria de sumo e concentrados. Consequentemente existe uma preocupação crescente nos potenciais problemas ambientais associados à produção deste subproduto, o que leva à necessidade do seu tratamento (Allobergenova, 2006). De fato, os elevados teores de humidade (66,4 - 78,2%) e de matéria orgânica biodegradável do bagaço de maçã fazem com que este subproduto seja volumoso e facilmente suscetível à fermentação, causando vários entraves à sua remoção. Enormes quantidades de bagaço de maçã são depositados a céu aberto, violando as normas de controlo de poluição e, em simultâneo, acarretando potenciais riscos para a saúde pública (Allobergenova, 2006).
Dado que o bagaço de maçã possui um grande volume, o seu transporte implica também um elevado custo. Desta forma, métodos como a secagem ao sol têm vindo a ser utilizados para reduzir o seu volume e assim facilitar a sua remoção. Este processo torna o bagaço de maçã mais escuro (escurecimento enzimático ou
19 oxidativo) e inapto para melhoramento do seu valor nutritivo, especialmente para fortificação alimentar. Além de secagem ao sol, foram já descritos vários outros métodos para reduzir o volume do bagaço de maçã e preservá-lo para posterior utilização (Fenton & Kennedy, 1998; Constenla et al., 2002; Sun et al., 2007), nomeadamente:
A secagem ao ar tem sido utilizada durante muitos anos para a preservação de alimentos através da exposição do alimento a um fluxo contínuo de ar quente, de modo a evaporar a água. No final, este processo origina produtos desidratados com maior tempo de conservação, contudo, a qualidade dos mesmos é geralmente bastante inferior à do produto original (Ratti, 2001).
A liofilização, um processo desenvolvido na segunda metade do século XX, minimiza os danos durante a secagem de produtos biológicos, é um bom método de desidratação para alimentos, produtos farmacêuticos e outros produtos (Reyes et al., 2010).
A secagem por pulverização é um processo contínuo onde um líquido ou pasta é transformado num produto seco, através da atomização do líquido num compartimento onde recebe um fluxo e ar quente.
A secagem a vácuo é um método de secagem semi-contínuo para a desidratação do fruto. Tem sido aplicada na produção de sumos de frutos (Maltini et al., 1992).
A secagem em leito fluidizado baseia-se num sistema contínuo de secagem, onde o material a ser desidratado é colocado numa passadeira perfurada, onde recebe ar quente da parte inferior, adquirindo uma movimentação similar a um líquido, daí o nome fluidizado (Cil & Topuz, 2010).
A maioria das utilizações do bagaço de maçã requer que se faça uma operação de desidratação como pré-tratamento. Naturalmente, a seleção de um determinado método para secagem do bagaço de maçã depende do seu custo de energia, perfil nutricional e objetivo pretendido (Yan, 2012).
20
2.2. VALORIZAÇÃO DO BAGAÇO DE MAÇÃ
Embora a indústria alimentar produza um enorme volume de subprodutos
sólidos ou líquidos, que derivam da produção, preparação e do consumo de alimentos, em muitos casos os resíduos de processamento de alimentos podem ter potencial para serem reciclados ou para a conversão em produtos úteis de valor acrescentado. Exemplos de reciclagem e transformação de resíduos orgânicos são produtos como os biocombustíveis, ingrediente funcional, nutrientes, aromatizantes naturais, forragem, alimentação e bioadsorventes para o tratamento de águas residuais (Hendriks & Zeeman, 2009; Laufenberg et al., 2003; Rashad & Nooman, 2009).
Existem várias formas de tratar os subprodutos húmidos que provêm das indústrias que produzem sumo de maçã. Nesta secção são descritas algumas das formas de tratar o bagaço de maçã.
2.2.1. BIOTRANSFORMAÇÃO
Inúmeras transformações microbiológicas têm sido propostas ao bagaço de maçã para adição de valor nutricional a produtos alimentares. Estas aplicações têm vindo a ser usadas em produtos de panificação, sopas, geleias, molhos, caramelos, agente de volume, alimento para animais, fermentação do bagaço de maçã para produção de energia e como substrato de biogás. Muitos estudos têm sido realizados com o objectivo de acrescentar valor aos constituintes moleculares do bagaço de maçã, tais como enzimas, proteínas, compostos de aroma, etanol, ácidos orgânicos, polissacarídeos, com o objetido por exemplo do enriquecimento de proteína na alimentação e oligossacarídeos pré-bióticos (Joshi & Sandhu, 2000). O bagaço de maçã é também uma fonte de carbono para microrganismos para a produção de ácidos orgânicos, tais como o ácido cítrico (Dhillon et al., 2011, Gullón et al., 2008), fungos comestíveis (Zheng & Shetty, 1998) e quitosana (Streit, 2004). Na maioria dos casos a fonte de carbono é oriunda do próprio substrato envolvendo processos de fermentação em estado solido (Zheng & Shetty, 1998).
2.2.2. ALIMENTAÇÃO ANIMAL
A recuperação de resíduos alimentares como alimentos para animais não é nova. O bagaço de maçã tem sido tradicionalmente utilizado como alimento para o gado, quer na sua forma húmida, quer na forma secada (Hang & Walters, 1989).
21 Em muitos países os agricultores têm utilizado resíduos alimentares para alimentar desde gado para carne, gado leiteiro e suíno. Antes de aplicar o bagaço na alimentação animal, estes têm que ser cuidadosamente analisados quanto ao seu teor de nutrientes e valor energético. Deve ser realizada uma boa análise dos bagaços, a fim de usá-los de forma eficiente no processo de alimentação animal (Mannapperuma, 2004).
Normalmente o resíduo obtido pelas indústrias de concentrado de sumo de fruto é rico em fibra, na qual se inclui a celulose, hemicelulose e lignina com um pobre teor de proteína. Atributos como o baixo teor de proteína e a baixa digestibilidade que o alto teor de fibra proporciona, tornam a maior parte dos subprodutos pobres para alimentação animal (Allobergenova, 2006). Contudo, com a ajuda da fermentação em estado sólido através de leveduras Candida utilis e Aspergillus niger, descobriu-se ser possível aumentar o teor de proteína com alguma degradação das fibras, tornando assim o bagaço de maçã mais adequado para alimentação animal (Verma & Joshi, 2000).
Os resultados de vários estudos efetuados no âmbito da alimentação animal (Tiwari et al., 2008), mostraram que não houve nenhum efeito significativo na produção de leite dos animais alimentados com ou sem bagaço de maçã húmido com cerca de 80% de humidade. Ambos os grupos analisados alcançaram maior rendimento no mesmo período de lactação (61 - 90 dias). Não houve alteração significativa na percentragem de gordura do leite nem no teor de proteína. No entanto, o nível de extrato seco desengordurado (ESD) foi comparativamente maior no grupo alimentado com bagaço de maçã. Como conclusão, este estudo permitiu sugerir que o bagaço de maçã pode substituir o milho na ração leiteira até ao limite de 33%, sem prejudicar os animais.
2.2.3. PRODUÇÃO DE ETANOL
O etanol é um dos mais importantes combustíveis renováveis, contribuindo para a redução dos impactos ambientais gerados pela utilização de combustíveis fósseis em todo o mundo (Mamma et al., 2009).
Numa escala industrial, a primeira geração de bioetanol foi produzida principalmente a partir de amido de milho e de cana-de-açúcar. No entanto, alguns
22 problemas a nível da segurança alimentar, levaram os pesquisadores a procurar uma matéria-prima que fosse mais competitiva e mais barata (Parmar, 2011).
A produção de etanol a partir de bagaço de maçã é uma opção muito atraente por este possuir inúmeras vantagens, entre as quais o seu elevado teor de polissacarídeos, o seu baixo custo e de não depender das condições climatéricas do exterior durante o processo de fermentação por se realizar em laboratório. Isso pode proporcionar um fornecimento de energia alternativo e ao mesmo tempo reduzir os problemas que a eliminação deste bagaço origina. Além disso, a bioconversão em bioetanol parece ser uma opção atraente para reduzir as emissões de gases que contribuem para o efeito de estufa produzidos pela utilização de combustíveis fósseis no sector dos transportes em todo o mundo (Parmar, 2011).
Várias investigações concluíram que há possibilidade de usar a fermentação em estado sólido, usando o bagaço como substrato único ou com a adição de melaço, para a produção de etanol e para enriquecer nutricionalmente outros produtos alimentares(Ngadi & Correia, 1992; Kanwa et al., 2012).
2.2.4. EXTRAÇÃO DA PECTINA
A produção de pectina é considerada a forma mais razoável de aproveitar o bagaço de maçã, quer do ponto de vista económico quer ecológico. Em comparação com a pectina de citrino, a pectina de maçã tem propriedades de gelificação de qualidade superior (Monspart-Senyi, 2006).
A pectina é um polissacarídeo estrutural formado por um grupo complexo de polissacarídeos que são encontrados na parede celular primária e nas camadas intercelulares de plantas terrestres (Monspart-Senyi, 2006). É um dos estabilizantes mais versáteis disponível no mercado. É gelificante, espessante, e as propriedades de estabilização tornam-no num aditivo essencial na produção de muitos produtos alimentares (Coelho, 2008).
Ihl et al., (1992), estudaram a recuperação da pectina a partir do bagaço de maçã, e o precipitado da pectina a partir do extrato em bruto com etanol ou com 2 - 4% (m/v) de cloreto de alumínio (AlCl3). O resultado final mostrou um rendimento
de pectina de 7,2% com etanol e de 1 a 4% com AlCl3. O grau de esterificação foi mais
elevado para as pectinas extraídas com AlCl3 a 4% (m/v). Os autores concluíram ainda
23 gelificação e uma quantidade residual de alumínio. No global, a extração de pectina com etanol é a mais recomendada, muito por causa do elevado rendimento e das propriedades aceitáveis da pectina.
Os subprodutos da indústria agroalimentar representam assim um desafio para a indústria, que procura maneiras de tornar o bagaço de maçã viável financeiramente sem comprometer o meio ambiente. Dado que se produz uma grande quantidade de bagaço de maçã, a preparação de um único produto derivado desse resíduo não seria economicamente viável, pelo que se deve explorar a produção de produtos alternativos diferenciados (Mahawara et al., 2012).
2.2.4.1. PRODUÇÃO DE GELEIA
Outra forma de valorização deste bagaço é usando-o como potencial ingrediente alimentar para produção de geleia (Barwal & Kalia, 1997).
Como o bagaço é rico em pectinas, com conteúdos médios entre 10 e 15% em base seca (Endreß, 2000), é possível obter geleias sem a incorporação de aditivos. A formação de geleia implica um controlo do tempo de cozedura e da temperatura, com uma concentração de açúcar suficiente para que a gelificação possa ocorrer sem comprometer o sabor, a cor e a textura da geleia.
Royer et al., (2006), através de avaliações sensoriais realizadas por um painel de 70 participantes, mostrou a possibilidade de obter geleia preparada com o bagaço, variando as concentrações de marmelo e de açúcar. Os consumidores apreciaram a geleia preparada com o bagaço com maior concentração de marmelo, devido a ser um sabor mais apreciado. Nesse estudo mostrou-se que era possível aproveitar o bagaço de maçã utilizando-o como um ingrediente alimentar para a produção de geleia (Royer et al., 2006).
24
2.3. VALOR NUTRICIONAL E COMPOSTOS BIOATIVOS DO BAGAÇO DE MAÇÃ
Tal como o fruto não processado, o bagaço de maçã contém quantidades significativas de fitoquímicos, como hidratos de carbono, proteínas, vitaminas e minerais (Bhushan et al., 2008). A sua composição varia consoante a variedade de maçã utilizada e o tipo de processamento aplicado na extração do sumo, especialmente em relação ao número de vezes que o fruto é prensado (Vendruscolo et al., 2008).
O perfil nutricional geral do bagaço de maçã está descrito no Quadro 1. Tipicamente, este possui entre 66 a 78% de humidade, 48 a 62% de hidratos de carbono expresso em base seca (ms), 4 a 6% (ms) de proteínas, e 11 a 15% (ms) de açúcares livres totais (Dhillona et al., 2012; Mahawara et al., 2012). Em termos de fibra dietética, o bagaço contém um valor elevado de fibra total, tipicamente entre 61 e 89% (ms), na qual a maior parte é fibra dietética insolúvel (Figuerola et al., 2005). Os principais constituintes de fibra dietética do bagaço são celulose (7 - 43%), lenhina (15 - 24%), hemicelulose (4 - 24%), pectinas (6 - 12%) e gomas. Estas fibras podem ser usadas, por exemplo para enriquecer produtos de padaria, através da adição de bagaço em pó juntamente com farinha de trigo (Chen et al., 1988; Gallaher & Schneeman, 2001; Villas-Boas et al., 2003; Sudha et al., 2007).
Componentes como a celulose, hemicelulose e a pectina não são digeridos por enzimas presentes no organismo humano, e são classificadas como sendo fibras dietéticas (Kaushal et al., 2002; Bhushan et al., 2008). No entanto, o dogma central é ainda a viabilidade, estabilidade, segurança e economia do(s) processo(s) desenvolvido(s) para extração destes compostos (Bhushan et al., 2008).
25
Quadro 1. Composição da maçã e do bagaço de maçã. (Fontes: Sinha, 2006; Linskens & Jackson,
1999; Mahawara et al., 2012; Dhillona et al., 2012; Figuerola et al., 2005; Baskaran et al., 2007; Joshi & Attri, 2006). ms, expresso em base seca.
Constituintes Bagaço (%) ms (1) Maçã (%) ms
Humidade 66,4 - 78,2 85,6
Hidratos de carbono 48,0 - 62,0 72,2
Proteína 3,9 - 5,7 2,1
Acidez (% acido málico) 2,5 - 3,3 3,5
Cinzas 2,1 - 3,5 1,4
Açúcares livres totais 10,8 - 15,0 72,2
Fibra dietética solúvel 4,1 - 14,6 Fibra dietética insolúvel 56,5 - 81,6
Fibra dietética total 60,7 - 89,8 16,7
Gordura 3,0 - 4,7 1,4 Minerais (% ms) Fosforo 0,1 11,0 Potássio 0,4 - 1,0 107,0 Cálcio 0,1 6,0 Magnésio 0,0 - 0,4 5,0 Sódio 0,2 1,0 Cobre (mg/kg) 1,1 Zinco (mg/kg) 15,0 0,0 Ferro (mg/kg) 31,8 - 38,3
(1) A variabilidade dos resultados deve-se a diferentes métodos de análise
26
2.4. COMPOSTOS FENÓLICOS
Nas últimas décadas, a atenção dos mercados para novos produtos capazes de diminuir o risco de doenças tem impulsionado a pesquisa científica para a identificação e a caracterização das propriedades antioxidantes de moléculas em produtos alimentares e seus derivados. O desenvolvimento de alimentos funcionais com propriedades benéficas para a saúde é atualmente um dos principais objetivos da investigação em alimentos (Francini & Sebastiani, 2013).
Todas as plantas, incluindo os frutos, partes da planta e especiarias sintetizam um vasto número de compostos que não estão diretamente envolvidos no metabolismo da planta, mas que têm funções associadas à sobrevivência da mesma (Joseph et al., 2009). Normalmente, de acordo com características da espécie, estes compostos estão presentes nos órgãos da planta (p.e. raízes, caules, folhas, flores, frutos) e são geralmente mais abundantes no tecido epidérmico dos órgãos, como na casca do fruto (Winkel-Shirley, 2002; Lattanzio et al., 2006).
De entre os vários constituintes dos alimentos, os compostos fenólicos são uma das classes mais vulgarmente associadas a propriedades benéficas para a saúde. Na realidade, o papel geral de compostos fenólicos em fisiologia vegetal e alelopatia tem sido reconhecido há muito tempo e continua ativamente a ser estudado por cientistas. Mas mais recentemente, estes compostos foram redescobertos por nutricionistas como moléculas benéficas e potencialmente interessantes na produção de alimentos funcionais, i.e., alimentos que têm um efeito potencialmente positivo sobre a saúde além da nutrição básica.
Os efeitos positivos dos compostos fenólicos sobre a saúde humana foram propostos pela primeira vez em 1936 por Bensath, (1936). Atualmente este fato pode ser comprovado pelo aumento notável no número de publicações científicas onde o termo "polifenóis" aparece.
Os compostos fenólicos estão presentes em vários alimentos, principalmente nos frutos e hortícolas, chá verde e chá preto, café e vinho. Mais de 30% dos compostos fenólicos da alimentação são obtidos através de sumos de frutos, daí que seja importante conhecer o teor de fenólicos totais destes alimentos (Escarpa & Gonzalez, 2001).
Em termos químicos, os compostos fenólicos são caracterizados pela presença de várias unidades de fenol (Quideau et al., 2011). São normalmente
27 também designados por polifenóis e apresentam uma grande diversidade estrutural, sendo considerados compostos multifuncionais (Balasundram et al., 2006).
Numa definição mais restrita, o nome "polifenol" deve ser utilizado para identificar os metabolitos secundários derivados de plantas exclusivamente a partir do derivado de chiquimato fenilpropanóide e/ou da via (s) de policetídeo, apresentando mais do que um anel fenólico e sendo desprovido de qualquer grupo funcional à base de azoto na sua expressão estrutural mais básica (Quideau et al., 2011). Os compostos fenólicos são classificados de acordo com o número de átomos de carbono do seu esqueleto básico (Quadro 2) e são divididos em compostos não flavonóides e compostos flavonóides (Cam & Aaby, 2010; Suárez et al., 2010).
Quadro 2. Algumas das classes maioritárias de compostos fenólicos
encontrados nas plantas. Adaptado de Mann et al., (1998).
N.º átomos Esqueleto básico Classe
6 C6 Fenóis Simples 7 C6-C1 Ácidos fenólicos 8 C6-C2 Ácidos fenilacéticos 9 C6-C3 Ácidos hidroxicinâmicos Fenilpropenos Cumarinas Isocumarinas Cromonas 14 C6-C2-C6 Estilbenos Antraquinonas 15 C6-C3-C6 Flavonóides Isoflavonóides 18 (C6-C3)2 Linhanos 30 (C6-C3-C6)2 Biflavonóides n (C6-C3)n (C6-C3-C6)n Linhinas Taninos condensados
28
2.4.1. ÁCIDOS FENÓLICOS
Os ácidos fenólicos são o segundo grupo mais importante de fitoquímicos na maçã (Haminiuk et al., 2012) e podem ser classificados em duas classes: os derivados do ácido hidroxibenzóico, que possuem sete átomos de carbono e os derivados do ácido hidroxicinâmico, com nove átomos de carbono estando presentes em quantidades significativas em maçãs, sendo os mais comuns os ácidos p-cumárico e o ácido cafeico. Esses dois compostos, geralmente, estão na forma esterificada com o ácido quínico, formando os ácidos p-coumaroilquínico e o ácido 5-cafeoilquínico, respectivamente (Nogueira et al., 2003; Soares, 2002).
Os ácidos hidroxicinâmicos (HCAs) são importantes substratos para a polifenoloxidase. Seus produtos de condensação e oxidação não somente contribuem para a formação de pigmentos de cor castanha (melanoidinas) em maçãs, mas também aumentam a oxidação de outros compostos fenólicos, como os 3-flavanóis, por mecanismo acoplado (Alberti, 2014).
O ácido 5-cafeoilquínico, conhecido como ácido clorogénico, é o ácido hidroxicinâmico mais abundante encontrado na maçã representado na Figura 5 (Guyot et al., 1998).
29
2.4.2. FLAVONÓIDES
Os flavonóides são os responsáveis pelo aspeto colorido das folhas e flores, podendo estar presentes em outras partes das plantas. Segundo Beecher, (2003) já foram identificados mais de 8000 componentes da família dos flavonóides. Estes compostos estão mesmo entre as moléculas com maior atividade antioxidante (Robards et al., 1999) e são constituídos por um alargado número de famílias de compostos.
Quimicamente, os flavonóides são polifenois de baixa massa molecular formados por 15 carbonos, que consistem em dois anéis arilo (A e B) ligados por um anel heterocíclico pirano (C) e que formam um heterociclo oxigenado (Figura 6). Conforme o estado de oxidação da cadeia heterocíclica do pirano e o padrão de substituição do anel-C, existem diferentes subclasses de flavonóides: 3-flavanóis, antocianinas, flavonóis, flavonas, isoflavonas e flavanonas (Volp et al., 2008).
Figura 6. Estrutura básica dos flavonóides (Volp et al., 2008).
Na estrutura da molécula, a posição do grupo OH é crucial para as propriedades antioxidantes dos flavonóides. Para além da capacidade de ceder átomos de hidrogénio (H) ou eletrões aos radicais livres, os flavonóides poderão exercer os seus efeitos através de mecanismos como a modulação das vias de sinalização celular, interações com a mitocôndria e alterações na expressão genética (Hernandez-Montes et al., 2006).
Pesquisas mostram benefícios para a saúde aquando do consumo de alimentos ricos em flavonóides, referindo melhorias na função cognitiva e atividade antidepressiva (Samman et al., 2003).
Para além das suas propriedades biológicas, os flavonóides também são de importante interesse na alimentação, cosmética, e na indústria farmacêutica, devido
30 ao fato de poderem ser usados como substitutos de antioxidantes sintéticos (Bektic et al., 2005).
2.4.2.1. 3-FLAVANÓIS
Os 3-flavanóis são compostos que apresentam um grupo hidroxilo no carbono 3 do anel C (Figura 7), e ao contrário dos outros flavonóides, geralmente são encontrados na forma aglicona (Shahidi & Naczk, 2004; Awad et al., 2001). Esta classe compreende as catequinas, epicatequinas e proantocianidinas.
As proantocianidinas são polímeros constituídos por duas ou mais unidades de 3-flavanóis sendo as catequinas e galocatequinas as unidades mais simples. Estes compostos existem na natureza hidroxilados nas posições 5 e 7 do anel A e variam na estereoquímica do carbono 3 do anel C e no grau de hidroxilação do anel B (Oldini, 2010).
Figura 7. Estrutura geral dos 3-flavanóis (Oldini, 2010).
As estruturas poliméricas de 3-flavanóis nas proantocianidinas, dividem-se em dois grupos: as proantocianidinas derivadas de catequina e epicatequina e as prodelfinidinas, derivadas de galocatequina e epigalocatequina (Figura 8). Os nomes proantocianidinas e prodelfinidinas resultam do fato destes compostos por hidrólise ácida originarem respetivamente a cianidina e a delfinidina (Alberti, 2014).
31
Figura 8. Estrutura dos 3-flavanóis mais abundantes em alimentos. Adaptado de Gonçalves, (2007).
As proantocianidinas foram inicialmente encontradas em amêndoas de cacau, nas quais após aquecimento sobre condições ácidas, hidrolisam-se em cianidina e (-)-epicatequina. Estes compostos são conhecidos por se degradarem ao ar ou sob a luz, formando derivados estáveis de cor castanha. Contribuem significativamente para a adstringência de alguns alimentos e também para a cor do sumo de maçã e outros sumos de frutos (Damodaran et al., 2010).
No caso das maçãs elas são uma fonte típica de proantocianidinas poliméricas de 3-flavanóis resultante de uma associação de catequinas. Afirma-se que a variedade de maçã Golden Delicious tem como compostos mais abundantes a epicatequina, proantocianidina B e floridzina (Chinnici et al., 2004).
Nas maçãs, a proantocianidina também está envolvida no escurecimento enzimático e, particularmente, o seu grau de polimerização é responsável pela adstringência e amargura de sumos de maçã e cidra (Khanizadeh et al., 2006). Além disso, o grau de escurecimento das maçãs depende da relação de ácidos hidroxicinâmicos e proantocianidinas (Alberti, 2014).
32
2.4.2.2. DIHIDROCALCONAS
As dihidrocalconas floridzina (floretina 2'-βD-glucósido) e floretina (Figura 9) também estão distribuídas em todo o fruto e correspondem a cerca de 66% do total de compostos fenólicos nas sementes de maçãs, enquanto que no parênquima e epiderme compreendem menos de 3% dos compostos fenólicos (Guyot et al., 1998). A floridzina sempre foi conhecida como composto encontrado exclusivamente em maçãs, sendo sugerida sua utilização como indicativo de adulteração (Hilt et al., 2003).
Figura 9. Estrututa da floridzina e floretina. Adaptado de Tokusoglu, (2011).
Estes compostos contribuem para a coloração da maçã, porém a sua oxidação resulta em cor amarela o que sugere que estes compostos não são bons substratos do enzima polifenoloxidase (Sanoner, 1999).
2.4.2.3. ANTOCIANINAS
Antocianinas compreendem um grupo de pigmentos solúveis responsáveis pela maioria das cores vermelha, azul e roxa dos frutos, vegetais e flores (Taleoka & Dao, 2002). Apresentam como estrutura básica o cátião flavílico (2-fenilbenzopirilium), sendo classificadas de acordo com o número e posição de seus grupos hidroxilo, pelo grau de metoxilação destes grupos e pela natureza e número de moléculas de açúcares. As antocianinas ocorrem como mono ou diglicosídeos de pelargonidina, cianidina, peonidina, delfinidina, petunidina e malvidina (Shahidi & Naczk, 2004; Taleoka & Dao, 2002).
33 Há presença de muitas antocianinas em maçãs como a cianidina-3-galactosídeo, cianidina-3-rutinosídeo, malvidina-3-glicosídeo e malvidina-3,5-diglicosídeo, ocorrendo predominância da cianidina-3-galactosídeo na casca e em sumo de maçã (Alonso-Salces et al., 2001). Os açúcares mais comuns são glucose, xilose, ramnose e arabinose. A glicosilação confere aumento na estabilidade e solubilidade em água das antocianinas, comparado com as antocianidinas (Shi et al., 2002).
2.4.2.4. FLAVONÓIS
Os flavonóis são considerados a menor classe de compostos fenólicos presente em maçãs, sendo encontrados principalmente na epiderme dos frutos (Guyot et al., 1998; Van Der Sluis et al., 2001). Estão envolvidos na regulação da textura de maçãs, agindo como inibidores da β-galactosidase (Shahidi & Naczk, 2004). São caracterizados por uma dupla ligação entre o carbono 2 e 3, um grupo hidroxilo na posição-3 e um grupo carbonilo na posição-4 do anel- C do núcleo flavan (Figura 10) (Shi et al., 2002; Van Der Sluis et al., 2001).
Figura 10. Estrutura de flavonóis. Fonte: Shi et al., (2002).
Muitos glicosídeos de quercetina são identificados em maçãs. Zardo et al., (2013) encontraram nas variedasdes Gala, Fuji e Joaquina, teores de 0,49, 0,42 e 0,41 mg/g, respectivamente, sendo que o glicosídeo hiperosídeo apresentou a maior concentração nas três amostras analisadas. Segundo Golding et al., (2001) e Guyot et al., (1998) os compostos como rutina, hiperosídeos (quercetina-3- -D-galactosídeo), isoquercitina (quercitina-3--D- glicosídeo), reinoutina (quercetina-3- -D-xilosídeo), avicularina (quercetina-3--L-arabinofuranosídeo) e quercitrina (quercetina-3--L-ramnosídeo) são encontrados em maçãs de forma frequente.
34
2.4.3. COMPOSTOS FENÓLICOS DA MAÇÃ
Tal como referido anteriormente, as maçãs são uma excelente fonte de compostos fenólicos e possuem uma capacidade antioxidante elevada.
Usando o método de Folin-Ciocalteu, compilou-se o conteúdo de fenólicos totais de 70 frutos, entre eles 12 variedades de maçã. Os resultados mostram valores de compostos fenólicos variáveis entre 11,88 mgEAG na pêra a 585,52 mgEAG/100 g em massa húmida na jujuba. Neste estudo, representado na Figura 11, as variedades de maçã Green Delicious, Red Delicious e Rosa Vermelho apresentaram valores intermédios de 68,29, 73,96 e 70,57 mgEAG/100 g de massa húmida, respetivamente. Outras variedades de maçã demostraram ainda possuir conteúdos de fenóis totais superiores. Em particular, o valor mais elevado (221 mg EAG/100 g na base húmida) foi obtido para a maçã Panaia-vermelho (Fu et al., 2011; Iacopini et al., 2010; Minnocci et al., 2010).
Figura 11. Teor total de compostos fenólicos de 70 frutos, incluindo várias variedades de maçã. As
barras verdes indicam as diferentes variedades de maçã (Fontes: Fu et al., 2011; Iacopini et al., 2010; Minnocci et al., 2010).
Estudos realizados por Vrhovsek et al., (2004) mostraram que o nível médio de polifenóis totais em maçãs (entre as quais oito das variedades das maçãs mais
0 100 200 300 400 500 600 P ê ra ( m e l) M e la n ci a ( p o lp a a m a re la ) P ê ra ( p e rf u m a d o ) U va ( E U A ) M e lã o ( p o lp a b ra n ca ) A ze it o n a A bac at e M e la n ci a ( Ji n to n g ) U va ( v e rd e ) B a n a n a ( ro y a l) B a n a n a M a n g o ( H a in a n ) C ar am b ol a M a n g o ( S h u ix ia n ) M ir ti lo Lar anj a u m b igo ( C hi na ) C it rus (ve rde) P o m e lo M a çã ( o rg â n ica ) M a çã ( V e rd e D e lic io u s) C it ru s (T a ilâ n d ia ) M a çã D ia cci a ta ' M a çã ( ro sa ve rm e lh a ) A m e ixe ir a ( v e rm e lh a ) T o m a te c e re ja M a çã ( V e rm e lh a D e lici o u s) P ê ss e g o l iso L a ra n ja ( Á fr ica d o S u l) U va (v er m el ho) K iw is A m e ixe ir a ( p re ta ) A b a c a xi M a çã S ta rk D e lic io u s A m e ixe ir a ( s a n h u a ) M a çã G o ld e n D e lici o u s C a q u i C er ej a s W a m p e e ch in ê s M a çã N e st a M a çã L im o n ce lla ' R o m ã M a çã M o ra G o ia b a M a çã R u g g in e M a çã P a n a ia -ve rm e lh o A m e ixa se ca Ju ju b a mg EAG e m 1 0 0 g n a b a se h ú mi d a
35 cultivadas na Europa Ocidental) se encontram entre valores de 66,2 e 211,9 mgEAG por 100 g de massa húmida, dependendo da variedade de maçã. Neste estudo os principais compostos fenólicos descritos para a maçã foram os 3-flavanóis (catequinas e proantocianidinas) (71 - 90%), o ácido hidroxicinâmico (4 - 18%), outros flavonóides (1 - 11%) e dihidrochalconas (2 - 6%). Para além disso, foi igualmente descrito a presença de antocianinas (1 - 3%) nas maçãs vermelhas (Vrhovsek et al., 2004).
Naturalmente, na maçã, como em outros frutos, a variabilidade do perfil de compostos fenólicos é grandemente influênciada pela variedade.
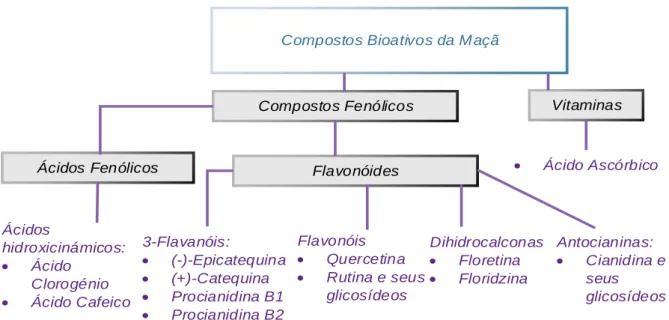
A Figura 12 mostra os principais compostos bioativos presentes na maçã, de acordo com Tokusoglu, (2011). Destes, salientam-se os compostos fenólicos.
Compostos Bioativos da M açã
Compostos Fenólicos Vitaminas
Ácidos Fenólicos Flavonóides
Ácidos hidroxicinámicos: Ácido Clorogénio Ácido Cafeico 3-Flavanóis: (-)-Epicatequina (+)-Catequina Procianidina B1 Procianidina B2 Flavonóis Quercetina Rutina e seus glicosídeos Dihidrocalconas Floretina Floridzina Antocianinas: Cianidina e seus glicosídeos Ácido Ascórbico
Figura 12. Compostos bioativos da maçã (adaptado de Tokusoglu, 2011).
À semelhança do fruto, os principais compostos fenólicos presentes no sumo de maçã são o ácido clorogénico, ácido cafeico, ácido p-cumárico, ácido ferúlico, catequina, epicatequina, proantocianidina (B1, B2, C1 trímero), rutina e floridzina. O tipo e a quantidade destes compostos apresentam variações importantes em relação às variedades de origem a partir do qual o sumo de maçã é produzido (Gliszczynska-Swiglo & Tyrakowski, 2003; Karaman et al., 2010; Wu et al., 2007).
36
2.4.3.1. DISTRIBUIÇÃO DE COMPOSTOS FENÓLICOS N A CASCA, SEMENTE E POLPA DE MAÇÃ
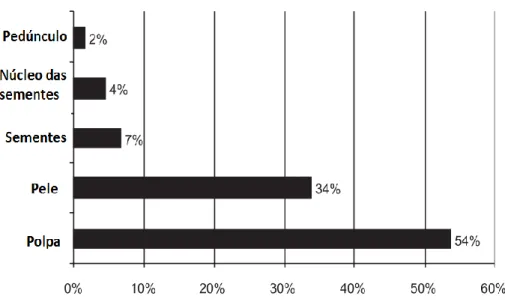
No processo de produção do sumo de maçã, cascas e sementes são descartadas, incluindo uma parte significativa da polpa. Como as cascas e polpa da maçã são ricas em compostos fenólicos e são os principais constituintes na morfologia do bagaço, é importante fazer-se uma caracterização dos mesmos constituintes na maçã, com o intuito de saber se a casca, polpa e semente têm valores significativos de compostos fenólicos (Kołodziejczyk et al., 2007).
Wolfe et al., (2003) determinaram os compostos fenólicos totais, flavonóides e antocianinas de quatro variedades de maçãs (Roma Beleza, idared, Cortland e Golden Delicious) na polpa e casca do fruto. Neste estudo, os autores concluíram que o conteúdo de compostos fenólicos totais da casca eram mais elevados na variedade Idared e Roma Beleza (588,9 e 500,2 mg de EAG / 100 g de casca, na base húmida), sendo os valores na polpa de 75,7 e 93,0 mg de EAG / 100 g de polpa, na base húmida, respetivamente (Wolfe et al., 2003). Os autores registaram ainda uma tendência semelhante para os flavonóides na variedade Idared: a concentração destes compostos na casca era de 303,2 mg de equivalentes de catequina / 100 g na base húmida, o que correspondia a concentrações seis vezes maiores ao encontrado na polpa (Wolfe et al., 2003).
As antocianinas foram detetadas apenas na casca, com valores muito diferentes para as diferentes variedades. Em mais pormenor, estes compostos foram descritos em quantidade muito residuais na variedade Golden Delicious enquanto o valor mais elevado (26,8 mg equivalentes de cianidina 3-glicosídeos / 100 g na base húmida) foi encontrado na casca da variedade Idared (Wolfe et al., 2003).
Proantocianidinas são encontradas em todo o fruto de maçã e os seus valores podem aumentar de 1,2 mg/g nas sementes, até 5,0 mg/g em base húmida na parte epidérmica da maçã (Guyot et al., 1998). Sanoner et al., (1999) encontrou mais proantocianidinas polimerizadas na parte do córtex de algumas variedades de maçãs. Uma caracterização aprofundada sobre os compostos fenólicos das maçãs associada à sua localização na casca, polpa e sementes, prova que as cascas e também as sementes, são ricos nestes compostos. Uma representação esquemática de varias gamas de concentração de compostos fenólicos específicos na casca (Łata
37 et al., 2009), polpa (McGhie et al., 2005) e sementes (Schieber et al., 2003), são apresentadas na Figura 13. Polpa e casca mg/g ms (+) - Catequina 0,38 - 1,47 (-) - Epicatequina 0,38 - 1,28 Rutina 0,37 - 1,59 Floridzina 0,11 - 0,43 Ácido Clorogénico 0,25 - 2,31 Ácido Cafeico 0,04 - 0,17
Figura 13. Distribuição de compostos fenólicos na casca, semente e polpa. – Não medido (Adaptado
de Łata et al., 2009; McGhie et al., 2005; Schieber et al., 2003; Iacopini et al., 2010).
Ao comer a maçã a casca é geralmente descartada, no entanto a casca representa uma parte da massa do fruto que pode fornecer uma fração significativa de compostos fenólicos, tornando-se uma fonte importante destes compostos (Łata et al., 2009; McGhie et al., 2005).
Casca mg/g ms (+) - Catequina 0,99 - 4,42 (-) - Epicatequina 1,24 - 5,75 Rutina 2,76 - 11,4 Floridzina 0,71 - 2,42 Ácido Clorogénico 0,26 - 2,33 Semente mg/g ms (+) - Catequina - (-) - Epicatequina 0,01 Rutina - Ácido Clorogénico 0,12 Floretina-xilo glicosídeo 0,05 Proantocianidina B2 0,02 Floridzina 1,9
38
2.4.3.2. COMPOSTOS FENOLICOS DO BAGAÇO DE MAÇÃ
Durante a produção do sumo de maçã, apenas uma fração dos compostos fenólicos são extraídos, enquanto que outra parte permanece no bagaço de maçã (Van Der Sluis et al., 2005). Devido ao fato de cascas e sementes serem descartados durante a produção de sumo, compostos fenólicos tais como quercetina e glicosídeos dihidrocalconas, são encontrados em pequenas quantidades no sumo de maçã (Markowski & Płocharski, 2006).
Sumo produzido a partir de maçãs da variedade Jonagold, obtido por polpação ou diretamente pressionando, tinha um valor significativamente menor ao nível dos compostos fenólicos e atividade antioxidante em relação a maçãs não processadas. Os valores reduziram em média 50% no caso do ácido clorogénico e 3% nas catequinas. A atividade antioxidante foi reduzida entre 10 a 13% em relação a maçãs frescas pelo processo de produção do sumo. Determinou-se que a maior parte dos compostos fenólicos ficam retidos no bagaço ou no bolo de prensagem e não foram extraídos. Estes resultados oferecem informação importante para a indústria de processamento de sumo de maçã, interessada em produzir um sumo com maior valor nutricional ou pelo menos, para utilizar o bagaço como uma fonte de antioxidantes (Root & Barrett, 2004).
Os compostos fenólicos presentes no bagaço de maçã são principalmente ácidos fenólicos e flavonóides, onde se incluem os 3-flavanóis, os flavonóis e as dihidrocalconas. Os ácidos fenólicos identificados são principalmente derivados de ácidos hidroxicinâmicos, embora alguns ácidos hidroxibenzóicos estejam presentes em menor quantidade (Foo & Luo, 1999). Os principais flavonóides identificados no bagaço incluem catequinas, glicosídeos de floridzina, glicosídeos de quercetina e proantocianidinas (Quadro 3). Uma vez que alguns compostos fenólicos têm demonstrado apresentar forte atividade antioxidante in vitro, a exploração comercial para a recuperação destes compostos parece promissora (Schieber et al., 2001).