Clínica Universitária de Doenças Infeciosas
O quociente CD4/CD8 e as comorbilidades não-SIDA na infeção
crónica por VIH
Ana Rita Franco
Junho
’2018
Clínica Universitária de Doenças Infeciosas
O quociente CD4/CD8 e as comorbilidades não-SIDA na
infeção crónica por VIH
Ana Rita Franco
Orientado por:
1
Resumo
A eficácia da TARVc atual transformou a infeção por VIH numa doença crónica virologicamente controlada e com recuperação imunitária sequencial mas com ativação imunitária e inflamação persistentes. Por essa razão, embora a mortalidade relacionada com SIDA tenha diminuído, doentes VIH+ sob TARVc eficaz encontram-se em maior risco de desenvolver complicações não-SIDA como doença cardiovascular, renal, hepática, neuro-cognitiva, neoplasias e osteoporose, quando comparados com indivíduos não infetados, apesar de supressão viral e recuperação de T CD4+ ótimas. Um quociente CD4/CD8 baixo, encontrado tanto na infeção crónica por VIH como em idosos não infetados, é associado a maior disfunção e ativação imunitária e, logo, a maior morbilidade e mortalidade.
O presente estudo teve como objetivo determinar de que forma o quociente CD4/CD8 se relaciona com o desenvolvimento de complicações não-SIDA.
Foi realizada uma avaliação evolutiva de um estudo prospetivo observacional onde um coorte de doentes VIH+ sob TARVc eficaz seguidos ao longo de oito anos foi dividido em dois grupos com base no quociente CD4/CD8. Foram registadas e analisadas as complicações não-SIDA desenvolvidas em ambos os grupos.
Verificou-se uma maior taxa de doença renal no grupo com um quociente CD4/CD8 baixo (0% vs 16, p = 0,008), sem outras diferenças estatisticamente significativas entre os grupos nas restantes complicações não-SIDA avaliadas, bem como na mortalidade. Paralelamente, demonstrou-se também que a recuperação imunitária é francamente inferior nos doentes com quociente CD4/CD8 <0,9 e que esta diferença se manteve ao longo dos oito anos de observação. Existe porém uma pequena, porém mantida, percentagem de doentes que reverte o seu quociente CD4/CD8 baixo (1,4%/ano).
Apesar das limitações, o presente estudo suporta a ideia de que um quociente CD4/CD8 baixo possa talvez ser um marcador de doentes em maior risco de desenvolver certas complicações não-SIDA.
Palavras-chave: infeção crónica por VIH; complicações não-SIDA; quociente CD4/CD8;
ativação T CD8+; imunosenescência; ativação imunitária.
2
Abstract
The effectiveness of the current antiretroviral therapies have transformed HIV infection into a chronic disease with virological control and sequential immune recovery, but with persistent immune activation and inflammation. Thus, even though AIDS-related mortality has decreased, patients living with HIV infection are more likely to develop non-AIDS events, such as cardiovascular, kidney, liver and neuro-cognitive disease, cancer and osteoporosis, when comparing with non-infected individuals, despite the achievement of optimal suppression of HIV replication and CD4 T cell count recovery. A low CD4/CD8 ratio, found either in chronic HIV infection and among elderly uninfected adults, is associated with greater immune activation and dysfunction and, therefore, with greater morbidity and mortality.
The aim of this project was to study the relation between the CD4/CD8 ratio and the development of non-AIDS morbidities.
An evolutionary evaluation of an observational prospective study was conducted, in which an HIV + cohort under effective HAART followed over eight years was divided into two groups based on their CD4/CD8 ratio. Non-AIDS comorbidities developed by both groups were recorded and analyzed.
There was a higher rate of renal disease in the group with a low CD4/CD8 ratio (0% vs. 16, p = 0.008), with no other statistically significant differences between groups in the remaining non-AIDS complications assessed, as well as mortality. In parallel, it has also been shown that immune recovery is markedly lower in patients with CD4/CD8 ratio <0.9 and that this difference was maintained over the eight years of observation. However, there is a small, but steady, percentage of patients who revert their low CD4/CD8 ratio (1.4% / year).
Despite its limitations, the present study supports the idea that a low CD4 / CD8 ratio may be a marker of patients at higher risk of developing certain non-AIDS complications.
Key-words: chronic HIV infection; non-AIDS comorbidities; CD4/CD8 ratio; CD8 T
3
Índice
Resumo ... 1 Abstract ... 2 Agradecimentos ... 4 Lista de abreviaturas ... 5 Lista de tabelas ... 6 Lista de figuras ... 6 Introdução ... 7 Pergunta de investigação ... 11 Metodologia ... 11 Desenho do estudo ... 11Definição de complicações não-SIDA ... 12
Critérios de exclusão ... 12
Análise estatística ... 13
Resultados ... 14
Descrição das características da população em estudo e comparação entre grupos ... 14
Desenvolvimento de complicações não-SIDA ... 15
Análise da terapêutica realizada... 16
Análise de sobrevivência ... 16
Descrição da evolução dos valores de linfócitos T CD4+ e CD8+ e do seu quociente ao longo do tempo ... 17
Discussão ... 19
Conclusão ... 27
Referências bibliográficas ... 28
Anexos ... 31
Anexo 1 - Aprovação da Comissão de Ética ... 31
4
Agradecimentos
Ao Dr. Robert Badura, por toda a disponibilidade, atenção e dedicação que me concedeu ao longo destes meses. Pela paciência de me explicar as vezes que fossem necessárias e pelas palavras de encorajamento quando o caminho se tornava menos fácil. Muto obrigada pelo seu apoio.
A todos aqueles que na Consulta de Imunodepressão do Hospital de Santa Maria me acolheram no seu local de trabalho e que despenderam parte do seu tempo para me ajudar a concretizar este projeto. Um obrigado especial à administrativa Marina.
À minha mãe, ao meu pai e ao João, sem os quais não estaria aqui hoje.
5
Lista de abreviaturas
CD – cluster of differentiation EAM – enfarte agudo do miocárdio
Doentes VIH+ - doentes infetados por vírus da imunodeficiência humana DP – desvio-padrão
IL – interleucina
IP – inibidor da protease
GALT – gut associated lymphoid tissue
HAD/HAND – HIV associated dementia/ HIV associated neurocognitive disorder HIVAN – HIV associated nephropathy
HIVICK – HIV immune complex kidney disease
HLA-DR – Human leukocyte antigen – antigen D related HTA – hipertensão arterial
Não-SIDA – evento não causado pela SIDA
NITR – inibidor da transcriptase reversa nucleosídeo NNITR – inibidor da transcriptase reversa não nucleosídeo p – p-value
PCR – proteína C reativa
Quociente CD4/CD8 - relação entre linfócitos T CD4+ e T CD8+ SIDA – síndrome da imunodeficiência humana adquirida
TARVc – terapêutica anti-retroviral combinada T CD4+ - linfócitos T que expressam o recetor CD4 T CD8 + - linfócitos T que expressam o recetor CD8 TNF – tumor necrosis fator
6
Lista de tabelas
Tabela 1 - Estatísticas descritivas do coorte total ... 14
Tabela 2- Comparação das características entre grupos ... 15
Tabela 3- Descrição das complicações não-SIDA desenvolvidas ... 15
Tabela 4- Doentes medicados com tenofovir ... 16
Tabela 5- Descrição dos óbitos ... 17
Lista de figuras
Figura 1- Seleção dos participantes do estudo... 13Figura 2- Análise de sobrevivência para mortes totais ... 17
Figura 3- Análise de sobrevivência para mortes por VIH ... 17
Figura 4- Evolução dos valores absolutos de T CD8+ ... 18
Figura 5 - Evolução dos valores absolutos de T CD4+ ... 18
Figura 6- Evolução dos valores percentuais de T CD8+ ... 18
Figura 7- Evolução dos valores percentuais de T CD4+ ... 18
7
Introdução
Os primeiros casos de Síndrome de Imunodeficiência Humana Adquirida (SIDA) foram referenciados há 30 anos atrás, em Atlanta. Atualmente, a pandemia vírus da imunodeficiência humana (VIH) /SIDA afeta todas as regiões do mundo, constituindo o maior problema de saúde pública nos continentes africano e asiático, pois limita o seu desenvolvimento económico e demográfico. Durante as três décadas desta pandemia, ocorreram mais de 65 milhões de casos de infeções por VIH e morreram
cerca de 25 milhões de pessoas com SIDA.[1]
A infeção por VIH envolve mecanismos complexos de interação entre a replicação vírica e os mecanismos de defesa do hospedeiro, uma vez que o vírus infecta
principalmente linfócitos T CD4+ (T CD4+). [2] Assim, a história natural da infeção vai
estar relacionada com o balanço entre a virémia e a resposta imunitária do hospedeiro. Esta infeção associa-se a alterações funcionais de praticamente todos os componentes do sistema imunitário, causadas quer pela ação direta do vírus quer pela
depleção dos T CD4+ ou ainda pela ativação imunitária persistente e generalizada. [2] A
razão de ser desta última prende-se com o facto de a proliferação celular ser fundamental para que o vírus seja integrado no genoma da célula hospedeira e se replique eficazmente. Deste modo, o vírus induz uma ativação persistente do sistema imunitário que reverte em seu benefício, ao permitir a manutenção da infeção de novas células e da replicação vírica. [2]
Atualmente, a terapêutica disponível para a infeção por VIH é a terapêutica anti-retrovírica combinada (TARVc) que tem como objetivo a supressão indefinida da replicação vírica e o consequente aumento da contagem de T CD4+ periféricos, impedindo assim a progressão da doença para a SIDA. [3, 4] Na TARVc utiliza-se a associação entre três ou mais anti-retrovirais escolhidos de entre os inibidores da transcriptase reversa nucleosídeos (NITR), inibidores da transcriptase reversa não-nucleósidos (NNITR), inibidores da protéase (IP) e inibidores da integrase.
Recomenda-se a utilização de dois NTRI + (NNTRI ou IP ou inibidor da integraRecomenda-se). [5]
Tanto em países desenvolvidos como em desenvolvimento, a esperança média de vida dos doentes infetados por VIH que têm acesso a esta terapêutica é medida em décadas, chegando até a aproximar-se do valor médio da população não infetada,
8
naqueles que são tratados em condições ótimas [6]. Isto leva a que o paradigma “infeção
por VIH/SIDA” comece a ser substituído pelo conceito de “infeção crónica por VIH”, com consequente diminuição da incidência de SIDA.
Quando utilizada corretamente, a TARVc resulta no controlo de VIH com restauração parcial da função imunitária, prevenindo assim as várias complicações que definem a SIDA. No entanto, isto não significa que a saúde foi completamente restaurada. Pelo contrário, adultos infetados por VIH (VIH+) com supressão da replicação de VIH devido a TARVc de longa duração encontram-se em risco de desenvolver várias complicações não relacionadas com a SIDA (não-SIDA), como
doenças cardiovasculares, neoplasias, doença renal, doença hepática,
osteopénia/osteoporose e doenças neuro-cognitivas. [3] Assim, apesar do aumento da contagem de T CD4+ periférica estar associado a redução da morbilidade e mortalidade, quando comparados com indivíduos sem infeção por VIH, aqueles sob TARVc apresentam maior risco de morbilidade e mortalidade, devido ao desenvolvimento das
complicações não-SIDA. [6]
Muitas destas complicações são similares àquelas que caracterizam a população idosa e, dada a sua natureza degenerativa, podem ter um impacto dramático na qualidade de vida e funcionalidade dos doentes. [7]
Existem vários fatores que contribuem para o aumento do risco de desenvolvimento destas complicações não-SIDA, como a toxicidade dos fármacos anti-retrovirais, a elevada prevalência dos fatores de risco tradicionais (como abuso de substâncias, tabagismo, alcoolismo, obesidade, hipertensão) e a disfunção imune e inflamação persistentes. [8] Esta última será o foco do presente trabalho.
O envelhecimento é caracterizado por alterações do sistema imunitário, nomeadamente a nível dos linfócitos T. Assim, comparando com jovens adultos, o sistema imunitário dos idosos da população geral é marcado por (a) redução do número e função de células estaminais hematopoiéticas, (b) involução tímica, (c) redução dos linfócitos T naïve circulantes, (d) aumento da frequência de linfócitos T CD28-CD57+ diferenciados e com potencial proliferativo limitado (senescentes), (e) aumento da
ativação de linfócitos T CD38+HLADR+, (f) aumento dos níveis de
citocinas/marcadores proinflamatórias, como IL-6, TNF-α, PCR, sCD14, sCD163, (g) diminuição da relação entre T CD4+ e T CD8+ (quociente CD4/CD8) e (h) diminuição
9
do comprimento dos telómeros de linfócitos T. Outras características também presentes são a hipercoagulabilidade (aumento de fibrinogénio e D-dímeros) e destruição da mucosa intestinal e translocação bacteriana (aumento de lipopolissacárido). [3, 6, 7]
Esta ativação/disfunção persistente do sistema imunitário e inflamação associadas ao envelhecimento são denominadas de “imunosenescência” e, curiosamente, também se encontram presentes em doentes infetados por VIH, sendo um
dos fatores de risco para o desenvolvimento das complicações não-SIDA. [4, 7] Sabe-se
que a TARVc reverte muitas destas vias proinflamatórias, mas o seu efeito é incompleto e a inflamação persiste indefinidamente. [8] Apesar de ainda não se encontrar bem estabelecido até que ponto a TARVc consegue reverter estas alterações, existem evidências de que haverá maior recuperabilidade imunitária quanto mais cedo for iniciada a terapêutica [9]. Contudo, a TARVc não tem o mesmo impacto em todas as células pro-inflamatórias, uma vez que determina uma diminuição notável dos T CD8+,
[9]
aproximando-se dos valores de elite controllers quando iniciada precocemente, enquanto a desregulação dos linfócitos B parece persistir. [10]
Em 1989, Taylor et al, comparou o papel preditor de evolução de doença para SIDA de três parâmetros imunológicos em doentes infetados com VIH: contagem absoluta de T CD4+, percentagem de T CD4+ e quociente CD4/CD8. Concluiu-se que a contagem absoluta de T CD4+ e o quociente CD4/CD8 eram os que melhor previam a progressão da doença. No final do século XX, Liu et al e Giogi et al mostraram que a ativação de linfócitos T CD8+ (T CD8+), medida através da expressão de CD38 e HLA-DR, também era um fator preditor independente para progressão da doença. Atualmente, apesar de o quociente CD4/CD8 ser utilizado para prever o outcome, a contagem absoluta de T CD4+ é ainda um dos critérios utilizados para iniciar TARVc e, juntamente com o nadir T CD4+, constitui o melhor marcador para avaliar a progressão da doença, estabelecimento de imunodeficiência, bem como risco de infeções oportunistas, neoplasias relacionadas com a SIDA e morte. [4, 11]
Relativamente à importância do quociente CD4/CD8, sabe-se o seguinte: durante a infeção por VIH não tratada, a contagem de T CD8+ aumenta, enquanto a de T CD4+ diminui. Durante a supressão viral mediada pela TARVc, alguns doentes
atingem contagem de T CD4+> 500 células/mm3 com simultâneo declínio dos T CD8+,
10
mantêm níveis elevados de linfócitos T CD8+ e, logo, um quociente CD4/CD8 persistentemente baixo, à semelhança do que se verifica no envelhecimento. Em ambas as situações, este quociente baixo associa-se a morbilidade e mortalidade. [3]
Assim, coloca-se a hipótese de, em doentes infetados por VIH e tratados com TARVc que apresentem recuperação ótima da contagem de TCD4+, o quociente
CD4/CD8 baixo poder identificar um subgrupo de doentes com disfunção imunitária/inflamação persistentes e fenótipo imunosenescente e consequentemente
maior risco de desenvolver complicações não-SIDA e, por isso, pior prognóstico e maior mortalidade. Se esta hipótese se confirmar, o quociente CD4/CD8 pode representar um bom preditor de eventos relacionados e não-relacionados com SIDA. Poderá assim ter grande utilidade para monitorização da resposta ao tratamento em doentes em diferentes fases clínicas da evolução da infeção crónica por VIH. [3, 12]
11
Pergunta de investigação
Nos doentes infetados por VIH e sob terapêutica TARVc eficaz, o quociente CD4/CD8 consegue prever o desenvolvimento de complicações não-SIDA?
Objetivos:
Determinar quociente CD4/CD8 após início de TARVc
Determinar complicações não-SIDA atuais
Determinar quociente CD4/CD8 atual
Determinar como o quociente CD4/CD8 se relaciona com o
desenvolvimento de complicações não-SIDA, em doentes infetados por VIH e sob terapêutica TARVc
Concluir acerca do valor prognóstico do quociente CD4/CD8 enquanto
marcador de progressão de doença
Metodologia
Desenho do estudo
Para responder à questão de investigação e atingir os objetivos propostos, foi feita uma avaliação evolutiva de um estudo prospetivo observacional iniciado em 2010, estudo esse que foi na altura aprovado pela Comissão de Ética. Deste modo, o período de observação encontra-se compreendido entre janeiro de 2010 e dezembro de 2017.
A população estudada consistiu num coorte de 102 doentes VIH+ que se mantiveram sempre sob terapêutica TARVc eficaz, seguidos ao longo de oito anos no Hospital de Santa Maria, Lisboa e onde se podiam definir dois grupos: 66 doentes que em 2010 apresentavam um quociente CD4/CD8> 1,2 (grupo I) e 36 doentes que em 2010 apresentavam um quociente CD4/CD8 <0,9 (grupo II). Para os doentes serem distribuídos pelos dois grupos, foram necessárias duas avaliações prévias em que o respetivo quociente se mantivesse.
Foi construída uma base de dados anonimizada no programa Microsoft Excel ® 2013 (Microsoft Corporation) onde foram registadas as seguintes variáveis referentes à população estudada: sexo, idade, tempo de diagnóstico de infeção por VIH, tempo de
12
TARVc eficaz, valor de nadir T CD4+, comorbilidades não-SIDA* e óbitos e respetivas causas. Foi ainda registada semestralmente a evolução dos seguintes valores laboratoriais: nº absoluto de T CD4+, % de T CD4+, nº absoluto de T CD8+, % de T CD8+ e carga viral.
*hipertensão arterial (HTA), dislipidémia, doença cardiovascular, enfarte agudo do miocárdio (EAM), neoplasias, doença renal e HIV associated dementia/HIV associated neurocognitive disorder (HAD/HAND).
A autora teve acesso aos dados já anonimizados.
Definição de complicações não-SIDA
As comorbilidades não-SIDA incluem um extenso espectro de doenças e já várias definições para abordar o problema no contexto de infeção por VIH foram utilizadas, desde doença subclínica, como espessura da íntima carotídea ou osteoporose, até doença terminal de órgão [3].
No presente estudo, foi considerada como sendo HTA o registo de tensão arterial> 140/90 mmHg e/ou realização de terapêutica anti-hipertensiva e/ou registo direto do diagnóstico no processo do doente; foi considerada como sendo dislipidémia a realização de terapêutica anti-dislipidémica e/ou o registo direto do diagnóstico no processo do doente; foi considerada como sendo doença cardíaca o registo direto do diagnóstico de miocardiopatia, miocardite, pericardite, doença arterial coronária, doenças da aorta, hipertensão pulmonar de causa cardíaca ou fibrilação auricular no processo do doente e/ou evidências destes diagnósticos em exames complementares de diagnóstico apoiados por sinais e sintomas; foi considerado como sendo doença renal o registo de proteínúria e/ou albuminúria e/ou o registo direto do diagnóstico no processo do doente; foram considerados como sendo EAM, neoplasias e HAD/HAND o registo direto destes diagnósticos no processo do doente.
Critérios de exclusão
A análise dos dados disponíveis relativos às variáveis supracitadas apenas foi feita nos doentes que, em ambos os grupos e durante todo o período de observação, mantiveram o seu quociente CD4/CD8 inicial e mantiveram uma terapêutica eficaz sem interrupções.
13
Doentes VIH-positivos sob TARVc eficaz em 2010
N=102
Grupo I Doentes com quociente CD4/CD8>1,2
em 2010 N=66
Grupo I Doentes que mantiveram CD4/CD8>1,2
N=64
Grupo I Doentes que mantiveram terapêutica
eficaz N=57
Grupo I N=56 Grupo II (controlo)
Doentes com quociente CD4/CD8<0,9 em 2010
N=36
Grupo II (controlo) Doentes que mantiveram CD4/CD8<0,92
N=32
Grupo II Doentes que mantiveram terapêutica
eficaz N=26
Grupo II (controlo) N=25
Figura 1- Seleção dos participantes do estudo
Assim, dos 66 doentes do grupo I, apenas foram analisados 57 doentes (foi excluído um doente que não manteve o quociente CD4/CD8> 1.2, sete doentes que não mantiveram terapêutica TARVc eficaz e um doente que não manteve o quociente CD4/CD8> 1,2 nem terapêutica eficaz) e dos 36 doentes do grupo II apenas foram analisados 26 doentes (foram excluídos três doentes que não mantiveram o quociente CD4/CD8 <0,9, seis doentes que não mantiveram terapêutica TARVc eficaz e um doente que não manteve o quociente CD4/CD8 <0,9 nem terapêutica eficaz). Para além disso, foram também excluídos doentes cujos processos não foram encontrados, o que aconteceu em um doente do grupo I e um doente do grupo II. No final da seleção restaram 56 casos e 25 controlos. Ver Figura 1.
Análise estatística
A análise estatística foi realizada recorrendo ao programa IBM SPSS Statistics® versão 22, envolvendo medidas de estatística descritiva (frequências absolutas e relativas) e estatística inferencial. Nesta última, usou-se o teste x-square para aferir diferenças entre variáveis categóricas e o teste t-student para aferir diferenças entre médias de variáveis quantitativas de amostras independentes. Cada média é expressa com o respetivo desvio padrão. A análise de sobrevivência foi realizada utilizando a análise de Kaplan-Meier. O limite para significância estatística foi estabelecido nos 5%, correspondendo a um p-value <0,05 (p <0,05). 1 doente sem processo encontrado 1 doente sem processo encontrado
14
Resultados
Descrição das características da população em estudo e comparação entre grupos
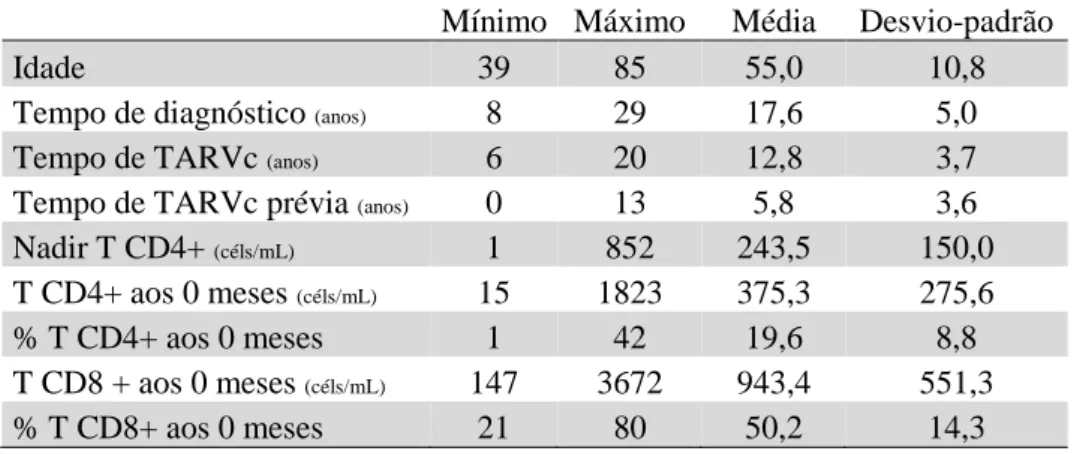
Os dados referem-se a 81 doentes (56 do grupo I e 25 do grupo II). A idade média da população é de 55 anos. Em média, os doentes foram diagnosticados com infeção por VIH há 18 anos e encontravam-se sob TARVc eficaz e mantida há 13 anos sendo que 6 desses 13 anos decorreram antes do período de observação. O valor médio de nadir T CD4+, T CD4+ aos 0 meses e T CD8+ aos 0 meses é respetivamente 243,5 céls/mL, 375,3 céls/mL e 934,4 cels/mL. Ver Tabela 1.
Tabela 1 - Estatísticas descritivas do coorte total
Mínimo Máximo Média Desvio-padrão
Idade 39 85 55,0 10,8
Tempo de diagnóstico (anos) 8 29 17,6 5,0
Tempo de TARVc (anos) 6 20 12,8 3,7
Tempo de TARVc prévia (anos) 0 13 5,8 3,6
Nadir T CD4+ (céls/mL) 1 852 243,5 150,0
T CD4+ aos 0 meses (céls/mL) 15 1823 375,3 275,6
% T CD4+ aos 0 meses 1 42 19,6 8,8
T CD8 + aos 0 meses (céls/mL) 147 3672 943,4 551,3
% T CD8+ aos 0 meses 21 80 50,2 14,3
Nas comparações entre os doentes de ambos os grupos, não se encontrou diferença estatisticamente significativa no que diz respeito ao sexo, idade, tempo de diagnóstico de infeção, valor T CD4 +nadir, valor T CD8+ aos 0 meses e comorbilidades pré-existentes. No entanto, os doentes com um quociente CD4/CD8 <0.9 encontravam-se sob TARVc eficaz e mantida, quer total quer previamente ao período de observação, durante menos tempo (10 anos vs 14, p = 0,000) (3 anos vs 10, p =0,000), têm menor valor de T CD4+ e de % de T CD4+ aos 0 meses (264,8 céls/mL vs 439,8, p = 0,019) (14,3% vs 22,6, p = 0,000) e maior percentagem de T CD8+ aos 0 meses (56,9% vs 46,5, p = 0,007). Ver Tabela 2.
15 T abela 2- Comp araçã o das carac terísti cas entre grupo s
Desenvolvimento de complicações não-SIDA
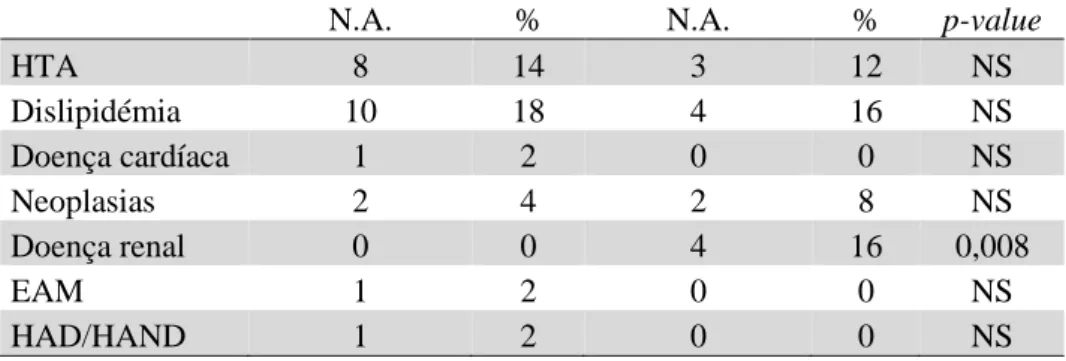
Não se encontrou diferença estatisticamente significativa entre os dois grupos de doentes no que diz respeito ao desenvolvimento da maioria das complicações não-SIDA durante o período de observação, nomeadamente HTA, dislipidémia, doença cardíaca, neoplasias, EAM e HAD/HAND. A única exceção é o desenvolvimento de doença renal que é superior nos doentes com quociente CD4/CD8 <0,9 (0% vs 16, p = 0,008). Pode também observar-se uma maior tendência por parte dos doentes deste grupo a desenvolverem neoplasias, apesar de não existir significância estatística. Ver Tabela 3.
Tabela 3- Descrição das complicações não-SIDA desenvolvidas
CD4/CD8 >1,2 CD4/CD8 <0,9
N = 56 N = 25
N.A. % N.A. % p-value
Sexo masculino 43 77 17 68 NS
Sexo feminino 13 23 8 32 NS
Idade (anos) 56,5 - 54,0 - NS
Tempo de diagnóstico (anos) 17,9 - 16,9 - NS
Tempo de TARVc (anos) 13,8 - 10,4 - 0,000
Tempo de TARVc prévia (anos) 6,8 - 3,5 - 0,000
Nadir T CD4+ (céls/mL) 262,9 - 200,0 - NS T CD4 ao mês 0 (céls/mL) 439,8 - 264,8 - 0,019 % T CD4+ ao mês 0 22,6 14,3 0,000 T CD8+ ao mês 0 (céls/mL) 853,7 - 1072,7 - NS % T CD8+ ao mês 0 46,5 56,9 0,007 HTA pré-existente 13 23 3 12 NS Dislipidémia pré-existente 16 29 8 32 NS
Doença cardíaca pré-existente 0 0 0 0 -
Neoplasia pré-existente 6 11 0 0 NS
Doença renal pré-existente 1 2 0 0 NS
EAM pré-existente 1 2 0 0 NS HAD/HAND pré-existente 0 0 0 0 - grupo I grupo II CD4/CD8>1.2 CD4/CD8 <0.9 N = 56 N = 25 1 doentes sem processo encontrado 1 doente sem processo encontrado
16
Análise da terapêutica realizada
Verificou-se que os doentes do grupo II se encontravam a fazer mais tenofovir, quer em qualquer altura do tratamento, quer atualmente, do que os do grupo I (50 vs 76%, p = 0,032; 38 vs 60%, p = 0,090). Ver tabela 4.
Tabela 4- Doentes medicados com tenofovir
Análise de sobrevivência
No que diz respeito à mortalidade, não se encontrou diferenças estatisticamente significativas entre os dois grupos, quer a nível de mortalidade geral, quer a nível de mortalidade por causas relacionadas com infeção por VIH. Ver Tabela 5.
N.A. % N.A. % p-value
HTA 8 14 3 12 NS Dislipidémia 10 18 4 16 NS Doença cardíaca 1 2 0 0 NS Neoplasias 2 4 2 8 NS Doença renal 0 0 4 16 0,008 EAM 1 2 0 0 NS HAD/HAND 1 2 0 0 NS grupo I grupo II CD4/CD8 >1,2 CD4/CD8 <0,9 N = 56 N = 25
N.A. % N.A. % p-value
Em qualquer altura 28 50 19 76 0,032
17
Figura 2- Análise de sobrevivência para mortes totais Figura 3- Análise de sobrevivência para mortes por VIH Tabela 5- Descrição dos óbitos
grupo I grupo II
CD4/CD8 >1,2 CD4/CD8 <0,9
N = 56 N = 25
N.A. % N.A. % p-value
Todos os óbitos 4 7 1 4 NS
Óbitos relacionado com VIH 2 4 0 0 NS
A análise de sobrevivência Kaplan-Meier também não demonstrou diferenças significativas. Ver Figuras 2 e 3.
Descrição da evolução dos valores de linfócitos T CD4+ e CD8+ e do seu quociente ao longo do tempo
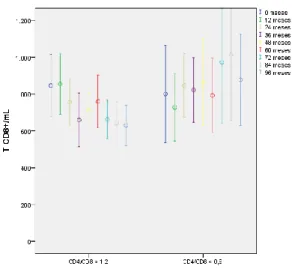
Tanto em termos absolutos como percentuais, verifica-se que o padrão de recuperação linfocitária é diferente nos dois grupos. No grupo I, há uma tendência progressiva e continuada de aumento de T CD4+ e diminuição de T CD8+, em posição ao grupo II, onde este padrão de recuperação apenas dura alguns anos, altura em que atinge um plateau. Ver Figuras 4, 5, 6 e 7. Estes diferentes padrões de recuperação linfocitária traduzem-se também num diferente padrão de evolução do quociente CD4/CD8 entre os grupos. Enquanto no grupo I, o quociente aumenta de forma progressiva e continuada, no grupo II este aumento apenas dura alguns anos, altura em que atinge um plateau. Ver Figura 8.
p=0,606 p=0,352
18
Figura 7- Evolução dos valores percentuais de T CD4+ Figura 6- Evolução dos valores percentuais de T CD8+
Figura 8- Evolução do quociente CD4/CD8
19
Discussão
O presente estudo foi iniciado em 2010 e acompanhou durante oito anos a evolução clínica de cerca de cem doentes, o que lhe conferiu o elevado nível de evidência tipicamente associado a um estudo prospetivo, em comparação com os retrospetivos. Assim, enquanto estudo prospetivo, apresenta elevada precisão na colheita de dados, no que diz respeito a exposições, fatores de viés e end-points.[13] No entanto, uma das suas limitações é a possibilidade de perda de casos durante o seguimento, o que se verificou neste estudo em particular, com perda de 21 dos 102 casos iniciais. Para além disso, uma outra dificuldade dos estudos prospetivos é por vezes a necessidade de amostras muito grandes para a encontrar outcomes raros. Deste modo, a perda de casos associada ao talvez pequeno número de casos iniciais pode estar na base das poucas diferenças significativas que se encontrou entre os dois grupos.
Ainda em relação ao desenho do estudo, coloca-se também a hipótese de ser necessário um tempo de observação mais longo para se encontrarem diferenças significativas entre grupos.
Um outro aspeto que pode ter conferido algum grau de erro aos resultados obtidos foram as limitações subjacentes aos critérios utilizados para se considerar ou não o desenvolvimento de complicações não-SIDA. Por um lado, os critérios não foram rigorosamente definidos antes do início do estudo. Por outro, os registos médicos com as informações clínicas dos doentes frequentemente não se encontravam percetíveis e/ou organizadas.
Analisando demograficamente as duas subpopulações estudadas, constata-se que ambas se encontram próximas das características da população geral portuguesa, em termos da distribuição etária e de género dos doentes. Segundo o relatório de 31 de dezembro de 2016 do Instituto Nacional de Saúde Dr. Ricardo Jorge, 71,5% dos casos de infeção por VIH diagnosticados em adultos corresponderam a indivíduos do sexo masculino e 28,5% a indivíduos do sexo feminino, sendo que o maior número de novos diagnósticos foi registado no escalão etário do 30-39 anos. [14] Estas características são relativamente sobreponíveis aos das subpopulações estudadas, onde o grupo I apresenta 77% de homens com uma idade média de diagnóstico de 38,6 anos e o grupo II
20
apresenta 68% de homens com uma idade média de diagnóstico de 37,1 anos. Mais se acrescenta que as duas subpopulações são demograficamente homogéneas entre si, o que significa que as eventuais diferenças encontradas entre os grupos não são devidas a influências de distribuição de idade ou género.
Apesar de os doentes de ambos os grupos terem um tempo de diagnóstico de infeção por VIH igual (18 anos vs 17, p = 0,412), aqueles que pertencem ao grupo II têm um tempo de TARVc eficaz menor (14 anos vs 10, p = 0,000). Isto significa que esses mesmos doentes começaram provavelmente a ser tratados mais tarde na evolução da doença (em média quatro anos mais tarde) que os do grupo I e, logo, estiveram sujeitos a mais inflamação. Esta diferença poderá ter impacto na capacidade de recuperação imunológica dos doentes, descrita mais à frente.
É ainda de salientar que o grupo I é constituído por mais doentes que tinham HTA (23 vs 12%, p = 0,367) e neoplasias (11 vs 0%, p = 0,170) previamente ao período de observação, o que confere alguma diferença entre a fragilidade inicial dos grupos. Embora estas diferenças não tenham atingido a significância estatística, não se pode excluir um eventual viés na amostra que poderá ter impacto nos outcomes registados posteriormente, nomeadamente a nível da mortalidade. Outros eventuais fatores de viés que não foram avaliados incluem hábitos tabágicos, utilização de drogas endovenosas, diabetes mellitus e infeção por vírus da hepatite B e C.
O objetivo principal do estudo era avaliar a capacidade do quociente CD4/CD8 de ser um marcador para o desenvolvimento de complicações não-SIDA. Neste aspeto, apesar de a grande maioria dos resultados obtidos não ter tido significância estatística (p> 0,05), a única diferença encontrada vai de encontro à revisão de literatura que afirma que doentes com um quociente CD4/CD8 baixo desenvolvem mais destas ocorrências [15], uma vez que se verificou que os doentes do grupo II apresentaram maior incidência de doença renal (0% vs 16, p = 0,008).
Segundo a bibliografia, doentes VIH+ têm maior risco de desenvolver doença renal do que a população em geral, o que lhes confere pior prognóstico, nomeadamente mortalidade aumentada. [16, 17] Apesar do risco de doença renal aguda estar a diminuir, está previsto que prevalência e incidência de doença renal crónica e doença renal terminal aumentem à medida que idade média das populações infetadas continua a
21
doenças que podem ser divididas de forma algo grosseira naquelas que são diretamente causadas pela ação do vírus e naquelas que surgem no contexto da infeção pelo vírus mas não são causadas diretamente por este. No primeiro grupo estão incluídas a nefropatia associada ao VIH (HIVAN), glomerulonefrite por deposição de imuno-complexos (HIVICK) e microangiopatias trombóticas; e no segundo encontram-se a doença renal por superinfeção e doença associada ao tratamento antirretroviral [16–18]
Todos os doentes que participaram no presente estudo encontravam-se sob TARVc eficaz e mantida e, portanto, sem vírus em circulação. Deste modo, as doenças renais mediadas pela ação do próprio vírus não poderiam ser causa do aumento da incidência de doença renal encontrado nos doentes com um quociente CD4/CD8 baixo. Aliás, a prevalência de HIVAN diminuiu drasticamente desde a introdução da terapêutica anti-retroviral e consequente supressão da supressão viral [18] e atualmente o HIVAN é na verdade mais frequentemente visto em doentes recém-diagnosticados com infeção por VIH em estadio avançado ou naqueles que descontinuaram TARVc [17], o que não corresponde à população em estudo.
Dentro das causas de doença renal em doentes VIH+ que não são diretamente mediadas pelo vírus, a coinfeção, em particular por vírus da hepatite C [16, 17, 19], poderia justificar as diferenças encontradas entre os grupos. No entanto, a coinfeção com outros vírus não foi estudada neste coorte de doentes, não sendo por isso possível estabelecer uma associação entre essa variável e o desenvolvimento desta complicação.
A doença renal associada a tratamento anti-retroviral eficaz e mantido pode surgir no seguimento de duas situações distintas. Por um lado, a situação mais linear consiste no desenvolvimento ou agravamento de doença renal devido aos efeitos nefrotóxicos da terapêutica anti-retroviral. Sabe-se que o tenofovir disoproxil fumarato, primeira linha de tratamento de VIH, pode causar disfunção tubular renal e os IP, indinavir e atazanavir, sendo insolúveis em urina alcalina, determinam cristalúria que pode causar nefropatia de cristais. [17, 18] Neste estudo, verificou-se que os doentes do grupo II se encontravam a fazer mais tenofovir, quer em qualquer altura do tratamento, quer atualmente, do que os do grupo I (50 vs 76%, p = 0,032; 38 vs 60%, p = 0,090). Este dado pode justificar a maior quantidade de doença renal desenvolvida pelos doentes do grupo II. Dos quatro doentes que desenvolveram doença renal, um deles foi devido a nefropatia diabética (dado concluído posteriormente ao estudo). Dos restantes
22
três doentes, é curioso observar que apenas um fez tenofovir. Isto significa que a doença renal dos outros dois doentes não teve como causa a nefrotoxicidade medicamentosa.
Por outro lado, doentes sob TARVc eficaz e mantida indefinidamente encontram-se num estado de infeção crónica por VIH onde apresentam inflamação crónica, envelhecimento prematuro e distúrbios metabólicos, como dislipidémia, hipertensão e diabetes, condições associadas a doença renal crónica [18]. Assim, o achado de que a incidência de doença renal foi maior no grupo com um quociente CD4/CD8 baixo apoia a hipótese de que nestes doentes existe uma disfunção imunitária e imunosenescência mais marcadas [4, 7], especialmente nos dois doentes que nunca fizeram tenofovir.
Relativamente à incidência de neoplasias nestes doentes, verificou-se que aqueles com um quociente CD4/CD8 baixo apresentam uma maior tendência para o seu desenvolvimento, apesar de tal não ter significância estatística. Para encontrar uma diferença estatisticamente significativa, talvez seja necessário um coorte com um maior número de casos e que seja seguido durante mais tempo. Estima-se que 10% dos doentes infetados por VIH desenvolvam neoplasias, sendo que é provável que as neoplasias não-SIDA venham a ganhar importância nos próximos anos à medida que a média de idades dos doentes VIH+ continua a aumentar [16]. Neste sentido, seria também importante distinguir as neoplasias definidoras das não definidoras de SIDA, o que não foi feito neste estudo. No entanto, nem todas as neoplasias não-SIDA mostram um aumento de prevalência nestes doentes, como é o caso da neoplasia da próstata, mama e colorrectal, verificando-se, contudo, um aumento de neoplasia anal, neoplasia
pulmonar, melanoma e carcinoma hepatocelular [16].
No que diz respeito à mortalidade, verificou-se um maior número óbitos quer totais quer por causas relacionadas com infeção por VIH no grupo I. Embora tal resultado não tenha atingido a significância estatística (7 vs 4%, p = 1,000; 4 vs 0%, p = 1,000), não deixa de ir contra o pressuposto inicial de que um quociente CD4/CD8 elevado seria associado a evoluções clínicas mais favoráveis. Esta inesperada diferença poderá ter resultado da expressão de vieses como uma tendência não estatisticamente significativa de antecedentes prévios mais marcados de HTA e neoplasias no grupo I. Os eventuais fatores de viés que não foram avaliados referidos anteriormente também poderão ter algum peso na maior mortalidade que o grupo I apresenta. Poder-se-á ainda
23
considerar a necessidade de uma amostra populacional maior para a observação da diferença estatisticamente significativa esperada.
No seguimento do último raciocínio, é ainda de salientar que algumas das comorbilidades avaliadas neste estudo, nomeadamente EAM e neoplasias, têm uma prevalência já por si baixa na população geral. Deste modo, é possível que o facto de não se terem detetado diferenças estatisticamente significativas entre grupos a nível dessas mesmas comorbilidades se deva ao facto de a amostra populacional não ser grande o suficiente. De facto, o coorte de cinquenta mil doentes no estudo de Trickey et al (2017) não foi suficiente para determinar uma associação entre o quociente CD4/CD8
ou contagem de T CD8+ e mortalidade em doentes infetados cronicamente por VIH. [20]
É possível que a quantidade de doentes requerida para se detetar as diferenças estatisticamente significativas procuradas seja incomportável no nosso panorama nacional. Assim, torna-se difícil avaliar corretamente a utilidade do quociente CD4/CD8 como marcador de prognóstico clínico para o seguimento destes doentes.
Paralelamente ao estudo do desenvolvimento de complicações não-SIDA, foi também estudada neste coorte a forma como o sistema imunitário dos doentes de ambos os grupos recupera da infeção por VIH enquanto sob supressão viral pela TARVc eficaz. Observou-se que o padrão de recuperação linfocitária, e consequente evolução do quociente CD4/CD8, é diferente entre os dois grupos, com os doentes do grupo I a apresentarem uma tendência progressiva e continuada de aumento de T CD4+ e diminuição de T CD8+, ao contrário do que acontece no grupo II onde esta evolução estabiliza em plateau após alguns anos. Esta estabilização dos valores é persistente e de valorizar, uma vez que se mantém por mais de quatro anos, um período de tempo considerável. Estes achados evidenciam então uma melhor capacidade de recuperação imunitária por parte dos doentes com um quociente CD4/CD8 elevado em comparação com aqueles cujo quociente é baixo. Ou seja, tratam-se efetivamente de dois grupos diferentes e que se comportam de forma distinta.
No contexto de infeção por VIH não tratada, a contagem de T CD8+ aumenta à
medida que a de T CD4+ diminui [21], com inversão do quociente CD4/CD8. Seria então
de esperar que após supressão viral por TARVc eficaz e consequente normalização da contagem de T CD4+, o mesmo acontecesse com a de T CD8+. No entanto, não é isto
24
que se verifica nos doentes do grupo II, uma vez que mantêm valores de T CD8+, tanto absolutos como percentuais, persistentemente elevados.
De acordo com alguns estudos em modelos animais [22], indivíduos em que se procedeu à depleção de linfócitos CD8+ apresentam uma infeção por VIH mais agressiva, permitindo inferir que a presença destas células determina melhor prognóstico clínico. O facto de se verificar o contrário no presente estudo pode indicar-nos que os valores aumentados de T CD8+ no grupo II não se devem a aumento da sua produção, mas sim a uma estimulação periférica aumentada e, logo, a uma maior ativação de linfócitos T. Por outras palavras, a normalização da contagem de T CD8+ no grupo I associada a melhor prognóstico clínico provavelmente não se deve a uma interrupção na sua produção, mas sim a uma ausência de estimulação periférica mantida. Deste modo, a produção de T CD8+ é a mesma em ambos os grupos, porém nos doentes com um quociente CD4/CD8 baixo existe mais estimulação periférica destas células.
Serrano-Villar et al (2014) reporta esta maior estimulação e ativação de T CD8+ em doentes com um quociente CD4/CD8 baixo, onde se verifica uma redução do compartimento de células T CD8+ naïve, um enriquecimento em células T CD8+ de memória efetoras (TEM) e de memória efetoras CD45RA+ (TEMRA) e níveis aumentados de T CD8+ HLADR+CD38+ (ativação) e T CD8+ CD28- e T CD8+
CD57+CD28- (senescência) [3].
Existem outros estudos que também fundamentam a ideia de que a ativação periférica de T CD8+ é um componente base da disfunção imunitária de doentes VIH+. Chevalier et al (2013) diz que o início precoce (nos primeiros seis meses) de TARVc reduz os níveis de T CD8+CD38+ para valores próximos de indivíduos não infetados, o que não acontece com doentes não tratados. [23] Jain et al (2013) também o afirma, demonstrando que os níveis de T CD8+CD38+ em doentes VIH+ não tratados são superiores aos de doentes VIH+ sob TARVc tardia, que por sua vez são superiores aos de doentes VIH+ sob TARVc precoce, os quais são ainda superiores aos de indivíduos não infectados. [9]
Deste modo, uma vez que o início precoce de TARVc mostrou reduzir os níveis de ativação de células T comparando com o início tardio [3, 9, 23], o facto de os doentes do grupo II terem iniciado terapêutica em média quatro anos mais tarde que os do grupo
25
I (tempo de TARVc eficaz 14 anos vs 10, p = 0,000) pode também contribuir para estimulação persistente de T CD8+ nestes doentes.
A infeção por VIH causa uma depleção massiva de linfócitos T CD4+ ao nível do gut associated lymphoid tissue (GALT). Seguidamente, nos estádios mais avançados da doença, ocorre ainda fibrose dos gânglios linfáticos com consequente disrupção da normal arquitectura do tecido e perda da capacidade de manter a população de linfócitos T CD4+. Enquanto a repopulação de T CD4+ no sangue periférico pode ser substancial
com TARVc, o mesmo já não acontece no GALT e gânglios linfáticos [24]. A
repopulação linfocitária nestes tecidos linfoides é bastante baixa e o grau em que são destruídos no início da infeção por VIH vai determinar a capacidade de recuperação de T CD4+ que os doentes apresentam após iniciarem TARVc. Deste modo, a fraca capacidade de recuperação de T CD4+ que os doentes com quociente <0,9 apresentam poderá ser explicada por um reservatório linfocitário à partida menor do que aqueles com um quociente CD4/CD9> 1,2.
Assim, doentes sob supressão viral por TARVc eficaz com um quociente CD4/CD8 <0,9 provavelmente apresentam simultaneamente uma fraca capacidade de recuperação de T CD4+ e uma ativação persistente de T CD8+, em oposição aos doentes com quociente CD4/CD8> 1,2 onde se verifica o contrário.
Dentro da amostra inicial de doentes incluídos no presente estudo, constatou-se que houve alguns que não mantiveram o quociente CD4/CD8 determinado inicialmente ao longo dos oito anos de observação. No grupo II, a reversão do quociente CD4/CD8 de 0,9 para 1,2 verificou-se em três dos 29 que mantiveram TARVc eficaz, o que corresponde a uma taxa de reversão de 1,4%/ano. Esta observação revela que apesar o quociente CD4/CD8 definir grupos efetivamente diferentes entre si, estes grupos provavelmente não são estáticos, sendo sim um processo dinâmico em que pode existir progressão de um grupo para o outro. Dado que os doentes do grupo II tinham menos tempo de TARVc no início do período de observação, coloca-se a questão de se esta reversão do quociente CD4/CD8 ao longo dos sete anos se possa dever ao facto de com o passar do tempo estes doentes alcançarem o mesmo tempo de TARVc que os do grupo I.
Face a esta possibilidade de reversão do quociente CD4/CD8 com o passar do tempo em doentes sob TARVc mantida, coloca-se ainda a questão de a elevação do
26
mesmo poder eventualmente ser nestes doentes um marcador indireto de diminuição/recuperação progressiva do reservatório viral, ou se por outro lado, apenas reflete uma menor desregulação imunitária. Isto é, continua por esclarecer se quociente CD4/CD8 poderá avaliar indiretamente o estado do reservatório viral e/ou o grau de desregulação imunitária.
27
Conclusão
O presente trabalho, um estudo prospetivo com uma amostra relativamente pequena, embora com um tempo de seguimento considerável, não demonstrou diferenças significativas no que diz respeito ao desenvolvimento da maioria das complicações não-SIDA e mortalidade entre os dois grupos definidos com base no quociente CD4/CD8. A única exceção foi a maior taxa de doença renal nos doentes com quociente CD4/CD8> 0,9, suportando a ideia de que a inflamação persistente é um processo desfavorável.
Foi também demonstrado que os dois grupos são diferentes em termos das capacidades dos respetivos T CD4+ e T CD8+ e que esta diferença se mantém com o passar dos anos. Permanece a questão sobre qual o motivo por detrás deste diferente comportamento linfocitário dentro de doentes VIH+ sob TARVc eficaz. No entanto, há uma pequena percentagem de doentes que reverte o seu quociente CD4/CD8, mostrando que se trata de um processo dinâmico.
Apesar das suas limitações, o presente estudo suporta a ideia de que um quociente CD4/CD8 baixo possa talvez ser um marcador de doentes em maior risco de desenvolver certas complicações não-SIDA. Deste modo, este marcador poderá ter algum relevo na monitorização de doentes VIH+ sob TARVc, podendo eventualmente identificar a necessidade de intervenções terapêuticas específicas, como por exemplo terapias imunomoduladoras que contrariassem a ativação imunitária persistente que estes doentes apresentam.
O presente estudo poderá ser considerado um estudo-piloto para que um novo e diferente estudo seja planeado, o qual necessitará de um coorte e tempo de observação maiores, de um registo criterioso das variáveis analisadas e de outras que não o foram desta vez e da eventual utilização de valores de quociente CD4/CD8 mais extremos de modo a melhor segregar os grupos estudados, especialmente considerando que o EAM e as neoplasias são ocorrências relativamente raras na população geral.
28
Referências bibliográficas
1. Paixão, M.T¸ Pádua, E. Epidemiologia da infecção por VIH e da sida – impacto mundial. Em: Antunes, F., Manual sobre a SIDA. 4th ed., Permanyer Portugal, Lisboa; 2011; 79
2. Espada de Sousa, A., Vitorino, R. Imunopatogenese e resposta imunitaria. Em: Antunes, F., Manual sobre a SIDA. 4th ed., Permanyer Portugal, Lisboa; 2011; 56-69
3. Serrano-Villar, S., Sainz, T., Lee, S.A., Hunt, P.W., Sinclair, E., Shacklett, B.L., et al. (2014) HIV-Infected Individuals with Low CD4/CD8 Ratio despite Effective Antiretroviral Therapy Exhibit Altered T Cell Subsets, Heightened CD8+ T Cell Activation, and Increased Risk of Non-AIDS Morbidity and Mortality. PLoS Pathogens, 10, 1–15.
4. Lu, W., Mehraj, V., Vyboh, K., Cao, W., Li, T. and Routy, J.P. (2015) CD4:CD8 ratio as a frontier marker for clinical outcome, immune dysfunction and viral reservoir size in virologically suppressed HIV-positive patients. Journal of the International AIDS Society, 18, 1–9.
5. Günthard, H.F., Saag, MS., Benson, C.A., Rio, C., Eron, J.J., Gallant, J.E., et al. (2016) Antiretroviral treatment and prevention of adult HIV infection: 2016 Recommendations of the International Antiviral Society-USA panel. JAMA - Journal of the American Medical Association, 316, 191–210.
6. Deeks, SG; Lewin, SR; Havlir, D. (2013) The End of AIDS: HIV Infection as a Chronic Disease. Lancet, 382, 1525–1533.
7. Deeks, S.G. (2011) HIV Infection, Inflammation, Immunosenescence, and Aging. Annual Review of Medicine, 62, 141–155.
8. Deeks, S.G., Tracy, R. and Douek, D.C. (2013) Perspective Systemic Effects of Inflammation on Health during Chronic HIV Infection. Immunity, 39, 633–645. 9. Jain, V., Hartogensis, W., Bacchetti, P., Hunt, P.W., Hatano, H., Sinclair, E., et al.
(2013) Antiretroviral therapy initiated within 6 months of HIV infection is associated with lower T-cell activation and smaller HIV reservoir size. Journal of
29
Infectious Diseases, 208, 1202–1211.
10. Moir, S. and Fauci, A. (2009) B cells in HIV infection and disease. Nature Reviews Immunology, 9, 235–245.
11. Sauce, D., Elbim, C. and Appay, V. (2013) Monitoring cellular immune markers in HIV infection: from activation to exhaustion. Current Opinion in HIV and AIDS, 8, 125–131.
12. Bruno, G., Saracino, A., Monno, L. and Angarano, G. (2017) The revival of an ‘ old ’ marker : CD4 / CD8 ratio. Aids reviews, 19, 81–88.
13. Euser, A.M., Zoccali, C., Jager, K.J. and Dekker, F.W. (2009) Cohort studies: Prospective versus retrospective. Nephron - Clinical Practice, 113, 214–217. 14. Departamento de Doenças Infeciosas do INSA - Unidade de Referência e Vigilância
Epidemiológica; Programa Nacional para a Infeção VIH/SIDA, Direção-Geral da Saúde. (2017) Infeção VIH/SIDA: a situação de Portugal a 31 de dezembro de 2016. Lisboa: Instituto Nacional de Saúde Doutor Ricardo Jorge (INSA, IP). 15. Serrano-Villar, S., Pérez-Elías, M.J., Dronda, F., Casado, J.L., Moreno, A., Royuela,
A., et al. (2014) Increased risk of serious non-AIDS-related events in HIV-infected subjects on antiretroviral therapy associated with a low CD4/CD8 ratio. PLoS ONE, 9, 1–8.
16. Serrano-Villar, S., Gutiérrez, F., Miralles, C., Berenguer, J., Rivero, A., Martínez, E., et al. (2016) Human immunodeficiency virus as a chronic disease: Evaluation and management of nonacquired immune deficiency syndrome-defining conditions. Open Forum Infectious Diseases, 3, 1–15.
17. Wyatt, C.M. (2017) Kidney Disease and HIV Infection. Top Antivir Med, 25, 13–16. 18. Cohen, S.D., Kopp, J.B. and Kimmel, P.L. (2017) Kidney Diseases Associated with Human Immunodeficiency Virus Infection. New England Journal of Medicine,
377, 2363–2374.
19. Palella, F. (2011) Renal disease in HIV infected Individuals. Curr Opin HIV AIDS,
30
20. Trickey, A., May, M.T., Schommers, P., Tate, J., Ingle, S.M., Guest, J.L., et al. (2017) CD4:CD8 Ratio and CD8 Count as prognostic markers for mortality in human immunodeficiency virus-infected patients on antiretroviral therapy: The antiretroviral therapy cohort collaboration (ART-CC). Clinical Infectious Diseases,
65, 959–966.
21. Margolick, J.B., Muñoz, A., Donnenberg, A.D., Park, L.P., Galai, N., Giorgi, J. V., et al. (1995) Failure of t-cell homeostasis preceding AIDS in HIV-1 infection. Nature Medicine, 1, 674–680.
22. Schimtz, J.E., Kuroda, M.J., Santra, S., Sasseville, V.G., Simon, M.A., Lifton, M.A., et al. (1999) Control of viremia in simian immunodeficiency virus infection by CD8+ lymphocytes. Science, 283, 857–860.
23. Chevalier, M.F., Petitjean, G., Dunyach-Rémy, C., Didier, C., Girard, P.M., Manea, M.E., et al. (2013) The Th17/Treg Ratio, IL-1RA and sCD14 Levels in Primary HIV Infection Predict the T-cell Activation Set Point in the Absence of Systemic Microbial Translocation. PLoS Pathogens, 9, 1–13.
24. Schacker, T. (2008) The role of secondary lymphatic tissue in immune deficiency of HIV infection. Aids, 22, 13–18.
31
Anexos
C Ë N T R O F I O S P I T Â L Â R LISBO,A NÕRTE, EPT
f f i H o s P r r A L D E
ffi
e'
SANTAú,ARïÂ
ffiffi
ffi i-ìi:x'pitai Iluïid*\íale rrï-r
Prof. Doutor João Lobo Antunes .
. .
Vknfrç**enb
. 1
Prof. Doutora Maria Luísa Figueira:
Exmo. Senhor Dr. Robert Boduro
Serviço de Doenços Infecciosos Cenlro Hospitclor lisboo Norte, E.P.E.
Lisboo, 29 de Novembro de 2010
Prof. Doutor Carlos Calhaz Jorge Dra. Elisa Pedro
Padre Fernando Sampaio Dra. Gabriela Martins Mendes Dra. GÍaça Nogueira
Mestre Enf. lsabel Côrte-Real Dr. Mário MiguelRosa
Assunlo: Estudo clínico "Actividode cifotóxico dEs cétulqs TCDS* em infeclodos por VIH-I
sob lercpêuticq onfi-retrovírico.e com um quociente de CD4/CD8 superior q um"
Pelo presente iniormomos que o proiecÌo citodo em epígrofe obteve, nq reuniõo reolizqdo em 3 de Novembro de 201O, porecer fqvoróvel do Comissõo. de Ético.
Mqis se informo que o referido Estudo foi enviodo oo Sr. Director Clínico, Prof. Dr. Joõo Áhoro Correio do Cunho, c fim de obter o ouÌorizoçõo finol poro o suo reolizoçõo.
Solientqmos que iniciodo o ono de 2010, foi decidido no primeiro reuniõo plenóriq, oo obrigo e no ômbito dos competêncios do Comissõo, esto ser semestrqlmente ocïuqlizodo em reloçõo qo desenvolvimento dos estudos fovorovelmente ovqliqdos e informodo do doto de conclusõo dos mesmos que deveró ser ocomponhodo de um relotório finol.
Com os melhores cumprimentos,
E Sqúde
@
Érq4
ffi
C I N T R O H O S P I T A L A R L I 5 B O A N O R Ï E , Ë P E
/Mc
Av. Professor Egas Moniz 1649-035 LTSBOA
Tel:217 805 000 - Fax:217 805 610 \ivì,vw.chln Bt
ffi i ï*:;pital I ' r r l i r i t l \ l i r i t ' t r t t :
Com
os melhores
cumprim
entos,fifua'$
/
Alameda das Linhas de Torres, 117 1769-001 LTSBOA Tel: 217 548 000 - Fax:217 548215 \ ì\;: ^-!, ' \r\, a\ ^&rÀ m.& - x i l r Y E n l w H o s P r r A L D E
T
SANITAMARIA
Exmo. Senhor Dr. Robert BaduraServiço de Doenças Infecciosas Centro Hospitalar Lisboa Norte, EPE
ReflPCA---a5-DEZ20.1O-O888
Assunto: Estudo Clínico "Actividade citotóxica das células TCDS* em infectados por VIH-1 sob terapêutica anti-retrovírica e com um quociente de CD4/ CDB superior a:uÍí' .
Tenho o prazer de inÍormar V. Exa. que o estudo clínico em epígrafe foi aprovado pela Comissão de Ética paraa Saúde do CHLN, € aatorizado pelo Conselho de Administração em 14 de DezembroJe 2010.
te;Co Conselho de Administração