Universidade de Pernambuco
Programa de PósGraduação em Engenharia de Sistemas
-PPGES
BIOSSENSORES: FUNDAMENTOS,
POTENCIALIDADES E APLICAÇÕES
Profa. Dra. Rosana Fonseca
Objetivo Geral:
Fornecer subsídios para que os alunos sejam capazes de
entender e aplicar os princípios e fundamentos dos
biossensores aliados às técnicas eletroanalíticas na
realização de análises quantitativas e qualitativas em
diferentes meios com a utilização de diferentes
superfícies eletródicas.
Objetivos Específicos:
Introduzir os fundamentos de técnicas eletroanalíticas, sensores e
biossensores;
Demonstrar a influência da otimização das técnicas
eletroanalíticas nas análises e na obtenção do limite de detecção;
Discutir as diferentes possibilidades de uso das superfícies eletródicas;
O uso de novos dispositivos, como os eletrodos quimicamente modificados;
Demonstrar a importância da etapa de preparação da amostra e o tempo total de análise;
Objetivos Específicos:
Sensores químicos/eletroquímicos
Definição
Classificação
Células eletroquímicas
Eletrodo de trabalho Eletrodo de referência Eletrodo auxiliar
Eletrodos quimicamente modificados
Métodos eletroquímicos de análise
Teste de eletroatividade e determinação do potencial de trabalho
Escolha da técnica eletroanalítica
Otimização dos parâmetros da técnica
Construção de curvas de trabalho e determinação do limite de detecção (LD) e limite de quantificação (LQ)
Objetivos Específicos
Biossensores
Definições dos biossensores
Desenvolvimento dos biossensores Classificação dos biossensores
Escolha do material biológico
Formas para imobilização de biomoléculas Escolha do transdutor mais adequado;
Sensores químicos/eletroquímicos e biossensores
A Idéia Geral de um Método Instrumental
Métodos eletroquímicos
i trás a informação
sobre a concentração
t i
i
Fonte de tensão
Métodos eletroanalíticos
Métodos analíticos baseados em medidas elétricas;
Medidas eletroquímicas são específicas para diferentes estados de oxidação;
Métodos de alta sensibilidade;
Instrumentação relativamente barata e simples; permite automação;
Informações a respeito da atividade;
Microeletrodos – análise in vivo;
Biossensores;
Considerações práticas
Eletrodos
Celas eletroquímicas
Eletrólito suporte
instrumentação
Sensores químicos
Dispositivos que transformam uma informação
química de uma determinada espécie em um
sinal analítico.
Reconhecimento
relacionado com uma
interação química
Transdução
conversão do sinal
físico-químico
Sensores químicos
Características de
um sensor ideal:
Resposta rápida e reversível;
Elevada sensibilidade, seletividade e reprodutibilidade;
Sensores químicos
Classificação de acordo
com a transdução
Térmicos:
utilizam o calor como parâmetro físico.
Eletroquímicos:
se baseiam na transferência de elétrons.
1.
Amperométricos:
medem a corrente produzida em uma
reação química.
2.
Potenciométricos:
medem o
potencial significativo no
eletrodo operante por acúmulo da carga na superfície do
eletrólito.
3.
Condutimétricos:
medem a condutividade.
Sensores químicos
Óticos
:
são baseados nas mudanças das propriedades
ópticas do reagente imobilizado através de medidas de
reflexão, dispersão, difusão de luz, refração e difração.
Piezoelétricos (acústicos):
baseiam-se na diferença de
frequência de vibração de um cristal devido à deposição de
massa na superfície de um eletrodo. É detectada por um
frequencímetro e convertida em unidades de massa.
Sensores eletroquímicos
Muito utilizado
Potenciométricos: fazem medidas da diferença de potencial
entre dois eletrodos imersos em uma solução.
Célula eletroquímica = eletrodos + solução
Potencial:
eletrodo de referência
potencial constante
Sensores químicos
Amperométricos: fazem medidas da diferença de corrente
entre 2 eletrodos imersos em uma solução.
Célula eletroquímica = eletrodos + solução
Potencial constante
Corrente varia
A corrente varia proporcionalmente à
concentração de um analito de interesse
Sensores químicos
Amperométricos:
Três eletrodos:
Eletrodo de
referência (potencial
constante; Ag/AgCl)
Eletrodo auxiliar ou
contra-eletrodo (ex:
Pt)
Eletrodo de trabalho
(ex: ouro; carbono
vítreo)
Ag magnéticoN
2 Potenciostato/galvanostato Registrador/ computador2 1 3
Sensores químicos
Amperométricos: tipos
Sensores químicos
J. Chil. Chem. Soc, 57, No4 (2012), págs.: 1336-1139
Amperométricos: medidas
Sensors (Basel). 2009; 9(7): 5368–5378.
Sensores químicos
Mais utilizados
Tipo de Sensor Potenciométrico Amperométrico Modo de operação Medida de potencial a
i=0
Medida de corrente Cinética do eletrodo Deve ser rápida O potencial do eletrodo
conduz a reação Resposta Potencial é função
exponencial da concentração
Corrente é função linear da concentração
Voltametria/Polarografia
A polarografia se enquadra na voltametria.(Koltoff e Laitinen).
1922: Jaromir Heyrowsky (Nobel 1959) apresentou pela primeira vez a polarografia.
Inicialmente, uma célula de dois eletrodos (indicador ou de trabalho e referência) era utilizada. O potencial variava linearmente entre o potencial inicial e o final e a corrente que fluía entre os dois eletrodos era monitorada.
1. A voltametria envolve a medida de corrente obtida sob condições que favorecem a polarização do eletrodo de trabalho, em função do potencial aplicado.
Celas eletroquímicas
Eletrodos de trabalho
Eletrodo de ouro Eletrodo de
Instrumentação
Frequencímetro Potenciostato + microbalança de cristal de quartzo (EQCM)
Ag magnético
N
2Potenciostato/galvanostato
Registrador/ computador
2 1 3
1.Elet. de trabalho 2.Elet. de referência 3.Elet. auxiliar Pt (fio)
Instrumentação:
1. Potenciostato/galvanostato acoplado a um
microcomputador dotado com o programa GPES.
Célula Eletroquímica:
1. Compartimento único e/ou encamisada para controle da temperatura
2. Tampa em Teflon®
adaptada para encaixe dos eletrodos
Eletrodos:
1. Referência: Ag/AgCl (em KCl 3,0 mol L-1)
Influência do O2 dissolvido em solução
Quando se trabalha na região catódica, há necessidade da remoção do
oxigênio atmosférico dissolvido nas soluções. Isto porque o O2 é eletroativo e produz duas ondas voltamétricas, uma com potencial ao redor de -0,10V
vs SCE e a outra com potencial ao redor de -0,75V vs SCE.
A primeira onda catódica é devido à reação:
O2+ 2H2O + 2e- H
2O2+ 2OH
-Os gases mais usados para remover o O2 das soluções são: N2, Ar e He. O Nitrogênio é o mais usado por ser mais barato e poder ser facilmente
obtido com pureza alta.
A segunda onda catódica (E~ -1,0V vs SCE)é devido à reação:
-Métodos eletroquímicos de análise
Surgem como alternativa simples e de baixo custo.
Possibilitam a análise de amostras contendo partículas sólidas
dispersas.
Medidas confiáveis
pré-tratamento mínimo da
amostra; monitoramento in situ.
Concentração do analito
Corrente, potencial,
condutividade, resistência e
carga elétrica.
Técnicas eletroanalíticas
Impedimétrico
TEMPO
EQCMEQCMPOTE
NC
IAL
Principais técnicas eletroanalíticas
Polarografia Voltametria cíclica Voltametria de redissolução anódica
Técnicas eletroanalíticas
Polarografia
Voltametria cíclica
Voltametria de redissolução anódica
Amperometria
Voltametria de pulso diferencial
Técnicas eletroanalíticas
Polarografia
Voltametria cíclica
Voltametria de redissolução anódica
Amperometria
Voltametria de pulso diferencial
Técnicas eletroanalíticas
Polarografia
Voltametria cíclica
Voltametria de redissolução anódica
Amperometria
Voltametria de pulso diferencial
Técnicas eletroanalíticas
Voltametria cíclica
Clássica para:
Testes de eletroatividade
Estudos mecanísticos
-0.2 0.0 0.2 0.4 0.6 0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 Corrente/ A
Técnicas eletroanalíticas
Voltametria de onda quadrada - SWV
A possibilidade de se obter correntes de pico bem definidas em experimentos executados em alta velocidade de varredura, reflete na melhora da sensibilidade da técnica. A corrente faradaica pode ser coletada em um intervalo de tempo adequado para que a contribuição da corrente capacitiva tenha se minimizado.
É possível, pela observação dos sinais das varreduras direta e inversa, se obter as informações análogas àquelas obtidas utilizando-se a VC.
Dá informações sobre a cinética e mecanismo do processo eletródico.
Técnicas eletroanalíticas
Teste de eletroatividade.
Escolha da técnica.
Variação dos parâmetros da técnica.
Curvas de trabalho e limite de detecção - LD.
Comparação com técnicas convencionais (ex.: Elisa, Cromatografia).
Técnicas eletroanalíticas
A eletroquímica estuda
São reações químicas onde ocorre troca de elétrons entre os reagentes, resultando na redução de um deles e na oxidação de outro.
Oxidante: a espécie que recebe elétrons (ocorre aumento no estado de oxidação;
Redutor: a espécie que doa elétrons (ocorre diminuição no estado de oxidação)
Reação Redox: A + B A+ + B
-Obs. Não se pode dizer que uma espécie é oxidante ou redutora, pois seu
comportamento depende do meio em que está presente. Ela só será um redutor se no meio reacional houver uma outra espécie que possa receber elétrons.
Durante uma reação de oxidação-redução ocorre variação do estado de oxidação das espécies envolvidas na reação.
As reações redox podem ser consideradas em duas semi-reações separadas
Exemplo:
Semi-reações:
Redução: ClO- + 2e- Cl- agente oxidante
Oxidação: NO2- NO
3- + 2e- agente redutor
Reação global: ClO- + NO
2- NO3- + Cl
-Estados de oxidação X
A reação pode ser qualitativamente realizada pela escolha adequada do potencial (ou energia) aplicado na superfície do eletrodo.
Neste caso, em uma solução aquosa
contendo as espécies eletroativas “A” e “B”, apenas A seria oxidada.
Porém, se o potencial for alto o suficiente, ambas “A” e “B”serão oxidadas na superfície do eletrodo.
Controle de reações redox
Em uma reação sobre um eletrodo, basicamente, pode-se controlar duas variáveis:
1. Potencial: pode-se adequadamente aplicar um potencial específico (ou energia) no eletrodo e, com isso, é possível escolher qual a reação que será realizada na superfície do eletrodo.
2. Corrente: pode-se controlar a taxa de uma reação redox, ou seja, fixando o valor de corrente (número de elétrons por unidade de área) que deverá ser fornecida (no caso de uma reação de redução) ou recebida (reação de oxidação) em um determinado intervalo de tempo. Este tipo de reação também é conhecida como galvanostática = corrente constante.
Controle de reações redox
Célula Galvânica:
Células onde ocorre a produção de energia
O Potencial de 1,1 V indica que o sistema está longe do equilíbrio. Assim, a reação prosseguirá no sentido da dissolução do eletrodo de Zn e depósito de Cu até que o equilíbrio seja atingido, ou seja, o potencial indicado no voltímetro seja ZERO volts.
Célula Eletrolítica:
Contrariamente às células galvânicas,
as células eletrolíticas consomem
energia
Assim, se no caso anterior conectarmos o terminal negativo de uma fonte de tensão ao eletrodo de Zn e aplicarmos um potencial maior que 1,1 V, forçaremos a reação a prosseguir no sentido inverso, ou seja, o cobre do anodo se dissolverá e Zn se depositará no catodo:
Cu0 + Zn2+ Cu2++ Zn0
Quando um metal é imerso em uma solução aquosa, imediatamente se inicia a reação, com formação dos íons em solução e com a
permanência dos elétrons no metal.
Elétrons carregam eletricamente o metal;
Criação de um campo elétrico;
Íons carregados positivamente, tendem a ficar retidos na vizinhança do metal;
Formação da dupla camada elétrica;
O metal é responsável pela formação da dupla camada e é chamado de eletrodo.
Dupla Camada Elétrica: transferência de cargas na interface eletrodo-eletrólito para que haja a red./ox. de um determinado íon sobre a superfície do eletrodo.
Na interface metal-solução há uma distribuição de cargas elétricas tal que uma diferença de potencial se estabelece entre o metal e a solução. A magnitude dessa diferença de potencial é dependente do sistema em consideração.
O potencial gerado por uma célula eletroquímica, depende:
• Temperatura absoluta;
• Concentração das espécies envolvidas;
• Pressão parcial (no caso de gases).
Ao contrário da técnica galvanostática, a escolha de um potencial adequado pode fornecer um maior controle da reação a ser desenvolvida no eletrodo.
Potencial de eletrodo
Para que ocorra o equilíbrio entre os potenciais químicos, ocorre a difusão de A para a superfície do eletrodo e a difusão de M para o seio da solução.
Potencial de eletrodo
A cronoamperometria é a técnica amperométrica que mede a
corrente que flui através do eletrodo de trabalho em função do tempo em um potencial constante.
Esse fluxo de corrente está correlacionado com o gradiente de
concentração das espécies oxidadas ou reduzidas na superfície do eletrodo de trabalho e é calculada por meio da equação de Cottrell:
Onde: i é a corrente a um tempo t, n é o número de elétrons, F é a constante de Faraday, A é a área do eletrodo, C é a concentração das espécies oxidadas e D é o coeficiente de difusão das espécies oxidadas.
Esta técnica, a cronoamperometria, é largamente empregada em
eletroanalítica, onde a intensidade de corrente é diretamente proporcional à concentração da espécie eletroativa no seio da solução.
O valor do potencial gerado por uma célula eletroquímica, depende em maior parte:
Natureza dos eletrodos
Cada eletrodo possui um potencial característico associado a um
determinado processo redox, determinado por condições padrão.
O potencial das espécies redox depende da:
(1)Temperatura padrão 25 °C (298,15 K);
(2)Concentração unitária para todas as espécies e solução envolvidas; (3)Pressão de 1 atm para todas as espécies gasosas envolvidas.
Série eletroquímica
–
potencial padrão de eletrodo
Condições padrão:
P = 1 atm; T = 25oC; [H+] = 1 M.
Quanto mais positivo o potencial
de redução de uma reação, quando comparada com outra
reação, maior é a tendência desta reação ocorrer neste sentido.
Seja EMo e EM+ o potencial do metal num ponto remoto da solução.
Assim, a diferença de potencial dentro da dupla camada será:
EM = EMo – EM+
A medida do valor absoluto dessa diferença de potencial é inviável,
pois qualquer que seja o sistema de medida adotado, o mesmo implicará a imersão dentro da solução de um terminal metálico que irá dar origem a um outro eletrodo. O que se faz é medir uma diferença de potencial relativa com relação a um eletrodo de referência.
Convencionou-se, assim, definir um eletrodo de referência padrão
(universal), de potencial “zero” (0,000 V), com relação ao qual todas as medidas de potencial que seriam referidas, porém, não necessariamente medidas. Trata-se do eletrodo padrão de hidrogênio, que consiste de uma barra de platina platinizada imersa em uma solução ácida padrão (1 mol/L), mantida a 25oC e através da qual se
Houve necessidade da escolha de um eletrodo de referência, pois
não era possível a determinação do potencial isolado de uma meia-célula.
O eletrodo padrão de hidrogênio (EPH) foi escolhido como eletrodo
de referência universal, ao qual foi atribuído o potencial de 0,000 V em qualquer temperatura.
Potencial padrão de eletrodo
Eletrodo gasoso, onde uma placa de platina
platinizada atua como suporte para o gás hidrogênio, fornecido sob pressão de 1 atm
A solução desta meia-célula é formada por H2SO4
A outra meia-célula é formada por um eletrodo
metálico (ex. Zn0), imerso em solução de seus íons
E° = 0,000 V tanto para reação de redução como
O potencial do eletrodo em teste, é denominado potencial padrão de
redução do respectivo eletrodo (E°Mn+/M).
Este potencial será positivo sempre que este eletrodo possuir maior
tendência para redução que o eletrodo de hidrogênio, ou seja, a reação global da célula é:
Mn+
(aq) + n/2 H2(g) M(s) + n H+(aq) EPH = anodo
Caso o eletrodo de hidrogênio tenha maior tendência para redução
que o eletrodo em teste, tem-se a reação global é:
M(s) + n H+
(aq) Mn+(aq) + n/2 H2(g) EPH = catodo
O potencial global da célula é definido pela fórmula:
Assim, para o primeiro caso, tem-se:
E°célula = E°Mn+/M – 0,000 E°
célula = E°Mn+/M = positivo
E°célula = positivos reação espontânea
Para o segundo caso:
E°célula = 0,000 – E°Mn+/M E°
célula = E°Mn+/M = negativo
E°célula = negativos reação não-espontânea
A espontaneidade de uma reação está relacionada com a energia livre. As seguintes relações devem ser avaliadas para se determinar se uma
reação eletroquímica será ou não espontânea.
G° = - nFE°
G° < 0 – reação espontânea, quando E° > 0 G° > 0 – reação não espontânea, quando E°<0 G° = 0 – reação em equilíbrio, quando E°=0
Quanto mais positivo o valor de E° da célula, mais negativo torna-se o
valor de ΔG°. Isto é, quanto mais afastadas as semi-reações estiverem na escala de potencial, mais fortemente a reação será favorecida no sentido de formação dos produtos.
Potencial de Eletrodo fora das Condições Padrão
Pode-se ter a célula eletroquímica em temperaturas diferentes de 25°C e/ou concentrações diferentes da unidade para as espécies químicas envolvidas nas reações eletródicas;
Nestes casos, o potencial da célula ou da semi(meia)-célula será definido pela equação de Nernst, que é:
Ecélula = potencial da célula nas condições experimentais
E°célula = potencial da célula nas condições padrão
R = constante dos gases ideais = 8,314 J mol L-1 K-1
T = temperatura absoluta = Kelvin
F = constante de Faraday = 96485 C (um Faraday é a quantidade de carga elétrica transportada por um mol de elétrons)
n = número de elétrons envolvidos na reação redox equilibrada
Q = quociente da reação (expressão que relaciona as concentrações dos produtos e dos reagentes elevadas a potência apropriada, conforme definido pelos coeficientes estequiométricos na equação global balanceada.
A espontaneidade de reação e o potencial
Tem-se que:
Potencial do eletrodo fora das condições padrão
Ecélula = E°célula - (RT/nF) x ln Q qualquer temperatura
ou
Ag/AgCl, KCl saturado 0,222 V Depósito Ag/AgCl
Solução de KCl (3,0 M) Fio de platina
Extremidade porosa (troca de íons)
Depósito Ag/AgCl
Solução de KCl (3,0 M)
Fio de platina
Extremidade porosa (troca de íons)
Eletrodo de referência
Medida de corrente é realizada entre o eletrodo de trabalho e o auxiliar
Metal condutor e inerte
Placa ou fio de Platina
Contato
Tubo de vidro
Vidro fundido
Resina epóxi
Fio de cobre
Ponto de solda
Terminação de platina
Quando um íon se move de um lugar para outro, o transporte de massa no interior do eletrólito é descrito por três diferentes processos:
Difusão: movimento espontâneo dos íons sob influência do gradiente de concentração, ou seja, de regiões de maior concentração para regiões de menor concentração, tendendo a anular o gradiente de concentração.
Migração: movimento das partículas carregadas que estão sob influência de um campo elétrico externo.
Convecção: transporte de massa devido ao gradiente de densidade do fluido (convecção natural), ou devido a movimentos de vibração e rotação dos eletrodos (convecção forçada)
Transporte de massa
Os processos de difusão e convecção podem ocorrer para todas as espécies presentes no eletrólito, entretanto a migração ocorre apenas para partículas eletricamente carregadas .
Durante o processo de redução dos íons no catodo (considerando íons positivos e a célula eletrolítica) há uma diminuição na concentração na interface, levando ao surgimento do gradiente de concentração, que por sua vez, é responsável pelo processo de difusão dos íons da região mais concentrada para a região menos concentrada.
O fluxo das espécies pode ser obtido pela primeira lei de Fick para a difusão, e pode ser escrita como:
Onde:
𝐽(𝑥) é o fluxo das espécies (𝑚𝑜𝑙 𝑠−1𝑐𝑚−2) 𝐷 é o coeficiente de difusão (𝑐𝑚2𝑠−1)
𝜕𝐶 ( 𝑥) / 𝜕𝑥 é o gradiente de concentração (𝑚𝑜𝑙 𝑐𝑚−4)
A lei de Fick descreve bem o fluxo das espécies quando o gradiente de
concentração é o parâmetro de maior relevância na equação do fluxo das espécies.
Entretanto, na presença de um sobrepotencial aplicado externamente é
necessário considerar também o efeito da migração iônica, pois há fluxo de espécies devido à presença do campo elétrico. Isso leva a adição de um termo extra na lei de Fick, que pode ser reescrita como:
Onde o termo tN (i/nF) representa a contribuição da migração iônica no fluxo total e
tN = é o número de transporte
i = é a densidade de corrente (A 𝑐𝑚-2)
F = constante de Faraday (C mol-1)
Eletrólito suporte
Para que o efeito da migração iônica seja diminuído ou quase anulado, faz-se necessário utilizar um sal inerte, ácido ou base, escolhido de maneira apropriada para a faixa de sobrepotencial em que se deseja trabalhar
O sal é adicionado ao eletrólito em altas concentrações fazendo com que o número de transporte tenda a zero para as espécies eletroativas, pois o número de transporte representa a fração de corrente transportada por cada íon
Este número deve ser o menor possível para que o processo seja basicamente controlado por difusão
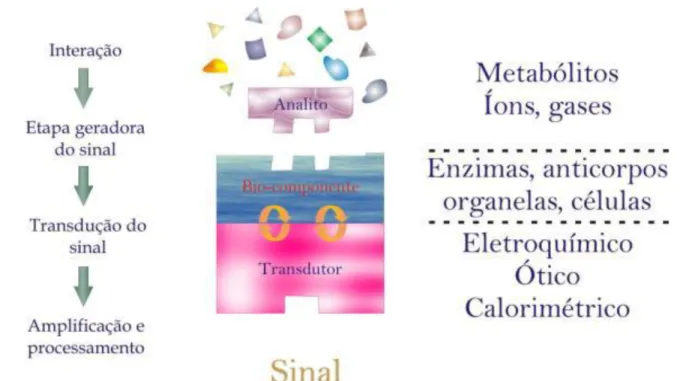
Biossensores
Problema enfrentado com o uso de sensores químicos tradicionais
Por que modificamos o eletrodo?
A modificação é efetuada para alcançar propriedades eletroquímicas diferentes do eletrodo
“puro”
Uma vez modificado, podemos alterar a composição/arquitetura do depósito para que estas “novas” propriedades sejam potencializadas
Estas propriedades são basicamente relacionadas com aspectos cinéticos da transferência
de elétrons (catálise) ou para que efeitos difusivos sejam aumentados
Economia de materiais e energia
Passivação da superfície (devido a adsorção de produtos da própria reação)
Alternativa simples e de baixo custo BIOSSENSORES
sores
IUPAC:” um biossensor é um dispositivo capaz de fornecer
informação analítica usando um elemento de
reconhecimento biológico o qual está em contato direto com um elemento de transdução”
Considerações
Componente biológico Subgrupo dos sensores químicos (reconhecimento)
Material biológico conectado a um transdutor
Converte um sinal biológico em sinal elétrico
Desaparecimento de reagente
Aparecimento do produto da reação entre o material
biológico e seu substrato
Analito Elemento de
Ilustração adaptada: MENDES, R. K. Tese (Doutorado)-Instituto de Química, Unicamp, 2006.
Nariz eletrônico: responsável pelo cheiro = instrumento
excepcionalmente sensível e seletivo, muito difícil de “imitar”
artificialmente.
Pode distinguir entre muitas substâncias químicas diferentes
qualitativamente e pode dar uma idéia geral de quantidade até limites muito baixos.
Os produtos químicos a serem detectados passam através da membrana
olfativa que são os componentes biológicos que detectam o substrato.
A resposta é um sinal elétrico que é transmitido para o cérebro por meio
dos nervos olfativos. O cérebro, então, traduz esta resposta na sensação que conhecemos pelo cheiro.
Língua: percepção de diferentes sabores = quimiorrecepção
Os receptores gustativos são ativados por substâncias químicas
presentes nos alimentos
Essa propriedade química está ligada ao aroma e sabor e ela
existe porque precisamos distinguir e classificar tudo que ingerimos
A maior quantidade de quimiorreceptores se encontra na língua, e
o que permite a diferenciação de sabor são os sensores dos terminais nervosos presentes nas papilas gustativas que nos permite degustar e diferenciar os mais diferentes sabores.
1º eletrodo enzimático - Clark e Lyons (1962)
Imobilização da enzima glicose oxidase entre duas membranas
O analito (glicose) e o oxigênio atravessam a primeira membrana para
reagir com a enzima
O oxigênio penetra na segunda membrana (permeável) e difunde até o
eletrodo (redução sobre a platina, -0,7V aplicado entre o catodo de Pt e o anodo de Ag = amperométrico)
[glicose] ~ diminuição da quantidade de oxigênio (consumido na reação
enzimática)
Histórico
Biosensors: an Introduction, 1997, Brian R. Eggins –Wiley, second edition
Reação:
Updike e Hicks (1967): melhoraram este biossensor (imobilização da
glicose oxidase por aprisionamento em matriz de poliacrilamida)
Guilbault e Montalvo (1969)
Construíram o primeiro biossensor potenciométrico para a uréia imobilizando a enzima urease em uma matriz de poliacrilamida sobre um eletrodo de vidro seletivo a íons amônio
A uréia é hidrolisada pela enzima urease, formando amônia e dióxido de
carbono. O potencial é proporcional a concentração de amônia, que é diretamente proporcional à concentração de uréia.
CO(NH2)2 + H2O CO2 + 2NH3
O eletrodo íon-seletivo de amônio é um eletrodo de pH de vidro modificado. A enzima é misturada a um gel revestido por uma membrana de rede de nylon que recobre o eletrodo. Ele é conservado em meio de outra membrana (diálise) .
Biossensores in vivo
Muitos experimentos foram realizados por meio da implantação de eletrodos no cérebro de animais vivos, para monitorar as mudanças nos níveis de dopamina
Biossensor para dopamina
A determinação quantitativa de dopamina é aumentada com a utilização de biossensores específicos para a dopamina, evitando assim, o efeito de matriz, como a interferência do ácido ascórbico
Biossensor construído com banana
Uma mistura simples de uma pequena quantidade de pó de grafite modificado com pó a base de banana e parafina líquida gera um biossensor para a
determinação de dopamina.
A dopamina é um derivado do catecol
A enzima polifenol oxidase presente na banana catalisa a oxidação do grupo
di-hidroxila, para formar quinona, na presença de O2
A redução eletroquímica da quinona gera novamente o catecol e a corrente
gerada é diretamente proporcional à concentração de dopamina. (Sidwell and Rechnitz, 1985; Wang and Lin, 1988).
Polifenol
oxidase -2 e
-+ 2H+
eletrodo
Dopamina
Analito ou substrato
Qualquer substância que é consumida ou produzida em um
processo bioquímico pode ser analisada por um biossensor.
Alguns exemplos são:
Açúcares fosfato
Uréia colesterol
Creatina penicilina
Etanol paracetamol
Ácido glutâmico aspirina
Ácido lático pesticidas*
Componente Biológico
A importância do componente biológico é que a sua interação com
o substrato é altamente específica, evitando interferências de outras substâncias presentes no sistema.
O componente biológico pode catalisar uma reação (ex. enzima –
substrato) ou ligar-se seletivamente ao substrato.
Podem ser considerados das seguintes formas:
Enzimas
Microorganismos (ex. bactérias e leveduras) Anticorpos
Ácidos nucléicos
Construção do biossensor
Envolve as seguintes etapas:
(1) Escolha do material biológico
(2) Imobilização do material biológico
(3) Escolha do transdutor mais adequado
Deve detectar apenas um reagente ou produto específico
Primeira etapa: Escolha do material biológico
Deverá reagir seletivamente com o analito de interesse
Purificada
Enzimas Tecido vegetal Extrato bruto
‡ Enzimas
Proteínas que funcionam como catalisadores biológicos
Uso crescente na química analítica alta sensibilidade e especificidade
eliminação do efeito de matriz
A reação enzimática para um único substrato pode ser representada
pela expressão:
E + S ES E + P
1 Região Fab
2 Região Fc
3 Cadeia pesada com um domínio variável (VH1) seguido por um domínio constante
CH1, uma região dobradiça e dois domínios
constantes (CH2 e CH3)
4 Cadeia leve com uma região de domínio variável (VL) e um constante (CL)
5 Sítio de ligação do antígeno (paratopo)
6 Regiões dobradiças
Componentes biológicos
‡ Anticorpos
Proteínas que se ligam especificamente a outras proteínas (antígenos) Uso crescente na química analítica alta sensibilidade e especificidade
eliminação do efeito de matriz
Stobiecka, e Hepel, Biosensors and
Bioelectronics 26 (2011).
Changes of apparent mass vs. time during binding of: (1) glutathione and (2) glutathione-capped AuNP, on a AuQC/AHT/Abmono/BSA modified gold piezoelectrode.
The design of an electrochemical and
nanogravimetric immunosensor with positive potential barrier for the detection of
glutathione-capped AuNP.
d a
b c S
N N C C S N N C C S S A u Au
S N
N C C
PBS buffer, pH9.0 AuNP
A u
SH SH S S
A u Au
PBS buffer, pH 7.2 Cystamine
NH2
H2N S S S NH2 S NH2 S NH2 S S A u Au
1,6-hexanedithiol HS SH 1. Glutaraldehyde 2. Anti-TnT O O 3. Glycine
Schematic of functionalized immunosensor
ag + ac
k
1ag - ac
k
2K
1K
2K
eq=
=
Ag - Ac
Componentes biológicos
‡ Ácidos nucléicos – DNA
Polímeros de nucleotídeos que apresentam estrutura em fita dupla
emparelhadas
Uso crescente na química analítica alta sensibilidade e especificidade
A reação de emparelhamento de bases obedece a exata seqüência de
Elemento de reconhecimento
Vantagens Desvantagens
Enzimas 1. formam complexos estáveis
com a espécie de interesse 2. são bastante seletivas
1. podem perder a atividade após imobilização
2. são estáveis por um período relativamente curto de tempo
Anticorpos 1. são altamente seletivos 2. são bastante sensíveis
3. a ligação com o anticorpo é muito estável
1. não possuem efeito catalítico
2. o imunocomplexo antígeno-anticorpo formado é
irreversível na maioria das vezes
Ácidos nucléicos 1. são bastante específicos 1. baixas correntes são geradas
Receptores 1. muito utilizados em análises
específicas
1. biossensores difíceis de
construir
2. possuem custo muito elevado
Método interessante
facilita a recuperação no meio de reação
↓
o custo por análise através de sua reutilização↑
a rapidez e exatidão do processoObs.: A imobilização não deve desnaturar o centro ativo da enzima!!!
Componentes biológicos
As técnicas mais comuns são:
Técnicas de imobilização
1. Oclusão ou apriosionamento
Aprisionamento da enzima nos espaços intersticiais de polímeros
2. Microencapsulamento – entre membranas
Enzimas são confinadas em pequenas esferas (micro cápsulas) de
membranas semipermeáveis com poros de 5 a 300 μm.
Difere da anterior, pois permite o aprisionamento de um volume ou nº
3. Adsorção Física
Interação física simples no substrato, por ex. entre a enzima e a
superfície da matriz (interações do tipo polar, iônico, hidrofóbico
Superfícies dos suportes são geralmente ativas e funcionam como
4. Ligação Covalente
Baseado na ligação covalente de grupos funcionais não
ativos da enzima a grupos reativos ligados na superfície do suporte insolúvel
Suportes insolúveis mais utilizados: Polímeros sintéticos:
5. Ligação Covalente Cruzada
Formação de partículas macroscópicas devido a LCC entre as moléculas da enzima e/ou molécula do suporte inerte com reagentes funcionais.
Reagentes bifuncionais tem sido muito usados.
Tipo de Imobilização Vantagens Desvantagens
Oclusão 1. podem ser utilizados diversos
materiais
2. preservação da atividade biológica
1. o efeito do tamanho dos poros dos
materiais pode comprometer a adsorção
2. perda da biomolécula por lixiviação Adsorção 1. simples
2. realizados em condições brandas 3. menos destrutiva para o material
biológico
1. ligações das biomoléculas são
dependentes do pH, solvente e temperatura
2. alta taxa de lixiviação para a
solução, comprometendo a estabilidade do sistema
Ligação Covalente 1. complexo estável
biomolécula-substrato
2. lixiviação das moléculas é
minimizada
3. maior sensibilidade
1. procedimentos mais laboriosos
com consumo de tempo
2. possibilidade de perda da atividade
biológica do material
Ligação Covalente Cruzada 1. procedimentos simples
2. forte ligação química das moléculas 3. dificuldade de controle da reação
1. pode ocorrer falta de rigidez da
Desempenho analítico
Estabilidade: diretamente relacionado com o tipo de
imobilização
Oclusão, microencapsulamento, adsorção física úteis
para 50-100 determinações depende do grau de cuidado dispensado na preparação do polímero ou do material empregado
Ligação covalente e covalente cruzada geralmente
Tempo de resposta geralmente controlado pela espessura
da camada do material biológico imobilizado. Para se obter uma resposta, o substrato deve:
Difundir do seio da solução até a superfície do biossensor.
Difundir através da membrana externa e reagir com o sítio ativo do
material biológico
Os produtos formados devem difundir -se até a base do sensor
Seletividade depende do grau de pureza e da
seletividade do material biológico usado para construir o biossensor.
As enzimas têm especificidade variada para seus substratos. A
glicose oxidase, a urease, etc., são muito específicas. Por outro lado, a L-aminoacido oxidase, a penicilase, a álcool oxidase, etc., possuem baixa especificidade, levando a uma diminuição da
seletividade dos biossensores que as contém
Transdutor deve responder a um dos reagentes consumidos ou
Biossensores de Primeira Geração: Clark e Lyons
Monitora-se o consumo de reagentes ou a formação dos produtos.
Classificação de acordo com o material biológico
Consumo de O2 ou a formação de
Biossensores de Segunda Geração
Mediadores artificiais livres em solução ou imobilizados juntamente com o material biológico (enzima)
Biossensores de Terceira Geração
Transferência direta de elétrons entre a superfície do eletrodo e o centro ativo da enzima
Estabelecem um contato elétrico entre a biomolécula e o eletrodo por
meio do seguinte mecanismo
o mediador sofre um processo redox, reconduzindo-se a seu estado fundamental, para em seguida sofrer um processo redox inverso na superfície do eletrodo, sendo também reconduzido a seu estado fundamental, completando um ciclo que restaura a biomolécula e o mediador
Se comportam como mensageiro “que conta ao eletrodo inerte” o que
se passou no interior do componente biológico, amplificando o sinal elétrico
Recurso usado para aumentar a seletividade em biossensores
amperométricos, uma vez que a presença de catalisador ou mediador possibilita um potencial de trabalho numa região próxima de 0 V (pois aumenta a cinética de transferência), mais imune a interferências de outras espécies eletroativas.
Para serem utilizados como mediadores redox, os compostos devem possuir as seguintes características:
Reagir rapidamente com a enzima
Apresentar cinética de transferência de elétrons reversível Baixo potencial de regeneração
Propriedades eletroquímicas independentes do pH Ser estável tanto na forma oxidada como na reduzida Não reagir com oxigênio
Não ser tóxico.
As enzimas desempenham a função de catalisar diversas
reações biológicas
Podem aumentar a velocidade de uma reação por um fator de
1014 quando comparada a uma reação não catalisada
Portanto, as enzimas apresentam um alto grau de especificidade
por seus substratos, aceleram reações químicas específicas
A maioria atua em soluções aquosas e em condições controladas
de temperatura e pH.
É a parte da enzimologia que estuda a velocidade das reações
enzimáticas e os atores que influenciam nesta velocidade. A cinética de uma enzima é estudada avaliando-se a quantidade de produto formado ou a quantidade de substrato consumido por unidade de tempo de reação
Os princípios gerais da cinética das reações químicas se aplicam às
reações catalisadas por enzimas, porém mostra-se também um aspecto distinto que não se observa usualmente em reações não-enzimática, a saturação com o substrato.
Efeito da concentração de substrato na velocidade da reação (concentração de enzima constante).
Observa-se que em uma concentração baixa de substrato, a velocidade inicial da reação (v0) é proporcional à concentração do substrato, desta forma a reação é considerada de primeira ordem com relação ao substrato
Com o aumento da concentração do substrato a velocidade inicial da reação se reduz, não
sendo mais proporcional à concentração do substrato, desta forma a reação é de ordem mista
Posteriormente, com o aumento da concentração do substrato, a velocidade da reação
A equação de Michaelis-Menten expressa a relação entre a velocidade de uma reação
enzimática e a concentração do substrato, podendo ser facilmente deduzida a partir da reação acima, onde milissegundos após a enzima e o substrato serem misturados, uma concentração ES é obtida e permanece constante enquanto a concentração de S estiver em excesso e k1 for maior que k3
Essa condição é chamada estado estacionário da reação, uma vez que a velocidade de
decomposição de ES se iguala à sua velocidade de formação.
Considerando que a velocidade máxima (Vmáx) é atingida quando os centros ativos das enzimas estiverem completamente saturados com o substrato, a velocidade inicial (V) será, então, proporcional à concentração de enzima presente,
onde:
•V é a velocidade observada a uma dada concentração substrato [S]
• Km é a constante de Michaelis, expressa em unidades de concentração (mol L-1) •Vmáx é a velocidade máxima na concentração de saturação do substrato
Equação de Michaelis-Menten
Fatores que Influenciam na Velocidade de uma Reação Enzimática
Temperatura: Quanto maior a temperatura, maior a velocidade da
reação, até se atingir a temperatura ótima; a partir dela, a atividade volta a diminuir, por desnaturação da molécula.
pH: Como na temperatura, existe um pH ótimo, onde a
distribuição de cargas elétricas da molécula da enzima e, em especial do sítio catalítico, é ideal para a catálise. Ponto isoeletrônico.
Exemplo de análise de desempenho de um biossensor enzimático.
Para o biossensor Au-CYS-TTF-GOx-GLU, calculou-se a constante aparente de Michaelis-Menten (KMapp) com base na curva analítica obtida
experimentalmente.
De acordo com a equação de Michaelis-Menten, a cinética enzimática pode ser
descrita em princípio por:
V = K2[GOx] [glicose] / KM + [glicose]
Para a construção dos eletrodos é desejável obter mais baixo valor de KM e V mais elevado. Em outras palavras, quanto menor o KM maior a atividade enzimática.
Por meio de uma relação recíproca, a equação inicialmente descrita por
Lineweaver-Burk relaciona os valores de correntes obtidos a partir do gráfico I vs concentração de glicose (C) dado por:
1 / Iss = 1 / Imax + KMapp / I
max C
onde, Iss é a corrente de estado estacionário após adição de glicose, Imax é a corrente máxima obtida após a saturação da curva e C é a concentração de glicose da solução. Obteve-se KMapp = 4,16x10-2 mol L-1.
Esse valor de KMapp é alto, em comparação com a literatura. Isto se deve,
provavelmente, a não saturação completa dos sítios ativos da GOx, não permitindo que esta catalise eficientemente a oxidação da glicose.
Classificação das Enzimas
As enzimas são classificadas em grupos conforme a natureza das reações químicas que catalisam. De acordo com a União Internacional de Bioquímica e Biologia Molecular (IUBMB, em inglês), são divididas em seis grupos.
As características apresentadas pelas enzimas depois de imobilizadas dependem principalmente da escolha apropriada do suporte e dos reagentes utilizados no processo de imobilização, visando manter a integridade do sítio ativo da enzima.
Os sensores biomiméticos e/ou quimiosensores são aqueles que usam substâncias
sintéticas como elemento de reconhecimento (análogos sintéticos)
A partir das informações sobre propriedades físico-químicas e estruturais do sítio
catalítico da enzima natural, inicia-se o processo do desenvolvimento de compostos orgânicos (ligantes) com funções químicas semelhantes aos resíduos de aminoácidos presentes no sítio catalítico da enzima natural
Algumas enzimas que possuem em seus centros ativos íons metálicos são
chamadas de metaloenzimas. Os íons metálicos de transição mais comuns são: Fe2+,
Fe3+, Cu2+, Zn2+, Mn2+ e Co2+, que participam dos processos catalíticos.
Sensores
Baseiam-se no uso de análogos sintéticos de enzimas naturais na
construção de sensores que fazem parte da terceira geração de (bio)sensores, nos quais possivelmente ocorra uma transferência direta de elétrons do sítio ativo da enzima para a superfície do eletrodo, sem a necessidade de compostos mediadores de elétrons.
Exemplo:
Sotomayor e colaboradores utilizaram o complexo mononuclear de Cu(II) [CuDipyCl2] (dipiridina) como catalisador biomimético na construção de um sensor para determinação de dopamina.
O sensor foi preparado modificando o eletrodo de carbono vítreo com uma membrana de náfion contendo [CuDipidiryCl2]. O sensor apresentou resposta linear para dopamina de 4,0x10-5 a 6,0x10-4 mol L-1 e
limite de detecção de 9,0x10-6 mol L-1.
Journal of Electroanalytical Chemistry 536 (2002) 71-81.
Sensores
Biossensores permitem resultados analíticos quantitativos em poucos minutos. Tempo de resposta do biossensor deve ser otimizado. Ex. glicosímetro apresenta resposta entre 5 a 30s.
Área da saúde:
Sangue
Gases Íons
Metabólitos Bactérias
Aplicações
Biossensor
?
Glicose Colesterol e triglicérides Lactato
Área da saúde: Imunossensores
A nanostructured piezoelectric immunosensor for detection of human cardiac troponin T
Rosana A.S. Fonseca1, Joilson Ramos-Jesus1, Lauro T. Kubota2, Rosa F. Dutra1,*
Emprego de nanopartículas de ouro modificadas para promover a detecção piezoelétrica e eletroquímica de troponina cardíaca T.
Detecção rápida de troponina cardíaca T e relacioná-la ao risco do
ocorrência de infarto
Esse estudo foi realizado até a etapa de ensaios com soro humano
positivado com a proteína cardíaca troponina T
50 100 150 200 0.8
0.9 1.0
R
[Anti-TnT] / ng.mL-1
Dependence of anti-TnT concentration on immunosensor sensitivity
0 20 40 60 80 100
0 100 200 300 400 500
Changes of freq
uency / Hz
PBS / mmols L-1
6.8 7.0 7.2 7.4 7.6 0 100 200 300 400 500
Changes of freq
uency / Hz
pH
Effect of pH on response of immunosensor
1 2 3 4 5
94 96 98 100 R el at ive fr equen cy / %
Number of injections
Control serum
Serum spiked with troponin
Immunosensor response to TnT in the human serum
0.1 0.2 0.3 0.4 0.5 10 20 30 40 Fr equen cy / H z
[Troponin T] / ng mL-1
Área da saúde: Genossensores
Desenvolvimento de (bio)sensores magneto eletroquímicos de DNA para a determinação de enterotoxinas de Staphylococcus em amostras de alimentos: Supervisor:
Profa. Dra. María Pedrero Muñoz
Instituição: Universidade Complutense de Madrid
Emprego de partículas magnéticas modificadas para promover a captura de cadeias selecionadas de ácido desoxirribonucléico (DNA na terminologia inglesa) e a detecção eletroquímica dos processos de hibridização do DNA imobilizado
Detecção rápida de enterotoxinas de Staphylococcus de interesse em
amostras de alimentos
Desenvolvimento de uma metodologia eletroanalítica para a determinação
de Staphylococcus em alimentos diversos
A ação de alguns possíveis interferentes encontrados nestas matrizes não
foi estudada.
Metodologia:
Replicação in vitro de moléculas de DNA - PCR (Polymerase Chain Reaction
- reação de polimerização em cadeia)
A enzima DNA polimerase termoestável produzirá novos segmentos de DNA
com base nas moléculas de DNA fornecida como modelo (DNA-molde)
Todos os componentes necessários à PCR (incluindo o DNA-molde, a enzima
DNA polimerase, desoxinucleotídeos-trifosfato e oligonucletídeos, dentre outros) são preparados em microtubos, os quais são submetidos a múltiplos ciclos de incubação em temperaturas pré-definidas (termociclagem)
Os microtubos possuem reações finalizadas de amplificação de DNA, os
produtos de PCR, que são avaliadas quanto à presença dos segmentos que se procurou amplificar a partir do DNA-molde fornecido, os amplicons
No caso de PCR realizado com finalidade clínica, os amplicons geralmente
As partículas magnéticas (MBs) constituem uma ferramenta versátil para o desenvolvimento de sensores de DNA e proteínas porque:
Proporcionam uma grande área superficial para a união de DNA, que
podem se separar facilmente da fase líquida com um pequeno imã e dispersar-se novamente de forma imediata ao se distanciar o ímã
Além disso, as partículas que não se ligam especificamente podem ser
eliminadas mediante uma lavagem controlada magneticamente
Modificação de eletrodos impressos de ouro com o mediador redox
tetratiafulvaleno (TTF)
As partículas separadas por meio de um imã de neodímio colocado na parte
inferior dos eletrodos impressos de ouro. A superfície desses eletrodos é modificada com o mediador TTF
Detecção do processo de hibridização por meio de amperometria,
Otimização de diferentes variáveis envolvidas no processo, estabelecendo-se
as características analíticas da metodologia desenvolvida
Estudo da reprodutibilidade dos sinais analíticos obtidos por meio de
diferentes genossensores fabricados da mesma maneira
Aplicação da estratégia proposta para análise de alimentos contaminados,
sem a necessidade de extrair previamente o material genético da amostra em questão
Estudar a possibilidade de fabricar um arranjo que permita detectar e/ou
quantificar simultaneamente e rotineiramente a presença das principais enterotoxinas de Staphylococcus em amostras de alimentos
Genossensores baseados em eletrodos impressos descartáveis = uso de um
Metodologia:
Imobilização de sondas de DNA biotiniladas sobre partículas magnéticas mo
dificadas com estreptavidina
Marcação do híbrido biotinilado resultante, com um polímero comercial de
estreptavidina-HRP
Depois de imobilizar as partículas assim obtidas, colocando-se um imã de
neodímio na parte inferior de eletrodos impressos de ouro modificados com o mediador redox tetratiafulvaleno (TTF), a detecção do processo de hibridização será realizada por amperometria, monitorizando a variação da corrente de redução do TTF a qual é gerada quando se adiciona peróxido de hidrogênio na presença de HRP
Determinação de DNA de enterotoxinas de Staphylococcus aureus = cadeias de
(Monocamadas Auto-Organizadas (SAMs)
Uma alternativa para prevenir a desnaturação da enzima
Promover uma orientação específica e preferencial da enzima à
superfície do eletrodo.
Monocamada auto-organizada
SAM
Constituem um método bastante interessante de obtenção de uma superfície com alto grau de orientação
São formadas espontaneamente como conseqüência da imersão de uma superfície sólida em uma solução constituída de moléculas anfóteras
Esquema do emparelhamento entre os alcanotióis e o retículo do ouro numa camada auto-organizada. Átomos de enxofre representados em rosa e átomos de ouro representados em dourado .
SAMs
Cadeia carbônica
Grupo ligante
Substrato metálico
Interface orgânica
•Atua como barreira física
•Altera a condutividade eletrônica
Interface meta-enxofre Interface orgânica
•determina as propriedades superficiais
Representação esquemática dos processos de imobilização de biomoléculas por adsorção física (a) encapsulamento por ligação cruzada (b) e acoplamento orientado por monocamadas auto-organizadas (c).
Efeito positivo no ambiente e disposião dos elementos biologicamente ativos
Aumenta o desempenho analítico dos biossensores
SAMs
São fáceis de serem formadas Formam estruturas ordenadas
A versatilidade na variação, por meio de grupos funcionais diferentes,
permite que se obtenham superfícies com características hidrofóbicas ou hidrofílicas e ainda permitindo reações de imobilização
Apresentam razoável estabilidade por um período longo de tempo,
permitindo que sejam utilizadas para a realização de um grande número de medidas
Reagentes e Soluções:
Tiol – cistamina = 1x10-3 mol L-1 (Sigma) Enzima – glicose oxidase (Sigma)
Enzima – frutose dehidrogenase (Sigma)
Substratos – D-glicose e D-frutose = 5x10-2 mol L-1 (Sigma) Mediador de elétrons – tetratiafulvaleno (sigma)
Glutaraldeído – (Sigma)
As medidas eletroquímicas foram realizadas em tampão fosfato 0,1 mol L-1, pH= 6,5; T = 35ºC.
Metodologia: Preparação usando
Instrumentação:
Potenciostato/galvanostato AUTOLAB® PGSTAT (ECO CHEMIE,
Holanda) acoplado a um microcomputador dotado com o programa GPES.
Eletrodos:
Referência: Ag/AgCl (em KCl 3,0 mol L-1) Auxiliar: placa de platina
Célula Eletroquímica:
Compartimento único e encamisada para controle da
temperatura
Tampa em Teflon® adaptada para encaixe dos eletrodos
Metodologia: Preparação usando
Eletrodo de referência
Eletrodo de trabalho Eletrodo de trabalho
ou contra-eletrodo
Eletrodo de Trabalho: eletrodo de ouro modificado com monocamadas de cistamina (Au/Cistamina) – 2 horas
Metodologia: Preparação usando
(1) Formação da SAM:
Construção do biossensor
Contato elétrico
Solução de cistamina Ouro
SAM de cistamina
Cistamina
2-aminoetil dissulfeto
N H2
Cys
TTF
Gox
FDH
Glutaraldeído
TTF = tetratiafulvaleno
Voltamogramas cíclicos de K4Fe(CN)6/K3Fe(CN)6 na concentração de 1,00x10-3 mol L-1 em tampão fosfato 0,10 mol L-1 (pH = 6,5) para: