Estrutura e dinâmica da vegetação lenhosa de cerrado sensu stricto no período de 19 anos, na reserva ecológica do IBGE, Distrito Federal, Brasil
Texto
(2) ADRIANO JOSÉ BARBOSA SOUZA. Estrutura e Dinâmica da Vegetação Lenhosa de Cerrado sensu stricto no período de 19 anos, na Reserva Ecológica do IBGE, Distrito Federal, Brasil. Dissertação aprovada junto ao Programa de Pós-Graduação em Ecologia da Universidade de Brasília como requisito parcial para a obtenção do título de Mestre em Ecologia.. Banca Examinadora:. ___________________________________________ Prof. Dr. Raimundo Paulo Barros Henriques Orientador – UnB. ___________________________________________ Prof. Dra. Heloísa Sinátora Miranda Membro Titular – UnB. ___________________________________________ Prof. Dra. Alba Valéria Rezende Membro Titular – UnB. ___________________________________________ Prof. Dr. John Du Vall Hay Suplente – UnB. Brasília, abril de 2010..
(3) SOUZA, ADRIANO JOSÉ BARBOSA. Estrutura e dinâmica da vegetação lenhosa de cerrado sensu stricto no período de 19 anos na Reserva Ecológica do IBGE, Distrito Federal, Brasil, 66 p., (UnB-IB, Mestre, Ecologia, 2010).. Dissertação de Mestrado – Universidade de Brasília. Departamento de Ecologia.. 1. Savanas. 2. Fogo. 3. Ecologia de comunidades. 4. Reserva Ecológica do IBGE. I. UnB-ECL/IB. II. Título (série).
(4) AGRADECIMENTOS. À minha família que sempre me apoiou em cada passo, em cada momento, nos bons e nos ruins. A todos os amigos que me acompanharam durante essa caminhada que muito me apoiaram e me ajudaram na realização deste trabalho e ao lado dos quais tive muitos bons momentos e alegrias. Aos professores da Ecologia da UnB, que muito contribuíram para o conhecimento que pude aprender. Ao Prof. Raimundo Henriques pela sua amizade, cordialidade, dedicação, paciência, e busca incansável pela excelência e qualidade do trabalho. Aos técnicos do laboratório Mardônio e Consolação pelo apoio e disponibilidade. À Emilia P. Braga a quem pude contar em todas as horas com sua inestimável amizade, com seu apoio, incentivo, com sua coragem e ousadia em solucionar as pequenas e grandes dificuldades. Ao CNPq pela concessão da bolsa de estudos de Mestrado. A todas as demais pessoas que me ajudaram para a realização deste trabalho, seja com ajuda científica ou um gesto de amizade..
(5) IV. ÍNDICE AGRADECIMENTOS. III. ÍNDICE. IV. RESUMO. VI. ABSTRACT. VII. CAPÍTULO 1: SAVANAS: OCORRÊNCIA, ESTRUTURA E FATORES DETERMINANTES. 8. 1. 8. INTRODUÇÃO. 1.1 PRINCIPAIS FATORES DETERMINANTES DE SAVANAS. 10. 1.1.1 Controles da base para o topo. 10. 1.1.1.1 Água. 10. 1.1.1.2 Nutrientes. 10. 1.1.2 Controles do topo para a base. 11. 1.1.2.1 Fogo. 11. 1.1.2.2 Herbivoria. 11. 1.2 AS SAVANAS SÃO SISTEMAS ESTÁVEIS OU INSTÁVEIS?. 12. 1.2.1 Savanas como sistemas estáveis (equilíbrio). 12. 1.2.1.1 Partição espacial do nicho. 12. 1.2.1.2 Partição fenológica do nicho. 13. 1.2.1.3 Competição balanceada. 14. 1.2.2 Savanas como sistemas instáveis (desequilíbrio). 14. 1.2.2.1 Gargalo demográfico. 14. 1.3 O CERRADO COMO UM BIOMA DE SAVANA. 15. 1.4 FORMULAÇÃO DO PROBLEMA. 18. 2. 18. REFERÊNCIAS BIBLIOGRÁFICAS. CAPÍTULO 2 DINÂMICA DA VEGETAÇÃO LENHOSA EM UM CERRADO SENSU STRICTO NO PERÍODO DE 18 ANOS. 23. 1. INTRODUÇÃO. 23. 2. MATERIAL E MÉTODOS. 26. 2.1 ÁREA DE ESTUDO. 26.
(6) V. 2.2 INVENTÁRIO DE CAMPO. 26. 2.3 CLASSIFICAÇÃO DAS FORMAS DE CRESCIMENTO. 27. 2.4 ANÁLISE DOS DADOS. 29. 2.5 ANÁLISES ESTATÍSTICAS. 30. 3. 31. RESULTADOS. 3.1 COMPOSIÇÃO FLORÍSTICA E ESTRUTURA. 31. 3.2 FORMAS DE CRESCIMENTO. 36. 3.3 ESTRUTURA E DINÂMICA DAS FORMAS DE CRESCIMENTO. 43. 3.4 MORTALIDADE, RECRUTAMENTO E INCREMENTO LÍQUIDO POR FORMA DE CRESCIMENTO. 45. 3.5 MORTALIDADE, RECRUTAMENTO E CRESCIMENTO POR ESPÉCIE E FORMA DE CRESCIMENTO. 47. 3.6 MORTALIDADE, RECRUTAMENTO E INCREMENTO PELAS CLASSES DE DIÂMETRO. 52. 3.7 INCREMENTO NO NÚMERO DE INDIVÍDUOS, CAULES E ÁREA BASAL POR ESPÉCIE. 55. 4. DISCUSSÃO. 57. 5. REFERÊNCIAS BIBLIOGRÁFICAS. 60. APÊNDICE I. 64.
(7) VI. RESUMO Esse estudo foi realizado com o objetivo de analisar e descrever as mudanças na composição, estrutura e dinâmica de uma comunidade vegetal de cerrado sensu stricto localizada na Reserva Ecológica do IBGE (Instituto Brasileiro de Geografia e Estatística), Distrito Federal, Brasil. Uma unidade amostral permanente de 0,5 ha, protegida do fogo desde 1973, com apenas um evento de queimada acidental em 1994. Foram realizados dois inventários, o primeiro em 1991 e o segundo em 2009. Todas as plantas com diâmetro ao nível do solo maior ou igual a 4,8 cm foram medidas e identificadas. Foi registrada uma mudança na estrutura e composição florística. Houve um aumento da riqueza de espécies, número de gêneros e famílias. A taxa de imigração de espécies foi maior que a de extinção no período entre os censos. As espécies foram classificadas em cinco formas de crescimento definido pela altura e diâmetro (árvores, arbustos grossos, arbustos finos, varas e palmeira/Vellozia (monocotiledôneas)). As árvores foram a forma de crescimento dominante nessa área no período estudado e as vara a forma menos abundante. Com exceção dos arbustos finos ocorreu uma diminuição na proporção relativa de todas as outras formas de vida, embora em termos absolutos, tenha ocorrido um aumento no número de indivíduos, caules e área basal em todas as formas de crescimento. Em média as taxas de mortalidade das árvores foram significativamente (P < 0.05) maiores do que de arbustos e monocotiledôneas, mas as taxas de recrutamento de arbustos foram significativamente (P < 0.05) maiores do que das árvores e monocotiledôneas. A taxa de crescimento em diâmetro dos caules das árvores foi significativamente (P < 0.05) maior do que a dos arbustos. As taxas de recrutamento do número de indivíduos, de número de caules e da área basal foram maiores que as taxas de mortalidade. Para 21 espécies onde foi possível calcular as taxas de mortalidade e recrutamento, onze apresentaram a taxa de recrutamento maior do que a taxa de mortalidade e 9 apresentaram taxa de mortalidade maior do que a taxa de recrutamento. As taxas de mortalidade e recrutamento decresceram com as classes de diâmetro. A maioria das espécies (87%) apresentou um incremento populacional positivo. Esses resultados indicam que o cerrado sensu stricto na área tem uma natureza sucessional após a queimada de 1994, que é consistente com a hipótese de que as savanas mésicas e úmidas são mantidas pelo fogo..
(8) VII. ABSTRACT This study analyzes and describes the changes in the composition, structure and dynamics of a plant community in the cerrado sensu stricto over a period of 18.9 years. The sampling was conducted on the Ecological Reserve of IBGE (Instituto Brasileiro de Geografia e Estatística), Federal District, Brazil, in a permanent plot of 0.5 hectares. The plot was protected from fire since 1973, but suffered an accidental fire in 1994. Two surveys were done, the first in 1991 and the second in 2009. In both surveys, all plants whose diameter at ground level was ≥ 4.8 cm were measured, identified and mapped. The structure and floristic composition changed over the period. There was an increase in species richness, number of genera and families. The immigration rate of species was greater than the extinction rate in the period between censuses. The species were classified in five types of growth forms defined by height and diameter (trees, thick shrubs, thin shrubs, poles and monocots (palms/Vellozia)). The trees were the dominant growth form and poles the less abundant. Except for the thin shrubs there was a reduction in the relative proportion of all other growth forms, although in absolute terms, there was an increase in the number of individuals, stems and basal area in all other growth forms. Average mortality rates of trees was significantly (P < 0.05) higher than in shrubs and monocots, but the recruitment rates of shrubs was significantly (P < 0.05) higher than for trees and monocots. The growth rate in stem diameter of trees was significantly (P <0.05) higher than that of shrubs. The recruitment rates of number of individuals, number of stems and basal area were higher than mortality rates. For the 21 species for which it was possible to calculate mortality and recruitment rates, 11 had a recruitment rate greater than mortality, and 9 species showed higher mortality rate than recruitment rate. Mortality rate and recruitment rate decreased with increase in stem diameter size. Most species (87%) showed a positive net increase in population size. These results indicate that the cerrado sensu stricto had a successional nature after the 1994 fire, which is consistent with the hypothesis that mesic and humid savannas are maintained by fire..
(9) 8. CAPÍTULO 1 SAVANAS: ESTRUTURA, OCORRÊNCIA E FATORES DETERMINANTES 1 INTRODUÇÃO. As savanas são formações onde coexistem duas formas de vida: árvores e gramíneas, sendo o extrato graminoso contínuo, mas ocasionalmente interrompido por árvores e arbustos. A vegetação desenvolve-se sobre solos bem drenados e o padrão de crescimento das plantas está associado com a ocorrência de uma estação seca (Bourlière & Hadley 1970; Scholes & Archer 1997). Os sistemas que apresentam essa mistura de árvores e gramíneas são muito diversos e exibem diferenças quanto à cobertura da copa de plantas lenhosas, quanto à altura (arbustos versus árvores, gramíneas baixas versus altas), quanto à forma funcional de árvores (decíduas versus perenes), quanto ao mecanismo fotossintético das gramíneas (C3 versus C4) e quanto à distribuição espacial das árvores (House et al. 2003). As savanas são geograficamente abrangentes e ocorrem em regiões onde a precipitação média anual (PMA) pode variar de ~ 200 mm a ~ 3.000 mm, e têm uma abrangência latitudinal de ~ 30° norte e ao sul do equador, cobrindo uma área de aproximadamente 33 milhões de km² (Scholes & Archer 1997; Beerling & Osborn 2006; Bond 2008). Os sistemas savânicos têm uma significativa importância socioeconômica e suportam uma grande proporção da população humana, sendo intensamente exploradas para conversão de áreas agrícolas, assim como pasto e criação de gado (Scholes & Archer 1997), têm uma influência significante nos ciclos biogeoquímicos globais e são altamente sensíveis para antecipar mudanças climáticas e mudanças no uso da terra (House et al. 2003). As condições edáficas, topográficas e muitas outras variam amplamente entre as savanas, e em particular o conjunto de espécies, de modo que os processos envolvidos nas dinâmicas de qualquer savana são peculiaridades, embora, usualmente, não há problemas em identificar uma dada mistura de árvore e gramínea como uma vegetação de savana (Jeltsch et al. 2000). As dinâmicas de savanas, e de provavelmente muitos outros ecossistemas são determinadas por uma grande escala de fatores. E qualquer tentativa de entender, conservar e.
(10) 9. manejar ecossistemas savânicos tem se deparado com as questões que dizem respeito aos fatores e processos que permitem a coexistência de árvores e gramíneas (Scarpe 1992; Jeltsch et.al. 2000). Segundo Frost et al. (1986) existem quatro fatores principais que determinam a ocorrência de savanas: água, nutrientes, herbivoria e fogo, que são utilizados para classificar as savanas em quatro tipos principais: (1) baixa disponibilidade de água e alto suprimento de nutrientes; (2) alta disponibilidade de água e solos bastante pobres em nutrientes; (3) água e nutrientes são altamente limitantes e (4) sem limitação de água e nutrientes. Bond (2008) classifica esses fatores em duas categorias: controles da base para o topo (água e nutrientes) e do topo para a base (fogo e herbivoria). Mais recentemente, Bucine & Hanan (2007) utilizam a precipitação média anual (PMA) como uma forma de classificação das savanas: savanas áridas apresentam PMA < 400 mm, as semi-áridas ou mésicas apresentam PMA entre 400 a 1600 mm e as savanas úmidas apresentam PMA > 1600 mm. Reconhecer se uma savana é intrinsecamente um sistema instável mantido por perturbações tais como o fogo e herbivoria ou um sistema estável que persiste em detrimento dessas perturbações é crítico para o seu manejo e entendimento (Sankaran et al. 2004). Os sistemas estáveis são baseados principalmente em modelos de sistemas em equilíbrio e não equilíbrio. No primeiro caso, os sistemas em equilíbrio se referem às savanas cuja coexistência à longo prazo de árvores e gramíneas não depende de perturbações como fogo e herbivoria ou da ação de fatores como variação da precipitação. Nesses sistemas embora a proporção de árvores e gramíneas possa variar em resposta a variação na precipitação, fogo ou herbivoria, o balanço competitivo não se altera (Scholes & Archer 1997; Sankaran et al. 2004). Enquadram-se nesse conceito os modelos de separação espacial ou temporal de nicho. No segundo caso, os sistemas de não equilíbrio são aqueles onde a ocorre coexistência de árvores e gramíneas, pois a ação de fatores como precipitação, fogo e herbivoria altera o estado de equilíbrio favorecendo periodicamente uma ou outra forma de vida ou fornecendo oportunidades para germinação e estabelecimento de árvores. Essa variação permite a coexistência dessas duas formas de vida e resulta numa razão dinâmica entre árvores e gramíneas. Enquadram-se nesse conceito os modelos de competição balanceada entre árvores e gramíneas. Os sistemas instáveis são baseados em modelos de sistemas de desequilíbrio. Os sistemas em desequilíbrio são aqueles onde a coexistência a longo prazo de árvores e gramíneas não é possível, pois o sistema tende a convergir para formações florestais ou.
(11) 10. campestres, mas persistem devido a influência de perturbações. Os modelos de gargalo demográfico enquadram-se nesse conceito (Sankaran et al. 2004). 1.1 PRINCIPAIS FATORES DETERMINANTES DAS SAVANAS 1.1.1 Controles da base para o topo: 1.1.1.1 Água Todas as savanas apresentam limitação por água por pelo menos parte do ano, sendo amplamente pressuposto que a competição em savanas é, principalmente, por água (Scholes & Archer 1997). O suprimento de água tem sido considerado o fator chave determinante da abundância de árvores em savanas (Bond 2008). Segundo Sankaran et al. (2005) em savanas determinadas pelo clima, as quais ocorrem em locais com PMA até ~ 650 mm, as restrições na cobertura lenhosa máxima são o resultado da limitação de água permitindo a persistência de gramíneas no sistema. A cobertura arbórea aumenta de forma aproximadamente linear até uma PMA de 650 mm, a partir desse ponto mesmo com o aumento da precipitação e da disponibilidade de água, outros fatores limitam a cobertura arbórea potencial (Sankaran et al. 2005; Sankaran et al. 2008). Diferentemente, foi observado em savanas do norte da Austrália que a cobertura de árvores apresenta um aumento linear com o aumento da PMA, no entanto, quando a água não representa um fator limitante (PMA > 650 mm) outros fatores, principalmente o fogo, atuam impedindo que a cobertura arbórea alcance o seu valor potencial, permitindo o desenvolvimento de gramíneas (Willians et al. 1996; Bond 2005). 1.1.1.2 Nutrientes A dinâmica de nutrientes em savanas resulta de uma variedade de escalas espaciais e temporais de interações entre clima, geologia, geomorfologia e a biota (Frost et al. 1986). Em savanas africanas, Scholes (1990) observou que diferenças na fertilidade do solo resultam em profundos efeitos na composição de espécies, fisionomia, estrutura e funcionamento das savanas. As savanas ocorrem usualmente em locais com baixa disponibilidade de nutrientes no solo e a escassez de nutrientes é considerada um importante fator que limita o crescimento de plantas lenhosas de savanas em regiões onde a disponibilidade de água poderia suportar a ocorrência de florestas (Ruggiero et al. 2002; Henriques 2005; Bond 2008)..
(12) 11. 1.1.2 Controles do topo para a base: 1.1.2.1 Fogo O fogo é a causa de mortalidade de plântulas, árvores jovens e adultas, tornando ocasionais os eventos de recrutamento de plantas lenhosas (Scholes & Archer 1997; Hoffman 1996; Hoffman & Jackson 2000; Hoffman et al. 2002; Hoffman & Solbrig 2003; Bond 2008). Higgins et al. (2007) constataram a influência do fogo na biomassa e na estrutura de populações de vegetação lenhosa em algumas savanas africanas. A biomassa e densidade de árvores e a composição de espécies em muitas savanas dependem do regime de fogo especialmente em locais onde a água não é um fator limitante, e a exclusão do fogo nesses sistemas impulsiona uma mudança progressiva na composição de espécies lenhosas (Bond 2008; Bond et al. 2005). A redução de árvores pelo fogo tem resultado na atual distribuição de vegetação dominada por gramíneas C4 e não existe uma síntese global sobre o que determina o regime de fogo nos ecossistemas (Bond et al. 2005). 1.1.2.2 Herbivoria Árvores jovens crescem rapidamente em áreas protegidas tanto do fogo quanto da herbivoria, mais que em áreas protegidas apenas pelo fogo (Scholes & Archer 1997). As plântulas e pequenas árvores são particularmente vulneráveis a herbivoria (McPherson 1993), sendo um importante fator na determinação de savanas, pois reduz a densidade, o crescimento e a regeneração de plantas lenhosas (Jeltsch et al. 2000). Em muitas partes da África os elefantes são os maiores agentes de mortalidade de árvores adultas e podem até mesmo estruturar a distribuição de savanas. A herbivoria de gramíneas reduz a competição com lenhosas e diminuindo o principal combustível para o fogo, bem como sua freqüência e intensidade, favorece o aumento da cobertura de árvores (Scholes & Archer 1997; van Langevelde et al. 2003; Bond 2008). Atualmente, em muitas savanas os animais de criação são os maiores herbívoros e seu efeito na vegetação lenhosa é complexo, com forte interação com o fogo (Bond 2008)..
(13) 12. 1.2 AS SAVANAS SÃO SISTEMAS ESTÁVEIS OU INSTÁVEIS? Dois grupos de hipóteses foram propostas para explicar o funcionamento de savanas: as que consideram as savanas como sistemas estáveis, ou seja, a coexistência de árvores e gramíneas a longo prazo ocorre independentemente de perturbações ambientais e o segundo grupo de hipóteses são as que consideram as savanas como sistemas instáveis, isto é, a coexistência de árvores e gramíneas a longo prazo depende de perturbações como fogo e herbivoria (Scarpe 1992; Sankaran et al. 2004). Identificar o mecanismo específico que permite a coexistência e define a cobertura de árvores em savanas é essencial para uma perspectiva aplicada. Tal conhecimento sustenta diretamente nossa habilidade em predizer as respostas das savanas aos vetores de mudanças ambientais, e contribui para uma adequada elaboração de estratégias de manejo (Sankaran et al. 2004). As tentativas de explicar os mecanismos responsáveis pelas interações entre árvores e gramíneas em savanas culminam em quatro classes de hipóteses alternativas que por sua vez levam a diferentes modelos conceituais de equilíbrio e persistência do bioma: separação espacial de nicho, separação fenológica do nicho, competição balanceada e gargalos demográficos (House et al. 2003). 1.2.1 Savanas como sistemas estáveis (equilíbrio) 1.2.1.1 Partição espacial do nicho Esse é o modelo clássico de equilíbrio de savanas inicialmente proposto por Walter (1971) para explicar a coexistência das duas formas de vida predominantes: árvores e gramíneas. Conhecido também como modelo de separação vertical de nicho radicular. Esse modelo pressupõe que a água é o fator limitante e que árvores e gramíneas têm acesso diferencial a esse recurso devido a diferenças na distribuição espacial das raízes no solo. Árvores e gramíneas competem por água nas camadas superficiais do solo e embora as gramíneas apresentem vantagem competitiva por água no perfil superficial do solo, as árvores são capazes de persistir por que alcançam acesso exclusivo a água das camadas mais profundas do solo (Walter 1971). Utilizando esses pressupostos é possível encontrar um simples estado de equilíbrio. Se a herbivoria for acrescentada como um fator, podem ser encontrados dois estados estáveis e se houverem condições de reduzida infiltração de água, e mudanças na razão do conteúdo de.
(14) 13. água entre as camadas superficiais e profundas do solo, dois estados de equilíbrio podem ser possíveis: um estado típico das condições de savanas e um estado com predomínio de árvores e poucas gramíneas (Walker & Noy-Meir 1982; Jeltsch et al. 2000). Entre suas limitações, esse modelo não explica satisfatoriamente a coexistência de árvores e gramíneas em savanas por dois motivos. Primeiramente, muitas espécies lenhosas apresentam raízes totalmente superficiais com uma atividade fisiológica dependente da disponibilidade de água nas camadas superficiais do solo e em algumas savanas africanas o padrão de distribuição de raízes no solo e de depleção de água é semelhante para árvores e gramíneas. Segundo, o modelo pressupõe uma homogeneidade espacial dos processos, tornando-o pouco realista em face de um ecossistema caracterizado por uma estrutura vegetacional. heterogênea.. No. cerrado,. Quesada. et. al.. (2004). constataram. que. aproximadamente 80% das raízes do estrato graminoso e de arbustos se distribuem na camada superficial do solo (até 30 cm de profundidade). Desse modo, mecanismos adicionais são necessários para permitir a coexistência de árvores e gramíneas (Scholes & Archer 1997; Jeltsch et al. 2000). 1.2.1.2 Partição fenológica do nicho Muitos autores têm discutido o papel da separação fenológica do nicho como um mecanismo que pode contribuir no equilíbrio da coexistência de árvores e gramíneas em savanas (Sala et al. 1997; Scholes & Archer 1997; House et al. 2003; Sankaran et al. 2004). O modelo fenológico de separação ocorre quando os diferentes estratos possuem ciclos ou história de vida que permitem a exploração de recursos em períodos ou estações diferentes do ano. Em síntese, esse mecanismo pressupõe que árvores de savanas têm potencialmente acesso exclusivo à água e nutrientes antes ou no início da estação chuvosa, enquanto que as gramíneas têm acesso depois atingindo maior desenvolvimento depois do início da estação chuvosa (Scholes & Archer 1997; Sankaran et al. 2004). Assim, o período de crescimento ou desenvolvimento de cada estrato é alternado permitindo a coexistência dessas duas formas de vida (Sankaran et al. 2004). De outro modo, a variabilidade anual pode também contribuir para a ocorrência de fatores que favorecem a vegetação herbácea em alguns anos (por exemplo, pequenos e frequentes eventos de precipitação, mudanças para chuvas de verão) e de fatores que beneficiam as plantas lenhosas em anos subsequentes (eventos de chuva intensa fornecendo.
(15) 14. grande recarga de água aos solos, chuvas de inverno), de modo que nenhuma forma de vida mantém uma vantagem consistente (Lauenroth et al. 1993; House et al. 2003). 1.2.1.3 Competição balanceada Nesse modelo, à medida que diminui a disponibilidade de água e nutrientes as gramíneas e plantas lenhosas se auto-limitam e a competição dentro de uma mesma forma de vida é maior ou mais importante que a competição interespecífica e, assim, permite a coexistência (Scholes & Archer 1997; House et al. 2003; Sankaran et al. 2004). No limite inferior do gradiente de precipitação, a disponibilidade de água é insuficiente para suportar o crescimento de árvores, enquanto que, acima do limite de precipitação requerido para permitir o crescimento de árvores, mas a demanda de água requerida pelas raízes leva a competição entre as árvores impedindo que o sistema seja dominado por esse estrato (Sankaran et al. 2004) Nesse modelo, segundo Scholes & Archer (1997) o ponto de equilíbrio pode variar em função do clima (precipitação) ou de perturbações (herbivoria e fogo). A coexistência a longo prazo de ambas as formas de vida no sistema ocorre devido a um balanço entre a susceptibilidade à intensidade e à variação nas flutuações inter-anuais de precipitação entre árvores e gramíneas (Sankaran et al. 2004). 1.2.2 Savanas como sistemas instáveis (desequilíbrio) 1.2.2.1 Gargalo demográfico Este modelo foi proposto por Menaut et al. (1990), segundo os quais uma premissa básica que suporta o modelo de gargalo demográfico de coexistência de árvores e gramíneas em savanas é que os impactos da variabilidade climática e dos distúrbios diferem em cada estágio do ciclo de vida das plantas lenhosas. As árvores são limitadas pela seca e pelo fogo no estágio de plântula e apenas pelo fogo no estágio juvenil. Assim, as savanas ocorrem devido à influência de fatores que favorecem o estabelecimento de plântulas em áreas com baixa PMA e devido a fatores que, como o fogo e a herbivoria (consumidores de plantas lenhosas), previnem o estabelecimento de árvores em áreas com alta PMA. A persistência de árvores e gramíneas no sistema é resultante de perturbações como fogo e herbivoria (Higgins et al. 2000; Sankaran et al. 2004)..
(16) 15. Um importante aspecto desse modelo é o efeito do armazenamento (Higgins et al. 2000; Bond 2005). A ocorrência de bancos de juvenis é comum em savanas com ocorrência frequente de fogo, mesmo quando a densidade de árvores adultas é baixa. Os juvenis podem permanecer na zona de queimada por décadas devido a sua tolerância ao fogo ou capacidade de rebrotamento de raízes ou caules protegidos do fogo. Desse modo, o maior obstáculo enfrentado pelos juvenis é escapar da zona de fogo ingressando numa classe de altura considerada zona de escape. A probabilidade de um juvenil alcançar a altura da zona de escape é determinada pela freqüência e intensidade do fogo que causa a morte de caules e dificulta a taxa de crescimento para a altura de escape (Bond 2005). Com isso, o recrutamento é controlado pela precipitação que limita o estabelecimento de plântulas, e pelo fogo, que previne o recrutamento para as classes de tamanho de adultos. O declínio no número de árvores adultas é o resultado do contínuo, mas baixos níveis de mortalidade de adultos. Assim, a coexistência é possível em uma ampla variação de condições ambientais em função de longos períodos de lento declínio no número de árvores adultas intercalados com eventos ocasionais de recrutamento (Higgins et al. 2000). A ocorrência de extensos períodos com condições favoráveis ou desfavoráveis para o recrutamento de árvores pode levar o sistema a convergir para florestas ou campos (Sankaran et al. 2004). 1.3 O CERRADO COMO UM BIOMA DE SAVANA O Cerrado é considerado um tipo savana e é provavelmente a maior savana do mundo, ocupando aproximadamente 2.000.000 km2 no Brasil Central, mais áreas disjuntas nos biomas adjacentes (Silva & Bates 2002). A sua vegetação é caracterizada por um mosaico heterogêneo de fisionomias vegetais (Goodland 1971; Eiten 1972). O gradiente de fisionomias vegetais (cerrado sensu lato) pode ser ordenado em quatro tipos principais em função das suas características estruturais: campo limpo, campo sujo, cerrado sensu stricto e cerradão. Essas fisionomias formam um gradiente vegetacional contínuo, não havendo limites definidos entre uma e outra fisionomia. O campo limpo é a fisionomia com mais alta cobertura de gramíneas, o campo sujo apresenta alta cobertura de gramíneas e baixa cobertura de arbustos, o cerrado sensu stricto tem menor cobertura de gramíneas e maior cobertura de árvores e arbustos e cerradão é uma formação florestal com maior cobertura arbórea e ausência de gramíneas (Henriques 2005). Entre essas fitofisionomias, o cerrado sensu stricto ocupa em torno de 70% da região (Eiten 1978; Dias 1992)..
(17) 16. O gradiente fisionômico e estrutural da vegetação apresenta uma variação inversa do componente lenhoso (densidade e altura) e do componente herbáceo dominado por gramíneas (Goodland 1971; Henriques 2005) e tem sido correlacionado com variações nos fatores ambientais (nutrientes dos solo, água, fogo) em uma tentativa de explicar a distribuição de indivíduos, espécies e grupos de vegetação (Goldsmith 1974). A determinação dos fatores responsáveis pela distribuição e dinâmica das fitofisionomias é uma das principais questões do bioma Cerrado (Henriques 2005). Três hipóteses foram propostas para explicar a ocorrência e distribuição da vegetação no bioma Cerrado: (1) concentração de nutrientes do solo, (2) disponibilidade de água e (3) fogo. Um modo de abordar essas questões é observar quais os padrões e processos que podem ou não ser explicados pela influência desses fatores (Henriques 2005). O cerrado sensu lato está associado com solos com baixos conteúdos de nutrientes, de grande maturidade e altamente intemperizados. A maior densidade e altura de plantas lenhosas foram correlacionadas com uma maior fertilidade do solo por Goodland & Pollard (1973) e Lopes & Cox (1977), mas outros estudos não corroboraram essa relação (Moreira 2000; Rugiero et al. 2002). Devido à maior capacidade da matéria orgânica em reter nutrientes, os solos das fisionomias com maior cobertura vegetal (cerrado, cerradão) tornamse mais férteis do que aqueles com menor cobertura (campo limpo, campo sujo), embora isso não indique que as áreas que apresentam maior cobertura possuíssem originalmente solos mais férteis (Henriques 2005). O conteúdo de água nas camadas superficiais do solo no final da estação seca e a profundidade do solo (solos mais profundos podem suportar maior estoque de nutrientes) aumentam das fisionomias abertas para as mais fechadas (Henriques 2005). Em uma área de cerrado protegida da ação antrópica, Pinheiro & Durigan (2009) observaram que uma modificação mais lenta que o normalmente observado das fisionomias em alguns trechos esteja relacionada a fatores de natureza edáfica ou microclimática com a possibilidade de que a comunidade nunca atinja uma estrutura de cerradão. A ocorrência de fisionomias abertas do cerrado sensu lato era atribuída a limitação por água devido ao período seco e à precipitação menor que as das áreas de florestas (Warming 1892; Henriques 2005). No entanto, alguns estudos mostraram que: as espécies de plantas tinham pequena ou nenhuma adaptação fisiológica à seca; a maioria das plantas tem raízes profundas com acesso às camadas de solo com água e o solo em fisionomias de cerrado sensu stricto apresentava água disponível para a vegetação o ano inteiro (Rawitscher et al. 1943; Rawitscher 1948; Henriques 2005)..
(18) 17. O naturalista Lund (1843) propôs que os campos e o cerrado sensu stricto surgiram a partir de freqüentes queimadas de vegetação originalmente florestal que era reconhecida como cerradão. Essa hipótese foi reforçada pela análise florística da vegetação lenhosa dos cerrados (Rizzini 1963). Baseado em algumas evidências, Rizzini (1979) afirmou que em áreas sem limitações edáficas o cerrado sensu stricto pode surgir de freqüentes queimadas do cerradão. Estudos de filogenia sugerem que as adaptações observadas em várias plantas lenhosas do cerrado como cascas ou cortiças grossas, árvores ou arbustos com caules grossos e poucos galhos (paquicaules), xilopódios subterrâneos, evoluíram em resposta a ação do fogo a pelo menos 4-10 milhões de anos, coincidindo com a dominância de espécies de gramíneas C4, altamente inflamáveis (Simon et al. 2009). O fogo é um agente de perturbação na vegetação do bioma Cerrado com grande impacto na dinâmica das populações das plantas. Diferentes tipos de danos na vegetação lenhosa têm sido relatados, principalmente nos padrões reprodutivos, no recrutamento e estabelecimento de novos indivíduos e taxas de mortalidade (Miranda & Sato 2005). Embora o fogo possa estimular a reprodução vegetativa de plantas no cerrado, ele tende também a aumentar a mortalidade e reduzir o tamanho de plantas e em escala fisionômica diminui a cobertura de lenhosas, reduzindo a densidade de indivíduos e alterando a composição de espécies em direção a formas de crescimento menores (Hoffmann & Moreira 2002; Henriques 2005). A alteração na estrutura da vegetação lenhosa resultante de queimadas sucessivas via altas taxas de mortalidade e “topkill”, resultam em sistemas com fisionomias mais abertas, com favorecimento das gramíneas em relação às lenhosas. O que por sua vez, pode tornar o sistema mais susceptível a queimadas durante a estação seca dificultando a regeneração do sistema para sua forma fisionômica pré-fogo (Miranda & Sato 2005) No entanto, quando a vegetação do cerrado é protegida do fogo ocorre um aumento na riqueza de espécies, no número de indivíduos, número de caules e na área basal (Henriques & Hay 2002). O aumento no período de exclusão do fogo possibilita o ingresso de novas espécies e o retorno de espécies eliminadas pelo fogo (Libano & Felfili, 2006). Foi observado por Hoffmann (1996) e Henriques & Hay (2002) que o fogo altera as taxas de crescimento proporcional das formas de crescimento dominante das plantas que sofrem queimadas anuais em relação a seus controles não queimados. Estes estudos estabeleceram uma relação negativa entre o tamanho da planta e a taxa de crescimento populacional em áreas queimadas anualmente. Esses resultados indicam que as taxas de crescimento populacional em áreas queimadas anualmente seguem a seguinte ordem: árvores < arbustos < herbáceas. Essa relação é consistente com a observação de que o fogo promove o desenvolvimento de.
(19) 18. vegetação dominada por gramíneas e a sua exclusão leva ao sucesso de arbustos e árvores (Henriques 2005). Outra observação realizada por Pinheiro & Durigan (2009) através da análise de fotografias aéreas em áreas de cerrado protegido contra o fogo durante 40 anos no Estado de São Paulo, mostrou que a densidade e altura da vegetação de fisionomias abertas ou áreas antropizadas evoluem para uma fisionomia mais densa e de porte mais alto. 1.4 FORMULAÇÃO DO PROBLEMA Foi proposto por Henriques & Hay (2002) que o fogo é o principal fator determinante das fisionomias da vegetação do Cerrado. A melhor evidência que o fogo é o fator principal de modificações é a observação de que em áreas protegidas do fogo a taxa de recrutamento populacional é maior que a taxa de mortalidade. Resultados semelhantes observados para cerrado sensu stricto foram obtidos por (Aquino et al. 2007; Roitman et al. 2008). Por outro lado, com a ocorrência de fogo no cerrado, as fisionomias mais fechadas podem estar sendo substituídas por fisionomias mais abertas com drásticas modificações na composição de espécies (Hoffman 1999; Moreira 2000; Henriques & Hay 2002; Henriques 2005). Na ocorrência de fogo, todos os tipos fisionômicos sofrem um processo de regressão para uma fisionomia mais aberta, com desenvolvimento do estrato dominado por gramíneas e herbáceas e diminuição do estrato lenhoso arbustivo-arbóreo (Henriques 2005). Assim é importante avaliar as mudanças na dinâmica natural da vegetação de cerrado sobre o tempo para entender os processos e mecanismos que mantém essa comunidade (Henriques & Hay 2002; Aquino et al. 2007).. 2 REFERÊNCIAS BIBLIOGRÁFICAS Aquino, F.G.; Walter, B.M.T. & Ribeiro, J.F. 2007. Woody community dynamics in two fragments of “cerrado” stricto sensu over a seven-year period (1995-2002), MA, Brazil. Revista Brasileira de Botânica, 30: 113-121. Beerling, D.J. and Osborne, C.P. 2006. The origin of the savanna biome. Global Change Biology. 12: 2023-2031. Bond, W.J. 2008. What limits trees in C4 grasslands and savannas? Annual Review of Ecology, Evolution and Systematics. 39: 641-659. Bond, W.J. 2005. Large parts of the world are brown or black: a different view on the “Green World” hypothesis. Journal of Vegetation Science. 16: 261-266..
(20) 19. Bond, W.J.; Woodward, G. I. & Midgley, G. F. 2005. The global distributions of ecosystems in a world without fire. New Phytologist. 165: 525-538. Bourlière, F. & Hadley, M. 1970. The ecology of tropical savannas. Annu. Rev. Ecol. Syst. 1:125-152. Bucine, G. & Hanan, N.P. 2007. A continental-scale analysis of tree cover in African savannas. Global Ecology and Biogeography. 16: 593-605. Dias, B.F.S. 1992. Cerrados: uma caracterização. In: Dias, B.F.S. (Eds.). Alternativas de desenvolvimento dos Cerrados: Manejo e Conservação dos Recursos Naturais Renováveis. FUNATURA. Brasília, Distrito Federal, Brasil, p.11-25. Eiten, G. 1972. The cerrado vegetation of Brazil. Botanical Review. 38: 201-341. Eiten, G. 1978. Delimitation of the Cerrado Concept. Vegetatio, 36(3): 169-178. Frost, P.; Medina, E.; Menaut, J.C.; Solbrig, O.; Swift, M. & Walker, B. 1986. Responses of savannas to stress and disturbance. IUBS Special Issue. 10: 1-82. Goldsmith, F.B. 1974. Multivariate analyses of tropical grassland communities in Mato Grosso, Brazil. Journal of Biogeography. 1: 111-122 Goodland, R. 1971. A physiognomic analysis of the cerrado vegetation of central Brasil. The Journal of Ecology. 59(2): 411-419. Goodland, R. & Pollard, R. 1973. The brazilian cerrado vegetation: a fertility gradient. Journal of Ecology. 6: 219-224. Henriques, R.P.B. 2005. Influência da história, solo e fogo na distribuição e dinâmica das fitofisionomias no bioma do cerrado. In: Scariot, A.; Souza-Silva, J.C. e Felfili, J.M. (orgs). Cerrado: ecologia, biodiversidade e conservação. Probio, Ministério do meio ambiente, Brasil, p.73-92. Henriques, R.P.B. & Hay, J.D. 2002. Pattern and dynamics of plant population. In: Oliveira, O.S.; Marquis, R.J. (eds.). The cerrados of Brazil: ecology and natural history of a neotropical savanna. Columbia University Press, New York, p. 140- 158. Higgins, S.I.; Bond, W.J. & Trollope, W.S.W. 2000. Fire, resprouting and variability: a recipe for tree-grass coexistence in savanna. Journal of Ecology. 88: 213-229. Higgins, S.I.; Bond, W.J.; February, E.C.; Bronn, A.; Euston-Brown, W.; Enslin, B.; Govender, N.; Rademan, L.; O’Reagan, S.; Potgieter, A.L.F.; Scheiter, S.; Sowry, R.; Trollope, L. & Trollope, W.S.W. 2007. Effects of four decades of fire manipulation on woody vegetation structure in savanna. Ecology. 88(5): 1119-1125. Hoffman, W.A. 1996. The effects of fire and cover on seedling establishment in a neotropical savanna. Journal of Ecology. 84: 383–393..
(21) 20. Hoffmann, W.A. 1999. Fire and population dynamics of woody plants in a neotropical savanna: Matrix Model Projections. Ecology. 80: 1354-1369. Hoffman, W.A. & Jackson, R.B. 2000. Vegetation-climate feedbacks in the conversion of tropical savanna to grassland. Journal of climate. 13: 1593-1602. Hoffmann, W. A. & Moreira, A. G. 2002. The role of fire in population dynamics of woody plants. In: Oliveira, O.S.; Marquis, R.J. (eds.). The cerrados of Brazil: ecology and natural history of a neotropical savanna. Columbia University Press, New York, p. 140- 158. Hoffman, W.A. & Solbrig, O.T. 2003. The role of topkill in the differential response of savanna woody species to fire. Forest Ecology and Management. 180: 273-286. Hoffman, W.A.; Schroeder, W; Jackson, R.B. 2002. Positive feedbacks of fire, climate, vegetation and the conversion of tropical savanna. Geophysical Research Letters. 29: 2052 House, J.I.; Archer, S.; Breshears, D.D. and Scholes, R.J. 2003. Conundrums in mixed woody-herbaceous plant systems. Journal of Biogeography. 30: 1763-1777. Jeltsch, F.; Weber, G.E. & Grimm V. 2000. Ecological buffering mechamisms in savannas: A unifying theory of long-term tree-grass coexistence. Plant Ecology. 150: 161 – 171. Lauenroth, W.K.; Urban, D.L.; Coffin, D.P.; Parton, W.J.; Shugart, H.H.; Kirchner, T.B. & Smith, T.M. 1993. Modeling vegetation structure-ecosystem process interactions across sites and ecosystems. Ecological Modeling. 67: 49-80. Libano, A.M. & Felfili, J.M. 2006. Mudanças temporais na composição florística e na diversidade de um cerrado sensu stricto do Brasil Central em um período de 18 anos (1985-2003). Acta Botânica Brasileira. 20(4): 927-936. Lopes, A. S. & Cox, F. R. 1977. Cerrado vegetation in Brazil: an edaphic gradient. Agronomy Journal. 69: 828-831. Lund, P.W. 1843. Blik paa Brasilien dryeverden. Selsk Skriften. 11: 1-82. McPherson, G. R. 1993. Effect of herbivory and herb interference on oak establishment in a semi-arid temperate savanna. Journal of Vegetation Science. 4: 687-692. Menaut, J. C.; Gignoux, J.; Parado, C. & Clobert, J. 1990. Tree Community Dynamics in a Humid Savanna of the Cote-d'Ivoire: Modelling the Effects of Fire and Competition with Grass and Neighbours. Journal of Biogeography. 17: 471-481. Moreira, A. G. 2000. Effects of fire protection on savanna structure in Central Brazil. Journal of Biogeography. 27: 1021–1029.
(22) 21. Miranda, H. S. & Sato, M. N. 2005. Efeitos do fogo na vegetação lenhosa do Cerrado. In: Scariot, A.; Souza-Silva, J.C. e Felfili, J.M. (orgs). Cerrado: ecologia, biodiversidade e conservação. Probio, Ministério do Meio Ambiente, Brasil, p.94-105. Pinheiro, E.S. & Durigan, G. 2009. Dinâmica espaço-temporal (1962-2006) das fitofisionomias em unidade de conservação do Cerrado no sudeste do Brasil. Revista Brasileira de Botânica. 32(3): 441-454. Quesada, C. A.; Miranda, A. C.; Hoddnet, M. G.; Santos, A. J. B; Miranda, H. S. & Breyer, L. M. 2004. Seasonal and depth variation of soil moisture in a burned open savanna (campo sujo) in Central Brasil. Ecological Aplications. 14: 33-41. Rawitscher, F.; Ferri, M. G. & Rachid, M. 1943. Profundidade dos solos e vegetação em campos cerrados do Brasil meridional. Anais da Academia Brasileira de Ciências. 15: 267-294. Rawitscher, F. 1948. The water economy of vegetation of the campos cerrados in southern Brazil. Journal of Ecology. 36: 16-32. Rizzini, C.T. 1963. A flora do cerrado. In: M.G. Ferri, Ed., Simpósio sobre o cerrado. São Paulo: Editora da Universidade de São Paulo, p. 126-177. Rizzini, C.T. 1979. Tratado de Fitogeografia do Brasil: Aspectos Sociológicos e Florísticos. São Paulo: Hucitec Ltda. Roitman, I.; Felfili, J.M. & Rezende, A.V. 2008. Tree dynamics of a fire-protected cerrado sensu stricto surrounded by forest plantations, over a 13-years period (1991-2004) in Bahia, Brazil. Plant Ecology. 197: 255-267. Ruggiero, P.G.C.; Batalha, M.A.; Pivello, V.R. & Meireles, S.T. 2002. Soil-vegetation relationships in cerrado (Brazilian savanna) and semideciduous Forest, Southeastern Brasil. Plant Ecology. 160:1-16. Sala, O.E., Lauenroth, W.K. & Golluscio, R.A. 1997. Plant functional types in temperate semi-arid regions. In: Plant Functional Types: their Relevance to Ecosystem Properties and Global Change. Smith, T.M., Shugart, H.H. & Woodward, F.I. (eds.). Cambridge University Press, Cambridge, p. 217–233. Sankaran, M.; Ratnam, J. & Hanan, N. P. 2004. Tree–grass coexistence in savannas revisited – insights from an examination of assumptions and mechanisms invoked in existing models. Ecology Letters. 7: 480–490 Sankaran, M.; Hanan, N.P.; Scholes, R.J.; Ratnam, J.; Cade, B.S.; Ardo, J.; Augustine, D.J.; Banyikwa, F.; Bronn, A.; Bucini, G.; Caylor, K.K.; Coughenour, M.B.; Diouf, A.; Ekaya, W.; Feral, C.J.; February, E.C.; Frost, P.G.H.; Gignoux, J.; Hiernaux, P.;.
(23) 22. Higgins, S.I., Hrabar, H.; Le Roux, X.; Ludwig, F.; Metzger, K.L.; Prins, H.H.T.; Ringrose, S.; Sea, W.; Tews, J.; Worden, J. & Zambatis, N. 2005. Determinants of woody cover in African savannas. Nature. 438: 846 - 849. Sankaran, M.; Ratnam, J. & Hanan, N. 2008. Woody cover in African savannas: the role of resources, fire and herbivory. Global Ecology and Biogeography. 17:236-245. Scarpe, C. 1992. Dynamics of savanna ecosystem. Journal of Vegetation Science. 3:293300. Scholes, R.J. 1990. The influence of soil fertility on the ecology of Southern African dry savannas. Journal of Biogeography. 17: 415-419. Scholes, R.J. & Archer, S.R. 1997. Tree-grass interactions in savannas. Annual Review of Ecology and Systematics. 28: 517 – 544. Silva, J. M. C. & Bates, J. M. 2002. Biogeographic patterns and conservation in the South America Cerrado: a Tropical Savanna Hotspot. Bioscience. 52(3): 225-233. Simon, M. F.; Grether, R.; Queiroz, L. P.; Skema, C.; Pennington, R. T. & Hughes, C. E. 2009. Recent assembly of the Cerrado, a neotropical plant diversity hotspot, by in situ evolution of adaptations to fire. PNAS. 106(48): 20359-20364. Van Langevelde, F.; van der Vijver, C.A.D.M.; Kumar, L.; van de Koppel, J. & de Ridder, N. 2003. Effects of fire and herbivory on the stability of the savanna ecosystems. Ecology. 84: 337-350. Walter, H. 1971. Ecology of Tropical and Subtropical Vegetation. Oliver and Boyd. Edinburgh, UK. Walker, B.H. & Noy-Meir, I. 1982. Aspects of the stability and resilience of savanna ecosystems. In: Huntley, B.J. & Walker, B.H. (eds). Ecology of tropical savannas. Springer-Verlag, Berlin, Germany, p. 556-590. Warming, E. 1892. Lagoa Santa. Et Beitrag til den biologiske plantegeografi. D. Kgl. Danske Vidensk Selsk., Skr. 6. Copenhagen. Willians, R.J.; Duff, G.A.; Bowman, D.M.J.S. & Cook, G.D. 1996. Variation in the composition and structure of tropical savannas as a function of rainfall and soil texture along a large-scale climatic gradient in the Northern Territory, Australia. Journal of Biogeography. 23: 747-756..
(24) 23. CAPÍTULO 2 DINÂMICA DA VEGETAÇÃO LENHOSA EM UM CERRADO SENSU STRICTO NO PERÍODO DE 19 ANOS 1 INTRODUÇÃO As savanas são formações onde coexistem duas formas de vida: árvores e gramíneas, sendo o extrato graminoso contínuo, mas ocasionalmente interrompido por árvores e arbustos. A vegetação desenvolve-se sobre solos bem drenados e o padrão de crescimento das plantas está associado com um clima fortemente sazonal (Bourlière & Hadley 1970; Scholes & Archer 1997). Apresentam ampla abrangência geográfica e ocorrem em regiões onde a precipitação média anual (PMA) pode variar de ~ 200 mm a ~ 3.000 mm, e têm uma amplitude latitudinal de ~ 30° norte e ao sul do equador, cobrindo uma área de aproximadamente 33 milhões de Km² (Scholes & Archer 1997; Beerling & Osborn 2006; Bond 2008). Existem quatro fatores principais que determinam a ocorrência de savanas: água, nutrientes, herbivoria e fogo, e são utilizados para classificar as savanas em quatro tipos principais: (1) baixa disponibilidade de água e alto suprimento de nutrientes; (2) alta disponibilidade de água e solos bastante pobres em nutrientes; (3) água e nutrientes são altamente limitantes e (4) sem limitação de água e nutrientes (Frost et al.1986). A maior parte do cerrado pode ser incluída no segundo tipo (Henriques & Hay 2002). Existem dois grupos de hipóteses propostos pra explicar o funcionamento de savanas. O primeiro grupo considera as savanas como sistemas estáveis, ou seja, a coexistência de árvores e gramíneas a longo prazo ocorre independentemente de perturbações ambientais. O segundo grupo de hipóteses considera as savanas como sistemas instáveis, isto é, a coexistência de árvores e gramíneas a longo prazo depende de perturbações como fogo e herbivoria. Reconhecer se uma savana é intrinsecamente um sistema instável mantido por perturbações tais como o fogo e herbivoria ou um sistema estável que persiste em detrimento dessas perturbações é crítico para o seu manejo e entendimento. (Scarpe 1992; Sankaran et al. 2004). Em algumas savanas o regime de fogo é considerado o principal fator limitante da biomassa e densidade de árvores, e modificador da composição e riqueza de espécies especialmente em locais onde a água não é um fator limitante (Bond 2008; Bond et al. 2005)..
(25) 24. A mortalidade de árvores pelo fogo tem resultado na atual distribuição da vegetação dominada por gramíneas C4 e não existe um consenso sobre o que determina o regime de fogo nesses ecossistemas (Bond et al. 2005). Por apresentar uma variação de PMA entre 800 mm e 2.000 mm (Dias 1992), o Cerrado pode ser considerado uma savana úmida. Desse modo, o principal fator considerado limitante da cobertura e densidade arbórea no Cerrado é o fogo, pois a herbivoria tem pouca influência nesse ecossistema devido à reduzida biomassa de ungulados consumidores dessa vegetação (Henriques 2005; Bond 2008). A determinação dos fatores responsáveis pela distribuição e dinâmica das fitofisionomias é uma das principais questões do bioma Cerrado (Henriques 2005). Foi proposto por Lund (1843) que os campos e o cerrado sensu stricto surgiram a partir de freqüentes queimadas da vegetação originalmente florestal reconhecida como cerradão. Uma análise florística da vegetação lenhosa dos cerrados reforçou essa hipótese (Rizzini 1963). Baseado em algumas evidências, Rizzini (1979) afirmou que em áreas sem limitações edáficas o cerrado sensu stricto pode surgir de freqüentes queimadas do cerradão. Estudos de filogenia sugerem que algumas adaptações observadas em plantas lenhosas endêmicas do cerrado como cascas grossas, paquicaules, brotos subterrâneos, entre outras, evoluíram em resposta à ação do fogo há pelo menos 4-10 milhões de anos, coincidindo com a dominância de espécies de gramíneas C4, altamente inflamáveis (Simon et al. 2009). Diferentes tipos de danos na vegetação lenhosa têm sido relatados, principalmente nos padrões reprodutivos, no recrutamento e estabelecimento de novos indivíduos e taxas de mortalidade (Miranda & Sato 2005). Embora o fogo possa estimular a reprodução vegetativa de plantas no cerrado, ele tende também a aumentar a mortalidade, reduzir o tamanho de plantas, diminuir a cobertura de lenhosas, reduzindo a densidade de indivíduos e alterando a composição de espécies em direção a formas de crescimento menores (Hoffmann & Moreira 2002; Henriques 2005). Em áreas de cerrado protegidas do fogo, observações indicam que a vegetação sofre alterações, tanto na composição de espécies quanto em densidade de árvores em direção a matas fechadas (Coutinho 1982, 1990; Moreira 2000; Henriques & Hay 2002; Roitman et al. 2008; Pinheiro & Durigan 2009). Além disso, alguns estudos usando plantas do cerrado sugerem que se a frequência de fogo diminuir, a cobertura e a densidade de plantas lenhosas aumentam (Hoffman 1999). Foi proposto por Henriques & Hay (2002) que o fogo é o principal fator determinante das fisionomias da vegetação do Cerrado, utilizando como importante evidência, a observação.
(26) 25. de que em áreas protegidas do fogo a taxa de recrutamento populacional é maior que a taxa de mortalidade. Resultados semelhantes observados para cerrado sensu stricto foram obtidos por Aquino et al. (2007) e Roitman et al. (2008). Com a ocorrência de fogo no cerrado, as fisionomias mais fechadas podem estar sendo substituídas por fisionomias mais abertas com drásticas modificações na composição de espécies, com desenvolvimento do estrato dominado por gramíneas e herbáceas e diminuição do estrato lenhoso arbustivo-arbóreo (Hoffman 1999; Moreira 2000; Henriques & Hay 2002; Henriques 2005). Durigan & Ratter (2006) sugerem que mais estudos de comunidades a longos prazos, usando parcelas permanentes para caracterizar a dinâmica de transição de cerrado/floresta devem ser realizados. Para entender os processos e mecanismos que mantém a comunidade de cerrado é importante avaliar as mudanças na dinâmica natural da vegetação sobre o tempo (Henriques & Hay 2002; Aquino et al. 2007). Assim, esse estudo analisou as alterações na vegetação de uma área de cerrado sensu stricto depois de 18,9 anos, mais especificamente as seguintes questões foram analisadas: (1) Como ocorre e quais são as modificações na composição florística em um cerrado sensu stricto? (2) Quais são as formas de crescimento de plantas lenhosas e que modificações ocorrem em suas proporções de número de espécies, indivíduos, caules e área basal em um cerrado sensu stricto? (3) Como as taxas de mortalidade, recrutamento e incremento variam entre as formas de crescimento e entre as classes de tamanho das plantas lenhosas de um cerrado sensu stricto? (4) A taxa de recrutamento é maior que a taxa de mortalidade em um cerrado sensu stricto? (5) O cerrado é uma vegetação em equilíbrio ou desequilíbrio?.
(27) 26. 2 MATERIAL E MÉTODOS 2.1 ÁREA DE ESTUDO A amostragem foi realizada na Reserva Ecológica do IBGE (Instituto Brasileiro de Geografia e Estatística), localizada a 16 km do centro de Brasília, latitude 15°57' sul e longitude 47°53' oeste (Figura 1). A altitude varia de 1.045 m a 1.125 m, com uma declividade média de 6%. Os solos são predominantemente “Oxisols” (U.S. Soil Taxonomy System). Quimicamente, os solos são ácidos (pH ≈ 5,4), com baixa disponibilidade de fósforo (P < 1 ppm), baixa concentração de cátions (K, Ca, Mg), alta concentração de alumínio e alto conteúdo de argila (Moreira 1992). A precipitação média anual, baseada no registro de 17 anos, é 1.469 mm. A precipitação mensal é bastante sazonal, com mais de 90% das chuvas ocorrendo de outubro a abril. A estação seca ocorre de maio a setembro. A variação da temperatura é típica de clima subtropical continental, com uma média anual de 21,9°C durante o mesmo período de 17 anos. A Reserva apresenta uma vegetação predominante relacionada com terrenos bem drenados das superfícies interfluviais que compreende dois tipos principais de fisionomia: uma savânica e outra campestre, representados respectivamente pelo cerrado sensu lato e sensu stricto e pelo campo sujo, sendo que o cerrado sensu lato ocupa cerca de 75% da superfície da Reserva (IBGE 2004). 2.2 INVENTÁRIO DE CAMPO Foi inventariada uma parcela permanente (unidade amostral) dentro de uma área de cerrado sensu stricto de 0,5 hectares (20 m x 250 m) estabelecida em 1989 quando foram registradas 48 espécies de plantas lenhosas totalizando 980 indivíduos e 1.158 caules (Henriques & Hay 2002). Essa área estava protegida do fogo desde 1973, mas um incêndio acidental atingiu toda a área em outubro de 1994. Esse estudo foi baseado nos dados coletados em outubro 2009 em relação ao estabelecido no inventário de junho de 1991. A parcela de 20 m x 250 m foi dividida em subparcelas de 10 m x 10 m cada (Figura 1). Dentro de cada sub-parcela, todas as plantas com diâmetro no nível do solo ≥ 4,8 cm foram identificadas até espécie e foi registrada a sua circunferência ao nível do solo e sua altura. Plantas com múltiplos caules (caules distantes até 30 cm do caule principal) resultado.
(28) 27. do crescimento vegetativo foram incluídas no censu se a soma de seus diâmetros forem ≥ 4,8 cm. Cada planta incluída no censu de 1991 foi etiquetada com uma placa de alumínio numerada e, então, identificada, bem como os novos indivíduos obtidos em 2009. 2.3 CLASSIFICAÇÃO DAS FORMAS DE CRESCIMENTO Para cada espécie com número maior ou igual a 15 indivíduos (número mínimo para executar a análise de regressão não linear) foi utilizada uma regressão não linear assintótica y = a(1 – e(-bx)), onde x é o diâmetro do caule (cm), y é a altura da planta (m), a e b são constantes determinadas no ajuste. O a é assíntota onde foi determinada a altura máxima (Hmax), e o diâmetro máximo (Dmax) foi determinado pela relação Dmax = ln(a)/b. As espécies foram classificadas baseadas nas formas de crescimento definidas por modificada por Henriques & Hay (2002), com algumas modificações utilizando a altura máxima como a seguir: árvore (Hmax ≥ 3 m), arbustos (Hmax < 3 m) e monocotiledôneas. Nessa última categoria foram incluídas as espécies da família Arecaceae e Velloziaceae por serem monocotiledâneas e apresentam um padrão de crescimento semelhante. Foi determinado um modelo geral relacionando o Dmax com Hmax para essas espécies do tipo y = a/(1 + e(-(x – x0)/b)), onde y é o Hmax (m), x é o diâmetro máximo obtido em campo, a, b e x0 são as constantes obtidas pelo ajuste. Para as espécies com menos de 15 indivíduos, classificou-se a sua forma de crescimento usando apenas a altura máxima obtida em campo (Hmax)..
(29) 28. Figura 1. Localização da parcela de 20 m x 250 m na área de estudo, na Reserva Ecológica do IBGE, Distrito Federal e no Brasil..
(30) 29. 2.4 ANÁLISE DOS DADOS Foi elaborada uma lista completa com todas as espécies registradas, incluindo o número de indivíduos, número de caules e área basal nos dois levantamentos apresentada no apêndice I. Foram calculadas as taxas de mortalidade e as taxas de recrutamento para o número total de indivíduos, para o número de indivíduos pelas formas de crescimento e para as populações de plantas com número ≥ 15 indivíduos na parcela. As taxas de mortalidade (m) e recrutamento (r) anual foram calculadas usando as equações (Sheil et al. 1995; Sheil & May 1996):. ଵ. ܰ ௧ ݉ = 100 ቐ1 − 1 − ൬ ൰൨ ቑ ܰଵଽଽଵ ଵ. ܰ ௧ = ݎ100 ቐ1 + ൨ − 1ቑ ܰଵଽଽଵ. Onde ܰଵଽଽଵ é o número de indivíduos no primeiro inventário, ܰ é o número de. indivíduos mortos, ܰ é o número de indivíduos recrutados e ݐé o tempo entre os inventários. (18,9 anos).. A taxa de crescimento em diâmetro (mm) do caule foi calculada pela diferença no diâmetro entre o inventário de 1991 e 2009, dividido pelo período de tempo em anos (18,9 anos). Algumas plantas mostraram crescimento negativo em diâmetro (170 plantas de 700 plantas utilizadas para os cálculos de crescimento). Isso deve ter sido causado por perdas naturais de casca, contração do tronco durante a estação seca, perdas da casca e “topkill” devido ao evento de fogo em 1994 e/ou erros de medida. Assim foi definido um limite operacional para incluir os incrementos de diâmetro nos cálculos, usando o método proposto por Newberry et al. (1999). Nesse método é construído um gráfico onde o eixo X é formado por uma curva cumulativa decrescente da proporção de plantas (logit(p)) e o eixo Y formado pelo intervalo de classes de incremento. A curva obtida mostrou um claro declínio negativo a partir de -2,5 mm após esse ponto há um aumento até certo valor constante da distribuição. Portanto, os valores de taxas de crescimento ≤ -2,5 mm (16 casos) foram considerados como resultado de erros de medida e os valores entre -2,5 mm e 0,0 mm foram considerados como resultado de contração do tronco ou perda de casca ou “topkill”..
(31) 30. Após o cálculo do crescimento por indivíduo, a média de crescimento por espécie foi estimada usando o método de amostragem aleatória dos dados (1.000 vezes) com reposição (“Bootstrapping”). 2.5 ANÁLISES ESTATÍSTICAS Todas as análises estatísticas foram realizadas com o programa SYSTAT versão 12 e Sigmaplot versão 11 (Systat Software 2008). Para satisfazer a premissa de normalidade dos dados foi realizada uma transformação angular das taxas de mortalidade e recrutamento e uma transformação logarítmica das taxas de crescimento. Comparações na distribuição de diâmetros e entre 1991 e 2009 foi feito utilizando o teste de Kolmogorov-Smirnov (Siegel & Castellan 1988). Foi realizado um teste qui-quadrado para verificar se houve diferenças no número de espécies, no número de indivíduos, no número de caules e na área basal por formas de crescimento entre 1991 e 2009. Foi realizada uma Análise de Variância (ANOVA) de um fator para testar diferenças nas médias das taxas de mortalidade, recrutamento e crescimento entre as formas de crescimento. Na comparação das taxas de mortalidade, recrutamento e crescimento, o tamanho da amostra não foi grande o suficiente para determinar de forma acurada o valor de F. Nesse caso foi utilizado o método de reamostragem (1000 vezes) para determinar os valores críticos de F. Foi realizado um teste post-hoc HSD de Tukey para determinar onde ocorrem as diferenças significativas..
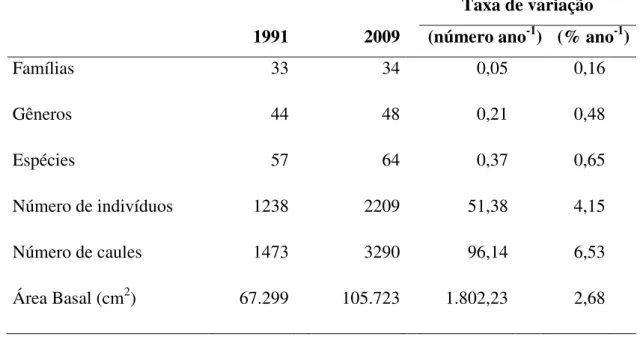
(32) 31. 3 RESULTADOS 3.1 COMPOSIÇÃO FLORÍSTICA E ESTRUTURA DA VEGETAÇÃO Foram registradas 33 famílias em 1991 e 34 em 2009. Apenas a família Celastraceae representada não foi registrada em 2009. Duas novas famílias foram encontradas em 2009: Myrtaceae e Papilionaceae. Essas mudanças representam um incremento de 3,0% no período e 0,2% ano-1 (Tabela 1). Foi encontrado um total de 44 gêneros em 1991 e 48 em 2009, sendo que 43 ocorreram nos dois levantamentos, apenas o gênero Plenckia presente foi extinto no local e cinco novos gêneros (Blepharocalyx, Bowdichia, Cybistax, Dimorphandra e Heteropterys) foram registrados em 2009. Isso corresponde a uma variação de total de 9,0% no período (0,5% ano-1) (Tabela 1). Foram registradas 66 espécies, sendo 57 em 1991 e 64 em 2009, correspondendo a um aumento de 12,3% no período ou 0,7% ano-1 (Tabela 1). Do total de espécies encontradas, 54 ocorreram em ambos os levantamentos. Duas espécies encontradas em 1991 não ocorreram em 2009 (Plenckia populnea e Allagoptera campestre), enquanto que nove espécies foram registradas apenas em 2009 (Aspidosperma tomentosum, Blepharocalyx salicifolius, Bowdichia virgilioides, Cybistax antisyphilitica, Dimorphandra mollis, Heteropterys byrsonimifolia, Miconia albicans, Miconia fallax e Pisonia noxia). Essas mudanças correspondem a uma taxa de extinção de 0,2 espécies ha-1 ano-1 e uma taxa de imigração de 1,0 espécies ha-1 ano-1. Com relação ao número de indivíduos, foi obtido um total de 1.238 indivíduos em 1991 e 2.209 em 2009, o que corresponde a um aumento total de 78%, isto é, 4,1% ano-1 (Tabela 1). Ainda pode-se observar que o número total de caules registrados em 1991 foi 1.473, enquanto que em 2009 foram obtidos 3.290 caules representando um aumento de +123% (6,5% ano-1). Houve um aumento de aproximadamente 50% da área basal, tendo sido registrados 67.299cm² em 1991 e 101.361cm² em 2009 produzindo uma variação 2,7% ano-1 (Tabela 1)..
(33) 32. Tabela 1. Número de famílias, gêneros e espécies, indivíduos, caules e área basal (cm2), taxas de variação no período de 18,9 anos (1991 - 2009) em 0,5 ha de cerrado sensu stricto, na Reserva Ecológica do IBGE, Distrito Federal, Brasil. Taxa de variação (número ano-1) (% ano-1). 1991. 2009. Famílias. 33. 34. 0,05. 0,16. Gêneros. 44. 48. 0,21. 0,48. Espécies. 57. 64. 0,37. 0,65. Número de indivíduos. 1238. 2209. 51,38. 4,15. Número de caules. 1473. 3290. 96,14. 6,53. 67.299. 105.723. 1.802,23. 2,68. Área Basal (cm2).
(34) 33. Em 1991 a família com maior riqueza de espécies foi Arecaceae (seis espécies), seguida por Vochysiaceae e Fabaceae com cinco e quatro espécies respectivamente. De modo que houve a perda de uma espécie na família Arecaceae e a entrada de uma espécie na família Fabaceae em 2009. Em 2009 as famílias Vochysiaceae, Fabaceae e Arecaceae apresentaram a maior riqueza com cinco espécies cada (Figura 2a). As famílias com maior número de indivíduos em 1991 foram Asteraceae, Ochnaceae e Malpighiaceae (Figura 2b). Enquanto que as famílias que apresentaram maior número de indivíduos em 2009 foram Melastomataceae, Ochnaceae e Malpighiaceae. Embora o número de indivíduos na família Ochnaceae de 1991 tenha sido maior, ela permaneceu como a segunda família mais abundante em 2009 (Figura 2b). De modo semelhante, as famílias Melastomataceae, Ochnaceae, Malpighiaceae, Vochysiaceae, Velloziaceae e Guttiferae apresentaram um aumento no número de indivíduos em 2009. Outro aumento registrado foi no número de indivíduos na família Melastomataceae que apresentou apenas dois indivíduos em 1991 e 345 indivíduos em 2009. A família Arecaceae apresentou a maior área basal em 1991 seguida pelas famílias Vochysiaceae e Ochnaceae. A família Melastomataceae também apresentou a maior área basal total em 2009, seguida por Arecaceae e Ochnaceae (Figura 2c). As famílias que registraram o maior aumento em área basal foram Melastomataceae, Velloziaceae, Fabaceae e Dilleniaceae. Além da família Celastraceae, cuja extinção local contribuiu para a redução da área basal total, as famílias Styracaceae, Hippocrateriaceae, Asteraceae, Rubiaceae e Symplocaceae também apresentaram redução de área basal em 2009, sendo a maior redução registrada para a família Styracaceae (Figura 2c). Em 1991 os gêneros com maior número de espécies foram Erythroxylum, Byrsonima, Qualea e Syagrus com três espécies cada um. O gênero com maior número de espécies em 2009 foi Miconia com quatro espécies, seguido pelos gêneros Erythroxylum, Byrsonima, Qualea e Syagrus com três espécies cada um (Figura 3a). O maior aumento no número de espécies foi no gênero Miconia com o ingresso de duas espécies em 2009. Os gêneros mais abundantes em 1991 foram Eremanthus, Ouratea e Byrsonima e em 2009 foram Miconia, Ouratea e Byrsonima (Figura 3b). O gênero Miconia apresentou o maior aumento seguido pelo gênero Davilla, enquanto a maior redução na abundância foi no gênero Eremanthus, seguido por Styrax..
(35) 34. (a). VOCHYSIACEAE FABACEAE ARECACEAE MELASTOMATACEAE MALPIGHIACEAE ERYTHROXYLACEAE NICTAGINACEAE ASTERACEAE APOCYNACEAE RUBIACEAE GUTTIFERAE CONNARACEAE BIGNONIACEAE OUTRAS FAMÍLIAS (22). 2009 1991. 0. 2. 4. 6. 8 10 12 14 16 Número de espécies. 18. 20. 22. 24. (b). MELASTOMATACEAE OCHNACEAE MALPIGHIACEAE VOCHYSIACEAE VELLOZIACEAE GUTTIFERAE ASTERACEAE DILLENIACEAE PROTEACEAE ARECACEAE FABACEAE MYRSINACEAE ERYTHROXYLACEAE OUTRAS FAMÍLIAS (22). 0. 100. 200. 300. 400. 500. Número de indivíduos. (c). MELASTOMATACEAE ARECACEAE OCHNACEAE FABACEAE VOCHYSIACEAE VELLOZIACEAE MALPIGHIACEAE STYRACACEAE ASTERACEAE SYMPLOCACEAE DILLENIACEAE PROTEACEAE GUTTIFERAE OUTRAS FAMÍLIAS (22). 0. 5000. 10000 Área Basal. 15000. 20000. 25000. (cm2). Figura 2. Número de espécies (a), número de indivíduos (b) e área basal em cm2 (c) das famílias, em ordem de importância no período de 18,9 anos (1991 - 2009) em 0,5 ha de cerrado sensu stricto, na Reserva Ecológica do IBGE, Distrito Federal, Brasil..
Imagem



Documentos relacionados
No Estado do Pará as seguintes potencialidades são observadas a partir do processo de descentralização da gestão florestal: i desenvolvimento da política florestal estadual; ii
29 Table 3 – Ability of the Berg Balance Scale (BBS), Balance Evaluation Systems Test (BESTest), Mini-BESTest and Brief-BESTest 586. to identify fall
Analisando-se os resultados, observou-se que, logo na primeira avaliação aos 8 dias de armazenamento, em ambiente refrigerado, o tratamento testemunha já
Com a investigação propusemo-nos conhecer o alcance real da tipologia dos conflitos, onde ocorrem com maior frequência, como é que os alunos resolvem esses conflitos, a
Bom, eu penso que no contexto do livro ele traz muito do que é viver essa vida no sertão, e ele traz isso com muitos detalhes, que tanto as pessoas se juntam ao grupo para
Os Autores dispõem de 20 dias para submeter a nova versão revista do manuscrito, contemplando as modifica- ções recomendadas pelos peritos e pelo Conselho Editorial. Quando
Receita de Produtos (Quantidade) Margem de Produtos (Qualidade) Alavancadores de Produtividade Investimento Investimento Processo Processo Mercado Mercado
13 Além dos monômeros resinosos e dos fotoiniciadores, as partículas de carga também são fundamentais às propriedades mecânicas dos cimentos resinosos, pois





