Universidade Federal de Ouro Preto
Programa de Pós-Graduação em Engenharia Ambiental
Mestrado em Engenharia Ambiental
Erik Sartori Jeunon Gontijo
“
INTERAÇÃO ENTRE SUBSTÂNCIAS HÚMICAS AQUÁTICAS E
ELEMENTOS METÁLICOS NA PORÇÃO LESTE DO
QUADRILÁTERO FERRÍFERO – MG
”Dissertação apresentada ao Programa de Pós-Graduação em Engenharia Ambiental, Universidade Federal de Ouro Preto, como parte dos requisitos necessários para a obtenção do título: “Mestre em Engenharia Ambiental – Área de Concentração: Meio Ambiente”
Orientador: Prof. Dr. Hubert Mathias Peter Roeser
Catalogação: sisbin@sisbin.ufop.br
G641i Gontijo, Erik Sartori Jeunon.
Interação entre substâncias húmicas aquáticas e elementos metálicos na porção leste do Quadrilátero Ferrífero - MG [manuscrito] / Erik Sartori Jeunon Gontijo – 2012.
xix, 92f. : il. color.; grafs.; tabs.; mapas.
Orientador: Prof. Dr. Hubert Mathias Peter Roeser.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Programa de Pós-Graduação em
Engenharia Ambiental.
Área de concentração: Meio Ambiente.
1. Humus - Teses. 2. Redes neurais (Computação) - Rede neural de Kohonen - Teses. 3. Quadrilátero Ferrífero (MG) - Teses. 4. Evaporador rotativo a vácuo - Teses. 5. Resina DAX-8 - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Agradecimentos
Primeiramente gostaria de agradecer ao professor Hubert, que além de ser um excelente orientador se tornou um grande amigo. Nossa relação sempre foi mais do que acadêmica ou profissional. Muito obrigado pela amizade, companheirismo, pelo conhecimento repassado e por acreditar em meu potencial. Vielen Dank mein Freund!
Agradeço as alunas de graduação Andréia, Francysmary, Mariana e a intercambista IAESTE Marina, que foram amigas e estudantes dedicadas. Como bolsistas deram uma excelente contribuição a este trabalho. Thanks a lot Marina for the “English practices” in
our lab!
Obrigado professor André Rosa (UNESP/Sorocaba) pela oportunidade de estágio em Sorocaba e pelas valiosas informações sobre métodos de extração de substâncias húmicas aquáticas.
Muito obrigado Bruno (doutorando da UNESP/Sorocaba) por explicar-me sobre os métodos de extração e estudo das SHA na UNESP. Foi um grande companheiro, sempre paciente e dedicado. Meus agradecimentos são também por ter me abrigado em sua casa durante minha estadia em Sorocaba.
Agradecimentos especiais ao Arnaldo, Marcão, Hebert e professor Rispoli pela ajuda e indispensável contribuição no improviso de peças para os equipamentos utilizados no LSA.
Agradeço aos amigos Celso e Adriana do LGqA: pela oportunidade de acompanhar a análise de amostras no ICP-OES e pela paciência ao auxiliar-me em algumas análises. Celso, você poderá contar comigo sempre que precisar!
Obrigado professora Gilmare por ajudar-me com as análises exploratórias multivariadas conduzidas no Matlab. Sua contribuição foi de vital importância!
I gratefully acknowledge the help of Professor Kurt Friese and UFZ (Magdeburg,
Germany) to perform DOC and metals analysis. I am pretty sure that they were essential
Muito obrigado a UFF, especialmente a Ilene, pelo apoio nas análises de COD em Niterói.
Agradeço a FAPEMIG e a Fundação Gorceix pela ajuda financeira na compra de equipamentos e materiais para uso em laboratório, imprescindíveis ao andamento da pesquisa.
Agradecimentos especiais a UFOP, a CAPES, ao CNPq e ao PROAMB pelo suporte financeiro, pela bolsa concedida e a oportunidade de ter desenvolvido esse trabalho.
“I do not know what I may seem to the world, but as to
myself, I seem to have been only like a boy playing on the
seashore and diverting myself in now and then finding a
smoother pebble or a prettier shell than ordinary, whilst the
great ocean of truth lay all undiscovered before me”.
Resumo
analisados com litologias diferentes a maior concentração de carbono se deu na época de transição da estação seca para a estação chuvosa e a menor se deu na estação chuvosa. Considerando os diferentes métodos de isolamento de material húmico, a evaporação rotativa mostrou-se promissora ao poder extrair SH com a possibilidade de minimização de alterações estruturais. Entretanto, ela é uma técnica demorada, sendo inconveniente para grandes volumes. As amostras extraídas com resinas DAX-8 apresentaram uma retenção média de 46,80% de COD nas colunas cromatográficas.
Abstract
from dry to rainy season and the lowest occurred in the rainy season. Considering the different methods of isolating humic material, the evaporation under vacuum proved to be promising to extracted HS with the possibility of minimizing structural changes. However, it is a time consuming technique and it is inconvenient for large volumes. The samples extracted by DAX-8 resin had an average retention of 46.80% of DOC in the chromatographic columns.
Lista de Figuras
Figura 2-1 – Esquema: Definição operacional de substâncias húmicas. ... 5
Figura 2-2 – Modelo estrutural proposto para substâncias húmicas. ... 7
Figura 2-3 – Mecanismos que levam a formação de substâncias húmicas. ... 9
Figura 2-4 – Possibilidade de aplicação de substâncias húmicas tendo em vista a proteção/recuperação ambiental. ... 14
Figura 2-5 – Exemplos de tecnologias que podem ser potencializadas pelo emprego de substâncias húmicas. ... 15
Figura 2-6 – Exemplo de barreira reativa permeável. ... 16
Figura 2-7 – Fontes de Fe(II) em lagoa ácida. ... 21
Figura 2-8 - Papel das substâncias húmicas na complexação do P. ... 26
Figura 2-9 – Efeito do pH na ionização e solubilidade na adsorção de ácidos e bases orgânicos adsorvíveis (SH). ... 29
Figura 2-10 – Exemplo de espectro de RMN – 13C de SHA extraídas de amostras de água de um rio no Estado de SP, onde (a) é resíduo de resina XAD-8 utilizada na extração dos compostos húmicos. ... 34
Figura 2-11 - Fatores a serem considerados na caracterização de espécies húmicas e metais.. ... 35
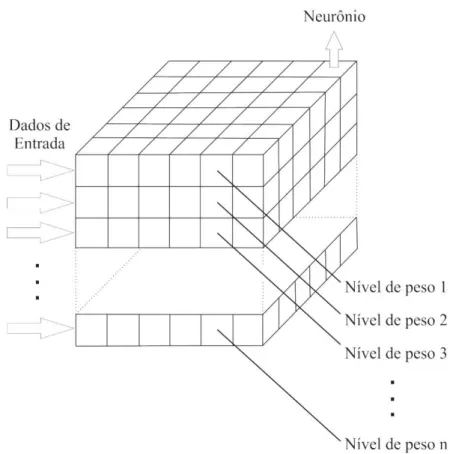
Figura 2-12 – Representação da arquitetura típica da rede neural de Kohonen. ... 38
Figura 2-13 – Localização aproximada do QF em Minas Gerais (Brasil)... 39
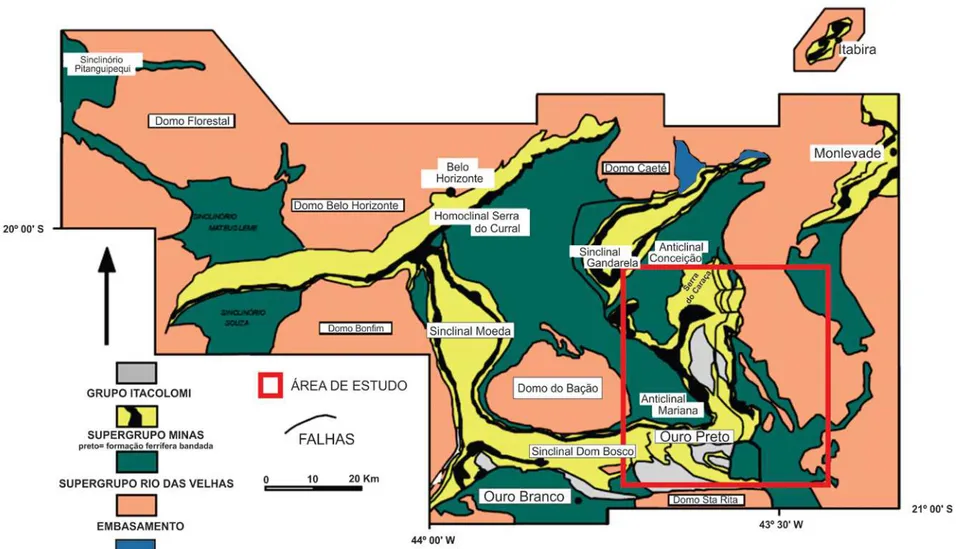
Figura 2-14 – Mapa geológico-estrutural do QF ... 41
Figura 3-1 – Vista do maciço do Caraça. ... 45
Figura 3-2 - Monocultura de eucaliptos no sopé da Serra do Caraça. ... 47
Figura 3-3 – a) Cascatinha, situada no córrego Cascata na área do parque do Caraça, com suas águas de coloração escura b) devido à presença de compostos húmicos. ... 49
Figura 3-4 – Mapa de localização da área estudada. ... 50
Figura 3-5 – a) Coloração escura da água em um ponto ao sul da serra do Caraça (ponto 1), provavelmente devido ao Fe e a compostos húmicos. b) Presença de concreção laterítica. 51 Figura 3-6 – a) Nível d’água e vegetação (ponto 1) em outubro/2010, b) março/2011 e c) agosto/2011. ... 51
Figura 3-8 – Ponto de coleta na serra do Itatiaia. ... 53
Figura 3-9 - Rio Garcia (ponto 4). ... 53
Figura 3-10 - Etapas de preparação das amostras para caracterização e extração de SHA por resina DAX. ... 56
Figura 3-11 – Desenho esquemático da extração de SHA com resina DAX-8. ... 58
Figura 3-12 – a) Eluição da coluna com resina DAX-8 e b) coleta do extrato. ... 58
Figura 3-13 – Evaporador rotativo a vácuo. ... 59
Figura 3-14 – Mapa litológico da região estudada. ... 62
Figura 4-1 – a) SHA fracionadas em AH e AF (os dois frascos são transparentes). b) Amostras com diferentes teores de AH e AF. ... 63
Figura 4-2 – a) Solos orgânicos escuros da região da Serra do Caraça. b) Sulcos erosivos na Serra do Caraça. ... 66
Figura 4-3 – a) Córrego desaguando no rio Piracicaba. b) Coleta de água nas margens do córrego. ... 68
Figura 4-4 – Mapa de grupamentos das amostras de águas naturais obtido pela rede neural de Kohonen. ... 72
Figura 4-5 – Mapas de distribuição individual das variáveis obtidos pela rede neural de Kohonen. ... 73
Figura 4-6 – Brejo (ponto 1) próximo a Serra do Caraça totalmente seco. ... 75
Figura 4-7 – Concentração de sulfato nas amostras de águas naturais. ... 77
Figura 4-8 – Correlação entre as variáveis COD e sulfato. ... 78
Figura 4-9 - Mapa de grupamentos das amostras de águas concentradas obtido pela análise de SOM (Kohonen). ... 78
Figura 4-10 - Mapas de distribuição individual das variáveis (amostras que passaram pela resina DAX-8) obtidas pela rede neural de Kohonen. ... 79
Figura 4-11 – Geologia da região da Serra do Caraça. ... 81
Lista de tabelas
Lista de abreviaturas e siglas
ACP – Análise de Componentes Principais AF – Ácidos Fúlvicos
AH – Ácidos Húmicos
AHA – Análise Hierárquica de Agrupamentos APHA – American Public Health Association AWWA – American Water Works Association
CAPES – Coordenação de Aperfeiçoamento de Pessoal de Nível Superior CC – Capacidade Complexante
CCD – Modelo de espectrômetro de emissão por plasma
CETESB – Companhia de Tecnologia de Saneamento Ambiental CGH – Compostos com Grupos Homólogos
CID – Carbono Inorgânico Dissolvido Cl – Cloretos
COD – Carbono Orgânico Dissolvido (=DOC, em inglês)
CODc – Carbono orgânico dissolvido obtido a partir da extração das substâncias húmicas em colunas cromatográficas com resina DAX-8
CODr – Carbono orgânico dissolvido de amostras de água que passaram pela resina CTD – Carbono Total Dissolvido
Da - Dalton
DAX-8 - resina macroporosa não iônica utilizada na extração de substâncias húmicas DDT – Dicloro-Difenil-Tricloroetano
DIMATOC - Dimatec Analysentechnik (equipamento para análise de carbono) Eh – Potencial hidrogeniônico
ET – Ecotóxicos
ERV – Evaporação Rotativa a Vácuo
IBGE – Instituto Brasileiro de Geografia e Estatística ICP-MS – Inductively coupled plasma mass spectrometry
ICP-OES – Inductively coupled plasma optical emission spectrometry IHSS – International Humic Substances Society
LGqA – Laboratório de Geoquímica Ambiental (UFOP) LQ – Limite de Quantificação
M – Metal
MA – Massachusetts MG – Minas Gerais/Brasil NDIR – Non-dispersive Infrared ORP – Potencial de oxirredução pH – Potencial Hidrogeniônico
PRB – Permeable Reactive Barriers (Barreiras Reativas Permeáveis) PROAMB – Programa de Pós-Graduação em Engenharia Ambiental QF – Quadrilátero Ferrífero
Resis – Resistividade RJ – Rio de Janeiro/Brasil
RMN - Ressonância Magnética Nuclear
RPPN - Reserva Particular do Patrimônio Natural
SH – Substâncias Húmicas, compostos húmicos ou material húmico (=HS, em inglês) SHA – Substâncias Húmicas Aquáticas (=AHS, em inglês)
SHA-M – Complexos formados entre SHA e metais
SIGEP - Comissão Brasileira de Sítios Geológicos e Paleobiológicos SOM - Self-organising maps ou rede neural de Kohonen
SP – São Paulo/Brasil T – Temperatura
UF – Unidades de Ultrafiltração
UFF – Universidade Federal Fluminense
UFMG – Universidade Federal de Minas Gerais UFOP – Universidade Federal de Ouro Preto UFZ – Helmholtz-Zentrum für Umweltforschung UK – United Kingdom
UNB – Universidade de Brasília
UNESP – Universidade Estadual Paulista
UNICAMP – Universidade Estadual de Campinas UV – Ultravioleta
WEF – Water Environment Federation
Sumário
1. Introdução... 1
1.1. Objetivos ... 2
1.1.1. Geral ... 2
1.1.2. Específicos ... 2
2. Revisão Bibliográfica ... 4
2.1. Carbono orgânico, substâncias húmicas e o meio aquático ... 4
2.2. Estrutura e composição das substâncias húmicas aquáticas ... 6
2.3. Processo de formação do material húmico em solos e águas naturais ... 8
2.4. Fontes e fatores que influenciam a formação e composição do húmus ... 11
2.5. Importância ambiental das substâncias húmicas aquáticas ... 12
2.6. Uso de compostos húmicos na remediação de ambientes contaminados ... 14
2.7. Interação entre substâncias húmicas aquáticas e espécies metálicas ... 18
2.7.1. Ferro ... 19
2.7.2. Manganês ... 21
2.7.3. Mercúrio ... 22
2.7.4. Alumínio ... 22
2.7.5. Zinco ... 23
2.7.6. Outros metais traço ... 24
2.8. Interação entre substâncias húmicas aquáticas e elementos não metálicos ... 24
2.8.1. Fósforo ... 24
2.8.2. Nitrogênio ... 26
2.8.3. Halogênios ... 26
2.9. Efeitos das substâncias húmicas no fitoplâncton e na produtividade primária de corpos d’água ... 27
2.11. Fracionamento das SHA ... 30
2.12. Estudo e caracterização das SHA e de complexos SHA-metais ... 32
2.12.1. Espectroscopia na região do infravermelho... 32
2.12.2. Espectroscopia na região do UV-Visível ... 33
2.12.3. Ressonância magnética nuclear ... 34
2.12.4. Determinação da aromaticidade de compostos húmicos ... 34
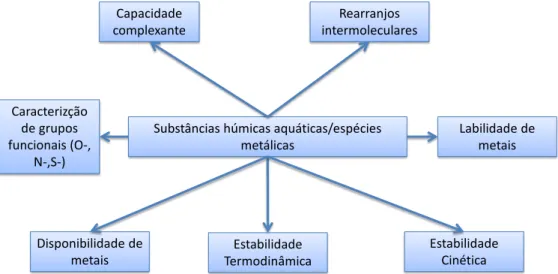
2.12.5. Fatores a serem considerados na caracterização de SH-metais ... 35
2.13. Análise exploratória multivariada dos dados ... 36
2.14. O Quadrilátero Ferrífero ... 39
2.14.1. Geologia ... 40
2.14.2. Relevo ... 42
2.14.3. Clima e vegetação ... 43
3. Materiais e métodos ... 44
3.1. Definição e identificação dos locais de amostragem ... 44
3.1.1. Serra do Caraça e sua vizinhança ... 45
3.1.2. A Serra do Itatiaia e sua vizinhança ... 52
3.2. Amostragens e análises preliminares ... 54
3.2.1. Análise de metais ... 54
3.2.2. Análises de carbono orgânico dissolvido ... 55
3.3. Extração de SHA empregando o método da resina DAX-8 ... 56
3.4. Extração das SHA empregando o método de evaporação rotativa ... 59
3.5. Análise multivariada dos dados das amostras de SHA ... 60
3.6. Avaliação da origem dos elementos nas regiões estudadas ... 61
4. Resultados e discussão ... 63
5. Conclusões ... 84
6. Sugestões para futuros trabalhos ... 86
1.
Introdução
O meio ambiente é o palco de um vasto número de interações químicas, que podem ocorrer naturalmente ou por intermédio de organismos vivos. Químicos ambientais tentam definir e quantificar essas reações, determinando os reagentes e produtos, construindo modelos e tentando encaixá-los na dinâmica dos ecossistemas. Nessas pesquisas, os materiais húmicos têm se destacado por estarem presentes em todos os lugares, por serem abundantes e por desempenharem uma grande influência química nos meios terrestre e aquático (Tipping, 2002).
As substâncias húmicas (SH) são definidas como compostos orgânicos heterogêneos, de estrutura indefinida e elevada massa molecular. Embora os processos que levem à sua formação ainda sejam pouco compreendidos, já se sabe que são derivadas da degradação de restos vegetais e animais por intermédio de microrganismos (Rosa, 1998).
No solo, as SH possuem propriedades de conter a erosão e reter água e calor (devido a sua coloração escura), facilitando a germinação de sementes. Também, atuam como fertilizantes ao ceder nutrientes para o desenvolvimento de plantas (Rosa, 1998).
Em águas naturais os compostos húmicos influenciam na disponibilidade e toxidade de metais para os seres vivos. Essas substâncias atuam na dispersão desses elementos químicos através de processos de sorção e dessorção (Rocha e Rosa, 2003).
No meio antrópico, o material húmico age em estações de tratamento de água, podendo reagir com o cloro e formar compostos orgânicos halogenados, que possuem características cancerígenas (Rocha e Rosa, 2003). Em ambiente agrícola podem interagir com pesticidas, influenciando na sua concentração e mobilidade no meio (Toscano, 1999).
Considerando que a água é uma das substâncias mais comuns na Terra, essencial para sobrevivência dos seres vivos, é de grande importância que os corpos hídricos apresentem condições físicas e químicas adequadas, devendo estar isentos de compostos que possam provocar efeitos deletérios a vida (Braga, Hespanhol et al., 2005). Sendo assim, como as SH se relacionam com vários componentes do meio, somado ao fato do aumento das preocupações com o meio ambiente nos últimos anos, elas têm atraído cada vez mais a atenção de pesquisadores do mundo inteiro (Janos, 2003).
e de extração de minérios, que tem alterado o ciclo geoquímico e o fluxo natural de metais pesados, aumentando a sua liberação na biosfera (Soares, Siqueira et al., 2002). A ampliação do descarte desses elementos no ambiente e o seu uso indevido na agricultura e indústria também representam um importante problema ambiental com riscos muitas vezes desconhecidos (Oliveira, M. R., 2007).
No QF as questões envolvendo as SH ainda são pouco conhecidas devido ao escasso número de pesquisas na região. Consequentemente, o assunto tratado no presente trabalho torna-se de maior relevância ambiental, visto que poderemos entender melhor como as substâncias húmicas aquáticas (SHA) interagem com os metais na área de estudo, de forma a contribuir para as ações de conservação das águas.
1.1.
Objetivos
1.1.1.
Geral
O objetivo geral do trabalho foi estudar a relação entre a concentração de substâncias húmicas aquáticas (SHA) e elementos metálicos na porção leste do Quadrilátero Ferrífero, comparando-se os métodos de extração por resinas DAX-8 e a evaporação rotativa a vácuo.
1.1.2.
Específicos
Os objetivos específicos consistiram em:
• Averiguar qual é o melhor método para concentração das substâncias húmicas aquáticas (evaporação rotativa x extração em colunas);
• Extrair substâncias húmicas de amostras de água coletadas durante as estações seca e chuvosa;
• Determinar as concentrações de carbono orgânico dissolvido (COD) e de SHA na porção leste do Quadrilátero Ferrífero;
• Verificar prováveis influências da sazonalidade nas concentrações de SHA e metais;
2.
Revisão Bibliográfica
2.1.
Carbono orgânico, substâncias húmicas e o meio aquático
No meio ambiente, a decomposição de restos vegetais e animais faz parte de um ciclo, onde o carbono (C) é recirculado para a atmosfera como dióxido de carbono (CO2) e forma, juntamente com elementos como nitrogênio e fósforo, compostos disponíveis para o desenvolvimento de plantas e outros organismos. Nesse processo, parte do C é assimilada pela vida microbiana e parte é convertida em material húmico (húmus) estável (Stevenson, 1994). Tal transformação advém da ação de enzimas específicas, como a urease, a catalase e a fosfatase (Rocha e Rosa, 2003) e faz com que essas substâncias fiquem estáveis frente à biodegradação. Essas alterações, com consequente degradação e mineralização da matéria orgânica, tem sido denomina humificação (Mcdonald, Bishop et al., 2004). O húmus está presente nos sedimentos e dissolvido nas águas de todos os ecossistemas fluviais e marinhos (Hessen e Tranvik, 1998).
A matéria orgânica pode ser classificada como particulada ou dissolvida. Operacionalmente, a fração da matéria orgânica que passa através de um filtro de 0,45 µm é definida como carbono orgânico dissolvido. Em corpos d’água, ele representa um dos maiores reservatórios de C orgânico da biosfera, sendo um recurso vital ao afetar as teias alimentares tanto diretamente, no uso pelos organismos, quanto indiretamente, por mecanismos como pH, turbidez, quelação de metais e transporte de contaminantes (Mcdonald, Bishop et al., 2004).
Em relação a uma perspectiva composicional, o COD pode ser separado em substâncias não húmicas, que são formadas por compostos conhecidos mais simples e de baixa massa molecular e substâncias húmicas, que consistem em compostos heterogêneos, refratários, originados de reações de síntese secundária, que têm alta massa molecular, estrutura complexa e coloração variando do amarelo ao preto. Esse segundo grupo também é caracterizado por ser rico em estruturas funcionais oxigenadas, tais como as carboxílicas, as fenólicas, as alcoólicas e as quinonas (Stevenson, 1994).
Segundo Janos (2003), cerca de 50 a 90%1 do COD nas águas naturais são substâncias húmicas aquáticas, que estão recebendo cada vez mais atenção devido ao seu
papel na química e ecologia das águas, sendo capazes de complexar-se com metais traços, modificar a estabilidade de coloides minerais, formar trihalometanos (substâncias cancerígenas) no processo de tratamento de água e até mesmo interagir com organismos vivos (Steinberg, 2003). Além disso, ressalta-se que essas substâncias são responsáveis pela solubilização e por complexarem-se com pesticidas, hidrocarbonetos e outros compostos liberados pelo homem no ambiente aquático (Thurman e Malcolm, 1981).
As substâncias húmicas aquáticas são provenientes do carreamento de material orgânico para rios, lagos e oceanos através da lixiviação e erosão de solos sob a ação das chuvas (fontes alóctones). Também podem ser produzidas dentro do próprio ecossistema aquático (fontes autóctones), sendo derivadas dos constituintes celulares e da degradação de organismos aquáticos nativos (Rocha e Rosa, 2003).
Baseado no fracionamento do húmus de solos a partir de um extrato alcalino, as substâncias húmicas podem ser separadas em três grupos denominados ácidos fúlvicos (AF), ácidos húmicos (AH) e humina. Os ácidos fúlvicos são os ácidos orgânicos que são solúveis em qualquer faixa de pH; ácidos húmicos são ácidos orgânicos que são solúveis acima de pH 2; e humina são compostos que são insolúveis em qualquer pH (Hessen e Tranvik, 1998). Essa definição operacional é exibida na Figura 2-1.
Figura 2-1 – Esquema: Definição operacional de substâncias húmicas (baseado em Steinberg, 2003).
Solúvel em ácidos
Insolúvel em ácidos
Completamente Insolúvel
Aumento do tamanho molecular
Diminuição da reatividade
As SH também podem ser fracionadas em ácidos húmicos himatomelânicos, grey e
brown, através da extração do AH solúvel em álcool etílico. O fracionamento dessas
substâncias para estudo pode ser fundamentado com base nessas diferenças de solubilidade (Rocha e Rosa, 2003).
Ressalta-se ainda que a abundância do húmus relativa a outros íons e fases minerais varia enormemente nos ecossistemas aquáticos. Em corpos hídricos, os AF dissolvidos são geralmente muito mais abundantes que os AH dissolvidos. Considerando-se o material particulado suspenso, ambos são igualmente abundantes e a concentração de humina não é significativa. Entretanto, em sedimentos lacustres e marinhos a humina pode ser uma fração considerável e os ácidos húmicos podem ser mais abundantes que os ácidos fúlvicos (Hessen e Tranvik, 1998).
2.2.
Estrutura e composição das substâncias húmicas aquáticas
Figura 2-2 – Modelo estrutural proposto para substâncias húmicas (Kleinhempel, 1970 apud Steinberg, 2003).
Recentemente, Piccolo (2001) discorreu sobre a teoria das associações supramoleculares, que é baseada na visão polimérica das SH. Essa visão diz que os compostos húmicos são formados por pequenas moléculas com diferentes massas moleculares, similar ao que ocorre com outras macromoléculas biológicas como as proteínas, os polissacarídeos e a lignina. Na visão supramolecular as SH são moléculas pequenas e que se auto-organizam em conformações supramoleculares, o que explicaria o grande tamanho aparente dos compostos húmicos. Essas grandes estruturas húmicas de moléculas relativamente pequenas são associadas por forças mais fracas como as interações de natureza hidrofóbica (como, por exemplo, Van der Waals) e ligações de hidrogênio. Essa última possui maior importância em valores de pH mais baixos.
hidrofóbicas (tais como cadeias polimetilênicas e ácidos graxos) que são estabilizadas em pH neutro por forças dispersivas hidrofóbicas. Suas conformações crescem progressivamente em tamanho a medida que aumentam as ligações intermoleculares de hidrogênio em baixos valores de pH até elas flocularem.
Apesar de não existir nenhum modelo estrutural que seja inteiramente satisfatório, algumas características relativas às SHA já são definidas entre os pesquisadores. Quanto à composição elementar, sabe-se que elas possuem aproximadamente 35% de oxigênio e cerca de 2% de nitrogênio e enxofre em sua estrutura (Rocha e Rosa, 2003). Tipping (2002) ainda completa que o conteúdo de C em compostos húmicos é da ordem de mais de 50%, embora para alguns ácidos fúlvicos de solos esse teor pode ser menor. É importante mencionar que esse carbono presente no material húmico ainda pode nos revelar importantes informações sobre a origem e a idade das SH, o que é feito através da avaliação das concentrações de carbono 13 (13C) e carbono 14 (14C). O 13C, por exemplo, é proveniente da formação de ácidos fúlvicos marinhos de algas e de material húmico de plantas terrestres. Com relação à idade dos compostos húmicos há estimativas de valores variando de 10 a até 2400 anos. Estes dados atestam a natureza refratária das SH (Tipping, 2002). A composição média de ácidos húmicos e fúlvicos extraídos de solos é mostrada na Tabela 2-1.
Tabela 2-1 – Composição elementar média das SH extraídas de solos.
Substâncias Húmicas
Composição elementar média (%)
C H O N S
Ácidos húmicos 53,8-58,7 3,2-6,2 32,8-38,3 0,8-4,3 0,1-1,5
Ácidos fúlvicos 40,7-50,6 3,8-7,0 39,7-49,8 0,9-3,3 0,1-3,6
Fonte: Calderoni & Schnitzer apud Rocha e Rosa (2003).
2.3.
Processo de formação do material húmico em solos e águas naturais
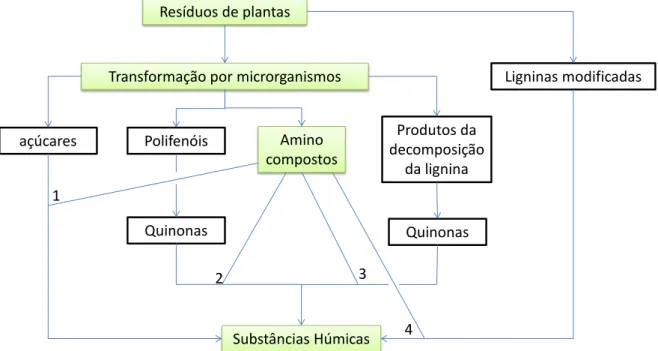
Stevenson (1994) discorre sobre algumas dessas vias que explicam a formação do húmus, como é indicado na Figura 2-3. A teoria clássica diz que as substâncias húmicas são provenientes de ligninas modificadas (via 4). Investigações mais recentes são a favor de mecanismos envolvendo quinonas (vias 2 e 3). Na prática, todas as 4 vias mostradas na Figura 2-3 podem ser consideradas mecanismos para a formação de ácidos húmicos e fúlvicos, incluindo a condensação de amino-açúcares (via 1). Mais detalhes sobre os caminhos que levam à formação dos materiais húmicos são apresentados nos tópicos abaixo (Stevenson, 1994):
a) Formação de SH a partir da lignina
De acordo com essa teoria (via 4) a lignina é incompletamente utilizada por microrganismos e sofre modificações que incluem reações com amônia (NH3), que é produzida durante o decaimento de substâncias orgânicas nitrogenadas por organismos, perda de grupos metoxil (OCH3) com a geração de o-hidroxifenóis e a oxidação de cadeias alifáticas com a formação de grupos COOH.
Figura 2-3 – Mecanismos que levam a formação de substâncias húmicas (baseado em Stevenson, 1994).
Os argumentos que suportam a teoria da degradação da lignina são:
Resíduos de plantas
Transformação por microrganismos Ligninas modificadas
açúcares Polifenóis Amino
compostos
Quinonas
Substâncias Húmicas
Produtos da decomposição
da lignina
Quinonas 1
2 3
- Ácidos húmicos e lignina são decompostos com considerável dificuldade pela grande maioria dos fungos e bactérias;
- Lignina e ácidos húmicos são solúveis em álcalis e precipitam em meio ácido; - Quando ligninas são aquecidas em solução básica, elas são transformadas em ácidos húmicos contendo metoxil. Ácidos húmicos tem muitas propriedades em comum com ligninas oxidadas;
- Componentes da lignina podem ser reconhecidos em ácidos fúlvicos e húmicos dissolvidos (Hessen e Tranvik, 1998).
Embora a lignina não seja facilmente biodegradável, se compararmos com outros componentes vegetais, existem mecanismos na natureza que levam a sua completa decomposição aeróbia. É importante destacar que oxigênio é requerido para a despolimerização microbiana da lignina.
b) Formação de SH a partir de produtos da decomposição da lignina por microrganismos
Neste processo a lignina também desempenha um importante papel na formação de ácidos húmicos e fúlvicos ao liberar aldeídos fenólicos e ácidos a partir do ataque de microrganismos. Isso induz a conversão enzimática desses compostos em quinonas, que vão sofrer polimerização na ausência ou presença de amino-compostos e vão dar origem a moléculas húmicas. Esse processo é representado pelo caminho 3 da Figura 2-3.
Atualmente, as teorias envolvendo a origem de quinonas a partir da lignina e as sintetizadas por microrganismos são consideradas as principais vias de formação de substâncias húmicas. Já a teoria clássica de formação de húmus a partir da lignina é considerada obsoleta por muito investigadores.
c) Formação de SH a partir da geração de polifenóis
d) Húmus formado a partir de açúcares
Neste processo, formas reduzidas de açúcares e aminoácidos originadas a partir do metabolismo microbiano são submetidas a uma etapa de polimerização não enzimática, que dá origem a polímeros nitrogenados (de coloração amarronzada). Essa teoria de que o húmus é formado a partir de açúcares é relativamente recente na história do húmus e está simbolizada no caminho 1 da Figura 2-3.
Um atrativo dessa teoria é que os reagentes (açúcares, aminoácidos, etc.) para formação do húmus são produzidos em abundância no ambiente através da atividade de microrganismos. Isso também explica a origem de SH onde as vias por lignina não são prevalentes.
2.4.
Fontes e fatores que influenciam a formação e composição do húmus
Nos solos, a lignina é vista como a principal fonte de substâncias húmicas. Isso faz com que os ácidos húmicos e fúlvicos ali gerados tenham características mais aromáticas, diferentes dos originados em águas, que possuem propriedades mais alifáticas. Entretanto, considerando-se que os maiores precursores de material húmico em rios e lagos são provenientes de fontes alóctones, assume-se que as SH nos ambientes aquáticos possuem praticamente os mesmos atributos das encontradas no ambiente terrestre (Mcdonald, Bishop et al., 2004).
A composição do material húmico pode variar consideravelmente dependendo do tipo de solo nas bacias hidrográficas, da biota aquática, das condições climáticas e de derrames antropogênicos (Watt, Malcolm et al., 1996). O despejo de esgotos domésticos, por exemplo, pode ser um dos contribuintes na gênese de SH em grandes rios (Malcom, 1985 apud Watt, Malcolm et al., 1996).
Estados Unidos demostraram que para cada aumento de 10 ºC na média anual de temperatura, o conteúdo de matéria orgânica em solos decresce cerca de 2 a 3 vezes. Regiões onde a drenagem é restrita não seguem essa dinâmica porque o oxigênio é limitado por um longo período de tempo, o que previne completamente o decaimento microbiano de restos de plantas sob uma vasta gama de temperaturas (Stevenson, 1994). A Tabela 2-2 apresenta mais detalhes sobre os fatores que interferem na origem do material húmico.
Tabela 2-2 - Fatores que influenciam na formação de material húmico.
Fator Influência
Tempo primeiros anos de sua formação. Atinge equilíbrio após cerca de 10 anos A taxa de acumulação de matéria orgânica em solos é alta durante os para materiais de textura fina a 1500 anos para áreas arenosas.
Vegetação
Regiões com vegetação composta por gramíneas possuem maior conteúdo de matéria orgânica se comparado com áreas de florestas. Isso é explicado
pela síntese do húmus ocorrer na rizosfera e ela é mais extensa em gramíneas se comparada a florestas. Os solos em que ocorrem gramíneas são formados em condições climáticas que levam a preservação da matéria
orgânica.
Material parental
O material parental vai influenciar na textura do solo, que vai alterar o conteúdo de material orgânico formado. A fixação de substâncias húmicas
na forma de complexos organo-minerais contribui para preservação da matéria orgânica em solos. Assim, solos de textura mais fina tem maior
conteúdo de material húmico que solos de textura média.
Topografia
A topografia ou relevo vão afetar o conteúdo de material húmico em solos devido às suas influências no escoamento superficial/retenção de água e umidade no solo. Solos formados depressões, com drenagem restrita, tem maior quantidade de matéria orgânica devido as condições anaeróbias que
prevalecem no ano, que levam a preservação do material.
Baseado em Stevenson (1994).
2.5.
Importância ambiental das substâncias húmicas aquáticas
facilmente ser oxidadas pelo oxigênio presente nas águas, causando depleção desse elemento e acarretando prejuízos para diversas formas de vida, além de deixar o ambiente mais redutor (Elkins e Nelson, 2002).
Por meio da adsorção, solubilização, hidrólise e dos efeitos microbiológicos e fotossensibilizantes, o húmus também pode afetar moléculas orgânicas liberadas pelo homem, o que influi na dispersão, mobilidade e transporte desses compostos no meio aquático. Assim sendo, torna-se ainda mais valioso o entendimento do papel das substâncias húmicas em corpos hídricos, que atualmente é pouco conhecido (Rosa, 1998; Elkins e Nelson, 2002).
Um grupo de substâncias antrópicas que são influenciadas pela presença do húmus são os agrotóxicos, que são utilizados com o objetivo de propiciar o aumento da produtividade agrícola, por meio do controle de pragas que causam prejuízos no cultivo de alimentos. Também, podem ser empregados no combate a enfermidades (como a malária) e na eliminação de ervas daninhas de estradas e vias públicas. Apesar dos inúmeros benefícios, o uso desses compostos pode causar sérios danos à saúde humana, além de problemas ambientais (Toscano, 1999).
Defensivos agrícolas carregados positivamente, como por exemplo, a atrazina, podem se ligar às substâncias húmicas carregadas negativamente, por meio de interações eletrostáticas favoráveis. Já os orgânicos polares, como o inseticida carbaryl, podem interagir com o material húmico via múltiplas ligações de hidrogênio. Compostos orgânicos apolares, como o Dicloro-Difenil-Tricloroetano (DDT), ligam-se às SH por meio de interações hidrofóbicas (Elkins e Nelson, 2002). Destaca-se que alguns estudos demonstraram que com o aumento do teor de COD, a velocidade de degradação da atrazina (fotólise direta) diminui (Torrents et al., 1997 apud Toscano, 1999).
Outras razões pelas quais as SHA são consideradas ambientalmente importantes foram descritas por (Rocha e Rosa, 2003):
- influem da disponibilidade de metais necessários ao desenvolvimento de organismos;
- podem possuir características oxirredutoras, influenciando a redução de espécies metálicas, como por exemplo, a redução de mercúrio iônico por material húmico, descrito no trabalho de (Zara, 2001);
- podem atuar como traçadores ambientais (Rosa, 1998);
- quando presentes em altas concentrações em estações de tratamento de água podem produzir compostos orgânicos halogenados, que possuem características cancerígenas.
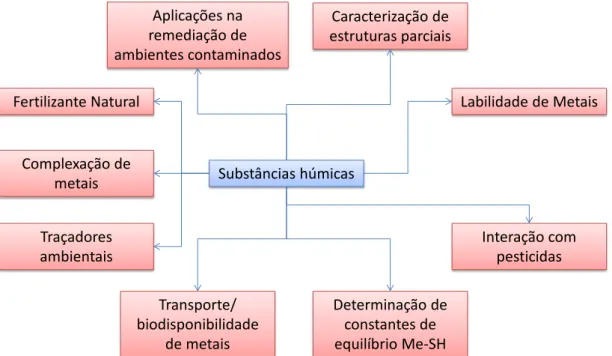
Rosa (1998, p.33) ainda destaca que as substâncias húmicas exercerão grande importância na redução/controle da poluição ambiental neste século, pois “além da versatilidade na complexação de metais, tem aumentado o aproveitamento de resíduos ricos em materiais húmicos decorrentes de tratamento de efluentes e compostagem de lixo”. A Figura 2-4 exibe um diagrama resumindo e relacionando a aplicação de SH visando a solução de problemas ambientais.
Figura 2-4 – Possibilidade de aplicação de substâncias húmicas tendo em vista a proteção/recuperação ambiental (baseado em Rosa, 1998; 2001).
2.6.
Uso de compostos húmicos na remediação de ambientes
contaminados
Tendo em vista os inúmeros problemas ambientais e o aumento da preocupação com o meio ambiente nos últimos anos, cientistas e engenheiros de várias partes do mundo
têm tentado desenvolver tecnologias para aprimorar, diminuir custos e superar limitações de processos de remediação de ambientes contaminados. Focando em aspectos técnicos e econômicos, as SH são promissoras ao serem utilizadas juntamente com técnicas de remediação in situ. Essa notável importância dos compostos húmicos vêm das suas características polifuncionais, que permitem que interajam com íons metálicos e compostos orgânicos. Consequentemente, essas substâncias podem afetar a especiação física e química de ecotóxicos2 (ET), alterando sua biodisponibilidade e toxidade (Perminova e Hatfield, 2005). Isso constitui, inclusive, mais um motivo para considerarmos os compostos húmicos ambientalmente importantes.
Grande parte das tecnologias de remediação com aplicação de compostos húmicos é baseada em estratégias de tratamentos químico e biológico in situ. Dentre as técnicas em que as SH podem ser aplicadas estão as barreiras reativas permeáveis (PRB), lavagem de solo, biorremediação e fitorremediação (Figura 2-5).
Figura 2-5 – Exemplos de tecnologias que podem ser potencializadas pelo emprego de substâncias húmicas. Baseado em Perminova e Hatfield (2005).
As barreiras reativas permeáveis são uma tecnologia in situ utilizada para tratar aquíferos rasos a um baixo custo em relação aos métodos tradicionais “pump and treat”. O uso de PRB reduz a exposição de humanos ao contaminante e permite que as terras sobrejacentes ao aquífero possam ser utilizadas efetivamente durante a remediação. Uma vez que uma barreira é instalada, ela pode permanecer no local a ser remediado até que o contaminante seja degradado em componentes menos perigosos (Bronstein, 2005).
2 Dentro da classe dos compostos ecotóxicos estão incluídos os metais pesados, petróleo, pesticidas, Tecnologias de remediação in situ
SH Baseada em tratamento químico
Biorremediação melhorada
Fitoremediação Lavagem de solo
Barreiras reativas permeáveis (PRB)
Conceitualmente uma barreira reativa permeável é definida como uma estrutura em subsuperfície com um meio reativo, que é designado a interceptar uma pluma contaminante através de um fluxo (gradiente natural da água subterrânea) que passa através do meio reativo, onde os contaminantes são adsorvidos, precipitados ou degradados, transformando-se em substâncias menos nocivas ao meio ambiente (Bronstein, 2005). Um desenho esquemático do processo é mostrado na Figura 2-6.
Figura 2-6 – Exemplo de barreira reativa permeável (Baseado em Bronstein, 2005).
Em PRB, os materiais usados no meio reativo devem demostrar rápida cinética para remover os contaminantes de águas subterrâneas sobre condições de fluxo natural. Além disso, esses materiais reativos devem ser baratos e funcionais durante longo tempo. Finalmente, as reações químicas não podem produzir e liberar produtos tóxicos. Nesse ponto, os compostos húmicos são considerados uma grande promessa ao atuarem como componentes reativos e baratos em PRB. Para avaliar o potencial do uso de SH nesses sistemas, é muito importante entender as propriedades sortivas e redox do húmus, que como está sendo discutido, é capaz de reduzir efeitos tóxicos de metais e outros componentes liberados pelo homem, além de alterar a sua mobilidade no meio (Perminova
et al. 2005).
função de aumentar a mobilidade e/ou solubilidade dos contaminantes imobilizados. Essa tecnologia é susceptível a vários problemas decorrentes do agente de lavagem, que pode se aderir na matriz do solo, acelerando o crescimento microbiano, causando precipitação dos seus constituintes nos poros da matriz e consequentemente reduzindo a permeabilidade do sistema. Outros problemas associados a esse processo é o alto custo para tratar e dispor fluidos residuais. Esses problemas não acontecem com soluções de lavagem compostas de substâncias húmicas, primeiramente por causa do baixo custo do material e em seguida devido aos compostos húmicos serem biologicamente recalcitrantes o que minimiza o efeito do crescimento microbiano. Entretanto, mesmo os materiais húmicos ainda são um desafio ao sucesso dessa técnica. Isso é porque em algumas situações os compostos húmicos dissolvidos podem se aderir nos materiais do solo ou aquífero, minando os esforços para interceptar e imobilizar os contaminantes solúveis (Perminova e Hatfield, 2005).
A biorremediação melhorada é uma técnica em que processos microbianos são utilizados para degradar ou transformar contaminantes em formas menos tóxicas ou não tóxicas. Especificamente, essa tecnologia aproveita processos naturais ao promover o crescimento microbiano. Entretanto essa técnica pode ser inibida se houverem altas concentrações de contaminantes ou na presença de outros componentes solúveis tóxicos para os microrganismos. O uso de SH pode ser extremamente útil visto que elas podem atenuar a toxidade do contaminante para os micróbios transformando os poluentes em formas menos tóxicas ou mesmo sequestrando-os em uma fase separada e reduzindo sua biodisponibilidade (Perminova e Hatfield, 2005).
2.7.
Interação entre substâncias húmicas aquáticas e espécies metálicas
Em muitos aspectos, o entendimento da ocorrência natural das SH e suas interações com espécies metálicas dissolvidas é de grande valor no estudo de depósitos minerais, principalmente se considerarmos a região do QF, que é uma das áreas clássicas da mineração brasileira. Essa importância dos compostos húmicos é devido ao seu papel na dispersão de elementos metálicos como o ouro, o urânio, o vanádio e os metais do grupo da platina. Os compostos húmicos podem, por exemplo, formar complexos solúveis com metais ou causar precipitação de íons metálicos via redução ou adsorção. Ressalta-se que o efeito dos ácidos húmicos e fúlvicos no comportamento de metais no meio ambiente e sua habilidade de controlar a liberação desses durante a mineração tem tido relevante impacto na geologia econômica e aumentado as preocupações envolvendo o meio ambiente (Wood, 1996).
Contudo, a importância da interação entre compostos húmicos e elementos metálicos vai muito além do meio econômico mineiro, pois as SH podem alterar a biodisponibilidade de metais essenciais para os seres vivos. Elas participam claramente de ciclos biogeoquímicos, além de atuarem como catalisadores redox, como será mostrado mais adiante (Elkins e Nelson, 2002; Steinberg, 2003).
Ainda considerando o meio aquático, acredita-se que um elemento metálico só é biodisponível quando ele está na forma de espécie dissolvida livre, ou seja, não ligado às SH. Além disso, quando esse metal está disponível ele pode ter um efeito tóxico para os seres vivos, dependendo de sua concentração no meio. Entretanto, ressalta-se que o processo de absorção de espécies metálicas pelos organismos vivos e o papel dos compostos húmicos ainda não são bem compreendidos (Steinberg, 2003).
O efeito das SH na toxidade de metais para organismos aquáticos é aparentemente contraditório, visto que existem casos de efeitos benéficos ou adversos da presença dos compostos húmicos. Gjessing (1981) apud Steinberg (2003), por exemplo, descreve uma diminuição da toxidade do Cd para o Salmão (Salmo salar) e para a alga verde
Em geral, enquanto o Fe e Al3+ são conhecidos por se ligarem fortemente aos materiais húmicos, o Mg2+ é considerado um ligante fraco. Outros elementos como Ni2+, Pb2+, Ca2+ e Zn2+ tem afinidades de ligação intermediárias (Manahan, 2005). Além disso, esses metais podem estar em diversas formas físico-químicas em corpos d’água. O estudo de como essas formas influem no meio é nomeada especiação de metais, que é influenciada por fatores como pH, potencial redox, tipos e concentrações de ligantes orgânicos (como, por exemplo, as substâncias húmicas) e inorgânicos (como, por exemplo, os bicarbonatos), material particulado e coloidal (Rocha e Rosa, 2003).
De acordo com Zara (2001), os agentes complexantes aquáticos podem ser divididos em ligantes simples como, por exemplo, o Cl-, CO3-2 e, aminoácidos, e compostos com grupos homólogos (CGH) como, por exemplo, as SHA, proteínas e óxidos de metais, que formam complexos de alta estabilidade e possuem um papel importante na distribuição de metais em águas naturais. Os CGH geralmente “contêm grande número de sítios complexantes por molécula e a concentração molar total destes sítios pode ser comparada à concentração de muitos ligantes simples” (Zara, 2001, p.19). Destaca-se que as SH dissolvidas são frequentemente os agentes complexantes dominantes em águas naturais (Tipping, 2002).
Considerando metais traço como o mercúrio, por exemplo, é importante mencionar que eles geralmente se ligam aos grupamentos funcionais ácidos da matéria orgânica, onde estão incluídos ácidos carboxílicos, íons amônio, fenóis, álcoois e tióis. Esses grupos contribuem com mais de 90% da acidez das SH e possuem diferentes constantes de dissociação e desprotonação em diferentes condições de pH (Ravichandran, 2004).
A presença de grupos doadores de elétrons como o oxigênio, o nitrogênio e o enxofre está associado às características de complexação das SHA com metais. Destaca-se que o oxigênio nas moléculas húmicas está sob a forma de grupos carboxílicos e fenólicos. Apesar de presentes em menor concentração, o nitrogênio e o enxofre estão distribuídos nos grupamentos peptídeos, sulfônicos e tióis, que possuem maior afinidade de ligação por metais do que grupos oxigenados. Um bom exemplo é a ligação entre Hg e grupamentos tióis, que já foi mencionada previamente (Buffle, 1990 apud Rocha e Rosa, 2003).
2.7.1.
Ferro
que esta vai ser fortemente afetada pela quantidade e composição das SH e compostos inorgânicos dissolvidos sob um potencial redox positivo e pH circum-neutro (Steinberg, 2003). O trabalho de Vörös et. al. (2000) apud Steinberg (2003), por exemplo, mostrou que sob influência de raios ultravioleta (UV), a decomposição de compostos húmicos pode resultar na inibição do crescimento de algas porque o Fe biodisponível é precipitado.
As SH, juntamente com a luz solar, ainda afetam o Fe em muitos outros aspectos em corpos d’água. Como será descrito mais adiante, os materiais húmicos e o Fe podem complexar-se com o P, tornando-o não disponível para os organismos aquáticos. Além disso, os compostos húmicos ainda estão envolvidos em reações de oxirredução do Fe. Em pH 5, por exemplo, a taxa de oxidação do Fe(II) cresce com o aumento das concentrações de AF. Nesse caso, a oxidação ocorre via formação de espécies reativas (como o HO2 e o O2-), criadas pela redução do O2 por AF foto-excitados. A redução do Fe também pode ocorrer via reações fotoquímicas, onde os AF podem converter o Fe(III) em Fe(II). Destaca-se que o mesmo processo de redução pode ocorrer sob ausência de luz solar (Steinberg, 2003).
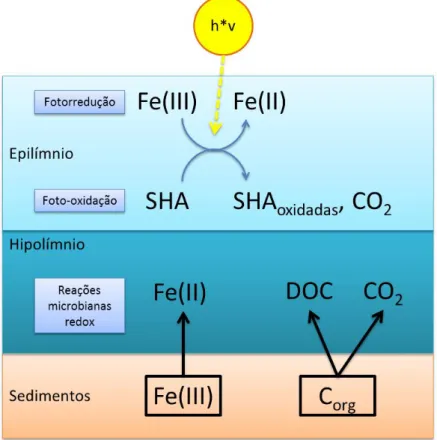
Estudos em três lagos com valores de pH entre 2,35 e 3 em Lusatia, Alemanha, explicaram mais claramente a formação de Fe(II) a partir de Fe(III) nesses corpos hídricos extremamente ácidos. As pesquisas foram conduzidas por Herzsprung et al. (1998) apud Steinberg (2003) e demostraram que um hipolímnio anóxido é formado sobre os sedimentos desses tipos de lago, onde bactérias reduzem o Fe(III) ao utilizá-lo como aceptor final de elétrons. O processo de redução também requer o consumo de oxigênio molecular ou de compostos de COD. Consequentemente há um aumento nas concentrações de Fe(II) no hipolímnio. Já no epilímnio a redução do Fe acontece via fotorredução por SH. Um desenho esquemático mostrando todo o processo é exibido na Figura 2-7.
Figura 2-7 – Fontes de Fe(II) em lagoa ácida (baseado em Steinberg, 2003).
2.7.2.
Manganês
Em condições oxidantes nos corpos hídricos, o dióxido de manganês (MnO2) é uma forma termodinamicamente estável do Mn, que também pode ser encontrado na forma dissolvida na zona eufótica de ambientes aquáticos. O Mn(II) é altamente biodisponível. Assim como no caso do Fe, as SH possuem um importante papel na fotorredução do Mn. Um possível mecanismo é o da redução do MnO2 por H2O2, que é formado devido a fotorredução do O2 na presença de compostos húmicos (Steinberg, 2003).
2.7.3.
Mercúrio
O mercúrio é um metal pesado que tem efeitos substancialmente tóxicos para os seres vivos já em baixas concentrações molares. Considerando o ciclo desse elemento, a conversão mais importante entre espécies é a metilação do íon Hg(II) por ação bacteriológica com a formação do metilmercúrio e do composto volátil dimetilmercúrio. A formação do metilmercúrio tem consequências mais graves por entrar facilmente na cadeia alimentar, bioacumular-se e biomagnificar-se (Zara, 2001).
Devido ao grande número de sítios de ligação, as SH podem interagir fortemente com vários metais pesados, incluindo o Hg(II). Os compostos húmicos, nesse caso, agem reduzindo fortemente a disponibilidade e a toxidade de íons de Hg(II) dissolvidos em meio aquático (Rocha, Sargentini et al., 2003).
Entretanto, é importante salientar que a interação das SH com íons Hg(II) não é somente baseada na complexação, mas também na redução de Hg(II) para Hg elementar, que então é volatilizado. Além de ambientalmente importante, isso é um relevante processo dentro do ciclo biogeoquímico do mercúrio em ambientes ricos em compostos húmicos, principalmente em áreas de mineração de ouro (Rocha, Sargentini et al., 2003).
O estudo de Rocha, Junior et al. (2000) revelou que a redução de íons Hg(II) por SH é relativamente lenta, requerendo dois ou mais dias. Além disso, mostrou que a forte complexação e redução do Hg(II) por material húmico podem ocorrer simultaneamente em ambientes aquáticos tropicais.
Concluindo, a complexação do Hg(II), assim como a volatilização do Hg(0), vão impedir a formação de metilmercúrio e consequentemente a bioacumulação e biomagnificação do mercúrio no meio ambiente.
2.7.4.
Alumínio
Além disso, destaca-se que na presença de AH há uma redução marcante na perda do Al em corpos hídricos, sugerindo que a interação entre compostos húmicos e esse elemento reduz sua hidroxipolimerização e precipitação (Elkins e Nelson, 2002; Dobranskyte, Jugdaohsingh et al., 2006).
Os materiais húmicos diminuem os efeitos tóxicos do Al em corpos d’água. Isso é o que foi comprovado no estudo de Dobranskyte, Jugdaohsingh et al. (2006), que revelou que na presença de AH, a toxidade desse metal diminui para a espécie Lymnaea stagnalis. Apesar da redução dos efeitos adversos, houve apenas uma pequena alteração na biodisponibilidade do metal, pois o AH manteve o Al na forma coloidal na coluna d’água, que é ainda disponível para uso pela espécie estudada. Entretanto, segundo Elkins e Nelson (2002), íons metálicos de Al ligados aos ácidos húmicos podem servir como pontes ao facilitar a ligação de compostos orgânicos negativamente carregados, como certos pesticidas, nos materiais húmicos, aumentando a biodisponibilidade dessas espécies orgânicas tóxicas. Destaca-se ainda que a presença de Al3+ em humanos tem sido correlacionada com algumas doenças, o que torna importante entender a especiação desse íon em águas naturais e seu relacionamento com as SH (Elkins e Nelson, 2002).
2.7.5.
Zinco
O zinco é tóxico para animais em altas concentrações. Entretanto a dureza da água, o pH, hidróxidos e as SH dissolvidas podem alterar a sua toxidade. Complexos podem ser formados entre metais pesados e compostos húmicos via substituição iônica e quelação. Nesses complexos, os cátions perdem sua toxidade (Steinberg, 2003).
Na literatura há vários registros de que a dureza da água e as SH são os melhores agentes protetores contra a toxidade de metais pesados. Entretanto, como foi mostrado, essa proteção tende a ser eliminada quando Ca, Mg e materiais húmicos estão presentes simultaneamente no sistema (Steinberg, 2003).
2.7.6.
Outros metais traço
As substâncias húmicas dissolvidas podem influenciar fortemente a especiação e destino de metais traço em corpos hídricos. Particularmente, o material húmico influencia fortemente na mobilidade e retenção de muitos íons metálicos em solos e água naturais. Em solos, a humina participa da retenção de metais, enquanto os AF e AH estão envolvidos no transporte desses metais em meio terrestre e aquático (Steinberg, 2003).
Muitos estudos demostraram que a maioria dos fortes ligantes consiste de compostos <10 KDa, mas que ligantes coloidais com propriedades similares também existem. Ressalta-se que as aplicações de técnicas espectroscópicas ainda mostraram que o Cd se liga predominantemente aos grupos funcionais oxigenados das substâncias húmicas (Steinberg, 2003).
2.8.
Interação entre substâncias húmicas aquáticas e elementos não
metálicos
2.8.1.
Fósforo
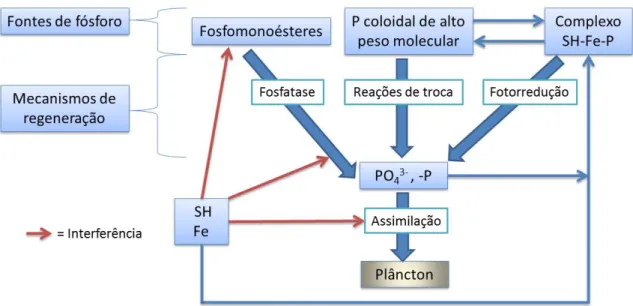
Além dos metais, elementos não metálicos também são influenciados por compostos húmicos. O fósforo, que é um nutriente limitante para o crescimento de organismos em corpos d’água, é um exemplo onde a concentração das SH altera a taxa com que o orto-P iônico é absorvido pelo plâncton. Hessen e Tranvik (1998) observaram que grande parte do P presente em lagoas húmicas está indisponível para organismos vivos por causa da sua complexação com materiais húmicos. É importante salientar que o estímulo ou a repressão do consumo de P por organismos é dependente do tamanho da partícula húmica (Steinberg, 2003).
materiais húmicos, Fe(III) e orto-P formam agregados coloidais. Nesse caso, a ligação com o P vai inibir a sua assimilação direta por microrganismos. Ressalta-se que SH isoladas não reagem com o fósforo em quantidades significativas, pois a complexação é mais efetiva na presença de Fe (Steinberg, 2003).
A evidência direta da complexação SH-Fe-P veio com Haan et al. (1990) apud Steinberg (2003), quando disseram que na presença de compostos húmicos, Fe e P são diretamente incorporados na fração com massa molecular de 10 a 20 KDa (moléculas maiores que 100 KDa também podem levar à absorção do P). Sem as SH, esse tipo de complexação não ocorre.
Em corpos hídricos, a luz solar pode alterar a especiação de complexos SH-Fe-P. Nesse caso, a radiação ultravioleta pode liberar o P, através da redução de Fe(III) para Fe(II)3. Ressalta-se que a fotorreação com a consequente liberação do fósforo dura cerca de uma hora e é reversível. Na ausência de luz o Fe(III) e o P são regenerados como complexos (Steinberg, 2003).
O P na forma de fosfato (PO43-) também pode ser liberado de complexos de alto peso molecular através de reações de deslocamento, nas quais participam ésteres fosfatados (P ésteres) de baixo peso molecular (Steinberg, 2003).
As SH ainda podem alterar a capacidade do plâncton em aproveitar fosfomonoésteres como fonte de P adicional, através da hidrólise por fosfatases alcalinas. É importante mencionar que Stewart e Wetzel (1982) apud Steinberg (2003) relataram que as moléculas húmicas podem aumentar a atividade das fosfatases, particularmente sob condições de pouca luz.
Apesar de aparentemente possuir um aspecto negativo, alguns autores (Jones, 1998
apud Steinberg, 2003) sugerem que o fósforo associado pode ser uma fonte duradoura de nutrição para produtores primários em lagos ricos em SH. A Figura 2-8 exibe um diagrama resumindo a relação entre material húmico e fósforo.
Apesar de tudo que foi mencionado e de tudo que já é conhecido, a natureza das relações entre o material húmico e o ciclo do fósforo ainda não é totalmente compreendidas, sendo necessários mais estudos para um completo entendimento do assunto (Hessen e Tranvik, 1998).
Figura 2-8 - Papel das substâncias húmicas na complexação do P (Baseado em Hessen e Tranvik, 1998; Steinberg, 2003).
2.8.2.
Nitrogênio
A interação entre N e SH ainda foi muito pouco estudada se compararmos com a relação entre P e SH. O que se supõe é que é improvável que compostos húmicos possam ser uma fonte de nitrogênio para a rede microbiana, já que se pensa que a biodisponibilidade das SH ligadas ao N é muito baixa. Entretanto, estudos recentes mostraram que a exposição do COD à luz solar força a liberação de compostos ricos em nitrogênio de alta disponibilidade para os seres vivos. Dentre esses compostos está a amônia, que é a mais efetivamente liberada e o nitrito (Steinberg, 2003).
2.8.3.
Halogênios
2.9.
Efeitos das substâncias húmicas no fitoplâncton e na produtividade
primária de corpos d’água
Como já mencionado parcialmente para os casos do fósforo e nitrogênio, as SH em corpos d’água podem afetar o fitoplâncton tanto servindo como fonte de carbono/energia/nutrientes, como por sua habilidade de interagir e modificar as propriedades de outros compostos químicos na água. Em anos recentes tem havido um crescente interesse em estudos sobre a utilização direta de SH dentro de cadeias alimentares em lagoas húmicas. Um deles (Tulonen et. al. 1992 apud Hessen e Tranvik, 1998) em um lago da Finlândia revelou que algas não podem crescer heterotroficamente na presença de compostos húmicos como fonte de C. Ainda foi mostrado que a fração de baixo peso molecular tem efeito fototóxico ou na disponibilidade de nutrientes para as algas, o que foi suprimido na presença de frações4 de alto peso molecular. Enfim, baseado nas evidências do trabalho foi possível concluir que as SH não têm uma significante contribuição direta como fonte de carbono e energia para o fitoplâncton, embora os estudos tenham demonstrado um bom crescimento de algas para as frações de alto peso molecular (Hessen e Tranvik, 1998).
Um efeito indireto das SH no fitoplâncton é através da modificação da toxidade de metais. Segundo Hessen e Tranvik (1998) muitos estudos demostraram que a toxidade do Cu para diatomáceas estuarinas foi reduzida por compostos húmicos em águas de rios. Efeito equivalente foi observado para o Cd no teste com a alga Selenastrum
capricornutum. No caso de fitoplâncton natural foi constatada redução de efeitos tóxicos para Zn, Pb, Hg e Cu.
Entretanto, a maior contribuição das substâncias húmicas não é na toxidade de metais e sim na modificação da disponibilidade e assimilação de metais essenciais (como o Fe) e nutrientes aniônicos (como o fosfato) para o crescimento de fitoplâncton. É possível que em certas circunstâncias a complexação metal-húmus possa deprimir a atividade biológica, como demostrado no estudo de Hecky (1980) apud Hessen e Tranvik (1998), que atribuiu a redução na produtividade primária ao material húmico, que fez com que parte do ferro ficasse menos disponível para o fitoplâncton.
2.10.
Extração das SH de águas naturais
Para estudos relacionados às SHA é inicialmente indispensável isolar certa quantidade de húmus. Isso é necessário porque a concentração desses compostos em águas é baixa (Tabela 2-3), sendo necessária uma grande quantidade de água para se obter uma abundância razoável de material húmico para estudo (Thurman e Malcolm, 1981). Um dos métodos mais utilizados para extração de compostos húmicos é a utilização de resinas macroporosas não iônicas, tais como a XAD-2 e a XAD-8 (Rocha e Rosa, 2003).
Tabela 2-3- Concentração de SHA extraídas de águas naturais.
Amostras Concentração (mg/L) Referências (Rocha e Rosa, 2003)
Águas superficiais 7-30
Rocha et al. (2000); Rocha et al. (1998);
Aster, Burba & Broekaert (1996); Suffet & MacCarthy (1989).
Águas subterrâneas 20 Suffet & MacCarthy (1989).
Águas marinhas 0,0029* Malcolm (1990).
* Teor de ácido húmico (fração das SHA) obtido.
A princípio, a resina não iônica adsorvente Amberlite® XAD-8 foi amplamente utilizada para extração de SHA. Atualmente ela tem sido substituída pela SupeliteTM DAX-8, que assim como a XAD-DAX-8, é uma resina de polimetilmetacrilato. Embora o processo de fabricação dessas duas resinas seja praticamente o mesmo, as especificações técnicas (como o tamanho do poro e área superficial) da DAX-8 diferem-se um pouco das da XAD-8. A DAX-8 é mais fácil de manipular, seu conteúdo de finos é menor que 1% (peso/peso) e sua habilidade de reter umidade é maior do que a da XAD-8 (Peuravuori, Lehtonen et al., 2002).
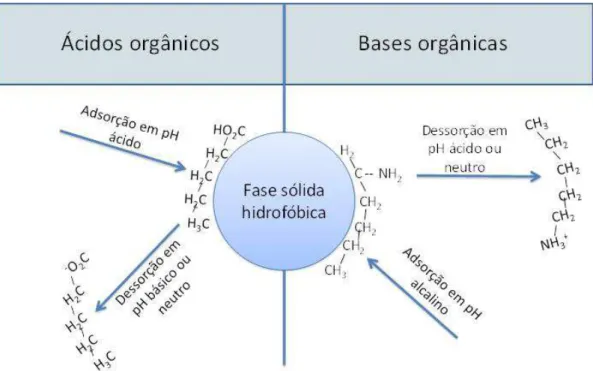
como –NH2 sejam protonados e formem, por exemplo, -NH3. Em valores de pH básico ou neutro (condições de não protonamento), as bases orgânicas são inicialmente adsorvidas e os ácidos orgânicos agora são dissociados e dessorvidos da superfície adsorvente (Steinberg, 2003). A Figura 2-9 mostra mais detalhes sobre a influência do pH na adsorção e dessorção de SH em resinas hidrofóbicas.
Figura 2-9 – Efeito do pH na ionização e solubilidade na adsorção de ácidos e bases orgânicos adsorvíveis (SH) (baseado em Steinberg, 2003).
Uma questão que tem sido muito discutida por pesquisadores é se o extrato obtido após isolamento de compostos húmicos por resinas macroporosas possui as mesmas características da substância em seu estado natural. Esse problema é devido principalmente às condições ácidas e básicas extremas envolvidas na concentração do húmus. Se o mesmo processo fosse aplicado para o isolamento de enzimas, quase toda sua atividade biológica seria perdida (Tipping, 2002).
apenas um evaporador rotativo acoplado a uma bomba de vácuo. As vantagens e desvantagens entre esse método e o por resinas DAX-8 são mostradas na Tabela 2-4.
Tabela 2-4 - Vantagens e desvantagens de dois métodos de extração de substâncias húmicas aquáticas.
Método Vantagens Desvantagens
Evaporação Rotativa
Baixas temperaturas; método brando.
Método lento; todos os solutos orgânicos e
inorgânicos são concentrados; inconveniente
para grandes volumes.
Resina macroporosa não iônica DAX-8
Alta capacidade de sorção; eluição eficiente; eluição com
solução diluída de NaOH; método brando e simples; resina facilmente regenerada;
adequado para grandes volumes de amostras.
Possibilidade de sorção irreversível.
Baseado em Aiken (1985) apud Rocha e Rosa (2003).
2.11.
Fracionamento
das SHAUma das técnicas mais utilizadas para o fracionamento de SH é a variação do pH, cujas frações obtidas são ácidos húmicos, ácidos fúlvicos e humina. Segundo Oliveira L.C. (2007) essas definições são baseadas na extração alcalina de solos e sedimentos e podem ser utilizadas quando o extrator é ácido, neutro ou solvente orgânico.
Tabela 2-5 - Métodos usualmente utilizados para o fracionamento de SH.
Procedimento Frações Referências
Diferença de solubilidade e
precipitação com ácidos e bases Ácidos húmicos, ácidos fúlvicos e humina
Procedimento utilizado convencionalmente Extração com diferentes
solventes orgânicos Bem definidas Post & Klamberg (1992)
Cromatografia de exclusão com
base no tamanho molecular Menos definidas Piccolo, Nardi & Concheri (1996) Ultrafiltração
Dependem da porosidade das membranas filtrantes
Burba, Shkinev & Spivakov (1995)
Eletroforese Separação depende das substâncias húmicas Duxbury (1989) Cromatografia de exclusão com
base no tamanho molecular e alta pressão
Boa separação Piccolo & Conte (1999)
Cromatografia com afinidade
por metais Obtêm-se 3-4 frações Kuckuk & Burba (2000)
Cromatografia em fase reversa Menos definidas Frimmel (1992)
Fonte: Rocha e Rosa (2003)
Um método barato e muito versátil usado para o fracionamento de SH é a cromatografia por permeação em gel, cuja separação é baseada na massa molar. A estrutura do gel é composta por um sistema de poros que age como um meio cromatográfico. As moléculas menores podem entrar nesses poros fazendo com que sua passagem pela coluna seja retardada. Consequentemente as moléculas são eluídas em ordem decrescente de massa molar (Oliveira, L. C., 2007). Rocha e Rosa (2003) destacam que problemas como interações químicas ou físicas entre o gel e o soluto devem ser contornados para não invalidar os resultados.
Outro procedimento simples e rápido para fracionamento de SHA é a ultrafiltração, que é considerado um método interessante devido a possibilidade de minimização de alterações químicas dos compostos húmicos. Ele permite o fracionamento baseado no tamanho molecular das SH através de uma série de membranas com diâmetro de poro de alguns nanômetros (Rocha e Rosa, 2003). Por essa técnica, o fracionamento pode ser feito em ordem ascendente ou descendente de tamanho molecular. Oliveira, L. C. (2007, p.32) destaca que um inconveniente “é a distribuição não uniforme dos tamanhos dos poros nessas membranas e, nesse caso, o tamanho molecular pode não ser o esperado”.
Particularmente, unidades de ultrafiltração (UF) com fluxo tangencial permitem uma filtração mais rápida em função da reduzida obstrução dos poros, “pois os compostos acumulados na superfície da membrana são deslocados pelo forte fluxo cruzado” (Burba et
al., 1997 apud Rocha e Rosa, 2003, p.52). Em um sistema composto por várias UF de fluxo tangencial acopladas on-line e operado por uma bomba peristáltica com múltiplos canais a coleta das frações obtidas é relativamente simples (Rocha e Rosa, 2003).
2.12.
Estudo e caracterização das SHA e de complexos SHA-metais
Para o estudo das SHA pode-se determinar o COD das diferentes frações húmicas obtidas, que pode ser comparado com a aromaticidade, parâmetros físico-químicos e concentrações de certos elementos químicos por meio do uso técnicas estatísticas. Métodos espectroscópicos, que tem como metas identificar grupos funcionais presentes nas moléculas, também podem ser utilizados no estudo dos compostos húmicos. De acordo com Aiken et al. apud Rocha e Rosa (2003), “a caracterização das SHA e suas propriedades no ambiente requer a utilização de procedimentos analíticos adequados combinados com métodos químicos, físicos e espectroscópicos”. Nesse caso, a extração é uma etapa crucial, pois é nela onde podem ocorrer alterações estruturais nas SH, com a consequente perda de algumas de suas características originais (Rocha e Rosa, 2003). Alguns métodos para estudo e caracterização dos compostos húmicos serão apresentados nos subtópicos a seguir.
2.12.1.
Espectroscopia na região do infravermelho
por meio de espectros de IV de SH que se pode obter informações sobre a natureza, a reatividade e o arranjo estrutural dos grupos funcionais contendo oxigênio. Stevenson (1994) ainda completa que os espectros ainda podem indicar a presença de impurezas inorgânicas como íons metálicos e argila e que essa técnica é apropriada para análises quantitativas.
Outras aplicações da espectroscopia IV incluem estudos das interações entre pesticidas e metais com a matéria orgânica. Um exemplo dessa aplicação é a confirmação de que os grupamentos -COOH desempenham um importante papel na complexação de cátions di- e trivalentes por SH e que os grupos OH, C=O e NH estão envolvidos na complexação de íons metálicos por SH.
2.12.2.
Espectroscopia na região do UV-Visível
A espectroscopia na região do UV é uma técnica importante na identificação de grupos cromóforos, pois alguns compostos presentes nas SH absorvem fortemente abaixo de 280 nm, que é onde ocorrem as transições eletrônicas do tipo π-π, que são características de compostos como ácidos benzoicos, derivados de anilina e outros correlatos que são subunidades da estrutura das SHA (Rocha e Rosa, 2003, p.63).
Segundo Rosa (1998), na região visível do espectro a absorção de energia radiante por SH está relacionada com transferência de elétrons dos orbitais π, σ e n do estado fundamental para estados de maior energia. O autor ainda ressalta que os espectros de absorção na região do UV e visível são pouco característicos, pois não apresentam regiões de absorção máxima ou mínima.