Dissertação
Síntese e Caracterização de Carregadores
Inorgânicos Sustentáveis para Remoção de
Íons de Efluentes Industriais
Mariana Araújo Teixeira
UNIVERSIDADE FEDERAL
DE OURO PRETO
Instituto de Ciências Exatas e
Biológicas
Programa de Pós-Graduação em Química
PPGQUIM
Ouro Preto
MINISTÉRIO DA EDUCAÇÃO
Universidade Federal de Ouro Preto
Instituto de Ciências Exatas e Biológicas
Programa de Pós-Graduação em Química
SÍNTESE E CARACTERIZAÇÃO DE CARREGADORES INORGÂNICOS SUSTENTÁVEIS PARA REMOÇÃO DE ÍONS DE EFLUENTES INDUSTRIAIS
MARIANA ARAÚJO TEIXEIRA
MINISTÉRIO DA EDUCAÇÃO Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Programa de Pós-Graduação em Química
SÍNTESE E CARACTERIZAÇÃO DE CARREGADORES INORGÂNICOS
SUSTENTÁVEIS PARA REMOÇÃO DE ÍONS DE EFLUENTES INDUSTRIAIS
Autora: Mariana Araújo Teixeira
Orientadora: Prof.ª Dr.ª Kisla Prislen Félix Siqueira
Dissertação apresentada ao Programa de
Pós-Graduação em Química da
Universidade Federal de Ouro Preto, como
parte dos requisitos para obtenção do título
de Mestre em Química.
Área de concentração:
Físico-Química
Ouro Preto/MG
Catalogação: www.sisbin.ufop.br T235s Teixeira , Mariana Araújo.
Síntese e caracterização de carregadores inorgânicos sustentáveis para remoção de íons de efluentes industriais [manuscrito] / Mariana Araújo Teixeira . -2017.
74f.: il.: color; grafs; tabs.
Orientadora: Profª. Drª. Kisla Prislen Félix Siqueira. Coorientadora: Profª. Drª. Aparecida Barbosa Mageste.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Departamento de Química. Programa de Pós-Graduação em Química.
Área de Concentração: Físico Química.
1. Efluente - Qualidade. 2. Manganês. 3. Fluoretos. 4. Adsorção. I. Siqueira, Kisla Prislen Félix. II. Mageste, Aparecida Barbosa. III. Universidade Federal de Ouro Preto. IV. Titulo.
i
AGRADECIMENTOS
Em primeiro lugar, agradeço a Deus pelas bênçãos alcançadas e pela proteção. Obrigada, meu Deus, por toda honra e toda glória. Obrigada, Nossa Senhora Aparecida, por ter me dado forças e não ter me deixado desistir em nenhum momento.
Os meus sinceros agradecimentos à minha família. Aos meus pais Valter e Luciane, meus grandes exemplos que sempre me dedicaram amor, carinho e nunca deixaram de acreditar em mim. Eu amo vocês! Ao meu irmão Diogo que sempre foi meu verdadeiro amigo e me apoiou, com toda sua atenção, em todas as minhas decisões. À minha irmã Maria Alice por me ensinar a amar cada dia mais e por ter me alegrado com simples gestos de carinho. Agradeço ao Alan por sempre ficar ao meu lado, agradeço pelos conselhos grandiosos que me permitiram seguir em frente e por ter me enchido de carinho e amor. Agradeço à minha Avó Rosa por ser tão especial e por ter me dado um amor infinito durante toda a minha trajetória. Agradeço também à minha tia Lúcia pelas orações, carinho e por sempre me ouvir. Obrigada Marília e Pedro por engrandecerem a família. Obrigada a todos os “Araújos”, em especial minha avó Maria pelo seu amor, preocupação e cuidado, e a todos os “Teixeiras” pelo grande apoio.
Agradeço à minha orientadora Profª. Drª. Kisla Siqueira por ter acreditado em mim quando iniciamos um projeto desconhecido. Agradeço a grande amizade, paciência e confiança de sempre. Agradeço à minha coorientadora Profª. Drª. Aparecida Mageste por ter me acolhido com muita dedicação e por ter me surpreendido com tanto carinho. Vocês duas foram essenciais em todos os momentos e me proporcionaram grandes aprendizados. O meu agradecimento ao Prof. Dr. Anderson Dias pelas conversas, conselhos e grandes ensinamentos. É uma honra ter por perto um grande e admirável profissional.
Agradeço aos meus companheiros de laboratório, em especial ao Adriano, pela ajuda e confiança. Aos meus amigos de mestrado Júlia, Guilherme e Roberta pela amizade, companhia e por terem tornado essa caminhada mais fácil e alegre. Agradeço também minha amiga Júlia Cris pela amizade e apoio.
ii
pelas análises de Raman e por ter me apoiado em todos os experimentos com equipamentos e vidrarias. Agradeço ao Laboratório de Hidrometalurgia pelas análises de ICP-OES e ao Vanderlei do Laboratório de Difração de Raios X pelo trabalho tão bem feito.
O meu verdadeiro agradecimento à Universidade Federal de Ouro Preto e ao Programa de Pós-Graduação em Química (PPGQUI) pela oportunidade de estudo e desenvolvimento desta pesquisa. Agradeço aos órgãos de fomento, Vale e FAPEMIG, pela concessão da bolsa de estudo. Enfim, o meu grande e sincero agradecimento aos membros da banca por terem aceitado 5o meu convite e a todos que me ajudaram na realização deste trabalho. Muito obrigada!
“Basta acreditar que um novo diavai raiar, sua hora vai chegar. ”
iii
RESUMO
Síntese e caracterização de carregadores inorgânicos sustentáveis para remoção de íons de efluentes industriais
Este trabalho apresentou um procedimento ambientalmente adequado para a remoção de manganês e fluoreto de efluentes industriais através de hidróxidos duplos lamelares (HDL). A metodologia foi dividida em duas etapas: Etapa I – Remoção de manganês por coprecipitação e Etapa II – Remoção de fluoreto por “efeito memória”. Um HDL ternário Mg-Mn-Al (HE)
foi produzido a partir de um efluente industrial que apresentou, inicialmente, um elevado teor de manganês (99,42 ± 3,11 mg/L) e fluoreto (162,15 ± 4,65 mg/L). Após a síntese do material, o efluente apresentou uma concentração de manganês de 0,0025 ± 0,0005 mg/L relativa à porcentagem de remoção de 99,99%. A presença de manganês no ternário HE foi
comprovada por espectroscopia de perda de energia de elétrons (EELS) onde encontrou-se uma concentração de 0,1588 ± 0,0048 mg Mn/g HDL. Sintetizou-se também um HDL sintético Mg-Al (HS) para fins de comparação. Os materiais foram caracterizados por difração
de raios X (DRX), análise térmica, espectroscopia Raman, microscopia eletrônica de varredura (MEV) e microscopia eletrônica de transmissão de alta resolução (MET). Ambos os materiais foram calcinados e os óxidos resultantes (OS e OE) foram aplicados para a remoção
do fluoreto presente no efluente industrial. A cinética de remoção de fluoreto foi descrita pelo modelo de pseudosegunda ordem para ambos os óxidos (OS e OE). O fenômeno de adsorção
foi descrito do tipo Langmuir para OS e do tipo Freundlich para OE. Os óxidos apresentaram
porcentagem de remoção de fluoreto do efluente de 94,02% e 95,11% para OS e OE,
respectivamente, e exibiram concentração de fluoreto residual de 9,74 mg/L para OS e 7,97
mg/L par OE. O procedimento proposto foi capaz de adequar os teores dos íons poluentes
manganês e fluoreto do efluente industrial de acordo com a Resolução CONAMA n°. 430 de 13 de maio de 2011, a qual estabelece que a concentração máxima permitida seja de 1,0 mg/L de manganês dissolvido e 10,0 mg/L de fluoreto total.
iv
ABSTRACT
Synthesis and characterization of sustainable inorganic chargers for removal ions of industrial effluent
This work presented an environmentally-friendly procedure for removal of manganese and fluoride from industrial effluents by lamellar double hydroxides (LDH). The methodology was divided into two phases: Step I - Manganese removal by coprecipitation and Step II –
Fluoride removal by memory effect. Ternary Mg-Mn-Al LDH (HE) was produced from an
industrial effluent which initially had a high content of manganese (99.42 ± 3.11 mg/L) and fluoride (162.15 mg/L). After the synthesis of the material, the effluent presented a concentration of manganese 0.0025 ± 0.0005 mg/L, relative a removal percentage of 99.99%. The presence of manganese in HE was confirmed by Electron Energy Loss Spectroscopy
(EELS) with a concentration of 0.1588 ± 0.0048 mg Mn/g HDL was found. Synthetic Mg-Al LDH (HS) was also synthesized for comparison purposes. The materials were characterized
by X-ray diffraction (XRD), thermal analysis, Raman spectroscopy, scanning electron microscopy (SEM) and high resolution transmission electron microscopy (TEM). Both materials were calcined and the resulting oxides (OS and OE) were applied for fluoride
removal present in the industrial effluent. The kinetics of fluoride removal were described by the second-order model for both oxides (OS and OE). The adsorption phenomenon was
described as Langmuir-type for OS and Freundlich model for OE. The oxides showed a
percentage of fluoride removal from the effluent of 94.02% and 95.11% for OS and OE,
respectively, and showed residual fluoride concentration of 9.74 mg/L for OS and 7.97 mg/L for OE. The procedure was able to adjust the levels of the pollutant ions manganese and
fluoride in the industrial effluent in accordance with CONAMA Resolution 430 of May 13, 2011, which the maximum permissible concentration is 1.0 mg/L of manganese and 10.0 mg/L of total fluoride.
v
LISTA DE FIGURAS
Figura 1. Esquema representativo dos polítipos 3R, 2H e 1H para os hidróxidos duplos lamelares. ... 5
Figura 2. Representação esquemática do processo de regeneração do HDL – “Efeito
memória”. ... 8
Figura 3. Tipos de isotermas de adsorção. ... 18
Figura 4. (a) Soluções com diferentes concentrações de F- exibindo cores inversamente
proporcionais à concentração de fluoreto. Concentrações variando de 0,0 até 0,9955 mg F-/L
(0,0 até 0,0522 mmol/L). (b) Curva analítica obtida a partir do método SPADNS. ... 25
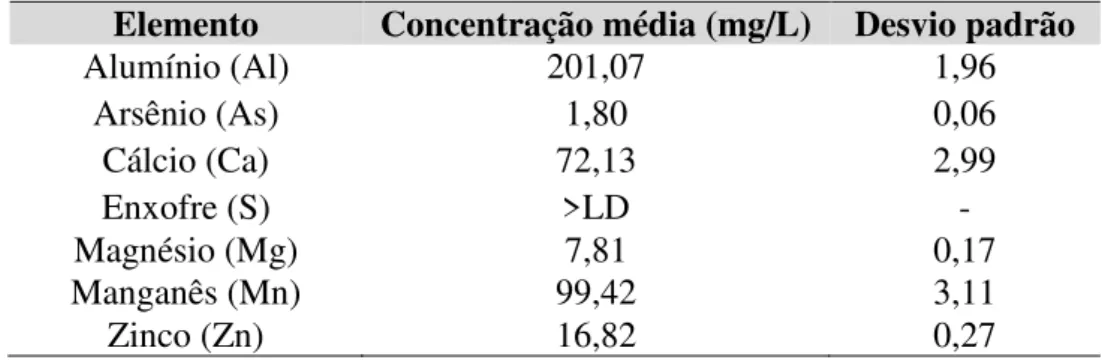
Figura 5. Difratogramas de raios X para os HDLs sintetizados: (a) Padrão ICDD 00-051-1525 Mg4Al2OH12CO3.3H2O (b) HS (c) HE. *picos referentes à fase de cobre (Cu(s)) presente
no porta-amostra. ... 32
Figura 6. Difratogramas de raios X para os óxidos produzidos: (a) Padrão ICDD 00-004-0829
– MgO (b) OS e (c) OE. ... 34
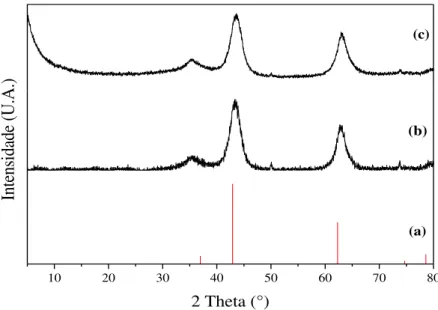
Figura 7. (a) Mapeamento elementar e (b) espectro dos elementos manganês, magnésio e alumínio para MET-EELS da amostra HE. ... 35
Figura 8. Análise térmica para os HDLs HS e HE. Curva TG (─) e curva DTG (─). ... 37
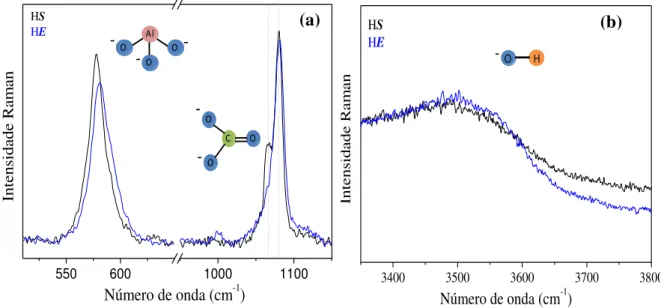
Figura 9. Espectros Raman para os HDLs produzidos HS (─) e HE (─) com a inserção das
moléculas referentes aos estiramentos identificados. (a) Região de frequência de 500 a 650 cm-1 e 950 a 1150 cm-1. (b) Região de frequência de 3200 a 3750 cm-1. Obs.: Todas as
intensidades foram normalizadas... 38
Figura 10. Micrografias de MEV dos materiais HS (a) e HE (b). Imagens MET que mostram
as partículas nanométricas e padrões SAED inseridas nas imagens, que confirmam a natureza policristalina das amostras para HS (c) e HE (d). As imagens MET em alta resolução que
mostram espaçamentos interplanares para HS (e) e HE (f)... 40
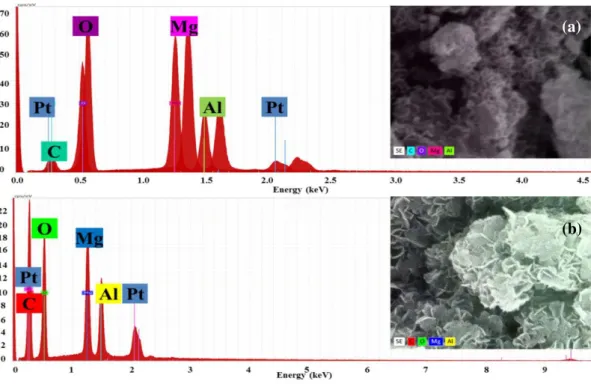
Figura 11. (a) Espectro de EDS e mapa químico do HS (b) Espectro de EDS e mapa químico do HE. Obs.: Os picos de platina (Pt) são provenientes do porta-amostra... 41
Figura 12. Curvas de cinética de adsorção de F- para os óxidos OS e OE, nas condições:
0,0522 mmol/L de F-, 25°C e 2,5 mg/L de adsorvente. ... 43 Figura 13. Ajuste dos modelos cinéticos aos dados experimentais de adsorção de F- através
dos óxidos OS e OE. (a) Modelo pseudoprimeira ordem (b) Modelos pseudosegunda ordem.
... 44
vi
Figura 15. Efeito da concentração inicial de fluoreto no processo de adsorção através dos óxidos OS e OE a 25 °C. (a) Isotermas de adsorção de fluoreto: quantidade adsorvida no
equilíbrio (qe) em função da concentração de equilíbrio (Ce). (b) Porcentagem de extração de
fluoreto em função da concentração inicial do ânion. ... 46
Figura 16. Ajuste dos modelos isotérmicos de (a) Langmuir e (b) Freundlich para os dados de adsorção de F- através do OS e OE a 25°C. ... 47 Figura 17. Difratogramas de raios X na região de 9 a 27 °2ϴ para os HDLs regenerados no ensaio de isoterma. (a) OS e (b) OE. ... 48
Figura 18. Difratogramas de raios X dos HDLs regenerados com efluente industrial após a remoção de fluoreto utilizando os óxidos OS e OE, a 25°C. (a) 0,3125 g OS (b) 0,9375 g OS
(c) 0,3125 g OE (d) 0,9375 g OE. * Picos referentes à fase de Cu(s) proveniente do
porta-amostra. ... 50
vii
LISTA DE TABELAS
Tabela 1. Características físico-químicas do efluente industrial. ... 29
Tabela 2. Concentrações médias encontradas para os elementos alumínio, arsênio, cálcio, enxofre, magnésio, manganês e zinco no efluente industrial através da análise de ICP – OES. ... 29
Tabela 3. Concentrações médias encontradas para os ânions fluoreto, cloreto, nitrato e sulfato no efluente industrial através da análise de Cromatografia Iônica. ... 30
Tabela 4. Concentrações médias dos metais alumínio, arsênio, cálcio, enxofre, magnésio, manganês e zinco encontradas no efluente industrial após o tratamento de remoção do cátion manganês através da análise de ICP - OES. ... 30
Tabela 5. Concentrações médias dos metais magnésio, alumínio e manganês encontradas nos HDLs HS e HE através da abertura das amostras na análise de ICP - OES. ... 34
Tabela 6. Valores encontrados para o ajuste dos modelos PPO e PSO aos dados experimentais. ... 43
Tabela 7. Valores encontrados para o ajuste dos modelos de isoterma de Langmuir e Freundlich aos dados de adsorção a 25 ° C e 2,5 g de adsorvente/L. ... 47
Tabela 8. Resultados encontrados para o ensaio de remoção de F- do efluente industrial
viii
LISTA DE ABREVIAÇÕES
ATG – Análise Termogravimétrica
CONAMA – Conselho Nacional do Meio Ambiente DRX – Difração de Raios X
DTG – Termogravimetria Diferencial EDS – Sistema de Dispersão de Energia
EELS – Espectroscopia por Perda de Energia de Elétrons HDL – Hidróxido Duplo Lamelar
ICDD – Centro Internacional de Dados de Difração
ICP-OES – Espectrometria de Emissão Óptica por Plasma Acoplado Indutivamente LD – Limite de Detecção
MET – Microscopia Eletrônica de Transmissão MEV – Microscopia Eletrônica de Varredura OMS – Organização Mundial da Saúde PPO – Pseudoprimeira Ordem
PSO – Pseudosegunda Ordem
SAED – Difração de Elétrons por Área Selecionada TG - Termogravimetria
ix
SUMÁRIO
RESUMO ... iii
ABSTRACT ... iv
LISTA DE FIGURAS ... v
LISTA DE TABELAS... ... vii
LISTA DE ABREVIAÇÕES ... viii
1. INTRODUÇÃO ... 1
2. OBJETIVOS ... 3
2.1. Objetivo geral ... 3
2.2. Objetivos específicos ... 3
3. REVISÃO BIBLIOGRÁFICA ... 4
3.1. Hidróxido duplo lamelar ... 4
3.1.1. Estrutura dos HDLs ... 4
3.1.2. Síntese dos HDLs ... 7
3.1.3. Propriedades e aplicações dos HDLs... 9
3.2. Manganês ... 12
3.3. Fluoreto ... 15
3.4. Adsorção em HDLs ... 17
3.4.1. Isotermas de adsorção ... 18
3.4.2. Cinética de adsorção ... 20
4. METODOLOGIA ... 22
4.1. Caracterização do efluente industrial ... 22
4.2. ETAPA I - Remoção de manganês (Mn2+) por coprecipitação ... 22
4.3. ETAPA II - Remoção de fluoreto por “efeito memória” ... 23
4.3.1. Estudo da cinética de adsorção ... 23
4.3.2. Estudo da isoterma de adsorção ... 24
4.3.3. Estudo de remoção de fluoreto do efluente industrial ... 24
4.4. Técnicas de quantificação de cátions e ânions ... 24
4.4.1. Espectrometria de Emissão Óptica por Plasma Acoplado Indutivamente... 24
4.4.2. Método SPADNS ... 24
4.4.3. Cromatografia de íons ... 26
4.5. Técnicas de caracterização dos HDLs ... 26
4.5.1. Difração de Raios X ... 26
4.5.2. Análise Térmica ... 27
x
4.5.4. Microscopia Eletrônica de Varredura e Microscopia Eletrônica de Transmissão ... 27
5.1. Caracterização do efluente industrial ... 29
5.2. ETAPA I - Remoção de manganês (Mn2+) por coprecipitação ... 30
5.2.1. Remoção de manganês do efluente industrial ... 30
5.2.2. Caracterização dos HDLs produzidos – HS e HE ... 31
5.3. ETAPA II - Remoção de fluoreto por “efeito memória” ... 42
5.3.1. Estudo de cinética de adsorção ... 42
5.3.1.1. Cinética de adsorção ... 42
5.3.1.2. Caracterização dos HDLs regenerados nos ensaios de cinética de adsorção ... 44
5.3.2. Estudo de isoterma de adsorção ... 45
5.3.2.1. Isoterma de adsorção ... 45
5.3.2.2. Caracterização dos HDLs regenerados no ensaio de isoterma de adsorção ... 47
5.4. Estudo da remoção de fluoreto de efluente industrial ... 48
5.4.1. Remoção de fluoreto do efluente industrial ... 48
5.4.2. Caracterização dos HDLs regenerados a partir do efluente industrial ... 49
6. CONCLUSÕES ... 52
7. REFERÊNCIAS BIBLIOGRÁFICAS ... 54
8. APÊNDICE ... 60
APÊNDICE A – Trabalhos apresentados em congressos... 60
1
1.
INTRODUÇÃO
A atividade industrial apresenta um aumento constante na atualidade e, em consequência disso, surge uma preocupação ambiental relacionada à geração de efluentes com concentrações elevadas de íons diversos e que eventualmente não recebem tratamentos adequados antes do descarte, tornando-os potencialmente poluidores.[1] Dentre essa
diversidade de íons, destaca-se o cátion manganês que apresenta alguns desafios relacionados à sua remoção de efluentes industriais, já que simples ajustes do pH não são suficientes para possível remoção.[2] O manganês é fundamental para a manutenção da saúde humana,
entretanto, em elevadas concentrações, acarreta em danos ao meio ambiente e aos seres humanos, o qual afeta principalmente os pulmões e o sistema nervoso central.[3] Águas
residuais contendo manganês são provenientes de diversas indústrias, principalmente no que tange à indústria metalúrgica.[4] O Conselho Nacional do Meio Ambiente (CONAMA) através
da Resolução n°. 430 de 13 de maio de 2011, dispõe sobre condições e padrões de lançamento de efluentes e estabelece o teor máximo permitido de 1,0 mg/L de manganês dissolvido.[5]
O ânion fluoreto também é considerado um íon poluidor. Em águas destinadas ao consumo humano, o fluoreto encontrado em elevadas concentrações causa efeitos adversos à saúde humana, como exemplo a fluorose dentária que acarreta em problemas no desenvolvimento do esmalte dentário.[6] A Resolução CONAMA n°. 430/2011 estabelece o
teor máximo permitido do ânion cujo valor é de 10 mg/L de fluoreto total.[5]
Devido ao aumento da rigidez das leis ambientais, há a necessidade da geração de novas tecnologias que possibilitem a produção de materiais ambientalmente adequados, que sejam direcionados para a despoluição e tratamento de resíduos. Nesse contexto, materiais do tipo carregadores inorgânicos se apresentam como promissores por serem capazes de remover íons de efluentes industriais. Esses materiais incorporam em sua estrutura algum tipo de espécie, seja ela cátions, ânions ou moléculas, removendo-as de algum meio. Os carregadores inorgânicos são promitentes já que são considerados ambientalmente seguros e adequados, uma vez que não causam danos ao meio ambiente e podem ser reciclados. Os hidróxidos duplos lamelares (HDL) são materiais denominados carregadores inorgânicos sustentáveis e apresentam em sua estrutura um empilhamento de lamelas contendo cátions e camadas interlamelares compostas por espécies aniônicas.[7] Os HDLs apresentam algumas vantagens,
tais como baixo custo de síntese, capacidade de reutilização/reciclagem e propriedades de troca iônica e adsorção.[7] Diante dessas características, a aplicação de HDLs para remoção de
3
2.
OBJETIVOS
2.1. Objetivo geral
Desenvolver uma tecnologia ambientalmente “limpa” com o uso de HDL tipo
hidrotalcita (Mg/Al-CO3) para remover os íons manganês e fluoreto presentes em um efluente
industrial.
2.2. Objetivos específicos
− Caracterizar o efluente industrial por meio de análises química e físico-química. − Sintetizar os hidróxidos duplos lamelares via síntese direta por coprecipitação e
caracterizá-los por técnicas espectroscópicas, microscópicas e por difração de raios X.
− Calcinar os hidróxidos duplos lamelares via calcinação convencional e caracterizar os óxidos obtidos por difração de raios X;
− Avaliar a capacidade dos HDLs em remover o cátion manganês do efluente industrial através da síntese dos hidróxidos duplos lamelares;
− Avaliar os estudos de adsorção (isotermas de adsorção e cinética de adsorção) para obter as melhores condições para remoção do ânion fluoreto do efluente industrial. − Avaliar a capacidade dos HDLs calcinados em remover o ânion fluoreto de
soluções sintéticas e efluente industrial a partir da propriedade “efeito memória”. − Confrontar os teores do cátion manganês e do ânion fluoreto presentes no efluente
4
3.
REVISÃO BIBLIOGRÁFICA
3.1. Hidróxido duplo lamelar
Os Hidróxidos Duplos Lamelares (HDL) são materiais designados como argilas aniônicas por serem formados pelo empilhamento de camadas de hidróxidos mistos de cátions divalentes e trivalentes contendo ânions hidratados entre as camadas.[10] As argilas aniônicas
são minerais estudados desde o início do século XX e essa designação deve-se ao equiparável
termo “argilas catiônicas”, que por sua vez, é empregado em materiais que apresentam
camadas de aluminossilicatos intercaladas por espécies catiônicas.[7,11] Naturalmente, os
HDLs podem ser encontrados; contudo, não são abundantes na natureza. Esses materiais podem ser sintetizados por diferentes rotas permitindo a obtenção de sólidos de alta pureza.[7,12,13] De acordo com Reichle[12], os estudos para a síntese desses compostos se
iniciaram na década de 1930 com Feitknecht, que se fundamentou no emprego de soluções de sais metálicos com uma base.[12] Como consequência, as pesquisas avançaram concentradas
na síntese, estrutura e propriedades dos HDLs e, então, os interesses industriais juntamente com os interesses científicos se desenvolveram a cada dia devido à gama de propriedades e aplicações desses materiais.[12]
Atualmente, o termo “Hidróxido Duplo Lamelar” é mais empregado em razão de ser atribuído às características estruturais dos materiais.[7,11] “Compostos do tipo hidrotalcita” é
outro termo bastante utilizado para nomear estes materiais.Sabe-se que a hidrotalcita é uma argila aniônica natural que contêm ânions carbonato (CO3-2) intercalados entre lamelas de
hidróxidos de magnésio e alumínioe, no momento em que se troca a natureza ou do cátion ou do ânion, os compostos são considerados do tipo hidrotalcita.[7,11]
3.1.1. Estrutura dos HDLs
Os hidróxidos duplos lamelares podem ser representados pela fórmula geral demonstrada pela Equação 3.1:
[M2+1-x M3+x (OH)2] x+ An-x/n•mH2O, Equação 3.1
onde M2+ representa o cátion metálico divalente, M3+ representa o cátion metálico trivalente,
An- refere-se ao ânion intercalado com carga n- e x representa a razão molar M3+/(M2+ + M3+ )
sendo 0,20 ≤ x ≤ 0,33.[14]
Esses compostos apresentam o empilhamento de hidróxidos de cátions e demandam da presença de ânions interlamelares para atingirem a neutralidade.[15] Esse fenômeno ocorre
5 brucita (Mg(OH)2). Essas camadas são formadas por íons Mg2+ coordenados octaedricamente
com grupos hidroxilas. Essas estruturas tipo brucita compartilham arestas e formam camadas neutras. No entanto, certa quantidade de íons divalentes M2+ (Ca2+, Mg2+, Zn2+, Co2+, Ni2+,
Cu2+, Mn2+) pode ser substituída por íons trivalentes M3+ (Al3+, Cr3+, Fe3+, Co3+, Mn3+),
originando-se em uma lamela carregada positivamente. Com o propósito de estabilizar essa lamela deixando-a neutralizada, moléculas de água e ânions An- (CO
32-, OH-, F-, Cl-, SO42-)
são intercalados.[7,16,17]
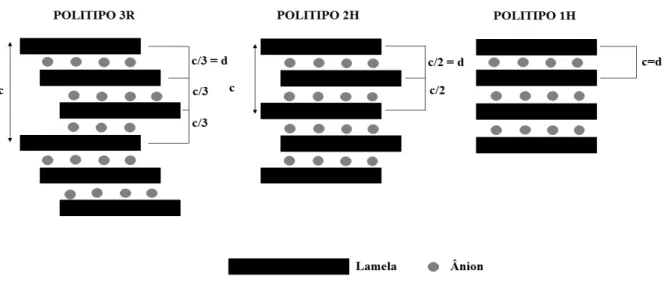
Os HDLs são classificados em dois tipos de sistemas cristalinos, os quais apresentam distintas formas de empilhamento das camadas lamelares: simetria romboédrica e simetria hexagonal.[7,18,19] Na simetria romboédrica, o parâmetro c da célula unitária equivale a três
camadas sucessivas, e neste caso, os átomos de uma camada coincidem com os átomos da terceira camada. Na simetria hexagonal, o parâmetro c corresponde a duas camadas sucessivas na célula unitária e os átomos de uma camada coincidem com os átomos da segunda camada na sequência.[19] Diante disso, os politipos referentes a essas simetrias de
empilhamento são denominados como politipos 3R e 2H, respectivamente. O politipo 3R apresenta o parâmetro c da célula unitária igual a três vezes o espaçamento basal e o politipo 2H apresenta o parâmetro c igual a duas vezes o espaçamento basal.[7]
Outro polítipo considerado é o 1H, o qual apresenta o parâmetro c igual ao espaçamento basal e simetria hexagonal. Em todos os casos citados, destaca-se que o espaçamento basal d corresponde a duas camadas lamelares e uma camada interlamelar.[7] A
Figura 1 expõe um esquema dos três politipos existentes para os HDLs.
Figura 1. Esquema representativo dos polítipos 3R, 2H e 1H para os hidróxidos duplos lamelares.
6 Para os HDLs naturais e sintéticos o politipo mais comum é o 3R, enquanto que os politipos 2H e 1H são relacionados ao estado de hidratação dos materiais.[7,20] Em condições
com baixa umidade relativa obtém-se HDLs com o politipo 3R, o qual apresenta o espaçamento basal igual à soma entre a espessura da lamela e o tamanho do ânion interlamelar. Em contrapartida, o espaçamento basal para os politipos 2H e 1H torna-se maior do que a soma entre a espessura da lamela com o tamanho do ânion interlamelar, atribuindo esse fato à presença de moléculas de água entre os ânions e as lamelas.[7]
A razão entre os cátions nos HDLs (MII/MIII) pode variar entre uma faixa de 1 a 6, o
que corresponde aos valores de x, na fórmula geral, variando em uma faixa de 0,20≤x≤0,33,
onde x representa a razão molar M3+/(M2+ + M3+).[14,20] Esta razão determina a densidade de
carga na lamela do HDL e pode intervir sobre propriedades estruturais e de troca iônica. Um aumento dessa razão implica redução de densidade de carga e da quantidade relativa de ânions, além disso, diminui a cristalinidade do material.[7,20]
A maioria dos HDLs estudados pela literatura envolve a produção de compostos constituídos de variados cátions divalentes, alumínio (Al3+) como cátion trivalente e como
ânion interlamelar, o carbonato (CO32–).[21,22,23,24] Entretanto, para um material ser hidróxido
duplo lamelar não é necessário que este seja constituído apenas por dois cátions metálicos. A síntese de sistemas utilizando misturas tanto de cátions divalentes quanto de cátions trivalentes é estudada com êxito.[7,20] Como exemplos, pesquisadores estudaram a síntese de
HDLs tipo Cu2+Mg2+/Mn3+[17], Ni2+Mg2+/Mn3+[17], Zn2+Cd2+/Cr3+[25] e Mg2+/Al3+Ga3+[26].
Nigadamanda[27] investigou a presença de um cátion IV em um HDL tipo Mg2+Al3+Ti4+ e
concluiu que a síntese foi possível, entretanto, uma deformidade da camada lamelar originou-se um HDL menos cristalino.[27]
A possibilidade de utilizar diversos cátions e ânions permitiu Coelho et al.[28] investigarem a interferência dos cátions Mg2+ e Mn2+ nos sistemas Co2+/Al3+ e Ni2+/Al3+,
respectivamente. Ambos os sistemas foram intercalados pelo ânion tereftalato (C6H4(COOH)2) e apresentavam diferentes teores de alumínio na estrutura. Os resultados
indicaram que foi possível a obtenção dos HDLs tipo Co2+Mg2+/Al e Ni2+Mn2+/Al através da
adição dos cátions divalentes e uma fração atômica de Al3+ de 0,5.[28]
Algumas pesquisas envolveram a síntese de HDLs do tipo hidrotalcita trocando somente um cátion divalente ou trivalente. Os pesquisadores Wan et al.[29] e Hudcová et al.[30]
analisaram a aplicação do HDL Mg2+/Fe3+ para remoção de fosfato e arsênio,
7 fosfato.[31] He et al.[32] utilizaram o ferro como cátion divalente, trabalhando com o HDL
Fe2+/Al3+ para remoção do cromo.[32] Lin et al.[33] estudaram o comportamento de um HDL
distinto, sem o uso dos cátions magnésio e alumínio na camada lamelar. Tal investigação demonstrou eficácia do sistema Co2+/Fe3+ para remoção de corantes aniônicos.[33]
Inúmeras espécies aniônicas podem ser intercaladas, como exemplo os haletos (Cl- e
F-), oxiânions (CO
32-, NO3-, SO42-), ânions complexos ([Fe(CN)6]4-), dentre outros.[7]
Juntamente com os ânions, moléculas de água estão presentes no domínio interlamelar (água de hidratação ou intrínsecas), nesse caso, as moléculas fazem parte da estrutura cristalina do HDL. As moléculas de água também podem estar presentes entre os cristalitos da estrutura (água adsorvida do ambiente ou extrínsecas), nessa situação, a quantidade das moléculas extrínsecas depende da umidade relativa da atmosfera.[7,20] A quantidade de água global em
HDLs é determinada como a soma de água nos domínios extrínsecos e intrínsecos, e a mesma pode ser determinada por análise termogravimétrica (ATG).[19,20]
3.1.2. Síntese dos HDLs
Existem diversos métodos para a síntese de HDLs, podendo ser classificados como métodos de síntese direta ou indireta. Dentre os métodos de síntese direta, destacam-se o método de coprecitação (sal-base),método do sal óxido e a síntese hidrotérmica.[7,15,34]Outros
métodos de síntese direta também são encontrados na literatura, tais como síntese eletroquímica, método sol-gel e hidrólise induzida, entretanto, são menos utilizados.[15,16,19] Já
nos métodos de síntese indireta que são realizados a partir de um HDL precursor, destacam-se os métodos de regeneração do precursor calcinado, troca iônica direta em solução, troca aniônica em meio ácido e substituição aniônica em fase dupla.[16,19] Estudos mostram que as
propriedades de cristalinidade e de superfície desses materiais são diretamente influenciadas pelo método e condições de síntese.[7] Os métodos via síntese direta por coprecipitação e via
síntese indireta por regeneração do precursor calcinado são os mais utilizados na literatura para preparação de HDLs e foram os métodos empregados no presente estudo.[16,27,35]
O método via síntese direta por coprecipitação apresenta duas variações dependendo das condições adotadas para controle do pH durante a precipitação: pH variável e pH constante.[15] A coprecipitação em pH variável fundamenta-se na adição de uma solução dos
8 A síntese por coprecipitação em pH constante se baseia em adicionar a solução dos sais dos cátions em uma solução contendo o ânion a ser intercalado, simultaneamente à adição de uma solução alcalina, a fim de manter o pH estável.[7] Crepaldi et al.[15] realizaram um
estudo comparativo entre os métodos de síntese citados, considerando o parâmetro pH em relação às características estruturais dos materiais obtidos.[15] Na perspectiva tecnológica, os
materiais sintetizados a pH constante apresentaram melhores resultados, embora o método a pH variável ter apresentado maior simplicidade de síntese. O fato de manter o pH constante acarretou em maior cristalinidade, menores partículas, maior área superficial e maior diâmetro médio de poros.[15]Além disso, tem-se outras vantagens como maior homogeneidade e pureza
da fase dos produtos obtidos.[10]Parâmetros de síntese, tais como concentração das soluções,
velocidade da adição das soluções, pH final da suspensão formada, grau de agitação e a temperatura da mistura devem ser monitorados.[7]
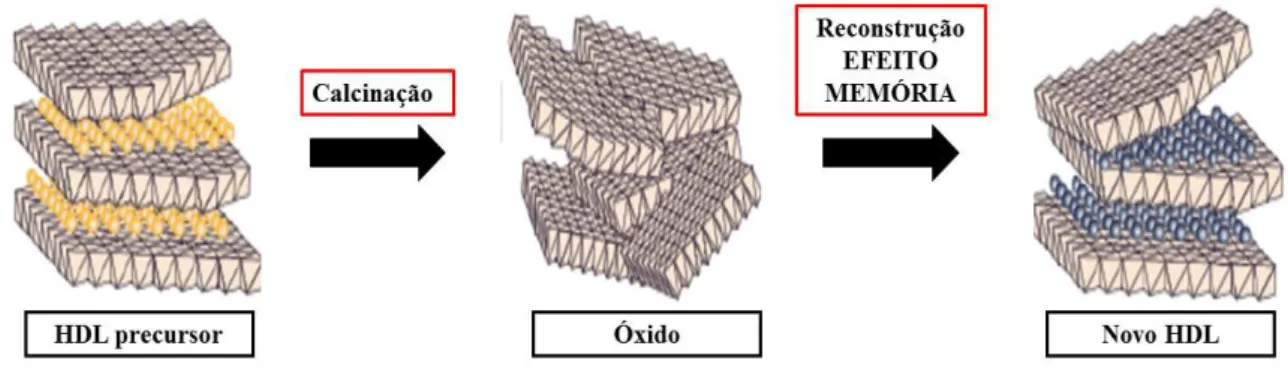
O método de síntese indireta via regeneração de um precursor calcinado envolve a remoção dos ânions hidratados interlamelares e dos grupos hidroxilas da estrutura do HDL para obtenção de um óxido misto.[36] Um HDL precursor é calcinado em uma temperatura de
aproximadamente 500°C. O óxido obtido entra em contato com uma solução de determinado ânion, regenera a sua estrutura lamelar e origina um novo HDL.[19] A capacidade de regeneração da estrutura lamelar é conhecida como “efeito memória”.[19,35] A Figura 2 ilustra como ocorre a regeneração do HDL através do “efeito memória”.
Figura 2. Representação esquemática do processo de regeneração do HDL –“Efeito memória”.
Fonte: Adaptado VIEIRA, 2009[19]
O método de regeneração do precursor calcinado está inteiramente vinculado à capacidade de troca iônica dos HDLs. Tal propriedade está relacionada com a razão MII/MIII,
9 estabilizar as camadas lamelares.[37] Diante disso, o HDL se formará mais facilmente quanto
maior for a capacidade de estabilização do ânion intercalado, portanto, o conhecimento dessa propriedade é muito importante. Alguns ânions foram classificados de acordo com Miyata[38]
seguindo a ordem de capacidade de estabilização da estrutura lamelar:[38]
CO32– > OH– > F– > Cl–> SO42– > Br– > NO3– > I–
Ao analisar a ordem de estabilização das camadas lamelares, nota-se que o ânion carbonato (CO32–) intercalado tornam as lamelas mais estáveis. Segundo Miyata[38], os ânions
divalentes apresentam maior seletividade quando comparados aos ânions monovalentes.[38] A
natureza dos ânions a serem intercalados para compensar a carga residual positiva das lamelas é quase ilimitada. No entanto, a obtenção de materiais puros e cristalinos para ânions diferentes do carbonato (CO32–) torna-se dificultada, já que durante a síntese o material pode
ser contaminado por esses ânions proveniente do CO2 atmosférico.[20]
HDLs podem captar ânions de soluções fundamentados em três mecanismos: adsorção, troca aniônica e por reconstrução de um precursor calcinado.[39] A adsorção acontece nas
superfícies entre as lamelas e deve ser praticada em HDLs intercalados com ânions que apresentam forte interação eletrostática com as lamelas para evitar trocas aniônicas, como por exemplo, o carbonato.[39] A troca aniônica ocorre quando os ânions intercalados no material
apresentam fraca interação eletrostática (Cl- e F-).[39] Neste caso, o grau de troca aniônica é
determinado pela densidade de carga e pela ordem de estabilização da estrutura lamelar, logo, depende do ânion substituinte e do ânion intercalado.[38,39] A remoção de ânions através de um
precursor calcinado se baseia no “efeito memória”. O HDL após ser calcinado entra em
contato com uma solução contendo os ânions de interesse e recupera a sua estrutura original. Certa quantidade de ânions é intercalada para manter a eletroneutralidade do material.[39]
Bernardo et al.[31] investigaram o uso do HDL Ca/Al para remoção do ânion fosfato (PO
43-)
por duas maneiras: via troca iônica e pelo precursor calcinado (“efeito memória”). A quantidade de remoção do ânion via troca iônica foi superior devido à diferença de área superficial dos materiais, entretanto, em ambas as rotas foram obtidos materiais cristalinos.[31]
3.1.3. Propriedades e aplicações dos HDLs
A grande capacidade de variação da composição dos HDLs, relacionada tanto a diferentes possibilidades de cátions di e trivalentes quanto de ânions a serem intercalados, atribui a esse grupo de materiais diferentes propriedades.[35]As propriedades como capacidade
10 aplicações para os HDLs, tais como catalisadores, adsorventes, aditivos para polímeros e farmacêuticas.[7,10,19]
A estabilidade térmica dos compostos tipo hidrotalcita pode ser investigada por análise termogravimétria (ATG) e análise térmica diferencial (ATD).[17,19]O comportamento térmico
desses materiais apresenta um padrão endotérmico e a decomposição ocorre em três etapas. Na primeira etapa acontece eliminação da água adsorvida até 100°C. A segunda etapa se caracteriza por perda de água interlamelar na faixa de 150-250°C e a terceira etapa refere-se à decomposição térmica dos grupos hidroxilas e ânions carbonato na faixa de 350-600°C, resultando em água e dióxido de carbono, respectivamente.[17,40] Acima de 400°C ocorre a
formação da fase MgO e a cristalização do espinélio (MgAl2O4) é detectada acima de
900°C.[17] A decomposição dos grupos hidroxilas pode ser um indício da estabilidade térmica
da estrutura das hidrotalcitas. Quando ocorre retardamento da desidroxilação supõe-se uma elevada estabilidade térmica.[40] A decomposição térmica de outros compostos do tipo
hidrotalcita contendo distintos cátions MII e MIII também é caracterizada por transições
endotérmicas. Essas transições dependem de alguns fatores, em particular a quantidade relativa dos cátions MII e MIII e o tipo de ânion.[17]
A capacidade de troca aniônica é de suma importância visto que pode ser aplicada para a síntese de novos compostos.[7] Essa propriedade torna-se maior quanto maior for a
densidade de carga do material. Além disso, deve se considerar a capacidade dos ânions de estabilizar a estrutura dos HDLs conforme a série de Miyata.[38]
Diante dessas propriedades, os HDLs se tornam aptos para diversas aplicações nas áreas de catálise, adsorção, eletroquímica, farmacêutica e médicas.[41] Os HDLs estão atraindo
atenção quando aplicados em catálise, uma vez que apresentam uma grande superfície básica.[7] As características de basicidade desses materiais permitem o seu uso com a
vantagem de que o número de sítios básicos podem ser ajustados de acordo com cada reação.[19,42] Diante disso, HDLs naturais, calcinados, funcionalizados e suportando outros
catalisadores estão sendo amplamente utilizados.[19] Em virtude da grande área superficial e
alta capacidade de troca aniônica, os HDLs também estão se destacando quando aplicados como sorventes e/ou adsorventes para a remoção de diversas espécies aniônicas no que tange o tratamento de efluentes industriais.[19]Além disso, a flexibilidade da zona interlamelar, a
11 Outras aplicações dos HDLs também são encontradas na literatura como farmacêuticas e eletroquímica. No campo farmacêutico, os HDLs geralmente são empregados como antiácido estomacal e como estabilizantes de compostos. No ramo da eletroquímica, a viabilidade desses materiais se valida pela possibilidade de preparo de HDLs com cátions eletroativos e intercalação de ânions com atividade eletroquímica.[7,19]
Diversas pesquisas[14,43,44] relatam o uso desses materiais no segmento de adsorção. A
remoção de oxiânions, tais como arsenato (AsO43-), carbonato (CO32-) e cromato (CrO42-), tem
recebido atenção de pesquisadores nos últimos anos por meio da adsorção em superfície e da troca aniônica.[36,44] Hudcová et al.[30] investigaram a sorção de arsenato a partir do HDL Mg/Fe e obteve-se até 99% de remoção do ânion em pH 5,5.[30] Demais estudos envolveram a
síntese de HDLs para remoção do ânion fosfato (PO43-): Wan et al.[29] investigaram o uso de
HDLs funcionalizados, enquanto que Bernardo et al.[31] sintetizou um HDL tipo Ca/Al.[29,31]
Existem outras importantes aplicações das hidrotalcitas envolvendo a remoção de íons de efluentes, remoção de metais pesados e resíduos radioativos.[40] Numerosos trabalhos
envolveram o estudo da remoção de outros íons via HDL: remoção de boro por meio do sistema Mg/Al-NO3[45], adsorção do cátion cádmio (Cd2+) através de HDLs
funcionalizados[24,46], remoção de cromo (Cr6+) empregando distintos compostos do tipo
hidrotalcita.[32,44,47] Bo et al.[47] investigaram a remoção dos cátions radioativos Sr2+ e Ba2+
através da hidrotalcita natural e calcinada, os resultados foram positivos para a remoção com hidrotalcita calcinada.[47] Kameda e colaboradores estudaram a remoção do ânion fluoreto
com detalhes.[14,45,48] Os estudos mostraram a remoção de tal ânion a partir de troca aniônica e
da regeneração de um precursor calcinado (“efeito memória”).[14,45,48] Os resultados exibiram
elevada capacidade para remoção de fluoreto e evidenciou a possibilidade de reutilização da hidrotalcita calcinada e dos materiais Mg/Al-NO3 e Mg/Al-Cl também calcinados.[14,48]
A habilidade de recuperação da estrutura lamelar fornece aos HDLs a possibilidade de reciclagem e reutilização, sendo essa uma característica importante nas aplicações industriais. O uso de adsorventes no tratamento de efluentes industriais depende da capacidade de adsorção, da capacidade de regeneração e quantidade de reutilização, o que viabiliza os custos do processo. De forma geral, os HDLs possuem de quatro a cinco ciclos de regeneração-reutilização com níveis de remoções viáveis e adequados.[46] Após sucessivos ciclos, ocorre
12
3.2. Manganês
O manganês (Mn) é o 5° metal e o 12° elemento químico mais abundante na natureza, está largamente distribuído na crosta terrestre, tanto no solo quanto na água e em materiais biológicos.[3,49,50] Seu nome é derivado do latim magnes, que significa ímã, devido às
propriedades magnéticas do seu óxido.[51] O manganês pode ser obtido a partir de alguns
minerais, sendo os principais o óxido MnO2 (pirolusita), que apresenta maior importância
comercial, os óxidos Mn3O4 e Mn2O3, o oxido-hidróxido MnOOH (manganita), o carbonato
MnCO3 (rodocrosita) e o silicato MnSiO3 (rodonita).[49] Em 2013, o Brasil ocupou o quinto
lugar da produção de minério de manganês (7,2% da produção mundial).[52] As principais
reservas brasileiras de manganês se encontram em Minas Gerais (87%), Mato Grosso do Sul (6,5%) e Pará (4,3%).[53]São diversas as aplicações industriais do manganês, porém, em torno
de 90% da produção mundial é destinada à fabricação de ligas ferro-manganês objetivando a produção de aço.[54] Nesse segmento, o manganês tem desempenhado um papel fundamental,
já que é o quarto metal mais utilizado no mundo e está presente no aço empregado em automóveis e na construção civil.[3]
O manganês é um elemento essencial e quantidades adequadas do íon estão presentes no corpo humano sendo dispensável uma suplementação.[1,4]O manganês atua como cofator
de diversas enzimas e é essencial na síntese do colesterol e da dopamina (neurotransmissor).[49] Já a deficiência do manganês é relativamente rara e, quando é
diagnosticada, podem-se notar mudanças no sistema reprodutivo e no metabolismo de lipídeos e carboidratos, além de perda de peso e fadiga.[1,49] Por outro lado, em elevadas
concentrações, o manganês pode ser tóxico e capaz de provocar distúrbios no sistema neurológico.[1,4]
Os seres humanos se expõem ao manganês através da ingestão de alimentos ricos em manganês, sabe-se que os alimentos são a principal fonte de manganês para os seres humanos.[55] Entretanto, a contaminação pelo metal pode ocorrer por meio da exposição,
principalmente via inalação de fumos ou poeiras provenientes da mineração e da indústria siderúrgica, onde envolvem elevados graus de exposição.[50] Nesses casos, além de os
trabalhadores, as populações que residem em torno das indústrias também estão sujeitas a altos níveis de exposição.[3]
A intoxicação causada pelo excesso de manganês no corpo afeta principalmente o cérebro.[3,4,56] O sistema nervoso central pode ser afetado causando diversos danos
13 Parkinson irreversível, a qual envolve tremores, rigidez da musculatura e lentidão de movimentos.[4,50]O excesso de manganês também pode causar irritações nas vias respiratórias
e inflamação nos pulmões, sendo associado à tosse e bronquite.[4,50]
O manganês é tóxico quando em excesso, logo, com tal característica precisa ser removido para se adequar aos padrões permitidos pela legislação vigente.[57] Considerando
essas decorrências, a Resolução CONAMA nº. 430/2011, que dispõe sobre as condições e padrões de lançamento de efluentes, estabelece que o padrão de lançamento de efluentes seja de 1,0 mg/L de manganês dissolvido.[5] Segundo a Resolução CONAMA n°. 357 de 17 março
de 2005, que dispõe sobre a classificação dos corpos de água e diretrizes ambientais para seu enquadramento, é estabelecido que para águas de classe II a concentração máxima permitida é de 0,1 mg/L de manganês dissolvido. Águas de classe II são águas que podem ser destinadas ao abastecimento para consumo humano após tratamento convencional. Essas águas são destinadas à proteção das comunidades aquáticas, à recreação de contato primário (natação, esqui aquático e mergulho), à irrigação de hortaliças, plantas frutíferas e de parques, jardins, campos de esporte e lazer, à aquicultura e às atividades de pesca.[58]
Contudo, o manganês é um elemento de difícil remoção de soluções devido a sua solubilidade em condições neutras e ácidas.[59] Quando comparado a outros metais, o
manganês apresenta em solução uma química complexa. A precipitação não ocorre pelo simples ajuste do pH, assim, a sua remoção de efluentes industriais torna-se dificultada.[51]
Nos últimos anos, diferentes processos para remoção de manganês de efluentes industriais têm sido estudados. Em virtude disso, os métodos para remoção e recuperação de manganês com grande destaque são a precipitação por hidróxido, a precipitação por carbonato e a precipitação oxidativa.[57]
Na oxidação do Mn (II) para Mn (IV) forma-se dióxido de manganês (MnO2), o qual é
insolúvel e de fácil remoção.[51]Essa oxidação pode ser feita direta pelo ar e O
2, contudo, a
cinética desse processo é um fator crítico para a sua aplicação implicando em um processo lento quando comparado a outros possíveis métodos. A oxidação feita aplicando somente o O2
se apresenta como um processo mais rápido, porém, o seu custo é mais elevado.[57] A
oxidação do manganês também pode ser feita com o uso de oxidantes fortes, tais como permanganato de potássio, cloro, hipoclorito ou ozônio. Entretanto, essa técnica tem como desvantagem o alto custo e a necessidade de métodos adequados para a manipulação dos reagentes.[60] O manganês também pode ser oxidado na presença de bases como hidróxido de
14 A precipitação por hidróxido (NaOH) e por carbonato (Na2CO3) são métodos para
remoção de manganês. Zhang et al.[57] relataram que tais procedimentos apresentam baixa
seletividade para Mn2+ e assim, não são recomendados para tratamento de efluentes com
baixos teores de manganês. Efluentes que apresentam baixos teores de manganês podem ser tratados por precipitação oxidativa comSO2/ar, a qual apresenta cinética e pH favoráveis para
tal processo.[57] Para níveis elevados do metal, esse método torna-se inadequado, logo, para
obter uma melhor eficácia, a precipitação oxidativa com SO2/ar deve ser associada a outro
método de remoção de manganês.[57] Barolli et al.[62] investigaram a oxidação do manganês a
partir do ozônio. A remoção consistiu na oxidação direta do metal solúvel para estados de oxidação insolúveis em água. Tal procedimento atingiu eficiência de até 99% de remoção.[62]
Outro método conhecido para remoção de manganês de soluções é a troca iônica, a qual é empregada para remoção de quantidades pequenas do manganês e envolve o uso de resinas sintéticas. Nesse processo, um íon adsorvido na resina é trocado pelos íons indesejáveis presentes na água. O cuidado desse processo está no controle da concentração do manganês para impedir sua oxidação e evitar problemas nas resinas.[51]
Zhang et al.[57] fizeram um estudo sobre os processos de remoção e recuperação de manganês de processos hidrometalúrgicos. Os autores mostraram a possibilidade de remoção de manganês de licores de lixiviação por meio de extração por solvente. Neste caso, o manganês foi removido e recuperado de outros metais (níquel, cobalto e magnésio).[57] Zhang
et al.[57] mostraram também o emprego de Sistemas Sinérgicos para remoção do cátion manganês. Esse processo se apresentou mais seletivo ao ser comparado com extração por solvente, entretanto, o uso de solventes caros limitaram a sua aplicação.[57]
Nas indústrias mineradora e metalúrgica, o manganês é considerado como um dos principais contaminantes dos efluentes líquidos. Sua ocorrência tem aumentado de forma expressiva e, geralmente, sua concentração está acima do permitido pela legislação para descarte no meio ambiente.[63] Apesar de existirem várias técnicas de tratamento empregadas
para tratar as águas residuais (precipitação química, permuta iônica e filtração), essas nem sempre são acessíveis do ponto de vista financeiro, prático e sob a perspectiva de aplicação em grande escala, tornando-os economicamente inviáveis. Ainda, esses métodos apresentam geração de subprodutos e ineficácia para baixas concentrações.[64] Dessa maneira, a metodologia proposta utilizando os HDLs como “carregadores” de cátions Mn2+ surge como
15
3.3. Fluoreto
O flúor (F2) é um gás e, usualmente, não se encontra na natureza em sua forma
elementar devido à sua alta reatividade e eletronegatividade, que faz com que seja encontrado somente em sua forma iônica: fluoreto (F-).[65,66] O fluoreto é um ânion caracterizado por
pequeno raio e apresenta facilidade para formar diferentes compostos orgânicos e inorgânicos no solo, rochas, ar, plantas e animais.[65]
O fluoreto pode ser disposto ao meio ambiente por fontes naturais, onde é liberado por meio do intemperismo dos minerais e das emissões vulcânicas, e por atividades antropogênicas, como a combustão do carvão, produção de pesticidas, fluoretação de águas e através de processos industriais.[66] Em diversos países, a elevada concentração de fluoreto é
resultado de descargas de águas residuais contaminadas pelo ânion.[65] Exemplos deindústrias
que liberam efluentes com alto teor de fluoreto são indústrias metalúrgicas, eletrônicas, processamento de vidros, cerâmicas, indústrias de produção de fosfato, fertilizantes e refinarias de petróleo.[65,67] Em alguns casos, a liberação de fluoreto pode atingir até 3000
mg/L.[67]
O homem se expõe ao fluoreto através do consumo de água potável, alimentos e produtos odontológicos.[68] Em locais com ocorrência de fluoreto, concentrações elevadas do
ânion na água e no solo são percebidas quando a rocha local é rica em fluoreto ou quando há descargas antropogênicas do ânion. Esse fato pode contribuir para que a água potável torne-se uma fonte de exposição humana com extrema relevância.[66,68]
O fluoreto tem efeitos tanto benéficos quanto prejudiciais à saúde humana. A ingestão em concentrações adequadas traz benefícios à saúde bucal do homem.[68] O principal
benefício do fluoreto é o efeito anticárie, que depende de sua presença permanente no meio ambiente bucal (saliva, placa bacteriana dentária e superfície do esmalte), sendo garantido com a presença de fluoreto na água e sal de cozinha, além de creme dental e enxaguantes bucais.[6]
Apesar de ser um mineral essencial, o excesso da ingestão de flúor pode causar efeitos adversos, como por exemplo, a fluorose dentária.[68] A fluorose dentária se define como uma
alteração no desenvolvimento do esmalte, caracterizada por hipomineralização e maior porosidade da região abaixo da superfície do esmalte dentário.[6] A fluorose é decorrência da
ingestão crônica de flúor durante o desenvolvimento dental. Os sintomas são proporcionais à quantidade de fluoreto ingerida.[69,70,71] Casos de fluorose óssea também são relatados, em que
16 ânion em longo prazo. Neste caso, ocorre alteração da estrutura óssea causando dores nos ossos e articulações.[66] Assim, a Portaria do Ministério da Saúde n°. 2914/2011 e a
Organização Mundial da Saúde (OMS) estabelecem que o limite permitido de fluoreto na água para consumo humano seja de 1,5 mg/L.[65,72]
A remoção de fluoreto de soluções pode acontecer por coagulação e precipitação, troca iônica, técnicas com membranas e tratamentos eletroquímicos.[8,9,65] Habuda-Stanic et al.[65]
enumeraram vantagens e desvantagens para os métodos de remoção de fluoreto citados. A técnica de coagulação/precipitação implica o uso de sais de cálcio, formando o precipitado fluoreto de cálcio (CaF2), o qual apresenta baixa solubilidade em água.[73] Nesse caso, sais de
alumínio também podem ser usados com a mesma finalidade.[8] Essa técnica apresenta alta
eficiência, contudo, é um método caro, dependente do pH e provoca a formação de lamas concentradas de sais de fluoreto.[65] Habuda-Stanic et al.[65] relataram que as técnicas com
membranas também exibem elevada eficiência, entretanto, apresentam alto custo de manutenção e produção de águas residuárias tóxicas.[65]
Os tratamentos eletroquímicos apresentam grande eficácia e alta seletividade, porém, o custo de instalação e manutenção das membranas é elevado.[66] Habuda- Stanic et al.[65]
também mencionaram a técnica de troca iônica utilizando resina de troca aniônica e relatou que a mesma apresenta um alto custo e vulnerabilidade a interferentes, apesar de apresentar alta eficiência.[65] Por fim, de acordo com Habuda-Stanic et al.[65],o método de adsorção
apresenta baixo custo, operação simples e se mostra como um processo viável e eficaz, já que o adsorvente usado pode agregar altas taxas de remoção com baixo custo de aplicação.[65,73]
Alguns estudos[8,9,14,73] foram realizados a fim de analisar a eficiência de HDLs para a
remoção de fluoreto por meio de adsorção. Os HDLs calcinados têm sido promitentes nesse âmbito por apresentarem a capacidade de regenerar a sua estrutura lamelar depois da adsorção de ânions (“efeito memória”).[8]Zhang et al.[9] estudaram a capacidade de um HDL composto
17 mg/L para 6,3 mg/L. Nesse mesmo estudo, Kameda et al.[10] relataram a eficiência da reciclagem do óxido Mg-Al.[14]
Batistella et al.[73] apresentaram um estudo de um HDL Mg/Al-CO3 ativado com
ácidos e verificaram a eficiência do material em remover fluoreto de soluções. Os resultados apresentaram alta capacidade de adsorção do fluoreto em função da quantidade de material utilizado (303,54 mg F-/g HDL).[73] Kameda et al.[48] se prevaleceram de outra possibilidade
de remoção e estudaram a capacidade de HDLs tipo Mg/Al-NO3 e Mg/Al-Cl de remover
fluoreto de soluções a partir da troca aniônica. Os resultados apresentaram grande eficiência de remoção ao utilizar esse processo, onde a concentração da solução de fluoreto reduziu de 100 mg/L para 5,2 mg/L (94,8%) ao utilizar o HDL Mg/Al-NO3 e de 100 mg/L para 3,3 mg/L
(96,7%) ao utilizar o HDL Mg/Al-Cl.[48]
Os HDLs mostraram grande poder de remoção de fluoreto e dessa maneira, estão atraindo atenção como materiais denominados eco-friendly.[6]O emprego de uma metodologia que emprega o “efeito memória” é uma opção promissora, já que pode ser executável a partir da reutilização de um HDL.
3.4. Adsorção em HDLs
A adsorção se define como um fenômeno físico-químico de superfície, onde existe uma concentração preferencial de um componente de um sistema em uma interface. A adsorção pode ocorrer em diferentes tipos de interface: gás-líquido, sólido-líquido, líquido-vapor e líquido-líquido.[74] O componente que adsorve é denominado como adsorvente,
enquanto que o componente adsorvido é denominado como adsorvato.[75] A adsorção pode ser
classificada como física ou química. A adsorção física (fisiossorção) decorre-se por forças de van der Waals entre as moléculas do adsorvato e o adsorvente. Enquanto que a adsorção química se fundamenta por ligações químicas entre o adsorvato e o adsorvente, sendo, geralmente, covalentes.[35,75]
Como relatado, vários trabalhos abrangem o uso dos HDLs com adsorção, os quais descrevem a remoção de ânions de soluções.[14,30,39]Geralmente, os processos de adsorção são
exotérmicos e assim, o desempenho do processo diminui com o aumento da temperatura. A uma temperatura constante, a quantidade adsorvida aumenta com a concentração do adsorvato (em solução ou em fase aquosa).[35,75] Além da temperatura, outros fatores também interferem
18
3.4.1. Isotermas de adsorção
O estudo experimental da adsorção em interfaces sólido-líquido envolve a medida da concentração do soluto na solução após a adsorção. O método usual para avaliar o mecanismo de adsorção é através da isoterma de adsorção.[74] Aisoterma de adsorção é adquirida a partir
do contato da solução do adsorvato com diferentes massas de adsorvente ou a partir da variação da concentração inicial do adsorvato em contato com massas iguais de adsorvente.[75]
Os gráficos obtidos são as isotermas de adsorção e descrevem a quantidade de soluto adsorvida (qe) em função da concentração do adsorvato no equilíbrio termodinâmico (Ce).[20] O termo “isoterma” relaciona-se com o fato de ser temperatura constante durante o processo de adsorção.[76]
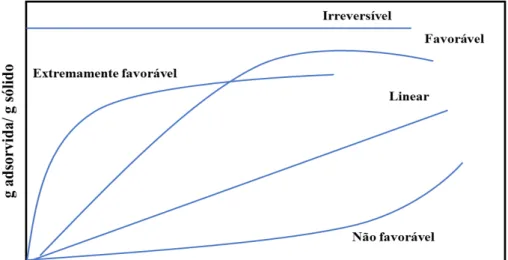
O perfil da curva da isoterma permite obter informações sobre o processo de adsorção.[75] Conforme apresenta a Figura 3, quando a quantidade adsorvida é proporcional à
concentração do fluido, a isoterma é linear (cruza a origem).[75] Normalmente, as isotermas
lineares não representam precisamente os processos reais, porém, são usadas devido a sua simplicidade.[76] As isotermas convexas (concavidade para baixo) mostram que grandes
quantidades adsorvidas podem ser obtidas com baixas concentrações de adsorvente, logo, são consideradas favoráveis.[75] Para a isoterma irreversível, entende-se que o adsorvato e o
adsorvente apresentam uma interação muito forte, logo, a quantidade adsorvida é independente da concentração de adsorvente. Este é o caso limite de uma isoterma favorável.[35,75,76] Por outro lado, as isotermas côncavas (concavidade para cima) são raras e
denominadas desfavoráveis, uma vez que a quantidade de soluto adsorvida é pequena e se eleva para concentrações elevadas de soluto em solução.[35,75]
Figura 3. Tipos de isotermas de adsorção.
19 A análise dos resultados experimentais pode ser feita a partir de modelos de isoterma de adsorção. Os modelos de isotermas mais considerados em trabalhos que envolvem hidróxidos duplos lamelares como adsorventes são o Modelo de Langmuir e o Modelo de Freundlich.[21,36,75] O modelo de Langmuir apresenta adsorção localizada e considera um
número finito de sítios energeticamente equivalentes. Esses sítios são isolados e uniformes, e em consequência dessas características, as moléculas de adsorvato não têm preferência por um determinado sítio.[20,35,76] Neste contexto, a adsorção é interrompida no instante em que
todos os sítios estão preenchidos resultando em uma única camada do adsorvato sobre o adsorvente, assumindo a formação de uma monocamada.[20,77] A equação do modelo de
Langmuir está representada na Equação 3.2 e a fórmula linearizada se encontra na Equação 3.3:
𝐪 =
𝐪 á𝐱 𝐂𝐞+ 𝐂𝐞 ,
Equação 3.2
𝒒
=
𝒒𝒎á𝒙+
𝒒𝒎á𝒙𝑪 , Equação 3.3onde q representa a quantidade de soluto adsorvido por grama de adsorvente no equilíbrio (mg/g), qmax representa a capacidade máxima de adsorção (mg/g), KL representa a constante de
interação adsorvato/adsorvente (L/mg) e Ce representa a concentração do adsorvato no equilíbrio (mg/L).[77] Ao considerar a concentração do adsorvato, compreende-se que se essa
concentração for muito baixa, a quantidade adsorvida aumenta linearmente com o aumento desta concentração. Em contrapartida, se a concentração for elevada, a quantidade adsorvida atinge a saturação, resultando no preenchimento completo da superfície de adsorção com as moléculas do adsorvato.[35]
O modelo de Freundlich pode ser aplicado em sistemas não ideais e apresenta uma descrição adequada de adsorção em multicamadas e em superfícies heterogêneas. As superfícies apresentam sítios com diferentes potenciais de adsorção e se descrevem como heterogêneas por terem diferentes grupos funcionais e interações adsorvato/adsorvente distintas.[35,77]Os diversos sítios de adsorção existentes apresentam diferentes energias, como
consequência, a equação da isoterma de Freundlich emprega uma distribuição exponencial.[35,77]
A equação assume que à medida que a concentração de adsorvato aumenta na fase líquida, a sua concentração também aumenta na superfície do adsorvente.[35,77] À medida que
20 heterogeneidade da superfície e resulta em uma aplicação em superfícies não uniformes.[77]A
equação do modelo de Freundlich é uma expressão empírica e está expressa na Equação 3.4 e sua forma linearizada exposta na Equação 3.5:[44]
q
e=K
FC
e1/n , Equação 3.4
Log q
e= log K
F+
1n
log C
e , Equação 3.5onde qe representa a quantidade de soluto adsorvido na fase sólida (mg/g), Ce representa a
concentração de equilíbrio do adsorvato em solução (mg/L), 1/n é uma constante relacionada à heterogeneidade da superfície e KF é a constante de capacidade de adsorção de Freundlich
[(mg1-(1/n) (g-1) (L1/n)].[77] É importante salientar que tal modelo não estabelece condições para
que haja a formação de uma monocamada completa à medida que Ce aumenta.
3.4.2. Cinética de adsorção
Os dados referentes à cinética de adsorção são fundamentais para selecionar o tempo de equilíbrio que favorece a remoção do adsorvato.[44] Portanto, a cinética de adsorção
representa a taxa de remoção do adsorvato na fase fluída em relação ao tempo.[76] A
velocidade de adsorção do adsorvato pode ser afetada pela temperatura, pH, força iônica, concentração inicial do adsorvato, agitação, tamanho das partículas e distribuição do tamanho dos poros.[76] Alguns modelos lineares são indicados para investigação do mecanismo que
controla o processo de adsorção (exemplos: reação química, transferência de massa e controle da difusão), entretanto, os mais utilizados são os modelos de pseudoprimeira ordem e pseudosegunda ordem.[76]
O modelo de pseudoprimeira ordem é fundamentado na equação de Lagergren e apresenta uma análise simples da capacidade dos sólidos de remoção.[76] A equação de
Lagergren é cabível somente em estágios inicias da adsorção, consequentemente, não fornece uma descrição para a faixa de tempo de contato integral.[35] Nesse modelo de cinética, a
adsorção é dependente de uma dada constante (K1), do tempo (t) e da quantidade de adsorção
no equilíbrio (qe).[35]Diante disso, a equação do modelo de pseudoprimeira ordem é dada pela
Equação 3.6 e sua forma linearizada está representada na Equação 3.7:
𝒒𝒕
𝒕