PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA
Cassiano Batesttin Costa
Propriedades Fotofísicas da Hidróxido Ftalocianina de Alumínio
em diferentes meios
Cassiano Batesttin Costa
Propriedades Fotofísicas da Hidróxido Ftalocianina de Alumínio
em diferentes meios
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências do Departamento de Física da Universidade Federal de Ouro Preto como requisito para obtenção do título de Mestre em Ciências.
Orientador: Prof. Dr. Thiago Cazati Co-Orientadora: Prof.ª Drª. Bruna Bueno Postacchini
AGRADECIMENTOS
Primeiramente agradeço a Deus por tudo, por mais esta etapa concluída na minha vida. Agradeço ao professor Thiago pela oportunidade, pelos ensinamentos e dedicação para me ajudar a concluir esta etapa.
Agradeço a professora Bruna pelos ensinamentos, pela paciência, pela oportunidade e por disponibilizar boa parte do seu tempo para me ajudar a chegar ao fim de mais esta jornada.
Agradeço a professora Vanessa pelos ensinamentos e por ter disponibilizado o material e o Laboratório de Pesquisa Tecnologia Farmacêutica Nanobiotecnologia para o desenvolvimento de parte da pesquisa. E em especial agradeço a Gwenaelle e a Mônica por toda a ajuda e explicações.
Agradeço a técnica Patrícia do CIPHARMA Laboratório Multiusuário no Departamento de Farmácia pela ajuda e explicações.
Agradeço aos professores e técnicos do laboratório do Grupo de Polímeros “Prof. Bernhard Gross” no Instituto de Física de São Carlos da Universidade de São Paulo
Agradeço a UFOP, pelo apoio financeiro.
Agradeço a Mariana, secretária do programa FIMAT por toda ajuda.
Agradeço o companheirismo e amizade dos colegas do Laboratório de Materiais Optoeletrônicos e do Laboratório de Fotofísica Molecular: Ana Cláudia, Ana Carolina, Jeilce, Junnia, Sérgio, Silvia e Tomás.
Agradeço aos amigos e companheiro de sala: Adriana, Anderson, Brillian, Carlos, Genilson, Harley, João, Juliana, Kennedy, Naiane e Tiago.
Agradeço aos irmãos da república Canaan por terem participado de mais esta jornada. Agradeço as amigas da república Feitiça por estarem presentes em mais esta etapa. Agradeço as amigas da república Nascente por terem me acompanhado em mais esta etapa.
Agradeço a Karaokê pela amizade e por ter participado desta etapa.
Agradeço a Mafê pela amizade, pelo carinho e por ter tornado está etapa melhor e mais agradável.
RESUMO
A terapia fotodinâmica (TFD) é um tratamento medicinal que apresenta alta seletividade terapêutica, e consequentemente vem apresentando excelentes resultados clínicos no tratamento de certos tipos de câncer. Este tratamento consiste em eliminar o tecido cancerígeno através dos produtos fototóxicos (espécies reativas de oxigênio) gerados por um fotossensibilizador ao interagir com a luz. O fotossensibilizador é uma molécula orgânica com capacidade de absorver luz em faixas especificas do espectro eletromagnético na região do visível, tal como as Hidróxido Ftalocianina de Alumínio (AlOHPc) estudada neste trabalho, a qual tem duas faixas de absorção, sendo estas entre 300-400 nm e entre 600-750 nm. O objetivo deste trabalho foi caracterizar as propriedades fotofísicas da AlOHPc e verificar o comportamento destas em diferentes meios, os quais foram: em diferentes solventes (etanol e sulfóxido de dimetilo (DMSO)), em diferentes concentrações (0,04-363,63 mol L-1), em diferentes proporções volumétricas de etanol/água destilada (v/v) e quando encapsulada em nanoesferas de ácido poliláctico (PLA). Neste estudo foram utilizadas as técnicas de caracterização de absorção óptica, de fluorescência estacionária, de fluorescência resolvida no tempo e de espalhamento de luz ressonante, e foram calculados os valores de eficiência quântica de fluorescência, da constante de Stern-Volmer e do coeficiente de absorção molar da AlOHPc. A compreensão das propriedades fotofísicas da AlOHPc em diferentes meios busca aprimorar a utilização desta molécula como fotossensibilizador no tratamento por TFD.
ABSTRACT
Photodynamic therapy (PDT) is a medical treatment that exhibits high therapeutic selectivity and consequently has shown excellent clinical results in treating of certain types of cancer. This treatment consists in removing the cancerous tissue through of phototoxic products (reactive oxygen species) generated by a photosensitizer to interact with the light. The photosensitizer is an organic molecule with capacity of absorbing light at specific bands of the electromagnetic spectrum in the visible region, such as Aluminum Hydroxide
Phthalocyanine (AlOHPc) studied this work, which exhibits two main absorption bands, the so called Soret band (300-400 nm) and the Q band (600-750 nm). This study evaluated the photophysical properties behavior of AlOHPc at different solvents (ethanol and dimethyl sulfoxide (DMSO)), different concentrations (0,04-363,63 mol L-1), different volumetric ratios of ethanol/distilled water (v/v) and encapsulated in nanospheres of polyacid lactic (PLA). The AlOHPc in solution were characterized by optical absorption, stationary fluorescence, time resolved fluorescence and by resonant light scattering (RLS). The fluorescence quantum efficiency, the Stern-Volmer constant and the molar absorption coefficient for AlOHPc were obtained. The studying of the photophysical properties of AlOHPc in different environments are relevant to understanding the behavior and use of
Aluminum Hydroxide Phthalocyanine as a photosensitizer for clinical application in photodynamic therapy (PDT) treatment.
LISTA DE FIGURAS
Figura 1 – Diagrama de Jablonski representando os processos monomoleculares que podem ocorrer após interação da molécula com a luz. S0 é o estado fundamental, S1 e S2 é o primeiro e o segundo estados excitados singletos, respectivamente. T1 e T2 é o primeiro e segundo estados excitados tripletos. Absorção de radiação eletromagnética (setas em vermelho). Processos radiativos por fluorescência ou fosforescência (setas em azul) e por processos não radiativos (setas ondulada e tracejada)... 6 Figura 2 – Representação da orientação do spin no processo de excitação. (a) Spins com
diferente multiplicidade e mesma energia, caracterizando o estado fundamental. (b) Spins com diferente multiplicidade e com energias diferentes, caracterizando o estado excitado singleto. (c) Spins com multiplicidade iguais e com energias diferentes, caracterizando o estado excitado tripleto ... 7 Figura 3 – Teorema de Föster, representação da transferência de energia ressonante mostrando
que os elétrons 1 (verde) e 2 (amarelo) permanecem no doador e no receptor, respectivamente, mesmo após a transferência de energia. Fonte7 ... 9 Figura 4 – Representação do teorema de Dexter. Múltipla troca no processo de transferência
de energia de Dexter, os elétrons 1 (verde) e 2 (amarelo) trocam de molécula. Fonte7 ... 10 Figura 5 – Representação dos processos de supressão estática. Fonte9, imagem alterada ... 11 Figura 6 – Comparação do processo de dissipação radiativa por fluorescência: em F moléculas
diluídas em solvente com baixo momento dipolar (), em F` mesma moléculas
diluídas em solvente com alto momento dipolar (*). Fonte9 ... 13 Figura 7 – Representação da geometria dos tipos de agregados: (a) agregado H, (b) agregado J
e (c) agregado HJ ... 15 Figura 8 – Diagrama de energia para dímeros com diferentes arranjos geométricos dos dipolos
Figura 10 – Espectro de absorção característico da ftalocianina sem metal central (linha preta) e da ftalocianina com metal central (linha vermelha) ... 17 Figura 11 – Representação da profundidade de penetração da radiação eletromagnética na
região do visível na pele humana. Fonte34, imagem modificada ... 19 Figura 12 – Representação do diagrama de Jablonski após excitação do fotossensibilizador (S0
→ S1), com cruzamento intersistemas entre o estado excitado singleto para o estado excitado tripleto do fotossensibilizador (S1 → T1). Reação do tipo I e representação da formação de oxigênio singleto (¹O2) na reação tipo II. Fonte34, imagem modificada ... 20 Figura 13 – Representação esquemática de nanocápsulas e nanoesferas poliméricas: (a)
fotossensibilizador dissolvido no núcleo oleoso da nanocápsula; (b) fotossensibilizador adsorvido à parede polimérica da nanocápsula; (c) fotossensibilizador retido na matriz polimérica da nanoesfera; (d) fotossensibilizador adsorvido ou disperso na matriz polimérica da nanoesfera. FonteErro! Indicador não definido., imagem alterada ... 22 Figura 14 – (a) Espectrofotômetro da Hitachi modelo Double Beam U-2900, localizado no
Grupo de Polímeros “Prof. Bernhard Gross” no Instituto de Física de São Carlos da Universidade de São Paulo. (b) Representação do arranjo instrumental do espectrofotômetro da Hitachi modelo Double Beam U-2900. Fonte, imagem modificada ... 25 Figura 15 – (a) Espectrofotômetro modular da Ocean Optics modelo Red Tide USB650,
localizado no Laboratório de Fotofísica Molecular no Departamento de Física da Universidade Federal de Ouro Preto. (b) Representação do sistema de detecção do espectrofotômetro modular Ocean Optics Red Tide USB650. Fonte... 26 Figura 16 – Espectrofluorímetro da Shimadzu modelo RF-5301PC, localizado no Laboratório
de Fotofísica Molecular no Departamento de Física da Universidade Federal de Ouro Preto ... 27 Figura 17 – Representação do espectrofluorímetro ... 28 Figura 18 – Espectrômetro modular de fluorescência da Picoquant modelo Fluotime 200,
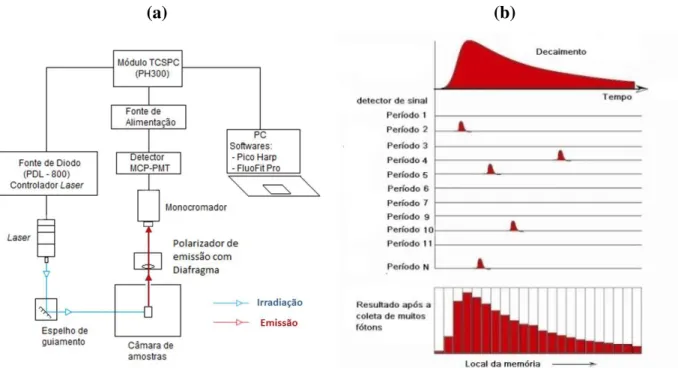
localizado no Laboratório de Fotofísica Molecular, do Departamento de Física da Universidade Federal de Ouro Preto... 31 Figura 19 – (a) Arranjo experimental para medidas de tempo de vida. (b) Histograma
Figura 20 – Curvas características obtidas pela técnica de TCSPC e ajuste utilizando o software FluoFit®. Curva em azul, decaimento da fluorescência. Curva em vermelho, função resposta do lazer. Abaixo em azul, resíduo do ajuste e no canto superior direto qualidade do ajuste (2) ... 33 Figura 21 – Estrutura química da hidróxido ftalocianina de alumínio ... 34 Figura 22 – Representação do método de deposição interfacial utilizado na preparação de
nanoesferas de PLA contendo AlOHPc ... 37 Figura 23 – Comparação dos espectros normalizado de absorção e de fluorescência (excitação
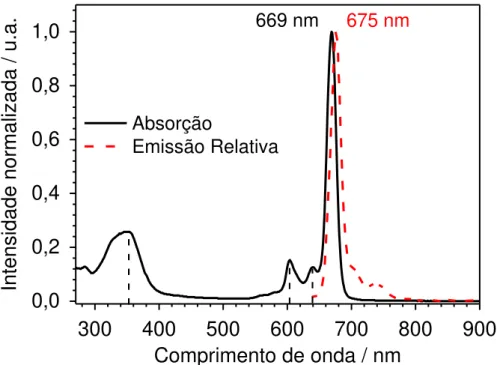
em 636 nm) da AlOHPc em solvente etanol ... 40 Figura 24 – Comparação dos espectros normalizado de absorção e de fluorescência (excitação
com 636 nm) da AlOHPc em solvente DMSO ... 41 Figura 25 – Comparação do perfil e intensidade dos espectros: (a) de absorção e (b) de
fluorescência (excitação em 636 nm) da AlOHPc em ambos os solventes. AlOHPc em concentração de 3,1 mol L-1 em ambos solventes ... 42 Figura 26 – Curva de decaimento de fluorescência da AlOHPc no solvente etanol (linha preta)
e em solvente DMSO (linha azul), para excitação (a) em 401 nm e (b) em 636 nm. Função resposta do laser em vermelho e curva de ajuste monoexponencial em verde ... 44 Figura 27 – Espectros de absorção da AlOHPc em diferentes concentrações nos solventes (a)
etanol e (c) DMSO, e as intensidade dos picos de absorção em função da concentração nos solventes (b) etanol e (d) DMSO ... 45 Figura 28 – Intensidade dos picos de absorção da AlOHPc em função da concentração. (a)
Principal pico de absorção em 669 nm e (b) nos picos em 353 nm, em 604 nm e em 640 nm, em solvente etanol. (c) Principal pico de absorção em 673 nm e (d) nos picos em 350 nm, 607 nm e 645 nm, em solvente DMSO. Ajuste linear (linha tracejada)... 46 Figura 29 – Espectro de fluorescência da AlOHPc em função da concentração no solvente (a)
etanol e no (c) DMSO. Espectro de fluorescência normalizada da AlOHPc no solvente (b) etanol e no (d) DMSO. Excitação em 636 nm ... 48 Figura 30 – Comportamento do pico de intensidade de fluorescência da AlOHPc em função
Figura 31 – Eficiência quântica de fluorescência da AlOHPc em função da concentração em solvente etanol (circulo preto) e em solvente DMSO (quadrado vermelho). Excitação em 636 nm... 50 Figura 32 – Tempo de vida do AlOHPc (a) em etanol e (b) em DMSO em função da
concentração, para excitação em 401 nm e em 636 nm ... 51 Figura 33 – Comparação do tempo de vida do AlOHPc nos solventes etanol e DMSO em
função da concentração, quando excitado em (a) 401 nm e (b) em 636 nm ... 52
Figura 34 – Comparação da eficiência quântica de fluorescência (F) da AlOHPc dada pelo modelo de Birks (Eq. 2) como a eficiência quântica de fluorescência obtida pelo método experimental (Eq.6), em solvente (a) etanol e em (b) DMSO ... 53
Figura 35 – Espectros de absorção da AlOHPc com concentração de 1,0 mol L-1 em etanol com diferentes de proporção de água (v/v). Em detalhe, máximos de intensidades dos picos de absorção da AlOHPc em função da proporção de água (v/v) nas soluções com concentração de 1,0 mol L-1... 55
Figura 36 – Espectros de absorção da AlOHPc com concentração de 4,0 mol L-1 em etanol com diferentes de proporção de água (v/v). Em detalhe, máximos de intensidades dos picos de absorção da AlOHPc em função da proporção de água (v/v) nas soluções com concentração de 4,0 mol L-1... 56
Figura 37 – Espectros de absorção da AlOHPc com concentração de 70,0 mol L-1 em etanol com diferentes de proporção de água (v/v). Em detalhe, máximos de intensidades dos picos de absorção da AlOHPc em função da proporção de água (v/v) nas
soluções com concentração de 70,0 mol L-1... 57 Figura 38 – Espectros de fluorescência (exc = 636 nm) da AlOHPc com concentração (a) de
1,0 mol L-1 e de (b) de 4,0 mol L-1 em diferentes proporções volumétricas de etanol/água (v/v). Nas figuras em detalhes estão os gráficos de intensidade máxima do pico de emissão em função da proporção de água (v/v) ... 58
Figura 39 – Espectros de fluorescência estacionária (exc = 636 nm) da AlOHPc com
concentração de 70,0 mol L-1 em função da proporção de água (v/v). Em detalhe, intensidade máxima do pico de fluorescência em função da proporção de água (v/v)... 59 Figura 40 – Espectros corrigidos de RLS da AlOHPc com concentração de (a) 1,0 mol L-1,
Curva da intensidade máxima de espalhamento dos espectros de RLS da AlOHPc em função da proporção de água (v/v) ... 61 Figura 41 – (a) tempos de vida da AlOHPc com concentração de 1,0 mol L-1 em mistura
etanol/água quando irradiada com 401 nm e (b) suas respectivas amplitudes ... 63 Figura 42 – (a) tempos de vida da AlOHPc com concentração de 4,0 mol L-1 em mistura
etanol/água quando irradiada com 401 nm e (b) suas respectivas amplitudes ... 64
Figura 43 – (a) tempos de vida da AlOHPc com concentração de 70,0 mol L-1 em mistura etanol/água quando irradiada com 401 nm e (b) as respectivas amplitudes ... 65
Figura 44 – Comparação dos tempos de vida da AlOHPc para a concentração de 1,0 mol L-1
(símbolos preto), de 4,0 mol L-1 (símbolos vermelho) e de 70,0 mol L-1 (símbolos verde), em função das proporção de água (v/v) nas soluções, irradiada com 401 nm ... 66 Figura 45 – Curva de Stern-Volmer obtida a partir da fluorescência da AlOHPc (soluções com
0-60% água (v/v)) quando excitada com 636 nm em função da concentração molar da água, nas concentrações de 1,0 mol L-1, 4,0 mol L-1 e 70,0 mol L-1. Em detalhe, ajuste linear (linha tracejada) do gráfico de Stern-Volmer (soluções com 0-30% água (v/v)) ... 67 Figura 46 – Espectros de absorção das formulações contendo AlOHPc em nanoesferas de
PLA ... 69 Figura 47 – Espectros de fluorescência das formulações contendo AlOHPc em nanoesferas de
PLA, com excitação em 636 nm ... 70 Figura 48 – Tempos de vidas das formulações de AlOHPc encapsulada em nanoesferas de
PLA. Excitação em 401 nm ... 71
Figura A. 1 – Distribuição de diâmetro médio da AlOHPc encapsulada em nanoesferas de PLA. (a) Formulação “branca”, (b) Formulação 1, (c) Formulação 2, (d) Formulação 3 e (e) Formulação 4 ... 86 Figura A. 2 – Espectro de fluorescência da AlOHPc em função da concentração no solvente
etanol, quando excitada em (a) 350 nm, em (c) 401 nm e em (e) 670 nm. Espectro de fluorescência normalizada da AlOHPc em função da concentração no solvente etanol, quando excitada em (b) 350 nm, em (d) 401 nm e em (f) 670 nm ... 87 Figura A. 3 – Espectro de fluorescência da AlOHPc em função da concentração no solvente
Espectro de fluorescência normalizada da AlOHPc em função da concentração no solvente DMSO, quando excitada em (b) 350 nm, em (d) 401 nm e em (f) 670 nm ... 88 Figura A. 4 – Curvas de decaimento de fluorescência resolvida no tempo da AlOHPc com
LISTA DE TABELAS
Tabela 1 – Propriedades físicas do solvente etanol e do solvente DMSO ... 35
Tabela 2 – Massas da AlOHPc em g utilizadas na preparação de nanoesferas de PLA, do ácido poliláctico em mg e do surfactante em mg ... 36
Tabela 3 – Valores da massa da AlOHPc em g utilizadas na preparação de nanoesferas de PLA, com os respectivos diâmetro médio e do índice de polidispersão ... 38 Tabela 4 – Coeficiente de absorção molar (()) da molécula de AlOHPc em solvente etanol e
em solvente DMSO... 42 Tabela 5 – Eficiência quântica de fluorescência da molécula de AlOHPc (F) na concentração
de 3,1 µmol L-1 em etanol e em DMSO ... 43 Tabela 6 – Tempo de vida () da AlOHPc para concentração 3,15 µmol L-1 no solvente etanol
e no solvente DMSO, quando excitada em 401 nm e em 636 nm ... 43 Tabela 7 – Coeficiente de absorção molar (()) da AlOHPc em solvente etanol e em DMSO
e a qualidade da regressão linear (R²) ... 46 Tabela 8 – Valor da constante de Stern-Volmer (KSV) para o caso de supressão dinâmica da
AlOHPc, constante de supressão bimolecular (kq) e qualidade do erro (R²) ... 68 Tabela 9 – Tempos de vida das formulações de AlOHPc, irradiada com 401 nm. Amplitudes
respectivas dos tempos de vida e qualidade do ajuste (²) ... 71
Tabela A. 1 – Valores das concentrações em mol L-1 e em mg L-1da AlOHPc em solvente etanol e em DMSO ... 85 Tabela A. 2 – Eficiência quântica de fluorescência em 401 nm (banda Soret) e em 636 nm e
em 670 nm (banda Q) da AlOHPc no solvente etanol e no DMSO ... 89 Tabela A. 3 – Tempo de vida () da AlOHPc no solvente etanol e no DMSO em função da
concentração, para a excitação em 401 nm e em 636 nm. Qualidade do ajuste (²) ... 90 Tabela A. 4 – Tempos de vida da AlOHPc e amplitude dos tempos de vida na concentrações
de 1,0 mol L-1 em função da % água (v/v), para a excitação em 401 nm.
Tabela A. 5 – Tempos de vida da AlOHPc e amplitude dos tempos de vida na concentrações de 4,0 mol L-1 em função da % água (v/v), para a excitação em 401 nm.
Qualidade do ajuste (²) ... 92 Tabela A. 6 – Tempos de vida da AlOHPc e amplitude dos tempos de vida na concentrações
de 70,0 mol L-1 em função da % água (v/v), para a excitação em 401 nm.
LISTA DE SÍMBOLOS E ABREVIATURAS
̅ Probabilidade média de um único fóton emitido ser absorvido
Deslocamento de Stokes
abs Deslocamento do pico de absorção
() Coeficiente de absorção molar no comprimento de onda
Tempo de permanência da molécula no estado excitado singleto / tempo de vida
0 Tempo de permanência da molécula no estado excitado singleto na ausência de supressor
0 Eficiência quântica de fluorescência da molécula na ausência de supressor
D Eficiência quântica de fluorescência da molécula doadora
F Eficiência quântica de fluorescência
ref Eficiência quântica de fluorescência da referência
Comprimento de onda
emi Comprimento de onda de emissão
exc Comprimento de onda de excitação
Momento dipolar
Frequência
[Q] Concentração molar do agente supressor Ânions superóxidos
1O2 Oxigênio singleto
3O2 Oxigênio tripleto
OH- Radicais Hidroxilas
A Absorbância
A(exc) Absorbância no comprimento de onda de excitação AlClPc Ftalocianina de alumínio cloro
AlOHPc Hidróxido ftalocianina de alumínio
Abs Absorbância da amostra mesmo comprimento de onda da irradiação
Absref Absorbância da referência no mesmo comprimento de onda da irradiação
CI Conversão interna
Co(II)Pc Ftalocianina de cobalto
DMSO Sulfóxido de dimetilo ou Dimetilsulfóxido
⃗ Dipolos induzidos das moléculas EROs Espécies reativas de oxigênio
F´ Áreas sob o espectro de fluorescência da amostra
F´ref Áreas sob o espectro de fluorescência da referência
F Intensidade de fluorescência da molécula
F0 Intensidade de fluorescência da molécula na ausência do supressor
F(exc) Intensidade de fluorescência por comprimento de onda
h Constante de Planck
I Intensidade de luz irradiada
I0 Intensidade de luz monocromática incidente
Icorrigido Curva de espalhamento de luz corrigido
IF Intensidade de fluorescência
IR Espectro de Rayleigh
ISP Espectro de espalhamento da solução pura.
Imedido Espectro de espalhamento de luz da amostra
IT Intensidade de luz transmitida
k Fator instrumental relacionado aos parâmetros do equipamento
K Função sensibilidade do espectrofluorímetro
kq Constante de supressão bimolecular
KSV Constante de Stern-Volmer
l Caminho óptico
M Molécula orgânica / Cromóforo
M* Molécula orgânica excitada / Cromóforo excitado
n Índice de refração
nref Índice de refração da referência
PGA Ácido poliglicólico
PI Polidispersão
PLA Ácido poliláctico
PLGA Ácido poli(láctico-co-glicólico)
Q Receptor / Supressor
R Espectro de Rayleigh
RN Espectro de Rayleigh normalizado
RLS Espalhamento de luz ressonante
RV Relaxamento vibracional
S0 Estado fundamental
S1 Primeiro estado excitado
S2 Segundo estado excitado
Sn n-estado singleto
t Tempo
T1 Primeiro estado tripleto TFD Terapia fotodinâmica
Tn n-estado tripleto
UV-Vis Ultravioleta-visível ZnPc Ftalocianina de zinco
SUMÁRIO
PREFÁCIO ... 3
1 FUNDAMENTOS TEÓRICOS EM FOTOFÍSICA MOLECULAR ... 5
1.1 PROCESSOS FOTOFÍSICOS INTRAMOLECULAR ... 5
1.2 PROCESSOS FOTOFÍSICOS BIMOLECULARES ... 7
1.2.1 Processos de supressão de fluorescência ... 10
1.3 EFICIÊNCIA QUÂNTICA DE FLUORESCÊNCIA ... 12
1.4 EFEITO DO SOLVENTE ... 13
1.5 AGREGAÇÃO ... 13
2 REVISÃO BIBLIOGRÁFICAS ... 16
2.1 FTALOCIANINAS ... 16
2.2 TERAPIA FOTODINÂMICA ... 18
2.2.1 Fotossensibilizadores: Ftalocianinas ... 20
2.3 ENCAPSULAMENTO /NANOESFERA... 21
3 OBJETIVO ... 23
4 TÉCNICAS DE CARACTERIZAÇÃO ÓPTICA ... 24
4.1 ESPECTROSCOPIA DE ABSORÇÃO ÓPTICA ... 24
4.2 ESPECTROSCOPIA DE FLUORESCÊNCIA ESTACIONÁRIA ... 26
4.3 ESPALHAMENTO DE LUZ RESSONANTE ... 29
4.4 ESPECTROSCOPIA DE FLUORESCÊNCIA RESOLVIDA NO TEMPO ... 30
5 MATERIAL E MÉTODOS ... 34
6 RESULTADOS E DISCUSSÃO ... 39
6.1 CARACTERIZAÇÃO ÓPTICA DA ALOHPC EM SOLVENTE ETANOL E EM DMSO ... 39
6.2 ESTUDO DA CONCENTRAÇÃO NAS PROPRIEDADES FOTOFÍSICAS DA ALOHPC ... 44
6.3 ESTUDO DA ALOHPC EM MISTURA ETANOL/ÁGUA DESTILADA ... 53
6.4 FOTOFÍSICA DA ALOHPC EM NANOESFERAS DE ÁCIDO POLILÁCTICO ... 68
REFERÊNCIAS BIBLIOGRÁFICAS ... 74
GLOSSÁRIO ... 84
APÊNDICE A ... 85
APÊNDICE B ... 86
APÊNDICE C ... 87
APÊNDICE D ... 89
APÊNDICE E ... 90
APÊNDICE F ... 91
PREFÁCIO
A Terapia Fotodinâmica (TFD) é um tratamento utilizado no combate de doenças oncológicas, dermatológicas e oftálmicas, com resultados científicos promissores desde os anos 80. Essa terapia baseia-se nas reações fotofísicas originadas a partir da ação da luz no fotossensibilizador localizadas no tecido afetado. Após a ativação (excitação) destes fotossensibilizadores, espécies reativas de oxigênio (EROs) como o oxigênio singleto (¹O2), o superóxido (O2-), o hidroperoxila (HO2), o hidroxila (OH) e o peróxido de hidrogênio (H2O2), são geradas e induzem a apoptose e/ou necrose das células tumorais. No entanto, a escolha do fotossensibilizador é um fator de grande importância no tratamento por TFD, pois devido às propriedades fotofísicas deste a taxa de formação de EROs no tecido cancerígeno pode ser elevada, acarretando consequentemente em um elevada eficiência de tratamento.
Este trabalho consistiu em estudar as propriedades fotofísicas da Hidróxido Ftalocianina de Alumínio (AlOHPc), a qual tem sido estudada como possível fotossensibilizador no tratamento por TFD. Para realização deste trabalho foi proposto estudar a AlOHPc em diferentes meios, buscando compreender como suas propriedades eletrônicas nestes meios.
Inicialmente foi utilizada a técnica de absorção óptica, como o intuído de averiguar a região no espectro de luz visível que a molécula absorve. A compreensão da região de absorção da AlOHPc é de grande importância na TFD, pois a partir da interação com a luz e excitação do fotossensibilizador, desencadeiam-se os processos físico-químicos no tecido cancerígeno, classificados como reações do tipo I e do tipo II na TFD, nas quais ocorrem a formação dos EROs. Também foi utilizada a espectroscopia de fluorescência estacionária, a qual permitiu verificar a região e a intensidade relativa de fluorescência da AlOHPc, e calcular a eficiência quântica de fluorescência da AlOHPc. Conhecer o comprimento de onda de máxima absorção e a região de emissão do fotossensibilizador permite inferir sobre a eficiência do tratamento.
valores do tempo de permanência da AlOHPc no estado excitado, permitiu detectar a ocorrência de agregados moleculares devido ao meio. O tempo de permanência no estado excitado singleto é uma variável importante na terapia fotodinâmica, pois quanto mais longo esse tempo mais eficiente à formação do estado tripleto e consequentemente mais provável a formação de espécies reativas de oxigênio.
A caracterização óptica em diferentes meios é importante devido às interações físico-químicas da molécula com o solvente. Sendo então realizada a caracterização da AlOHPc solubilizada nos solventes etanol e DMSO e verificando se ocorreu alteração nestas propriedades devido à interação da AlOHPc com o solvente (interação soluto-solvente). A interação entre as moléculas de AlOHPc (interação soluto-soluto) é de grande importância, por poder ocasionar alterações nas propriedades fotofísicas. Sendo assim, também foi realizada a caracterização da AlOHPc em função da concentração (0,04-363,63 mol L-1) averiguando os processos fotofísicos intramolecular e bimoleculares (ou intramoleculares).
Também realizou-se o estudo da AlOHPc em diferentes proporções volumétricas de etanol/água destilada (v/v). Devido às ftalocianinas serem moléculas hidrofóbicas e à utilização desta molécula como fotossensibilizadores ser em meio aquoso (sangue), necessita-se a compreensão das propriedades fotofísicas da AlOHPc em função da proporção de água.
1 FUNDAMENTOS TEÓRICOS EM FOTOFÍSICA MOLECULAR
Este capítulo aborda os processos fotofísicos intramolecular e os processos fotofísicos
bimoleculares que pode ocorrer após as moléculas orgânicas interagirem com a radiação
eletromagnética na região do UV-Vis. Também descreve sobre o efeito do solvente nas
propriedades ópticas da molécula e os tipos de agregações moleculares.
As propriedades fotofísicas de uma molécula orgânica (cromóforo) como a eficiência quântica, o coeficiente de absorção molar e o tempo de permanência no estado excitado, são determinadas pela natureza e pela energia de seus estados eletronicamente excitados. No entanto, devido ao meio a molécula pode ter alterações na estrutura química inicial. A compreensão e a caracterização das energias relativas dos estados eletrônicos dessas moléculas é o objetivo da fotofísica molecular.1,2
Após a molécula orgânica absorver radiação eletromagnética, os elétrons no estado de menor energia (estado fundamental S0) são excitados para estados de maior energia (estados excitados, Sn), apresentando transições eletrônicas características. No estado excitado a molécula tende a retornar ao estado fundamento por processos radiativos (com emissão de fóton) e não radiativos (sem emissão de fóton).
1.1 PROCESSOS FOTOFÍSICOS INTRAMOLECULAR
de mesma energia (isoenergético) pertencente a estados eletrônicos de diferentes multiplicidade.3
No caso da desativação por processos radiativos a molécula excitada retorna para o estado fundamental emitindo um fóton, esse processo é chamado de fotoluminescência. No entanto, a fotoluminescência é dividida em duas categorias: i) a fluorescência (S1→S0) (fenômeno investigado neste trabalho) na qual o elétron no estado excitado singleto preserva a multiplicidade de spin que tinha no estado fundamental (Figura 2(b)), isso permite que o seu retorno ao estado fundamental ocorra de forma mais rápida com emissão na ordem de 10-10– 10-7 s; e ii) a fosforescência (T1→S0), a emissão do fóton ocorre a partir de um estado excitado tripleto (Figura 2(c)), no qual o elétron excitado apresenta a mesma multiplicidade de spin do elétron no estado fundamental. O retorno do elétron ao estado fundamental a partir do estado excitado tripleto é considerado uma transição proibida, tornando a emissão lenta, da ordem de 10-3–100 s.3
(a) (b) (c)
Figura 2 – Representação da orientação do spin no processo de excitação. (a) Spins com diferente multiplicidade e mesma energia, caracterizando o estado fundamental. (b) Spins com diferente multiplicidade e com energias diferentes, caracterizando o estado excitado singleto. (c) Spins com multiplicidade iguais e com energias diferentes, caracterizando o estado excitado tripleto
De forma geral, as diferenças entre os níveis vibracionais do estado fundamental e do estado excitado singleto são semelhantes, de modo que o espectro de fluorescência muitas vezes se assemelha a primeira banda de absorção (imagem especular), isto devido à emissão
de um fóton ser tão rápido como a absorção do fóton ( 10-15 s), porém a molécula excitada permanece no estado excitado durante um determinado tempo, sendo entre 10-12 s até 10-9 s (dependendo do tipo de molécula e do meio) antes de emitir um fóton ou submeter-se a processos fotofísicos. Durante a permanência da molécula no estado excitado, esta tende a perder parte da energia absorvida devido às conversões internas e ao rearranjo eletrônico dos orbitais moleculares, causando um deslocamento do espectro de fluorescência para comprimentos de onda de menor energia em relação ao espectro de absorção. A diferença entre o máximo da primeira banda de absorção e o máximo de fluorescência é chamado o deslocamento de Stokes ().9
Este parâmetro pode fornecer informações importantes sobre os estados excitados da molécula, como por exemplo, se o momento de dipolo de uma molécula fluorescente é maior no estado excitado do que no estado fundamental S0. O deslocamento de Stokes aumenta com o aumento da polaridade do solvente.
1.2 PROCESSOS FOTOFÍSICOS BIMOLECULARES
distintas. Estas interações bimoleculares podem desencadear processo de transferência de energia radiativa e não radiativa, transferência da carga, dissociação química e formação de complexos.
O caso da transferência de energia radiativa (ou transferência de energia trivial)
consiste em duas etapas ocorrendo consecutivamente, sendo a emissão de radiação por parte da molécula doadora no estado excitado (M*) e a posterior reabsorção desta radiação por parte da molécula receptora (Q), como representado abaixo:
M*→ M + h
Q + h→ Q*
A eficiência da transferência de energia radiativa depende de fatores como: a sobreposição espectral entre a emissão do doador e absorção do receptor, do coeficiente de absorção molar do receptor, da concentração do receptor e da eficiência quântica de fluorescência do doador (D).4
Birks propôs um simples modelo cinético para estudar o caso da transferência radiativa entre moléculas idênticas, as quais apresentam tempo de permanência no estado excitado mais longo devido as sucessivas reabsorções e reemissões. O modelo de Birks baseia-se na suposição da probabilidade média de um único fóton emitido ser reabsorvido ( ̅) e é expresso pela seguinte equação:9
̅
,
( 1 )sendo, o tempo de permanência da molécula no estado excitado () mais longo que o tempo
de permanência da molécula no estado excitado na ausência de transferência radiativa (0). O modelo de Birks também pode ser utilizado para analisar o comportamento da
eficiência quântica de fluorescência da molécula (F), a qual tente a ser menor que a
eficiência quântica de fluorescência da molécula na ausência de transferência radiativas (0). Essa diminuição da eficiência quântica é causada pelo aumento da probabilidade do fóton emitido ser reabsorvido e é calculada pela seguinte equação:9
̅
A utilização deste modelo permitiu explicar quantitativamente as alterações das propriedades fotofísicas da AlOHPc em função da concentração.
A transferência de energia não radiativa consiste basicamente em envolver simultaneamente o decaimento da molécula doadora no estado excitado (M*) causando a excitação da molécula receptora (Q), sendo:
M* + Q → M + Q*
A transferência de energia não radiativa causada pela presença do receptor influência a eficiência de emissão do doador,4 mas não altera a forma do espectro de fluorescência e não causa alteração no tempo de permanência do doador no estado excitado (no caso de moléculas do mesmo tipo).5,9 Dois casos bem conhecidos de transferência de energia não radiativa são:
i) Teoria de Förster, que consiste da molécula doadora no estado excitado (M*) transferir energia não radiativa ou ressonante para a molécula receptora (Q) via interações do tipo dipolo-dipolo de longo alcance, não envolvendo colisão entre as moléculas, reabsorção ou transferência de elétrons (Figura 3).6 No entanto, para que ocorra a transferência de energia é necessária uma condição ressonante entre as oscilações dos campos elétricos do estado excitado do doador e do estado fundamental do receptor, além da sobreposição entre o espectro de emissão do doador e o espectro de absorção do receptor e também da orientação espacial entre os dipolos elétricos dos dois estados diretamente envolvidos.
Figura 3 – Teorema de Föster, representação da transferência de energia ressonante mostrando que os elétrons 1 (verde) e 2 (amarelo) permanecem no doador e no receptor, respectivamente, mesmo após a transferência de energia. Fonte7
haver interação entre as nuvens eletrônicas (interpenetração orbital). Como representado na Figura 4, a transferência na radiativa ocorre com a molécula doadora no estado excitado (M*) transferindo um elétron da banda de condução para a banda de condução da molécula receptora (Q), e simultaneamente o receptor transfere um elétron da banda de valência para a banda de valência do doador (M) (recirculação de elétrons ou múltipla-troca). Devido à troca de elétrons esse tipo de transferência é confundido com transferência de carga, no entanto, neste caso não há formação de radicais livres e as cargas da molécula se conservam. Essa transferência de energia não radiativa requer sobreposição direta entre os orbitais envolvidos e a restrição de spin deve ser obedecida para a conservação global de spin.4,7
Figura 4 – Representação do teorema de Dexter. Múltipla troca no processo de transferência de energia de Dexter, os elétrons 1 (verde) e 2 (amarelo) trocam de molécula. Fonte7
1.2.1 Processos de supressão de fluorescência
A interação de uma molécula (M) ou molécula excitada (M*) com uma molécula supressora (Q, do inglês quencher) pode resultar na diminuição da intensidade de fluorescência da molécula. Algumas destas interações podem ocorrer por colisões moleculares, formação de complexos não fluorescentes, rearranjo molecular, transferência de energia ou transferência de elétrons.2,8 A supressão de fluorescência molecular ocasionada devido à presença de um supressor, pode ser atribuída a processos de supressão dinâmica (ou colisional), a processos de supressão estática ou ocorrência de ambos os processos ocorrendo simultaneamente.
da eficiência quântica de fluorescência da molécula na ausência do supressor (0) pela
eficiência quântica de fluorescência da amostra na presença do supressor (), ou do tempo de
permanência da molécula no estado excitado na ausência do supressor (0) pelo tempo de
permanência da molécula no estado excitado na presença do supressor (), na qual se a relação for linear obtém-se a constante de Stern-Volmer (KSV), dada por:
, -
, -
( 3 )onde, [Q] é a concentração molar do agente supressor e kq é constante de supressão bimolecular. Na supressão dinâmica o tempo de permanência da molécula no estado excitado é alterado pela presença do supressor.9
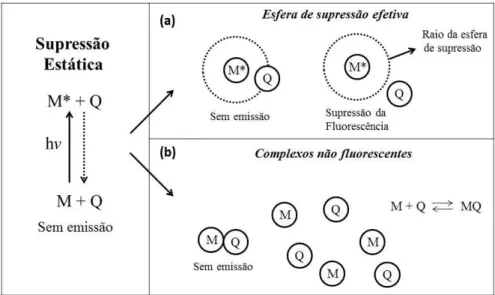
A supressão estática pode ocorrer de duas formas distintas: i) no primeiro caso
conhecido como esfera de supressão efetiva, define-se ao redor da molécula excitada um
volume esférico, na qual se a molécula supressora encontra-se dentro deste volume a emissão da molécula excitada não ocorre (Figura 5(a)). ii) O segundo caso é chamado de formação de
complexos não fluorescentes, que ocorre devido à interação da molécula com o supressor
ainda no estado fundamental gerando um complexo não fluorescente (Figura 5(b)). Em ambos os casos o tempo de permanência da molécula no estado excitado não é alterado pela presença do supressor.9
Na supressão estática, a curva de Stern-Volmer pode apresentar relação linear e não linear. No caso de formação de complexos não luminescentes observa-se uma relação linear, sendo obtida a partir da intensidade de fluorescência da molécula ou eficiência quântica, dada por:
, -
, ( 4 )sendo, ks a constante de associação. No caso de esfera de supressão efetiva a relação é não
linear, e dada por:
(
, -)
,
( 5 )onde, Vq é o volume esférico da molécula e NA é a constante de Avogadro.
Para o caso onde ocorrer à supressão dinâmica e estática simultaneamente, observa-se o desvio da linearidade da curva de Stern-Volmer.9
1.3 EFICIÊNCIA QUÂNTICA DE FLUORESCÊNCIA
A eficiência quântica de fluorescência (F) é a razão entre os fótons emitidos e os fótons absorvidos, ou seja, informa a eficiência da desativação do estado excitado singleto por emissão de fótons.
O método de cálculo de eficiência quântica de fluorescência utilizado nesse trabalho é um método comparativo e é calculado pela seguinte equação:
( 6 )
onde, ref é a eficiência quântica de fluorescência da referência, n e nref são os índice de
refração da amostra e da referência, respectivamente. A F´ e F´ref são as áreas sob o espectro
de fluorescência da amostra e da referência, respectivamente. E Abs e Absref são os valores de
1.4 EFEITO DO SOLVENTE
No estudo fotofísico de moléculas em solução a escolha do solvente utilizado é de grande importância, pois devido a propriedades do solvente como: polaridade, grupo funcional, viscosidade entre outras, o solvente irá interagir de diferentes formas com a molécula em solução. Essa interação entre moléculas do soluto e do solvente é conhecida como solvatação.
O valor da polaridade do solvente, a qual é determinada pelo momento dipolar () das moléculas do solvente, ocasiona o deslocamento espectral da banda característica de absorção ou emissão das moléculas do soluto, chamando de deslocamento solvatocrômico. Ou seja, a utilização de solventes com alta polaridade tende a causar o deslocamento do pico de absorção ou de emissão do espectro característico das moléculas do soluto para comprimentos de onda de menor energia (deslocamento batocrômico), isto devido à polaridade causar o rearranjo na orientação das moléculas do soluto e consequentemente a diminuição entre os níveis de energia, como representado na Figura 6. Quando ocorre o deslocamento para comprimentos de onda de maior energia o efeito é chamado de deslocamento hipsocrômico.9,11
Figura 6 – Comparação do processo de dissipação radiativa por fluorescência: em F moléculas diluídas em solvente com baixo momento dipolar (), em F` mesma moléculas diluídas em solvente com alto momento dipolar (*). Fonte9
1.5 AGREGAÇÃO
agregado). O tamanho destes sistemas complexos pode variar entre nanômetros (micelas) a micrometros (filmes finos, membranas).
O estudo da agregação é de grande importância, pois em certos casos os agregados resultantes possuem propriedades diferentes da molécula isolada. No caso das clorofilas, a associação destas moléculas na membrana da tilacóide é responsável pela captura da luz solar e pelo processo de fotossíntese.12 A formação da membrana celular é outro caso de agregação, na qual os fosfolipídios agregados tem a função de separar o interior da célula do meio exterior.13 Devido as diferentes propriedades dos agregados, o estudo e aplicação destes abrangem diferentes áreas como a Química, a Física, a Engenharia e a Medicina.
Há muitos aspectos experimentais e teóricos ainda não compreendidos relacionados à formação dos agregados como, por exemplo, a dinâmica de formação de tais sistemas. No trabalho de Aggarwal,14 são descritos alguns dos mecanismos que favorecem a formação de agregados, sendo:
i) Interação eletrostática: são resultantes da interação de cargas opostas entre dipolo-dipolo ou dipolo-dipolo-íons, cuja magnitude é diretamente dependente da constante dielétrica do meio e da distância entre as cargas;
ii) Formação de pontes de hidrogênio: é a interação entre o átomo de hidrogênio de uma molécula com o átomo altamente eletronegativo de outra molécula. Para que ocorra esta formação os monômeros devem apresentar boa aproximação para que as nuvens eletrônicas dos átomos que formam essa ligação se sobreponham. Esta interação é eficiente para distâncias curtas e apresentam boa estabilidade no agregado formado;
iii) Empilhamento -(do inglês, - stacking): ocorre a uma atração não covalente entre anéis aromáticos, empilhando-os. São atribuídas às interações bimoleculares;
iv) Interação hidrofóbica: está interação acontece ao adicionar moléculas hidrofóbicas em solução aquosa. As moléculas hidrofóbicas (apolares) interagem entre si, minimizando o contato com as moléculas polares.
Figura 7 – Representação da geometria dos tipos de agregados: (a) agregado H, (b) agregado J e (c) agregado HJ
Estes tipos de agregados apresentam diferentes propriedades eletrônicas e ópticas quando comparadas com as propriedades da molécula na forma monomolecular. No caso dos agregados tipo J observa-se o deslocamento da banda de absorção para comprimentos de onda de menor energia, e os agregados do tipo H apresentam deslocamento da banda de absorção para comprimentos de onda de maior energia. Basicamente este efeito pode ser explicado da seguinte forma: os agregados do tipo J tem o ângulo entre o momento de transição e a linha que une o centro dos monômeros sendo zero, e os dipolos induzidos orientam-se de tal forma que o polo positivo de um deles fica próximo do polo negativo do outro, consequentemente diminuindo a energia de transição e deslocando a banda de absorção para comprimentos de onda de menor energia (Figura 8(a)). Nos agregados tipo H, o momento de transição do monômero é perpendicular à linha que os une, desta forma a onda eletromagnética induz a formação de dois dipolos, onde cargas semelhantes se aproximam aumentando a energia de transição e deslocando a banda de absorção para comprimentos de onda de maior energia (Figura 8(b)).14
2 REVISÃO BIBLIOGRÁFICAS
Neste capitulo são apresentados algumas informações sobre as ftalocianinas e suas
aplicações, em especial na utilização como fotossensibilizador no tratamento por terapia
fotodinâmica (TFD). Também é abordada a importância do encapsulamento do
fotossensibilizadores para a utilização na TFD.
2.1 FTALOCIANINAS
As ftalocianinas foram descobertas acidentalmente em 1907 por Braun e Tchernic na
South Metropolitan Gas Company em Londres, após sintetizarem a o-cianobenzamida com a ftalamida e o anidrido acético e observar a formação de um composto escuro e insolúvel em água, o qual viria a ser classificado como ftalocianina e ter sua estrutura química compreendida somente em 1930 pelo Prof. Reginald P. Linstead.15 O nome ftalocianina, do inglês phthalocyanine foi concebido como a combinação do prefixo phthal, originalmente do grego naphta (óleo de rocha), para enfatizar a associação com seus vários percussores derivados do ácido ftálico e da palavra grega cyanine (azul escuro).16
A estrutura química das ftalocianinas é formada por quatro unidades de indol (Figura 9(a)) que são unidos por átomos de nitrogênio (Figura 9(b)). O indol é um composto orgânico aromático heterocíclico. As ftalocianinas são moléculas de origem sintética e planares. O macrociclo é formado por 18 elétrons conjugados, que conferem a aromaticidade por obedecem à regra de Huckel. A ftalocianina de base livre (sem elemento metálico) é constituída por 32 átomos de carbono, 8 átomos de nitrogénio e 18 átomos de hidrogênio.17
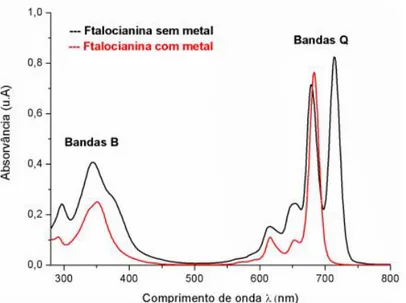
A região central da molécula de ftalocianina pode ser ocupada por um elemento metálico (metaloftalocianina) gerando algumas alterações nas características especificas do composto original. A Figura 10 mostra os espectros de absorção característicos da ftalocianina de base livre (sem elemento metálico) e da ftalocianina com elemento metálico (metaloftalocianina), observa-se que as ftalocianinas possuem duas bandas de absorção. A banda Soret (ou banda B), a qual ocorre entre 300-400 nm, com um largo pico de absorção e é caracterizada por transferência eletrônica entre os orbitais moleculares dos grupos indol. As
transições eletrônicas (a2u() eg(*)) originadas na banda Soret causa a redistribuição e o aumento da densidade eletrônica ao redor dos átomos de nitrogênio que ligam os grupos indol. A banda Q é originada por transferências eletrônicas entre os orbitais moleculares dos
grupos indol e os anéis benzênicos (a1u() eg(*)). As variações de densidade eletrônica devido às transições da banda Q não induzem a uma carga pontual, mas ao invés disso se espalha por toda a molécula. Na banda Q se observa a formação de três picos de absorção na região entre 600-750 nm. O pico de maior intensidade de absorção tem o valor do coeficiente de absorção molar () característico da ordem de 105 L mol-1 cm-1 e os outros dois picos de menor intensidade correspondem a transições vibracionais. A banda Soret e a banda Q são atribuídas às transições eletrônicas dos orbitais (Homo) para o orbita * (Lumo) do macrociclo.16,18,19
Figura 10 – Espectro de absorção característico da ftalocianina sem metal central (linha preta) e da ftalocianina com metal central (linha vermelha)
transferência de elétrons, moléculas não tóxicas, hidrofobicidade, alta estabilidade física e química, entre outras, elas tem sido estudadas e aplicadas em diversas áreas. Braik e colaboradores21 tem utilizado derivados da ftalocianina de cobalto (Co(II)Pc) no desenvolvimento de filmes finos aplicados como sensores de perclorato. No desenvolvimento de células solares, Yuen e colaboradores 22 tem utilizado diferentes metaloftalocianinas com fulereno buscando o desenvolvimento de células solares com elevadas taxas de eficiência de conversão de energia. As ftalocianinas também têm sido aplicadas no desenvolvimento de cristais líquidos.23,24 E dentre outras áreas, verifica-se muitos estudos sendo realizados utilizando as ftalocianinas como fotossensibilizadores no tratamento medicinal por terapia fotodinâmica (TFD),17,25 aplicação está que é de interesse neste trabalho.
2.2 TERAPIA FOTODINÂMICA
A Terapia Fotodinâmica (TFD) é um tratamento utilizado no combate a doenças oncológicas,26 dermatológicas,27 oftalmológicas28 e também pode ser utilizado na eliminação de microrganismos tais como bactérias, fungo e vírus.29 O termo fotodinâmica começou a ser utilizado pelo von Tappeiner em 1904, para descrever as reações química que consumiam oxigênio induzidas pela fotossensibilização. Após estudos, von Tappeiner publicou que o tratamento por TFD consistia basicamente da utilização de um fotossensibilizador, de oxigênio e de luz na região do visível, no entanto, devido aos equipamentos e conhecimentos físico-químico da época, o tratamento por TFD só passou a apresentar resultados mais promissores a partir dos anos 80.30
Para iniciar o processo de fotossensibilização e tratamento por TFD o fotossensibilizador deve ser adicionado na região desejada ou acumular-se no tecido cancerígeno após ser injetado na corrente sanguínea. A região então é irradiada com fonte de luz, de preferencia no comprimento de onda de maior absorção do fotossensibilizador, iniciando as reações fotofísicas e fotoquímicas desejadas.31,32 Estas reações geram produtos fototóxicos danosos ao tecido cancerígeno ocasionando a morte das células alvo (células neoplásticas). Como vantagem da utilização da TFD tem-se alta taxa de seletividade de destruição do tecido cancerígeno e baixos efeitos colaterais quando comparados com os efeitos da quimioterapia, da radioterapia ou da cirurgia.26,33
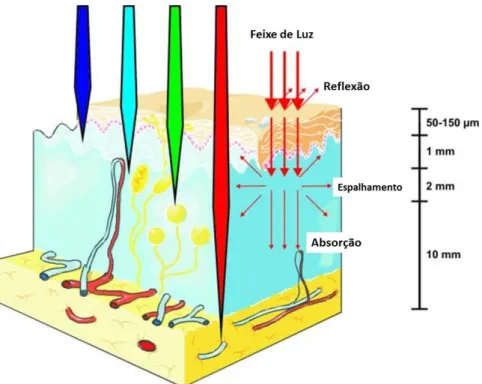
faixa de comprimento) é de grande importância. Estudos mostram que a irradiação com comprimentos na região do vermelho e do infravermelho (600-1200 nm) apresentam maior profundidade de penetração no tecido celular, como representado na Figura 11.34,35 No entanto, para comprimentos de onda maiores que 800 nm a energia da irradiação é baixa, resultando em baixa taxa de oxigênios singletos (1O2) formado durante os processos fotofísicos da TFD.36
Figura 11 – Representação da profundidade de penetração da radiação eletromagnética na região do visível na pele humana. Fonte34, imagem modificada
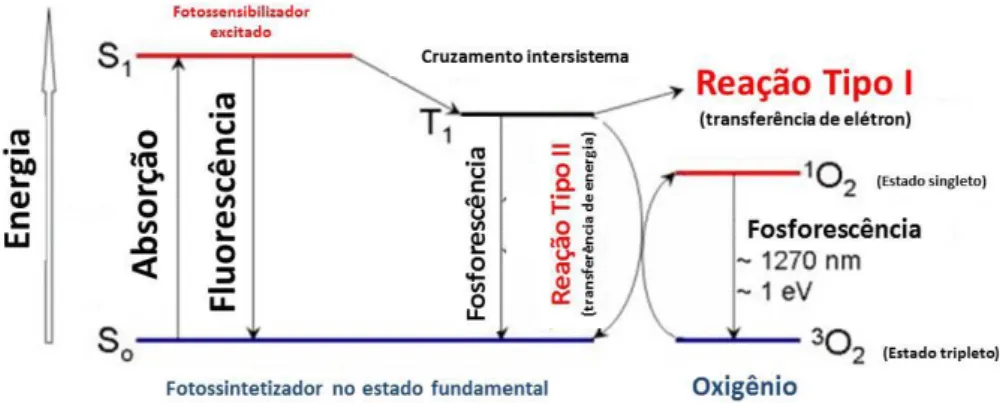
Os processos fotofísicos necessários para a terapia fotodinâmica consistem inicialmente da irradiação do fotossensibilizador ocasionando a excitação deste para um estado excitado singleto. Neste estado excitado singleto ocorre à transição por cruzamento intersistema do fotossensibilizador excitado para o primeiro estado excitado tripleto, o qual pode desencadear dois tipos de reações, com representado na Figura 12.37 Na reação do tipo I, o fotossensibilizador já no estado tripleto transfere elétrons para as moléculas vizinhas formando radicais livres ou íons radicais, os quais ao reagirem com o oxigênio molecular (O2) levam a produção de espécies de oxigênio reativos como: ânions superóxidos ( ), peróxido
de hidrogênio (H2O2) e radicais hidroxilas (OH–), que são capazes de oxidar varias moléculas
citotóxico e capaz de matar diretamente células neoplásticas através da indução de apoptose
e/ou necrose.40,41
Figura 12 – Representação do diagrama de Jablonski após excitação do fotossensibilizador (S0 → S1), com cruzamento intersistemas entre o estado excitado singleto para o estado excitado tripleto do fotossensibilizador (S1→ T1). Reação do tipo I e representação da formação de oxigênio singleto (¹O2) na reação tipo II. Fonte34, imagem modificada
2.2.1 Fotossensibilizadores: Ftalocianinas
Os fotossensibilizadores são moléculas capazes de absorver radiação eletromagnética e transferir esta energia por transferência de energia ou de elétrons para outras moléculas, este processo é à base do tratamento por terapia fotodinâmica (TFD). Após os fotossensibilizadores serem injetados na corrente sanguínea, eles são transportados por afinidade com a lipoproteína do plasma sanguíneo42 e tende a se concentrar no tecido cancerígeno.43 Para que ocorra boa eficiência do tratamento por TFD o fotossensibilizador deve apresentar: baixa toxidade no escuro, fotossensibilidade não prolongada, rápida eliminação pelo corpo, alta seletividade e penetração no tecido cancerígeno, formação do estado tripleto excitado com alta taxa de transferência de energia para os oxigênios tripletos, baixa agregação em meio aquoso e alto coeficiente de absorção molar para absorção na região entre 600-750 nm.44,45
apresentar resultados positivos nos tratamentos, este fotossensibilizador apresentava limitações, como: baixa intensidade de absorção na região entre 600-750 nm, longa permanência na pele deixando o paciente sensível a luz por semanas e baixo acumulo do tecido cancerígeno.47,49 Limitações semelhantes foram identificadas em outros fotossensibilizadores desenvolvidos utilizando moléculas pertencentes ao grupo das porfirinas.17
Devido a estes limitantes outras moléculas como as ftalocianinas começaram a ser estudadas como fotossensibilizadores, pertencendo então à segunda geração. Algumas ftalocianinas apresentarem propriedades ópticas ideais para a aplicação no tratamento médico por TFD, como elevado coeficiente de absorção molar na região de 600-750 nm, região que corresponde a uma janela terapêutica ideal para o tratamento.50 De acordo com de Oliveira e colaboradores17 o primeiro composto fotossensibilizador a base de ftalocianina e com permissão para tratamento médico em tumores de coroide, olhos, pálpebras e bexiga é o Photosens®, e têm apresentado bons resultados.51 Outros compostos a base de ftalocianina já foram desenvolvidos, no entanto ainda estão em fase de testes clínicos.
2.3 ENCAPSULAMENTO / NANOESFERA
Apesar das vantagens e bons resultados que a terapia fotodinâmica tem apresentado, a hidrofobicidade da maioria dos fotossensibilizadores tem sido uma das maiores dificuldades neste tratamento por causar à agregação do fotossensibilizador devido o meio aquoso (sangue), alterando suas propriedades fotofísicas. Sendo assim, uma alternativa que tem sido pesquisada é o encapsulamento do fotossensibilizador.
O encapsulamento de fotossensibilizador permite a liberação deste em tecidos preferenciais, buscando proporcionar vantagens e contornando limitações de: propriedades físico-químicas (solubilidade), farmacodinâmicas (potencialização do efeito terapêutico), farmacocinéticas (controle da absorção e distribuição tecidual), além de possibilitar redução da toxicidade local e sistêmica.52 Exemplos de tipos de encapsulamento utilizados no transporte de fotossensibilizador são as nanopartículas poliméricas biodegradáveis, as nanoemulsões, os lipossomos, as nanopartículas magnéticas, as nanopartículas lipídicas, os dendrímetros, entre outros.53
nanocápsulas, por apresentarem diferente composição e organização estrutural. As nanocápsulas (Figura 13(a) e (b)) são constituídas por um invólucro polimérico disposto ao redor de um núcleo oleoso, podendo o fotossensibilizador estar disperso neste núcleo e/ou adsorvido à parede polimérica. Por outro lado, as nanoesferas (Figura 13(c) e (d)), que não apresentam óleo em sua composição, são formadas por uma matriz polimérica, onde o fotossensibilizador pode ficar retido ou adsorvido.
Figura 13 – Representação esquemática de nanocápsulas e nanoesferas poliméricas: (a) fotossensibilizador dissolvido no núcleo oleoso da nanocápsula; (b) fotossensibilizador adsorvido à parede polimérica da nanocápsula; (c) fotossensibilizador retido na matriz polimérica da nanoesfera; (d) fotossensibilizador adsorvido ou disperso na matriz polimérica da nanoesfera. FonteErro! Indicador não definido., imagem alterada
A utilização de polímeros no encapsulamento de fotossensibilizador tem-se mostrado uma alternativa positiva para aumentar a biocompatibilidade e a dispersão de compostos que são insolúveis em água, garantindo assim à dispersão do fotossensibilizador em meio aquoso. Alguns dos polímeros mais estudados são: o ácido poliláctico (PLA), o ácido poliglicólico (PGA) e os copolímeros ácido poli(láctico-co-glicólico) (PLGA). Esses polímeros apresentam baixa toxicidade e consisti de materiais biocompatíveis, os quais são degradados in vivo em fragmentos menores e facilmente excretados.55
Alguns resultados sobre a utilização de polímeros no encapsulamento de fotossensibilizadores já tem sido publicados, como por exemplo, o apresentado por Ricci-Junior e colaboradores56, no qual se realizou o encapsulamento da ftalocianina de zinco
(ZnPc) utilizando o polímero PLGA e obtendo um sistema hidrofílico de tamanho apropriado para acumular-se na região tumoral e sem alteração significativa das propriedades do fotossensibilizador.
3 OBJETIVO
Este trabalho tem como objetivo realizar a caracterização das propriedades fotofísicas da AlOHPc em diferentes meios, utilizando as técnicas de absorção óptica, de fluorescência estacionária, de fluorescência resolvida no tempo e de espalhamento de luz ressonante. E também calcular os valores de eficiência quântica de fluorescência, da constante de Stern-Volmer e do coeficiente de absorção molar. Para isto:
- Investigou-se as propriedades fotofísicas da AlOHPc nos solventes etanol e sulfóxido de dimetilo (DMSO) comparando-as, e em seguida analisando o comportamento destas propriedades em função da concentração. Este estudo buscou compreender os processos fotofísicos monomoleculares e bimoleculares, como as interações soluto-solvente e soluto-soluto, que podem ocorrer nestes meios após a interação da AlOHPc com a luz;
- Realizou-se a caracterização da AlOHPc em diferentes proporções volumétricas de etanol/água (v/v). Sabe-se que a AlOHPc é uma molécula hidrofóbica e em presença de água ela tende a agregar-se, então este estudo consiste em verificar se ocorre alteração das propriedades fotofísicas da AlOHPc em função do aumento da proporção de água nas soluções;
4 TÉCNICAS DE CARACTERIZAÇÃO ÓPTICA
As técnicas de caracterização óptica utilizadas neste trabalho foram: espectroscopia
de absorção óptica (UV-Vis), espectroscopia de fluorescência estacionária, espalhamento de
luz ressonante e espectroscopia de fluorescência resolvida no tempo.
4.1 ESPECTROSCOPIA DE ABSORÇÃO ÓPTICA
A espectroscopia de absorção óptica permite a caracterização de moléculas e materiais em geral, através da investigação das transições eletrônicas.58,59 Durante este trabalho foi utilizado dois modelos de espectrofotômetros para a caracterização das transições eletrônicas da AlOHPc.
(a) (b)
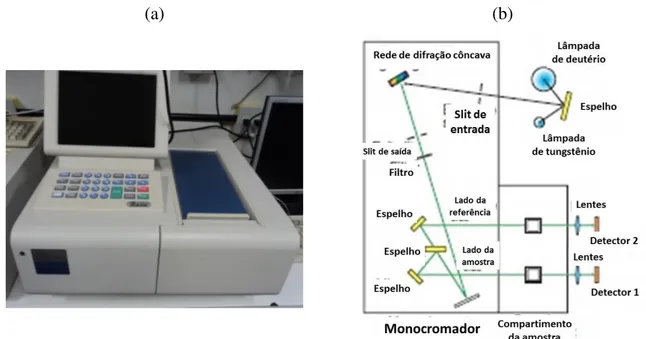
Figura 14 – (a) Espectrofotômetro da Hitachi modelo Double Beam U-2900, localizado no Grupo de Polímeros “Prof. Bernhard Gross” no Instituto de Física de São Carlos da Universidade de São Paulo. (b) Representação do arranjo instrumental do espectrofotômetro da Hitachi modelo Double Beam U-2900. Fonte60, imagem modificada
(a) (b)
Figura 15 – (a) Espectrofotômetro modular da Ocean Optics modelo Red Tide USB650, localizado no Laboratório de Fotofísica Molecular no Departamento de Física da Universidade Federal de Ouro Preto. (b) Representação do sistema de detecção do espectrofotômetro modular Ocean Optics Red Tide USB650. Fonte61
A intensidade de absorção do material (absorbância, A) depende do número de moléculas que possuem iguais capacidades de absorção e estão situados no caminho óptico do feixe de radiação eletromagnética. A absorbância pode ser obtida pela equação:
.
/
, ( 7 )onde, I0 é a intensidade de luz monocromática incidente, IT é a intensidade de luz transmitida,
() é o coeficiente de absorção molar [L mol-1 cm-1], l é o caminho óptico [cm] e é a concentração molar da amostra [mol L-1]. Essa teoria é conhecida como lei de Beer-Lambert,59,62 e a partir dela foi possível estimar o valor do coeficiente de absorção molar da AlOHPc.
4.2 ESPECTROSCOPIA DE FLUORESCÊNCIA ESTACIONÁRIA
permitindo registrar no detector a intensidade de fluorescência em função do comprimento de onda.
Para o estudo da fluorescência da AlOHPc foram utilizados dois espectrofluorímetros da Shimadzu modelo RF-5301PC (Figura 16). Um dos espectrofluorímetros utilizado está localizado no Laboratório de Fotofísica Molecular no Departamento de Física da Universidade Federal de Ouro Preto, neste equipamento foram realizados as medidas de fluorescência da AlOHPc em diferentes proporções volumétricas de etanol/água (v/v) e da nanoesfera polimérica contendo AlOHPc. O outro espectrofluorímetro encontra-se no Grupo de Polímeros “Prof. Bernhard Gross” no Instituto de Física de São Carlos da Universidade de São Paulo e neste equipamento foram realizados as medidas de fluorescência da AlOHPc em diferentes solventes e da AlOHPc em diferentes concentrações.
Estes espectrofluorímetro são compostos por: fonte de radiação eletromagnética posicionado a 90º do detector, dois monocromadores sendo um para selecionar o comprimento de onda de emissão da amostra e o outro para o comprimento de onda da excitação. Com a possibilidade de baixa intensidade do sinal de emissão, os espectrofluorímetros operam com tubos fotomultiplicadores para amplificação do sinal. A configuração típica dos espectrofluorímetros é representada na Figura 17.62,63
Figura 17 – Representação do espectrofluorímetro
A intensidade de fluorescência (IF) de uma molécula florescente é proporcional à
concentração, e esta relação pode ser estimada pela seguinte equação9:
( ) ( ) ( )* , ( ) -+ ( 8 )
ou pode ser dada em função do valor da absorbância do composto9:
( ) ( ) ( ){ ( )} ( 9 )
sendo, exc é o comprimento de onda excitação, emi é o comprimento de onda de emissão,
I0(exc) é a intensidade do feixe incidente sobre a amostra, () é o coeficiente de absorção
molar no comprimento de onda, A(exc) é a absorbância no comprimento de onda de
excitação, F(exc) é a variação da intensidade de fluorescência por comprimento de onda com
condição normalizada (∫ ( ) ) e k é um fator instrumental relacionados aos
parâmetros do equipamento.
No entanto, fatores como a transferência de energia radiativa entre moléculas da mesma espécie (item 1.2) e efeito de filtro interno podem causar a diminuição da intensidade de fluorescência esperada. O efeito de filtro interno ocorre devido à solução apresentar um alto número de moléculas (alta concentração), ocasionando à atenuação do feixe de radiação incidente, ou seja, o feixe de radiação não irradia proporcionalmente a mesma quantidade de moléculas.9
4.3 ESPALHAMENTO DE LUZ RESSONANTE
As medidas de espelhamento de luz ressonante foram realizadas utilizando o espectrofluorímetro da Shimadzu modelo RF-5301PC, localizado no Laboratório de Fotofísica Molecular no Departamento de Física da Universidade Federal de Ouro Preto. O espalhamento de luz ressonante foi utilizada no estudo da AlOHPc em diferentes proporções volumétricas de etanol/água destilada (v/v).
A técnica de espalhamento de luz ressonante (do inglês, Resonant Light Scattering –
RLS) consiste da interação das moléculas com a radiação eletromagnética. Essa técnica tem se mostrado extremamente útil devido a sua alta sensibilidade e seletividade na verificação da existência de agregados (dímeros, trímeros, entre outros). De acordo com Pasternack e colaboradores,64,65 o aumento do sinal de espalhamento na região espectral de absorção indica a formação de espécies de moléculas agregadas. O espectro experimental de RLS das moléculas monomoleculares é diferenciado do espectro de moléculas agregadas por apresentar um mínimo local devido à “perda de fótons” via absorção superpondo-se a qualquer sinal de espalhamento, ou seja, o aumento da intensidade da luz espalhada no comprimento de onda indica espécies de agregados com transição eletrônica.
Os espectros de RLS foram obtidos realizando inicialmente a medida da solução pura (sem AlOHPc) e depois das soluções contendo AlOHPc. Os espectros foram registrados com o detector do equipamento posicionado a 90º da fonte de radiação eletromagnética, durante a varredura simultânea dos monocromadores de excitação e de emissão, ou seja, ambos ajustados inicialmente com mesmo comprimento de onda (=0) varrendo automaticamente a região entre 300 até 900 nm.