INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE
EGAS MONIZ
MESTRADO INTEGRADO EM MEDICINA DENTÁRIA
CARACTERIZAÇÃO DE REVESTIMENTOS DE NITRETO DE
TITÂNIO PARA IMPLANTES DENTÁRIOS E ADITAMENTOS
PROTÉTICOS
Trabalho submetido por
Patrícia Domingues Prior Neves
para a obtenção do grau de Mestre em Medicina Dentária
INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE
EGAS MONIZ
MESTRADO INTEGRADO EM MEDICINA DENTÁRIA
CARACTERIZAÇÃO DE REVESTIMENTOS DE NITRETO DE
TITÂNIO PARA IMPLANTES DENTÁRIOS E ADITAMENTOS
PROTÉTICOS
Trabalho submetido por
Patrícia Domingues Prior Neves
para a obtenção do grau de Mestre em Medicina Dentária
Trabalho orientado por
Professor Doutor Hélder José Nunes da Costa
e coorientado por
Professor Doutor Paulo Rogério Figueiredo Maia
"A tarefa não é tanto ver aquilo que ninguém viu, mas pensar o que ainda ninguém pensou sobre aquilo que toda a gente viu."
DEDICATÓRIA
Aos meus pais, por acreditarem sempre em mim, por todo o apoio incondicional e todos
os ensinamentos e valores que me transmitiram. Por serem os meus pilares e a minha
grande força e me permitirem seguir o meu sonho apesar de ter seguido uma área bem
diferente da praticada pela família em geral. Que este trabalho seja o início de um grande
projeto que juntos poderemos vir a desenvolver.
À minha irmã Inês, pela enorme amizade e compreensão.
Ao meu Noivo, pelo carinho e paciência infinita e pela transmissão de confiança e de
força, em todos os momentos.
A eles, dedico todo este trabalho e espero que o culminar desta etapa, possa, de alguma
AGRADECIMENTOS
Esta secção não me permite agradecer, como devia, a todas as pessoas que, ao longo do
meu Projeto Final do Mestrado Integrado em Medicina Dentária me ajudaram, direta ou
indiretamente, a cumprir os meus objetivos e a realizar mais esta etapa da minha formação
académica. No entanto, não posso deixar de mencionar algumas pessoas, sem as quais
este projeto não seria possível.
Ao meu Orientador Professor Doutor Hélder Costa e ao meu Co-Orientador Professor
Doutor Paulo Maia do Instituto Superior de Ciências da Saúde Egas Moniz (ISCSEM),
pela confiança e apoio que depositaram em mim, pela permanente disponibilidade,
dedicação, paciência, incentivo e conhecimento transmitido ao longo deste trabalho.
Ao meu Co-Orientador Professor Doutor Pedro Graça do I3N da Universidade de Aveiro
pela disponibilidade e apoio dado a este projeto.
Ao meu Co-Orientador Professor Doutor João Borges da FCT/Universidade Nova de
Lisboa pela disponibilidade e apoio no desenvolvimento de vários ensaios.
À Co-Orientadora Engenheira Alice Marciel da Empresa/Departamento de Engenharia
de Materiais da Universidade de Aveiro por contribuir imensamente com comentários,
pesquisa de artigos, sugestões, realização de ensaios e críticas positivas.
Ao Professor Jorge Silva, da FCT/Universidade Nova de Lisboa, pela disponibilidade,
contributo nos testes biológicos e auxílio na interpretação de resultados.
Às Universidades envolvidas, Universidade de Aveiro, Faculdade de Ciências e
Tecnologias (FCT)/Universidade Nova de Lisboa e em especial ao Instituto Superior de
Ciências da Saúde Egas Moniz por permitirem a realização deste projeto.
À empresa Prirev e a todos os colaboradores, pelo revestimento das amostras.
Aos meus amigos Diogo, Filipa, Francisco, Madalena e Rute que conheci neste percurso
académico, por toda a amizade e momentos que partilhámos.
Aos meus Familiares e Noivo, pelos ensinamentos e por serem a razão da minha
perseverança e coragem.
RESUMO
Introdução: O titânio é conhecido pelas excelentes características como
biocompatibilidade, resistência à corrosão, baixa citotoxicidade e por potenciar a
osteointegração, sendo o biomaterial de eleição para implantes dentários. Apesar das
distintas características têm sido mencionadas algumas limitações. Neste contexto, o
nitreto de titânio afigura-se um substituto promissor, respondendo com melhorias
estéticas, biomecânicas, promovendo o crescimento celular e reduzindo a adesão
bacteriana.
Objetivos: Caracterização da superfície de implantes e aditamentos protéticos, revestidos
com nitreto de titânio, do ponto de vista mecânico, químico e biológico; comparação com
a superfície de implantes revestidos a titânio.
Materiais e Métodos: Comparação e análise de dois implantes e dois aditamentos
protéticos de cada revestimento (nitreto de titânio e multicamada de zircónio, carbonitreto
de zircónio e nitreto de titânio), depositados pelo método PVD. Adicionalmente, a mesma
metodologia foi aplicada e comparada em amostras comerciais. A caracterização da
superfície envolveu os seguintes testes: difração de raio-X; perfilometria ótica;
microscopia eletrónica de varrimento com espectrometria de energia dispersiva de
raio-X; teste de pull-off; teste de citotoxicidade, teste de adesão e proliferação celular; teste da fosfatase alcalina e imunofluorescência.
Resultados: Os implantes com revestimento de nitreto de titânio apresentam melhores
características mecânicas, químicas e principalmente biológicas; a adesão dos
revestimentos em estudo não revela destacamento do substrato quando aplicada uma
força inferior a 2,8 MPa; a porosidade inerente ao substrato é considerada controlada e
reprodutível; o filme de nitreto de titânio revela elevada capacidade de adesão e
proliferação celular, tal como ausência de citotoxicidade celular; a morfologia das células
não é afetada e há evidências de atividade metabólica indutora de mineralização.
Conclusão: O revestimento nitreto de titânio abre perspetivas futuras em relação a
substratos metálicos diferentes de titânio na área da Medicina Dentária.
ABSTRACT
Introduction: Titanium as a coating material distinguishes itself by its above average
biocompatibility, resistance to corrosion, low cytotoxicity and for better enhancing
osseointegration, being therefore the biomaterial of choice for this purpose. Despite the
different characteristics, some limitations were mentioned. As such, titanium nitride has
been suggested as a solution for these limitations, by improving aesthetics and
biomechanical properties of titanium, as well as by boosting cell growth and reducing
bacterial adhesion.
Objectives: Characterization of the implants and prosthetic devices’ surface, coated with
titanium nitride, from a mechanical, chemical and biological perspective; comparison of
the latter with titanium coated implants.
Materials and Methods: Comparison and analysis of two implants and two prosthetic
devices, one of each coated with the titanium nitride compound, and the remaining coated
with a multilayer composed of zirconium, zirconium carbonitride and titanium nitride
(deposited by the PVD method). Additionally, the same methodology was applied by
benchmarking the sample against commercially available equivalents. The surface
characterization involved the following tests: X-ray diffraction; optical profilometry;
scanning electron microscopy with X-ray dispersive energy spectrometry; pull-off test;
cytotoxicity test, adhesion test and cell proliferation; alkaline phosphatase test and
immunofluorescence.
Results: Implants with titanium nitride coating displayed better mechanical, chemical ,
and biological characteristics; coatings’ adhesion studied did not displayed signs of
substrate detachment when forces of less than 2.8 MPa were applied; substrate’s porosity
is considered controlled and reproducible; titanium nitride film shows high levels of
cellular adhesion and proliferation with no cytotoxicity; cell’s morphology was not
affected and it was found evidence of metabolic activity inducing mineralization.
Conclusion: Titanium nitride exhibits high potential among the metallic substrates, other
than titanium, for applications in the field of Dentistry.
ÍNDICE GERAL
I. INTRODUÇÃO ... 13
II. ESTADO DE ARTE ... 15
2.1. EDENTULISMO ...15
2.1.1. REABILITAÇÃO ORAL DE ESPAÇOS EDÊNTULOS ...16
2.2. IMPLANTOLOGIA ...18
2.2.1. IMPLANTE ...19
2.4. BIOCOMPATIBILIDADE ...22
2.4.1. CITOTOXICIDADE ...23
2.5. MATERIAIS BIOCOMPATÍVEIS ...24
2.5.1. MATERIAS USADOS EM IMPLANTOLOGIA ...24
2.5.1.1. TITÂNIO...26
2.6. REVESTIMENTO E TRATAMENTO DE SUPERFÍCIE ...27
2.6.1. NITRETO DE TITÂNIO...29
III. OBJETIVOS ... 31
IV. HIPÓTESES... 32
V. MATERIAIS E MÉTODOS ... 35
5.1. TIPO DE ESTUDO ...35
5.2. LOCAL DE REALIZAÇÃO DO PROJETO ...35
5.3. APROVAÇÃO E CONDIÇÕES ...35
5.4. AMOSTRAS ...35
5.5. MATERIAIS ...37
5.6. METODOLOGIA ...37
5.6.1. PROCESSO DE DEPOSIÇÃO DO FILME ...37
5.6.2. MÉTODOS DE ANÁLISE DE SUPERFÍCIE ...42
5.6.2.1. DIFRAÇÃO DE RAIO X (DRX) ...42
5.6.2.3. MICROCOPIA ELETRÓNICA DE VARRIMENTO (SEM) ...44
5.6.2.4. ESPECTROSCOPIA DE RAIO-X POR DISPERSÃO DE ENERGIA (EDXS)………...……...…. 45
5.6.3. TESTES MECÂNICOS ...45
5.6.3.1. TESTE DE “PULL-OFF”– ADESÃO ...45
5.6.4. TESTES BIOLÓGICOS ...47
5.6.4.1. TESTE DE CITOTOXICIDADE...48
5.6.4.2. ADESÃO E PROLIFERAÇÃO CELULAR ...50
5.6.4.3. FOSFATASE ALCALINA ...53
4.5.1.1. ANÁLISE DA MORFOLOGIA – IMUNOFLUORESCÊNCIA ...54
VI. RESULTADOS ... 59
6.1. ANÁLISE DA SUPERFÍCIE ...59
6.2. TESTES BIOLÓGICOS ...72
6.2.1. TESTE DE CITOTOXICIDADE ...72
6.2.2. ADESÃO E PROLIFERAÇÃO CELULAR ...72
6.2.3. FOSFATASE ALCALINA – ALP ...74
6.2.4. ANÁLISE DA MORFOLOGIA – IMUNOFLUORESCÊNCIA...75
VII. DISCUSSÃO ... 79
VIII. CONCLUSÃO ... 85
ÍNDICE FIGURAS
Figura 1: Barómetro Nacional de Saúde Oral, em reposta à pergunta: Q2. ...16
Figura 2: Barómetro Nacional de Saúde Oral, em reposta à pergunta: Q2.1. ...17
Figura 3: Diferentes tipos de desenho do corpo do implante da categoria de implantes de “forma radicular”. ...19
Figura 4: Classificação dos tipos de osso preconizada por Mish. ...22
Figura 5: Fotografia de uma mandíbula que data 600 a.C. ...25
Figura 6: Ilustração do processo de PVD. ...37
Figura 7: Ilustração do processo de deposição por arco catódico. ...39
Figura 8: Máquinas usadas no processo de revestimento das amostras. ...39
Figura 9: Ilustração da difração de raios-X. ...43
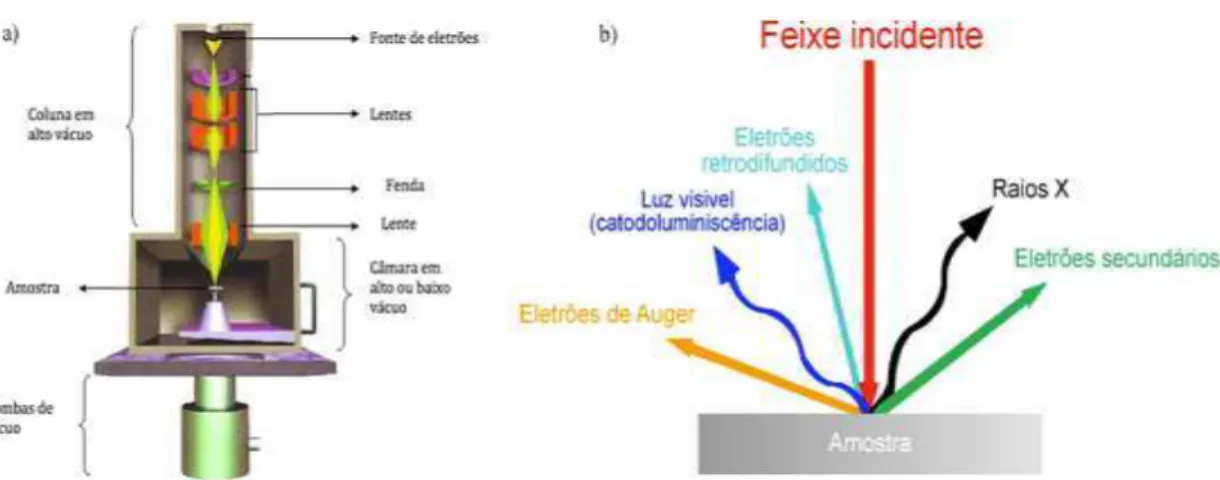
Figura 10: a) Princípio de geração do feixe de eletrões num sistema SEM; b) Interação do feixe de eletrões com a matéria. ...45
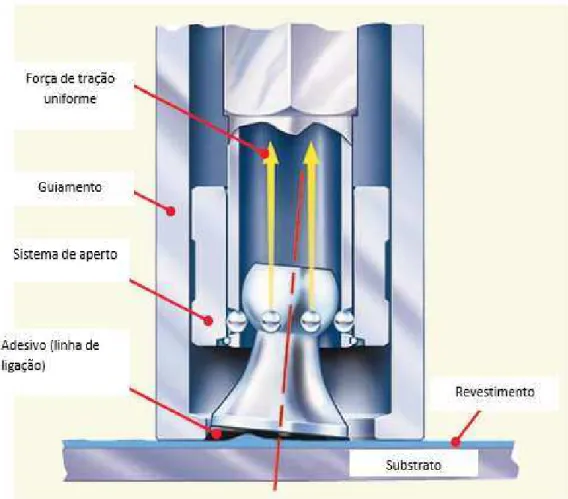
Figura 11: Esquematização do princípio de funcionamento do equipamento usado para determinar a adesão dos filmes de TiN. ...46
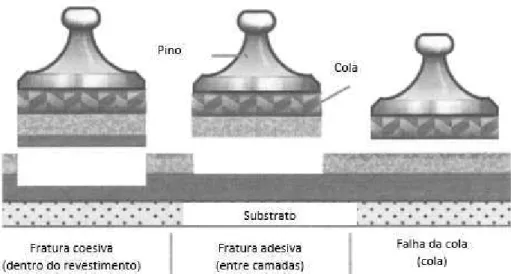
Figura 12: Esquematização representativa da análise visual do tipo de fratura no teste de adesão. ...47
Figura 13: Câmara de Neubauer para contagem de células. ...49
Figura 14: Leitor de microplacas usado na leitura da absorvância. ...50
Figura 15: Redução da resazurina a resorufina. ...52
Figura 16: Espetros de absorvância da resazurina e da resorufina. ...53
Figura 18: Micrografias dos implantes e dos aditamentos protéticos com ampliação de
25 x: monocamada de TiN (1), multicamada Zr/ZrCN/TiN (2) e comercial (3)...59
Figura 19: Mapeamento de EDXS dos implantes e aditamentos protéticos: monocamada
de TiN (1), multicamada Zr/ZrCN/TiN (2) e comercial (3). ...60
Figura 20: Espetro de difração raio-X por ângulo rasante dos filmes TiN e Zr/ZrCN/TiN,
depositados num substrato de silício. . ...62
Figura 21: Micrografias dos filmes depositados. a) TiN e b) Zr/ZrCN/TiN, depositados
num substrato de silício. ...63
Figura 22: Micrografias do filme de TiN a duas ampliações 1 kx e 10 kx, depositados
num substrato de silício. ...63
Figura 23: Micrografias do filme de Zr/ZrCN/TiN a 10 kx, depositado num substrato de
silício. ...64
Figura 24: Mapeamento de EDXS e respetiva indexação elementar do filme de TiN,
depositado num substrato de silício. ...64
Figura 25: Mapeamento de EDXS e respetiva indexação elementar do filme de
Zr/ZrCN/TiN, depositado num substrato de silício. ...65
Figura 26: Mapeamento de EDXS e respetiva indexação elementar dos implantes
HI-TEC Implants® sem deposição, com deposição de TiN e com deposição de Zr/ZrCN/TiN.
...66
Figura 27: Mapeamento de EDXS e respetiva indexação elementar do implantes HI-TEC
Implants® com deposição de TiN e do implante Exaktus® Cilíndricos Biodent HEX RP
comercial. ...67
Figura 28: Resultados da Perfilometria referentes às amostras do implante HI-TEC
Implants® com revestimento de TiN, do implante HI-TEC Implants® com o revestimento
de Zr/ZrCN/TiN e do implante Exaktus® Cilíndricos Biodent HEX RP comercial. . ....68
Figura 29: Resultados da Perfilometria referentes às amostras do silício com
Figura 30: Resultados da Perfilometria referentes às amostras do silício com
revestimento de Zr/ZrCN/TiN. ...69
Figura 31: Resultados obtidos no teste de adesão para o revestimento de TiN (à direita) e Zr/ZrCN/TiN (à esquerda). ...70
Figura 32: Esquematização gráfica dos resultados obtidos no teste de adesão e proliferação celular. ...73
Figura 33: Resultados obtidos no teste ALP para as amostras de TiN. ...74
Figura 34: Resultados obtidos no teste ALP para as amostras de Zr/ZrCN/TiN. ...75
Figura 35: Resultados da marcação da imunofluorescência para o filme de TiN. ...76
Figura 36: Resultados da marcação da imunofluorescência para o revestimento de Zr/ZrCN/TiN. ...77
ÍNDICE DE TABELAS
Tabela 1: Tabela descritiva das amostras usadas no projeto... 36
Tabela 2: Parâmetros de deposição do revestimento com TiN. ... 41
Tabela 3: Parâmetros de deposição do revestimento com Multicamadas Zr/ZrCN/TiN.
... 41
Tabela 4: Especificações dos anticorpos e marcadores utilizados. ... 57
Tabela 5: Resultados de viabilidade celular relativa ao controlo negativo obtidos no teste
de citotoxicidade para os revestimentos em estudo. ... 72
Tabela 6: Resultados do teste de Adesão e Proliferação Celular para as amostras de TiN,
LISTA DE ABREVIATURAS
ABS - Acrilonitrila Butadieno Estireno
ALP - Fosfatase Alcalina
BNSO - Barómetro Nacional de Saúde Oral
BSA - Albumina de Soro Bovino
C - Carbono
DMF - Naftol AS-MX Fosfato/N,N Dimetillformamida
DMSO - Dimetilsulfóxido
DRX - Difração de raios-X
EDXS - Espectroscopia de raio-X por Dispersão de Energia
FCT - Faculdade de Ciências e Tecnologias
Fe - Ferro
H - Hidrogénio
IF –Imunofluorescência
ISCSEM– Instituto Superior de Ciências da Saúde Egas Moniz N - Azoto
NiT - Nitreto de Titânio
OMD - Ordem dos Médicos Dentistas
O - Oxigénio
PBS - Tampão Fosfato Salino
PVD - Deposição Física em Vapor de Fase
SEM - Microcopia eletrónica de varrimento
Ti - Titânio
TiO2 - Dióxido de Titânio
I.
INTRODUÇÃO
O impacto do edentulismo na saúde e bem-estar da população é um problema atual e que
requer intervenção.
A falta de confiança e conforto, associados frequentemente ao uso de próteses removíveis,
estão relacionados com embaraços e estigmas sociais que limitam significativamente a
qualidade de vida do paciente. Nesse sentido, a implantologia tem assumido um papel
crucial na reabilitação oral de pacientes com espaços edêntulos, com o intuito de
restabelecer a estética e a função mastigatória.
As vantagens dos implantes são notórias, quer do ponto de vista funcional quer do
estético, e o seu cariz fixo contribui de forma positiva para um incremento significativo
da autoconfiança do paciente. Assim sendo, é necessário compreender e analisar as
características e a influência dos materiais que existem atualmente, assegurando a sua
perpetuidade e biointegração.
A osteointegração de um implante dentário depende da biocompatibilidade do material e
das suas propriedades inerentes (químicas, físicas e estruturais), sendo a resposta celular
e a cicatrização óssea peri-implantar, na interface implante-osso, frequentemente afetada
pela topografia e rugosidade da superfície do implante.
Em Medicina Dentária, o titânio (Ti) é conhecido pelas excelentes características como
biocompatibilidade, resistência à corrosão, baixa citotoxicidade e por potenciar a
osteointegração, sendo o biomaterial de eleição para este fim.
Apesar das distintas características têm sido mencionadas algumas limitações. Para
contornar essas limitações, o nitreto de titânio (TiN) foi sugerido com o intuito de
melhorar a estética e as propriedades biomecânicas, promovendo o crescimento celular e
reduzindo a adesão bacteriana, tornando este composto um substituto promissor.
No que diz respeito à produção deste composto, o método de PVD (Deposição Física em
Vapor de Fase) apresenta vantagens singulares. Este método permite formar uma camada
quase perfeita, que não se desintegra nem afeta a topografia da superfície do material
Tendo em conta estas características e, uma vez que este composto já é usado na área da
Medicina em instrumentos cirúrgicos e dispositivos médicos, pretende-se com este estudo
revelar a caracterização da superfície de implantes dentários e de aditamentos protéticos,
revestidos com TiN, comparando-a à superfície de implantes dentários e aditamentos
protéticos de Titânio, comumente comercializados.
No seguimento desta investigação avaliou-se o revestimento de dois implantes e dois
aditamentos protéticos revestidos com o composto de TiN e de dois implantes e dois
aditamentos protéticos revestidos com por um composto constituído por três diferentes
camadas, zircónio, carbonitreto de zircónio e nitreto de titânio (Zr/ZrCN/TiN),
depositadas de forma consecutiva.
As amostras de aditamentos protéticos e de implantes foram cedidas por empresas. O
revestimento das amostras foi realizado na empresa Prirev – Equipamentos e Revestimentos Técnicos e a sua caracterização foi efetuada nos Departamentos de Física e Engenharia de Materiais da Universidade de Aveiro, FCT/Universidade Nova de Lisboa
e Instituto Superior de Ciências da Saúde Egas Moniz.
A estruturação e o estado de arte do projeto final assentaram numa fundamentação teórica
lógica e sequencial, através da revisão literária cuidada e com recurso a livros da
II.
ESTADO DE ARTE
2.1. EDENTULISMO
O edentulismo é definido pela ausência parcial ou total de dentes, congénita ou adquirida
e apresenta-se como uma condição debilitante e irreversível.
A cárie, a doença periodontal e o trauma são as condições clínicas que constituem os
principais motivos da perda dentária (Craddock, 2009). Além das causas clínicas, fatores
demográficos, socioeconómicos, hábitos genéricos e de saúde oral e o acesso a cuidados
de saúde têm sido frequentemente relacionados (Batista, Lawrence, & de Sousa, 2015;
Emami, de Souza, Kabawat, & Feine, 2013; Montandon, Zuza, & de Toledo, 2012).
O número de peças dentárias e a posição que ocupam na arcada dentária pode ter uma
série de consequências deletérias na saúde oral e na qualidade vida do indivíduo, (Batista
et al., 2015; Emami et al., 2013) que se podem expressar pela diminuição da capacidade
mastigatória e fonética, pelos prejuízos nutricionais, estéticos e psicológicos que
interferem significativamente com a autoestima e integração social (Agostinho, Silveira,
& Campos, 2015).
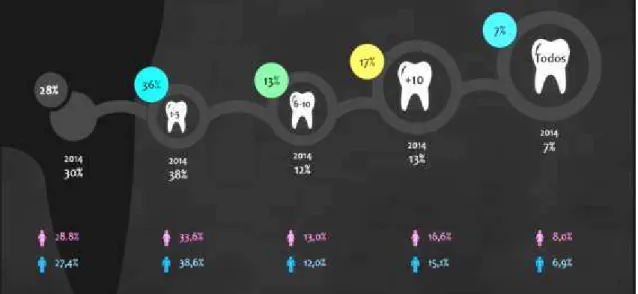
Em Portugal, segundo o Barómetro Nacional de Saúde Oral (BNSO) de 2015 (tendo sido
utilizada uma amostra desproporcional estratificada para garantir uma margem de erro
baixa nos resultados globais) dos portugueses inquiridos, apenas 28% têm a dentição
completa, com exceção dos dentes do siso. Em 2014, 32% dos portugueses inquiridos
afirmaram que têm falta de mais do que 6 dentes naturais, valor este que se mostrou
crescente no BNSO de 2015, com um percentual de 37%, indicando uma tendência
crescente no que diz respeito à perda de peças dentárias (figura 1) (OMD, 2015).
O tratamento desta condição pressupõe a reabilitação protética, existindo diversas
Figura 1:Barómetro Nacional de Saúde Oral de 2015, em reposta à perguntaμ “Q2. Com exceção dos dentes do siso, tem falta de dentes naturais?” (disponível em https://www.omd.pt/barometro/docs/ barometrosaudeoral2015.pdf).
2.1.1. REABILITAÇÃO ORAL DE ESPAÇOS EDÊNTULOS
A reabilitação, após a perda de uma peça dentária, é fundamental para o restabelecimento
da função e da manutenção dos dentes adjacentes e oponentes. Os pacientes nem sempre
estão conscientes das opções terapêuticas de substituição dentária e a reabilitação deve
ser restabelecida num curto espaço de tempo após a perda (Craddock, 2009).
A Prótese ou Reabilitação Oral é a área da Medicina Dentária responsável pela
reabilitação do sistema estomatognático, que pressupõe a substituição artificial de um ou
mais dentes naturais, parte de um dente, ou estruturas associadas por razões estéticas,
funcionais, ou ambas (Boucher & Zwemer, 1993).
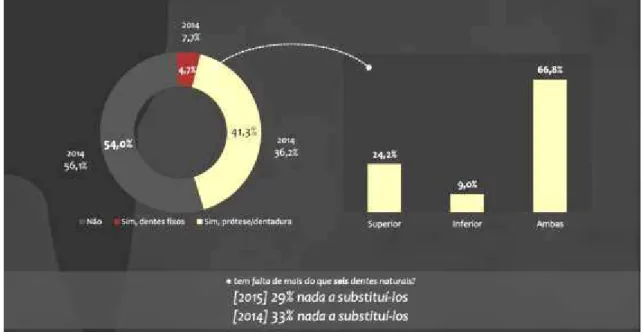
No mesmo estudo realizado pela Ordem dos Médicos Dentistas (OMD) no BNSO em
2015, averiguou-se que 54,0% dos portugueses não possuem reabilitação oral dos espaços
edêntulos e apenas 4,7% possuem reabilitação fixa, representando uma quebra de 3
Figura 2: Esquematização do Barómetro Nacional de Saúde Oral de 2015, em reposta à perguntaμ “Q2.1. Tem algo a substituí-los?” (disponível em https://www.omd.pt/barometro/docs/barometrosaudeoral2015. pdf).
A escolha do tratamento reabilitador depende de fatores como o número de elementos em
falta e integrantes, o suporte e a respetiva relação com as estruturas adjacentes, a
experiência do clínico e a vontade e disponibilidade do paciente. A esquematização que
se segue resume as diferentes abordagens de tratamento praticáveis (Shillingburg, 2012).
No que diz respeito à prótese fixa, os implantes dentários osteointegrados são uma opção
até 96,8% (Charyeva, Altynbekov, Zhartybaev, & Sabdanaliev, 2012; Jung et al., 2008).
No entanto, reabilitar dentes com implantes continua a ser um desafio, particularmente
na região anterior, onde tanto o sucesso estético quanto o funcional são exigidos (Guez,
2002; Sadan, Blatz, Salinas, & Block, 2004).
As próteses implantossuportadas oferecem diversas vantagens quando comparadas com
reabilitações removíveis e suportadas por tecido mole. O quadro que se segue lista as
vantagens inerentes a este tipo de reabilitação:
2.2. IMPLANTOLOGIA
O grande desafio da Medicina Dentária tem sido a pesquisa de procedimentos menos
traumáticos e mais efetivos do ponto de vista funcional e estético na reabilitação de
pacientes (Costa, Sousa, Lucena, & Souza, 2015). Neste contexto, surgiu a Implantologia
como especialidade da Medicina Dentária, dedicada a restabelecer a função e a estética
perdida, através da implantação cirúrgica de implantes em titânio e posterior colocação
de peças protéticas de substituição.
A cirurgia é a área mais antiga da Medicina Dentária e a implantologia a segunda mais
antiga. A implantologia moderna foi desenvolvida no final de 1960 com base nos estudos
de Bränemark, passando a ser uma ciência evidente e bem documentada (Rodriguez y
Baena, Rizzo, Manzo, & Lupi, 2017).
VANTAGENS DAS PRÓTESES IMPLANTOSSUPORTADAS:
o Manutenção do osso
o Manutenção da dimensão vertical oclusal o Posicionamento estético do dente
o Oclusão adequada
o Melhoria da saúde psicológica
o Recuperação da propriocepção o Aumento da estabilidade o Aumento da retenção
o Melhoria da fonética
o Redução do tamanho da prótese removível o Aumento do índice de sucesso da prótese o Aumento do tempo de duração da restauração o Melhoria da função da prótese
o Manutenção dos músculos da mastigação e da expressão facial
A implantação é definida como “a inserção de qualquer objeto ou material, como uma substância aloplástica ou outro tecido, parcialmente ou completamente no corpo, com objetivos terapêuticos, diagnósticos, protéticos ou experimentais.” Devemos distinguir implantação de reimplantação (reinserção na posição pré-avulsão acidental ou
intencional) e transplantação (transferência de um tecido, órgão ou parte dele para outra
parte do corpo do mesmo indivíduo) (Anusavice, Shen, & Rawls, 2013).
2.2.1. IMPLANTE
Os implantes dentários têm uma forma cilíndrica idêntica a de um parafuso e são
colocados estrategicamente na maxila e/ou mandíbula com a finalidade de auxiliar a
reabilitação das estruturas orofaciais perdidas. São compostos por dois componentes: o
corpo do implante, que é introduzido cirurgicamente no osso, e o pilar transmucoso
(aditamento protético) que faz a ligação entre o corpo do implante e o elemento protético.
Macroscopicamente, o desenho do corpo do implante pode ser cilíndrico, rosqueável,
nivelado, perfurado, sólido, oco ou aberto, com ou sem espiras. A superfície pode
apresentar-se lisa e sem revestimento, revestida ou texturizada (Babbush, Hahn, Krauser,
& Rosenlicht, 2010).
Figura 3: Diferentes tipos de desenho do corpo do implante da categoria de implantes de “forma radicular”,
cujo o corpo utiliza uma coluna óssea vertical (C. E. Misch, 2006).
A história dos implantes com esta configuração específica data de milhares de anos e
compreende civilizações antigas como a chinesa que há 4.000 anos esculpiam e
martelavam brotos de bambu no osso, os egípcios há 2.000 anos e, mais recentemente, há
1.500 anos, os incas que esculpiam conchas do mar em estacas e fixavam-nas dentro do
A Academia Americana de Implantologia em conjunto com outras Instituições de Saúde
reconheceram, em 1988, o termo forma radicular para a categoria de implantes endósseos que se assemelham a raízes de dentes naturais (The JOI Glossary of Terms, 2016).
Na atualidade, existem inúmeros formatos disponíveis que oferecem distintas
combinações de desenho do corpo do implante, diâmetro, formato da plataforma,
comprimento, conexões protéticas, interfaces e condições de superfície. As diferentes
micro e macro características, ao serem combinadas entre si, criam uma diversidade
incalculável de desenhos e configurações possíveis (Alcoforado & Redinha, 2008; Misch,
2011).
A colocação do implante é um procedimento cirúrgico, com diferentes técnicas descritas
na literatura. A mais comum compreende duas fases distintas: a primeira compreende o
levantamento de um retalho mucoperiósseo, preparação do leito implantar, colocação do
implante com um parafuso de cicatrização e recobrimento do implante com o retalho e
respetiva sutura. O implante fica recoberto por mucosa entre 3 a 6 meses para que ocorra
a osteointegração; na segunda fase cirúrgica o implante é exposto e o parafuso de
cicatrização é substituído pelo pilar transmucoso, sobre o qual irá assentar o elemento
protético. Existem, no entanto, outros protocolos como a carga imediata ou a colocação
imediata em alvéolo pós-extração.
O desenho do implante tem como propósito alcançar a fixação clínica rígida
correspondente ao contacto direto da interface osso-implante, microscopicamente, sem
interposição de tecido fibroso. Não existe um sistema perfeito e a escolha pode ser
desconcertante. O clínico facilmente pode ser tentado a optar por um sistema novo com
características mais apelativas ou economicamente mais rentáveis. O sucesso do
tratamento com recurso a implantes depende da experiência clínica e da escolha adequada
do sistema a cada paciente (Alcoforado & Redinha, 2008).
Albrektsson propôs os seguintes critérios para o sucesso mínimo:
Os implantes endósseos são fruto de um longo processo de investigação levado a cabo
por Bränemark, em 1969.
“A osteointegração envolve a ancoragem de um implante pela formação de tecido ósseo ao redor do implante sem crescimento de tecido fibroso na interface osso-implante” (Albert, Behrmann, & Barash, 1999).
A arquitetura do colagénio, presente na matriz óssea, é o principal determinante das
propriedades mecânicas dos tecidos. Aquando da colocação cirúrgica do implante, existe
um efeito na disposição do osso periimplantar que se traduz pela aplicação de uma tensão
na interface (Davies, 1998; Delgado‐Ruiz et al., 2015; Wang, Bank, TeKoppele, & Agrawal, 2001).
Verificou-se, através de estudos, que superfícies rugosas beneficiam a osteointegração
devido à adesão inicial de proteínas não-colagénicas do osso, como a osteopontina e a
sialoproteína, que migram para o local da lesão, bem como a nucleação do fosfato de
cálcio nos locais de ligação do cálcio destas mesmas proteínas (Boerboom et al., 2007).
A osteointegração e consequente remodelação óssea envolve funções celulares
sequenciais (fixação celular, migração e proliferação seguida da expressão de marcadores
do fenótipo osteoblasto e a síntese, a deposição e a mineralização de uma matriz óssea),
regulados por hormonas sistémicas e pela produção de fatores locais. A vascularização e
a existência de um estímulo adequado são fundamentais para este processo (Davies,
Albrektsson et al., em 1981, correlacionou alguns fatores que afetam diretamente o processo de osteointegração: a biocompatibilidade do material; o desenho do implante;
as características de superfície do implante; o estado do leito implantar; a técnica cirúrgica
utilizada e, por fim, as condições de carga aplicadas sobre o implante após a sua colocação
(Alcoforado & Redinha, 2008).
O tipo de osso é um critério fundamental quando se opta por este padrão de reabilitação.
A classificação de densidade óssea baseia-se em características macroscópicas da cortical
e do trabeculado medular e foi preconizada por Mish em 1998.
▪ I: Osso cortical denso
▪ II: Cortical densa e osso trabeculado grosso
▪ III: Cortical óssea fina e trabeculado fino
▪ IV: Osso trabecular fino
▪ V: Osso não-mineralizado, imaturo (Iezzi et al., 2015)
Figura 4: Classificação dos tipos de osso fundamentada em características macroscópicas da cortical e do trabeculado medular preconizada por Mish em 1998 (disponível em http://www. singularimplants.com.br/ cone-morse-cilindrico).
2.4. BIOCOMPATIBILIDADE
A biocompatibilidade pode ser definida como a capacidade de um material para extrair
uma resposta biológica adequada do hospedeiro numa situação específica (Black, 2005).
A avaliação biológica de dispositivos médicos é realizada para determinar o potencial de
toxicidade resultante do contato dos materiais do dispositivo com o corpo. Os materiais
materiais, produzir efeitos adversos locais ou sistêmicos significativos, ser cancerígenos,
ou, produzir efeitos adversos reprodutivos e de desenvolvimento.
Portanto, a avaliação de qualquer novo dispositivo destinado ao uso humano exige dados
de testes sistemáticos, para garantir que os benefícios fornecidos pelo produto final
superem os riscos potenciais produzidos pelos materiais do dispositivo (FDA, 1998).
A biocompatibilidade pode ser avaliada por testes in vitro e in vivo (Daguano, Santos, &
Rogero, 2007). A avaliação in vitro da biocompatibilidade é realizada por testes de
citotoxicidade (Rogero, Lugão, Ikeda, & Cruz, 2003).
2.4.1. CITOTOXICIDADE
Citotoxicidade é descrita como sendo a capacidade intrínseca de um determinado material
em potenciar alterações metabólicas nas células em cultura, podendo ou não culminar em
morte celular (Rogero et al., 2003).
O teste de citotoxicidade in vitro é classificado segundo a International Standard Organization, ISO 10993-1, como o teste inicial para avaliar biocompatibilidade de materiais para uso de dispositivos médicos (Daguano et al., 2007; Rogero et al.,
2003)(ISO 10993-1:2009).
O uso de culturas de células in vitro tornou-se uma prática recorrente dos laboratórios
responsáveis pelo controlo de qualidade. Os testes in vitro apresentam vantagens quando
comparados aos ensaios in vivo (Rogero et al., 2003): facultam resultados preliminares
relacionados com a interação entre o material e o corpo biológico, de forma rápida e
eficiente, apresentam alta reprodutibilidade e padronização, são financeiramente
acessíveis e minimizam a necessidade de testes em animais pela substituição de linhagens
animais e humanas (Craig & Powers, 2004; Sakaguchi & Powers, 2012).
Em implantologia, a biocompatibilidade e, neste caso, as propriedades citológicas são de
extrema importância. A interação entre células e a superfície do material testado
desempenha um papel importante, assim como a questão de saber se as funções
fisiológicas básicas, ou seja, a capacidade do citoesqueleto para regenerar após a
inoculação e a capacidade das células de se dividir, não foram danificadas.
O caráter da interação célula-material pode ser manifestado de diversas formas. O
ainda assim ser impróprio, devido ao relacionamento interrompido entre as células e o
material testado.
Os principais parâmetros, que indicam a capacidade de osteointegração, dependem de
como as células aceitam o material ou a superfície do material, como as células do
citoesqueleto respondem em termos de regeneração do citoesqueleto, se a resposta celular
ao material é positiva e, até que ponto, a divisão celular é mantida ou limitada (Prachar,
Bartakova, Brezina, Cvrcek, & Vanek, 2015).
2.5. MATERIAIS BIOCOMPATÍVEIS
O Instituto Nacional de Saúde, em 1982, através da Declaração da Conferência de
Desenvolvimento de Consenso, definiu biomaterial como “qualquer substância (diferente
de fármacos) ou combinação de substâncias, de origem sintética ou natural, que podem
ser usadas por qualquer período de tempo e que aumentam ou substituem parcial ou
totalmente qualquer tecido, órgão ou função corporal.”
Os materiais biocompatíveis são especificamente desenvolvidos em função da aplicação
a que se destinam e têm de obedecer a rigorosos parâmetros de segurança e qualidade
para poderem ser aprovados pelas entidades reguladoras.
2.5.1. MATERIAS USADOS EM IMPLANTOLOGIA
Ao longo dos anos, diversos materiais foram testados para a confeção de implantes
dentários. Os primeiros registos coincidem com civilizações antigas que testaram
diferentes artefactos e matérias-primas que permitissem a ancoragem fixa. Na América
Central, 600 a.C., a civilização Maia usou fragmentos de conchas marinhas posicionados
em estacas. Existem ainda, registos que permitem inferir que, já no antigo Egípcio se
usavam metais preciosos e no Médio Oriente brotos de bambu, devido à consequente
Figura 5: Fotografia de uma mandíbula que data 600 a.C., da época Maia, onde foram encontrados, em 3 incisivos, fragmentos de conchas marinhas posicionados em estacas. É possível que tenha sido uns dos primeiros casos de sucesso de implantes realizado no ser humano (Ring & do Nascimento, 1995).
Em implantologia, vários materiais e ligas foram testados como possíveis alternativas.
No entanto, estudos e resultados clínicos demonstraram que o resultado a médio
longo-prazo e a taxa de sucesso eram bastante fracos para os requisitos aceitáveis em Medicina.
O desenho do implante, a conexão protética, a resistência mecânica do material, a
resistência à corrosão, a disponibilidade, as considerações biomecânicas e os
revestimentos/acabamentos de superfície são fatores que devem ser considerados na
escolha do material para implantes (Anusavice, Shen, & Rawls, 2013).
Na atualidade, apenas o Ti comercialmente puro e a liga de Titânio-Alumínio-Vanádio
(Ti6Al4V) apresentam resultados clínicos promissores e literatura que corrobora as suas
2.5.1.1. TITÂNIO
O titânio apresenta-se na tabela periódica como metal de transição leve, com número
atómico 22, peso atómico 47,9 e ligações metálicas. Existe em abundância na natureza e
apresenta-se como elemento puro. O titânio apresenta uma estrutura hexagonal compacta
(HC) designada por Ti-(α) à temperatura ambiente. Quando submetido a temperaturas de
882 ◦C sofre uma transformação alotrópica para a estrutura cúbica de corpo centrado
(CCC), denominada Ti-(β), estruturaque conserva até ao seu ponto de fusão T = 1668 ◦C (Anusavice et al., 2013).
O Ti comercialmente puro apresenta uma pureza na escala dos 98% a 99,5%. A
quantidade de impurezas e de elementos residuais influenciam as propriedades físicas e
determinam a classificação do titânio comercialmente puro (Davis & Metals, 1998).
O titânio e as suas ligas têm sido largamente utilizados como dispositivos biomédicos. As
propriedades do titânio comercialmente puro, como a resistência à degradação
eletroquímica e à fadiga, a biocompatibilidade e resposta biológica favorável, a densidade
baixa, a alta resistência e as excelentes propriedades mecânicas tornam os materiais à
base de titânio grandes atrativos para a Medicina Dentária (Craig & Powers, 2004;
Ikarashi et al., 2005; Ralf‐J Kohal, Att, Bächle, & Butz, 2008).
Relativamente ao seu uso em implantes dentários, a formação de uma camada estável de
dióxido de titânio (TiO2) à superfície, de espessura de 2 a 10 nm, e a baixa sinalização
inflamatória fazem com que seja o material de eleição para este fim (Burkhardt, Joss, &
Lang, 2008; Ikarashi et al., 2005). Estudos inferiram que, no caso de pacientes
medicamente saudáveis, a taxa de sucesso em implantes dentários de titânio é de 90% a
95% (Diz, Scully, & Sanz, 2013).
O óxido que se forma na superfície do Ti ocorre na natureza em três fases distintas:
anatase (tetragonal), brookite (ortorrômbica) e rutilo (tetragonal) (Anusavice et al., 2013).
Surpreendentemente, a fase rutilo demonstra um aumento da resposta de células
osteoblásticas, sendo menos provável que se inicie uma resposta inflamatória.
Verificou-se também, que a dissolução de iões metálicos nesta faVerificou-se tem uma ordem de magnitude
inferior. Estas constatações sugerem que o potencial de biocompatibilidade possa ser
superior às outras fases polimorfas cristalinas (Gaintantzopoulou, Zinelis, Silikas, &
No que diz respeito à estética, principalmente na zona anterior da maxila, a cor cinzenta
do titânio e a descoloração inerente a este material é considerada problemática,
principalmente em biótipos gengivais finos, onde a cor cinzenta se pode evidenciar
através da espessura da mucosa e em recessões gengivais, sendo normal existir perda
vertical de 1 mm na crista alveolar, seguida de 0,1 mm adicional para cada ano
subsequente, na zona periimplantar (Heydecke, Kohal, & Gläser, 1999; Ralf J Kohal,
Weng, Bächle, & Strub, 2004). A recessão e a transparência da fina mucosa resultarão na
visualização progressiva do implante com a exposição desagradável da superfície do
metal de coloração escura (Ajlouni, Elshahawy, Ajlouni, & Sadakah, 2017).
Existem opções terapêuticas para solucionar este problema estético inerente ao uso de
implantes de titânio de que é exemplo o aumento e o enxerto de tecidos, que permite
aumentar a espessura da mucosa e cobrir a exposição ao metal. Ainda assim, o resultado
estético imediato e a longo prazo é imprevisível e dispendioso (Bosco, Bonfante, Luize,
Bosco, & Garcia, 2006; Burkhardt et al., 2008).
Apesar da biocompatibilidade ser reconhecida e ter sido largamente testada, a libertação
e dissolução da superfície da liga de titânio e o aumento da concentração de iões metálicos
na periferia periimplantar e em nódulos linfáticos regionais, responsáveis pelo
desenvolvimento de periimplantites e reações alérgicas, tem levantado dúvidas acerca
desta opção como biomaterial de eleição (Burkhardt et al., 2008; Ralf‐J Kohal et al., 2008; Sridhar et al., 2015).
Mesmo havendo incerteza nas constatações clínicas, estes fatores negativos motivaram
os pesquisadores a melhorar as propriedades físico-químicas e biológicas dos implantes
através de várias modificações de superfície (Lou et al., 2015).
2.6. REVESTIMENTO E TRATAMENTO DE SUPERFÍCIE
A geometria, a topografia superficial e a composição dos substratos são cruciais para o
sucesso a curto e longo prazo dos implantes dentários (Le Guéhennec et al., 2007).
Na tentativa de otimizar e solucionar os problemas com os materiais já existentes, houve
um grande avanço científico no tratamento de superfície dos implantes dentários com o
intuito de aumentar a interação material-osso, biocompatibilidade e melhorar o
No que confere à rugosidade da superfície do implante, vários estudos comprovam um
efeito significativo sobre a integração celular e evidenciam a associação existente entre o
aumento da rugosidade nas superfícies de contacto e o comportamento celular traduzindo
-se, a nível clínico, no aumento da osteointegração (Bornstein, Lussi, Schmid, Belser, &
Buser, 2003; Thalji & Cooper, 2014; Trisi et al., 2003).
O aumento da rugosidade da superfície foi associado a aumentos na expressão de
integrina para as células osteoblásticas, favorecendo a diferenciação dos osteoblastos e a
proliferação celular (Lange et al., 2002). A rugosidade e a microtextura podem influenciar
a disposição das fibras de colagénio na zona de interface implante-osso/tecido,
aumentando o metabolismo, a orientação das células e a sua expressão fenotípica
(Delgado‐Ruiz et al., 2015; Kearns, Williams, Mirvakily, Doherty, & Martin, 2013).
Diversos tratamentos de superfície têm sido estudados e testados, entre eles a implantação
de iões de magnésio, a deposição de hidroxiapatite ou fosfato de cálcio em nanocamadas,
o condicionamento com ácidos fortes (ácido clorídrico, ácido fluorídrico ou ácido
sulfúrico), o jateamento com partículas (óxido de titânio, óxido de alumínio, cloreto de
sódio, hidroxiapatita, fosfato de cálcio) o processamento a laser, a sinterização de
partículas e o spray plasma (Ellingsen, Thomsen, & Lyngstadaas, 2006; Tomé et al.,
2015).
As superfícies de implantes dentários podem ser agrupadas em 5 grupos: usinadas,
macrotexturizadas, microtexturizadas, nanotexturizadas ou biomiméticas (De Carvalho,
Pellizzer, De Moraes, Falcón-Antenucci, & Ferreira Júnior, 2009).
Estas técnicas de texturização de superfície têm sido aplicadas para criar diferentes
geometrias e graus de rugosidade da superfície. As modificações de superfície visam
melhorar as interações celulares com a superfície do implante, estimular a atividade
celular, melhorar a osteointegração e a resistência da interface osso-implante para
estabilizar a carga funcional (Delgado‐Ruíz et al., 2011; Ellingsen et al., 2006).
A nanotecnologia oferece novas formas de interagir com processos biológicos relevantes
e fornece meios de compreensão e realização de funções específicas de células
(Mendonça, Mendonça, Aragao, & Cooper, 2008).
com os estágios iniciais do processo de cicatrização óssea e aumento da resposta celular,
verificando-se uma resposta óssea mais rápida em superfícies rugosas (Aboushelib,
Osman, Jansen, Everts, & Feilzer, 2013; Svanborg, Andersson, & Wennerberg, 2010).Os
dados existentes sugerem que passos críticos na osteointegração podem ser modulados
pela modificação em nanoescala da superfície do implante (Barbosa, 2015; Mendonça et
al., 2008; Svanborg, Andersson, & Wennerberg, 2010).
Os processos de tratamento de superfície podem ser divididos em dois grupos: adição e
subtração. No método de adição, é aplicado à superfície do implante um revestimento,
que poderá ser ou não do mesmo material do implante e, no método de subtração é
removida parte da camada superficial do implante (Brandão et al., 2010).
Os revestimentos em Ti, em estruturas simples ou multicamadas, possuem aplicações de
ampla gama em vários campos, nomeadamente instrumentos cirúrgicos e dispositivos
biomédicos. Diferentes métodos foram utilizados para preparar filmes com base em Ti,
cujas propriedades dependem do método e das condições de deposição. A técnica de
deposição de arco catódico é versátil, de alta produtividade e eficiente, com capacidade
de preparar uma grande variedade de compostos binários e multifásicos rígidos.
A deposição confere à superfície elevada dureza e um coeficiente de atrito muito baixo,
proporcionando uma excelente barreira a ambientes quimicamente agressivos e uma taxa
de difusão para os tecidos circundantes baixa ou quase nula (Balaceanu et al., 2002).
No presente trabalho, reportamos sobre a síntese e caracterização nos revestimentos
rígidos de TiN monocamada e Zr/ZrCN/TiN multicamadas, depositados em diferentes
substratos pela técnica do arco catódico.
2.6.1. NITRETO DE TITÂNIO
Samuel Steinemenan, em 1972, patenteou o uso de implantes de titânio ou liga de titânio
para o tratamento cirúrgico de ossos. “Um implante de titânio ou titânio com a característica inovadora da camada superficial formada como um óxido, nitreto,
carboneto e carbonitreto. A camada superficial é aplicada para evitar a abrasão e a
corrosão do implante e para evitar o desgaste entre os implantes de contato, bem como
Buechel e Pappas, em 1997, patentearam a "prótese com superfície resistente ao desgaste
biologicamente inerte". As superfícies de suporte de carga são revestidas com material
resistente à abrasão biologicamente inerte, tal como o TiN, de preferência 8 a 10 µm de
espessura, mais resistente do que o substrato para prevenir o desgaste e a
lixiviação/dissolução de iões para os tecidos circundantes (Fredrick F Buechel & Pappas,
1999).
Recentemente, na área da Medicina, houve um crescente interesse no revestimento de
TiN. O TiN é uma cerâmica que tem propriedades gerais, como grande dureza (2000
kg/mm2), alta temperatura de decomposição (2949 °C), resistência notável ao desgaste e
corrosão, estabilidade química em temperatura ambiente, biocompatibilidade intrínseca,
supercondutividade e cor dourada-amarela que permite a camuflagem sob o tecido
gengival (Maurer, Brown, Payer, Merritt, & Kawalec, 1993; Toth, 2014; van Hove,
Sierevelt, van Royen, & Nolte, 2015).
Este revestimento biologicamente inerte foi aprovado pela Federal Food and Drug Administration. Em várias experiências in vitro, os implantes revestidos com TiN apresentaram menor desgaste de polietileno e metal, quando comparados com outros
materiais utilizados para próteses ortopédicas e dentárias, mostrando propriedades de
tolerância ao sangue encorajadoras com uma percentagem de hemólise perto de zero
(Dion, Baquey, Candelon, & Monties, 1992).
Annunziata et al. relataram recentemente que este revestimento mostra uma função dupla na promoção da formação óssea e na redução da adesão bacteriana. Piscanec et al., em
2004, demonstraram que a nitretação de superfícies de implantes de titânio, sob condições
fisiológicas, pode promover a formação in vivo de material semelhante a osso (Piscanec et al., 2004).
Esses achados refletem um grau de bioatividade elevado, o que pode ser de grande
importância no processo de osteointegração de implantes revestidos com TiN. No
entanto, a pesquisa para avaliar as propriedades da superfície e a biocompatibilidade, para
III.
OBJETIVOS
Este trabalho de investigação tem como principais objetivos:
1. A caracterização da superfície de implantes e de aditamentos protéticos,
revestidos com Nitreto de Titânio, do ponto de vista mecânico, químico e
biológico;
2. Comparação com a superfície de implantes revestidos a Titânio comercializados
IV.
HIPÓTESES
Hipótese Nula 1
Os implantes com revestimento de nitreto de titânio apresentam melhores
características mecânicas, químicas e biológicas que os implantes de
titânio.
Hipótese Alternativa 1
Os implantes com revestimento de Nitreto de Titânio apresentam piores
características mecânicas, químicas e biológicas que os implantes de
Titânio.
▪ Hipótese Nula 2
A adesão do revestimento de TiN não revela destacamento do substrato. ▪ Hipótese Alternativa 2
A adesão do revestimento de TiN não revela destacamento do substrato.
▪ Hipótese Nula 4
O revestimento de TiN revela capacidade de adesão e proliferação celular.
▪ Hipótese Alternativa 4
O revestimento de TiN não revela capacidade de adesão e proliferação
celular.
▪ Hipótese Nula 5
O revestimento de TiN, do ponto de vista biológico in vitro, é biocompatível (não é citotóxico).
▪ Hipótese Alternativa 5
O revestimento de TiN, do ponto de vista biológico in vitro, não é biocompatível (é citotóxico).
▪ Hipótese Nula 3
O revestimento de TiN apresenta porosidade controlada.
▪ Hipótese Alternativa 3
▪ Hipótese Nula 6
As células que aderem ao revestimento de TiN adotam uma morfologia
característica do seu fenótipo. ▪ Hipótese Alternativa 6
As células que aderem ao revestimento de TiN não adotam uma morfologia
característica do seu fenótipo.
▪ Hipótese Nula 7
O revestimento de TiN, do ponto de vista biológico, mantém uma atividade
metabólica indutora da mineralização, avaliada através da enzima da
fosfatase alcalina (ALP).
▪ Hipótese Alternativa 7
O revestimento de TiN, do ponto de vista biológico, não mantém uma
atividade metabólica indutora da mineralização, avaliada através da
V.
MATERIAIS E MÉTODOS
5.1. TIPO DE ESTUDO
Trata-se de um estudo clínico experimental in vitro com a finalidade de caracterizar e comprovar a segurança do revestimento de TiN e verificar a sua resposta biológica.
5.2. LOCAL DE REALIZAÇÃO DO PROJETO
A investigação realizou-se na Universidade de Aveiro, no Departamento Física e
Engenheira de Materiais; na FCT/Universidade Nova de Lisboa, no Laboratório de
Biomateriais e Engenheira de Tecidos e, na empresa Prirev. Decorreu entre os meses de maio de 2017 e outubro de 2017.
5.3. APROVAÇÃO E CONDIÇÕES
Este projeto foi apresentado para obtenção de grau de Mestre em Medicina Dentária, no
Instituto Superior de Ciências da Saúde Egas Moniz. Foi sujeito a aprovação pela
Comissão Científica do Mestrado Integrado em Medicina Dentária do ISCSEM.
As entidades envolvidas no projeto, Universidade de Aveiro, a empresa Prirev – Equipamentos e Revestimentos Técnicos e a FCT/Universidade Nova de Lisboa autorizaram a realização do estudo nas respetivas instalações. (Anexo I, II e III)
5.4. AMOSTRAS
Para a realização desta investigação foi necessário reunir algumas amostras dos materiais
em estudo e criar condições para a realização dos testes clínicos. Durante o projeto,
decidiu-se inserir uma nova variável ao estudo e testar/analisar um revestimento
multicamadas de Zr/ZrCN/TiN que estava a ser aplicado pela Empresa Prirev, para dar resposta a alguns problemas inerentes ao revestimento de TiN.
Para os ensaios in vitro de adesão e proliferação celular, morfologia, fosfatase alcalina e para os ensaios mecânicos, uma vez que a arquitetura dos implantes e aditamentos
protéticos não se enquadram nos parâmetros dos testes, houve a necessidade de revestir
placas de aço inox (forma circular, diâmetro 14mm) com os revestimentos em estudo
(TiN e multicamada (Zr/ZrCN/TiN)).
Como controlo do processo de revestimento e para facilitar a análise das amostras foram
usadas placas de silício nos ciclos de PVD juntamente com os implantes e aditamentos
Tabela 1: Tabela descritiva das amostras usadas no projeto.
AMOSTRAS Nº MODELO COMERCIAL REVESTIMENTO DIÂMETRO COMPRIMENTO MÁQUINA CICLO TEMPO
Implante 2 Exaktus® Cilíndricos Biodent HEX RP
Titânio Comercialmente
Puro (Tipo IV)
3,75 mm 13 mm Comercial Comercial Comercial
Implante 2 HI-TEC Implants® TiN 3,75 mm 10 mm Kenosistec K3606 2h
Implante 2 HI-TEC Implants® Multicamadas
(Zr/ZrCN/TiN) 3,75 mm 10 mm Microcoat M862516 2h20m
Aditamento
Protético 2 Exaktus® Kerator BHI TiN 3,5 mm 4 mm Comercial Comercial Comercial
Aditamento
Protético 2 Tipo Locator TiN 3,5 mm 4 mm Kenosistec K3606 2h
Aditamento
Protético 2 Tipo Locator
Multicamadas
(Zr/ZrCN/TiN) 3,5 mm 3 mm Microcoat M862516 2h20m
Placas
Aço-Inox 10 --- TiN 14 mm --- Kenosistec K3606 2h
Placas
Aço-Inox 10 ---
Multicamadas
5.5. MATERIAIS
Para a produção dos filmes de TiN e Zr/ZrCN/TiN foram usados alvos de titânio de grau
2 (com pureza mínima superior a 99,7% e com elementos residuais de ferro (Fe), carbono
(C), oxigénio (O), azoto (N) e hidrogénio (H)) e alvos de zircónio (Zr) (com pureza
mínima superior a 99,6% e elementos residuais de Ti, Fe, háfnio (Hf), C, O, N e H).
Foram utilizados os gases árgon e nitrogénio com pureza mínima de 99,9997% e o gás
metano com pureza mínima de 99,9995%.
5.6. METODOLOGIA
5.6.1. PROCESSO DE DEPOSIÇÃO DO FILME
O método PVD é uma das técnicas possíveis para revestir materiais biocompatíveis. Esta
técnica permite formar uma camada quase perfeita de um material, que não se desintegra
nem afeta a topografia da superfície, podendo ser aplicado em aço, aço inox, latão,
alumínio, zamak, polímeros e superfícies cerâmicas.
Berghaus, em 1938, patenteou o processo de PVD. No entanto, para consolidar os
princípios propostos por Berghaus, Mattox, no início da década de 60, descobriu as
deposições iónicas que possibilitaram industrializar e ampliar os conhecimentos em
sistemas de vácuo. Com a revolução tecnológica foi possível desenvolver sistemas de
vácuo, fontes de alimentação e tecnologia de ponta que permitiu otimizar a produção dos
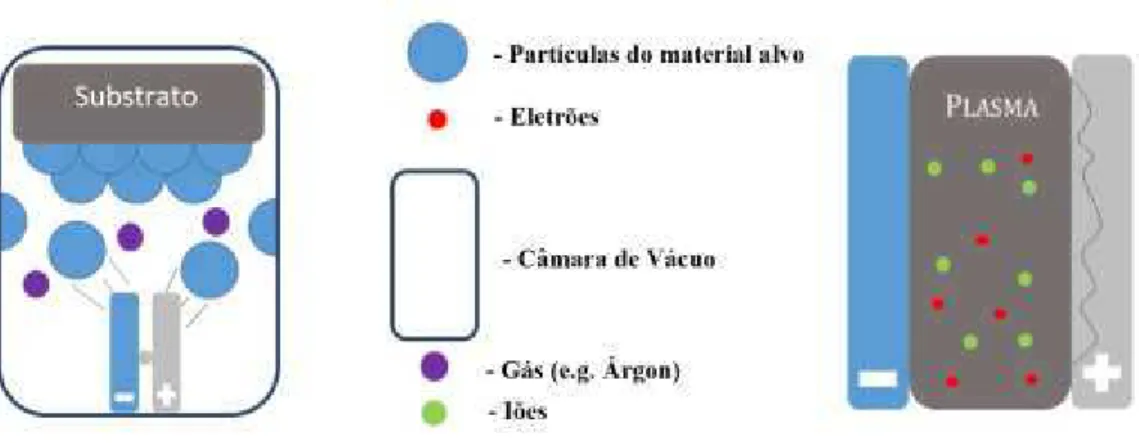
revestimentos. De uma forma simplista pode ser descrito em quatro etapas: evaporação,
transporte, reação e deposição, como ilustrado na figura seguinte.
O revestimento PVD com TiN e multicamada Zr/ZrCN/TiN apresenta vantagens
inigualáveis em instrumentos cirúrgicos e dispositivos médicos, nomeadamente próteses
e implantes. Este processo confere elevada dureza (>2500 HV) aliada a um coeficiente
de atrito muito baixo (<0,70 µ), proporcionando uma maior aptidão ao corte em
instrumentos cirúrgicos; densidade muito elevada, que proporciona uma excelente
barreira a qualquer ambiente quimicamente agressivo; e, uma excelente
biocompatibilidade, apresentando uma taxa de difusão baixa ou nula, prevenindo a
passagem do material da prótese para os tecidos circundantes.
A tecnologia “random arc” utilizada pela empresa Prirev – Equipamentos e Revestimentos Técnicos, no processo de PVD, permite uma ionização superior e a deposição de revestimentos funcionais a relativamente baixa temperatura (200 – 450 ºC) fazendo com que, esse parâmetro não influencie as características do substrato. Esta
tecnologia, por não produzir qualquer tipo de resíduo, pode ser considerada uma
tecnologia verde.
No processo por arco catódico, o conceito básico envolve a criação do arco através da
aplicação de uma densidade de corrente elevada vaporizando o material existente no alvo.
Este material será direcionado para o substrato de forma controlada, usando para isso uma
diferença de potencial entre o alvo e o substrato (BIAS). Nesta fase é criado um plasma
através da ionização dos iões de árgon (gás raro) injetados para o interior da câmara.
Outros gases podem ser usados durante o processo, como é exemplo o N, que irá reagir
com os elementos vaporizados do alvo.
Este processo tem como principal vantagem uma maior densidade de vaporização quando
comparado com técnicas concorrentes (vaporização térmica); os cátodos podem ser
posicionados em distintas configurações e as fontes de alimentação necessárias são de
relativamente baixa potência. Como principais desvantagens deste processo podemos
mencionar a dificuldade de revestir peças com geometrias complexas e a possível
Figura 7: Ilustração do processo de deposição por arco catódico.
Para que o produto final tenha as características necessárias, é importante que na fase
inicial do processo as peças sejam devidamente limpas (remoção de resíduos orgânicos e
inorgânicos), preparadas e carregadas na câmara. No interior da câmara a pressão desce
(na ordem dos 10-5 mbar) e inicia-se o aquecimento dos substratos a revestir. Após esta
fase é promovida a corrosão iónica na superfície do substrato para maximizar a aderência
ao revestimento. Inicia-se a fase de deposição e, após a finalização deste ciclo, o substrato
é arrefecido lentamente e as peças retiradas da câmara, prontas para serem embaladas e
entregues.
Figura 8: Máquinas (Prirev – Equipamentos e Revestimentos Técnicos) - usadas no processo de revestimento das amostras. A da esquerda Kenosistec - Recipe TiN-SRAM e a da direita Microcoat - Multicamadas Zr/ZrCN/TiN.
A deposição por arco catódico ocorre numa câmara de baixas pressões e consiste na
evaporação do material de revestimento presente nos alvos, através de um arco elétrico
O processo, no interior da câmara, inicia-se com a incidência de um arco, criado por uma
descarga de alta corrente e baixa tensão através de um gás altamente ionizado, sobre os
“targets” que contêm o material do revestimento (o cátodo). A temperatura aumenta e
provoca pequenas crateras no “target” devido à remoção de material. O arco vai-se extinguindo e reincidindo em novas crateras, provocando a ilusão de movimento do arco.
O cátodo é posteriormente arrefecido com água, havendo projeção de jatos de material
(iões do material altamente ionizados e partículas) no estado gasoso, que podem alcançar
velocidades de 10 km/s.
O tamanho das partículas presentes no respetivo jato de material expelido pelo “target”, varia consoante o ponto de fusão do material e a velocidade. Pontos de fusão e velocidade
de arco inferiores resultam em partículas com um diâmetro maior. Obtêm-se partículas
de dimensões inferiores quando a velocidade e o ponto de fusão são superiores.
Durante o processo pode ocorrer uma emancipação de macropartículas consequente da
prolongada incidência do arco sobre o cátodo e evaporação longa. Estas partículas,
definidas por “droplets”,são depositadas juntamente com o revestimento.
O número de partículas libertadas ao longo do processo pode ser reduzido. Para isso
podemos reduzir a corrente do arco, aumentar a distância entre os “targets” e o substrato, aumentar a pressão do gás ou aplicar um campo magnético coaxial para aumentar a
densidade.
As tabelas que se seguem sumariam os parâmetros de deposição, usados pela empresa,
Tabela 2: Parâmetros de deposição do revestimento com TiN.
KENOSISTEC - Recipe TiN-SRAM
Parâmetros Valores
Tecnologia PVD random arc
Ciclo nº 1K3606
2K2963
Data de Produção 29/07/17
25/09/17
Corrente 540 A
Fluxo de Gás (%)
Passos Árgon
(%)
Reativo (N2) (%)
0 (Ti) 100 0
1 90 10
2 40 60
3 17 83
4 30 70
Pressão Total durante a Deposição ~7x10-3 mbar Temperatura de Deposição 165 ºC Tempo de Deposição - Ciclo 60 minutos
Tabela 3: Parâmetros de deposição do revestimento com Multicamadas Zr/ZrCN/TiN.
MICROCOAT - Multilayer (Zr/ZrCN/TiN)
Parâmetros Valores
Tecnologia PVD random arc
Ciclo nº M8622/3
M8792 Data de Produção 28/08/17
21/09/17
Corrente 360 A
Fluxo de Gás (%)
Passos Árgon
(%)
Reativo CH4 (%)
Reativo N2 (%)
1 (Zr) 100 0 0
2 100 0 0
3 90 0 10
4 10 10 80
5 10 20 70
6 20 0 80
7 20 0 80
8 30 0 70
Pressão Total durante a Deposição
~ 5x10-3 mbar
5.6.2. MÉTODOS DE ANÁLISE DE SUPERFÍCIE
A escolha de métodos de análise adequados é muito importante para obter resultados
confiáveis. Nesta seção, será descrita uma breve abordagem dos princípios dos métodos
de análise usados na caracterização, teorias gerais e aspetos técnicos.
5.6.2.1. DIFRAÇÃO DE RAIO X (MICROESTRUTURA) – DRX A difração de raios-X é uma ferramenta de caracterização primordial nas investigações
atuais. Consiste numa técnica não-destrutiva e caracteriza-se pela incidência de um feixe
de raios-X, de comprimento de onda conhecido, sobre a amostra que será difratado
consoante as distribuições atómicas dos cristais.
Todo o sólido cristalino tem seu padrão de difração de raios-X próprio e exclusivo, assim
como fases distintas dos mesmos materiais. A difração de raios-X é utilizada para estudos
estruturais de amostras, sendo possível obter informações sobre presença de fases
cristalinas, orientação de cristais, tamanho médio de cristais (tamanho de grão),
parâmetros da célula unitária, tensões internas, entre outros.
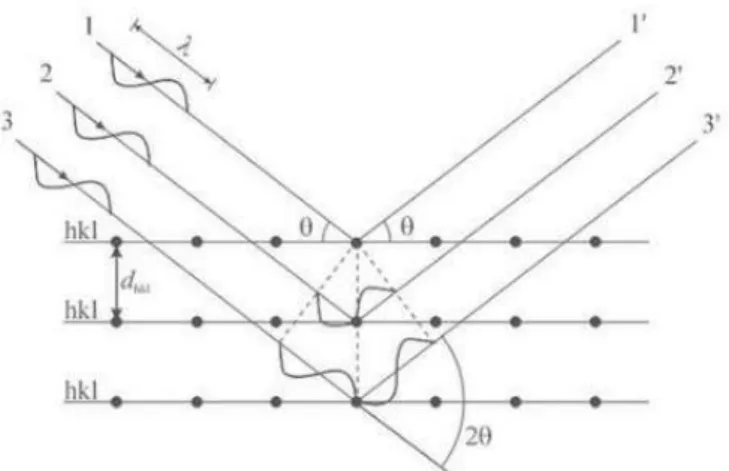
Quando uma amostra cristalina é exposta a um raio de raios-X dentro de um certo ângulo,
os planos de cristal da amostra atuam como uma grade de difração. Conhecer o
comprimento de onda (ʎ) do raio de raios-X incidente e o ângulo (θ) entre o feixe incidente e o plano de cristal torna possível a determinação da distância entre os planos
de cristal (d), como sugere a lei de Bragg:
� = 2�ℎ ���(θ),
onde n é um número inteiro (1, 2, 3, ...) comumente 1. A intensidade dos picos de difração