Helena Isabel Vicente dos Santos
Limite de disfagia e capacidade de deglutição fracionada
em indivíduos com doença de Parkinson
Projeto elaborado com vista à obtenção do grau de Mestre em terapia da fala na Área de motricidade orofacial e deglutição
Orientador: Professor Doutor João Parracho Costa, Professor Associado na Faculdade Medicina da Universidade Lisboa
Coorientador: Professora Doutora Isabel Peixoto Guimarães, Professor Coordenador da Escola Superior de Saúde do Alcoitão
Helena Isabel Vicente dos Santos
Limite de disfagia e capacidade de deglutição fracionada em
indivíduos com doença de Parkinson
Projeto elaborado com vista à obtenção do grau de Mestre em terapia da fala na Especialidade de motricidade orofacial e deglutição
Orientador: Professor Doutor João Nuno Marques Parracho Guerra da Costa, Professor Associado na Faculdade Medicina da Universidade Lisboa
Coorientador: Professora Doutora Isabel Peixoto Guimarães, Professor Coordenador da Escola Superior de Saúde do Alcoitão
Júri:
Presidente: Professor Doutor João Manuel Cunha da Silva Abrantes
Presidente do Conselho Técnico-Científico da Escola Superior do Alcoitão Vogais: Professor Doutor João Nuno Marques Parracho Guerra da Costa
Professor Associado na Faculdade Medicina da Universidade Lisboa Professora Doutora Inês Tello Rato Milheiras Rodrigues
Nota:
Este documento, elaborado no âmbito da 3ª edição do Mestrado em terapia da fala –
especialização em motricidade orofacial e deglutição, da Escola Superior de Saúde do Alcoitão (ESSA), foi redigido de acordo com as normas ortográficas em vigor desde janeiro de 2009. Segue as normas estabelecidas pela ESSA para redação de Trabalhos Académicos e Científicos1 e as normas internacionais Vancouver (5ª edição, 1997) no que concerne a referências bibliográficas, para apresentação de artigos propostos a publicação em revistas médicas2.
1 Escola Superior de Saúde do Alcoitão. Normas para redação de Trabalhos académicos e científicos. Conselho
Científico. Alcoitão; outubro de 2004
2 Comissão Internacional de Editores de Revistas Médicas. Normas para apresentação de artigos propostos para
RESUMO
ABSTRACT
Objective: The objectives of the present study are: (i) find the dysphagia limit in patients with idiopathic Parkinson’s disease, (ii) study neurophysiological measures in the deglutition of
patients with Parkinson’s disease and (iii) understand if a compensatory strategy like the
consistencies adaptation influences the ability to fragment a volume when swallowing it, in
patients with Parkinson’s disease. Methodology: Eleven patients with Parkinson’s disease and eleven, matched age and sex, healthy individuals were assessed with neurophysiological methods: surface electromyography of the supra-hyoid muscles and uniaxial accelerometry, with an accelerometer placed in the middle line between the cricoid and thyroid cartilages, in order to detect the larynx movements during swallowing. Two tasks were proposed: (i) the dysphagia limit test and (ii) a task where patients were asked to fragment liquid and nectar like bolus. Results: Eight patients with Parkinson’s disease (73%) have a dysphagia limit under 20mL and three (27%) present a dysphagia limit above this volume. All healthy subjects present dysphagia limits above 20mL. The interval 0-2 (laryngeal elevation and relocation) is more prolonged in patients with dysphagia limits below 20mL when compared to healthy subjects. All the other neurophysiological measures, extracted in the dysphagia limit task with 3mL, do not show any statistically difference between groups. The number of nectar swallows, in the task where participants were asked to fragment the volumes, is superior for the healthy participants when compared to the patients with dysphagia limit
under 20mL. The duration between de liquid deglutition’s is higher in the patients group with dysphagia limit under 20mL. For all tasks the reaction time is superior for patients when compared to healthy subjects. This difference is statistically proven between the control group ant the group of patients with dysphagia limit below 20mL. Conclusion: The small dimension of the sample limits the generalization of conclusions. Even Parkinson patients with few complains about their swallow present dysphagia limits under 20mL. Patients with
Parkinson’s take more time to fragment volumes of liquid and nectar and seem to have more difficult when trying to control the liquid bolus. The consistency adaptation from liquid to nectar seems to be helpful to facilitate oral control in these patients.
INTRODUÇÃO
A doença de Parkinson (DP) é uma doença neurodegenerativa cuja prevalência aumenta com a idade(1). Estima-se que a prevalência, em países industrializados, seja 0.3% na população geral e 1% na população acima dos 60 anos(2). Na Europa, entre os 85 e os 89 anos foi reportada uma prevalência de 3.5%(3). Frequentemente, a DP é associada a um conjunto de sintomas motores, no entanto, os sintomas não motores, associados a esta patologia, e nos quais se insere a disfagia, estão correlacionados com um aumento da incapacidade e diminuição da qualidade de vida(4).
Estudos recentes baseados em técnicas de avaliação objetivas estimam que a prevalência de disfagia em pessoas com DP seja de aproximadamente 72 a 87%. A broncoaspiração acontece em cerca de 50% dos doentes com DP(5) e conduz a um elevado risco de pneumonia de aspiração e morte nesta população(6,7).
A deglutição é um processo complexo, frequentemente, dividido em três fases distintas: oral, faríngea e esofágica(8). As fases oral e faríngea estão fortemente relacionadas e por isso são, frequentemente estudadas em conjunto, recebendo a denominação de deglutição orofaríngea. É nesta fase orofaríngea que surgem a maioria das alterações associadas a disfagias neurogénicas(9,10). A deglutição orofaríngea é um processo complexo constituída por eventos sucessivos e coordenados que requerem um controlo motor voluntário (fase oral) e involuntário (fase faríngea). O bolo alimentar na cavidade oral, gera um input
sensorial que é transmitido ao córtex, resultando no desencadear do reflexo de deglutição(8,11,12). Após este momento, iniciam-se a elevação e encerramento da laringe e do palato mole por ação da musculatura suprahoideia(10,13,14). A língua propulsiona o bolo que passa para a faringe e cuja progressão é auxiliada pela ação dos constritores da faringe(15). Depois disto, dá-se o relaxamento do músculo cricofaríngeo que resulta na abertura do esfíncter esofágico superior e, portanto, na passagem do alimento para o esófago(10,16).
Diversos autores têm estudado a deglutição em doentes com DP e existe um conjunto de alterações, nas fases oral e faríngea da deglutição já reportadas. O pumping lingual, as
lento(19–22). Estas alterações contribuem para o aumento do risco de disfagia e broncoaspiração na DP(20). A broncoaspiração pode, muitas vezes, surgir antes que exista um reconhecimento da existência do problema por parte de doentes e cuidadores(23). É frequente que estes doentes apresentem uma perceção alterada, relativamente a estas alterações que surgem associadas à condição neurológica, fator que contribui, ainda mais, para uma identificação tardia do problema(24–26). Na literatura é reportado que a disfagia a um nível subclínico está presente em cerca de 35% dos doentes que vivem em casa(27). Neste sentido, a utilização de técnicas não invasivas que permitam a obtenção de resultados objetivos e fiáveis adquire ainda mais relevância. Estas poderão assumir um papel preponderante na deteção de alterações numa fase inicial, contribuindo assim para um maior conhecimento da doença e proporcionando um método fiável de rastreio e avaliação para utilização na prática clínica.
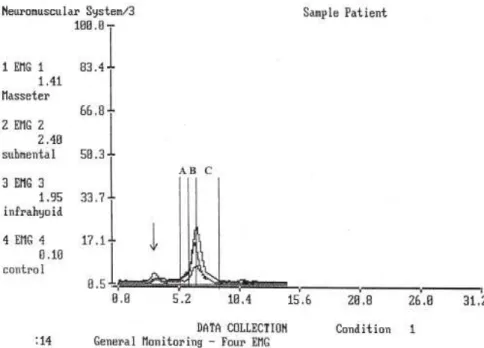
Figura 1 – Figura adaptada de Vaiman et al., 2004. Sinal eletromiográfico captado durante deglutição de água,
num indivíduo saudável. Traçado superior: musculatura do submento; traçado medial: masséter; traçado inferior: musculatura infrahioideia. A – final da fase oral; B – fase faríngea; C – início da fase esofágica.
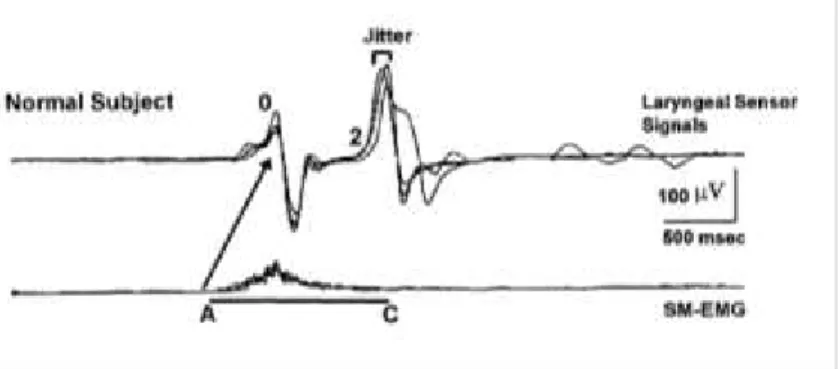
Figura 2 – Figura adaptada de Ertekin et al., 1998. Sinal de eletromiografia da musculatura SH (inferior) e sinal
do sensor laríngeo (acelerómetro)(superior), recolhido durante a deglutição de água, num indivíduo saudável. Intervalo A-C – duração total da ativação dos SH; A-0 – duração desde o início da ativação dos SH até ao início do movimento de elevação laríngea; 0-2 – duração da elevação e estabilização laríngea.
Ambas as técnicas, EMGs e acelerometria, são não invasivas, relativamente simples de utilizar e possibilitam, respetivamente, a obtenção, em tempo real, de dados sobre a ativação muscular(29) e sobre o movimento do complexo hiolaríngeo. Além disso, não implicam exposição a nenhum tipo de radiação, fator que é, frequentemente, referido como uma limitação à realização da videofluoroscopia(43), que é a técnica ainda considerada como
reference standard(44) no que à avaliação da deglutição diz respeito. O fato de não existir
nenhum fator que impeça a utilização, de forma repetida, destas técnicas, torna-as em ferramentas a considerar na realização de reavaliações e como instrumentos de biofeedback.
Usadas de forma complementar possibilitam a obtenção de informação acerca da deglutição voluntária e reflexa.
O teste do limite de disfagia, que tem por base uma avaliação instrumental com EMGs na região suprahioideia (SH) e um sensor piezoelétrico na região laríngea(43), tem sido utilizado em diferentes estudos, com diferentes tipos de amostra(20,32,33,43,45,46), inclusive doença de Parkinson idiopática (DPi)(20,21,32). Indica qual é o volume de líquido, a partir do qual é necessária mais do que uma deglutição, para que este seja engolido totalmente. Este volume é considerado o limite de disfagia(43). É aceite que indivíduos sem disfagia tenham um limite de disfagia acima de 20 mL(43). A especificidade e sensibilidade deste método são de 100% e 95.4%, respetivamente(43), mesmo em indivíduos que evidenciam uma auto perceção alterada(42), como acontece frequentemente em indivíduos com DP.
DP que, pelo facto de apresentarem limites de disfagia reduzidos, frequentemente necessitam de fracionar a porção de alimento que colocam na cavidade oral. Esta prova será realizada com duas consistências alimentares, líquido e pastoso néctar, de modo a compreender se uma pequena adaptação na consistência alimentar, tem impacto no controlo oral, em indivíduos com DP.
A adaptação da consistência alimentar, como estratégia compensatória para reduzir o risco de broncoaspiração, é muito utilizada na prática clínica(47) e vários autores referem que o aumento da viscosidade reduz o risco de broncoaspiração em diferentes patologias(48–56) inclusivamente em doenças neurodegenerativas(52,57). Os estudos têm tentado descrever alterações na fisiologia da deglutição causadas pela alteração na consistência alimentar(53,57–64), no entanto baseiam-se em provas de deglutição única(52,59–61,65).
METODOLOGIA
O protocolo do estudo foi aprovado pela Comissão de Ética do Centro Hospitalar Lisboa Norte, em Lisboa no dia 30 de Maio de 2016.
Participantes
Os participantes foram recrutados nas consultas de neurologia e terapia da fala do Campus Neurológico Sénior em Torres Vedras e em Lisboa.
Foram investigados 22 participantes divididos em três grupos: (i) Indivíduos com DPi com LD>20mL; (ii) indivíduos com DPi com LD20 mL e (ii) indivíduos saudáveis, sem
disfagia, emparceirados por idade e sexo com os participantes com DPi, como grupo controlo. O diagnóstico de DPi foi realizado por médicos neurologistas especialistas na área.
Instrumentos
Para classificação de aspetos relativos à DP, à deglutição e à condição cognitiva dos participantes foram aplicados quatro instrumentos. A Movement Disorder Society-Sponsored
Revision of the Unified Parkinson's Disease Rating Scale (MDS/UPDRS)(66) foi utilizada
para avaliação de aspetos motores e não motores associados à DPi. A condição cognitiva foi avaliada com recurso ao Mini Exame do Estado Mental– Versão portuguesa (MEEM)(67) e indivíduos com defeito cognitivo foram excluídos do estudo. Relativamente à deglutição, a escala funcional de ingestão por via oral (Functional oral intake scale – FOIS)(68) foi utilizada para classificar o nível de funcionalidade, dos participantes, em termos de deglutição de alimentos e líquidos, incluindo a necessidade de adaptação de consistências alimentares e de uso de estratégias compensatórias. O questionário de distúrbios da deglutição (versão portuguesa em processo de validação) (Swallowing disturbance questionnaire – SDQ) foi aplicado para avaliar a auto perceção dos participantes quando à sua deglutição e as possíveis alterações associadas à ingestão de alimentos e líquidos.
Procedimentos neurofisiológicos
Antes da colocação dos elétrodos, a pele foi sujeita a um processo de limpeza e abrasão com algodão embebido em álcool a 70%.
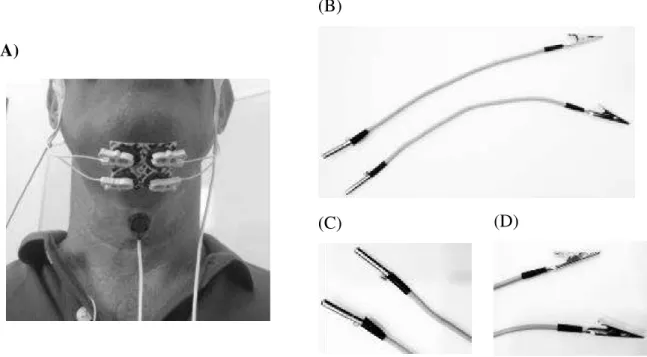
Os elétrodos bipolares de espuma e cloreto de prata (Covidien Kendall H92SG) foram colocados na musculatura SH (milohioideu, geniohioideu e ventre anterior do digástrico)(16,46). Os elétrodos originais foram cortados, de modo a que se obtivessem elétrodos quadrados com uma dimensão de 1cmx1cm. Os dois pares de elétrodos foram posicionados lateralmente à linha média entre a mandíbula e o osso hióide com distância inter-elétrodos de aproximadamente um cm (69,70). O elétrodo terra foi aplicado na pele sobre a clavícula direita. Um acelerómetro uniaxial Pro-tech, Model 1697 foi colocado na linha média entre as cartilagens tiroideia e cricoideia de modo a detetar os movimentos de elevação e abaixamento do complexo hiolaríngeo(16,46). O acelerómetro foi fixado com recurso a fita adesiva(71). Este acelerómetro foi conectado ao electromiógrafo com recurso a dois adaptadores construídos para o efeito (Figura 3).
(A)
(B)
(C) (D)
Figura 3 – (A) Colocação dos elétrodos e acelerómetro, num participante, para recolha do sinal de EMGs e acelerometria; (B) adaptadores construídos para o acelerómetro ao aparelho de eletromiografia; (C) extremidade dos adaptadores que conectava com os cabos do aparelho de eletromiografia; (D) extremidade dos adaptadores que conectava com o acelerómetro.
Este sistema foi conectado a um ecrã adicional, que projetava para os participantes um sinal visual (sinal imperativo) para estes iniciarem a deglutição.
Durante a recolha de dados os participantes estavam sentados. Foi-lhes dada a indicação para que se mantivessem confortáveis e evitassem movimentos repentinos de cabeça. Antes de cada prova foram recolhidos sinais de EMGs e acelerometria, durante um minuto, de modo a captar o padrão base, em repouso, de cada um dos participantes.
As provas foram gravadas com recurso a uma câmara de filmar e a um tripé. A imagem captou os participantes e o ecrã com os sinais de EMGs e de acelerometria, de forma a facilitar a análise posterior.
Provas baseadas em avaliações neurofisiológicas
Em todas as provas, foi dada a indicação ao participante, de que só deveria engolir após a visualização, no ecrã do computador, do sinal imperativo. Este sinal visual imperativo consistiu na alteração da forma de uma linha de base estável, conforme exemplificado na Figura 4. Antes do início das provas o sinal foi explicado e mostrado a cada um dos participantes. Este sinal foi criado, pelo investigador, com recurso a dois elétrodos ligados a um canal do eletromiógrafo, com o objetivo de garantir o sincronismo dos dados.
Figura 4 – A moldura preta marca o sinal eletromiográfico visualizado pelos participantes. O momento do sinal imperativo está indicado pela seta preta. A – Sinal eletromiográfico, em bruto, relativo à ativação da musculatura SH à esquerda, durante uma deglutição de líquido; B – Sinal eletromiográfico, em bruto, relativo à ativação da musculatura SH à direita, durante uma deglutição de líquido; C – Sinal de acelerómetro durante uma deglutição de líquido.
A
B
A determinação do limite de disfagia (LD) baseou-se no protocolo original do teste do limite de disfagia descrito(16). Foram administrados diferentes volumes de água (1,3,5,10,15, 20, 25, 30, 35, 40, 45 mL) com seringa graduada até o limite da disfagia ser encontrado(16,46). Foi dada uma indicação verbal para que o participante tentasse deglutir, de uma só vez, o volume colocado na cavidade oral, após a visualização do sinal imperativo no ecrã de computador. Além desta indicação, foi transmitido aos participantes que, caso não conseguissem deglutir o volume de uma só vez, deveriam engolir até que não restassem resíduos na cavidade oral ou faringe. Depois da primeira deglutição, os sinais de EMGs e acelerometria foram captados durante oito segundos para cada um dos volumes(16,46). Quando foi observada a ocorrência dos dois sinais (EMGs e acelerómetro) em simultâneo, nos oitosegundos de registo, aceitou-se a existência de deglutição fracionada. Sempre que tal se registou, o procedimento foi repetido uma vez mais com o mesmo volume de água(16,46). Se na repetição não ocorreu deglutição fracionada, a prova continuou com o volume de água imediatamente acima. Quando na repetição do volume ocorreu deglutição fracionada aceitou-se que aceitou-se tinha encontrado o limite de disfagia. No caso de surgirem sinais clínicos de broncoaspiração (tosse, dispneia ou voz molhada) o procedimento era interrompido(16,46).
As provas de deglutição fracionada (DF), adaptadas especificamente para este estudo, foram realizadas com duas consistências alimentares: líquido (DFL) e néctar (DFN). A consistência néctar foi obtida através da adição de 1.2 gramas de espessante Resource® Thicken Up Clear a 100 mL de água à temperatura ambiente(52). Esta foi realizada com um volume de 10 mL(72). Foi solicitado aos participantes que, após visualização do sinal no ecrã, deglutissem o volume em pequenas porções, idealmente mais do que duas deglutições. O registo neurofisiológico foi interrompido após um intervalo de 8 segundos sem sinais de deglutição.
A ordem de administração das consistências alimentares foi pseudoaleatória e entre diferentes tarefas houve intervalos de um minuto. Cada tarefa foi repetida duas vezes(31). Entre diferentes provas o intervalo foi de cinco minutos(46).
Figura 5 – Linha de tempo representativa da ordem e duração de aplicação de cada um dos instrumentos e provas durante o protocolo experimental (a duração de cada prova é representada pelos valores numéricos). MEEM – Mini exame do estado mental; MDS-UPDRS Parte II – Secção relativa aos aspetos motores da vida diária na escala Movement Disorder Society-Sponsored Revision of the Unified Parkinson's Disease Rating Scale; FOIS – Functional Oral Intake Scale (Escala funcional de ingestão por via oral); SDQ – Swallowing disturbance questionnaire (questionário de distúrbios da deglutição, em validação para o português europeu).
Análise dos registos de EMGs e acelerometria
Os dados recolhidos foram codificados e armazenados informaticamente. Em cada prova analisou-se a segunda repetição, de modo a incluir o fator aprendizagem e a garantir que os participantes compreendiam o que lhes era solicitado.
O lado escolhido (direito ou esquerdo) para a marcação do traçado de EMGs, baseou-se na pontuação da parte motora da MDS-UPDRS. Em todos os participantes, as marcações foram feitas no sinal correspondente ao lado com a pontuação mais elevada, isto é o lado mais sintomático em termos de desempenho motor.
(A), término da ativação da musculatura SH (C), inicio do movimento de elevação da laringe (0) e início do movimento de abaixamento laríngeo (2) (Figura 6).
Figura 6 – Deglutição única de 3 mL de água, de um participante pertencente ao grupo de controlo. Marcação dos pontos de referência no sinal de EMGs (lado esquerdo por apresentar uma pontuação mais elevada na pontuação parcial da parte motora da MDS-UPDRS) e no sinal de acelerometria. Os sinais de EMGs estão retificados e suavizados. A-C – duração total da ativação da musculatura SH recolhida com o sinal de EMGs; A-0 – intervalo desde o início da ativação da musculatura SH até ao início do movimento de elevação laríngea (integra a fase oral da deglutição); 0-2 – intervalo desde o início do movimento de elevação laríngea até ao início do movimento de abaixamento laríngeo (elevação e estabilização da laringe); 2-C – intervalo desde o início do abaixamento laríngeo até ao final da ativação da musculatura SH.
Para a análise consideraram-se os seguintes intervalos, delimitados pelos pontos acima mencionados:
(i) Intervalo A-C, que corresponde à duração total de ativação da musculatura SH recolhida com o sinal de EMGs;
(ii) Intervalo A-0, que integra a fase oral da deglutição. Este intervalo dá-nos informação sobre a fase oral da deglutição, a fase voluntária. Além disso, visto que o ponto zero corresponde a um dos primeiros eventos da fase reflexa da deglutição (início da elevação laríngea), este intervalo fornece informação acerca da relação temporal entre o início da ativação voluntária da musculatura SH e o início da fase reflexa da deglutição;
EMGs e acelerometria foi feita para o volume de 3mL, volume que todos os participantes incluídos no estudo deglutiram.
Tabela 1 – Variáveis analisadas em cada uma das provas (LD3mL e DF).
Prova do limite de disfagia com 3mL (LD3mL) Prova de deglutição fracionada
• Tempo de reação (intervalo entre o início do sinal visual imperativo e o início do sinal da EMGs na musculatura suprahioideia) (s);
• Intervalo A-C (s);
• Intervalo A-0 (s);
• Intervalo 0-2 (s)
• Intervalo 2-C (s);
• Amplitude máxima (retificada e suavizada) (V) e amplitude máxima normalizada ao pico máximo (obtido nas provas de LD) (%).
• Tempo de reação (intervalo entre o início do sinal visual imperativo e o início do sinal da EMGs na musculatura suprahioideia) (s);
• Número total de deglutições;
• Intervalo entre as deglutições (s).
As variáveis acima referidas e a sua relação com os restantes instrumentos foram analisadas através de técnicas de estatística descritiva e inferencial, com o software de análise
estatística Statistical Package for the Social Sciences (SPSS® 23.0). A estatística descritiva é
apresentada sob a forma de valores médios e desvios-padrão. No que concerne à estatística inferencial, dada a reduzida dimensão da amostra, foram utilizados testes não paramétricos independentemente da distribuição dos resultados para as diferentes variáveis.
Os resultados referentes ao grupo de doentes com LD>20mL, incluíram apenas uma análise descritiva. Devido à reduzida dimensão deste grupo (n=3), este não foi incluído, isoladamente, nos testes de análise inferencial. As correlações, entre as diferentes variáveis, foram calculadas com recurso ao coeficiente de correlação de Spearman. Todas as
comparações entre o grupo controlo, o total de doentes com DPi e o grupo de doentes com LD20mL, foram realizadas com recurso ao teste de Mann-Whitney. As comparações, dentro
de cada um dos grupos, nas diferentes provas, foi feita através do teste de Wilcoxon (
signed-ranks). A exceção foi a comparação entre os tempos de reação, em cada uma das provas.
RESULTADOS
De um total de vinte e seis participantes recrutados para o estudo, quatro foram excluídos por não cumprirem critérios de elegibilidade. As características demográficas, clínicas e relativas à disfagia dos participantes com DPi avaliados neste estudo encontram-se listadas nas tabelas 2 e 3.
Tabela 2 – Características demográficas e clínicas dos participantes com DPi incluídos no estudo. Os participantes do grupo de doentes com LD>20mL estão destacados na tabela.
Participante Sexo (anos) Idade
Anos desde o primeiro sintoma(a)
Anos desde o diagnóstico (a)
Pontuação total MDS-UPDRS(b)(c)(f)(g) Pontuação parte III MDS-UPDRS(b)(d)(h)(i)
H&Y MEEM
1 F 61 3 1 32 50 2 30
2 M 67 9 7 46 26 2 26
4 F 75 11 8 63 48 3 28
6 M 73 6 3 58 18 2 30
8 M 58 2 1 44 28 2 29
9 M 67 16 15 77 44 3 30
11 F 81 3 3 77 53 3 29
12 M 75 9 8 37 52 2 29
14 M 74 25 15 83 23 3 30
15 M 72 9 5 104 58 2 29
20 F 63 6 5 41 18 2 28
Apenas um dos doentes em estudo (participante 15), apresentou um SDQ com pontuação total superior a 11, cut-off acima do qual se assume que existe risco de aspiração.
Este doente é também o que apresenta uma maior pontuação na prova MDS-UPDRS e um menor LD. Sete outros doentes, seis dos quais pertencentes ao grupo com LD20mL, referiram, no SDQ, dificuldades na fase oral da deglutição (itens 1 a 5), nomeadamente acumulação de resíduos na cavidade oral (item 2) e queda anterior de alimento (item 4), que se registou para apenas um destes doentes com LD20mL.
Tabela 3 – Características relativas à disfagia dos participantes com DPi incluídos no estudo. Os participantes do LD>20mL estão destacados na tabela.
Part. LD (mL) FOIS SDQ Total(c)(d) SDQ oral(e)(f)(h) SDQ faríngea(e)(g)(i)
1 20 7 2.5 0 2,5
2 5 7 6.5 2 4,5
4 5 7 5.5 3 2,5
6 25 6 4.5 2 2,5
8 40 7 1.5 1 0,5
9 10 7 6.5 3 3,5
11 20 7 8.5 3 7,5
12 5 7 4.5 1 3,5
14 25 7 7.5 3 4,5
15 3 7 23.5 8 15,5
20 10 7 1.5 0 1,5
As correlações estatisticamente significativas (p<0,05) estão acima assinaladas nas Tabelas 2 e 3 com as letras (a), (b), (c), (d), (e), (f), (g), (h) e (i). Como esperado, existe uma forte correlação entre a pontuação total da MDS-UPDRS e a parte III da mesma escala (ρ=0.909; p<0.05).
Existe uma forte correlação entre o número de anos desde o diagnóstico e o número de anos desde o primeiro sintoma (ρ=0.956; p<0.05). A pontuação total da MDS-UPDRS apresenta uma forte correlação com o total do SDQ (ρ=0.851; p<0.05), a com ambas as partes deste questionário, pontuação dos cinco itens relativos à fase oral (ρ=0.953; p<0.05) e pontuação dos dez itens relativos à fase faríngea da deglutição (ρ=0.663; p<0.05). A pontuação da MDS-UPDRS parte III apresenta, igualmente, uma forte correlação com o SDQ (ρ=0.814; p<0.05) e com as partes relativas à fase oral (ρ=0.916; p<0.05) e à fase faríngea da deglutição (ρ=0.651; p<0.05).
Limite de Disfagia (LD)
De um total de onze doentes com DPi incluídos no estudo, oito (73%) apresentaram
um LD20mL, com valor médio de de 9.8 mL. Os três doentes com DL>20mL, que corresponde a 27% do total de doentes com DPi, apresentaram um valor médio de 30mL. Todos os indivíduos saudáveis, incluídos no estudo, obtiveram LD>20mL, com valor médio de 41.8 mL.
aumenta (ρ=-0.682) e torna-se estatisticamente significativa (p<0.05). Existe também uma boa correlação entre o LD e a pontuação dos cinco itens, do SDQ, referentes à fase oral da deglutição (ρ=-0.668; p<0.05), bem como com a pontuação dos dez itens referentes à fase faríngea (ρ=-0.676; p<0.05). Quanto à MDS-UPDRS parte III, a correlação encontrada é negativa, como antecipado, no entanto é baixa (ρ=-0.134; p>0.05). Não se verifica qualquer correlação significativa entre as variáveis associadas à duração da doença (anos desde o primeiro sintoma e anos desde o diagnóstico) e o LD (p>0.05).
Duração das fases da deglutição e amplitude do sinal de EMGs
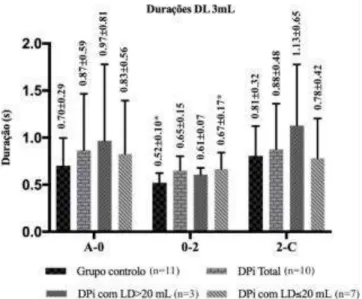
Relativamente às durações dos diferentes intervalos analisados na prova de LD3mL, os resultados obtidos encontram-se resumidos na Tabela 4 e no Gráfico 1. O participante 15 foi retirado desta análise, assim como da análise da amplitude, pelo facto de ter apresentado deglutição fracionada para o volume de 3mL.
A maior duração do intervalo A-C registou-se no grupo de indivíduos com DPi com LD>20mL. O grupo controlo apresentou a menor duração deste intervalo, quando comparado com a totalidade dos indivíduos com DPi, e com os dois subgrupos de doentes (p>0.05) (Tabela 4).
Tabela 4 – Duração do intervalo A-C (duração total da ativação da musculatura SH, captada através de EMGs), para os quatro grupos considerados no estudo.
Duração A-C
Grupo Controlo
(n=11) 2.030.35 DPi total (n=11) 2.310.83
DPi com LD>20mL
(n=3)
2.711.01
DPi com LD20mL
(n=8)
2.280.77
deste intervalo, comparativamente com os três grupos de doentes considerados (p>0.05). Três participantes, dois do grupo com LD20mL e um do grupo com LD>20mL revelaram sinais de hesitação antes do início efetivo do movimento de propulsão do volume de água (Gráfico 1).
O intervalo 0-2 teve uma menor duração no grupo controlo e uma maior duração em todos os grupos de doentes considerados no estudo. A maior diferença registou-se entre o grupo controlo e o grupo com DPi com LD20mL (p<0.05). O grupo de doentes com LD>20mL apresentou uma maior duração que o grupo controlo, mas menor que o grupo de doentes com LD20mL (Gráfico 1). Verificou-se uma correlação moderada significativa entre a duração do intervalo 0-2 e as cotações da MDS-UPDRS (ρ=0.486), da MDS-UPDRS parte III (ρ=0.520), e dos cinco itens relativos à fase oral da deglutição do SDQ (ρ=0.581; p<0.05). A correlação entre a duração deste intervalo e o LD foi inversa (ρ =-0.385) e não significativa (p>0.05).
O intervalo 2-C foi maior no grupo com DPi>20mL. O grupo controlo apresentou uma duração ligeiramente superior ao grupo de doentes com LD20mL e inferior ao grupo com incluiu a totalidade dos doentes. (p>0.05) (Gráfico 1).
Parecem ter sido os intervalos A-0 e 2-C os que mais contribuíram para a duração total da ativação da EMGs. Isto foi confirmado com recurso a correlações, o intervalo A-C apresentou uma boa correlação com os intervalos A-0 (ρ=0.599) e 2-C (ρ=0.584; p<0.05), mas não com o intervalo 0-2 (ρ=0.019; p>0.05). O intervalo 0-2 foi, no entanto, o que apresentou diferenças significativas entre o grupo controlo e o grupo de doentes com LD20mL. Foi também este intervalo que apresentou uma menor variabilidade dos dados. A duração deste intervalo parece assim, ser mais sensível a alterações na deglutição nesta população, mesmo para amostras de reduzida dimensão (Tabela 4 e Gráfico 1).
Tabela 5 – Valores de amplitude máxima, em microvolts, e em % (normalizada ao pico máximo, obtido na prova do LD), para os quatro grupos em estudo.
Amplitude máxima (V)
Amplitude máxima (%)
Grupo Controlo
(n=11) 64.4729.51 82.2025.09
DPi Total (n=11) 53.6320.79 82.3222.26
DPi com LD>20mL
(n=3) 59.3817.69 93.4120.87
DPi com LD20mL
Considerandos os valores absolutos, em microvolts, o grupo controlo apresentou valores superiores de amplitude máxima. O grupo de doentes com LD20mL apresentou os menores valores de amplitude máxima. As diferenças entre os grupos DPi total e DPi com LD20mL com o grupo controlo não foram significativos (p>0.05). Os valores normalizados evidenciaram uma tendência diferente. A amplitude máxima normalizada foi superior no grupo de doentes com LD>20mL, e inferior no grupo controlo, DPi total e DPi com
LD20mL, embora de forma não significativa (p>0.05) (Tabela 5).
Prova de deglutição fracionada
Na prova de DF, 18% dos participantes no grupo controlo apresentaram sinais de hesitação em ambas as provas, DFL (Figura 7) e DFN. Quanto ao grupo de doentes com
LD20mL, 37.5% dos participantes apresentaram sinais de hesitação na prova DFL e 25% dos participantes apresentaram sinais de hesitações na prova DFN.
Figura 7 – Traçado de EMGs e acelerometria de um doente com LD20mL na prova de DFL. No intervalo das deglutições observam-se sinais de hesitação.
Na prova DFL, três doentes (27%), dois do grupo com LD20mL e um do grupo com LD>20mL apresentaram tosse, sinal clínico de possível penetração/aspiração laríngea.
Para ambas as consistências, o grupo com DPi com LD>20mL, apresentou o maior número de deglutições. A diferença entre este grupo e os restantes foi superior na prova DFN. O grupo controlo obteve, para líquido e néctar, maior número de deglutições do que o grupo DPi total e do que o grupo de doentes com LD20mL. A diferença entre o grupo controlo e o
grupo de DPi com LD20mL realizaram maior número de deglutições de líquido (p>0.05) (Gráfico 2).
Verificou-se uma correlação moderada entre a parte III da MDS-UPDRS e o número de deglutições de líquido (ρ =-0.518; p<0.05), e uma boa correlação entre a mesma secção da MDS-UPDRS e o número de deglutições de néctar (ρ =-0.782; p<0.05). A correlação entre o número de deglutições de néctar e a pontuação dos itens do SDQ relativos à fase oral da deglutição foi moderada (ρ =-0.576; p<0.05). Não se verificaram correlações significativas com LD.
Gráfico 2 – Número de deglutições nas provas de DFL e DFN, para os quatro grupos em estudo. As diferenças com significado estatístico (p<0.05), entre o grupo controlo e o grupo com DPi com LD20mL estão marcadas com *.
Em ambas as consistências, a duração entre deglutições foi inferior para o grupo controlo quando comparado com os grupos de doentes. A diferença entre o grupo controlo e o grupo de doentes com LD20mL é maior, no caso da consistência líquida (p<0.05) (Gráfico 3).
Gráfico 3 – Intervalo entre deglutições, nas provas de DFL e DFN, para os quatro grupos em estudo. Grupo controlo: n=11; Grupo DPi Total: n=10; Grupo DPi com LD>20mL: n=3; Grupo DPi com LD20mL: n=7. As diferenças com expressão estatística (p<0.05), entre o grupo controlo e o grupo com DPi com LD20mL estão marcadas com *.
A duração entre as deglutições de líquido apresenta uma boa correlação com a MDS-UPDRS parte III (ρ=0.791; p<0.05) e com a pontuação dos itens do SDQ, relativos à fase oral da deglutição (ρ=0.627; p<0.05). Embora as correlações entre o intervalo entre deglutições e o LD tenham sido sejam negativas, como esperado, estas apresentaram um valor baixo e não significativo (p>0.05).
Tempo de reação
Dois participantes com DPi com LD20mL (um com LD=3mL e outro com LD=5mL) deglutiram antes do sinal imperativo nas provas e DFL. Estes doentes foram excluídos da apresentação dos resultados relativos ao tempo de reação, pois a deglutição antes do sinal imperativo não se deveu a uma maior rapidez na resposta, mas, provavelmente a escape posterior prematuro.
Na prova do LD3mL, o tempo de reação foi superior no grupo de DPi com
DPi com LD20mL foram menores que a encontrada na prova de LD3mL (p>0.05) (Gráfico 4).
No grupo controlo, no grupo com DPi com LD>20mL e também no grupo DPi total verificou-se um claro aumento nos tempos de reação quando comparámos a prova de LD3mL com as provas de DF. No grupo controlo, esta diferença foi significativa quando comparámos as provas de DFL e DL3mL (p<0.05). Os doentes com LD20mL, não apresentaram tempos de reação diferentes (p>0.05) nas provas LD3mL, DFL e DFN (Gráfico 4).
DISCUSSÃO
Nos últimos anos têm surgido vários estudos sobre a prevalência e as alterações da deglutição encontradas em indivíduos com DPi. As descobertas do presente estudo são discutidas abaixo, divididos por secções.
Limite de Disfagia (LD)
No presente estudo, de um total de onze indivíduos com DPi, três (27%) apresentaram
um LD>20mL e oito (73%) um LD20mL. Todos os controlos incluídos no estudo obtiveram um LD>20mL e uma média de LD superior à de ambos os grupos de doentes. Estudos anteriores, que incluíram indivíduos com DP, com amostras superiores à do presente estudo, reportaram LD20mL em 53% (n=58)(21) e 91% (n=33)(42), destes doentes. Um outro
estudo, com amostra semelhante (n=10) à incluída neste trabalho, encontrou um LD20mL em 60% dos doentes(32).
A diminuição do LD em doentes com DPi pode ser explicada por alterações motoras mas também por alterações sensoriais, menos estudadas e mais associadas a estadios tardios da doença(20) . Se a informação sensorial gerada pelos sensores presentes na cavidade oral não corresponder às características do bolo, isto poderá resultar numa incorreta avaliação a nível do sistema nervoso central e no consequente fracionamento durante a deglutição. Este parece ser um mecanismo compensatório de proteção, devido à insuficiente informação acerca do bolo(10). Neste estudo, contudo, não foram incluídos doentes em estadios avançados da doença, pelo que a justificação para a diminuição do LD, poderá estar associada, essencialmente, aos aspetos motores da doença. A rigidez e bradicinesia, características da doença originam um conjunto de alterações na fase oral da deglutição. Os estudos sugerem que, desde cedo, ocorrem alterações, como o pumping lingual ou a
lentificação de movimentos, que dificultam o controlo do bolo na cavidade oral (17,18). Estas alterações podem justificar a necessidade de uma deglutição fracionada de pequenos volumes, sobretudo de volumes líquidos, que pelas suas características são mais difíceis de conter e controlar. Nestes doentes é, também, frequente um atraso no desencadear do reflexo de deglutição, na transição para a fase faríngea(19,20), o que pode resultar numa perda de controlo sobre o volume de líquido, e na necessidade de o fracionar.
deglutição. Embora a correlação entre o LD e a pontuação total do SDQ tenha sido baixa, o participante com menor LD (3mL) foi o único que apresentou um score de SDQ>11, indicativo de risco de aspiração e, portanto, de uma disfagia mais grave. Para além deste, cinco outros doentes com LD20mL, e um com LD>20mL, assinalaram algum grau de dificuldade nos itens do SDQ associados à fase oral da deglutição, nomeadamente à permanência de resíduos na cavidade oral e à queda anterior de alimento durante a deglutição. Sendo o SDQ um questionário que se baseia na perceção do doente, não podemos esquecer que os estudos indicam que a população com DPi apresenta, frequentemente, uma perceção alterada relativamente às alterações associadas à sua condição neurológica(24–26). Neste estudo, contudo, o SDQ apresenta uma boa correlação com a pontuação total e parte motora da MDS-UPDRS. Assim, as informações reportadas pelos doentes relativamente às alterações da deglutição parecem estar diretamente relacionadas com os dados relativos à progressão da doença, o que nos dá alguma confiança na análise dos resultados deste questionário.
Duração das fases da deglutição e amplitude do sinal de EMGs
duração desta fase nos indivíduos com DP, pode ser explicada pela maior duração das fases voluntária e reflexa (intervalos A-0, 0-2 e 2-C).
Relativamente à duração do intervalo A-0, verificou-se a mesma tendência que a observada para o intervalo A-C. Foi o grupo de doentes com LD>20mL a apresentar maior duração. No entanto, o facto de este grupo incluir apenas três doentes, torna este resultado pouco significativo. O grupo que incluiu todos os doentes e o grupo de DPi com LD20mL apresentaram maior duração desta fase, comparativamente ao grupo controlo, embora estas diferenças não tenham sido significativas. No nosso estudo, o grupo com DPi com LD20mL apresentou valores superiores aos reportados noutros estudos feitos com o mesmo volume, ou volume inferior(21,30,42). O mesmo se verificou para o grupo controlo, quando comparamos com os mesmos estudo(21,30,42) e com um outro que estudou apenas indivíduos sem patologia, em diferentes faixas etárias(73). Estas diferenças podem, mais uma vez, ser explicadas pelas diferenças entre as amostras, nomeadamente no que diz respeito à dimensão, pela diferença de volumes usados, que foi menor em um dos estudos mencionados (2mL) (30), mas também pela existência de movimentos de hesitação que, no presente estudo, foram observados em três doentes, dois pertencentes ao grupo com LD20mL e um pertencente ao grupo com LD>20mL.
A tendência observada, de prolongamento desta fase nos doentes, pode ser explicada pelas alterações que desde cedo ocorrem na fase oral em doentes com DP, como a lentificação dos movimentos da língua e a existência de hesitações quando se tenta iniciar o movimento de propulsão(17,18). Estes podem ser explicados por sintomas comuns na DP, como a rigidez e a bradicinesia, e resultar num atraso da transição da fase voluntária para a fase reflexa da deglutição.
O tempo necessário para a elevação e estabilização laríngea (intervalo 0-2) foi, no presente estudo, menor no grupo controlo, quando comparado com os grupos de doentes.
diferentes estudos, com diferentes metodologias de avaliação(19–22) parece ser altamente específica da doença de Parkinson(21), algo que é suportado pelo presente estudo.
Os valores de amplitude máxima retificada e suavizada, em microvolts, ou normalizada ao pico máximo, não revelaram qualquer diferença significativa entre os grupos, situação também verificada em estudos anteriores(21). Verificámos, contudo, que a amplitude retificada e suavizada parece, no nosso estudo, ser superior em indivíduos sem patologia, mas que esta tendência se inverte quando normalizamos os valores ao pico máximo obtido durante a deglutição, de cada indivíduo. No entanto, todos os valores são muito próximos pelo que as diferenças não são significativas.
Deglutição fracionada
Nesta prova, indivíduos saudáveis e com DPi, evidenciaram sinais de hesitação na fase oral da deglutição, o que pode ser explicado pelo aumento de complexidade da prova, quando comparada com deglutições únicas, pelo facto de requerer capacidade de controlo do volume na cavidade oral, enquanto se realiza o fracionamento. Estas hesitações foram mais frequentes no grupo com DPi, especialmente na prova de DFL, o que pode ser explicado pelas alterações na fase oral, características nesta doença e acima mencionadas, e pela maior dificuldade no controlo de volumes líquidos, pelas características deste tipo de consistência.
Relativamente ao número de deglutições, o grupo com DPi com LD>20mL, apresentou o maior número de deglutições, em ambas as provas, algo que não foi antecipado, mas que pode mais uma vez ser explicado pela reduzida dimensão da amostra. O grupo controlo apresentou, para ambas as consistências, maior número de deglutições que o grupo de DPi total e que o grupo com LD20mL. Esta diferença foi mais expressiva no caso da consistência néctar, sobretudo entre o grupo controlo e o grupo de indivíduos com DPi e LD20mL. Este resultado pode ser explicado pelo melhor controlo oral apresentado pelos indivíduos saudáveis, quando comparados com os DP. No entanto, esperava-se que ambos os grupos realizassem mais deglutições de néctar do que de líquido. Isto aconteceu no grupo
A duração do intervalo entre deglutições foi inferior no grupo de controlo, comparativamente aos grupos de doentes, em ambas as provas. A diferença entre controlos e doentes com LD20mL foi significativa no caso da consistência líquida. Para esta consistência, todos os grupos apresentaram intervalos maiores entre deglutições, no entanto esta diferença foi pequena no caso do grupo controlo e no grupo com LD>20mL. Assim, verificamos que todos os grupos conseguem mais rapidamente fracionar a consistência néctar, e que no caso do grupo controlo e indivíduos com LD>20mL, embora isto seja verdade, existe uma pequena diferença no desempenho, relativamente a esta variável. O
grupo com LD20mL revela, contudo, uma maior diferença na duração deste intervalo quando comparadas as duas consistências. Isto pode ser indicativo de uma maior dificuldade no controlo e fracionamento de um volume líquido mantido na cavidade oral. No entanto, a diferença encontrada entre as duas consistências faz-nos considerar que, tal como a própria deglutição fracionada, este aumento no intervalo entre deglutições, poderá constituir um mecanismo compensatório de proteção. Para que tal seja esclarecido, são, contudo, necessários mais estudos.
Nas provas de DFL dois doentes pertencentes ao grupo com LD20mL, deglutiram antes do sinal imperativo. Estes doentes apresentaram LD de 3mL e 5mL. A ocorrência da deglutição antes do sinal deveu-se, provavelmente a dificuldades no controlo do bolo, que resultarem em escape posterior prematuro para a faringe, que levou ao desencadear do reflexo de deglutição. Estes dados corroboram a hipótese que, os reduzidos LD apresentados por estes doentes estão associados a dificuldades na fase oral da deglutição. Na prova de DFN, esta perda prematura para a faringe não aconteceu, o que pode ser uma indicação que uma pequena adaptação na consistência (espessamento dos líquidos para néctar) poderá, nos doentes com DPi, facilitar o controlo oral, mesmo em casos de LD muito pequenos. Funcionalmente, nas refeições, estes doentes tendem a colocar volumes superiores aos seus LD na cavidade oral, pelo que a capacidade de controlar o bolo, enquanto fazem o fracionamento para deglutição, é muito importante para uma deglutição segura, sem risco para a função respiratória.
Tempo de reação
com DPi e parkinsonismo atípicos (atrofia multissistémia e paralisia supranuclear progressiva), pode, segundo os autores desse trabalho, ser explicada por dificuldades no processamento do estímulo auditivo apresentado como pista ou uma disfunção na pré-programação ou início da resposta motora, causada por uma disfunção nas vias que conectam os gânglios da base ao córtex pré-motor e áreas motoras suplementares, na região frontal(30). Na realidade, embora os participantes do estudo não tenham revelado défices cognitivos, de acordo com o questionário aplicado (MEEM), não foi feita uma avaliação cognitiva detalhada. Deste modo, não podemos determinar, com certeza que a causa desta diferença nos tempos de reação não esteja relacionada, também, com questões cognitivas. Em todos os grupos, os tempos de reação foram superiores nas provas de deglutição fracionada, o que pode ser explicado pelo facto de esta ser uma prova que requer um planeamento motor mais complexo.
Tal como reportado num estudo anterior(21), não se verificaram correlações entre o LD e as durações dos intervalos A-C, A-0 e 0-2. De igual modo, não se verificaram correlações entre este teste e as variáveis analisadas nas provas de DF ou o tempo de reação. No entanto, os doentes com LD mais baixos parecem ser os que apresentaram piores resultados nas diferentes variáveis analisadas.
Importa referir que uma das principais limitações deste estudo prende-se com a reduzida dimensão da amostra dada a dificuldade em recrutar doentes com DPi com características semelhantes. Este aspeto resultou numa importante variabilidade dos dados. Por este motivo, fizemos uma análise essencialmente descritiva e com carácter exploratório, dos valores encontrados. Os resultados estatísticos devem ser essencialmente interpretados como sugestivos da presença de diferenças.
Conclusões
A reduzida dimensão da amostra limita a generalização de qualquer conclusão retirada a partir do presente estudo.
Bibliografia
1. Sveinbjornsdottir S. The clinical symptoms of Parkinson’s disease. J Neurochem. 2016 Jul 1;n/a – n/a.
2. de Lau LML, Breteler MMB. Epidemiology of Parkinson’s disease. Lancet Neurol.
2006 Jun;5(6):525–35.
3. Clarke CE, Moore AP. Parkinson’s disease. BMJ Clin Evid. 2007;2007.
4. Wood LD, Neumiller JJ, Setter SM, Dobbins EK. Clinical review of treatment options
for select nonmotor symptoms of Parkinson’s disease. Am J Geriatr Pharmacother. 2010
Aug;8(4):294–315.
5. Logemann JA, Gensler G, Robbins J, Lindblad AS, Brandt D, Hind JA, et al. A randomized study of three interventions for aspiration of thin liquids in patients with
dementia or Parkinson’s disease. J Speech Lang Hear Res JSLHR. 2008 Feb;51(1):173– 83.
6. Wang X, You G, Chen H, Cai X. Clinical course and cause of death in elderly patients
with idiopathic Parkinson’s disease. Chin Med J (Engl). 2002 Sep;115(9):1409–11. 7. Nóbrega AC, Rodrigues B, Melo A. Is silent aspiration a risk factor for respiratory
infection in Parkinson’s disease patients? Parkinsonism Relat Disord. 2008
Dec;14(8):646–8.
8. Miller AJ. Deglutition. Physiol Rev. 1982 Jan;62(1):129–84.
9. Bakheit AM. Management of neurogenic dysphagia. Postgrad Med J. 2001 Nov;77(913):694–9.
10. Ertekin C, Aydogdu I. Neurophysiology of swallowing. Clin Neurophysiol Off J Int Fed Clin Neurophysiol. 2003 Dec;114(12):2226–44.
11. Ertekin C, Palmer JB. Physiology and electromyography of swallowing and its disorders. Suppl Clin Neurophysiol. 2000;53:148–54.
12. Miller AJM. Neuroscientific Principles of Swallowing and Dysphagia. 1st Edition. Sydney, Austrália: Singular Publishing Group; 1999.
13. Ohmae Y, Logemann JA, Kaiser P, Hanson DG, Kahrilas PJ. Timing of glottic closure during normal swallow. Head Neck. 1995 Oct;17(5):394–402.
14. Perlman A, Schulze-Delrieu K. Deglutition and Its Disorders: Anatomy, Physiology, Clinical Diagnosis, and Management. Singular Publishing Group; 1997. 544 p.
15. Chi-Fishman G, Stone M, McCall GN. Lingual action in normal sequential swallowing. J Speech Lang Hear Res JSLHR. 1998 Aug;41(4):771–85.
17. Umemoto G, Tsuboi Y, Kitashima A, Furuya H, Kikuta T. Impaired food transportation
in Parkinson’s disease related to lingual bradykinesia. Dysphagia. 2011 Sep;26(3):250–
5.
18. Nagaya M, Kachi T, Yamada T, Igata A. Videofluorographic study of swallowing in
Parkinson’s disease. Dysphagia. 1998;13(2):95–100.
19. Robbins JA, Logemann JA, Kirshner HS. Swallowing and speech production in
Parkinson’s disease. Ann Neurol. 1986 Mar;19(3):283–7.
20. Ertekin C. Electrophysiological evaluation of oropharyngeal Dysphagia in Parkinson’s disease. J Mov Disord. 2014 Oct;7(2):31–56.
21. Ertekin C, Tarlaci S, Aydogdu I, Kiylioglu N, Yuceyar N, Turman AB, et al. Electrophysiological evaluation of pharyngeal phase of swallowing in patients with
Parkinson’s disease. Mov Disord Off J Mov Disord Soc. 2002 Sep;17(5):942–9.
22. Stroudley J, Walsh M. Radiological assessment of dysphagia in Parkinson’s disease. Br
J Radiol. 1991 Oct;64(766):890–3.
23. Suttrup I, Warnecke T. Dysphagia in Parkinson’s Disease. Dysphagia. 2016 Feb;31(1):24–32.
24. Leow LP. Mechanisms of airway protection in ageing and Parkinson’s disease. 2007 [cited 2016 Apr 14]; Available from: http://ir.canterbury.ac.nz:80/handle/10092/1461
25. Shaker R, Belafsky PC, Postma GN, Easterling C. Principles of Deglutition: A Multidisciplinary Text for Swallowing and its Disorders. Springer Science & Business Media; 2012. 994 p.
26. Bushmann M, Dobmeyer SM, Leeker L, Perlmutter JS. Swallowing abnormalities and
their response to treatment in Parkinson’s disease. Neurology. 1989 Oct;39(10):1309–
14.
27. Kalf JG. Drooling and dysphagia in Parkinson’s disease. Nijmegen: Radboud University; 2011.
28. Stepp CE. Surface electromyography for speech and swallowing systems: measurement, analysis, and interpretation. J Speech Lang Hear Res JSLHR. 2012 Aug;55(4):1232–46. 29. Cram JR, Criswell E. Cram’s Introduction to Surface Electromyography. Jones &
Bartlett Learning; 2011. 436 p.
30. Alfonsi E, Versino M, Merlo IM, Pacchetti C, Martignoni E, Bertino G, et al. Electrophysiologic patterns of oral-pharyngeal swallowing in parkinsonian syndromes. Neurology. 2007 Feb 20;68(8):583–9.
32. Belo LR, Gomes NAC, Coriolano M das GW de S, de Souza ES, Moura DAA, Asano AG, et al. The relationship between limit of Dysphagia and average volume per swallow
in patients with Parkinson’s disease. Dysphagia. 2014 Aug;29(4):419–24.
33. Aydogdu I, Kiylioglu N, Tarlaci S, Tanriverdi Z, Alpaydin S, Acarer A, et al. Diagnostic value of “dysphagia limit” for neurogenic dysphagia: 17 years of experience in 1278 adults. Clin Neurophysiol Off J Int Fed Clin Neurophysiol. 2015 Mar;126(3):634–43.
34. Tawadros PB, Cordato D, Cathers I, Burne JA. An electromyographic study of parkinsonian swallowing and its response to levodopa. Mov Disord Off J Mov Disord Soc. 2012 Dec;27(14):1811–5.
35. Vaiman M, Eviatar E, Segal S. Surface electromyographic studies of swallowing in normal subjects: a review of 440 adults. Report 3. Qualitative data. Otolaryngol--Head Neck Surg Off J Am Acad Otolaryngol-Head Neck Surg. 2004 Dec;131(6):977–85. 36. Reddy NP, Thomas R, Canilang EP, Casterline J. Toward classification of dysphagic
patients using biomechanical measurements. J Rehabil Res Dev. 1994 Nov;31(4):335– 44.
37. Reddy NP, Katakam A, Gupta V, Unnikrishnan R, Narayanan J, Canilang EP. Measurements of acceleration during videofluorographic evaluation of dysphagic patients. Med Eng Phys. 2000 Jul;22(6):405–12.
38. Reddy NP, Canilang EP, Casterline J, Rane MB, Joshi AM, Thomas R, et al. Noninvasive acceleration measurements to characterize the pharyngeal phase of swallowing. J Biomed Eng. 1991 Sep;13(5):379–83.
39. Suryanarayanan S, Reddy NP, Canilang EP. A fuzzy logic diagnosis system for classification of pharyngeal dysphagia. Int J Biomed Comput. 1995 Mar;38(3):207–15. 40. Lee J, Steele CM, Chau T. Classification of healthy and abnormal swallows based on
accelerometry and nasal airflow signals. Artif Intell Med. 2011 May;52(1):17–25. 41. Kim YH, Oh B-M, Jung I-Y, Lee JC, Lee GJ, Han TR. Spatiotemporal characteristics of
swallowing in Parkinson’s disease. The Laryngoscope. 2015 Feb;125(2):389–95. 42. Ertekin C, Aydogdu I, Yüceyar N, Tarlaci S, Kiylioglu N, Pehlivan M, et al.
Electrodiagnostic methods for neurogenic dysphagia. Electroencephalogr Clin Neurophysiol. 1998 Aug;109(4):331–40.
43. Ertekin C, Aydoğdu I, Yüceyar N. Piecemeal deglutition and dysphagia limit in normal subjects and in patients with swallowing disorders. J Neurol Neurosurg Psychiatry. 1996 Nov;61(5):491–6.
44. Eisenhuber E, Schima W, Schober E, Pokieser P, Stadler A, Scharitzer M, et al. Videofluoroscopic assessment of patients with dysphagia: pharyngeal retention is a predictive factor for aspiration. AJR Am J Roentgenol. 2002 Feb;178(2):393–8.
46. Selçuk B, Uysal H, Aydogdu I, Akyuz M, Ertekin C. Effect of temperature on electrophysiological parameters of swallowing. J Rehabil Res Dev. 2007;44(3):373–80. 47. Newman R, Vilardell N, Clavé P, Speyer R. Effect of Bolus Viscosity on the Safety and Efficacy of Swallowing and the Kinematics of the Swallow Response in Patients with Oropharyngeal Dysphagia: White Paper by the European Society for Swallowing Disorders (ESSD). Dysphagia. 2016 Apr;31(2):232–49.
48. Chen MY, Ott DJ, Peele VN, Gelfand DW. Oropharynx in patients with cerebrovascular disease: evaluation with videofluoroscopy. Radiology. 1990 Sep;176(3):641–3.
49. Clavé P, Arreola V, Romea M, Medina L, Palomera E, Serra-Prat M. Accuracy of the volume-viscosity swallow test for clinical screening of oropharyngeal dysphagia and aspiration. Clin Nutr Edinb Scotl. 2008 Dec;27(6):806–15.
50. Rofes L, Arreola V, Clavé P. The volume-viscosity swallow test for clinical screening of dysphagia and aspiration. Nestlé Nutr Inst Workshop Ser. 2012;72:33–42.
51. Kuhlemeier KV, Palmer JB, Rosenberg D. Effect of liquid bolus consistency and delivery method on aspiration and pharyngeal retention in dysphagia patients. Dysphagia. 2001;16(2):119–22.
52. Rofes L, Arreola V, Mukherjee R, Swanson J, Clavé P. The effects of a xanthan gum-based thickener on the swallowing function of patients with dysphagia. Aliment Pharmacol Ther. 2014 May;39(10):1169–79.
53. Rofes L, Arreola V, Mukherjee R, Clavé P. Sensitivity and specificity of the Eating Assessment Tool and the Volume-Viscosity Swallow Test for clinical evaluation of oropharyngeal dysphagia. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2014 Sep;26(9):1256–65.
54. Leonard RJ, White C, McKenzie S, Belafsky PC. Effects of bolus rheology on aspiration in patients with Dysphagia. J Acad Nutr Diet. 2014 Apr;114(4):590–4. 55. Leder SB, Judson BL, Sliwinski E, Madson L. Promoting safe swallowing when puree
is swallowed without aspiration but thin liquid is aspirated: nectar is enough. Dysphagia. 2013 Mar;28(1):58–62.
56. Bhattacharyya N, Kotz T, Shapiro J. The effect of bolus consistency on dysphagia in unilateral vocal cord paralysis. Otolaryngol--Head Neck Surg Off J Am Acad Otolaryngol-Head Neck Surg. 2003 Dec;129(6):632–6.
57. Clavé P, de Kraa M, Arreola V, Girvent M, Farré R, Palomera E, et al. The effect of bolus viscosity on swallowing function in neurogenic dysphagia. Aliment Pharmacol Ther. 2006 Nov 1;24(9):1385–94.
58. Taniguchi H, Tsukada T, Ootaki S, Yamada Y, Inoue M. Correspondence between food consistency and suprahyoid muscle activity, tongue pressure, and bolus transit times during the oropharyngeal phase of swallowing. J Appl Physiol Bethesda Md 1985. 2008
59. Zu Y, Yang Z, Perlman AL. Hyoid displacement in post-treatment cancer patients: preliminary findings. J Speech Lang Hear Res JSLHR. 2011 Jun;54(3):813–20.
60. Matsuo K, Kawase S, Wakimoto N, Iwatani K, Masuda Y, Ogasawara T. Effect of viscosity on food transport and swallow initiation during eating of two-phase food in normal young adults: a pilot study. Dysphagia. 2013 Mar;28(1):63–8.
61. Bisch EM, Logemann JA, Rademaker AW, Kahrilas PJ, Lazarus CL. Pharyngeal effects of bolus volume, viscosity, and temperature in patients with dysphagia resulting from neurologic impairment and in normal subjects. J Speech Hear Res. 1994 Oct;37(5):1041–59.
62. Choi KH, Ryu JS, Kim MY, Kang JY, Yoo SD. Kinematic analysis of dysphagia: significant parameters of aspiration related to bolus viscosity. Dysphagia. 2011 Dec;26(4):392–8.
63. Inamoto Y, Saitoh E, Okada S, Kagaya H, Shibata S, Ota K, et al. The effect of bolus viscosity on laryngeal closure in swallowing: kinematic analysis using 320-row area detector CT. Dysphagia. 2013 Mar;28(1):33–42.
64. Stachler RJ, Hamlet SL, Mathog RH, Jones L, Heilbrun LK, Manov LJ, et al. Swallowing of bolus types by postsurgical head and neck cancer patients. Head Neck. 1994 Oct;16(5):413–9.
65. Dantas RO, Kern MK, Massey BT, Dodds WJ, Kahrilas PJ, Brasseur JG, et al. Effect of swallowed bolus variables on oral and pharyngeal phases of swallowing. Am J Physiol. 1990 May;258(5 Pt 1):G675–81.
66. Goetz CG, Tilley BC, Shaftman SR, Stebbins GT, Fahn S, Martinez-Martin P, et al. Movement Disorder Society-sponsored revision of the Unified Parkinson’s Disease
Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord Off J Mov Disord Soc. 2008 Nov 15;23(15):2129–70.
67. Guerreiro S, Leitão O, Castro-Caldas A, Garcia C. Adaptação à população portuguesa
da tradução do “Mini mental state examination (MMSE).” Rev Port Neurol. 1994;3:9–
10.
68. Queirós A, Moreira S, Silva A, Costa R, Lains J. Contributo para a Adaptação e Validação da Eat Assessment Tool (EAT-10) e da Functional Oral Intake Scale (FOIS). Rev Soc Port Med Física E Reabil. 2014 Jan 27;24(2):25–30.
69. Archer SK, Garrod R, Hart N, Miller S. Dysphagia in Duchenne Muscular Dystrophy Assessed Objectively by Surface Electromyography. Dysphagia. 2012 Nov 21;28(2):188–98.
70. Vaiman M, Segal S, Eviatar E. Surface electromyographic studies of swallowing in normal children, age 4-12 years. Int J Pediatr Otorhinolaryngol. 2004 Jan;68(1):65–73. 71. Zoratto DCB, Chau T, Steele CM. Hyolaryngeal excursion as the physiological source
72. Athukorala RP, Jones RD, Sella O, Huckabee M-L. Skill training for swallowing rehabilitation in patients with Parkinson’s disease. Arch Phys Med Rehabil. 2014 Jul;95(7):1374–82.
73. Physiological Changes In Oropharyngeal Swallowing With Age:An Electrophysiological Study [Internet]. ResearchGate. [cited 2017 Mar 5]. Available from: