PUC-SP
Andréia Rodrigues Parnoff Stadulni
ESTIMATIVA DA PERDA AUDITIVA EM NEONATOS
NASCIDOS EM HOSPITAIS MUNICIPAIS DE SÃO PAULO
MESTRADO EM FONOAUDIOLOGIA
Andréia Rodrigues Parnoff Stadulni
ESTIMATIVA DA PERDA AUDITIVA EM NEONATOS
NASCIDOS EM HOSPITAIS MUNICIPAIS DE SÃO PAULO
Dissertação apresentada à Banca Examinadora da Pontifícia Universidade Católica de São Paulo, como exigência parcial para obtenção do título de MESTRE em Fonoaudiologia, sob a orientação da Profª. Drª. Doris Ruthi Lewis.
Stadulni, Andréia Rodrigues Parnoff.
Estimativa da perda auditiva em neonatos nascidos em Hospitais Municipais de São Paulo / Andréia Rodrigues Parnoff Stadulni – São Paulo, 2013. 74 f.
Dissertação (Mestrado) - Pontifícia Universidade Católica de São Paulo. Programa de Estudos Pós-Graduados em Fonoaudiologia. Área de concentração: Clínica Fonoaudiológica. Linha de Pesquisa: Audição na Criança. Orientadora: Profª. Drª. Doris Ruthi Lewis
Estimation of hearing loss in newborns born in São Paulo city hospitals 1. Prevalência. 2. Perda auditiva. 3. Recém-nascido
ESTIMATIVA DA PERDA AUDITIVA EM NEONATOS NASCIDOS EM HOSPITAIS MUNICIPAIS DE SÃO PAULO
BANCA EXAMINADORA:
____________________________________________ Profª. Drª. Doris Ruthi Lewis - Orientadora
____________________________________________ Profª. Drª. Ana Cláudia Fiorini
____________________________________________ Profª Drª. Regina Mingroni Netto
____________________________________________ Profª. Drª.
Autorizo, exclusivamente para fins acadêmicos e científicos, a reprodução parcial ou total desta dissertação através de fotocópias ou meios eletrônicos.
___________________________________ Andréia Rodrigues Parnoff Stadulni
ESTIMATIVA DA PERDA AUDITIVA EM NEONATOS NASCIDOS EM HOSPITAIS MUNICIPAIS DE SÃO PAULO
PONTIFÍCIA UNIVERSIDADE CATÓLICA DE SÃO PAULO
PUC-SP
Programa de estudos Pós-Graduados em Fonoaudiologia
Coordenadora do Curso de Pós- Graduação Profª. Drª. Léslie Piccolotto Ferreira
Vice-coordenadora do Curso de Pós- Graduação Profª. Drª. Doris Ruthi Lewis
O valor das coisas não está no tempo em que elas duram, mas na intensidade com que acontecem.
Por isso existem momentos inesquecíveis, coisas inexplicáveis e pessoas incomparáveis.
Dedico este trabalho...
A minha filha Lauren, razão do meu viver;
Te amo!
Agradeço a minha orientadora Profª. Drª. Doris Ruthi Lewis pelos ensinamentos e paciência nestes 24 meses.
A minha grande amiga Leydiane Lima, pelas palavras de apoio e companheirismo nos momentos difíceis, amiga para o que der e vier, estarás no meu coração sempre!
A amiga e companheira de 24 meses de Mestrado Cristiane Cervelli, por sempre estar ao meu lado, nos momentos de alegria, tristeza. Você sempre esteve comigo, eu nunca esquecerei.
A amiga Gabriela Ivo, por me acolher na chegada ao Mestrado e pelas palavras de conforto nos momentos de aflição. Gosto muito de você e te admiro muito como amiga e profissional que és.
As colegas que me acolheram no Centro Audição na Criança quando lá cheguei: Helén, Sabrina, Taise, Natália, Daniele e Paloma. Obrigada pela atenção e paciência de passar a dinâmica do serviço. Em especial a amiga e colega Mabel Gonçalves pelos seus ensinamentos e dedicação a fonoaudiologia: admiro-te muito amiga!! Aos secretários do centro Audição na Criança: Eduardo e Marilei pela ajuda e dedicação.
Aos funcionários da PUC-SP: Marcos (Comitê de ética), João (biblioteca DERDIC), em especial a secretária da Pós Graduação em Fonoaudiologia: Virgínia.
As queridas professoras que muito aprendi e tanto admiro: Profª. Drª. Angelina Martinez, Profª. Drª. Beatriz Novaes e Profª. Drª. Beatriz Mendes.
Às professoras Drª. Ana Cláudia Fiorini e Drª. Regina Mingroni, pela orientação neste trabalho e como consequência a realização de um grande sonho de obter o título de Mestre.
Introdução: após a obrigatoriedade da triagem auditiva neonatal no Brasil, estudos científicos são pertinentes para que se possa traçar um perfil dos neonatos que estão sendo diagnosticados com deficiência auditiva no país. Objetivo: Estimar a perda auditiva (PA) em neonatos nascidos em Hospitais Municipais de São Paulo. Método: Fizeram parte da casuística desta pesquisa 37.479 neonatos nascidos em
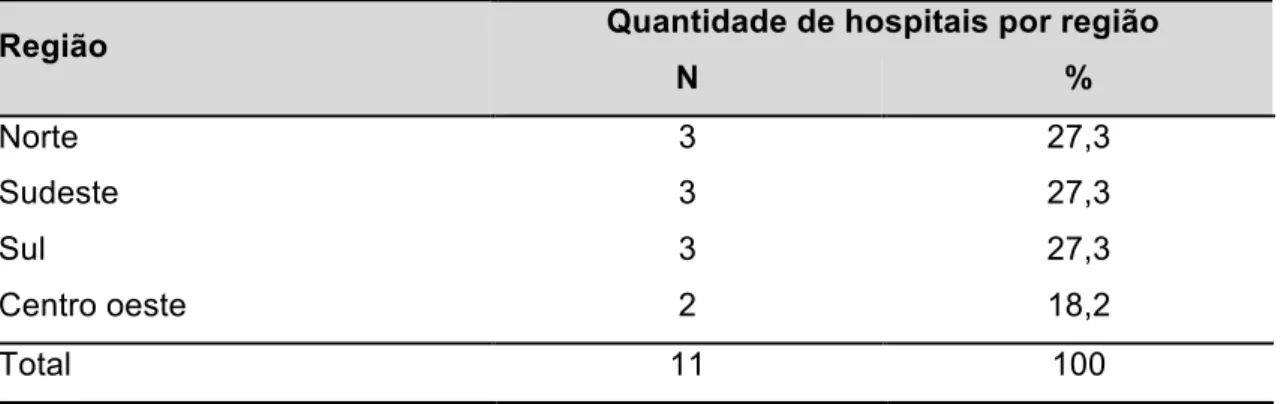
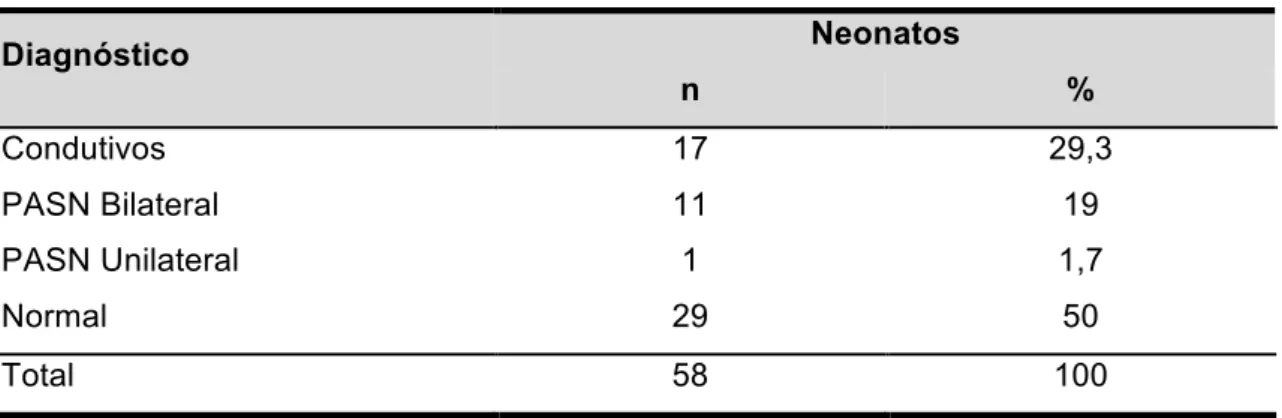
11 hospitais municipais de São Paulo, residentes nas regiões sudeste, centro oeste, norte e sul, no período de outubro de 2010 a outubro de 2011. Destes, os com falha na Triagem Auditiva Neonatal Universal (TANU) eram encaminhados para os Centros de referência em saúde auditiva para diagnóstico audiológico e os com perda auditiva sensorioneural (PASN) realizavam avaliação genética. Resultados: do total de 182.986 nascimentos no município de São Paulo, 37.479 (20,48%) nasceram em 11 Hospitais Municipais ou conveniados e participaram da presente pesquisa. Do total de neonatos encaminhados para diagnóstico audiológico 0,2% (76/37.479), 76,3% (58/76) concluíram o diagnóstico, sendo que o número de PA no seguimento (follow up) foi de (23,69%). Dos que concluíram o diagnóstico audiológico 50% tiveram resultados dentro da normalidade, 29,3% perdas condutivas, 19% PASN bilaterais e 1,7% PASN unilateral. A estimativa da prevalência de PA é 0,01%. Um intervalo de 95% de confiança para essa estimativa é dado por [0,07%; 0,14%]. Dos pacientes que realizaram análise genética, 55,5% não apresentaram alterações para o teste mutação c.35delG, 22,2% permanecem em investigação de síndromes, sendo um de Waardenburg e outro com hipotireoidismo congênito; 11,15% a provável causa da PA é hereditária, pois os pais são consanguíneos, e 11,15% foi identificada mutação c.35delG em homozigose. Conclusão: a estimativa da deficiência auditiva no Município de São Paulo se equipara a de países desenvolvidos.
Introduction: After neonatal hearing screening became mandatory in Brazil, further scientific studies are relevant in order to draw a profile of the newborns diagnosed with hearing loss across the country. Purpose: To estimate hearing loss in infants born at municipal hospitals in São Paulo (SP), Brazil. Methods: Participants were 37,479 infants born at 11 municipal hospitals in São Paulo between October 2010 and October 2011, who resided in the Southeast, Midwest, North or South regions of the city. Subjects who failed the universal neonatal hearing screening (UNHS) were referred to hearing health reference centers for audiological diagnosis, and those with sensorineural hearing loss were genetically assessed. Results: From a total of 182,986 births in the city of São Paulo, 37,479 (20.48%) occurred at the 11 municipal hospitals considered and were selected for this study. Of all the newborns referred for audiological diagnosis (76/37,479=0.2%), 76.3% (58/76) concluded the diagnostic process, with a follow-up loss of 23.69%. From those who concluded the process, 50% presented normal results, 29.3% had conductive hearing loss, 19% had bilateral sensorineural hearing loss, and 1.7% presented unilateral sensorineural hearing loss. The estimated prevalence of hearing loss is 0.10%, with a 95% confidence interval given by [0.07%; 0.14%]. From the subjects who were genetically assessed 5 (55.5%) did not present 35delG mutation, 2 (22.2%) are still under investigation for syndromes (including one for Waardenburg and one for congenital hypothyroidism), 1 (11.15%) had probable hereditary hearing loss due to consanguineous parents, and 1 (11.15%) were homozygous for c.35delG mutation. Conclusion: The estimated hearing loss for the city of São Paulo, Brazil, is equivalent to those of developed countries.
Keywords: Prevalence; Hearing loss; Infant, Newborn
CeAC Centro Audição da Criança
CMV Citomegalovírus
COMUSA Comitê Multiprofissional em Saúde Auditiva
DA Deficiência Auditiva
DERDIC Divisão de Educação e Reabilitação dos Distúrbios da Comunicação DNV Declaração de Nascido Vivo
EOA Emissões Otoacústicas
HIV Vírus da Imunodeficiência Humana/ Human Immunodeficiency Vírus IBGE Instituto Brasileiro de Geografia e Estatística
IDH Índice de Desenvolvimento Humano
IRDA Indicadores de Risco para Deficiência Auditiva JCIH Joint Committee on Infant Hearing
NISA Núcleo Integrado de Saúde Auditiva ORL Otorrinolaringologista
PA Perda Auditiva
PASN Perda Auditiva Sensorioneural
PEATE Potencial Evocado Auditivo de Tronco Encefálico
PEATE-A Potencial Evocado Auditivo de Tronco Encefálico Automático PEPG Programa de Estudos Pós-Graduados
PIB Produto Interno Bruto
PIG Pequeno para idade gestacional
UTI Unidade de Terapia Intensiva
UTIN Unidade de Terapia Intensiva Neonatal UNICAMP Universidade de Campinas
LISTA DE ANEXOS
ANEXO I- Autorizações para utilização de dados de diagnóstico... 70
ANEXO II- Termo de Consentimento Livre Esclarecido Genética... 72
Quadro 1 – Síndromes Genéticas e DA... 30
TABELA 1 – Distribuição de nascimentos nos Hospitais Municipais/ conveniados que participaram da presente pesquisa no período de outubro de 2010 a outubro de 2011 (N=37.479)... 47 TABELA 2 – Distribuição de número de nascimentos por Hospital e encaminhamentos para diagnóstico audiológico após a falha na TANU (N=37.479)... 48 TABELA 3 – Distribuição dos hospitais por região do Município de São Paulo na casuística da presente pesquisa (N=11)... 49 TABELA 4 – Distribuição do gênero dos neonatos encaminhados para diagnóstico audiológico (N=76)... 50 TABELA 5 – Distribuição dos neonatos que concluíram diagnóstico quanto à região de moradia e status do diagnóstico (N=76)... 50 TABELA 6 – Distribuição do status audiológico após a conclusão (N=58)... 51
1. INTRODUÇÃO... 16
1.1 Aspectos epidemiológicos... 18
1.1.1 Prevalência da Perda Auditiva em Neonatos... 19
1.1.2 Prevalência da Perda Auditiva no Brasil... 22
1.1.3 Etiologia da Deficiência Auditiva... 26
1.1.3.1 Fatores pré-natais... 28
1.1.3.2 Fatores pós-natais... 31
1.1.4 Indicadores de Risco para Deficiência Auditiva (IRDA)... 33
1.2 Considerações sobre o Município de São Paulo... 35
2. OBJETIVOS... 38
2.1 Objetivo Geral... 38
2.2 Objetivos Específicos... 38
3. MATERIAL E MÉTODO... 39
3.1 Delineamento, população e período do estudo... 39
3.2 Procedimento para coleta de dados... 42
3.2.1 Primeira etapa... 43
3.2.2 Segunda etapa... 44
3.2.3 Terceira etapa... 45
3.3 Análise Estatística... 46
3.4 Plano de Análise... 46
4. RESULTADOS... 47
4.1 Caracterização dos nascimentos no Município de São Paulo... 47
4.2 Caracterização dos neonatos encaminhados para diagnóstico audiológico... 50
4.3 Caracterização dos neonatos que concluíram o diagnóstico audiológico... 51
4.4 Caracterização dos neonatos que concluíram a Avaliação Genética... 55
5. DISCUSSÃO... 56
6. CONCLUSÃO... 61
7. REFERÊNCIAS BIBLIOGRÁFICAS... 62
1. INTRODUÇÃO
A audição é um sentido fundamental para o desenvolvimento cognitivo e
social. Por essa razão, quando uma criança é acometida por uma deficiência
auditiva (DA), as consequências refletem diretamente na linguagem receptiva e
expressiva, no desenvolvimento educacional e nas relações sociais.
Um dado importante é que os custos para a identificação da deficiência
auditiva bem como para a intervenção precoce são inferiores àqueles despendidos
na educação de uma criança reabilitada. Estudos com experiências internacionais
evidenciaram, ainda, que a educação especial é três vezes mais dispendiosa do que
a manutenção de uma criança deficiente auditiva em escola regular, mesmo quando
utilizado apoio especializado (Schroeder et al., 2006).
Além disso, a importância do diagnóstico precoce está diretamente
relacionada as intervenções que podem ser realizadas de forma a se obter
benefícios com a plasticidade neuronal, que tem seu ápice aos seis meses de idade,
e é fundamental para o desenvolvimento de conexões cerebrais, promovendo um
prognóstico favorável para o desenvolvimento da linguagem oral dessas crianças
(Boechat, 2002).
De fato, a obrigatoriedade da triagem auditiva neonatal (TAN) em hospitais e
maternidades de todo Brasil, por meio da Lei Federal nº 12.303, de 2 de agosto de
2010, foi uma conquista para a Fonoaudiologia, que comprovou, por meio de
evidências científicas, a importância do diagnóstico precoce para o desenvolvimento
das habilidades de comunicação, ao reduzir o impacto que a perda auditiva (PA)
acarreta na vida adulta.
Nesse contexto, a detecção da causa da deficiência auditiva é igualmente
fundamental, tanto para sua prevenção como para a adequação dos métodos
fonoaudiológicos e educacionais que deverão ser utilizados durante a reabilitação
(Russo e Santos, 1989).
Mas novas preocupações têm mobilizado os pesquisadores da área: quantas
o diagnóstico após a falha na triagem? E destas, quais as prováveis etiologias da
deficiência auditiva?
Por isso, é extremamente necessária, e pertinente, a realização de estudos
científicos que proporcionem dados sobre a TAN, para que se possa traçar um perfil
dos neonatos que estão sendo diagnosticados com deficiência auditiva no país.
O conhecimento sobre a epidemiologia dessa deficiência, ou seja, sobre sua
prevalência e seus determinantes, é importante para que sejam tomadas as medidas
preventivas necessárias, além de permitir uma organização mais eficaz dos serviços
de saúde que realizam as ações de intervenção e reabilitação (Arakawa et al., 2010).
Considerada como a principal ciência da informação em saúde, a
epidemiologia tem sido definida como forma de quantificar, por meio de números,
técnicas de amostragens e de análises estatísticas, os fenômenos saúde e doença,
contribuindo para o conhecimento sintético e totalizante das situações de saúde das
populações humanas (Almeida Filho e Rouquayrol, 2006).
Porém, estudos epidemiológicos em fonoaudiologia são raros; isso se dá
devido ao fato de os profissionais da área estarem mais voltados para o atendimento
clínico individual, pouco contemplando a dimensão do coletivo e da saúde da
população em geral. A incorporação do método epidemiológico na prática
fonoaudiológica contribuirá para uma formação mais humanística, pois os preceitos
éticos serão mais respeitados e a cidadania estimulada, tornando-a uma área mais
acessível e voltada ao social (Lessa, Cavalheiro e Ferrite, 1997).
Segundo orientação do Comitê Multiprofissional em Saúde Auditiva -
COMUSA, elaborar recomendações sobre a Triagem Auditiva Neonatal Universal
(TANU) é de suma importância para a promoção da saúde da gestante, dos
neonatos e lactentes, no que diz respeito à prevenção de perdas auditivas por meio
de medidas específicas a serem aplicadas após estudos epidemiológicos de
prevalência e determinantes dessa patologia. Tais orientações vêm ao encontro da
necessidade desse tipo de estudo para a organização de ações de promoção,
prevenção e tratamento em saúde auditiva (Lewis et al., 2010).
Um levantamento epidemiológico da prevalência da deficiência auditiva em
pública nos vários níveis de atenção à saúde, para que seja criada uma rede de
cuidados que possa organizar e propor resoluções às demandas em saúde da
população.
Diante do exposto, o presente estudo tem a finalidade de estimar a as perdas
auditivas em neonatos nascidos nos hospitais municipais de São Paulo e que
realizaram a TANU.
1.1 Aspectos epidemiológicos
Conceito usado pela epidemiologia, o termo prevalência refere-se à força com
que certas doenças subsistem nas coletividades, sendo sua medida mais simples a
frequência absoluta dos casos. Com isso, é possível estimar e comparar, no tempo e
no espaço, a ocorrência de uma doença em relação a variáveis referentes à
população. Já o termo incidência, diz respeito à medida de quantas pessoas
tornaram-se doentes. Ambos os conceitos envolvem espaço e tempo, ou seja, quem
está ou ficou doente num determinado lugar e numa dada época (Almeida Filho e
Rouquayrol, 2006).
A distribuição da DA e os seus aspectos epidemiológicos estão relacionados
às diferentes características populacionais e regionais, sendo muitas as possíveis
causas do distúrbio. Ainda que a investigação diagnóstica da DA deva ser ampla, de
30 a 50% dos casos permanecem sem etiologia conhecida (Mozaria et al., 2004).
As estimativas sobre a prevalência da DA na infância em todo mundo são
dificultadas pela grande variação de objetivos dos inúmeros estudos. São
encontrados estudos cujo objetivo é definir casos de DA; outros descrevê-los, e há
ainda os que buscam definir sua prevalência em determinada população. A esse
respeito, Davis e Davis (2010) advertiram que não se deve estudar a prevalência da
DA pelo número de aparelhos de amplificação distribuídos, ou pelo tamanho da lista
de espera de determinado serviço, pois trata-se de um distúrbio que nem sempre é
percebido pela população. Para os autores, a prevalência pode ser estimada por
1.1.1 Prevalência da Perda Auditiva em Neonatos
Nos países desenvolvidos, a deficiência auditiva sensorioneural é observada
entre uma a três crianças por 1000 nascimentos (Mozaria et al., 2004; Joint Committee on Infant Hearing, 2007).
Em estudo sobre a TANU em um hospital do México, Arellano, Garza e Muller
(2006) tiveram como objetivo diagnosticar perdas auditivas uni ou bilateral
congênitas, analisando o total de nascimentos entre novembro de 2003 e novembro
de 2005, num total de 3.069 nascimentos, sendo triados 3.066 (99,9%) neonatos.
Considerando todos os 3.069 neonatos, a ocorrência de neonatos com Indicadores
de Risco para Deficiência Auditiva (IRDA) foi de 2,37% (7/3069); dessas, sete
crianças foram encaminhadas para diagnóstico, sendo que três apresentaram
fatores de risco, segundo o Joint Committee on Infant Hearing (JCIH), em cinco
casos foi constatada perda auditiva sensorioneural (PASN) bilateral moderada; uma
perda auditiva condutiva e outra foi classificada como tendo audição normal. A
ocorrência de todas as formas de perda auditiva congênita foi de 1,95 para cada
1000 recém-nascidos, enquanto a ocorrência de PASN foi de 1,63 para cada 1000
recém-nascidos (0.97/1000 para o grupo com indicadores de risco e 0.65/1000 para
aqueles sem fatores de risco).
Khandekar et al. (2006) apresentaram as primeiras experiências com a TANU
em Oman na Arábia e evidenciaram que a cobertura da TANU foi de 66,6% (21.387
/32.125). Foram encaminhados para diagnóstico audiológico 36 neonatos (0,17%),
desses 10/21.387 neonatos tiveram resultados dentro da normalidade, 6/21.387
diagnóstico de PASN e 20/21.387 alterações condutivas.
Capua et al. (2007), em estudo realizado na Itália, Siena, com 21.195 neonatos, realizaram a TANU em 19.700 neonatos. Desses, 18.151 passaram e
1.344 realizaram o Potencial Evocado Auditivo de Tronco Encefálico (PEATE), por
apresentarem indicadores de risco; 1.549 foram indicados para reteste, tendo sido
perdidos 255 para seguimento. Dentre aqueles que realizaram o segundo exame,
1.102 passaram e 192 falharam. Do total de PEATE realizados 1.536, passaram
1.501 e foram encaminhados para diagnóstico 35 neonatos (18 do sexo masculino e
bilateral em 24/35 (68,6%) e unilateral em 11/35 (31,4%). Com relação ao tipo de
perda auditiva, a sensorioneural foi predominante (33/35) 94,28%, enquanto a perda
condutiva foi encontrada em (1/35) 2,9%, e a mista em (1/35) 2,9%. A prevalência
estimada para todos os tipos de perda auditiva foi de 1.78/1000 nascidos vivos
35/19.700, e para a perda auditiva bilateral foi de 1.42/1000 28/19.700.
Em estudo na França com população de 33.873 neonatos que realizaram a
TANU, Levêque et al. (2007) relataram que 98,7% passaram e 1,3% falharam (429/33.873), sendo os que falharam encaminhados para diagnóstico. No
diagnóstico, 27 neonatos apresentaram DA. A prevalência encontrada para
população estudada foi de 0,08% (27/33.873).
Com o objetivo de descrever os resultados da TAN em neonatos com IRDA
em um hospital universitário na França, no período de abril de 2001 a março de
2007, Ohl et al. (2009) realizaram estudo com 1.461 neonatos. Destes, 538 (37%) falharam no primeiro teste, mas apenas 432 (80%) realizaram o segundo exame,
dos quais 156 (10%) falharam novamente e foram encaminhados para a realização
do PEATE. Nessa fase, 120 (77%) compareceram e 60 (38%) apresentaram
resultados alterados. Desses, 46 (77%) foram diagnosticados com PASN,
apresentando como IRDA mais significativos: desordem neurológica (13%), asfixia
de grau severo (8,7%), síndromes associadas à perda auditiva (8,7%), infecções
congênitas (8,7%), hereditariedade (6,5%) e anomalias craniofaciais (4,3%). A
prevalência de DA foi de 0,21%.
Paladini et al. (2009), em pesquisa na Itália entre março 2004 e dezembro de
2008, levantaram que 8.748 neonatos (96,30%) passaram no primeiro exame da
TANU, com e sem IRDA. Passaram por reteste 253 (2,78%), dos quais 55 (0,6%)
precisaram realizar PEATE. Desses, 33 (60%) obtiveram resultados normais, 19
(34,54%) PASN, e os demais três neonatos não finalizaram o exame. A ocorrência
da DA nessa pesquisa foi de 1,84%.
Em estudo retrospectivo por meio de banco de dados, tendo como objetivo
estudar os indicadores de risco para deficiência auditiva na Holanda, Van Dommelen
et al. (2010) encontraram uma ocorrência do distúrbio equivalente a 1,8%, sendo 80% de perdas bilaterais e 20% de unilaterais. Os indicadores de risco foram:
presença de anomalias craniofaciais, anomalias sindrômicas e infecções congênitas.
indicadores de risco mais significativos os cuidados neonatais por mais de 12 dias e
o uso de ventilação mecânica. Outros indicadores não tiveram significância
estatística na amostra estudada.
Em estudo realizado durante oito meses na República da Costa do Marfim,
Tanon-Anoh et al. (2010) avaliaram por meio da TAN 1306 neonatos (87,4%), de um
total de 1495 neonatos, sendo a idade média de 4,5 dias. A ocorrência da perda
auditiva nessa população foi de 5,96 por 1000 (7/1174 dos neonatos que
completaram o exame). A idade média ao diagnóstico foi de 22 semanas. As razões
para a não adesão, de acordo com 62 mães contatadas, foram: falta de recursos
financeiros, ausência de perda auditiva, medo da reação do cônjuge e falta de
informações sobre a triagem e a perda auditiva.
Algumas pesquisas sobre a TANU trazem dados referentes à perda no
seguimento (follow up), Shulman et al. (2010) em estudo nos EUA, relataram que o número de crianças que passaram pela triagem auditiva neonatal antes da alta
hospitalar foi de 92%, destas 2% foram encaminhadas para o diagnóstico e
receberam, enquanto 48% foi perda de follow up. As causas dessas perdas seriam:
falta de um banco de dados único, com dados referentes às avaliações dos
neonatos; falta de um equipamento reserva: por vezes o equipamento era enviado
para manutenção e assim alguns neonatos ficaram sem a triagem, tendo que se
deslocar para um centro de diagnóstico para se submeter a triagem; escassez de
fonoaudiólogos especializados na avaliação da população infantil; falta de
conhecimento por parte da equipe do hospital sobre a perda auditiva, dificultado pela
falta de um protocolo padronizado, para transmitir o resultado da triagem e
orientações para os pais. As barreiras encontradas para os familiares chegarem até
os centros de diagnóstico audiológico seriam: localização dos centros de
diagnóstico, demora na autorização do seguro saúde para realização dos
procedimentos necessários, diferença entre as línguas, quando a língua da família
não era o inglês.
Já Liu et al. (2008) em Massachusetts, afirmaram que possuem um sistema de dados com todas as informações referentes a saúde dos neonatos, desde a
certidão de nascimento, até os dados referentes a exames realizados e seus
respectivos resultados, mesmo assim, a perda no seguimento foi de 157 crianças
as dificuldades estão relacionadas a distância dos centros de diagnóstico, mudanças
da família para outro estado e língua que não o inglês.
Em pesquisa sobre a TAN em Western Cape (África do Sul), Friderichs e
Swanepoel (2012) relataram que, após os neonatos com falhas na TANU serem
encaminhadas para diagnóstico, as taxas de prevalência de perda auditiva
significativa entre neonatos com média de idade de 13,5 semanas foram de
4.5/1000, incluindo: sensorioneural (1.5/1000), condutiva (15.9/1000).
Como observado nos estudos supracitados, a estimativa da DA em neonatos
no mundo é entre 0,08% a 0,5%.
1.1.2 Prevalência da Perda Auditiva no Brasil
No Brasil, poucos estudos investigaram a prevalência da deficiência auditiva
ao nascimento.
Em estudo de base populacional com neonatos, em um hospital privado de
São Paulo, no período entre 1996 e 1999, com uma casuística de 4631 (90,6% dos
nascidos vivos), Chapchap e Segre (2000) encontraram dez crianças com
deficiência auditiva permanente, equivalendo a uma prevalência de 2.4/1000
(0,24%).
Em pesquisa com neonatos com muito baixo peso e seus IRDA na UTIN do
Hospital de Clínicas de Porto Alegre, no período de setembro de 2000 a janeiro de
2002, Lavinsky et al. (2003) encontraram os seguintes indicadores de risco para DA:
medicação ototóxica (57,3%), ventilação mecânica (32%) e meningite (9,4%).
Foram a óbito antes da alta hospitalar 30 neonatos (39%), e quatro (3%) foram
perdidos, sendo avaliados 96 neonatos com Emissões Otoacústicas (EOA). Desses,
84 passaram no primeiro teste, sendo que 22 (26,1%) necessitaram de um segundo
exame; em doze casos, ambos os testes indicaram falha e foram encaminhados
para realização de PEATE, dos quais seis (6,3%) obtiveram diagnóstico de DA
Em estudo realizado em duas maternidades públicas do Espírito Santo, no
período de agosto de 2002 a agosto de 2005, Nielsen, et al. (2007) avaliaram 3364 (68%) do total de nascimentos nesses hospitais (4.951 neonatos), sendo que 425
(12,6%) apresentaram um IRDA e 11 (2,5%), mais de um. Dentre os fatores de risco
mais prevalentes, constataram: peso ao nascimento abaixo de 1500g (21%),
medicação ototóxica (21%) e ventilação mecânica por período superior a cinco dias
(20%). Foram encaminhados para diagnóstico 19 (0,57%) neonatos, sendo a
ocorrência de DA obtida para esse estudo de 0,3%.
Borges et al. (2006), em estudo realizado em uma maternidade pública do Acre, no período de novembro de 2004 a janeiro de 2005, avaliaram 200 neonatos;
desses, os que apresentaram falha na TANU eram encaminhados para diagnóstico.
A prevalência de DA foi de 0,5%.
Um primeiro estudo de base populacional com padrões epidemiológicos foi
realizado por Béria et al. (2007), no Município de Canoas, interior do Rio Grande do
Sul; porém, o objetivo não era avaliar a DA em neonatos, e sim sua prevalência em
crianças acima de 4 anos, que foi de 6,8%.
Monteiro (2008) estudou o custo e a efetividade de cinco protocolos de TAN
em 2060 nascidos vivos, no período de maio de 2006 a janeiro de 2007, 92,04%
(1896/2060) realizaram a TAN na maternidade da pesquisa. Do total de triados, 89%
(1688/1896) não possuíam indicadores de risco para perda auditiva, segundo o JCIH
(2000). Os 11% (208/1896) restantes possuíam um ou mais IRDA. Os 297 neonatos
que foram encaminhados para reteste, sendo que compareceram 84,5% (251/297) e
faltaram 46 neonatos; destes, 15% (7/46) apresentavam IRDA e 85% (39/46) não
apresentavam. Do total de 251 encaminhados para o retorno 84% (211/251)
neonatos passaram e 16% (40/251) falharam e foram encaminhados para
diagnóstico audiológico em centro de referência, em 15 dias. Foram diagnosticados
0,3% (7/2060) com algum tipo de perda auditiva, incluindo as condutivas. As perdas
de tipo neurossensorial foram de 0,1% (2/2060), sendo 50% (1/2) dos casos sem
indicador de risco para perda auditiva, apresentando perda profunda unilateral, e
50% com indicador, apresentando perda profunda bilateral. O indicador de risco de
maior ocorrência foi a hereditariedade (35,4%), Unidade de Terapia Intensiva (UTI)
Em outro estudo, Mattos et al. (2009) trouxeram os resultados iniciais após seis meses de implantação da TANU em um hospital universitário de Santa
Catarina. Foram triados 625 neonatos; destes, 470 passaram e 155 falharam para o
primeiro teste com EOA. Após reteste, 143 passaram e 12 foram encaminhados
para Otorrinolaringologista (ORL) / PEATE, apresentando fatores de risco como:
síndromes, anomalia craniofacial, história familiar de DA, uso de ototóxico, sífilis
congênita, baixo peso ao nascer. Desses 12, sete foram perdidos no seguimento e
cinco realizaram PEATE, dos quais três obtiveram resultados dentro do padrão de
normalidade e dois, PASN. O percentual de presença de perda auditiva confirmada
pós-triagem auditiva para esse estudo foi de 0,32%.
Lima et al. (2010) analisaram os resultados obtidos na TAN em um hospital público do Estado de São Paulo, no Centro de Estudos e Pesquisas em Reabilitação
da Faculdade de Ciências Médicas da UNICAMP. Foram avaliados 5106 neonatos
de baixo risco para DA no primeiro mês de vida, sendo que 628 (12,3%) falharam e
foram encaminhados para realização do Potencial Evocado Auditivo de Tronco
Encefálico Automático PEATE-A. Desses, 223 (35,3%) compareceram ao exame,
199 (89,2%) passaram e 24 (10,8%) falharam e foram encaminhados para
diagnóstico. Com relação à presença de indicadores e risco nessa população,
observou-se que, dos 24 neonatos com falha no reteste, quinze (62,5%) possuíam
indicador de risco para surdez e nove (37,5%) não possuíam. Dos encaminhados
para diagnóstico, dois (8,33%) tiveram DA bilateral confirmada.
Botelho et al. (2010) estudaram 186 recém-nascidos com peso igual ou inferior a 1.500g e/ou idade gestacional até 34 semanas, internados na UTIN de um
hospital; em doze deles (6,3%) foram identificadas perdas auditivas, sendo dois
(16,7%) com alterações unilaterais e dez (83,3%) bilaterais. Um neonato (0,5%) teve
como diagnóstico etiológico sífilis congênita, um (0,5%), toxoplasmose congênita e
outro (0,5%), citomegalovirose congênita (CMV); além disso, cinco mães (2,7%)
apresentaram sorologia positiva para o HIV.
Bevilacqua et al. (2010), em estudo de três anos de TANU na Universidade de
São Paulo (Bauru), teve como objetivo diagnosticar perdas auditivas congênitas
unilaterais ou bilaterais. O total de nascimentos para o período foi de 12.766, sendo
que, destes, 99 vieram a óbito. Foram então selecionados 12.667, realizando a
indicadores de risco. O indicador de risco de maior ocorrência foram antecedentes
familiares de perda auditiva, seguido de permanência por mais de 48 horas na UTI,
uso de medicamentos ototóxicos e ventilação mecânica por cinco dias ou mais. Os
autores não especificaram a porcentagem de cada indicador. Um total de 8920
neonatos (77,8%) passaram no primeiro exame e 2546 (22,2%) falharam, sendo
encaminhados para retestes, dos quais 503 foram perdidos para seguimento
(follow-up). Foram retestados 2043 neonatos, dos quais 1661 passaram e 382 (3,33%) foram encaminhados para diagnóstico; desses, 366 (95,8%) concluíram a fase do
diagnóstico e 16 (4,20%) faltaram no dia agendado. Dos encaminhados para
diagnóstico, 312 (85,3%) apresentaram resultados normais, 43 (11,7%), alterações
condutivas e 11(3,0%) foram diagnosticados como PASN. A ocorrência da PA para
esse estudo foi de 0.95/1000.
Barbosa e Lewis (2011) analisaram os indicadores de qualidade de um
programa de triagem auditiva neonatal seletiva, ou seja, em neonatos com IRDA, em
um hospital do município de São Paulo. A TAN foi realizada em 95,8% (297/310) dos
neonatos, sendo que destes, 20,9% (62/297) falharam no exame com o PEATE-A,
sendo encaminhado para diagnostico 3% (9/297), desses cinco neonatos
confirmaram a presença de PA, quatro (57,1%) com perda auditiva condutiva, um
(14,3%) apresentando quadro do espectro da neuropatia auditiva e dois (28,6%)
com audição normal. A ocorrência de PASN (Espectro da Neuropatia Auditiva) foi de
0,3% (1/297) e perda auditiva condutiva, 1,3% (4/297). Para esse estudo, 90% (279)
dos neonatos apresentaram apenas um indicador de risco para a deficiência auditiva
e foi observada a presença de máximo cinco IRDA.
Em estudo realizado em uma maternidade do Paraná, com 908 neonatos,
Mello et al. (2011) encontraram a prevalência de DA sensorioneural em 1/908 nascidos vivos, e de perda auditiva condutiva em 2/908 dos neonatos avaliados. No
neonato com DA sensorioneural foi diagnosticada a presença da mutação c.35delG.
Os autores concluíram que a avaliação audiológica, em conjunto com exames
1.1.3 Etiologia da Deficiência Auditiva
De acordo com a Política Nacional de Atenção à Saúde Auditiva, em
recém-nascidos e lactantes a perda auditiva pode ocorrer por causas pré-natais: fatores
genéticos, síndromes genéticas, malformações da orelha interna, infecções
congênitas pelo vírus da rubéola, CMV, herpes simples, toxoplasmose e sífilis; uso
gestacional de substâncias teratogênicas - talidomida, álcool, cocaína, e
medicamentos ototóxicos; radioterapia no primeiro semestre da gestação;
peri-natais: anóxia, prematuridade com peso abaixo de 1500 gramas, hiperbilirrubinemia,
traumatismo craniano ou pós-natais: causas metabólicas, como hipotireoidismo e
diabetes, infecções virais, rubéola, varicela-zoster, influenza, vírus da caxumba,
CMV, entre outros; labirintite e meningite bacteriana, encefalite e otite média crônica.
Há ainda outras causas, menos frequentes, como doenças autoimunes, acidose
tubular renal, neoplasias, trauma craniano, trauma acústico e utilização de drogas
ototóxicas – aminoglicosídeos, diuréticos de alça, cisplatina, entre outras.
Nóbrega, Weckx e Juliano (2005), em estudo retrospectivo dividido em dois
momentos: 1990 a 1994 e 1994 a 2000, no ambulatório de Otorrinolaringologia da
UNIFESP, com 519 indivíduos inicialmente selecionados, estudaram 442 indivíduos
com DA, tendo observado a etiologia genética (12,9%), a consanguidade (4,9%), a
rubéola congênita (12,9%), a meningite (10,6%) e as intercorrências perinatais
(14,9%). A causa desconhecida corresponde a 36,6% dos casos. Os autores
concluíram que estas categorias (causa desconhecida não é etiologia, logo não deve
ser somada aqui). Corresponderam a mais de 80% dos casos de DA em ambos os
períodos, sendo que as ocorrências de consanguidade e de causas genéticas foram
estatisticamente maiores entre 1990 a 1994, quando comparadas as demais
etiologias e períodos. A rubéola congênita continuou como importante etiologia
nessa pesquisa, apesar de já estar totalmente controlada e ausente em vários
países, assim como a surdez pós-meningite. Não houve diferença entre os sexos
masculino e feminino em ambos os períodos do estudo, assim como não houve
correlações entre o sexo e as etiologias de DA.
DA em crianças e jovens de 6 meses a 17 anos, obtiveram os seguintes achados: 52
(32%) apresentaram etiologia desconhecida; 66 (41%) presumida e 44 (27%)
confirmada, sendo 29 (18%) por causa genética; 27 (17%) presumida multifatorial;
24 (15%) meningite; 14 (9%) rubéola congênita; 6 (4%) medicação ototóxica; 4 (2%)
hiperbilirrubinemia; 2 (1%) baixo peso ao nascimento; 2 (1%) CMV e 2 (1%)
toxoplasmose. Das causas genéticas em 21 crianças (72%), a etiologia foi
presumida e em 8 (28%) foi confirmada, revelando um caso (13%) de herança
autossômica recessiva, um (13%) de herança mitocondrial, três casos (38%) de
síndromes (Goldenhar, Waadenburg e alargamento do aqueduto vestibular) e três
(38%) sem especificações quanto ao padrão de herança. Nesse estudo, a meningite
foi a maior responsável pela DA adquirida, enquanto a rubéola materna foi a maior
causa de DA congênita. As autoras concluíram que a etiologia desconhecida
continua prevalecendo e evidenciam a necessidade de se realizar rotineiramente
estudos genéticos para obter um perfil real da prevalência das causas da DA
congênita.
Oliveira et al. (2010) afirmaram que a gravidez na adolescência pode causar
riscos a saúde do neonato e esse assunto vem sendo amplamente discutido e
pesquisado no mundo, pois, nesses casos, os neonatos estariam mais suscetíveis a
problemas de saúde e a óbitos antes do primeiro ano de vida.
Maciel et al. (2012) em pesquisa com o objetivo de comparar as características maternas de mães adolescentes e mães adultas, quanto aos
resultados perinatais, via de parto e dados sobre os seus recém-nascidos,
realizaram um estudo transversal retrospectivo com mães cadastradas no Sistema
de Informações sobre Nascidos Vivos (SINASC) em Caruaru-PE, em 2006 e 2007.
Das 10.653 mães estudadas, 2.540 eram adolescentes (de 10 a 19 anos completos).
Dessas adolescentes 32,0% tinham entre 8 a 11 anos de escolaridade; 30,3%
viviam em união consensual; 51,4% fizeram sete consultas ou mais de pré-natal;
37,7% de suas crianças nasceram de parto cesáreo, 7,4% prematuras, 9,6% de
baixo peso e 0,7% Ápgar no 5º minuto ≤ 7. Ao comparar os indicadores com os das mães adultas, observou-se que mães adolescentes possuíam maior probabilidade
de estar sem companheiros; risco aumentado para seus neonatos serem prematuros
forma de risco quando comparadas as adultas, assim como o parto cesáreo
apresentou-se como fator de proteção às adolescentes. Concluíram que a gravidez
na adolescência está associada à ausência de companheiro, prematuridade, baixo
peso ao nascer e Apgar igual ou menor que sete no 5º minuto.
1.1.3.1 Fatores pré-natais
Mustafa, Arnos e Pandya (2001) relataram em estudo que cerca de 60% dos
casos de PASN podem ser atribuídos a fatores genéticos, e 40%, às mais diversas
etiologias. Dentre as causas genéticas, as formas hereditárias sindrômicas
constituem 30% dos casos de deficiência auditiva em crianças, sendo as formas não
sindrômicas as mais prevalentes na população deficiente auditiva, ocorrendo em
cerca de 70% dos casos.
A surdez não sindrômica pode ter herança autossômica dominante,
autossômica recessiva, ligada ao cromossomo X e mitocondrial, sendo que 80% dos
casos de surdez não-sindrômica apresentam herança autossômica recessiva. As
perdas auditivas com esse padrão de herança são geralmente sensorioneurais, de
manifestação pré-lingual, de graves a profundas, geralmente atingem todas as
frequências e são estacionárias (Keats e Berlin, 1999).
A surdez não-sindrômica de herança autossômica dominante corresponde a
20-25% dos casos de surdez hereditária, sendo a maioria de manifestação
pós-lingual, progressiva e sensorioneural. Já para a herança ligada ao cromossomo X à
surdez hereditária é estimada em 1 a 1,5% (Willems, 2000).
A surdez hereditária de herança mitocondrial, juntamente com a mutação
c.35delG do gene GJB2, é uma das mutações mais comuns que causam surdez. Essa mutação também tem sido encontrada em pacientes com perda auditiva após
uso de antibióticos aminoglicosídeos (Estivill et al.,1998).
Até o momento, já foram mapeados mais de 60 locos autossômicos
responsáveis pela surdez recessiva; desses, 34 tiveram os seus genes identificados
Kelsell et al. (1997), conseguiram isolar e clonar o gene GJB2 que, codifica a proteína Conexina 26, sendo esse o primeiro gene identificado relacionado à surdez
não-sindrômica e também o primeiro relacionado à surdez de herança autossômica
recessiva.
Em outro estudo, Wilcox et al. (2000) relataram que 70% dos casos de surdez
de herança autossômica recessiva estão associados à mutação c.35deIG e que
mutações no gene da Conexina 26 são responsáveis por de 10 a 20% do total das
PASN. Em várias populações do mundo, foi confirmado que as mutações no gene
da Conexina 26 são causas muito frequentes de DA.
Del Castillo et al. (2002), em estudos nas populações espanholas e francesas,
encontraram a del (GJB6-D13S1830) no gene GJB6 como a segunda mutação mais
frequente causadora de surdez pré-lingual.
Bernardes et al. (2006) realizaram estudo molecular com 32 crianças candidatas e submetidas ao implante coclear na UNICAMP-SP, para rastreamento
da mutação c.35 delG, feito através da extração de DNA do sangue periférico. A
mutação foi encontrada em homozigose em quatro do total das crianças avaliadas
(12%), sendo essa a causa da DA; em seis crianças, a mutação foi encontrada em
heterozigose (19% dos casos), não sendo possível diagnosticar a causa da surdez
nesses casos. Por fim, 69% dos pacientes não apresentavam alteração.
Santos et al. (2011), em estudo audiológico e genético de lactentes de alto risco no Hospital da Mulher-CAISM/UNICAMP, no período de fevereiro de 2009 a
março de 2010, encaminharam para avaliação diagnóstica 52 lactentes que falharam
na TANU. Desses, 38 (73%) concluíram todas as etapas do processo diagnóstico,
os demais faltaram e foram excluídos do estudo. Os resultados do diagnóstico
audiológico mostraram que 16 (42,2%) apresentaram resultados normais, 12
(31,5%) perda auditiva condutiva, 9 (23,7%), PASN bilateral e 1 (2,6%), unilateral.
No estudo genético, todos os indivíduos revelaram resultados normais para mutação
c.35 delG do gene da conexina 26 (GJB2).
No que se refere às síndromes genéticas, mais de 400 podem apresentar
perda auditiva como uma de suas características; porém, as mais encontradas,
Quadro 1 - Síndromes Genéticas e DA
Fonte: Dados básicos Silva e Duarte (1995). Elaborado pelo autor.
Outro fator pré-natal de risco para DA muito estudado e preocupante são as
infecções congênitas como: toxoplasmose, rubéola, sífilis, CMV, herpes e HIV. Não
é característica de todas a instalação imediata da perda auditiva, como ocorre na
toxoplasmose, CMV, herpes e sífilis, pois a perda auditiva pode se instalar precoce
ou tardiamente. Essas infecções congênitas podem ser assintomáticas, deixando
sequelas tanto na mãe quanto no recém-nascido. O seu diagnóstico requer testes de
sorologia (Joint Committee on Infant Hearing, 2000).
O CMV é um tipo de herpes que pode infectar o recém-nascido na gestação,
ou nas primeiras semanas de vida, sendo a mais comum das infecções.
Suspeita-se, inclusive, que seja a maior causa de deficiência auditiva sensorioneural
congênita não hereditária (Schildroth, 1994).
O estudo de Grosse, Ross e Dollard (2008) determinou a frequência da DA
sensorioneural bilateral moderada a profunda em crianças com infecção congênita
por CMV, logo após o nascimento utilizando cultura de vírus em amostras de urina
ou saliva em combinação com TANU para CMV e revisão da literatura sobre essa
infecção e ocorrência de perda auditiva. Os resultados demonstraram que,
aproximadamente, 14% das crianças com infecção congênita por CMV podem
3-5%, DA sensorioneural bilateral moderada a profunda. Entre essas últimas,
estima-se que 15-20% dos casos são atribuíveis à infecção congênita por CMV.
De Vries et al.(2011) realizaram uma pesquisa referente ao CMV com o objetivo de determinar sua prevalência ao nascimento nos Países Baixos. Um
conjunto de 6.500 cartões com amostras de sangue de neonatos foi testado
anonimamente para CMV, estratificado pelo número de nascimentos em diferentes
regiões no ano de 2007. A prevalência de nascimentos com infecção de CMV
congênita foi de 0,54%, sendo significativamente mais elevada nas regiões com
mais de 30% de imigrantes em comparação com regiões com uma baixa proporção
dessa população. Com base no conhecimento da história natural da infecção CMV
congênita, por ano, aproximadamente 1.000 crianças nascem com ela nos Países
Baixos, das quais aproximadamente 180 (0,1% de todos os recém-nascidos)
apresentarão sequelas, sendo a deficiência auditiva encontrada com maior
frequência.
1.1.3.2 Fatores pós-natais
Roslyn (1996); Roeser (2001); Brasil (2004); Mercado, Burgos e Munoz,
(2007) destacaram que os fatores de risco para perda auditivas pós-natais são de
variada natureza, sendo elas:
• Causas metabólicas, como hipotireoidismo e diabetes, infecções virais
(rubéola, varicela-zoster, influenza, vírus da caxumba, CMV, entre outras);
• Labirintite e meningite bacteriana, encefalite, otite média crônica e outras
menos frequentes como: autoimunes, acidose tubular renal, neoplasias,
trauma craniano, trauma acústico;
• Drogas ototóxicas como antibióticos aminoglicosídeos:
dihidroesptreptomicina, gentamicina, neomicina, tobramicina, amicacina,
netilmicina, polimixina B, polimixina E (colistina), que podem ocasionar a
destruição das células neurossensoriais da orelha interna, afetando a cóclea
piretanida, torasemida, que podem afetar o ouvido interno e rins;
anti-inflamatório não hormonal: indometacina, naproxeno, fenoprofeno, ácido
mefenámico, piroxicam; antimaláricos: quinina, cloroquina, pirimetamina;
antineoplásicos: cisplatino, mostarda nitrogenada, bleomicina, carboplatino,
dactinomicina, droloxifeno, vincristina, misonidazol, ciclofosfamida, ifosfamida,
metotrexato, que podem causarperda da audição e otalgia.
Para Wertzner et al. (2007), outra alteração que acomete a população infantil
é a otite média, inflamação na orelha média frequentemente associada a um
aumento de fluido infectado ou não. Sua etiologia é variada e acomete as vias
aéreas superiores, sendo maior a prevalência na primeira infância e decrescendo
com a idade. Além disso, sabe-se que 50% das crianças com um ano de idade já
apresentaram pelo menos um episódio de otite, o que pode prejudicar a aquisição e
o desenvolvimento da linguagem.
Em pesquisa com lactentes que realizaram pelo menos três avaliações
auditivas (no 1º mês de vida, 6º mês, 12º mês), Pereira, Azevedo e Testa (2010)
distribuíram os sujeitos em dois grupos: grupo controle, de crianças que passaram
na TAN, e grupo estudo, composto por crianças que falharam na TAN por
comprometimento condutivo confirmado pelo resultado da timpanometria e da
avaliação otorrinolaringológica. No estudo retrospectivo, foram analisados
prontuários de 217 crianças nascidas pré-termo entre os anos de 2003 e 2006,
pertencentes ao “Programa de acompanhamento multidisciplinar de neonatos de alto
risco”. Já o estudo prospectivo consistiu no acompanhamento de 66 crianças
nascidas no ano de 2007, sendo 31 nascidas a termo e 35 pré-termo. Nos resultados obtidos no estudo prospectivo, os autores observaram que no grupo de estudo, 16
(57,1%) lactentes apresentaram comprometimento condutivo no decorrer do primeiro
ano de vida; e no grupo controle, 9 (23,7%).
Apesar de o grupo de estudo apresentar maior ocorrência de
comprometimento condutivo, as crianças do grupo controle também apresentaram
alteração condutiva no primeiro ano de vida, sendo 23,7% no estudo prospectivo e
12,6% no estudo retrospectivo. Observaram que lactentes que tiveram otite no
período neonatal tiveram mais chance de desenvolver outros episódios de otite ao
por apresentar otite secretora têm mais chance de desenvolver episódios de otite,
principalmente entre o 6º e o 12º mês de vida.
Davis e Davis (2010) relataram que existe uma preocupação com problemas
de orelha média. Isto é especialmente apropriado nos países em desenvolvimento
onde a presença de doença da orelha média está altamente correlacionada com a
perda de audição. A longo prazo, ocorre um aumento da prevalência da doença da
orelha média nos países em desenvolvimento, podendo resultar em problemas
futuros como: otite média crônica ou levando à colesteatoma, e as complicações são
mais prováveis onde há pouco acesso a cuidados de saúde e/ou tratamento eficaz.
1.1.4 Indicadores de Risco para Deficiência Auditiva (IRDA)
Segundo Costa e Costa (1998), neonatos prematuros tendem a apresentar
intercorrências clínicas importantes, ao ficar expostos a fatores iatrogênicos
diversos, como, por exemplo, o uso de drogas ototóxicas, destacando-se, entre elas,
os aminoglicosídeos, muito utilizados por combaterem infecções bacterianas. Além
disso, são mais suscetíveis a episódios de hipóxia.
Lo e Friedman (2002) relataram que a ação teratogênica de um medicamento
sobre o embrião ou feto em desenvolvimento depende de diversos fatores,
destacando-se: 1) estágio de desenvolvimento do concepto; 2) relação dose-efeito
do medicamento usado; 3) genótipo materno-fetal; 4) potencial teratogênico do
medicamento.
Câmara (2005) e Jacob et al. (2006) afirmaram que antibióticos (aminoglicosídeos) como a gentamicina e amicacina são amplamente utilizados em
neonatos internados em Unidade Neonatal como terapêutico e profilático, com o
objetivo de tratar infecções.
No que se refere às malformações, Castiquini et al.(2006) concluíram que a
perda auditiva é um dos achados clínicos mais comuns nos casos de malformações
de orelha, sendo que o tipo e o grau dessa perda estarão relacionados ao local da
avaliaram 37 indivíduos, sendo 19 orelhas com malformações bilaterais e 18 com
malformações unilaterais, totalizando 56 orelhas malformadas. O predomínio foi de
malformações de orelha externa e de orelha externa associadas a malformações de
orelha média. A perda auditiva associada a malformações foi do tipo condutiva
moderada.
Com o objetivo de comparar a ocorrência dos IRDA infantil ao longo de quatro
anos, em um Programa de TAN no Município de São Paulo, Vieira et al. (2007) pesquisaram 382 prontuários de neonatos prematuros, encontrando como fatores de
risco mais frequentes: permanência em UTIN com período superior a 48 horas em
80% da amostra; baixo peso em 30%; uso de medicação ototóxica em 40%; 13,6%
tinham antecedentes familiares para DA; ventilação mecânica, em 40,2% e
convulsões neonatais em 9,8%. Infecções congênitas foi o indicador de risco que
apresentou diminuição estatisticamente significante ao longo dos anos: em 2000,
foram treze casos (11%), diminuindo para cinco (5,4%) em 2003.
Em estudo, Pereira, Martins e Azevedo (2007) avaliaram a associação entre
perda auditiva e indicadores de risco em um programa da TANU, ao verificar a
prevalência de alterações auditivas. Foi realizada uma análise retrospectiva de
avaliações de 1696 neonatos, sendo 648 pré-termos e 1048 a termo. Os fatores de
risco mais encontrados nos pré-termo foram: baixo peso ao nascimento, 43,05%;
uso de ototóxicos, 29,86%, e ventilação mecânica, 21,36%. Já nos neonatos com
nascimento a termo, os fatores de risco foram: antecedentes familiares, 9,34%; uso
de ototóxicos, 7,14%, e baixo peso, 6,87%. A PASN foi identificada em 0,82% dos
neonatos a termo, e em 3,1% pré-termos. A perda auditiva condutiva foi a mais
frequente nas duas populações, sendo 14,6% nos neonatos a termo e 16,3%
naqueles nascidos pré-termo.
Tiensoli et al. (2007) relataram que a chance de um recém-nascido com peso
inferior a 1.500 gramas ao nascimento apresentar alteração auditiva é 5,5 vezes
maior do que aqueles que nasceram com peso superior; porém, por apresentarem,
concomitantemente, vários IRDA, torna-se difícil isolar apenas o indicador peso. Já
um recém-nascido que foi submetido à exsanguineotransfusão devido à
hiperbilirrubinemia tem 18 vezes mais chance de apresentar alteração auditiva do
Amado et al. (2009), em levantamento de prontuários de uma maternidade pública de Campinas/SP, tiveram como objetivo identificar os fatores de risco para
DA em 589 protocolos de neonatos que realizaram a TANU. Desses, 152 (25,8%)
apresentaram indicadores de risco para DA, sendo os mais prevalentes: histórico
familiar de DA, Apgar de 0 a 4 no 1’, uso de medicamentos ototóxicos,
hiperbilirrubinemia e permanência em UTI Neonatal. Em 98 (65%) dos protocolos foi
encontrado um único indicador de risco. Do total das avaliações realizadas na
amostra, apenas um neonato falhou nos três testes, o qual apresentava três
indicadores de risco: hiperbilirrubinemia, permanência em UTI e uso de
medicamentos ototóxicos.
Davis e Davis (2010) relataram que mesmo em lugares onde a TANU é
estabelecida, o conhecimento dos IRDA ajudam a identificar e acompanhar aqueles
neonatos com audição normal, mais que apresentaram um risco para DA, indicando
a necessidade de posterior observação e acompanhamento do desenvolvimento
dessa criança.
1.2 Considerações sobre o Município de São Paulo
Segundo o Instituto Brasileiro de Geografia e Estatística - IBGE (2011), a
população do município de São Paulo é de 10.886.518 habitantes. Atualmente é a
cidade brasileira em décimo lugar na lista mundial de Produto Interno Bruto (PIB),
sendo a cidade mais rica do Brasil e a sexta mais populosa do mundo.
Segundo o site Cidade de São Paulo (2011), o município possui 1.769
estabelecimentos de saúde, 40 hospitais públicos, 61 hospitais particulares, 24.957
leitos hospitalares, 146 faculdades, 26 universidades e 22 Centros de Educação
Tecnológico.
Segundo Santoro (2008), o Índice de Desenvolvimento Humano (IDH) é
amplamente utilizado para aferir o nível de desenvolvimento econômico e social de
diferentes países e permitir comparações entre eles, sendo construído a partir de
encarregadas de calcular o IDH para diferentes unidades territoriais sejam elas
países, estados ou municípios, usualmente lançam mão de adaptações nas
variáveis que integram aqueles componentes básicos, em função da disponibilidade
de dados com maior ou menor grau de agregação.
Segundo a Prefeitura Municipal de São Paulo - Secretaria Municipal do
Desenvolvimento, Trabalho e Solidariedade (2000), no caso da cidade de São
Paulo, o cálculo do IDH intramunicipal levou em consideração as seguintes variáveis
para cada um de seus 96 distritos:
• rendimento do chefe da família, em face da ausência de base segura para o
calculo do PIB per capita por distrito municipal;
• taxa de mortalidade infantil, em substituição à esperança de vida ao nascer;
• taxa de alfabetização combinada com a média de anos de estudos, ambas
referentes ao chefe da família, em lugar de matrículas por nível de ensino e
taxa de alfabetização de adultos.
Segundo Rolnik (2003), o IDH da cidade de São Paulo, de forma geral é
elevado (0,841), porém se observado por região, nota-se que é muito heterogêneo,
demonstrando as desigualdades sociais existentes nos países em desenvolvimento.
Nas regiões mais centrais do Município de São Paulo, o IDH é superior, diminuindo
à medida que se afasta do centro. Essa, com certeza, é uma questão histórica, pois
as populações de baixa renda concentram-se nas periferias, por não terem como
custear a vida na região mais central.
O IDH no Município de São Paulo, nas regiões (Sul e Oeste) apresenta o
valor médio de (0.75), sendo eles na Vila Mariana e Vila Clementino, por exemplo.
No entanto, alguns bairros na mesma região Sul, apresentam IDH menor que (0.30),
sendo eles em Marsilac e Socorro como exemplo, sendo que a região com maior
IDH tem média de (0.95) (Prefeitura Municipal de São Paulo, 2011).
Segundo a Prefeitura Municipal de São Paulo (Infocidade), nas regiões Sul e
Oeste, concentram-se o maior número de gestantes sem nenhuma consulta
inferior a 15 anos de idade, alta concentração de neonatos com peso inferior a 2499
2
OBJETIVOS
2.1 Objetivo Geral
Estimar a perda auditiva em neonatos nascidos em Hospitais Municipais de
São Paulo.
2.2 Objetivos Específicos
a) Descrever o número de nascimentos no Município de São Paulo e por região de moradia;
b) Caracterizar as perdas auditivas em um grupo de neonatos após falha na TANU;
3
MATERIAL E MÉTODO
3.1 Delineamento, população e período do estudo
O presente estudo é de caráter descritivo e transversal, e está inserido na
linha de pesquisa Audição na Criança, do PEPG em Fonoaudiologia da PUCSP,
tendo sido aprovado pelo Comitê de Ética, sob o CAAE: 04539312.5.0000.5482.
Fizeram parte da casuística desta pesquisa neonatos nascidos em 11
hospitais municipais de São Paulo – e que fazem parte da rede de Proteção Mãe
Paulistana, residentes das regiões sudeste, centro oeste, norte e sul, no período de
outubro de 2010 a outubro de 2011. Os hospitais foram identificados por números,
sendo os de números 1, 2, 3 e 4 pertencentes à região Sudeste, 5 e 6 à Centro
Oeste, 7, 8 e 9 à região Norte e 10 e 11 à região Sul.
O Programa Mãe Paulistana foi criado pela Prefeitura de São Paulo e oferece
assistência integral a gestantes, com um sistema que acompanha além da gestação,
os atendimentos realizados aos neonatos e lactentes durante seu primeiro ano de
vida. É oferecido atendimento a cerca de 80.000 gestantes, em 409 Unidades
Básicas de Saúde, 36 hospitais, 25 ambulatórios especializados, contando ainda
com uma Central de Regulação Obstétrica e Neonatal, para garantir a internação
durante o parto e registro dos procedimentos realizados. A TANU faz parte deste
programa desde agosto de 2010, de forma universal em 18 serviços hospitalares,
que acompanham uma média de 4000 nascimentos/mês (Prefeitura Municipal de
São Paulo - Secretaria Municipal de Saúde de São Paulo).
Os IRDA seguem os critérios do COMUSA (Lewis et al., 2010) e critérios da
prefeitura do município de São Paulo (adaptados de Azevedo, 1996; JCHI, 2000)
retirados do edital da chamada pública n°03/2008 - SMS.G, 03/2008, que visava à
contratação de serviço de TAN (São Paulo, 2010).
Quadro 2 - IRDA adotados pela prefeitura do município de São Paulo (2008), adaptados do JCHI (2000) e Azevedo (1996)
Criança pequena para idade gestacional (PIG)
Hiperbilirrubinemia a níveis excedendo a indicação para exsanguineo
Ventilação mecânica por cinco dias ou mais
Peso ao nascimento inferior a 1500 gramas ou pequeno para idade gestacional (PIG)
Asfixia neonatal grave: 0 a 4 no 1° ou 0 a 6 no 5° minuto
Medicação ototóxica (aminoglicosídeos, associação com diuréticos, agentes quimioterápicos)
Antecedentes familiares de deficiência auditiva sensorioneural (hereditariedade)
Infecções congênitas (toxoplasmose, sífilis, rubéola, citomegalovírus, herpes e HIV)
Anomalias craniofaciais: incluindo alterações morfológicas do pavilhão e conduto auditivo.
Sinais ou outros achados associados com síndromes
Infecções bacterianas ou virais pós-natais (meningite)
Alcoolismo materno ou uso de drogas psicotrópicas na gestação
Hemorragia ventricular
Consanguinidade
Atualmente a TANU é realizada nos hospitais Municipais da seguinte forma:
Nos neonatos sem IRDA é realizado o exame de EOA. No caso de falha é
realizado PEATE-A. Se até o momento da alta o neonato não passou nesses
exames, é agendado um horário de retorno 15 dias após o nascimento.
No caso dos neonatos com IRDA Pequeno para Idade Gestacional (PIG), são
realizados os exames de EOA e PEATE-A. Se o neonato apresentar apenas IRDA é
realizado apenas o PEATE-A, se até a alta hospitalar o neonato não passar nesses
exames, também é agendado um horário para retorno 15 dias após o nascimento.
Nos retornos após os 15 dias de nascimento, é realizado o PEATE-A, caso o
neonato não passe, o mesmo é encaminhado para o Centro de Alta Complexidade
em Saúde Auditiva, mais próximo à região de moradia para efetuar o diagnóstico
audiológico. Portanto os neonatos com falha na TANU são encaminhados a um dos
4 serviços credenciados como referência em Alta Complexidade, da rede de Política
1. Centro Audição na Criança (CeAC), da Divisão de Educação e Reabilitação
dos Distúrbios da Comunicação da Pontifícia Universidade Católica de São Paulo -
DERDIC/PUC-SP, que atualmente é responsável por atender a demanda das
crianças com falha na TAN de hospitais municipais das zonas Norte e Sul
localizados nos bairros: Vila Nova Cachoeirinha, Vila Maria, Pirituba, Jardim São
Luiz, Jardim Ângela e Santo Amaro;
2. Hospital Central da Irmandade da Santa Casa de Misericórdia de São Paulo,
Departamento de Otorrinolaringologia, responsável por atender as falhas da triagem
auditiva dos hospitais Municipais da zona Leste, localizados nos bairros: Ermelino
Matarazzo, São Miguel, Itaquera e Cidade Tiradentes;
3. Núcleo Integrado de Saúde Auditiva NISA Penha/PMSP – Ambulatório
Maurice Paté, responsável por atender as falhas da triagem auditiva dos hospitais
municipais da zona Leste, juntamente com a Santa Casa de Misericórdia;
4. Universidade Federal de São Paulo - UNIFESP, responsável pelas falhas da
triagem auditiva dos hospitais das zonas Sudeste e Centro Oeste do município de
São Paulo, localizados nos bairros: Vila Clementino, Jabaquara, Tatuapé, Mooca,
Bela Vista, Rio Pequeno, Lapa e Liberdade.
Apenas o Centro Audição na Criança (CeAC), da Divisão de Educação e
Reabilitação dos Distúrbios da Comunicação da Pontifícia Universidade Católica de
São Paulo - DERDIC/PUC-SP, e Universidade Federal de São Paulo - UNIFESP
participaram deste estudo por terem informado o diagnóstico audiológico dos
neonatos que falharam na TANU em todo o período do estudo, conforme
autorização destas instituições (Anexo I).
A seguir, pode-se visualizar a organização dos hospitais municipais onde são
realizadas a TANU e os Centros de Alta Complexidade onde são realizados os
diagnósticos no município de São Paulo. Os números de 1 a 15 referem-se aos
Figura 1 – Fluxograma da Alta Complexidade em Saúde Auditiva no Município de São Paulo
Os procedimentos para diagnóstico audiológico dos serviços acima
referenciados como Alta Complexidade em Saúde Auditiva realizam o protocolo
considerando a Portaria GM/MS nº 2.073, de 28 de setembro de 2004, que institui a
Política Nacional de Atenção à Saúde Auditiva, portaria Nº 589, de 08 de outubro de
2004.
3.2 Procedimento para coleta de dados
A coleta de dados do presente estudo foi dividida em três etapas, descritas a