UNIVERSIDADE FEDERAL DO CEARÁ
CURSO DE PÓS-GRADUAÇÃO EM QUÍMICA
ÁREA DE CONCENTRAÇÃO: QUÍMICA ORGÂNICA
ASPECTOS QUÍMICOS DO ESTUDO DE Hamelia patens Jacq.
RAIMUNDO REGIVALDO GOMES DO NASCIMENTO
ORIENTADORA: Dra. MARY ANNE SOUSA LIMA
Regivaldo Gomes do Nascimento, 2010. 158 f; il. color. enc.
Orientador: Profa. Dra. Mary Anne Sousa Lima Área de concentração: Química orgânica
Dissertação (mestrado) - Universidade Federal do Ceará, Centro de Ciências. Depto. de Química Orgânica e Inorgânica, Fortaleza, 2010.
1. Alcalóides oxidólicos 2. investigação fitoquímica 3. Química vegetal I. Lima, Mary Anne Sousa (Orient.) II. Universidade Federal do Ceará – Pós-Graduação em Química III. Título
AGRADECIMENTOS
Agradeço em primeiro lugar a Deus por ter me dado saúde e disposição, e principalmente por ter colocado em meu caminho tantas pessoas importantes para a realização desse trabalho.
À minha família, em especial aos meus pais, Francisco do Nascimento e Luiza Gomes do Nascimento, e aos meus irmãos, Ednaldo, Regineide, Lucineide e Lucileide, pelo apoio e incentivo para continuar minha formação acadêmica.
Ao professor Manoel Andrade Neto, por ter me incentivado a estudar e ingressar no universo da pesquisa, me acolhendo em seu laboratório desde o inicio da minha formação acadêmica, sendo um amigo, orientador e incentivador.
À professora Mary Anne Sousa de Lima, por ter me recebido em seu laboratório e contribuído com sua orientação, dedicação e carinho na realização desse trabalho.
Ao professor Edilberto Rocha Silveira, pela coleta da planta.
Aos colegas do laboratório LAFIPLAM 1, em especial a Antônia, por ter contribuído significativamente no isolamento das substâncias aqui descritas, ao Artur, Henrique, Renata, Daniel, Elton e Profa. Mary Anne, pelos espectros.
Gostaria de agradecer também a Evilene, por me ajudar a enxergar além das dificuldades, me incentivando e apoiando nos meus projetos de vida.
SUMÁRIO
LISTA DE SIGLAS LISTA DE FIGURAS LISTA DE TABELAS LISTA DE QUADROS
LISTAS DE FLUXOGRAMAS RESUMO
ABSTRACT
CAPÍTULO 1 INTRODUÇÃO... 14
CAPÍTULO 2 CONSIDERAÇÕES BOTÂNICAS... 16
2.1 Considerações Botânicas sobre a Família Rubiaceae... 16
2.2 Considerações Botânicas sobre o Gênero Hamelia... 16
2.3 Considerações Botânicas sobre a Espécie Hamelia patens... 17
CAPÍTULO 3 LEVANTAMENTO BIBLIOGRÁFICO... 19
CAPÍTULO 4 DETERMINAÇÃO ESTRUTURAL... 31
4.1 Determinação estrutural dos constituintes químicos não-voláteis das folhas de H. patens (HPFE-D)... 31
4.1.1 Determinação Estrutural de HP-1... 31
4.1.2 Determinação Estrutural de HP-2... 46
4.1.3 Determinação Estrutural de HP-3... 4.1.4 Determinação Estrutural de HP-4... 4.1.5 Determinação Estrutural de HP-10... 58 71 80 4.2 Determinação estrutural dos constituintes químicos não-voláteis dos talos de H. patens (HPTE)... 94
4.2.1 Determinação Estrutural de HP-5... 4.2.2 Determinação Estrutural de HP-6... 4.2.3 Determinação Estrutural de HP-7... 94 104 108 4.3 Determinação estrutural dos constituintes químicos não-voláteis do caule de H. patens (HPCE)... 115
4.3.1 Determinação Estrutural de HP-8... 115
4.3.2 Determinação Estrutural de HP-9... 120
5.1 Métodos Cromatográficos... 126
5.1.1 Cromatografia de Adsorção... 126
5.1.2 Cromatografia de Exclusão... 127
5.1.3 Cromatografia Líquida de Alta Eficiência (CLAE)... 127
5.2 Métodos Espectrométricos... 127
5.2.1 Espectrometria de Ressonância Magnética Nuclear de Hidrogênio (RMN 1H) e de Carbono-13 (RMN 13C)... 127
5.2.2 Espectrometria de absorção na região do Infravermelho (IV)... 129
5.2.3 Espectrometria de Massas (EM)... 129
5.3 Métodos Físicos... 129
5.3.1 Ponto de Fusão... 129
5.4 Estudo dos Constituintes Químicos Não Voláteis de H. patens... 130
5.4.1 Material botânico... 130
5.4.2 Obtenção do extrato etanólico das folhas de H. patens - HPFE... 130
5.4.3 Particionamento do extrato etanólico das folhas de H. patens - HPFE... 130
5.4.4 Fracionamento Cromatográfico de HPFE-D... 132
5.4.5 Fracionamento Cromatográfico de HPFE-D 1: Isolamento de HP-1... 132
5.4.6 Fracionamento Cromatográfico de HPFE-D 2: Isolamento de HP-2... 133
5.4.7 Fracionamento Cromatográfico de HPFE-D 3: Isolamento de HP-3... 5.4.8 Fracionamento Cromatográfico de HPFE-D 4: Isolamento de HP-4... 5.4.9 Fracionamento Cromatográfico de HPFE-B: Isolamento de HP-10... 5.5 Obtenção do extrato etanólico dos talos de H. patens - HPTE... 5.5.1 Particionamento do extrato etanólico dos talos de H. patens-HPTE... 5.5.2 Fracionamento Cromatográfico de HPTE-D: Isolamento de HP-5... 5.5.3 Fracionamento Cromatográfico de HPTE-H: Isolamento de HP-6 e HP-7... 5.6 Obtenção do extrato etanólico do caule de H. patens - HPCE... 5.6.1 Particionamento do extrato etanólico do caule de H. patens - HPCE... 5.6.2 Fracionamento Cromatográfico de HPCE-D: Isolamento de HP-8... 5.6.3 Recristalização da Fração HPCE-A: Isolamento de HP-9... 135 135 137 139 139 139 140 143 143 143 145 CAPÍTULO 6 CONCLUSÃO... 146
CAPÍTULO 7 CONSTANTES FÍSICAS... 147
CCD Cromatografia em Camada Delgada
CLAE Cromatografia Líquida de Alta Eficiência
HPFE Extrato Etanólico das Folhas de Hamelia patens
HPCE Extrato Etanólico do Caule de Hamelia patens
HPTE Extrato Etanólico dos Talos de Hamelia patens
COSY Correlation Spectroscopy
DEPT Distortionless Enhancement by Polarization Transfer
EM Espectrometria de Massas
HMBC Heteronuclear Multiple Bond Correlation
HSQC Heteronuclear Single Quantum Coherence
RMN 13C Ressonância Magnética Nuclear de Carbono-13
RMN 1H Ressonância Magnética Nuclear de Hidrogênio-1
IV Infravermelho
IE Ionização por Elétrons
T.R. Tempo de Retenção
F.R. Fator de Retenção
LISTA DE FIGURAS
Figura 1 –Fotos de H. patens com detalhes para flores e frutos... 17
Figura 2 – Foto de H. patens em seu habitat natural... 18
Figura 3 –Espectro de absorção na região do infravermelho de HP-1 (NaCl)... 39
Figura 4 –Espectro de massas de HP-1 (70 eV, IE)... 39
Figura 5 –Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-1... 40
Figura 6 –Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP-1... 40
Figura 7 –Espectro de RMN 13C – DEPT - 135°[125 MHz, (CD3)2CO] de HP-1... 41
Figura 8 –Espectro de 1H, 1H – COSY [500 x 500 MHz, (CD3)2CO] de HP-1... 42
Figura 9 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-1... 43
Figura 10 –Expansões do Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD 3)2CO] de HP-1. 43 Figura 11 –Espectro de 1H, 1H – NOESY [500 x 500 MHz, (CD3)2CO] de HP-1... 44
Figura 12 –Espectro de 1H, 13C – HSQC [500 x 125 MHz, (CD3)2CO] de HP-1... 45
Figura 13 –Espectro de absorção na região do infravermelho de HP-2 (NaCl)... 51
Figura 14 –Espectro de massas de HP-2 (70 eV, IE)... 51
Figura 15 –Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-2... 52
Figura 16 –Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP-2... 52
Figura 17 - Espectro de RMN 13C – DEPT - 135°[125 MHz, (CD3)2CO] de HP-2... 53
Figura 18 –Espectro de 1H, 1H – COSY [500 x 500 MHz, (CD3)2CO] de HP-2... 53
Figura 19 –Expansão do Espectro de 1H, 1H – COSY [500 x 500 MHz, (CD3)2CO] de HP-2... 54
Figura 20 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-2... 54
Figura 21 –Expansões do Espectro de1H, 13C –HMBC [500 x 125 MHz, (CD3)2CO] de HP-2. 55 Figura 22 –Espectro de 1H, 1H – NOESY [500 x 500 MHz, (CD3)2CO] de P-2... 56
Figura 23 –Espectro de 1H, 13C – HSQC [500 x 125 MHz, (CD3)2CO] de HP-2... 57
Figura 24 –Espectro de absorção na região do infravermelho de HP-3 (NaCl)... 66
Figura 25 –Espectro de massas de HP-3 (70 eV, IE)... 66
Figura 26 –Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-3... 67
Figura 27 –Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP-3... 67
Figura 28 –Espectro de RMN 13C – DEPT - 135°[125 MHz, (CD3)2CO] de HP-3... 68
Figura 29 –Espectro de 1H, 1H – COSY [500 x 500 MHz, (CD3)2CO] de HP-3... 68
Figura 30 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-3... 69
Figura 34 –Espectro de absorção na região do infravermelho de HP-4 (NaCl)... 76
Figura 35 –Espectro de RMN1H [500 MHz, (CD3)2CO] HP-4... 77
Figura 36 –Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP-4... 77
Figura 37 –Espectro de RMN 13C – DEPT - 135°[125 MHz, (CD3)2CO] de HP-4... 78
Figura 38 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-4... 78
Figura 39 –Expansões do Espectro de1H, 13C – HMBC [500 x 125 MHz, (CD 3)2CO] de HP-4.. 79
Figura 40 – Espectro de 1H, 13C – HSQC [500 x 125 MHz, (CD3)2CO] de HP-4... 79
Figura 41 –Espectro de massas de HP-10 (70 eV, IE)... 87
Figura 42 –Espectro de absorção na região do infravermelho de HP-10 (KBr)... 87
Figura 43 –Espectro de RMN1H [500 MHz, CD3OD] HP-10... 88
Figura 44 –Espectro de RMN 13C – BB [125 MHz, CD3OD] de HP-10... 88
Figura 45 –Espectro de RMN 13C – DEPT - 135°[125 MHz, CD3OD] de HP-10... 89
Figura 46 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, CD3OD] de HP-10... 89
Figura 47 –Expansões do Espectro de 1H, 13C – HMBC [500 x 125 MHz, CD3OD] de HP-10.. 90
Figura 48 –Expansões do Espectro de 1H, 13C –HMBC [500 x 125 MHz, CD3OD] de HP-10.. 91
Figura 49 – Espectro de 1H, 13C – HSQC [500 x 125 MHz, CD3OD] de HP-10... 92
Figura 50 – Expansões do Espectro de 1H, 13C –HSQC [500 x 125 MHz, CD3OD] de HP-10... 92
Figura 51 –Espectro de 1H, 1H – COSY [500 x 500 MHz, CD3OD] de HP-10... 93
Figura 52 –Expansões do Espectro de 1H, 1H – COSY [500 x 500 MHz, CD3OD] de HP-10.... 93
Figura 53 –Espectro de massas de HP-5 (70 eV, IE)... 100
Figura 54 –Espectro de absorção na região do infravermelho de HP-5 (KBr)... 100
Figura 55 –Espectro de RMN1H [500 MHz, C5D5N] de HP-5... 101
Figura 56 –Expansão do espectro de RMN1H [500 MHz, C5D5N] de HP-5... 101
Figura 57 –Espectro de RMN 13C – BB [125 MHz, C5D5N] de HP-5... 102
Figura 58 –Espectro de RMN 13C – DEPT - 135°[125 MHz, C5D5N] de HP-5... 102
Figura 59 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-5... 103
Figura 60 –Expansão do Espectro de 1H, 13C –HMBC [500 x 125 MHz, (CD 3)2CO] de HP-4... 103
Figura 61 –Espectro de absorção na região do infravermelho de HP-6 (NaCl)... 106
Figura 62 –Espectro de RMN1H [500 MHz, CDCl3] HP-6... 106
Figura 63 –Espectro de RMN 13C – BB [125 MHz, CDCl3] de HP-6... 107
–
Figura 67 –Espectro de RMN1H [500 MHz, CDCl3] de HP-7... 113
Figura 68 –Espectro de RMN 13C – BB [125 MHz, CDCl3] de HP-7... 113
Figura 69 –Espectro de 1H, 13C – HMBC [500 x 125 MHz, CDCl3] de HP-7... 114
Figura 70 –Espectro de absorção na região do infravermelho de HP-8 (KBr)... 118
Figura 71 –Espectro de RMN1H [500 MHz, C5D5N] de HP-8... 118
Figura 72 –Espectro de RMN 13C – BB [125 MHz, C5D5N] de HP-8... 119
Figura 73 –Espectro de RMN 13C – DEPT - 135°[125 MHz, C5D5N] de HP-8... 119
Figura 74 –Espectro de massas de HP-9 (70 eV, IE)... 123
Figura 75 –Espectro de absorção na região do infravermelho de HP-9 (KBr)... 123
Figura 76 –Espectro de RMN1H [500 MHz, CD3OD] de HP-9... 124
Figura 77 –Espectro de RMN 13C – BB [125 MHz, CD3OD] de HP-9... 124
LISTA DE TABELAS
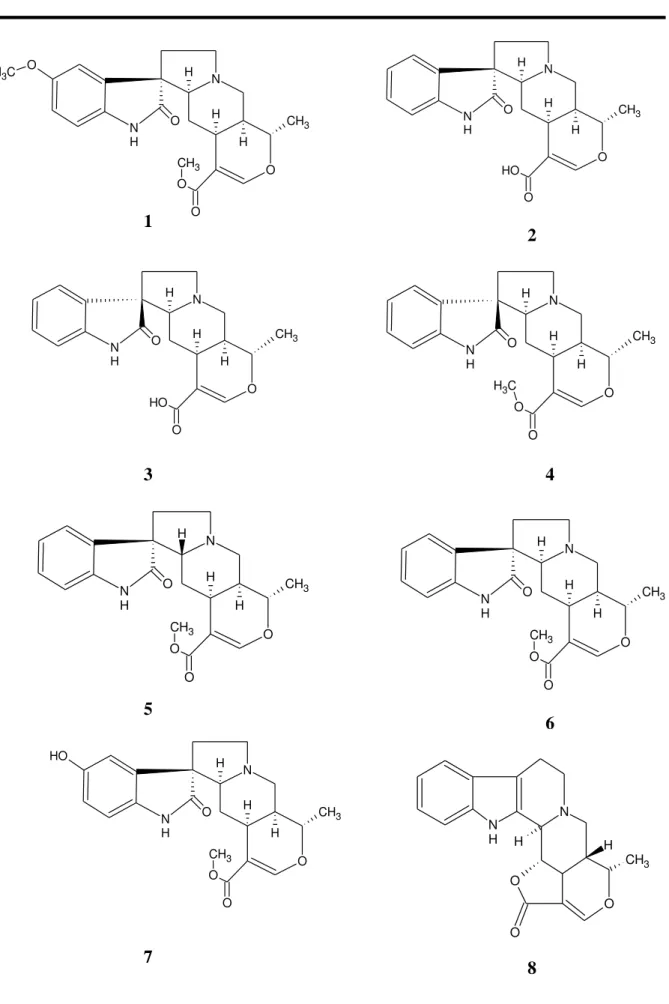
Tabela 1 Metabólitos secundários isolados de espécies do gênero Hamelia... 20 Tabela 2 Estruturas químicas de metabólitos secundários isolados do gênero
Hamelia... 21 Tabela 3 Ocorrência de alcalóides oxindólicos... 23 Tabela 4 Estruturas químicas de alcalódes oxindólicos isolados de outras espécies 25
Tabela 5 Deslocamentos químicos de RMN 13C-BB de HP-1 com padrão de
hidrogenação [RMN 13C-BB e DEPT 135°, [125 MHz (CD3)2CO]... 32
Tabela 6 Dados de RMN 1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ
(n=2 e n=3) de HP-1... 35 Tabela 7 Análise comparativa dos deslocamentos químicos () de RMN 13C de
HP-1 [125 MHz, (CD3)2CO] com a pteropodina [25 MHz, CDCl3]... 38
Tabela 8 Deslocamentos químicos de RMN 13C-BB de HP-2 com padrão de
hidrogenação [(CD3)2CO, (125 MHz)]... 47 Tabela 9 Análise comparativa dos deslocamentos químicos (de RMN 13C [125
MHz, (CD3)2CO] de HP-1 e HP-2... 48 Tabela 10 Dados de RMN 1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ
(n=2 e n=3) de HP-2... 49 Tabela 11 Análise comparativa dos deslocamentos químicos () de RMN 13C de
HP-1 [125 MHz, (CD3)2CO] com a isopteropodina [25 MHz, CDCl3]... 50
Tabela 12 Deslocamentos químicos de RMN 13C-BB de HP-3 com padrão de
hidrogenação [(CD3)2CO, 125 MHz]... 59
Tabela 13 Dados de RMN 1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ
(n=2 e n=3) de HP-3... 61
Tabela 14 Análise comparativa dos deslocamentos químicos () de RMN 13C de HP-1 [125 MHz, (CD3)2CO] com a palmirina [25 MHz, CDCl3]... 65
Tabela 15 Deslocamentos químicos de RMN 13C-BB de HP-4 com padrão de
hidrogenação [RMN 13C-BB e DEPT 135°, [125 MHz (CD3)2CO]... 72 Tabela 16 Análise comparativa dos deslocamentos químicos (de RMN 13C [125
MHz, (CD3)2CO] de HP-3 e HP-4... 74 Tabela 17 Dados de RMN 1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ
Tabela 18 Deslocamentos químicos de RMN C-BB de HP-10 com padrão de
hidrogenação RMN 13C-BB e DEPT 135°, [125 MHz, CD3OD]... 81
Tabela 19 Dados de RMN 1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ (n=2 e n=3) de HP-10... 85
Tabela 20 Análise comparativa dos deslocamentos químicos () de RMN 13C de HP-1 [125 MHz, CD3-OD] com o canferol-3-O-α -L-rhamnopiranosil-(1→6)- -D-galactopiranosídeo [125 MHz, DMSO-d6]... 86
Tabela 21 Deslocamentos químicos de RMN 13C-BB de HP-5 com padrão de hidrogenação RMN 13C-BB e DEPT 135°, [125 MHz, CD3OD]... 95
Tabela 22 Dados de RMN 13C, [125 MHz, (C5D5N)] de HP-5, em comparação com os dados da literatura... 99
Tabela 23 Dados de RMN 13C (125 MHz, CDCl3) de HP-6 em comparação com os dados da literatura... 105
Tabela 24 Dados de RMN 13C (125 MHz, CDCl3) de HP- 7 em comparação com os dados da literatura... 111
Tabela 25 Dados de RMN 13C (125 MHz, C5D5N) de HP- 8 e da literatura [ALAM et al., 1996 (150 MHz, DMSO-d6)] [VOUTQUENNE et al., 1999 (75 MHz, CDCl3)]... 117
Tabela 26 Deslocamentos químicos de RMN 13C-BB de HP-9 com padrão de hidrogenação RMN 13C-BB e DEPT 135°, [125 MHz, (CD3)2CO]... 121
Tabela 27 Análise comparativa dos deslocamentos químicos () de RMN13C de HP-9 [125 MHz, (CD3-OD)] com dados da literatura... 122
Tabela 28 Particionamento do extrato etanólico HPFE... 131
Tabela 29 Fracionamento cromatográfico de HPFE-D... 132
Tabela 30 Fracionamento cromatográfico de HPFE-D 1... 133
Tabela 31 Fracionamento cromatográfico de HPFE-D 2... 134
Tabela 32 Fracionamento cromatográfico da fração (104-140) (5-23)... 134
Tabela 33 Fracionamento cromatográfica de HPFE-D 3... 135
Tabela 34 Fracionamento cromatográfico de HPFE-D 4... 136
Tabela 35 Fracionamento cromatográfico da fração (36-50) (2-4)... 136
Tabela 36 Fracionamento cromatográfico de HPFE-B... 138
Tabela 37 Particionamento do extrato etanólico HPTE... 139
LISTA DE QUADROS
Quadro 1 Proposta mecanística para as fragmentações que justificam os
principais picos registrados no espectro de massa de HP-1 ... 37
Quadro 2 Proposta mecanística para as fragmentações que justificam os
principais picos registrados no espectro de massa de HP-3 ... 63
Quadro 3 Proposta mecanística para as fragmentações que justificam os
principais picos registrados no espectro de massa de HP-5 ... 97
Quadro 4 Proposta mecanística para as fragmentações que justificam os
principais picos registrados no espectro de massa de HP-7 ... 110
Quadro 5 Proposta mecanística para as fragmentações que justificam os
LISTA DE FLUXOGRAMAS
Fluxograma 1 Fracionamento cromatográfico do extrato etanólico das
folhas de H. patens... 131 Fluxograma 2 Fracionamento cromatográfico de HPFE-D... 137 Fluxograma 3 Fracionamento cromatográfico de HPFE-B... 138
Fluxograma 4 Fracionamento cromatográfico do extrato etanólico dos
talos de H. patens... 142
Fluxograma 5 Fracionamento cromatográfico do extrato etanólico do
RESUMO
Neste trabalho foi realizado a investigação fitoquímica de Hamelia patens
(Rubiaceae) nativa da Serra de Guaramiranga-CE. A realização de sucessivos tratamentos cromatográficos a partir do extrato etanólico das folhas possibilitou o isolamento dos alcalóides oxindólicos pentacíclicos pteropodina, isopteropodina e palmirina, já citados na literatura para a espécie, do alcalóide isopalmirina de caráter inédito na literatura, além do flavonóide canferol-3-O-α-L-rhamnopiranosil-(1→6) -D-galactopiranosídeo. O estudo do extrato etanólico dos talos possibilitou o isolamento dos esteróides -sitosterol e estigmasterol como mistura, do estigmast-4-en-3,6-diona, além do triterpeno ácido ursólico. A partir do extrato etanólico do caule foram obtidos o ácido vanílico e a mistura de esteróides -sitosterol e estigmasterol glicosilados. Para o isolamento dos metabólitos secundários foram empregadas técnicas cromatográficas convencionais como cromatografia em camada delgada, cromatografia filtrante, cromatografia flash, cromatografia preparativa e Cromatografia Líquida de Alta Eficiência (CLAE). A caracterização estrutural dos compostos isolados foi realizada através de técnicas espectroscópicas como infravermelho, espectrometria de massas e ressonância magnética nuclear, incluindo técnicas uni (RMN 1H e RMN 13C e DEPT 135) e bidimensionais (HMBC, HSQC, COSY e NOESY), além de comparação com dados descritos na literatura.
Palavras chaves: Hamelia patens, Alcalóides oxindólicos, esteróides, triterpenos, RMN.
ABSTRACT
This work describes the phytochemical investigation of Hamelia patens
(Rubiaceae) native from Guaramiranga montain, Ceará, Brazil. Sucessive chromatographic treatment of the ethanol extract of leaves led to the isolation of the pentaciclic oxindole alkaloids pteropodine, isopteropodine, palmirine, and the new isopalmirine, besides the flavonoid kaempferol l-3-α-O-rhamnopyranosyl-(1-6)-β -D-galactopyranoside. The study of the ethanol extract of the stems led to the isolation of the steroids β-sitosterol and stigmasterol as mixture, stigmast-4-en-3,6-dione, and the triterpene ursolic acid. The ethanol extract of the trunk yielded vanillic acid and the -sitosterol and stigmasterol glucosilated. The isolation of the chemical constituents were performed by the use of chromatographic techniques, including flash cromatography, thin layer crohromatography, preparative crhomatography, and preparative high performance liquid chromatography (HPLC). The strucutral charactherization were performed by the use of infrared, mass spectrometry and nuclear magnetic resonance, including one (1H NMR, 13C NMR and DEPT 135) and two-bidimensional pulse sequences (HMBC, HSQC, COSY e NOESY), and comparison with literature data.
Capítulo 1
1 INTRODUÇÃO
O uso de espécies vegetais, com fins de tratamento e cura das doenças e
de seus sintomas, remonta ao início da civilização, desde o momento em que o
homem despertou para a consciência e começou um longo percurso de manuseio,
adaptação e modificação dos recursos naturais para o seu próprio benefício. Esta
prática milenar ultrapassou todos os obstáculos e chegou até os dias atuais, sendo
amplamente utilizada por toda a população mundial como fonte de recurso
terapêutico eficaz. Certamente, a medicina moderna, composta por um grande
número de medicamentos com ações específicas sobre receptores, enzimas e
canais iônicos, não teria atingido o grau de desenvolvimento atual se não fosse com
o auxílio dos produtos naturais, notadamente os derivados de plantas superiores.
O uso de plantas medicinais representa muitas vezes o único recurso
terapêutico de muitas comunidades e grupos étnicos. Dessa forma, usuários de
plantas medicinais de todo o mundo, mantêm em voga a prática do consumo de
fitoterápicos, tornando válidas informações etnofarmacológicas que foram sendo
acumuladas durante séculos [BHATTACHARJEE et al., 2005].
O Brasil é o país com maior diversidade genética vegetal, contando com
mais de 55.000 espécies catalogadas, de um total estimado entre 350.000 a 550.000
[SIMÕES et al., 2000]. Em decorrência desta alta complexidade, sua biodiversidade
ainda é pouco conhecida, apesar de representar um grande patrimônio nacional.
Além disso, o processo de colonização trouxe ao país muitas espécies utilizadas
pelos europeus e africanos.
A família Rubiaceae é uma das maiores famílias de dicotiledôneas da
espécies possuem importância econômica como o café (Coffea arabica) e o jenipapo
(Genipa americana), e outras são amplamente utilizadas na medicina como
Cinchona officinale, espécie da qual é extraída a quinina. Espécies de Palicourea e
Psychotria são tóxicas para o gado e Gardênia, Ixora e Mussaenda são utilizadas
como plantas ornamentais [CORRÊA et al., 1926]. Esta família é largamente
representada no Ceará, por arbustos e árvores, divididos em uma grande variedade
de gêneros endêmicos e espécies inéditas do ponto de vista botânico.
Hamelia patens Jacq. é uma espécie da família Rubiaceae com
ocorrência pantropical e utilizada na medicina tradicional. Uma série de aplicações
medicinais tradicionais é conhecida para esta espécie ao longo da América Latina
(do México à Argentina). No México, é usada para 42 diferentes fins medicinais,
especialmente estancar hemorragias, curar feridas e em perturbações menstruais
[REYES et al., 2004]. Estudos químicos anteriores com um espécimem nativa na
América Central revelou uma fonte prolífica de alcalóides oxindólicos.
Desta forma, o presente trabalho descreve o estudo fitoquímico da
espécie H. patens nativa do Nordeste do Brasil, visando o isolamento e a
Capítulo 2
2 CONSIDERAÇÕES BOTÂNICAS
2.1 Considerações Botânicas sobre a Família Rubiaceae
Espécies de Rubiaceae são endêmicas nas regiões mais quentes,
principalmente nos trópicos, onde mais de 70% das espécies crescem. Esta vasta
família ocupa o quarto lugar de todo o reino vegetal, compreendendo cerca de
13000 espécies distribuídas em 350 gêneros.
Estas espécies estão distribuídas em 25 tribos: Henriquezieae,
Catesbaeeae, Cruckshanksieae, Retiniphylleae e Coussareeae existem somente na
América, principalmente na América do sul. Por outro lado, só no hemisfério oriental
ocorrem Knoxieae, Alberteae e Vanguerieae, enquanto que Naucleeae, Cinchoneae,
Rondeletieae, Condamineeae, Hedyotideae, Mussaendeae, Hamelieae, Gardenieae,
Guettardeae, Chiococceae, Ixoreae, Morindeae, Psychotrieae, Paederieae,
Anthospermeae, Spermacoceae e Stellatae ocorrem na Europa e nas Américas
[CHIQUIERI et al., 2004].
No Brasil há ocorrência de várias espécies distribuídas em 18 tribos:
Henriquezieae, Retiniphylleae, Coussareeae, Naucleeae, Cinchoneae, Rondeletieae,
Condamineeae, Hedyotideae, Mussaendeae, Hamelieae, Gardenieae, Guettardeae,
Chiococceae, Ixoreae, Psychotrieae, Paederieae, Spermacoceae e Stellatae
[CHIQUIERI et al., 2004].
2.2 Considerações Botânicas sobre o Gênero Hamelia
A tribo Hameliceae possui 4 gêneros com ocorrência no Brasil: Hamelia,
Coutarea, Bertiera e Hoffmannia. O gênero Hamelia é composto por sete espécies:
Hamelia patens Jacq., Hamelia sanguinea T. S. Elias, Hamelia rovisosae Wernham e
Hamelia xerocarpa Kuntze[CHIQUIERI et al., 2004].
2.3 Considerações Botânicas sobre a Espécie Hamelia patens
A espécie Hamelia patens Jacq. é uma planta muito comum na República
da Argentina, difundida por toda a América do Sul até as Antilhas e dispersa na
região mexicana e península da Flórida [CHIQUIERI et al., 2004]. Pode ser
encontrada em vários habitats, no entanto, cresce melhor em locais com boa
umidade e pleno sol à sombra parcial.
Na América Tropical, H. patens apresenta porte arbusto, podendo chegar
a uma altura de 3,6 m. Possui flores em cimos espiralados e corola de cinco pétalas,
sendo desfrutadas por borboletas. Os frutos são arredondados, pequenos e
brilhantes, podendo ser comidos por aves [CORRÊA et al., 1926].
Figura 2 – Foto de H. patens em seu habitat natural
Capítulo 3
3 LEVANTAMENTO BIBLIOGRÁFICO
Dentre as espécies do gênero Hamelia, somente as espécie H. magniflora
e H. patens foram submetidas à investigação fitoquímica. Nas classes de
metabólitos secundários isolados destacam-se os alcalóides do tipo oxindólicos,
indólicos, além de flavonóides do tipo flavanona, cujos esqueletos básicos estão
representados abaixo:
Dados da literatura revelaram os alcalóides oxindólicos como
estimulantes na produção de linfócitos e também na modulação positiva de
receptores muscarínicos M1 e 5-HT-2. A fração alcaloídica das folhas de H. patens
nativa no México demonstrou efeito relaxante do miométrio em teste in vivo com
ratos [REYES et al., 2004].Por outro lado, estudos realizados com a pteropodina (4) (Tab. 2, p. 21) revelaram as atividades antioxidante, antigenotoxica e na indução de
linfócitos em ratos[ROGELIO et al., 2008].
A Tabela 1 (p. 20) e a Tabela 2 (p. 21) a seguir apresentam um
levantamento bibliográfico acerca dos metabólitos secundários isolados do gênero
Hamelia, revelando como principais marcadores quimiotaxônomicos os alcalóides
oxindólicos pentacíclicos. No entanto, além do gênero Hamelia, esta classe de
alcalóides também pode ser encontrada em espécies de Uncaria e Gelsemium,
como mostrado na Tabela 3 (p. 23) e Tabela 4 (p. 25).
N H
O
O
O
N H
Alcalóides Oxindolicos
Substâncias Espécie Referência
Palmerina (1) H. patens BORGES et al., 1979
Isomaruquina (2) Maruquina (3)
H. patens BORGES et al., 1979
Pteropodina (4) H. patens BORGES et al., 1980
Especiofilina (5) H. patens BORGES et al., 1981
Isopteropodina (6) H. patens ADAMS et al.,1989
Rumberina (7) H. patens REYES et al., 2004
Alcalóides Indólicos
Magniflorina (8)
Ajmalicina (9) H. magniflora RUMBERO, 1991
Flavonóides
(2S) Narirutina (10)
(2R) Narirutina (11)
H. patens AQUINO, 1990
Outras classes de metabólitos (Triterpenos e Esteróides)
-Sitosterol (12) Ácido Ursólico (13)
-Sitosterol glicosilado (14)
H. patens SUBRAHMANYAM et al., 1973
Stigmast-4-en-3,6-diona (15) H. patens RIPPERGER, 1978
N H O N O O O CH3 H H H CH3 7 O H N H O N O O O CH3 H H H CH3 N H N O H CH3 O O H 8 1 N H O N O O O H H H CH3 CH3 O C H3 2 N H O N O O O H H H H CH3 N H O N O O O H H H H CH3 3 N H O N O O O H H H CH3 C H3 4 5
Tabela 2 – Estruturas químicas dosmetabólitos secundários isolados no gênero Hamelia.
Alcalóides Oxindolicos
Substâncias Espécie Referência
7(R)-Gleissoschizol oxindolico (16) Tabernaemontana corymbosa
KUAN et al., 2009
7(S)-Gleissoschizol oxindolico (17)
7(R), 16(R), 19(E)-Isositsirikina oxindolico (18)
7(S), 16(R), 19(E)-Isositsirikina oxindolico (19)
Paratunamida A (20) Cinnamodendron axillare
KAGATA et al., 2006
Paratunamida B (21)
Paratunamida C (22)
Paratunamida D (23)
Gelegamina A (24) Gelsemium elegans ZHEN et al., 2009
Gelegamina B (25)
Gelegamina C (26)
Gelegamina D (27)
Gelegamina E (28)
Matemona (29) Iotrochota purpurea CARLETTI et al., 2000
11-Methoxy-14-hydroxy-19-oxo-gelsenicina (30) Gelsemium sempervirens
KITAJIMA et al., 2003
11-Methoxy-14-hydroxygelsenicina (31)
11-Methoxygelsemoxonina (32)
Nb-Demethylalstophyllal oxindolico (33) Alstonia macrophylla WAH et al., 1996
Alstonal (34)
Nb-Demethylalstophyllina oxindolico (35)
Alstonisina (36)
17-Demethoxy-hydroisorhynchophyllina (37) Ervatamia yunnanensis
YU et al., 1999
17-Demethoxy-isorhynchophyllina (38)
Gelsecrotonidina (39) Gelsemium elegans YAMADA et al., 2008
14-Hydroxygelsecrotonidina (40)
11-Methoxygelsecrotonidina (41)
14-Hydroxygelsedilam (42)
Neolaugerina (43) Neolaugeria resinosa WENIGER et al., 1993
Isoneolaugerina (44)
15-Hydroxyisoneolaugerina (45)
Ácido Isopteropodico (46) Uncaria sinensis HONG et al., 1993
Ácido Pteropodico (47)
Ácido Mitraphylico (48)
Ácido Isorhynchophylico (49)
Ácido Rhynchophylico (50)
16, 17-Dihydro-17β-hydroxy isomitraphyllina (51) Mitragyna parvifolia PANDEY et al., 2006
16, 17- Dihydro-17β-hydroxy mitraphyllina (52)
Uncarina C (53) Uncaria tomentosa MUHAMMAD et al., 2001
Uncarina D (54)
Uncarina E (55)
Mitraphyllina (56)
N H O N H H H H OH N O N O H H O O Me H H O Me O Me N H O N O H H OH H O C H3 N H O N O H H OH H O C H3
16 17
18 19
N H O N O H O O O H O O OH O H O H O H 20 N H O N O H O H O O H O O OH O H O H O H N H O N O H O O O H O O OH O H O H O H N H O N O H O O O H O O OH O H O H O H 21
Tabela 4 - Estruturas dealcalóides oxindólicos isolados de outras espécies.
N H
O N
O O
O H
H H
CH3
C H3
56
N H
O N
O O
O H
H H
CH3
C H3
Capítulo 4
4 DETERMINAÇÃO ESTRUTURAL
4.1 Determinação estrutural dos constituintes químicos não-voláteis das folhas de Hamelia patens
4.1.1 Determinação Estrutural de HP-1
Os sucessivos tratamentos cromatográficos da fração diclorometano,
obtida a partir da partição do extrato etanólico das folhas de Hamelia patens,
resultaram no isolamento de um sólido amorfo branco denominado de HP-1 (p.f.
211,7-212,3 °C).
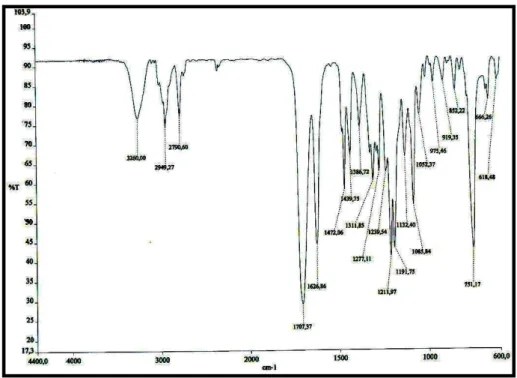
A análise do espectro no infravermelho (Fig. 3, p. 39) revelou bandas
características de deformações axiais da ligação N-H em 3260 cm-1 e de ligações
C-N de aminas terciárias em 1086 cm-1. Observaram-se também duas bandas
relativas a deformações axiais de ligação C-O em 1212 e 1192 cm-1, além de
vibrações de deformações axiais da ligação C=O de éster α, -insaturado e de
-lactamas em 1707cm-1. Foram observadas ainda absorções características de
ligações C=C conjugada em 1627 cm-1; uma banda larga em 751 cm-1 relativa à
deformação angular fora do plano de C-H de anel aromático, além de deformações
axiais em 2949 e 2791 cm-1 de C-H alifáticos.
O espectro de RMN 13C-BB [125 MHz, (CD3)2CO] de HP-1 (Fig. 6, p. 40)
apresentou 21 linhas espectrais. Sendo dois sinais de grupamentos de carbonila em
180,5 (C-2) e 167,8 (C-22) referente às funções amida e éster conjugado,
respectivamente. Em adição, observaram-se oito sinais em [ 155,5 (C-17), 110,9
(C-16), 134,9 (C-8), 124,2 (C-9), 122,9 (C-10), 128,8 (C-11), 109,9 (C-12) e 142,9
(C-13)] que foram relacionados a carbonos sp2, dos quais o carbono em 155,5
oxigenado e o outro de carbono nitrogenado [ 75,2 (C-3) e 73,2 (C-19)], além de um
grupamento metoxila em 51,1 (C-23).
Posterior comparação dos espectros RMN 13C-BB e DEPT 135° [125
MHz, (CD3)2CO] (Fig. 7, p. 41) revelou a presença de nove carbonos metínicos,
quatro carbonos metílênicos, dois carbonos metílicos e seis carbonos
não-hidrogenados. Estas informações, em adição ao valor do pico do íon molecular em
m/z 368 no espectro de massas (Fig. 4, p. 39), possibilitaram inferir a fórmula
molecular C21H24N2O4 para HP-1 (Tab. 5).
Tabela 5 – Deslocamentos químicos de RMN 13C-BB de HP-1 com padrão de hidrogenação [RMN 13C-BB e DEPT 135°, 125 MHz, (CD3)2CO].
C CH CH2 CH3 Fómula Molecular
180,5 155,5 55,7 51,1
167,8 128,8 54,0 18,9
142,9 124,2 35,4
134,9 122,9 30,9
110,9 109,9
56,9 75,2
73,2 38,9 32,1
C4 C9H9 C4H8 C2H6 C21H23
C2O4 N2H C21H24N2O4
Análise detalhada do espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-1
(Fig. 5, p. 40), mostrou um total de 19 sinais. Neste espectro foram observados cinco
sinais na região de hidrogênios olefínicos em 7,40 (s, 1H, H-17); 7,30 (d, J=7,4 Hz,
1H, H-9); 7,18 (dt, J=7,7; 1,0 Hz, 1H, H-11); 7,01 (dt, J=7,7; 0,9 Hz, 1H, H-10) e 6,88
(d, J=7,7 Hz, 1H, H-12), um multipleto em 4,49 (m, 1H, H-19) de um hidrogênio
oxi-metínico, e um singleto característico de metoxila em 3,54 (s, 3H, H-23). Em
adição, foram observados ainda vários conjuntos de multipletos em 3,20 (m, 2H,
(m, 1H, 14a). Em 1,36 (d, J=6,2 Hz, 3H, H-18), foi observado um dubleto intenso
referente a hidrogênios de grupamento metila ligado a carbono mono-hidrogenado.
O espectro de correlação homonuclear 1H, 1H-COSY de HP-1 (Fig. 8, p.
42) revelou o acoplamento do hidrogênio em 7,30 (H-9) com o hidrogênio em
7,01 (H-10), e do hidrogênio em 7,18 (H-11) com os dois hidrogênios em 7,01
(H-10) e 6,88 (H-12), respectivamente. Foram observados ainda os acoplamentos do
hidrogênio em 4,49 (H-19) com os hidrogênios em 1,36 (H-18) e 1,61 (H-20); e
do hidrogênio em 3,33 (H-21) com os hidrogênios 1,61 (H-20). De acordo com
estes dados foi possível sugerir as seguintes subestruturas para HP-1:
Analisando o Espectro de Correlação Heteronuclear 1H, 13C-HSQC de
HP-1 (Fig. 12, p. 45) foi possível estabelecer inequivocadamente a correlação de
todos os hidrogênios a seus respectivos carbonos.
Através da análise detalhada do espectro bidimensional de correlação
homonuclear à longa distância 1H, 1H-HMBC da substância HP-1 (Fig. 9 e 10, p. 43)
foi possível visualizar as correlações dos hidrogênios em 1,64 (H-6b) e 1,47 (H-6a)
com o carbono 180,5 (C-2); dos hidrogênios em 3,33 (H-5a),3,20 (H-21a) e 1,95
(H-14a) acoplando com o carbono 75,2 (C-3) e dos hidrogênios em 2,34 (H-3),
1,64 (H-6b) e 1,47 (H-6a) com o carbono 56,9 (C-7), de acordo com a subestrutura
1.
Neste espectro verificaram-se os acoplamentos dos hidrogênios em 6,88
(H-12) e 7,01 (H-10) com o carbono 134,9 (C-8); dos hidrogênios em 7,18 (H-11)
e 7,01 (H-10) com o carbono em 124,2 (C-9); e do hidrogênio em 6,88 (H-12)
com o carbono 122,9 (C-10). Em adição, foram observados os acoplamentos do
hidrogênio em 7,18 (H-11) com o carbono 109,9 (C-12) e dos hidrogênios 7,18
(H-11) e 7,30 (H-9) com o carbono 142,9 (C-13), de acordo com a subestrutura 2.
Por outro lado, os acoplamentos dos hidrogênios 2,40 (H-15) e 7,4
(H-17) com o carbono 110,9 (C-16); dos hidrogênios 4,49 (H-19) com o carbono
18,9 (C-18); dos hidrogênios 2,40 (H-15) e 3,20 (H-21a) com o carbono 38,9
(C-20) e dos hidrogênios 7,4 (H-17) e 2,40 (H-15) com o carbono 167,8 (C-22), H
H H
H 13 8
9 11 12
10
N
H
N
O
H H
H H H
H H
H
H 2
7 3
6 5
14 21
Subestrutura 1
sugeriram a construção do núcleo diidrofurano contendo uma carbometoxila em
C-16, conforme a subestrutura 3.
Tabela 6 – Dados de RMN1H, 13C e correlações de 1H, 13C-HSQC e 13 C-HMBC nJ (n=2 e n=3) de HP-1.
C HSQC HMBC
δC δH 2JCH 3JCH
2 180,5 - - H-3, H-6a, H-6b
3 75,2 2,34 (m) H-14a H-21a, H-21b H-5a, H-5b,
5 55,7 2,34 (m)
3,20 (m) H-6b H-21b
6 35,4 1,95 (ddd, J = 7,6; 5,1;
0,84 Hz), 2,29 (m) H-5a H-3
7 56,9 - H-6a, H-6b, H-3 H-6b, H-14a H-5a, H-5b,
8 134,9 - - H-6a, H-10, H-12
9 124,2 7,30 (d, J = 7,4 Hz) H-10 H-11
10 122,9 7,01 (dt, J = 7,7; 0,85 Hz) - H-12
11 128,8 7,18 (dt, J = 7,7; 1,0 Hz) H-10 H-9
12 109,9 6,88(d, J = 7,7 Hz) H-11 H-10
13 142,9 - - H-9, H-11
14 30,9 1,64 (m)
1,47 (m) H-15 -
15 32,1 2,40 (m) H-14a H-21a
16 110,9 - H-17, H-15 H-14a
17 155,5 7,40 (s) - H-15
18 18,9 1,36 (d, J = 6,2 Hz) H-19 -
19 73,2 4,49 (m, 1H) - H-17, H-21a, H-21b, H-15
20 38,9 1,61(m, 1H) H-21a, H-15 H-14b
21 54,0 2,34 (m) 3,33 (m) - H-5a, H-5b
22 167,8 - - H-17, H-15
23 51,1 3,54 (s) - -
As interações dipolo-dipolo à longa distância do espectro de correlação
homonuclear 1H, 1H – NOESY de HP-1 (Fig. 11, p. 44), foram decisivas para a
confirmação da estrutura final, através dos importantes acoplamentos do hidrogênio
em 7,30 (H-9) com os hidrogênios em 2,34 (H-3) e 1,95 (H-14a).
O espetro de massa (Fig. 4, p. 39), além de fornecer o pico do íon
molecular m/z 368, apresentou importantes sinais com razão massa/carga de 223,
208, 69 e 41, que sugeriram a proposta mecanística para os fragmentos do quadro
1, p. 37.
N
H N
O
O
COOMe
C H3
H H
H H H
H
8 7
10 11
12 13
2
6 5
15
16 20
17 18
22 23 19
9
Quadro 1 – Proposta mecanística para as fragmentações que justificam os principais picos registrados no espectro de massas de HP-1
C9H7NO
C8H10O3
C10H14O3
N
O
COOMe +
.
+
.
N
H N
O
O
COOMe
N
O
COOMe +
N
+
.
N+
.
m/z 368
m/z 69
m/z 223
m/z 208
m/z 41
CH3
A posterior comparação dos dados de RMN 13C de HP-1 com dados
descritos na literatura para alcalóides oxindólicos (Tab. 7), possibilitou caracterizar
HP-1 como sendo a pteropodina, um alcalóide oxindólico já isolado anteriormente
das partes aéreas de H. patens [ADAMS et al., 1979].
Tabela 7 – Análise comparativa dos deslocamentos químicos () de RMN13C de
HP-1 [125 MHz, (CD3)2CO] com a pteropodina [25 MHz, CDCl3].
C HP-1
Pteropodina [ADAMS et al., 1989]
δC δC
2 180,5 181,9
3 75,2 74,0
5 55,7 53,0
6 35,4 29,0
7 56,9 56,0
8 134,9 133,5
9 124,2 123,0
10 122,9 122,2
11 128,8 128,8
12 109,9 109,0
13 142,9 141,0
14 30,9 34,0
15 32,1 31,0
16 110,9 109,8
17 155,5 155,0
18 18,9 18,5
19 73,2 72,0
20 38,9 37,9
21 54,0 55,0
22 167,8 168,0
23 51,1 50,5
Figura 3 – Espectro de absorção na região do infravermelho de HP-1 (NaCl)
Figura 5 – Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-1
Figura 6 – Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP- 1
N
O
COOMe C
H3
N H
O
180,5
75,2 55,7 35,4 56,9
134,9 124,2 122,9 128,8 109,9
142,9
30,9 32,1
110,9 155,5 18,9
73,2 38,9 54,0
Figura 8 – Espectro de 1H, 1H – COSY [500 x 500 MHz, (CD3)2CO] de HP-1
8 7 13
2
9
N H
O
H H
H H
11 10 12
a
b
c
15
16 20
17 18
22 23 21
N
O
COOMe
C H3
H H
H H
19
14 f
g e
a b c
d e
Figura 9 – Espectro de 1H, 13C – HMBC [500 x125 MHz, (CD3)2CO] de HP-1
Figura 10 - Expansão do Espectro de 1H, 13C – HMBC [500 x 125 MHz, (CD3)2CO] de HP-1 H H H H 13 8 9 11 12 10 a b c d e f g h 16 18 22 23
O
COOMe
C H3 H H H H H 21 15 19 1720 j i
l m n o p N H N O H H H H H H H H H 2 7 3 6 5 14 21 q r s t u a b d f e g j i q s p
u t
Figura 11 – Espectro de 1H, 1H – NOESY [500 x 500 MHz, (CD3)2CO] de HP-1
N
H N
O
O
COOMe
C H3
H H
H
H 8
7
10 11
12 13
2
6 5
15
16 20
17 18
22 23
19
9
3 14
21
a
b
a
4.1.2 Determinação Estrutural de HP-2
Sucessivos tratamentos cromatográficos da fração diclorometano, obtida a
partir da partição do extrato etanólico das folhas de H. patens, levaram ao
isolamento de um sólido amorfo branco denominado de HP-2 (p.f. 204,3-205,5 °C).
A análise do espectro no infravermelho (Fig. 13, p. 46) revelou banda
característica de deformação axial de ligação N-H em 3263 cm-1, além de banda em
1210 cm-1 relativa a deformação axial de ligação C-O e vibrações de deformações
axiais de ligações C=O de éster α, -insaturado e de -lactama em 1708 cm-1. Foi
observada ainda absorção característica de ligações duplas conjugadas em 1625
cm-1; uma banda larga em 754 cm1 relativa à deformação angular fora do plano de
C-H do anel aromático, além de deformações axiais em 2949, 2925 e 2800 cm-1 de
C-H alifáticos.
O espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-2 (Fig. 15, p. 52)
mostrou-se bastante semelhante ao de HP-1, onde foram observados sinais de
hidrogênio aromáticos em 7,30 (d, J=6,6 Hz, 1H, H-9); 7,16 (dt, J=7,7; 1,3 Hz, 1H,
H-11); 6,97 (dt, J=7,7; 0,9 Hz, 1H, H-10) e 7,70 (d, J=7,7 Hz, 1H, H-12) e um sinal de
hidrogênio olefínico em 7,37 (s, 1H, H-17). Observou-se ainda um multipleto em
m, 1H, H-19) relativo a um hidrogênio oxi-metílico, e um singleto
característico de metoxila em 3,54 (s, 3H, H-23). Em 1,41 (d, 3H, H-18), foi
observado um dubleto intenso, que foi relacionado a hidrogênios de carbono metílico
ligado a carbono mono-hidrogenado.
No espectro de RMN 13C-BB [125 MHz, (CD3)2CO] (Fig. 16, p. 52) foram
observadas 21 linhas espectrais. De maneira análoga a HP-1 foram identificados 2
comparação com o espectro de DEPT 135° [125 MHz, (CD3)2CO] (Fig. 17, p. 53 e
Tab. 8).
Tabela 8 – Deslocamentos químicos de RMN 13C-BB de HP-2 com padrão de hidrogenação [RMN 13C-BB e DEPT 135°, (CD3)2CO, 125 MHz].
C CH CH2 CH3 Fórmula Molecular
180,5 155,4 54,8 51,1
167,7 128,6 54,3 18,9
142,5 125,4 35,5
134,8 122,7 31,3
112,0 110,2
57,7 73,2
72,3 39,1 31,7
C4 C9H9 C4H8 C2H6 C21H23
C2O4 N2H C21H24N2O4
A posterior construção de uma tabela de comparação entre os dados de
RMN 13C de HP-1 e HP-2 permitiu visualizar que as principais diferenças estão
relacionadas aos deslocamentos do carbono C-3, que se encontra em 72,3 (C-3)
em HP-2, e portanto mais desprotegido em HP-1 em 75,2 (C-3), Tab. 9 (p. 48), a
Tabela 9 – Análise comparativa dos deslocamentos químicos (de
RMN 13C [125 MHz, (CD3)2CO] de HP-1 e HP-2.
C HP-1 HP-2
δC δC
2 180,5 180,5
3 75,2 72,3
5 55,7 54,8
6 35,4 35,5
7 56,9 57,7
8 134,9 134,8
9 124,2 125,4
10 122,9 122,7
11 128,8 128,6
12 109,9 110,2
13 142,9 142,5
14 30,9 31,3
15 32,1 31,7
16 110,9 112,0
17 155,5 155,4
18 18,9 18,9
19 73,2 73,2
20 38,9 39,1
21 54,0 54,3
22 167,8 167,7
23 51,1 51,1
De acordo com estes dados foi observado que HP-2 é um isômero
estrutural de HP-1, já que possuem a mesma fórmula molecular C21H24N2O4. Este
dado foi confirmado pelo espectro de massas que mostrou o pico do íon molecular
em m/z 368 (Fig. 14, p. 51).
Os espectros de correlação bidimensional heteronuclear - HSQC (Fig. 23,
p. 57) e HMBC (Fig. 20, p. 54 e Fig. 21, p. 55) de HP-2 também demonstram
semelhanças com a análise feita para HP-1, e determinou a correlação inequívoca
de cada carbono e seu respectivo hidrogênio, de acordo com a Tab. 10 (p. 49), a
Tabela 10 – Dados de RMN1H, 13C e correlações de 1H, 13C-HSQC e 13C-HMBC nJ (n=2 e n=3) de HP-2.
C HSQC HMBC
δC δH 2JCH 3JCH
2 180,53 - - H-3
3 72,3 2,36 (m, 1H) - H-21a, H-5a
5 54,8 3,27 (m, 2H) e 2,44 (m, 2H) - H-3
6 35,5 1,94 (m, 1H); 2,29 (m, 1H) H-5b -
7 57,7 - H-6a H-9, H-5a, H-14a
8 134,8 - - H-10, H-12
9 125,4 7,30 (d, J=6,6 Hz, 1H) - H-11
10 122,7 6,97 (dt, J=7,7; 0,9 Hz, 1H) - H-12
11 128,6 7,16 (dt, J=7,7; 1,3 Hz, 1H) H-10 H-9
12 110,2 7,70 (d, J=7,7 Hz, 1H) H-11 H-10
13 142,5 - - H-9, H-11
14 31,3 0,87 (m, 1H) e 1,56 (m, 1H) H-3 -
15 31,7 2,46 (m, 1H) - H-17, H-21a, H-19
16 112,0 - H-17, H-15
17 155,3 7,37 (s, 1H) - H-15
18 18,9 1,41 (d, J=6,2 Hz, 3H) H-19 -
19 73,2 4,37 (m, 1H) H-18 H-17, H-21b
20 39,1 1,63 (dt, J=13,1; 3,7 Hz, 1H) H-21a, H-15 H-18
21 54,3 3,39 (dd, e 2,41 (m, 2H) J=13,1; 3,7 Hz, 2H) - H-3
22 167,7 - - H-17, H-15, H-23
23 51,1 3,54 (s, 3H) - -
Porém, após a análise detalhada no espectro homonuclear - NOESY (Fig.
22, p. 56) de HP-2, foram observados importantes acoplamentos à longa distância
entre o hidrogênio aromático H-9 em 7,30 (H-9) com os hidrogênios em 1,36
(H-18), e 4,37 (H-19).
De posse dessa análise e após comparação com dados de RMN 13C
descritos na literatura (Tab. 11, p. 50), HP-2 foi caracterizado como o epímero de
HP-1 denominado de isopteropodina. Este alcalóide já foi isolado anteriormente da
parte aérea de H. patens [ADAMS et al., 1989].
Tabela 11 – Análise comparativa dos deslocamentos químicos () de RMN 13C de
HP-2 [125 MHz, (CD3)2CO] com a isopteropodina [25 MHz, CDCl3].
C HP-2
Isopteropodina [ADAMS et al, 1989]
δC δC
2 180,53 181,6
3 72,3 72,2
5 54,8 53,6
6 35,5 30,3
7 57,7 57,1
8 134,8 133,8
9 125,4 124,5
10 122,7 122,5
11 128,6 127,7
12 110,2 109,8
13 142,5 140,5
14 31,3 34,9
15 31,7 30,6
16 112,0 109,9
17 155,4 155,0
18 18,9 18,6
19 73,2 71,2
20 39,1 38,0
21 54,3 54,1
22 167,7 167,6
23 51,1 51,0
Figura 13 – Espectro de absorção na região do infravermelho de HP-2 (NaCl)
Figura 15 – Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-2
Figura 16 – Espectro de RMN 13C – BB [125 MHz, (CD3)2CO] de HP-2
N
H N
O
COOMe O
112 167,7 51,1
155,4 18,9
73,2 39,1 54,3
31,7 31,3 72,3 57,7
134,8 54,8 35,5 125,4 122,7 128,6
110,2 142,5
Figura 17 - Espectro de RMN13C – DEPT - 135°[125 MHz, (CD3)2CO] de HP-2
Figura 19 – Espectro de 1H, 1H – COSY - [500 x 500 MHz, (CD3)2CO] de HP-2 –
Expandido
Figura 22 – Espectro de 1H, 1H – NOESY [500 x 500 MHz, (CD3)2CO] de HP-2
N
H N
O C
H3
COOMe
O
H
H
16
22 23
17 18
20 21
15 14 3
7 8
5 6 10 11
12
13
2
4.1.3 Determinação Estrutural de HP-3
Sucessivos tratamentos cromatográficos da fração diclorometano. obtida a
partir da partição do extrato etanólico das folhas de H. patens, resultaram no
isolamento de um sólido amorfo branco denominado de HP-3 (p.f. 100,3-101,1 °C).
A análise do espectro no infravermelho de HP-3 (Fig. 24, p. 66) revelou
banda característica de deformação axial N-H em 3259 cm-1 e de ligações C-N de
aminas terciárias em 1086 cm-1. Observaram-se também uma banda em 1209 cm-1
de ligação C-O, e vibrações de deformações axiais C=O de éster α, -insaturado e
de -lactamas em 1706 cm-1. Foi observada ainda absorção característica de ligação
dupla conjugada em 1630 cm-1; uma banda em 755 cm-1 relativa à deformação
angular fora do plano de C-H de anel aromático, além de deformações axiais em
2948 e 2791 cm-1 de C-H alifáticos.
O espectro de RMN 13C-BB [125 MHz, (CD3)2CO] de HP-3 (Fig. 27, p. 67)
apresentou 22 linhas espectrais. De modo Semelhante a HP-1 e HP-2, a análise
detalhada deste espectro revelou dois sinais em 180,5 (C-2) e 167,8 (C-22)
característicos de carbonilas de amida e de éster conjugado, respectivamente.
Foram observados ainda oito sinais referentes a carbonos sp2 [ 110,9 (C-16), 136,2
8), 110,2 9), 155,5 17) 156,7 10), 113,2 11), 111,4 12) e 133,8
(C-13)], dos quais os carbonos em 155,5 (C-17) e 156, 7 (C-10) encontram-se
oxigenados. Outra diferença observada no espectro de HP-3 foi a presença de um
carbono adicional relativo a um grupamento metoxila em 56,0 (C-24). Comparando
os espectros RMN 13C-BB e DEPT 135° [125 MHz, (CD3)2CO] (Fig. 28, p. 68),
observaram-se oito linhas espectrais referentes a carbonos metínicos; quatro
A partir destas informações foi possível elucidar a fórmula molecular de
HP-3 como sendo C22H26N2O4 (Tab. 12), em acordo com o pico do íon molecular em
m/z 398 no espectro de massa (Fig. 25, p. 66).
Tabela 12 – Deslocamentos químicos de RMN 13C-BB de HP-3 com padrão de hidrogenação (RMN 13C-BB e DEPT 135°, 125 MHz (CD3)2CO).
C CH CH2 CH3 TOTAL
156,7 155,5 55,7 56,0
136,2 113,1 54,0 51,1
133,8 111,4 35,4 18,9
110,9 110,2 30,9
57,4 75,3
73,2 37,6 32,1
C5 C8H8 C4H8 C3H9 C20H25
C2O5 N2H C22H26N2O5
O estudo do espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-3 (Fig. 26,
p. 67) revelou quatro sinais de hidrogênios em 7,46 (s, 1H, H-17), 6,80 (m, 1H, H-
9), 6,76 (m, 1H, H-11), 6,95 (d, J=2,4 Hz, H-12), além de dois sinais simpleto e
intensos em 3,55 (s, 3H, H-23) e 3,78 (s, 3H, H-24), e um outro dupleto em 1,37
(d, J=6,2 Hz, 3H, H-18), relacionados a hidrogênios de grupamentos metoxilas e
metila, respectivamente. De maneira análoga aos espectros de HP-1 e HP-2, o
espectro de HP-3 mostrou ainda conjuntos de multipletos em 2,46-2,31, 1,48 (m,
2H, H-6a) e 1,96 (m, 2H, H-6b).
O Espectro de Correlação Heteronuclear – HSQC de HP-3 (Fig. 32, p. 70)
permitiu a associação de cada carbono ao seu respectivo hidrogênio de forma
inequívoca.
Por outro lado, a análise do espectro bidimensional HMBC (Fig. 30, p. 69)
e dos dois hidrogênios aromáticos em 6,95 (H-12) e 6,80 (H-9) com o carbono em
136,2 (C-8), subestrutura 1.
A posição relativa do grupo metoxila adicional foi determinada atavés dos
acoplamentos dos hidrogênios 6,95 (H-12), 6,80 (H-9) e 3,78 (H-24) com o carbono
156,72 (C-10). Em adição, foram observados os acoplamentos do hidrogênio em
6,95 (H-12) com o carbono 113,20 (C-11) e dos hidrogênios em 6,80 (H-9), 6,95
(H-12) com o carbono (C-13), conforme subestrutura 2.
Ainda analisando este espectro, observaram-se os acoplamentos dos
hidrogênios em 7,46 (H-17) e 2,42 (H-15) com o carbono em 110,9 (C-16); o
acoplamento do hidrogênio 4,50 (H-19) com o carbono 18,9 (C-18) e dos
hidrogênios 3,55 (H-23), 7,46 (H-17) e 2,42 (H-15) com o carbono em 167,8
(C-22), levando à proposição da subestrutura 3, p. 61.
N
H N
O O
CH3
H H H
7
5 6 8 10 11
13
2
24
3 9
12
O CH3
H H
8 11
12 9
10
24
13
Subestrutura 1
Tabela 13 – Dados de RMN1H, 13C e correlações de HSQC e HMBC nJ (n=2 e n=3) de HP-3.
C HSQC HMBC
δC δH 2JCH 3JCH
2 180,5 - H-3
3 73,3 2,37 (m) H-5a, H-6a e H-14a -
5 55,7 3,19 (dd, 2,46 (m) J=11,9; 1,8 Hz) H-6a -
6 35,4 1,96 (ddd, 0,85 Hz) ; 2,31 (m) J=6,85; 5,0; H-5b -
7 57,4 - - H-14b
8 136,2 - H-9 H-12
9 110,2 6,80 (m) - -
10 156,7 - H-9 H-12 e H-24
11 113,2 6,76 (m) H-12 -
12 111,4 6,95 (d, J=2,35 Hz) H-11 -
13 133,8 - H-12 H-9
14 30,9 1,48 (m) 1,66 (m) H-15 H-20
15 32,1 2,42 (m) H-20 e H-14a H-17, H-19 e H-21a
16 110,9 - H-17 e H-15 -
17 155,5 7,46 (s) - H-15 e H-19
18 18,9 1,37 (d, J=6,2 Hz) H-19 -
19 73,2 4,50 (m) - H-17
20 37,6 1,61 (m) H-19, H-15 e H-21a H-18
21 54,0 2,37 (m) 3,34 (m) - -
22 167,8 - - H-17, H-23 e H-15
23 51,1 3,55 (s) - -
24 56,0 3,78 (s) - -
COOMe C
H3
H
H
H
16 15
17 19
20
22 23
Adicionalmente, o espectro homonuclear 1H, 1H – NOESY de HP-3 (Fig.
31, p. 70), revelou importantes acoplamentos dipolo-dipolo a longa distância do
hidrogênio em 6,95 (H-12) com os hidrogênios da metoxila em 3,76
(H-24),b) e 196a), conforme o fragmento mostrado abaixo.
O espectro de massa (Fig. 25, p. 66) apresentou picos semelhantes a
HP-1 (m/z 223, 208, 41 e 60), com o surgimento de dois picos (m/z 367 e 297)
caracterizando a presença da metoxila adicional, como mostrado na proposta
mecanística no quadro 2, p. 63.
N
H N
O O
CH3
H
H H
3 7
8 9 10 11
13
2 12
Quadro 2 – Proposta mecanística para as fragmentações que justificam os principais picos registrados no espectro de massa de HP-3
OCH3
.
C8H10O3 C10H14O3 C10H9NO2 N H N O O O CH3 COOMe +.
N H N O O COOMe + N H N O O CH3 + C4H5O3.
N O COOMe +.
N O COOMe +m/z 208
CH3
.
N
+
.
m/z 69
N +
.
m/z 41
m/z 367
m/z 297
m/z 223
Os dados acima discutidos e a posterior comparação com dados de RMN
13C descritos na literatura (Tab. 14, p. 65) para o alcalóide oxindólico palmirina,
revelou a semelhança entre as duas substâncias. Este alcalóide também já foi
isolado a partir da parte aérea de H. patens [BORGES et al., 1979].
N
H N
O
O O
CH3
COOMe 23 22
16
15
17 19
20 21
14 3
7
5 6 8
9 10 11
12
13
2
18 24
Tabela 14 – Análise comparativa dos deslocamentos químicos () de RMN 13C
de HP-3 [125 MHz, (CD3)2CO] com a palmirina (25 MHz, CDCl3).
C HP-3
Palmirina [BORGES, 1979]
δC δC
2 180,5 181,0
3 73,3 72,3
5 55,7 53,6
6 35,4 34,9
7 57,4 57,6
8 136,2 135,3
9 110,2 109,9
10 156,7 156,0
11 113,2 112,2
12 111,4 111,9
13 133,8 133,8
14 30,9 30,3
15 32,1 30,7
16 110,9 110,0
17 155,5 155,1
18 18,9 18,6
19 73,2 71,3
20 37,6 38,2
21 54,0 54,1
22 167,8 167,6
23 51,1 51,0
24 56,0 55,7
Figura 24 – Espectro de absorção na região do infravermelho de HP-3 (NaCl)
Figura 26 – Espectro de RMN 1H [500 MHz, (CD3)2CO] de HP-3
![Tabela 5 – Deslocamentos químicos de RMN 13 C-BB de HP-1 com padrão de hidrogenação [RMN 13 C-BB e DEPT 135°, 125 MHz, (CD 3 ) 2 CO]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/41.892.135.801.546.809/tabela-deslocamentos-químicos-rmn-padrão-hidrogenação-rmn-dept.webp)
![Figura 7 - Espectro de RMN 13 C – DEPT - 135° [125 MHz, (CD 3 ) 2 CO] de HP-1](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/50.892.158.790.133.637/figura-espectro-rmn-dept-mhz-cd-co-hp.webp)
![Figura 8 – Espectro de 1 H, 1 H – COSY [500 x 500 MHz, (CD 3 ) 2 CO] de HP-1 8 7132 9NHO H HH H111012a b c 15 1620 1718 22 23N21O COOMeCH3HHHH1914fgeacbdef g](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/51.892.147.770.112.727/figura-espectro-cosy-mhz-nho-coomech-hhhh-fgeacbdef.webp)
![Tabela 8 – Deslocamentos químicos de RMN 13 C-BB de HP-2 com padrão de hidrogenação [RMN 13 C-BB e DEPT 135°, (CD 3 ) 2 CO, 125 MHz]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/56.892.139.798.292.588/tabela-deslocamentos-químicos-rmn-padrão-hidrogenação-rmn-dept.webp)
![Tabela 9 – Análise comparativa dos deslocamentos químicos ( de RMN 13 C [125 MHz, (CD 3 ) 2 CO] de HP-1 e HP-2](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/57.892.274.663.214.700/tabela-análise-comparativa-dos-deslocamentos-químicos-rmn-mhz.webp)

![Figura 17 - Espectro de RMN 13 C – DEPT - 135° [125 MHz, (CD 3 ) 2 CO] de HP-2](https://thumb-eu.123doks.com/thumbv2/123dok_br/15359839.564371/62.892.172.766.128.536/figura-espectro-rmn-dept-mhz-cd-co-hp.webp)