Universidade de Trás-os-Montes e Alto Douro
Cardiomiopatia Dilatada no Cão: Casos Clínicos
Dissertação de Mestrado em Medicina Veterinária
Iolanda Susana Cancela de Sousa
Orientador: Professora Doutora Maria João Miranda Pires
Coorientador: Dr. Luís Montenegro
Universidade de Trás-os-Montes e Alto Douro
Cardiomiopatia Dilatada no Cão: Casos Clínicos
Dissertação de Mestrado em Medicina Veterinária
Iolanda Susana Cancela de Sousa
Orientador: Professora Doutora Maria João Miranda Pires
Coorientador: Dr. Luís Montenegro
Composição do Júri:
____________________________________________________
____________________________________________________
____________________________________________________
iii Agradecimentos
À professora Maria João Pires por toda a ajuda e disponibilidade, por sempre arranjar tempo para me esclarecer dúvidas e por todas as vezes que me recebeu na UTAD.
À doutora Teresa Sargo pela simpatia e por se ter disponibilizado a ajudar-me tanto. À doutora Cláudia Abreu pela simpatia e por me ter ajudado sempre que precisei. À Luna pela companhia constante, por ser uma guerreira e ter vencido a batalha mesmo contra as probabilidades. Pela alegria contagiante e o abanar de cauda enérgico que a carateriza, pelo ânimo que me dá e por me deixar todos os dias de coração cheio.
Aos meus pais por fazerem tudo por mim e me permitirem chegar até aqui. Aos meus tios e primas pelos domingos, por serem como irmãs para mim.
A toda a equipa do HVM pela simpatia e conhecimento transmitido, por me continuarem a receber tão bem cada vez que lá volto.
A todos os colegas de estágio pelo apoio, espírito de equipa, jantaradas e momentos de diversão. Em especial à Mariana, Martinha e Ana Marta por estarem sempre lá para tudo.
À Angela por se ter tornado uma grande amiga. Por todas as gargalhadas, conversas, conselhos, apoio, força. Por saber que posso contar sempre com ela, por ter as portas abertas para mim quer fosse no Porto, em Vila Real ou em Lugo, por me receber sempre tão bem e me fazer sentir parte da família. Por me ter ensinado e ajudado tanto, por ser das melhores pessoas que conheço e pela amizade que em pouco tempo se tornou tão forte.
Aos companheiros de curso pelos 5 anos fantásticos e por todos os momentos passados na “bila”, que se fosse a enumerar nunca mais terminava.
À Bruna por me conhecer tão bem, por conseguir sempre surpreender-me pela positiva e por todos os testamentos que me dão tanto gosto de enviar e receber.
Às suspeitas do costume Catarina, Susana e Lipa por continuarem presentes ao fim destes anos todos e não terem mudado nem um bocadinho.
Ao “gang dos coffees” Resende e Choupina pelas conversas e parvoíces, que faziam toda a diferença no meu estado de espírito.
Às companheiras do Sea Life pela amizade e carinho que permaneceu e por me continuarem a fazer sentir em casa sempre que lá vou.
Aos companheiros de voluntariado pelos momentos incríveis que passámos juntos e por se terem tornado grandes amigos, senão mesmo família.
iv Resumo
A cardiomiopatia dilatada (CMD) é uma doença primária do miocárdio caraterizada por uma hipertrofia excêntrica progressiva e disfunção sistólica, sobretudo do ventrículo esquerdo. É uma das doenças cardíacas adquiridas mais comuns em cães. Afeta sobretudo cães de meia idade e de raças grandes e gigantes, sendo particularmente frequente em algumas delas. A etiologia é idiopática, mas sabe-se que existe uma componente genética no Doberman Pinscher, Dogue Alemão, Boxer, Wolfhound Irlandês, Terra Nova e Cão d’Água Português. A apresentação clínica é variável e pode existir uma fase assintomática longa antes do desenvolvimento de sinais clínicos de insuficiência cardíaca, durante a qual pode ocorrer morte súbita. O diagnóstico passa pela exclusão de outras doenças cardíacas ou com apresentações clínicas semelhantes, sendo a ecocardiografia um exame fundamental. O tratamento é sobretudo farmacológico e sempre paliativo, focando-se no controlo dos sinais clínicos e melhoria da qualidade de vida. O prognóstico é reservado a mau e o tempo de sobrevivência varia com vários fatores. Assim, este trabalho tem como objetivo o seguimento de casos clínicos de cães com CMD e a análise e interpretação dos sinais clínicos, exames complementares e tratamento realizado.
Neste trabalho foram acompanhados 4 casos de CMD observados durante um estágio realizado no Hospital Veterinário Montenegro, entre agosto de 2014 e fevereiro de 2015.
Todos os cães eram machos de meia idade e de raças grandes, incluindo um Doberman Pinscher, um Boxer e um Serra da Estrela. Um dos cães tinha CMD pré-clínica e os restantes apresentavam sinais de insuficiência cardíaca congestiva (ICC) esquerda ou bilateral, sendo os mais frequentes prostração, tosse e ascite. No exame físico foi detetado um sopro cardíaco, pulso fraco e arritmia em dois cães. As arritmias mais comuns foram fibrilhação atrial e complexos prematuros ventriculares. As principais alterações radiográficas foram cardiomegalia, edema pulmonar e ascite. O diagnóstico definitivo foi ecocardiográfico, através da confirmação do aumento das câmaras cardíacas e da presença de disfunção sistólica. Dois cães tinham síndrome do eutiroideu doente. O tratamento médico resultou numa melhoria clínica. Os tempos de sobrevivência foram curtos, embora apenas um cão tenha morrido devido à ICC, por interrupção do tratamento. Nestes cães foram observadas várias caraterísticas frequentemente associadas com CMD, tal como descrito na literatura.
v Abstract
Dilated cardiomyopathy (DCM) is a primary myocardial disease characterized by progressive ventricular dilation and systolic dysfunction, specially of the left ventricle. It’s one of the most common acquired heart diseases in dogs. It affects mostly middle-aged dogs and large and giant breeds, being particularly frequent in some of them. The etiology is idiopathic but it’s known that there is a genetic component in Doberman Pinscher, Great Dane, Boxer, Irish Wolfhound, Newfoundland and Portuguese Water Dog. Clinical presentation is variable and may exist a long assymptomatic phase before the development of clinical signs of heart failure, during which sudden death may occur. The diagnosis is made by excluding other cardiac diseases or diseases with similar clinical presentations, being echocardiography an essential exam. The treatment is mostly pharmacological and always palliative, focusing on controlling clinical signs and improving life quality. The prognosis is usually poor and survival time varies according to several factors. Therefore, the aim of this work is to follow clinical cases of dogs with DCM and analyze the clinical signs, diagnostic tests and performed treatment.
In this work 4 cases of DCM, observed during an internship in the Hospital Veterinário Montenegro between August of 2014 and February of 2015, were followed.
All dogs were middle-aged males from large breeds, such as Doberman Pinscher, Boxer and Estrela Mountain Dog. One had preclinical DCM and the others presented signs of left-sided or biventricular congestive heart failure (CHF), most commonly lethargy, cough and ascites. During physical examination two dogs had a heart murmur, weak pulse and arrhythmia. The most common arrhythmias were atrial fibrillation and premature ventricular complexes. The main radiographic abnormalities were cardiomegaly, pulmonary edema and ascites. Final diagnosis was made by echocardiography, through confirmation of cardiac chambers enlargement and presence of systolic dysfunction. Two dogs had simultaneously euthyroid sick syndrome. Medical treatment resulted in clinical improvement. Survival times were short, although only one dog died due to CHF, because the treatment was discontinued. In conclusion, these dogs displayed features commonly associated with DCM, as described in the literature.
vi Índice I. Introdução ...1 1. Cardiomiopatias ...1 2. Cardiomiopatia dilatada ...1 2.1. Definição ...1 2.2. Epidemiologia ...1 2.3. Etiologia ...2 2.3.1. Fatores genéticos ...2 2.3.2. Deficiências nutricionais ...4 2.3.3. Alterações metabólicas ...5
2.3.4. Doenças inflamatórias e infeciosas ...6
2.3.5. Alterações imunológicas ...6
2.3.6. Fármacos e toxinas ...7
2.3.7. Taquicardia ...7
2.3.8. Outras causas ...8
2.4. Fisiopatologia ...8
2.4.1. Sistema nervoso simpático ...9
2.4.2. Sistema renina-angiotensina-aldosterona ... 10 2.4.3. Péptidos natriuréticos ... 11 2.4.4. Endotelina ... 12 2.4.5. Óxido nítrico ... 13 2.4.6. Adrenomedulina ... 13 2.4.7. Citocinas ... 13 2.4.8. Remodelação cardíaca ... 14 2.4.9. Metabolismo energético ... 15 2.5. Diagnóstico ... 15 2.5.1. Apresentação clínica ... 15 2.5.2. Exame físico ... 18 2.5.3. Exames complementares ... 19 2.5.3.1. Eletrocardiografia ... 19 2.5.3.2. Radiografia ... 20 2.5.3.3. Ecocardiografia ... 23
vii 2.5.3.4. Análise laboratorial ... 28 2.5.3.4.1. Geral ... 28 2.5.3.4.1. Biomarcadores... 29 2.5.3.4.1.1. Péptidos natriuréticos ... 29 2.5.3.4.1.2. Troponinas ... 31 2.5.3.4.1.3. Endotelina ... 32 2.5.4. Diagnóstico genético ... 33 2.6. Tratamento ... 33 2.6.1. Fármacos utilizados ... 34
2.6.2. CMD com ICC aguda ... 36
2.6.3. CMD com ICC crónica ... 38
2.6.4. CMD pré-clínica ... 41
2.6.5. Controlo rítmico ... 42
2.6.6. Exercício físico e nutrição ... 44
2.7. Prognóstico ... 46
2.8. Prevenção ... 48
II. Objetivos ... 49
III. Casos clínicos ... 50
1. Introdução ... 50
2. Análise dos casos clínicos ... 51
2.1. Identificação ... 51 2.2. Apresentação clínica ... 52 2.3. Eletrocardiografia ... 52 2.4. Radiografia torácica ... 53 2.5. Ecocardiografia ... 54 2.6. Análise laboratorial ... 57 2.7. Classificação da CMD ... 58 2.8. Tratamento ... 58
2.9. Acompanhamento dos casos clínicos ... 59
IV. Discussão ... 61
V. Conclusão ... 72
viii Índice de figuras
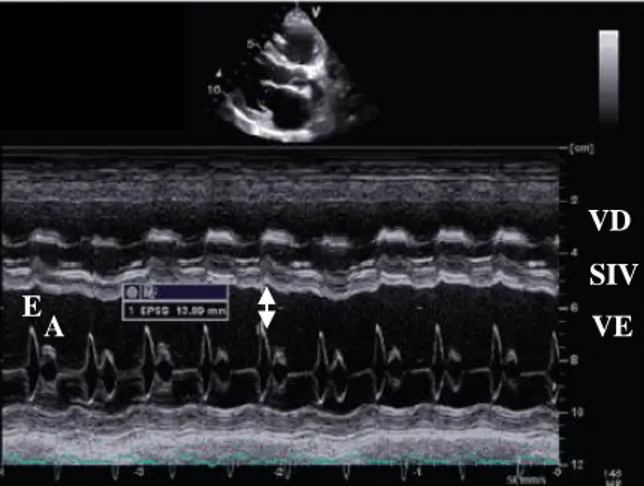
Figura 1- Alterações morfológicas nas cardiomiopatias. A - coração normal. B - cardiomiopatia dilatada. C - cardiomiopatia hipertrófica ...1 Figura 2 – Efeitos compensatórios do SNC em resposta à diminuição da pressão sanguínea na IC ... 10 Figura 3 – Ativação e efeitos do SRAA na IC ... 11 Figura 4 – Representação esquemática dos efeitos dos péptidos natriuréticos ... 12 Figura 5 - ECG de Doberman Pinscher fêmea de 9 anos com CMD. Aumento da duração da onda P, consistente com aumento do AE, e aumento da duração dos complexos QRS, refletindo um atraso na condução intraventricular. Derivação II, 50 mm/s, 1 cm = 1 mV ... 19 Figura 6 - ECG de Doberman Pinscher macho de 3 anos com CMD. Presença de FA, ondas de fibrilhação evidentes na linha isoelétrica (setas). Derivação II, 25 mm/s, 1 cm = 1 mV .... 20 Figura 7 - ECG de Doberman Pinscher fêmea de 9 anos com CMD. Presença de trio e par de VPCs. Derivação II, 25 mm/s, 1 cm = 1 mV ... 20 Figura 8 - Silhueta cardíaca normal (A) e com aumento do átrio esquerdo (B). Na projeção laterolateral, o aumento do átrio esquerdo é identificado pela existência de uma área convexa no bordo caudal da silhueta cardíaca (seta vermelha), bem como pelo deslocamento dorsal da traqueia e brônquio esquerdo (seta cinza). Na projeção dorsoventral é visível uma protuberância na posição das 3 horas (seta azul) ... 21 Figura 9 - Medição do VHS na projeção laterolateral de uma radiografia torácica de um cão. O eixo longo corresponde a 5,1 vértebras torácicas e o eixo curto a 4,4. O VHS é obtido pela soma dos dois valores, ou seja VHS = 5,1 + 4,4 = 9,5. Este valor está dentro do intervalo de referência, sendo compatível com um tamanho cardíaco normal ... 22 Figura 10 – Projeção radiográfica laterolateral de um cão com cardiomegalia generalizada, deslocamento dorsal da traqueia e padrão alveolar marcado ... 23 Figura 11 - Ecocardiografia de Doberman Pinscher fêmea de 8 anos com CMD e FA. Plano paraesternal direito de eixo longo, Doppler a cores. Todas as câmaras cardíacas estão dilatadas e existe fluxo de regurgitação mitral ligeira ... 25 Figura 12 - Ecocardiografia de Dogue Alemão macho com CMD. Plano paraesternal direito de eixo curto, modo M do VE ao nível das cordas tendinosas. LVIDd=74,5mm, LVIDs=65,9mm e FE=11,6%. Dilatação do VE com diminuição da espessura do septo IV e parede livre e hipocinesia marcada ... 25
ix Figura 13 – Plano paraesternal direito de eixo longo, modo M do VE ao nível da válvula mitral. EPSS > 10 mm (setas) ... 26 Figura 14 – Plano paraesternal direito de eixo longo, modo M ao nível da artéria aorta. O PEP é mais longo (setas) porque o aumento da pressão sistólica demora mais tempo ... 26 Figura 15 – Índices de função diastólica do modo Doppler. A – velocidade da onda A (m/s), DT – tempo de desaceleração da onda E (ms) ... 27 Figura 16 – Plano apical de 4 câmaras, Doppler espectral. Padrão de relaxamento anormal, com inversão do rácio E:A ... 27 Figura 17 – Radiografia torácica do cão 2, projeção laterolateral direita. Aumento do bordo caudal da silhueta cardíaca (seta grande) e deslocamento dorsal da traqueia (seta pequena) compatíveis com cardiomegalia esquerda, VHS = 11,5 vértebras ... 53 Figura 18 – Radiografia torácica do cão 2, projeção dorsoventral. Cardiomegalia ... 53 Figura 19 – Radiografia torácica do cão 4, projeção laterolateral direita. Cardiomegalia esquerda com deslocamento dorsal da traqueia (seta preta), VHS = 13 vértebras. Vasos pulmonares congestionados e edema pulmonar com padrão intersticial difuso (setas brancas). A perda de definição da região abdominal (asterisco) é compatível com ascite ... 54 Figura 20 – Radiografia torácica do cão 4, projeção ventrodorsal. Dilatação cardíaca marcada entre as 3 e as 5 horas (chaveta), correspondente ao átrio e ventrículo esquerdos. Congestão e edema pulmonar (setas) ... 54 Figura 21 – Ecocardiografia do cão 1, plano paraesternal direito. A – eixo longo, é visível a dilatação do VE. B – eixo curto, o aumento do rácio AE:Ao indica dilatação do AE. C – eixo curto, modo M do VE. FE=12% traduzindo uma disfunção sistólica grave. D – eixo longo, modo Doppler a cores evidenciando o fluxo de regurgitação da válvula mitral ... 56 Figura 22 - Ecocardiografia do cão 3, plano paraesternal direito. A – eixo longo, dilatação átrioventricular esquerda grave. B – eixo curto, disfunção sistólica grave com FE=13% ... 56 Figura 23 - Ecocardiografia do cão 4. A – plano paraesternal direito de eixo curto ao nível das cordas tendinosas, disfunção sistólica com FE=24%. B – plano apical de 4 câmaras com Doppler a cores onde é visível insuficiência valvular mitral grave ... 56 Figura 24 - Ecocardiografia de reavaliação do cão 1, plano paraesternal direito de eixo curto. A – dilatação esquerda moderada rácio AE:Ao=1,59. B – modo M, disfunção sistólica com FE=27% ... 59
x Índice de tabelas
Tabela 1 - Critérios para o diagnóstico de CMD segundo a ESVC ... 28
Tabela 2 - Fármacos mais utilizados no tratamento de cães com CMD, doses e vias de administração ... 35
Tabela 3 - Fármacos mais utilizados no controlo das arritmias mais frequentes em cães com CMD, doses e vias de administração ... 42
Tabela 4 - Identificação dos cães quanto à raça, género, idade e peso ... 51
Tabela 5 – Motivo da consulta e alterações detetadas no exame físico de todos os cães ... 52
Tabela 6 - Dados eletrocardiográficos dos cães 1, 3 e 4 ... 52
Tabela 7 - Dados radiográficos dos cães 2, 3 e 4 ... 53
Tabela 8 - Dados ecocardiográficos dos cães 1, 3 e 4 ... 55
Tabela 9 – Diagnóstico de CMD nos cães deste trabalho segundo o sistema de pontos da ESVC ... 57
Tabela 10 – Ionograma e doseamento das hormonas da tiroide dos cães 1, 2 e 3 ... 57
Tabela 11 – Fármacos e doses utilizados no tratamento dos 4 cães, após alta hospitalar ... 58
Tabela 12 - Alterações no tratamento do cão 4 ... 58
Tabela 13 - Evolução ecocardiográfica do cão 1 ... 59
Índice de gráficos Gráfico 1 – Número de casos clínicos acompanhados durante o período de estágio no Hospital Veterinário Montenegro, distribuídos por especialidade ... 50
xi Lista de abreviaturas, símbolos, siglas ou acrónimos
α – Alfa β – Beta
® – Marca registada % – Por cento
ADH – Vasopressina
ADN – Ácido desoxirribonucleico AD – Átrio direito
AE – Átrio esquerdo
AMP – Monofosfato de adenosina ANP – Péptido natriurético atrial Ao – Artéria aorta
AV – Atrioventricular BID – A cada 12 horas
BNP – Péptido natriurético cerebral Bpm – Batimentos por minuto CMD – Cardiomiopatia dilatada CNP – Péptido natriurético tipo C cTnI – Troponina cardíaca I cTnT – Troponina cardíaca T
dATP – 2-Desoxiadenosina trifosfato DTe – Tempo de desaceleração da onda E ECA – Enzima de conversão da angiotensina ECG – Eletrocardiograma
EDVI – Índice de volume final diastólico EPSS – Separação do ponto E ao septo Eta-1 – Early T lymphocyte activation
ESVC – Sociedade Europeia de Cardiologia Veterinária ESVI – Índice de volume final sistólico
xii ET – Tempo de ejeção ET-1 – Endotelina 1 ET-2 – Endotelina 2 ET-3 – Endotelina 3 FA – Fibrilhação atrial FE – Fração de encurtamento FC – Frequência cardíaca h – Horas IC – Insuficiência cardíaca
ICC – Insuficiência cardíaca congestiva IE – Índice de esfericidade
IECA – Inibidor da enzima de conversão da angiotensina IM – Intramuscular
IV – Intravenosa
IVCT – Tempo de contração isovolumétrica IVRT – Tempo de relaxamento isovolumétrico
IVSd – Espessura do septo interventricular na diástole IVSs – Espessura do septo interventricular na sístole
LVIDd – Dimensão interna do ventrículo esquerdo na diástole LVIDs – Dimensão interna do ventrículo esquerdo na sístole
LVPWd – Espessura da parede livre do ventrículo esquerdo na diástole LVPWs – Espessura da parede livre do ventrículo esquerdo na sístole mmHg – Milímetros de mercúrio
MMPs – Metaloproteinases de matriz NO – Óxido nítrico
NT-proANP – Fragmento N-terminal do péptido natriurético proatrial NT-proBNP – Fragmento N-terminal do péptido natriurético procerebral PEP – Período de pré-ejeção
xiii RNAs – Ácidos ribonucleicos
SC – Subcutânea SID – A cada 24 horas
SNC – Sistema nervoso central SNS – Sistema nervoso simpático
SRAA – Sistema renina-angiotensina-aldosterona T4 – Tiroxina (ou tetraiodotironina)
TID – A cada 8 horas TMF – Fluxo transmitral
TNF-α – Fator de necrose tumoral alfa TSH – Hormona estimulante da tiroide VD – Ventrículo direito
VE – Ventrículo esquerdo VHS – Vertebral heart size
1 I. Introdução
1. Cardiomiopatias
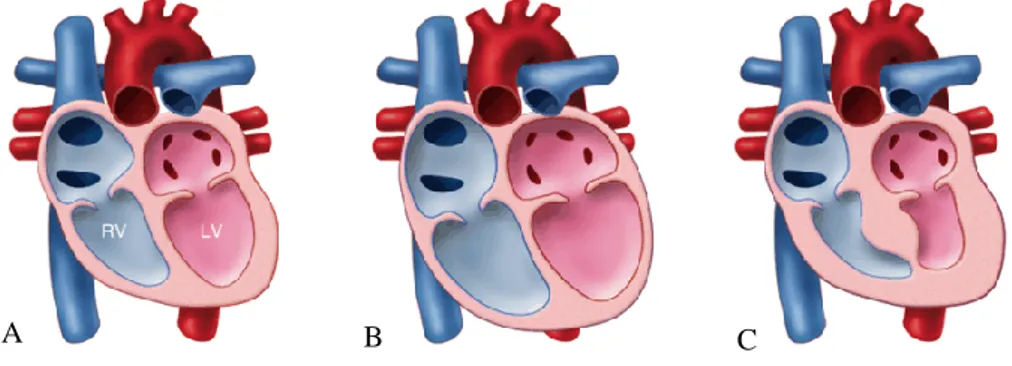
As cardiomiopatias definem-se como doenças primárias do miocárdio, que são caraterizadas por anomalias estruturais e funcionais, na ausência de doença das artérias coronárias, hipertensão, doença valvular e doença cardíaca congénita que possam explicar as alterações cardíacas observadas (Towbin, 1998; Tidholm et al., 2001a; Elliott et al., 2008). Podem ser classificadas em 4 tipos: CMD, hipertrófica, restritiva e arritmogénica do ventrículo direito (VD) (McNally et al., 2013) (Figura 1).
Figura 1- Alterações morfológicas nas cardiomiopatias. A - coração normal. B - cardiomiopatia dilatada. C - cardiomiopatia hipertrófica. LV - ventrículo esquerdo, RV - ventrículo direito (Adaptado de McNally et al., 2013).
2. Cardiomiopatia dilatada 2.1. Definição
A CMD canina é uma doença primária idiopática na qual ocorre uma dilatação progressiva do ventrículo esquerdo (VE) mas que pode afetar as 4 câmaras, sobretudo em fases mais avançadas (Elliott et al., 2008; Bonagura, 2010; McNally et al., 2013). Há uma redução da contratilidade miocárdica que origina disfunção sistólica e posteriormente diastólica (McEwan, 2000a; Tidholm et al., 2001a).
2.2. Epidemiologia
Juntamente com a insuficiência crónica da válvula mitral e a dirofilariose em algumas regiões, a CMD é uma das doenças cardíacas adquiridas mais comuns em cães (Tidholm et
al., 2001a; O’Grady e O’Sullivan, 2004).
Afeta sobretudo cães de raças grandes e gigantes, mas também alguns de raça média (O’Grady e O’Sullivan, 2004). É pouco frequente em cães de porte pequeno, como foi observado num estudo no qual 92% dos cães pesavam mais de 15 kg (Tidholm, 1996). Entre
C B
2 as raças mais predispostas encontram-se Doberman Pinscher, Dogue Alemão, Boxer, Cocker Spaniel Inglês e Americano, Wolfhound Irlandês, Terra Nova, Cão d’Água Português, Pastor da Nova Zelândia, Dogue Canário, Pastor Alemão, São Bernardo, Labrador Retriever, Golden Retriever, Weimaraner, Dálmata, entre outras (Tidholm, 1996; Morales et al., 2001; Sleeper
et al., 2002; Munday et al., 2006; Distl et al., 2007; Martin et al., 2009; Wess et al., 2010b).
É sobretudo diagnosticada em cães de meia idade, sendo mais frequente entre os 6 e os 8 anos (Martin et al., 2009). Com o aumento da idade aumenta a probabilidade de manifestação de CMD. No entanto, um cão com mais de 7 anos sem alterações elétricas e ecocardiográficas tem boas hipóteses de permanecer saudável (Wess et al., 2010a). No Cão d’Água Português está descrita uma forma juvenil de CMD, com início médio às 13 semanas de vida (Dambach et al., 1999). Também foi observada uma forma juvenil no Doberman Pinscher, na qual os cachorros afetados tinham entre 10 dias e 4 semanas de idade (Vollmar et
al., 2003).
De um modo geral, os machos são mais afetados do que as fêmeas (Tidholm, 1996; Distl et al., 2007; Pereira et al., 2008; Martin et al., 2009). No entanto, há estudos que observaram uma distribuição igual de géneros, mas os machos desenvolveram alterações mais cedo (Calvert et al., 1997; Brownlie e Cobb, 1999; Wess et al., 2010b).
2.3. Etiologia
Por definição, a CMD primária é de origem desconhecida e não consequente a nenhuma alteração sistémica ou doença cardiovascular identificável. Pode ser genética ou idiopática. A CMD pode também ser secundária a deficiências nutricionais, alterações metabólicas, doenças infeciosas, anomalias imunológicas, fármacos, toxinas, taquicardia, entre outros (Tidholm et al., 2001a). No mesmo indivíduo, mais do que uma etiologia pode contribuir para o desenvolvimento de CMD (McNally et al., 2013).
2.3.1. Fatores genéticos
Em medicina humana estima-se que 20-30% dos casos de CMD sejam de origem genética (Caforio et al., 2008). O modo primário de transmissão é através de uma via autossómica dominante, sendo menos comum a via autossómica recessiva (McNally et al., 2013). Foram identificadas mutações associadas à CMD em mais de 50 genes (Posafalvi et
al., 2013), que codificam proteínas mitocondriais (Suomalainen et al., 1992), citoesqueléticas
(Towbin, 1998), nucleoesqueléticas, do sarcómero, banda Z, membrana nuclear e do transporte do cálcio (McNally et al., 2013; Simpson et al., 2015b).
3 Nos cães, a elevada prevalência de CMD em determinadas raças e as caraterísticas únicas dentro de cada uma, sugerem uma componente genética subjacente (Meurs, 1998; Munday et al., 2006). Sabe-se que existe CMD familiar no Boxer (Harpster, 1991), Doberman Pinscher (Meurs, 1998), Cão d’Água Português, Wolfhound Irlandês, Dogue Alemão e Terra Nova. O padrão de hereditariedade é autossómico dominante no Doberman Pinscher (Meurs
et al., 2007) e Terra Nova (Wiersma et al., 2008), sendo autossómico recessivo no Cão
d’Água Português (Dambach et al., 1999; Alroy et al., 2000; Sleeper et al., 2002). No Dogue Alemão foi sugerido um padrão autossómico recessivo ligado ao cromossoma X (Meurs et
al., 2001). Também no Wolfhound Irlandês se pensa que a transmissão é feita através de um
modo autossómico recessivo e que genes ligados ao cromossoma X têm alguma importância menor na expressão de CMD (Distl et al., 2007). A presença de alelos específicos para o género pode explicar a maior prevalência em machos (Philipp et al., 2007).
Vários estudos têm identificado genes candidatos para CMD canina. Um estudo em Wolfhound Irlandês identificou 6 loci potencialmente envolvidos, localizados nos cromossomas caninos 1, 10, 15, 17, 21 e 37. O polimorfismo detetado no cromossoma 37 foi significativamente associado com a doença (Philipp et al., 2012). A CMD juvenil do Cão d’Água Português foi associada a um locus do cromossoma canino 8 (Werner et al., 2008). No Doberman Pinscher foi identificado um fator de risco genético no cromossoma 5, presente em aproximadamente metade dos cães com CMD (Mausberg et al., 2011). Também foi descrita uma associação com uma deleção no gene PDK4 do cromossoma 14 (Meurs et al., 2012), no entanto não se verificou noutro estudo (Owczarek-Lipska et al., 2012). Foi ainda proposta uma contribuição multigénica e identificado um locus que pode estar ligado ao cromossoma X como novas variáveis que influenciam o risco de CMD nesta raça (Simpson et
al., 2015a). No Boxer está descrita uma associação entre a CMD e uma mutação da proteína
estriatina, mas não foi encontrada em todos os animais, o que sugere a existência de pelo menos outra causa (Meurs et al., 2013).
À semelhança de medicina humana, foram encontradas mutações causais de CMD canina em proteínas mitocondriais (Lopes et al., 2006; Meurs et al., 2012), do citoesqueleto (Wiersma et al., 2007; Wiersma et al., 2008), do complexo associado à distrofina, envolvidas na citoarquitetura, envelope nuclear, sarcómero e retículo sarcoplasmático (Werner et al., 2008), afetando assim a regulação do cálcio (Oyama et al., 2009) e do metabolismo lipídico (Philipp et al., 2012). Foi sugerido que a etiologia no Wolfhound Irlandês possa ser diferente da dos outros cães, podendo existir diferentes formas de CMD hereditária dentro da própria
4 raça. Uma possibilidade é a existência de alterações no metabolismo lipídico (Vollmar e Aupperle, 2015). Foi ainda proposta a existência de anomalias hereditárias que levam a estados deficientes em L-carnitina no Boxer (Harpster, 1991) e em taurina no Cão d’Água Português, associados ao desenvolvimento de CMD (Alroy et al., 2005).
2.3.2. Deficiências nutricionais
A CMD no cão pode ser secundária a deficiências nutricionais em taurina e L-carnitina (Keene, 1991; Kittleson et al., 1997).
A taurina é um aminoácido sulfurado com grande importância para a função miocárdica. É o aminoácido livre mais abundante no coração, onde modula as concentrações tecidulares e disponibilidade de cálcio e ajuda na inativação de radicais livres (Sanderson, 2006). É também importante para a conjugação de sais biliares, sendo um dos dois aminoácidos que os cães podem utilizar para esse efeito (Zoran, 2010). Não é considerado essencial, uma vez que o balanço entre a síntese e a perda mantém as concentrações dentro de valores normais, mesmo sem haver ingestão (Kittleson et al., 1997).
Está descrito o desenvolvimento de CMD secundária à deficiência de taurina em cães, mas nem todos os que têm concentrações baixas desenvolvem a doença em 48h (Sanderson et
al., 2001). Foi encontrada uma associação entre deficiência de taurina e CMD em várias raças
incluíndo Cocker Spaniel Americano, Terra Nova, Golden Retriever, Labrador Retriever, Dálmata, Bulldog Inglês e Cão d’Água Português (Kittleson et al., 1997; Alroy et al., 2000; Alroy et al., 2005; Backus et al., 2006; Sanderson, 2006). A deficiência de taurina pode ser hereditária ou induzida por dietas que levem à sua depleção, quer pela pouca disponibilidade de aminoácidos sulfurados para a sua síntese como pelo aumento da excreção de ácidos biliares, acelerando assim as perdas urinárias e gastrointestinais (Backus et al., 2003; Fascetti
et al., 2003). Cães saudáveis alimentados com dietas restritas em proteína ou à base de
cordeiro e farelo de arroz desenvolveram deficiência em taurina (Sanderson et al., 2001; Tôrres et al., 2003; Backus et al., 2003). Concentrações sanguíneas abaixo 180 nmol/mL são consideradas indicativas de deficiência de taurina em cães (Backus et al., 2003). Assim, a dieta pode levar à deficiência de taurina que pode resultar em CMD em cães. Nestes casos a taurina torna-se condicionalmente essencial e a suplementação pode resultar numa melhoria substancial na função cardíaca (Sanderson et al., 2001).
A L-carnitina é uma pequena molécula hidrossolúvel, sintetizada primariamente no fígado a partir dos aminoácidos lisina e metionina (Keene, 1991). No organismo apenas existe naturalmente a forma L. A forma D inibe competitivamente as ações da forma L e os
5 mamíferos são incapazes de a converter (Sanderson, 2006). Encontra-se sobretudo no coração e músculo esquelético, onde se concentra através de um mecanismo de transporte ativo de membrana. É responsável pelo transporte de ácidos gordos do citoplasma para o interior da mitocôndria para que possa ocorrer β-oxidação, sendo esta a principal fonte energética do coração (Pion et al., 1998). Participa também na destoxificação da mitocôndria, facilitando a remoção de ácidos gordos acumulados (Sanderson, 2006). Pensa-se que não é um nutriente essencial e que a síntese hepática é adequada em cães normais (Pion et al., 1998).
A deficiência de L-carnitina em cães pode ser classificada como plasmática, sistémica ou miopática (Sanderson, 2006). Como causas de deficiência primária de L-carnitina foram sugeridas alterações genéticas resultantes em defeitos na síntese ou absorção intestinal, degradação excessiva, alteração do metabolismo renal e defeito no transporte de membrana que a impeça de chegar ao miocárdio em quantidades suficientes (Keene, 1991; Paulson, 1998). Pensa-se que em estados de deficiência de L-carnitina ocorram alterações no coração que possam comprometer a contratilidade, no entanto nem todos os doentes com deficiência de L-carnitina têm alterações cardíacas (Paulson, 1998). Foi também sugerido que a deficiência de L-carnitina podia ser consequente a CMD por destruição celular, mas foi observada antes do início da doença, o que indica que a deficiência de L-carnitina pode causar CMD em cães (Sanderson, 2006). Em 1991 estimava-se que entre 17-60% dos cães com CMD tinham também deficiência de L-carnitina (Keene, 1991). A associação entre deficiência miocárdica de L-carnitina e CMD canina está documentada em Boxers (Keene, 1991; Costa e Labuc, 1994). Em cães da raça Cocker Spaniel Americano, apesar de não se ter verificado esta associação, a suplementação pode ser benéfica no tratamento da CMD (Kittleson et al., 1997).
2.3.3. Alterações metabólicas
A hormona da tiroide está relacionada com a função cardiovascular e o hipotiroidismo é uma causa reversível de insuficiência cardíaca (IC). Por isso, doentes com disfunção da tiroide sem tratamento têm maior risco de IC (Biondi, 2012). A relação entre hipotiroidismo e CMD tem sido controversa. Por um lado existem estudos, tanto em medicina humana (Khochtali et al., 2011; Seol et al., 2014) como veterinária (Lombard, 1984; Flood e Hoover, 2009), que sugerem uma associação entre níveis baixos de hormonas da tiroide e CMD, descrevendo uma normalização da função cardíaca após o tratamento de substituição hormonal com levotiroxina. Por outro lado, esta associação nem sempre é evidente. Um estudo recente demonstrou que cães da raça Doberman Pinscher com CMD têm 2,26 vezes
6 mais risco de ter hipotiroidismo, sugerindo uma ligação entre as duas doenças. No entanto, mostrou também que o hipotiroidismo não teve qualquer influência na etiologia e progressão da CMD, excluíndo essa hipótese (Beier et al., 2015). Também noutro estudo mais antigo não foi possível identificar nenhuma relação entre as duas doenças nesta raça (Calvert et al., 1998). Ainda assim é aconselhada a avaliação da função da tiroide em doentes com IC e CMD não isquémica para descartar o hipotiroidismo como causa (Biondi, 2012).
Para além do hipotiroidismo, outras alterações metabólicas têm sido associadas com CMD, como Diabetes mellitus e feocromocitoma (Tidholm et al., 2001a).
2.3.4. Doenças inflamatórias e infeciosas
A miocardite, quer seja idiopática, infeciosa ou autoimune, pode levar ao desenvolvimento de CMD (Caforio et al., 2008). A CMD inflamatória carateriza-se por um estado de hipocinesia miocárdica, com dilatação do VE e diminuição da fração de ejeção, acompanhado por inflamação, sem a presença de vírus ou bactérias (Tidholm et al., 2001a; Maisch et al., 2005; Elliott et al., 2008). Os cães, como os humanos, podem desenvolver CMD inflamatória (Fonfara et al., 2013a).
Alguns agentes infeciosos, sobretudo vírus, são uma causa conhecida de CMD humana (Caforio et al., 2008). O efeito viral direto pode provocar inflamação e levar à lise dos miócitos. Por outro lado, pode haver persistência viral no miocárdio mesmo sem inflamação, que pode dar origem a processos autoimunes (Maisch et al., 2005; Elliott et al., 2008). Em cães, está documentada insuficiência miocárdica associada a miocardite por Parvovírus (Vollmar et al., 2003). Outros agentes infeciosos incluem Adenovírus tipo 1 e 2 ou Herpesvírus, mas são causas pouco frequentes de CMD canina. Poderão ainda existir outros vírus responsáveis como Coronavírus, vírus da esgana canina ou outros agentes patogénicos menos comuns (Maxson et al., 2001). Para além de vírus, foi também foi proposta CMD secundária a miocardite por bactérias e protozoários como Trypanosoma (Tidholm et al., 2001a).
2.3.5. Alterações imunológicas
A CMD pode ser mediada por processos autoimunes, que envolvem a produção de autoanticorpos contra proteínas cardíacas e uma regulação anormal dos linfócitos (Limas, 1996; Buse et al., 2008). Pode haver reatividade cruzada contra o miocárdio e, mesmo sem existir uma infeção ativa, os anticorpos produzidos contra estruturas de bactérias ou antigénios virais podem induzir reações citotóxicas e provocar lesões (Tidholm et al., 2001a;
7 Maisch et al., 2005). Em medicina humana, foram encontrados autoanticorpos circulantes específicos para o coração em cerca de 26% dos doentes com CMD (Caforio et al., 1992). Pensa-se que as isoformas α e β da cadeia pesada de miosina cardíaca sejam os principais antigénios, mas foram identificados outros potencialmente relacionados com a CMD, como actina cardíaca α, aconitase mitocondrial, gliceraldeído-3-fosfato desidrogenase (GAPDH) e fosforilase de glicogénio cerebral (GPBB) (Caforio et al., 1992; Buse et al., 2008). Em medicina veterinária sabe-se que há envolvimento de processos imunes na CMD, bem como noutras doenças cardíacas (Tidholm et al., 2001a).
2.3.6. Fármacos e toxinas
O tratamento crónico com Doxorrubicina, um fármaco antineoplásico, pode induzir insuficiência miocárdica e ICC de forma semelhante à observada em cães com CMD (Silva e Camacho, 2005). Pensa-se que a cardiotoxicidade deste fármaco possa estar relacionada com a inibição da biossíntese da coenzima Q10 e da ATPase sódio-potássio ou com a libertação de histamina, cálcio e outros metabolitos, que podem lesionar os miócitos. Histologicamente pode ser observada uma vacuolização caraterística das células miocárdicas. Estas alterações produzidas no miocárdio são potencialmente irreversíveis (Toyoda et al., 1998). A cardiotoxicidade está relacionada com a dose cumulativa total. Para doses cumulativas de 90 e 150 mg/m2 não foram observadas alterações cardíacas (DeFrancesco et al., 2002), mas está descrita insuficiência miocárdica para uma dose cumulativa total de 240 mg/m2 (Silva e Camacho, 2005). Mesmo quando são respeitadas as doses terapêuticas recomendadas há risco, por isso deve ser feito o acompanhamento com recurso à ecocardiografia durante a utilização deste fármaco, de modo a prevenir a cardiotoxicidade (Silva e Camacho, 2005).
Outros agentes responsáveis por cardiomiopatias incluem outros fármacos antineoplásicos, etanol, cobalto, catecolaminas, histamina, metilxantinas e vitamina D (Tidholm et al., 2001a). Foi também proposto que ionóforos como Monensina e Lasalocida, agentes cardiotóxicos utilizados como químicos agrícolas, possam ter um papel na etiologia de CMD em cães Pastor da Nova Zelândia, explicando assim a elevada prevalência observada nesta raça (Munday et al., 2006).
2.3.7. Taquicardia
As taquicardias prolongadas ou recorrentes, sobretudo as ventriculares, podem levar à disfunção do VE num curto período de tempo, mesmo quando a frequência cardíaca (FC) não é muito elevada (Zupan et al., 1996). Assim, arritmias crónicas podem causar disfunção
8 miocárdica, mimetizando a CMD (Foster et al., 2006). Em cães normais, a tensão do coração aumenta da base para o ápex. Na cardiomiopatia induzida por taquicardia há uma reversão do padrão de distribuição de tensão no VE. Isto traduz-se numa diminuição da tensão sistólica do VE (sobretudo no ápex) e da sua deformação de torção, bem como perda da retração diastólica inicial (Kusunose et al., 2013a). Estas alterações podem estar associadas com a disfunção do VE uma vez que há um comprometimento da função miocárdica transmural e do enchimento diastólico (Kusunose et al., 2013b). Quando há normalização do ritmo cardíaco pode haver uma recuperação completa da cardiomiopatia induzida pela taquicardia (Zupan et
al., 1996; Foster et al., 2006). Por vezes o diagnóstico não é fácil e é possível que cães com
taquicardias prolongadas sejam classificados erradamente como casos de CMD idiopática primária (Foster et al., 2006). Em cães de raças gigantes, nos quais é comum a disfunção miocárdica ser precedida por fibrilhação atrial (FA) com FC alta, há a possibilidade da CMD ser o resultado de um processo primário ou consequência da arritmia (Lobo e Pereira, 2002).
2.3.8. Outras causas
Está descrita CMD secundária a isquémia miocárdica. Em medicina humana é uma causa comum, representando cerca de metade dos casos (Tidholm et al., 2001a; McNally et
al., 2013). Algumas doenças miocárdicas infiltrativas, como neoplasias ou doenças de
armazenamento, podem afetar a função miocárdica (Tidholm et al., 2001a). No entanto, um estudo com 12 cachorros Cão d’Água Português não encontrou evidências da doença de armazenamento miocárdico como causa de CMD (Dambach et al., 1999). Foi também sugerida a existência de anomalias bioquímicas ou estruturais que possam comprometer a função contrátil, sem destruição celular (Lobo e Pereira, 2002).
2.4. Fisiopatologia
Na CMD a diminuição da contratilidade miocárdica dá origem a disfunção sistólica. Secundariamente há dilatação do VE, cujo aumento progressivo pode levar a insuficiência da válvula atrioventricular (AV), acelerando ainda mais a dilatação cardíaca (Nelson, 2003a). Com o agravamento da doença pode surgir também disfunção diastólica (Lobo e Pereira, 2002; Maisch et al., 2005). Assim, há uma redução do débito cardíaco que leva a IC, ou seja, um estado em que o coração não consegue bombear sangue suficiente para satisfazer as necessidades metabólicas dos tecidos, ou só consegue fazê-lo com pressões de enchimento elevadas (Strickland, 2008; Oyama, 2010).
9 Numa tentativa de melhorar o débito cardíaco e conservar a pressão arterial, são ativados mecanismos compensatórios que promovem o aumento da FC, da resistência vascular periférica e a retenção de fluidos (Nicholls et al., 1996; Nelson, 2003b). Estes envolvem o sistema nervoso simpático (SNS), sistema renina-angiotensina-aldosterona (SRAA), péptidos natriuréticos, entre outros (Swedberg et al., 1990; Nicholls et al., 1996). A ativação dos sistemas neurohormonais é benéfica numa fase inicial, no entanto os seus efeitos a longo prazo são prejudiciais, uma vez que aumentam a carga de trabalho do coração em insuficiência (Nicholls et al., 1996). A vasoconstrição e as elevadas pressões de enchimento aumentam o stresse na parede ventricular, que já se encontra distendida pela dilatação da câmara. Isto associado à FC aumentada e possíveis arritmias compromete a perfusão coronária do miocárdio, podendo originar hipóxia. Deste modo, há uma progressão da disfunção miocárdica e redução do débito cardíaco, tornando-se um ciclo vicioso (McEwan, 2000b; Borgarelli et al., 2001; O’Sullivan et al., 2007b). Quando os mecanismos compensatórios falham, gera-se uma congestão venosa generalizada que é responsável pelos sinais clínicos (Ramirez, 2001). O débito cardíaco pode diminuir de tal forma que, mesmo com vasoconstrição, a pressão arterial baixe tanto que leve a um estado de choque cardiogénico (Lobo e Pereira, 2002).
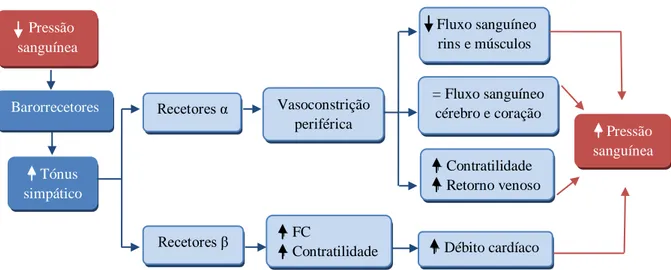
2.4.1. Sistema nervoso simpático
A diminuição do débito cardíaco é detetada pelos barorrecetores do arco aórtico e seio carotídeo, que provocam um aumento reflexo do tónus simpático e retirada do tónus vagal, resultando num aumento da FC (McEwan, 2000b). A estimulação dos recetores α1 adrenérgicos do músculo liso causa vasoconstrição, que aumenta o retorno venoso ao coração (pré-carga) numa tentativa de melhorar a contratilidade cardíaca pelo mecanismo de Frank
Starling. Por outro lado, resulta também num aumento da pós-carga (McEwan, 2000b). Ainda
numa fase inicial da CMD existe uma regulação negativa dos recetores adrenérgicos β, verificando-se uma redução do seu número, sobretudo dos do tipo β1 (Borgarelli et al., 1999; Elliott e Marr, 2001). Se houver reserva miocárdica suficiente, a estimulação destes recetores cardíacos pode aumentar a contratilidade (McEwan, 2000b) (Figura 2).
10 A nível das adrenais, há libertação de catecolaminas (epinefrina e norepinefrina) que contribuem para a vasoconstrição, aumento da FC e da contratilidade miocárdica. No entanto, podem causar arritmias ventriculares potencialmente fatais (Nicholls et al., 1996; Borgarelli
et al., 2001).
2.4.2. Sistema renina-angiotensina-aldosterona
O SRAA é ativado numa fase inicial da IC compensada e contribui para a sua progressão. A magnitude da ativação está relacionada com a gravidade da doença. Deste modo, quanto maior for a atividade do SRAA, mais próxima está a descompensação da IC (Hirsch et al., 1991; Koch et al., 1995).
No rim, a baixa perfusão e a estimulação dos recetores adrenérgicos β do aparelho justaglomerular resultam na libertação de renina. Esta transforma o angiotensinogénio circulante (produzido pelo fígado) em angiotensina I, que é depois convertida em angiotensina II pela enzima de conversão da angiotensina (ECA) (McEwan, 2000b). A angiotensina II tem ações específicas em vários órgãos incluíndo coração, rins, adrenais, cérebro e vasos sanguíneos, sendo um vasoconstritor potente (Hirsch et al., 1991; McEwan, 2000b). Nas glândulas adrenais promove a libertação de aldosterona, que contribui para o aumento da pré-carga através da retenção de água e sódio (Figura 3). No sistema nervoso central (SNC) aumenta a sede e induz a libertação de vasopressina (ADH) pela hipófise, contribuindo para a retenção de fluidos e vasoconstrição (McEwan, 2000b).
Pressão sanguínea Barorrecetores + Tónus simpático + Contratilidade + Retorno venoso Vasoconstrição periférica Recetores α Recetores β + FC
+ Contratilidade + Débito cardíaco
+ Pressão sanguínea Fluxo sanguíneo rins e músculos = Fluxo sanguíneo cérebro e coração
Figura 2 – Efeitos compensatórios do SNC em resposta à diminuição da pressão sanguínea na IC. FC – Frequência cardíaca (Adaptado de Strickland, 2008).
11 Os níveis aumentados de angiotensina II e aldosterona podem induzir hipertrofia, necrose e fibrose das células miocárdicas, contribuindo para a remodelação ventricular compensatória, que é responsável pela dilatação cardíaca e progressão da IC (Hirsch et al., 1991; Ohtani et al., 1997; Borgarelli et al., 2001).
2.4.3. Péptidos natriuréticos
Os péptidos natriuréticos têm um papel importante no controlo da função renal e cardiovascular. Intervêm na manutenção da pressão sanguínea através da regulação do balanço de fluidos, opondo-se à ação do SRAA e limitando a sua atividade na IC inicial (Nicholls et al., 1996; Thibault et al., 1999; Borgarelli et al., 2001). Existe o péptido natriurético atrial (ANP), o cerebral ou tipo B (BNP) e o tipo C (CNP).
O CNP localiza-se primariamente no endotélio vascular. Tem ação vasodilatadora através do relaxamento do músculo liso e inibe a remodelação vascular (Nicholls et al., 1996; Sisson, 2010). Tal como os outros péptidos, diminui a pré-carga e inibe o SRAA, mas não é natriurético (Borgarelli et al., 2001). As suas concentrações plasmáticas são baixas e não parecem aumentar na IC (Nicholls et al., 1996).
Em condições normais, o ANP e BNP são sintetizados maioritariamente pelos miócitos atriais e armazenados em grânulos como moléculas percursoras, proANP e proBNP (Thibault et al., 1999; Sisson, 2010). Existem vários fatores que acionam a sua libertação na corrente sanguínea, mas o principal é o estiramento atrial, através de canais de cálcio mecânico sensíveis (Thibault et al., 1999; Sisson, 2010). Assim, a homeostasia intracelular do cálcio é considerada o elemento chave na regulação da secreção dos péptidos natriuréticos (Thibault et al., 1999). Estes dois péptidos têm ações semelhantes que passam pela indução da natriurese, através da inibição do transporte tubular de sódio no ducto coletor medular interno
Perfusão renal ECA + Pressão sanguínea Aldosterona Angiotensinogénio Renina Reabsorção de água e sódio AngiotensinaI Vasoconstrição periférica AngiotensinaII
Figura 3 – Ativação e efeitos do SRAA na IC. ECA – Enzima de conversão da angiotensina (Adaptado de Strickland, 2008).
12 do rim, diminuição da resistência vascular, através de vasodilatação, e neutralização da resposta neurohormonal à IC pela inibição da libertação de renina, aldosterona e vasopressina (Swedberg et al., 1990; Nicholls et al., 1996; Tidholm et al., 2001b; Borgarelli et al., 2001; Sisson, 2010) (Figura 4).
Nas doenças cardíacas existem alterações fenotípicas nos miócitos, que voltam a expressar genes fetais incluindo ANP e BNP, aumentando assim as concentrações circulantes (Nicholls et al., 1996;Thibault et al., 1999). Em doentes com IC, os níveis de BNP aumentam bastante, ultrapassando os de ANP, e correlacionam-se com a fração de ejeção do VE (Nicholls et al., 1996).
2.4.4. Endotelina
A endotelina é um dos vasoconstritores mais potentes conhecidos (Nicholls et al., 1996). É sintetizada pelas células endoteliais e libertada para a circulação na forma inativa de proendotelina, que é depois degradada em endotelina 1 (ET-1), endotelina 2 (ET-2) e endotelina 3 (ET-3), os péptidos ativos. Os seus efeitos passam por vasoconstrição e aumento da contratilidade miocárdica. Interagem com o SRAA inibindo a produção de renina e estimulando a libertação de aldosterona (Sisson, 2010).
Em condições normais, os níveis de ET-1 circulantes são muito baixos e têm origem nas células endoteliais. Durante a IC há uma elevação das concentrações plasmáticas, que se pensa ser devido à produção miocárdica (Sisson, 2010). Um estudo confirmou a ativação da ET-1 na CMD e ICC canina (O’Sullivan et al., 2007b). No entanto, o aumento não é tão marcado como o dos péptidos natriuréticos (Nicholls et al., 1996). Concentrações persistentemente elevadas de ET-1 provocam proliferação e hipertrofia do músculo liso vascular e miocárdico, contribuindo assim para a remodelação cardíaca (Sisson, 2010).
ANP BNP Estiramento atrial Stresse na parede Vasodilatação
+
–
NatriureseAngiotensina II, Aldosterona Figura 4 – Representação esquemática dos efeitos dos péptidos natriuréticos. ANP – péptido natriurético atrial, BNP – péptido natriurético cerebral (Adaptado de Prošek e Ettinger, 2010).
13 2.4.5. Óxido nítrico
O óxido nítrico (NO) é um vasodilatador derivado do endotélio. Níveis aumentados inibem a síntese de ET-1, funcionando como um mecanismo de retroação negativa (Sisson, 2010). É também um importante antagonista funcional da angiotensina II (Ware, 2011a). Na IC há um comprometimento da libertação endotelial, que resulta numa redução da capacidade vasodilatadora, efeitos inotrópico e cronotrópico negativos e lesões nos miócitos (Ware, 2011a). A CMD está associada a disfunção endotelial e deficiência em NO, que origina uma diminuição do fluxo sanguíneo sistémico e coronário. No entanto, um estudo demonstrou que a perfusão coronária pode estar comprometida independentemente do NO e da função endotelial, implicando assim defeitos na sinalização distal ou anomalias da estrutura vascular coronária (Nikolaidis et al., 2005).
2.4.6. Adrenomedulina
A adrenomedulina é um péptido natriurético e potente vasodilatador, com efeitos inotrópicos positivos. Os seus níveis plasmáticos encontram-se aumentados na IC e em situações de inflamação e sabe-se que a angiotensina II estimula a sua produção e libertação (Sisson, 2010; Ware, 2011a). Este péptido atenua a hipertrofia miocárdica e a produção de colagénio e é utilizado como marcador de hipertrofia ventricular (Sisson, 2010).
2.4.7. Citocinas
As citocinas são péptidos endógenos envolvidos na modulação da estrutura e função cardíaca. Aumentos crónicos de angiotensina II e aldosterona estimulam a sua produção (Ware, 2011a). Têm um papel importante em situações inflamatórias e na remodelação dos tecidos (Sisson, 2010). Em cães com doença cardíaca verificou-se um aumento da expressão de citocinas, resultante da ativação do sistema inflamatório (Fonfara et al., 2013b).
O fator de necrose tumoral α (TNF-α), uma citocina proinflamatória produzida em resposta ao stresse, deprime a função miocárdica e contribui para a hipertrofia e apoptose, quando cronicamente aumentado (Sisson, 2010; Ware, 2011a). A osteopontina, também denominada early T lymphocyte activaton (Eta-1), é uma proteína reguladora envolvida na remodelação das células miocárdicas que leva a hipertrofia. A sua expressão aumenta em resposta à sobrecarga de pressão e ativação do SRAA e sabe-se que está ligeiramente elevada em cães com CMD (Sisson, 2010).
14 2.4.8. Remodelação cardíaca
A ativação crónica dos mecanismos anteriormente descritos leva a alterações anatómicas e morfológicas do miocárdio. Este processo é designado por remodelação cardíaca e contribui para o agravamento da disfunção já existente (Strickland, 2008; Sisson, 2010). A remodelação patológica tem vários processos e vias de sinalização em comum com a fisiológica, no entanto o resultado é irreversível, com diminuição da função sistólica e diastólica e eventualmente descompensação cardíaca (Sisson, 2010).
O aumento do stresse da parede ventricular (por sobrecarga de pressão ou volume), neurohormonas como a angiotensina II, a norepinefrina, a aldosterona e a ET-1 e as citocinas proinflamatórias como interleucinas e TNF-α são alguns dos estímulos para a remodelação cardíaca (Ware, 2011a). Um estudo recente propôs que a serotonina pode ter um papel na função e estrutura cardíaca normais e pode contribuir para a remodelação miocárdica e comprometimento funcional em cães com CMD (Fonfara et al., 2014).
A hipertrofia miocárdica é a base da resposta de remodelação, tendo como objetivo a normalização do débito cardíaco, da tensão da parede ventricular e pressões de enchimento (Strickland, 2008). A remodelação ventricular pode ainda envolver perda celular, formação excessiva de matriz intersticial e destruição de pontes de colagénio entre miócitos. Esta última é secundária à ação de colagenases miocárdicas ou metaloproteinases de matriz (MMPs) e favorece a dilatação ventricular e distorção, por deslize de miócitos adjacentes (Ware, 2011a).
Na CMD ocorre uma hipertrofia excêntrica, que se carateriza por dilatação da câmara como resposta à sobrecarga de volume, numa tentativa de aumentar o débito cardíaco e compensar a disfunção sistólica (Strickland, 2008). A espessura da parede ventricular aumenta ligeiramente, para se manter proporcional ao raio da câmara, tentando diminuir a tensão (Sisson, 2010). O aumento de tamanho do VE é acompanhado por uma maior deposição de colagénio na matriz extracelular, originando fibrose miocárdica (O’Grady et al., 2009). A elevada tensão da parede ventricular pode prejudicar a perfusão coronária, sobretudo se existir taquicardia (Dukes-McEwan, 2010). Há também uma predisposição para isquémia, uma vez que a densidade relativa dos capilares e mitocôndrias diminui (Ware, 2011a). A hipertrofia dos miócitos e fibrose aumentam a massa cardíaca total e a rigidez ventricular, dando origem a disfunção diastólica por comprometimento do relaxamento cardíaco (Ware, 2011a). Por outro lado, o aumento da deposição de colagénio prejudica a condução elétrica entre os miócitos, favorecendo o desenvolvimento de arritmias (Gilbert et al., 2000).
15 Com a progressão da dilatação do VE pode surgir um sopro de regurgitação AV secundário à distensão do anel mitral (Dukes-McEwan, 2010). No entanto, um estudo sugeriu que a regurgitação mitral está relacionada com alterações da forma do VE e da geometria dos músculos papilares, não requerendo dilatação do anel mitral nem redução da fração de ejeção do VE (McGinley et al., 2005).
2.4.9. Metabolismo energético
Durante a IC, o coração tem preferência para glicose como substrato metabólico, em vez de ácidos gordos (Nikolaidis et al., 2004b). Uma das primeiras respostas das células é o aumento do número de mitocôndrias, numa tentativa de estar à altura das necessidades energéticas. No entanto há uma queda da produção de ATP (Sisson, 2010). Num estudo realizado em cães foi observado que a CMD grave foi acompanhada pelo desenvolvimento de resistência à insulina e pelo comprometimento da sinalização de insulina miocárdica. Estas alterações estiveram associadas à redução dos níveis miocárdicos de insulina, podendo assim explicar a depleção de ATP observada em estados avançados da CMD (Nikolaidis et al., 2004b). Uma vez que a resistência à insulina aumenta com a idade, foi sugerido que possa explicar a predisposição para CMD em doentes mais velhos (Parikh et al., 2006).
2.5. Diagnóstico
O diagnóstico de CMD é feito tendo em conta a identificação do animal e a informação obtida durante a realização da anamnese, exame físico e exames complementares de diagnóstico, nomeadamente a eletrocardiografia, a radiografia torácica e a ecocardiografia, bem como a análise laboratorial geral e o doseamento de biomarcadores cardíacos.
Outras doenças cardíacas congénitas ou adquiridas levam muitas vezes a quadros clínicos e ecocardiográficos semelhantes à CMD, devendo ser excluídas (McEwan, 2000a).
2.5.1. Apresentação clínica
A progressão da CMD pode ser classificada em 3 fases, correspondendo a primeira a um coração normal, sem qualquer tipo de alterações, e ausência de sinais clínicos. Na segunda, apesar de ainda não se observarem sinais clínicos, já existe algum grau de alteração morfológica ou elétrica, como aumento do tamanho do VE ou arritmias (O’Grady e O’Sullivan, 2004). Esta fase é também chamada de CMD oculta ou pré-clínica, devido ao seu caráter assintomático, e pode ser definida como uma condição na qual há dilatação e hipocinesia do VE detetadas ecocardiograficamente, na ausência de alterações clínicas e radiográficas de ICC (Tidholm et al., 2001a). Na terceira e última fase, as alterações cardíacas
16 são acompanhadas por sinais clínicos de ICC, sendo por isso também conhecida como fase evidente ou clínica da CMD (O’Grady e O’Sullivan, 2004). Alguns autores consideram apenas a existência de 2 fases, dividindo-as em CMD pré-clínica e clínica (Lobo e Pereira, 2002; McEwan et al., 2003).
Na maioria dos casos a progressão da doença é lenta e a fase pré-clínica longa, podendo durar vários anos (McEwan, 2000a; McEwan et al., 2003). Idealmente a CMD deve ser detetada nesta fase, de modo a iniciar um tratamento que possa diminuir a sua progressão (Elliott e Marr, 2001). Geralmente o diagnóstico é feito mais cedo em cães de trabalho porque, como dependem de um débito cardíaco normal para manter a atividade diária, têm tendência a tornar-se mais letárgicos ao longo do tempo. Em cães sedentários, a doença é normalmente detetada em fases mais avançadas, muitas vezes já com sinais clínicos associados (Munday et al., 2006).
As elevadas pressões de enchimento existentes na CMD favorecem o desenvolvimento de sinais clínicos associados com ICC (McEwan, 2000a). Estes podem surgir de forma aguda e levar a um quadro clínico muito exuberante (Lobo e Pereira, 2002). A apresentação clínica de CMD inclui frequentemente sinais de ICC esquerda ou biventricular (Tidholm et al., 2001a). Na ICC esquerda há sobretudo sinais respiratórios causados por edema pulmonar ou derrame pleural, enquanto na ICC direita o abdómen pode estar distendido por hepatomegalia e ascite (Tidholm et al., 2001a; Bonagura, 2010). Para além dos já mencionados, entre os principais sinais clínicos encontram-se: intolerância ao exercício, taquipneia ou dispneia, tosse, letargia, anorexia, polidipsia e síncope (Tidholm, 1996; Borgarelli et al., 1999; Lobo e Pereira, 2002; Tidholm e Jönsson, 2005; Besche et al., 2007; Martin et al., 2009; Fuentes, 2012). Na ICC crónica grave pode existir caquexia cardíaca, uma síndrome multifatorial que envolve inapetência, má absorção, má digestão e alterações metabólicas. Há uma perda de massa muscular evidente, fraqueza e maior esforço respiratório (Moneva-Jordan, 2003). Na fase clínica é frequente o desenvolvimento de ICC ou morte súbita, muitas vezes por arritmias (Dambach et al., 1999; Kraus et al., 2009; Martin et al., 2009; Bonagura, 2010).
As manifestações clínicas variam conforme as raças (McEwan, 2000a). De um modo geral, as raças grandes tendem a ter uma progressão lenta e o principal sinal clínico de ICC é taquipneia (McEwan, 2000a; Fuentes, 2012).
No Doberman Pinscher as arritmias são muito comuns na CMD pré-clínica e encontradas muito mais frequentemente do que nas outras raças. No entanto, alguns cães têm apenas alterações ecocardiográficas, sem arritmias (Mausberg et al., 2011). São frequentes
17 episódios de síncope associados ao exercício, que podem resultar não só de taquiarritmias como também de bradicardia (Calvert et al., 1996). A morte súbita é muito frequente nesta raça, estimando-se que ocorra em 25-30% dos cães, devido a arritmias como taquicardia e fibrilhação ventricular (Calvert et al., 2000b). Num estudo com 56 Doberman Pinscher esta percentagem foi ainda maior, sendo observada em 50% dos cães antes do desenvolvimento de ICC (Calvert et al., 2000a). Assim, parecem existir dois grupos de Doberman Pinschers, os que têm morte súbita e os que desenvolvem ICC (Meurs, 1998). Na fase clínica, a ICC esquerda é mais frequente (Calvert et al., 1997). Está ainda descrita uma forma juvenil de CMD nesta raça, com alta morbilidade e variabilidade individual. A maioria dos cachorros afetados desenvolveu ICC entre os 10 dias e as 17 semanas de idade (Vollmar et al., 2003).
O Cão d’Água Português apresenta uma forma juvenil de CMD canina, que afeta cachorros com uma média de 13 semanas de idade. Pode ocorrer morte súbita ou desenvolvimento de sinais clínicos inespecíficos, como depressão e redução do apetite, com rápida progressão para ICC fulminante e morte em 1-5 dias. Num estudo, todos os cães afetados morreram entre as 2 e as 32 semanas (Dambach et al., 1999).
A CMD no Boxer é caraterizada pela presença de arritmias, sendo frequentes episódios de síncope, geralmente durante o exercício, e eventualmente sinais de ICC. Por vezes as arritmias são descobertas acidentalmente, mas é comum a sua progressão para taquiarritmias graves, potencialmente fatais. Em cães não diagnosticados, e mesmo nos que estão a ser tratados, a morte súbita devido às arritmias é uma complicação frequente (Harpster, 1991). As síncopes são frequentes, tendo sido observadas em 70% dos cães desta raça com CMD (Martin et al., 2009). Muitas vezes resultam de taquicardias ventriculares. Nesse caso, um exame Holter de 24h realizado nos primeiros 1-2 dias após a síncope contém muitos complexos prematuros ventriculares (VPCs) e geralmente taquicardia ventricular paroxística. No entanto é importante diferenciar de bradicardia neurogénica, que pode existir em cães com CMD e ser responsável pelos episódios de síncope (Thomason et al., 2008).
No Weimaraner está descrita uma forma de CMD grave e de progressão rápida, sendo comuns arritmias ventriculares que podem levar a episódios de síncope ou morte súbita antes do desenvolvimento de sinais clínicos (McEwan, 2000a).
Em Wolfhound Irlandês a CMD tem um início relativamente tardio, afetando sobretudo cães mais velhos (Vollmar et al., 2013). Entre as apresentações mais comuns encontram-se perda de peso, taquicardia, dispneia, ascite e intolerância ao exercício (Brownlie e Cobb, 1999; Martin et al., 2009).
18 No Dogue Alemão é muito comum a presença de FA associada a sinais de ICC esquerda ou biventricular, como intolerância ao exercício, fraqueza e redução do apetite (Meurs et al., 2001; Martin et al., 2009). Alguns cães podem desenvolver esta arritmia antes de serem detetadas alterações cardíacas, como dilatação ventricular (Meurs, 2010a).
Como principais sinais clíncos de outras raças estão ainda descritos intolerância ao exercício e fraqueza em São Bernardo e Pastor Alemão e redução do apetite em Golden Retriever (Martin et al., 2009).
2.5.2. Exame físico
As alterações detetadas durante o exame físico variam com o grau de IC. A taquipneia, a dispneia, a ascite e a perda de peso são sinais observados frequentemente (Tidholm e Jönsson, 2005).
Os cães com um baixo débito cardíaco podem apresentar sinais de hipotensão, como mucosas pálidas, aumento do tempo de repleção capilar, hipotermia e pulso fraco (Fuentes, 2012). Por outro lado, podem existir situações de hipertensão sistémica (Bonagura, 2010).
À auscultação cardíaca pode ser detetado um sopro sistólico apical esquerdo, geralmente de baixa intensidade (menor ou igual a III/VI) por regurgitação da válvula mitral. Pode também estar presente um som de galope protodiastólico (S3 – anterior à diástole) de baixa frequência, que reflete um comprometimento diastólico grave do ventrículo (Tidholm et
al., 2001a; Chetboul et al., 2007; Fuentes, 2012). A FC tem tendência para aumentar com a
progressão da doença (Martin et al., 2009). O ritmo cardíaco pode ser irregular devido à presença de FA, VPCs, complexos prematuros supraventriculares e taquicardia, tanto ventricular como supraventricular. A presença de arritmias pode originar um pulso fraco, rápido, irregular e não sincronizado com os batimentos cardíacos (Lobo e Pereira, 2002). O
pulsus alternans, caraterizado por uma alternância regular da amplitude de pulso, é
frequentemente detetado no exame físico e indica disfunção miocárdica grave. Pensa-se que possa ser mais prevalente em Cocker Spaniel Inglês do que nas outras raças de cães afetadas pela CMD (Moneva-Jordan et al., 2007).
Em casos de ICC esquerda, durante a auscultação pulmonar podem ser ouvidos sons broncovesiculares e estertores, pela presença de edema. Localizam-se sobretudo na região perihilar, podendo ser audíveis por todo o campo pulmonar em fases mais avançadas. Se existir derrame pleural a auscultação torna-se difícil (Lobo e Pereira, 2002). Na ICC direita é comum a distensão da veia jugular e pulso jugular, hepatomegalia e ascite, podendo existir edema periférico nos casos mais graves (Lobo e Pereira, 2002; Bonagura, 2010).
19 2.5.3. Exames complementares
2.5.3.1. Eletrocardiografia
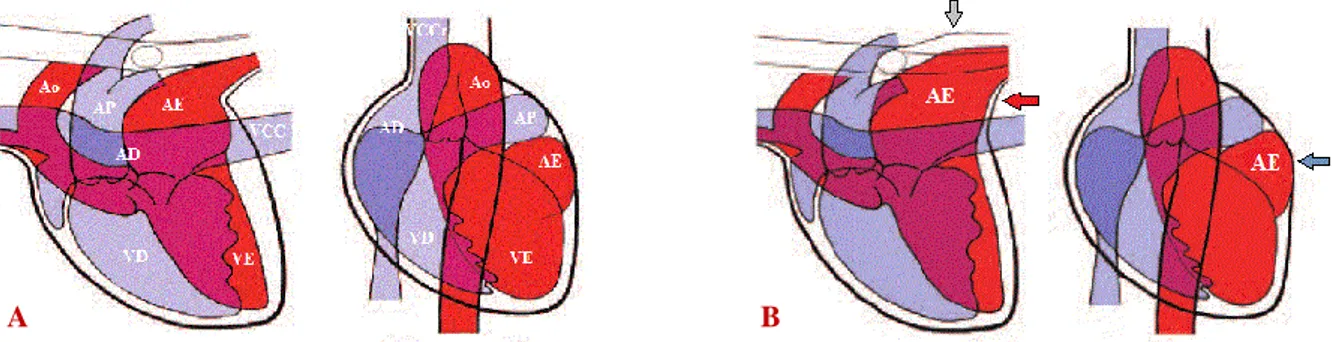
A maioria dos cães com CMD apresenta anomalias no eletrocardiograma (ECG), que podem indicar padrões de aumento cardíaco ou arritmias (Bonagura, 2010). Um aumento de amplitude ou duração da onda P ou do complexo QRS pode refletir dilatação das câmaras (Figura 5) e uma onda R de baixa amplitude pode ser devida à presença de derrame pleural. Geralmente o eixo elétrico encontra-se normal (Lobo e Pereira, 2002; McEwan et al., 2003).
A eletrocardiografia é um exame essencial para a identificação e avaliação de arritmias (McEwan et al., 2003). A monitorização ambulatória com um aparelho Holter, feita normalmente durante 24h, é um método não invasivo que ajuda a perceber a verdadeira incidência das arritmias e a sua complexidade. Juntamente com o ECG, é muito útil para relacionar o ritmo cardíaco com os sinais clínicos (McEwan, 2000a; Lobo e Pereira, 2002). Estes exames têm especial importância na fase pré-clínica porque, sendo métodos precoces de diagnóstico e rastreio, permitem identificar animais aparentemente saudáveis com risco de desenvolver CMD e iniciar um tratamento adequado sempre que estiver indicado. Assim, em cães de raça grande, a deteção de um sopro ou arritmia deve ser sempre investigada com ecocardiografia e ECG, preferencialmente recorrendo a monitorização Holter durante 24h (Calvert et al., 2000b; McEwan, 2000a; Lobo e Pereira, 2002; Fuentes, 2012).
A CMD está muito associada a arritmias. Num estudo realizado com 369 cães, apenas 11% não apresentavam alterações do ritmo cardíaco (Martin et al., 2009). A arritmia mais frequentemente detetada é FA (Lombard, 1984; Tidholm, 1996; Tidholm et al., 2001a; Tidholm, 2006) (Figura 6). Esta arritmia é encontrada principalmente em cães de grande porte e raças gigantes como Wolfhound Irlandês, Dogue Alemão, Terra Nova, Pastor Alemão, São Bernardo e Dogue Canário, podendo indicar CMD pré-clínica em cães aparentemente saudáveis (Brownlie e Cobb, 1999; Morales et al., 2001; Martin et al., 2009; Meurs, 2010a; Vollmar e Aupperle, 2015). Também é muito comum a existência de VPCs e taquicardia Figura 5 - ECG de Doberman Pinscher fêmea de 9 anos com CMD. Aumento da duração da onda P, consistente com aumento do AE, e aumento da duração dos complexos QRS, refletindo um atraso na condução intraventricular. Derivação II, 50 mm/s, 1 cm = 1 mV (Adaptado de Ware, 2011b).