UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
YUGO LIMA MELO
PEROXIDASE DE GLUTATIONA MITOCONDRIAL DE ARROZ É CRUCIAL PARA O CRESCIMENTO POR FAVORECER A FOTOSSÍNTESE
YUGO LIMA MELO
PEROXIDASE DE GLUTATIONA MITOCONDRIAL DE ARROZ É CRUCIAL PARA O CRESCIMENTO POR FAVORECER A FOTOSSÍNTESE
Dissertação apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Bioquímica.
Orientador:
Prof. Dr. Joaquim Albenísio Gomes da Silveira
YUGO LIMA MELO
PEROXIDASE DE GLUTATIONA MITOCONDRIAL DE ARROZ É CRUCIAL PARA O CRESCIMENTO POR FAVORECER A FOTOSSÍNTESE
Dissertação apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Bioquímica.
Orientador:
Prof. Dr. Joaquim Albenísio Gomes da Silveira
Aprovada em: 05 / 02 / 2014.
BANCA EXAMINADORA
________________________________________ Prof. Dr. Joaquim Albenísio Gomes da Silveira (Orientador)
Universidade Federal do Ceará (UFC)
_________________________________________ Dr. Marcio de Oliveira Martins
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Josemir Moura Maia
AGRADECIMENTOS
Ao Prof. Dr. Joaquim Albenísio Gomes da Silveira, por ter acreditado no meu potencial, aceitando me orientar durante estes dois anos de mestrado, oferecendo todo o suporte técnico, conselhos e todo tipo de contribuição para esta importante etapa da minha formação profissional.
À Profa. Dra. Cristiane Elizabeth Costa de Macêdo, por ter sido minha primeira orientadora e responsável pelos meus primeiros aprendizados em experimentação científica, sendo sempre paciente, incentivadora e, acima de tudo, amiga. Devo grande parte do que sou hoje aos ensinamentos desta pesquisadora na primeira (e provavelmente a mais importante) etapa da minha formação.
Ao Prof. Dr. Josemir Moura Maia, não só pelas contribuições e por ter aceitado a participação na banca examinadora, mas também pela extrema importância na minha formação de iniciação científica e pelo acolhimento no meu difícil momento de adaptação no início do mestrado, além de ter sido coorientador essencial para a minha formação durante a iniciação científica.
Ao Dr. Marcio de Oliveira Martins, pela aceitação do convite para participar da banca examinadora e pelas valiosas contribuições neste trabalho, tanto na obtenção de dados quanto nas discussões.
Aos integrantes e ex-integrantes do LABPLANT, Adilton, Amnon, Ana Karla, Cinthya, Cris, Emiliano, Evandro, Fabrício, Girlaine, Glaydson, Jamyla, João Victor, Jones, Jordânia, Juliana, Lara, Marcio, Milton, Petterson, Rachel, Rafael, Sérgio e Tathi, pelos auxílios oferecidos sempre que solicitados.
Ao Prof. Luiz Eduardo Voigt, meu coorientador de iniciação científica e um dos responsáveis pela minha escolha na carreira de bioquímico.
Ao Prof. Dr. José Tadeu Abreu de Oliveira e aos integrantes do LPVD, por toda a assistência concedida.
Aos demais professores do departamento, por terem feito parte da minha formação, direta ou indiretamente.
Aos funcionários do Departamento de Bioquímica e Biologia Molecular e da coordenação da Pós-Graduação em Bioquímica da UFC.
Ao coordenador da Pós-Graduação, Prof. Dr. Márcio Viana Ramos.
Aos integrantes e ex-integrantes do LABIOTEC (UFRN), aos quais tenho enorme carinho e consideração, por terem participado da minha formação inicial de pesquisador.
À CAPES, pela concessão da bolsa de estudos.
A todos os meus amigos de Maceió e de Natal, principalmente, do Facex e da UFRN.
Acima de tudo, aos meus familiares e, em especial, aos meus pais e meus irmãos, responsáveis pelas coisas mais importantes que aprendi na vida e pelos quais eu tenho amor incondicional.
RESUMO
O papel fisiológico das peroxidases de glutationa (GPX) da mitocôndria em plantas é muito pouco conhecido. Suas relações com a fotossíntese são desconhecidas, ainda mais na presença de estresse salino. Essa enzima possui grande importância na remoção de H2O2 e hidroperóxidos orgânicos, contribuindo na proteção oxidativa e na homeostase redox. Neste estudo, mutantes de arroz silenciados nos genes OsGPX1 ou OsGPX3, das proteínas mitocondriais, foram utilizados para entender os mecanismos fisiológicos do papel dessa enzima no crescimento e fotossíntese. Adicionalmente, estes processos foram estudados também em condições de estresse salino para as plantas silenciadas em OsGPX1. Os resultados mostram, pela primeira vez, que a deficiência de uma GPX mitocondrial é capaz de restringir o crescimento vegetal por deficiência na fotossíntese. Este efeito deve ser causado indiretamente por mudanças nas redes genéticas e metabólicas desencadeadas por alterações nos níveis de H2O2 (aumentado) e/ou glutationa reduzida (diminuída). É provável que o estado redox alterado em mitocôndrias pelo efeito da GPX possa aumentar a fotossíntese através da comunicação entre esta organela e cloroplastos por mecanismos ainda não estabelecidos. Além disso, o gene OsGPX1 mostrou ter papel significativo no controle do movimento estomático, que é crucial para a eficiência do uso da água sob condição de estresse salino. As GPX mitocondriais também parecem estar envolvidas com a dissipação do excesso de energia luminosa na forma de calor (NPQ) no aparato do fotossistema II e na rota da fotorrespiração. Em conclusão, o gene OsGPX1, associado com seu produto proteico e mudanças desencadeadas nas redes metabólicas e gênicas, são essenciais para o crescimento de arroz pelo aumento da fotossíntese, especialmente a nível de eficiência de uso da luz envolvendo atividade do fotossistema II e eficiência quântica do CO2 em condições normais de crescimento. Adicionalmente, a GPX1 aparenta mostrar uma importância menor para a resistência ao estresse salino.
ABSTRACT
The physiological role of glutathione peroxidases (GPX) in plant mitochondria is little known. Their relations with the photosynthesis are unknown, even more in presence of salt stress. This enzyme have great importance in H2O2 and organic hydroperoxides scavenging, contributing in oxidative protection and redox homeostasis. In this study, silenced rice mutants in OsGPX1 and OsGPX3 genes, coding for the mitochondrial proteins, were used to better understand the physiological mechanisms of the role of this protein in growth and photosynthesis. Additionally, these processes were also studied in salt stress conditions with the plants silenced in OsGPX1. The results show, for the first time, that the lacking of a mitochondrial GPX is capable of restricting plant growth by impairment in photosynthesis. This response might be an indirect consequence of changes in gene and metabolic networks trigged by alterations in H2O2 (raised) and/or reduced glutathione (diminished). It is likely that the altered redox state in mitochondria by GPX effects can improve photosynthesis through cross-talk between this organelle and chloroplasts by yet unknown mechanisms. Furthermore, the OsGPX1 gene showed significant role in stomatal control, which is crucial to the water use efficiency under salt stress conditions. The mitochondrial GPX also seems to be involved with dissipation of excess light energy as heat (NPQ) in photosystem II apparatus and in photorespiratory pathway. In conclusion, the OsGPX1 gene, associated with it protein product and changes in gene and metabolic networks, are essential to rice growth by improvement of photosynthesis, especially at light use efficiency level involving photosystem II activity and CO2 quantum efficiency in normal and growth conditions. Additionally, GPX1 seems to be less important to salt stress tolerance.
LISTA DE ILUSTRAÇÕES
CAPÍTULO 1
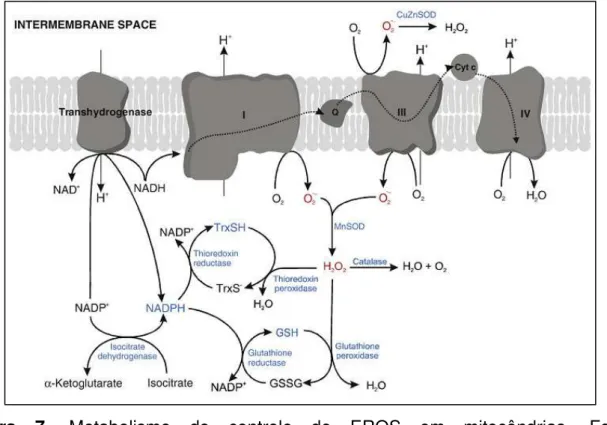
Figura 1. Rede de reações das principais enzimas antioxidantes vegetais ... 19 Figura 2. Exemplo de reação da GPX ... 20 Figura 3. Representação por esquema em Z das reações dependentes de luz da fotossíntese ... 23 Figura 4. Ciclo de Calvin-Benson ... 24 Figura 5. Ciclo de reparo do PSII ... 26 Figura 6. Esquema da localização da reação de Mehler na cadeia transportadora de elétrons da fotossíntese ... 31 Figura 7. Metabolismo do controle de ROS em mitocôndrias ... 33
CAPÍTULO 2
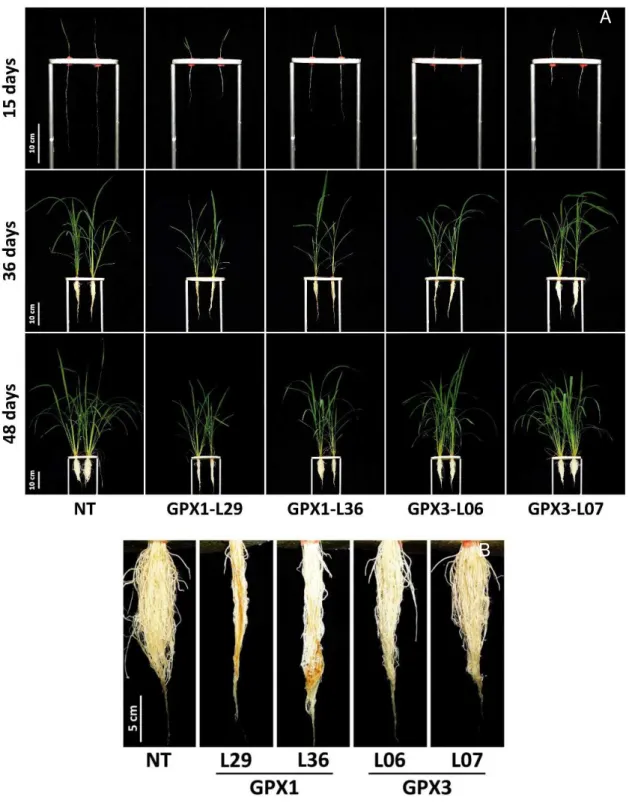
Figura 1. Nível de transcritos dos genes OsGPX1 e OsGPX3 nas linhagens silenciadas para os respectivos genes em folhas ... 56 Figura 2. Caracterização do crescimento de plantas de arroz não transformadas e linhagens silenciadas para OsGPX1 ou OsGPX3 e condição das raízes das mesmas plantas ... 57 Figura 3. Comprimento da parte aérea e massa fresca total de plantas de arroz não transformadas e linhagens silenciadas para OsGPX1 ou OsGPX3 ... 58 Figura 4. Detecção histoquímica de H2O2, concentração de H2O2 e nível de peroxidação lipídica em folhas de arroz não transformadas e linhagens silenciadas para OsGPX1 ou OsGPX3 ... 61 Figura 5. Concentração de glutationa reduzida em folhas de arroz não transformadas e linhagens silenciadas para OsGPX1 (L29 e L36) ou OsGPX3 (L06 e L07) ... 62
CAPÍTULO 3
LISTA DE TABELAS
CAPÍTULO 2
Tabela 1. Parâmetros de trocas gasosas de plantas de arroz não transformadas e linhagens silenciadas para OsGPX1 ou OsGPX3 ... 59 Tabela 2. Parâmetros de fluorescência da clorofila a de plantas de arroz não transformadas e linhagens silenciadas para OsGPX1 ou OsGPX3 ... 60
CAPÍTULO 3
LISTA DE ABREVIATURAS
A Taxa de assimilação de CO2 Amax Taxa fotossintética máxima
Ci Pressão parcial de CO2 intercelular E Transpiração foliar
ETR Taxa de transporte de elétrons atual
Fv/Fm Rendimento quântico máximo do fotossistema II GPX Peroxidase da glutationa
gs Condutância estomática GSH Glutationa reduzida
Jmax Taxa de transporte de elétrons máxima NPQ Quenching não fotoquímico
PPFD Densidade de fluxo de fótons fotossintético Pr Fotorrespiração
PSI Fotossistema I PSII Fotossistema II
qP Quenching fotoquímico Rd Respiração no escuro
ROS/EROS Espécies reativas de oxigênio
TBARS Substâncias reativas ao ácido tiobarbitúrico Vcmax Taxa de carboxilação máxima da Rubisco WUE Eficiência do uso da água
α Eficiência quântica
SUMÁRIO
CAPÍTULO 1 – Referencial teórico ... 14
1. JUSTIFICATIVA ... 15
2. REFERENCIAL TEÓRICO ... 17
2.1. Espécies reativas de oxigênio e peroxidase da glutationa ... 17
2.1.1. As peroxidases da glutationa ... 19
2.2. A fotossíntese ... 22
2.2.1. Fotoinibição, fotoproteção e reparo de fotodano ... 24
2.2.2. O estresse foto-oxidativo ... 26
2.3. Efeitos do estresse salino em plantas ... 27
2.3.1. O efeito osmótico do estresse salino ... 28
2.3.2. O efeito tóxico do estresse salino ... 29
2.3.3. Danos à fotossíntese e formação de espécies reativas de oxigênio pela salinidade ... 30
2.3.4. Mecanismos de tolerância ao estresse salino ... 31
2.4. Metabolismo mitocondrial e a relação com o cloroplasto ... 32
3. HIPÓTESE E OBJETIVOS ... 36
3.1. Hipótese ... 36
3.2. Objetivo geral ... 36
3.3. Objetivos específicos ... 36
CAPÍTULO 2 – Crescimento, fotossíntese e metabolismo oxidativo de arroz silenciado para os genes OsGPX1 ou OsGPX3 codificantes para GPX mitocondriais ... 48
1. INTRODUÇÃO ... 50
2. MATERIAL E MÉTODOS ... 52
2.1. Transformação das plantas ... 52
2.2. Crescimento das plantas ... 52
2.3. PCR quantitativo em tempo real (qRT-PCR) ... 53
2.4. Detecção histoquímica de H2O2 ... 53
2.5. Quantificação de peróxido de hidrogênio ... 53
2.7. Determinação da eficiência fotossintética e fluorescência da clorofila a .. 54
2.8. Análise estatística e desenho experimental ... 55
3. RESULTADOS ... 56
3.1. Nível de transcritos e diferenças de crescimento entre os genótipos ... 56
3.2. Efeitos do silenciamento dos genes OsGPX1 e OsGPX3 na fotossíntese ... 58
3.3. Mudanças no metabolismo oxidativo de arroz silenciado para GPX1 e GPX3 ... 60
4. DISCUSSÃO ... 63
CAPÍTULO 3 – Mitochondrial GPX1 is crucial for growth via photosynthesis improvement but is less importante for salt tolerance in rice plants …………... 67
1. INTRODUCTION ……….. 71
2. MATERIALS AND METHODS ………... 75
2.1. Construction of plant vectors, plant transformation and plant growth conditions ……….. 75
2.2. Plant growth ………... 75
2.3. Salt treatment and plant harvesting ……… 76
2.4. Quantitative real-time PCR (qRT-PCR) ………. 76
2.5. Protein extraction and glutathione peroxidase activity ………. 76
2.6. Reduced glutathione, lipid peroxidation and hydrogen peroxide ………... 77
2.7. Electrolyte leakageand Na+ content ……….. 77
2.8. Determination of photosynthetic efficiency, chlorophyll a fluorescence and photosynthetic pigments ……….. 78
2.9. Statistical analysis and experimental design ………. 79
3. RESULTS ……….. 80
3.1. Physiological characterization of mitochondrial GPX1 silenced plants showed that this gene is essential for photosynthesis and growth ……… 80
3.2. Antioxidant characterization in mGPX1 knockdown lines revealed that silencing induced an increase in H2O2 and a decrease in reduced glutathione levels ……….. 82
3.4. Photosynthetic parameters from A-PPFD and A-Ci curves revealed that mGPX1 was essential for photosynthetic efficiency in normal growth conditions but that it was less important for salt tolerance ………. 87 3.5. Gas exchange and PSII activity parameters indicated that mGPX1 was essential for photosynthesis and water use efficiency ………. 90 4. DISCUSSION ... 93
C
APÍTULO1
1. JUSTIFICATIVA
As peroxidases formam uma classe de enzimas em tecidos animais, vegetais e de microrganismos que catalisa a oxirredução entre o peróxido de hidrogênio (H2O2) ou hidroperóxidos orgânicos (R-OOH) e vários agentes redutores (HIRAGA et al., 2001; HOFRICHTER et al., 2010; FAWAL et al., 2013). Devido a sua vasta funcionalidade em processos fisiológicos, a atividade de peroxidase pode ser facilmente detectada em toda a vida de várias plantas: dos estágios iniciais da germinação à etapa final da senescência, passando pelo controle de elongação celular, mecanismos de defesa e vários outros papéis (PASSARDI et al., 2005).
Sob condições normais de crescimento, a produção de H2O2 (e de outras espécies reativas de oxigênio) em diferentes compartimentos celulares é baixa (POLLE, 2001; MILLER et al., 2010). Entretanto, muitos estresses podem desfazer a homeostase celular pelo aumento na produção dessas espécies reativas. Dentre eles, destacam-se o estresse por seca e dissecação, estresse salino, frio, choque térmico, metais pesados, radiação ultravioleta, poluentes presentes no ar (tais como ozônio e SO2), estresses mecânicos, deficiência nutricional, ataque de patógenos e alta luminosidade (MITTLER, 2002; MILLER et al., 2010; YAMANE et al., 2012). A produção aumentada das espécies reativas de oxigênio durante condições estressantes pode representar um problema para as células, apesar de também serem importantes na sinalização para a ativação de respostas aos estresses e rotas metabólicas de defesa (KNIGHT e KNIGHT, 2001;TRIANTAPHYLIDES e HAVAUX, 2009; SUZUKI et al., 2012). Como consequência, as peroxidases estão envolvidas em todos esses processos.
Especificamente, a seca e a salinidade são dois fatores ambientais importantes que afetam negativamente o crescimento e o desenvolvimento de plantas. Desta forma, ambos têm grande impacto na produtividade agrícola (FLOWERS, 2004; GOLLDACK et al., 2011). Esta problemática é importante, tendo em vista que um dos maiores desafios para a biotecnologia na agricultura é satisfazer a crescente demanda da produção alimentícia necessária para acompanhar o crescimento populacional mundial (GODFRAY et al., 2010; TESTER e LANGRIDGE, 2010).
2. REFERENCIAL TEÓRICO
2.1. Espécies reativas de oxigênio e peroxidase da glutationa
EROS são definidas como moléculas de oxigênio ou grupamentos hidroxil com um elétron extra (MUNNS, 2005). Estas EROS são geradas constantemente durante processos metabólicos normais nas mitocôndrias, nos peroxissomos, nos cloroplastos e no citoplasma. Entretanto, quando produzidos em excesso, prejudicam a homeostase metabólica através de danos oxidativos a lipídeos (destruindo as membranas lipídicas), proteínas e ácidos nucléicos por serem altamente reativos a estes tipos de molécula (McCORD, 2000; APEL e HIRT, 2004; MUNNS, 2005;
SHARMA et al., 2012).
Maiores quantidades de EROS são formadas nas células quando diferentes rotas metabólicas entram em descompasso, como quando submetidas a estresses. Nestas condições, elétrons que possuem um alto estado de energia são transferidos para oxigênio molecular (O2), formando diferentes tipos de EROS, principalmente o oxigênio singleto (1O2), radicais superóxido (O2●-), peróxido de hidrogênio (H2O2) e
radical hidroxil (HO●-) (TAKAHASHI e ASADA, 1988; MITTLER, 2002; HALLIWELL,
2006). Esta transferência ocorre, por exemplo, quando um excesso de poder redutor na forma de elétrons nas cadeias transportadoras das mitocôndrias e cloroplastos é gerado e não é dissipado de maneira eficaz (FOYER e NOCTOR, 2003). Entretanto, apesar do potencial para causar oxidações danosas, atualmente sabe-se que EROS, principalmente o H2O2, são também potentes moléculas sinalizadoras (GILL e TUTEJA, 2010; FINKEL, 2011;MURPHY et al., 2011; SHARMA et al., 2012). EROS estão envolvidas no controle do crescimento e desenvolvimento vegetal, nas respostas de aclimatação como priming a estímulos de estresses e em uma série de outros eventos (JONES, 2006; FOYER e NOCTOR, 2005a, 2005b, 2009).
sido encontrados em quase todos os compartimentos celulares, demonstrando a importância da desintoxicação para a sobrevivência celular (MITTLER et al., 2004).
Dentre as moléculas não enzimáticas, destacam-se o ascorbato, a glutationa, o α-tocoferol, flavonóides, antocianinas e carotenóides, sendo geralmente os três primeiros os mais estudados. Estas moléculas são antioxidantes de baixa massa molecular que funcionam como tampões redox, interagindo com as EROS e atuando como uma interface metabólica que modula a indução de respostas de aclimatação apropriada, ou morte celular programada (HALLIWELL e FOYER, 1976; TAKAHASHI e ASADA, 1988; FOYER e NOCTOR, 2005b). As redes metabólicas bioquímicas relacionadas aos mecanismos antioxidantes são complexas (MUNNS e TESTER, 2008). Em Arabidopsis thaliana L., por exemplo, mais de 150 genes estão envolvidos neste sistema e o conhecimento das possíveis funções, da coordenação, do grau de redundância e da interação destes e entre estes genes ainda está incompleto (MITTLER et al., 2004).
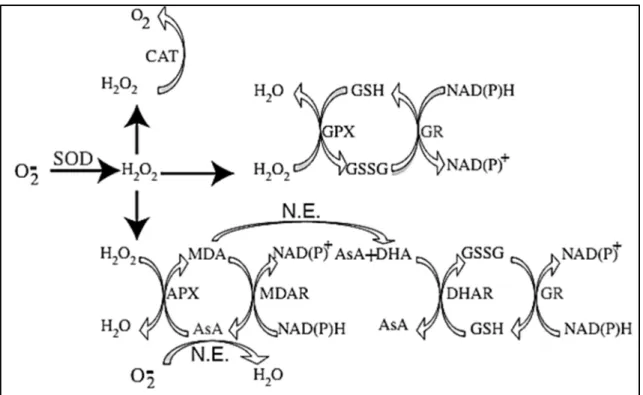
Dentre as principais enzimas antioxidantes estão a dismutase do superóxido (SOD), a catalase (CAT), a redutase da glutationa (GR) e as peroxidases do ascorbato (APX) e da glutationa (GPX). As atividades coordenadas das múltiplas isoformas destas enzimas em diferentes compartimentos subcelulares realizam um balanço entre a taxa de formação e de remoção das EROS, mantendo controlado também os níveis de H2O2 necessários para a sinalização celular (figura 1) (TÜRKAN e DEMIRAL, 2009;O'BRIEN et al., 2012).
Figura 1. Rede de reações das principais enzimas antioxidantes vegetais (GSH = Glutationa reduzida; GSSG = Glutationa oxidada; MDA = Monodehidroascorbato; AsA = Ascorbato; MDAR = Redutase do monodehidroascorbato; DHA = Dehidroascorbato; DHAR = Redutase do dehidroascorbato; N.E. = Reação não enzimática). Fonte: BASHIR et al., 2007.
2.1.1. As peroxidases da glutationa
A peroxidase da glutationa (GPX, EC 1.11.1.9) foi descoberta primeiramente em animais como sendo uma enzima de eritrócitos com função de proteger hemoglobinas de estresses oxidativos (MILLS, 1957). Posteriormente, sua função específica foi definida como catalisadora da remoção de hidroperóxidos, tais como H2O2 e hidroperóxidos lipídicos (FLOHE, 1982). A primeira publicação que divulga a existência de GPX em vegetais ocorreu em 1985, em um trabalho com espinafre, milho, Lemna e sicômoro (DROTAR et al., 1985).
casos, os níveis de expressão de genes relacionados e a atividade da GPX são aumentados em resposta a estresses (NAVROT et al., 2006).
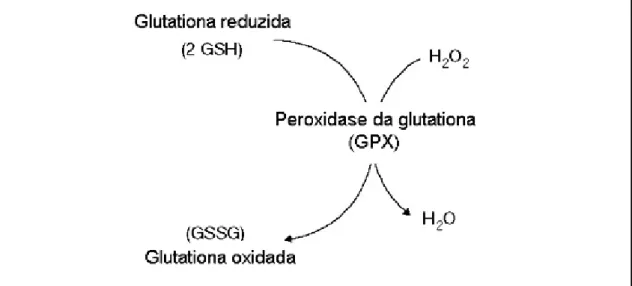
Atualmente, a GPX é definida como o nome geral para uma família de múltiplas isoenzimas que catalisam a redução de H2O2 ou hidroperóxidos orgânicos a água ou álcoois correspondentes utilizando glutationa reduzida (GSH) como doadora de elétrons (figura 2) (MARGIS et al., 2008). Todavia, a preferência na utilização dos agentes oxidantes e redutores por essa enzima tem sido controversa em condições in vivo (HERBETTE et al., 2002; NAVROT et al., 2006). Estudos têm mostrado que as GPX de algumas plantas e levedura (Saccharomyces cerevisiae) são capazes de reduzir peróxidos mais eficientemente ou, às vezes até exclusivamente, utilizando tiorredoxinas em vez de GSH como redutor (HERBETTE et al., 2002; JUNG et al., 2002; TANAKA et al., 2005). Por este motivo, muito autores classificam as GPX vegetais como peroxirredoxinas. (HERBETTE et al., 2002; NAVROT et al., 2006). Entretanto, vários estudos têm mostrado que a GPX pode utilizar tanto GSH e/ou tiorredoxinas como agentes redutores (FOYER e NOCTOR, 2011).
Figura 2. Exemplo de reação da GPX, utilizando H2O2 e GSH como substratos.
Recentemente as duas isoformas citosólicas foram encontradas também em cloroplastos (PASSAIA et al., 2013).
Em geral, existem poucos estudos para as funções fisiológicas específicas das isoformas vegetais de GPX. A maior parte desses estudos são voltados para as isoformas cloroplásticas. Plantas de Arabidopsis com expressão aumentada de GPX de cloroplastos mostraram ser mais resistentes a estresses abióticos e bióticos (ROXAS e LODHI, 2000; YOSHIMURA et al., 2004), enquanto plantas com expressão diminuída nestes genes mostraram-se mais sensíveis a alguns estresses (CHANG et al., 2009; GABER et al., 2012; PASSAIA et al., 2013). A GPX cloroplástica também parece estar envolvida com o controle de abertura e fechamento dos estômatos através de interações com níveis de H2O2 e ABA (MIAO et al., 2006). Além disso, a ausência desta enzima provocou alterações morfológicas, anatômicas e funcionais em folhas de Arabidopsis (CHANG et al., 2009), evidenciando assim a importância desta enzima em plantas.
A literatura sobre o papel fisiológico das GPX mitocondriais é escassa e apenas três estudos publicados envolvendo isoformas desta organela foram encontrados. Em um deles, Milla e colaboradores (2003) caracterizaram a expressão de vários genes GPX em Arabidopsis em resposta a diferentes condições, tais como exposição a estresses abióticos e soluções hormonais. Interessantemente, a isoforma mitocondrial foi a que mostrou maiores níveis de expressão para a maioria das condições em que as plantas foram submetidas. Por este motivo, os autores também analisaram o nível de expressão dessa GPX em diferentes tecidos da planta. Os outros dois trabalhos dizem respeito às isoformas mitocondriais de arroz, GPX1 e GPX3 (PASSAIA et al., 2013; PASSAIA et al., 2014). Estes trabalhos mostraram que a GPX1 é importante para o crescimento e para a formação de espículas enquanto a GPX3 modula o desenvolvimento vegetal e a homeostase do H2O2 em raízes.
2.2. A fotossíntese
A fotossíntese é o processo presente em plantas e outros organismos usado para converter energia luminosa em energia química, armazenada em moléculas de carboidratos sintetizadas a partir do CO2 e água. Como consequência, O2 também é produzido, sendo assim um processo importante também para os organismos aeróbicos. A fotossíntese em plantas engloba duas etapas de reações: a dependente de luz e a de assimilação/fixação de carbono. Nas reações dependentes de luz, a clorofila e outros pigmentos fotossintéticos das células absorvem a energia luminosa e conserva como ATP e NADPH, ao passo que moléculas de O2 são formadas. Nas reações de assimilação de carbono, o ATP e o NADPH gerados são usados para reduzir o CO2 para formar trioses fosfatadas, amido, sacarose e seus produtos derivados numa sequência de reações (TAKAHASHI e MURATA, 2008; TAIZ e ZEIGER, 2010; NELSON e COX, 2013).
A etapa fotoquímica (figura 3) consiste de um processo de fotofosforilação ocorrido nos cloroplastos e envolve o fluxo de elétrons através de uma série de carreadores protéticos membranares. Primeiramente nesta etapa, a absorção de fótons por um complexo proteico chamado antena excita moléculas de clorofila e outros pigmentos acessórios. Estes pigmentos transferem a energia obtida dos fótons para centros de reação presentes nos denominados fotossistemas, que, ao serem excitados energeticamente, provocam uma separação de cargas elétricas, produzindo um forte doador e um forte aceptor de elétrons (TAIZ e ZEIGER, 2010; NELSON e COX, 2013; VINYARD et al., 2013).
Figura 3. Representação por esquema em Z das reações dependentes de luz da fotossíntese. Fonte: NELSON e COX, 2013.
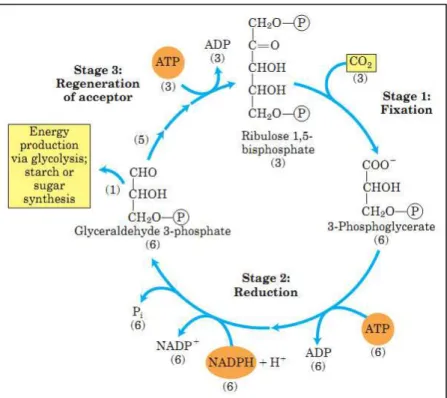
Figura 4. Ciclo de Calvin-Benson e as suas três etapas: fixação do CO2 pela Rubisco (1), redução do 3-fosfo-glicerato (2) e regeneração do aceptor (3). Fonte: NELSON e COX, 2013.
2.2.1. Fotoinibição, fotoproteção e reparo de fotodano
Para evitar a fotoinibição, várias respostas fotoprotetivas podem ser ativadas sob excesso de energia luminosa através da regulação de absorção da luz, dissipação do excesso dos estados excitados ou remoção de EROS eventualmente produzidos (CAZZANIGA et al., 2013). Dentre estes mecanismos de fotoproteção, os mais bem estudados são: (1) anulação da exposição à luz pelo movimento de folhas e cloroplastos; (2) bloqueio da luz por moléculas específicas (como compostos fenólicos, por exemplo) na epiderme foliar; (3) reforço de sistemas de remoção de EROS enzimáticos e não enzimáticos; (4) dissipação da energia luminosa absorvida como energia térmica (relacionada com o qE e o NPQ); (5) aumento do fluxo cíclico de elétrons no PSI; (6) aumento das taxas de fotorrespiração (WU et al., 1991; DEMMING-ADAMS e ADAMS, 1992; ASADA, 1999; TAKAHASHI e BADGER, 2011; NIYOGI e TRUONG, 2013).
Figura 5. Ciclo de reparo do PSII pela proteólise e síntese de novas proteínas após o fotodano. Fonte: KATO e SAKAMOTO, 2009
2.2.2. O estresse foto-oxidativo
poder oxidativo para lipídeos, ácidos nucleicos e proteínas (TRIANTAPHYLIDES e HAVAUX, 2009; ALBORESI et al., 2011; CAZZANIGA et al., 2013).
Adicionalmente, os próprios centros de reação do PSII podem ser fontes de EROS. As principais proteínas do PSII (D1 e D2) ligam-se a carreadores de elétrons que medeiam a transferência de elétrons do P680 para quinonas (PQA e PQB) estáveis através da feofitina (Pheo) (ANDERSSON e BARBER, 1996; MELIS, 1999). Uma vez reduzida, as quinonas se difundem na membrana até o citocromo b6f, que intermedeia a passagem de elétrons para o PSI (figura 3). Condições de estresse ambiental que limitam a utilização de equivalentes redutores podem levar a uma superredução do pool dessas quinonas (HUNER et al., 1998; MELIS, 1999). Se ainda mais elétrons forem transferidos (como consequência de um aumento de luminosidade, por exemplo) enquanto o pool de quinona está totalmente reduzido, a feofitina pode sofrer recombinação de cargas com o P680, resultando na formação de P680 tripleto. O P680 em estado tripleto é capaz tanto de provocar dano oxidativo direto ao PSII quanto de reagir com o O2 em estado fundamental, formando O2 singleto. Sob estas condições de estresse (LOGAN, 2005).
Assim, é mostrado que não apenas o excesso de luz causa a produção de EROS nos fotossistemas, mas também condições estressantes que alteram estes complexos de forma indireta. Além disso, é provável que a geração de EROS sob condições estressantes seja um dos principais responsáveis pela inibição do ciclo de reparo das proteínas do PSII (TAKAHASHI e BADGER, 2011).
2.3. Efeitos do estresse salino em plantas
A salinidade compromete o estabelecimento, crescimento, desenvolvimento e produtividade das plantas (MATHUR et al., 2007; MUNNS e TESTER, 2008; TAIZ e ZEIGER, 2010). Este comprometimento é ocasionado, principalmente, por dois componentes do estresse salino: o osmótico, que causa dificuldade de absorção de água pela planta, levando à desidratação da mesma; e o tóxico, causado pela absorção de íons salinos específicos, tendo como efeito secundário interferência no metabolismo vegetal e desbalanceamento nutritivo (LÄUCHLI e GRATTAN, 2007; MUNNS e TESTER, 2008; TAIZ e ZEIGER, 2010; DIAS e BLANCO, 2010).
2.3.1. O efeito osmótico do estresse salino
Os efeitos negativos da salinidade nas plantas são causados primeiramente pelo efeito osmótico do sal ao redor das raízes (MUNNS e TESTER, 2008). A água dissolve sais pela hidratação e estabilização de íons, tais como os íons Na+ e Cl- no caso do sal NaCl (NELSON e COX, 2013). Sendo assim, quanto maior a concentração de sais na solução, menor será a disponibilidade de moléculas de H2O livres. Esta menor disponibilidade de água na solução do solo causa dificuldades de absorção de água pela planta, resultando num estresse osmótico (ou estresse hídrico), que pode ser provocado tanto pela salinidade como pela baixa umidade dos solos (MARSCHNER, 2012).
Com a diminuição do conteúdo ou da disponibilidade de água do solo, há, proporcionalmente, uma diminuição da pressão hidrostática, podendo fazer com que os valores desta pressão sejam negativos e que as plantas percam a força de sucção suficiente para absorver a água do solo. Em decorrência do decréscimo do conteúdo de água da planta, as células se contraem, havendo uma diminuição da pressão de turgescência contra as paredes celulares e, consequentemente, uma diminuição na taxa de crescimento dos tecidos vegetais (TAIZ e ZEIGER, 2010).
2.3.2. O efeito tóxico do estresse salino
Mais tardiamente que o efeito osmótico, um efeito tóxico é também responsável por prejuízos a plantas submetidas à salinidade, causando o chamado estresse iônico. Munns e Tester (2008) definem esta como uma segunda fase da resposta da planta à salinidade que se inicia com o acúmulo de sais em concentrações tóxicas nas folhas velhas do vegetal. Diversos estudos sugerem que a membrana plasmática deve ser o primeiro local de injúria pelo sal (MANSOUR, 1998; KUKREJA et al., 2005).
A principal causa da toxicidade do estresse salino por NaCl está associada aos danos específicos do íon sódio (Na+) acumulado nos tecidos foliares, o que pode resultar em necrose das folhas mais velhas. Os danos causados por este acúmulo variam dependentemente do tempo de exposição ao sal, da taxa de acúmulo de Na+ nas folhas e da efetividade da compartimentalização do Na+ nos tecidos e nas células pela espécie vegetal (PARVAIZ e SATYAWATI, 2008). Além disso, altas concentrações de Na+ dificultam a absorção de outros nutrientes essenciais (como potássio, ferro e zinco, por exemplo) de duas maneiras: (1) pela interferência destes íons com transportadores na membrana plasmática da raiz, como canais de potássio (K+); e (2) pela redução do crescimento radicular (TESTER e DAVENPORT, 2003). Apesar do Na+ representar o principal íon causador de toxicidade pela salinidade, algumas espécies vegetais são também sensíveis ao cloreto, o principal ânion encontrado em solos salinos (TÜRKAN e DEMIRAL, 2009).
como resultado da salinidade prejudica várias rotas metabólicas e o balanço iônico citoplasmático (GIRI et al., 2007; EVELIN et al., 2009).
Segundo Tester e Davenport (2003), bem como mostrado em outros trabalhos, folhas são mais vulneráveis ao Na+ que raízes. A explicação para isso é que tanto o Na+ quanto o Cl- acumulam maiores quantidades nos primeiros órgãos comparados ao segundo, já que o Na+ é transportado para a parte aérea através do rápido movimento da água no xilema consequente da transpiração, podendo retornar para as raízes apenas através do floema.
2.3.3. Danos à fotossíntese e formação de espécies reativas de oxigênio pela
salinidade
Segundo Munns e Tester (2008), a resposta mais dramática da salinidade em plantas é a diminuição na abertura estomática. As respostas estomáticas são induzidas pelo efeito osmótico do sal fora das raízes, ou seja, a condutância estomática é imediatamente afetada pela salinidade devido, primeiramente, ao desequilíbrio hídrico provocado. Esta resposta estomática é provavelmente regulada por sinais da raiz em situações de estresse hídrico através, principalmente, do hormônio ácido abscísico (ABA), que é acumulado nestas condições (DAVIES et al., 2005; TAIZ e ZEIGER, 2010). Além de afetar a condutância estomática, o efeito osmótico da salinidade prejudica também a taxa fotossintética pela diminuição da expansão foliar (MUNNS e TESTER, 2008; TAIZ e ZEIGER, 2010).
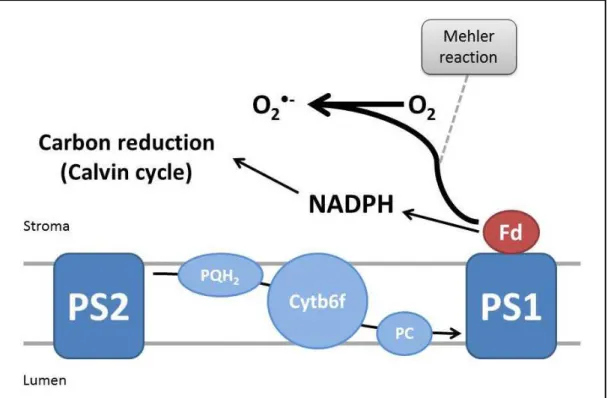
Figura 6. Esquema da localização da reação de Mehler na cadeia transportadora de elétrons da fotossíntese. (PS2 = Fotossistema 2; PQH2 = Plastoquinonas; Cytb6f = Citocromo b6f; PC = Plastocianina; PS1 = Fotossistema 1; Fd = Ferredoxina).
2.3.4. Mecanismos de tolerância ao estresse salino
Para os efeitos danosos gerais causados pela salinidade, muitas plantas possuem alguns mecanismo de tolerância a este estresse. Basicamente elas são capazes de amenizar, ou em alguns casos até neutralizar, os efeitos negativos da salinidade pela ativação de respostas bioquímicas que incluem: (1) síntese e acúmulo de osmólitos; (2) manutenção da homeostase iônica intracelular e; (3) mecanismos de eliminação de espécies reativas de oxigênio, geradas como efeito secundário do estresse (FLOWERS, 2004; ASHRAF e AKRAM, 2009).
“ajustamento osmótico” (ou, ainda segundo estes autores, acúmulo de solutos pelas células) como um processo no qual o potencial hídrico pode ser diminuído sem a diminuição do turgor ou volume celular através de uma “rede” de aumentos no conteúdo de solutos por célula.
Estes solutos, chamados de solutos compatíveis (ou osmólitos compatíveis), são compostos que podem promover o ajustamento osmótico sem prejudicar as funções enzimáticas (TAIZ e ZEIGER, 2010). Em geral, solutos compatíveis podem ser íons essenciais (como o K+), mas a maior parte são solutos orgânicos (HUSSAIN et al., 2010), tais como açúcares (frutose, glicose, glicerol, inositóis metilados, trealose, rafinose, frutanos etc.), aminoácidos e derivados (prolina, glicina-betaína, β -alanina-betaína, prolina-betaína etc.) e outros compostos, como os compostos sulfônicos (BOHNERT e JENSEN, 1996; NUCCIO et al., 1999; HUSSAIN et al., 2010; TAIZ e ZEIGER, 2010).
Conforme já foi abordado, a salinidade provoca, além do dano osmótico, um dano iônico causado pela toxicidade de alguns íons, sendo o principal deles o Na+. Desta forma, a limitação da entrada de Na+ na raiz, bem como a distribuição do Na+ para os órgãos da planta e a manutenção da homeostase iônica intracelular pela compartimentalização do íon nos vacúolos são mecanismos de grande importância para a tolerância do vegetal ao meio salino (RUIZ-LOZANO et al., 2012).
Nos últimos anos, a importância da manutenção de elevadas proporções K+/Na+ no citosol para a tolerância à salinidade está se tornando cada vez mais difundida. As homeostases intracelulares do K+ e do Na+ são essenciais para a atividade de muitas enzimas citosólicas, para a manutenção do potencial de membrana e de níveis osmóticos adequados nas células (SHABALA e CUIN, 2007; MUNNS e TESTER, 2008). Para tanto, as plantas utilizam de grande variedade de proteínas transportadoras, localizadas na membrana plasmática e no tonoplasto. Estas proteínas são essenciais para promover o transporte de solutos e para compartimentalizar íons citotóxicos longe do citoplasma, facilitando ainda a função destes íons como sinalizadores (HUSSAIN et al., 2010).
2.4. Metabolismo mitocondrial e a relação com o cloroplasto
células. Assim, estas organelas estão diretamente ligadas ao metabolismo energético dos eucariotos. Em linhas gerais, isso se dá pelo fato da membrana interna das mitocôndrias possuírem uma cadeia transportadora de elétrons (ETC) mitocondrial, que consiste de complexos proteicos que usam a energia derivada de um redutor para formar um gradiente de prótons através da membrana. Semelhantemente à cadeia transportadora de elétrons dos cloroplastos, esse gradiente de prótons possibilita a síntese de ATP (RHOADS et al., 2006; NELSON e COX, 2013).
O metabolismo energético mitocondrial é reconhecido atualmente como, quantitativamente, a fonte mais importante de EROS na maioria dos tipos celulares eucarióticos não fotossintetizantes. EROS originadas na mitocôndria são conhecidas por serem importantes determinadores de funções celulares, participando de várias redes de sinalização e também em uma variedade de processos degenerativos (RHOADS et al., 2006; KOWALTOWSKI et al., 2009). A formação de EROS mitocondriais ocorre sob condições respiratórias normais mas é aumentada em resposta a uma variedade de condições anormais, incluindo exposição a estresses bióticos e abióticos. Desta forma, as mitocôndrias possuem isoformas enzimáticas e vias específicas para controlar os níveis dessas EROS (figura 7) (RHOADS et al., 2006; KOWALTOWSKI et al., 2009).
Além das funções majoritárias no metabolismo energético oxidativo e na geração de energia pela síntese de ATP em organismos eucariotos, as mitocôndrias participam de vários outros processos importantes em plantas (ARAÚJO et al., 2014). A participação destas organelas já foi atribuída a eventos como fotossíntese, fotorrespiração, metabolismo do nitrogênio, regulação redox e sinalização (SWEETLOVE et al., 2002; HEAZLEWOOD et al., 2004; DUTILLEUL et al., 2005; URBANCZYK-WOCHNIAK et al., 2006; FOYER et al., 2011; BAUWE et al., 2012).
Alguns estudos têm demonstrado que o metabolismo de cloroplastos e mitocôndrias são intimamente conectados. Rzigui e colaboradores (2013) mostraram que mutantes de tabaco deficientes na atividade do complexo I da cadeia respiratória mitocondrial exibem assimilação de CO2 prejudicada sob condições normais de crescimento. A literatura também tem mostrado que as rotas relacionadas à oxidase alternativa mitocondrial (AOX) está associada com a proteção do aparato fotossintético contra danos fotoquímicos pelo aliviamento da redução em excesso no fotossistema I e pela indução de quenching não fotoquímico (NPQ) (DINAKAR et al.,
2010; ZHANG et al., 2012). A atividade da oxidase do citocromo mitocondrial (COX) também parece estar associada com a manutenção da fotossíntese através da modulação de EROS (DINAKAR et al., 2010). Adicionalmente, experimentos com
mutantes de Arabidopsis deficientes em proteínas desacopladoras (UCPs) mostraram que essas proteínas estão associadas com uma menor assimilação de CO2, maior NPQ e crescimento reduzido, sugerindo que o controle do fluxo de elétrons na mitocôndria está associado com a performance fotossintética (SWEETLOVE et al., 2006).
3. HIPÓTESE E OBJETIVOS
3.1. Hipótese
A expressão reduzida de GPX mitocondrial provoca alterações metabólicas e prejuízos na fotossíntese mediados principalmente pela função sinalizadora do H2O2 através de uma comunicação entre mitocôndrias e cloroplastos.
3.2. Objetivo geral
Avaliar a participação das GPX mitocondriais no metabolismo oxidativo, crescimento e fotossíntese de plantas utilizando o arroz como modelo vegetal.
3.3. Objetivos específicos
Caracterizar fenotipicamente plantas de arroz silenciadas para a expressão das GPX mitocondriais GPX1 e GPX3.
Diferenciar o desempenho fotossintético entre as plantas silenciadas para OsGPX1, OsGPX3 e plantas não transformadas.
Avaliar o nível de resposta da atividade da GPX e possíveis alterações nas concentrações dos seus substratos, H2O2 e glutationa reduzida, em plantas com baixa expressão de isoformas mitocondriais.
Avaliar o grau de relação entre a atividade das GPX mitocondriais e o desempenho da fotossíntese em plantas submetidas a estresse salino.
REFERÊNCIAS
ADIKU, S.G.K.; RENGER, M.; WESSOLEK, G.; FACKLAM, M.; HECHT-BUCHOLTZ, C. Simulation of the dry matter production and seed yield of common beans under varying soil water and salinity conditions. Agricultural Water Management, v. 47, p. 55–68, 2001.
ALBORESI, A.; DALL’OSTO, L.; APRILE, A.; CARILLO, P.; RONCAGLIA, E.; CATTIVELLI, L.; BASSI, R. Reactive oxygen species and transcript analysis upon excess light treatment in wild-type Arabidopsis thaliana vs a photosensitive mutant lacking zeaxanthin and lutein. BMC Plant Biology, v. 11, p. 62, 2011.
ALLAKHVERDIEV, S.I.; MURATA, N. Environmental stress inhibits the synthesis de novo of proteins involved in the photodamage-repair cycle of photosystem II in Synechocystis sp PCC 6803. Biochimica et Biophysica Acta, v. 1657, p. 23–32, 2004.
ANDERSSON, B.; BARBER, J. Mechanisms of photodamage and protein degradation during photoinhibition of photosystem II. In: BAKER, N.R. (ed.). Photosynthesis and the Environment. Dordrecht: Kluwer Academic Publishers, p. 101–121, 1996.
APEL, K.; HIRT, H. Reactive oxygen species: metabolism, oxidative stress and signal transduction. Annual Review of Plant Biology, v. 55, p. 373–399, 2004.
ARAÚJO, W.L.; NUNES-NESI, A.; FERNIE, A.R. On the role of plant mitochondrial metabolism and its impact on photosynthesis in both optimal and sub-optimal growth conditions. Photosynthesis Research, v. 119, p. 141–156, 2014.
ASADA, K. Radical production and scavenging in the chloroplasts. In: BAKER, N.R. (ed.). Photosynthesis and the environment. Volume 5. New York: Kluwer Academic Publishers, p. 123–150, 2004.
ASADA, K. The water-water cycle in chloroplasts: scavenging of active oxygen species and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, v. 50, p. 601–639, 1999.
ASHRAF, M.; AKRAM, N.A. Improving salinity tolerance of plants through conventional breeding and genetic engineering: An analytical comparison. Biotechnology Advances, v. 27, p. 744–752, 2009.
BASHIR, K.; NAGASAKA, S.; ITAI, R.N.; KOBAYASHI, T.; TAKAHASHI, M.; NAKANISHI, H.; MORI, S.; NISHIZAWA, N.K. Expression and enzyme activity of glutathione reductase is upregulated by Fe-deficiency in graminaceous plants. Plant Molecular Biology, v. 65, p. 277–284, 2007.
BLAHA, G; STELZL, U.; SPAHN, C.M.T.; AGRAWAL, R.K.; FRANK, J.; NIERHAUS, K.H. Preparation of functional ribosomal complexes and effect of buffer conditions on tRNA positions observed by cryoelectron microscopy. Methods in Enzymology, v. 317, p. 292–309, 2000.
BOHNERT, H.J.; JENSEN, R.G. Strategies for engineering water stress tolerance in plants. Trends in Biotechnology, v. 14, p. 89–97, 1996.
BRAY, E.A. Plant responses to water deficit. Trends in Plant Science, v. 2, p. 48–54, 1997.
CALVIN, M.; BENSON, A.A. The path of carbon in photosynthesis. Science, v. 107, p. 476–480, 1948.
CAZZANIGA, S.; OSTO, L.D.; KONG, S-G.; WADA, M.; BASSI, R. Interaction between avoidance of photon absorption, excess energy dissipation and zeaxanthin synthesis against photooxidative stress in Arabidopsis. The Plant Journal, v. 76, p. 568–579, 2013.
CHANG, C.C.C.; ŚLESAK, I.; JORDÁ, L.; SOTNIKOV, A.; MELZER, M.; MISZALSKI, Z.; MULLINEAUX, P.M.; PARKER, J.E.; KARPIŃSKA, B.; KARPIŃSKI, S. Arabidopsis chloroplastic glutathione peroxidases play a role in cross talk between photooxidative stress and immune responses. Plant Physiology, v. 150, p. 670–683, 2009.
DAVIES, W.J.; KUDOYAROVA, G.; HARTUNG, W. Long-distance ABA signaling and its relation to other signaling pathways in the detection of soil drying and the mediation of the plant’s response to drought. Journal of Plant Growth Regulation, v. 24, p. 285–295, 2005.
DEMMIG-ADAMS, B.; ADAMS III, W.W. Photoprotection and other responses of plants to high light stress. Annual Review of Plant Physiology and Plant Molecular Biology, v. 43, p. 599–626, 1992.
DIAS, N.S.; BLANCO, F.F. Efeitos dos sais no solo e na planta. In: GHEYI, H.R.; DIAS, N.S.; LACERDA, C.F. Manejo da salinidade na agricultura: estudos básicos e aplicados, Fortaleza: INCT Sal, p. 130–141, 2010.
DIETZ K-J.; JACOB, S.; OELZE, M-L.; LAXA, M.; TOGNETTI, V.; DE MIRANDA, S.M.N.; BAIER, M.; FINKEMEIER, I. The function of peroxiredoxins in plant organelle redox metabolism. Journal of Experimental Botany, v. 57, p. 1697–1709, 2006. DINAKAR, C.; ABHAYPRATAP, V.; YEARLA, S.R.; RAGHAVENDRA, A.S.; PADMASREE, K. Importance of ROS and antioxidant system during the beneficial interactions of mitochondrial metabolism with photosynthetic carbon assimilation. Planta, v. 231, p. 461–474, 2010.
DUTILLEUL, C.; LELARGE, C.; PRIOUL, J-L.; DE PAEPE, R.; FOYER, C.H.; NOCTOR, G. Mitochondria-driven changes in leaf NAD status exert a crucial influence on the control of nitrate assimilation and the integration of carbon and nitrogen metabolism. Plant Physiology, v. 139, p. 64–78, 2005.
ESHDAT, Y.; HOLLAND, D.; FALTIN, Z.; BEN-HAYYIM, G. Plant glutathione peroxidases. Physiologia Plantatarum, v. 100, p. 234–240, 1997.
EVELIN, H.; KAPOOR, R.; GIRI, B. Arbuscular mycorrhizal fungi in alleviation of salt stress: a review. Annals of Botany, v. 104, p. 1263–1280, 2009.
FALTIN, Z.; HOLLAND, D. Glutathione peroxidase regulation of reactive oxygen species level is crucial for in vitro plant differentiation. Plant and Cell Physiology, v. 51, p. 1151–1162, 2010.
FAWAL, N.; LI, QIANG; SAVELLI, B.; BRETTE, M.; PASSAIA, G.; FABRE, M.; MATHÉ, C.; DUNAND, C. PeroxiBase: a database for large-scale evolucionary analysis of peroxidases. Nucleic Acids Research, v. 41, p. D441–D444, 2013. FINKEL, T. Signal transduction by reactive oxygen species. The Journal of Cell Biology, v. 194, p. 7–15, 2011.
FLOHE, L. Glutathione peroxidase brought into focus. In: PRYOR, W.A. (ed.). Free Radicals in Biology. Volume 5, New York: Academic Press, p. 223–254, 1982. FLOWERS, T.J. Improving crop salt tolerance. Journal of Experimental Botany, v. 55, p. 307–319, 2004.
FOYER, C.H.; NOCTOR, G. Ascorbate and glutathione: the heart of the redox hub. Plant physiology, v. 155, p. 2–18, 2011.
FOYER, C.H.; NOCTOR, G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context. Plant, Cell and Environment, v. 28, p. 1056–1071, 2005a.
FOYER, C.H.; NOCTOR, G. Redox homeostasis and antioxidant signaling: a metabolic interface between stress perception and physiological responses. The Plant Cell, v. 17, p. 1866–1875, 2005b.
FOYER, C.H.; NOCTOR, G. Redox regulation in photosynthetic organisms: signaling, acclimation, and practical implications. Antioxidants & Redox Signaling, v. 11, p. 861–905, 2009.
FOYER, C.H.; NOCTOR, G. Redox sensing and signalling associated with reactive oxygen in chloroplasts, peroxisomes and mitochondria. Physiologia Plantarum, v. 119, p. 355-364, 2003.
GABER, A.; OGATA, T.; MARUTA, T.; YOSHIMURA, K.; TAMOI, M.; SHIGEOKA, S. The involvement of Arabidopsis glutathione peroxidase 8 in the suppression of oxidative damage in the nucleus and cytosol. Plant and Cell Physiology, v. 53, p. 1596–1606, 2012.
GAO, P.P. ZHENG, G.H.; WU, Y.H.; LIU, P. Effect of exogenous potassium on photosynthesis and antioxidant enzymes of rice under iron toxicity. Russian Journal of Plant Physiology, v. 61, p. 47-52, 2014.
GILL, S.S.; TUTEJA, N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology and Biochemistry, v. 48, p. 909– 930, 2010.
GIRI, B.; KAPOOR, R.; MAKERJI, K.G. Improved tolerance of Acacia nilotica to salt stress by arbuscular mycorrhiza, Glomus fasciculatum, may be related to elevated K+/Na+ ratios in root and shoot tissues. Microbial Ecology, v. 54, p. 753–760, 2007. GODFRAY, H.C.; BEDDINGTON, J.R.; CRUTE, I.R.; HADDAD, L.; LAWRENCE, D.; MUIR, J.F.; PRETTY, J.; ROBINSON, S.; THOMAS, S.M.; TOULMIN, C. Food security: the challenge of feeding 9 billion people. Science, v. 327, p. 812–818, 2010. GOLLDACK, D.; LÜKING, I.; YANG, O. Plant tolerance to drought and salinity: stress regulating transcription factors and their functional significance in the cellular transcriptional network. Plant Cell Reports, v. 30, p. 1383–1391, 2011.
HALLIWELL, B.; FOYER, C.H. Ascorbic acid, metal ions and the superoxide radical. Biochemical Journal, v. 155, p. 697–700, 1976.
HALLIWELL, B.; Reactive species and antioxidants: redox biology is a fundamental theme of aerobic life. Plant Physiology, v. 141, p. 312-322.
HEAZLEWOOD, J.L.; TONTI-FILIPPINI, J.S.; GOUT, A.M.; DAY, D.A.; WHELAN, J.; MILLAR, A.H. Experimental analysis of the Arabidopsis mitochondrial proteome highlights signaling and regulatory components, provides assessment of targeting prediction programs, and indicates plant-specific mitochondrial proteins. The Plant Cell, v. 16, p. 241–256, 2004.
HERBETTE, S.; LENNE, C.; LEBLANC, N.; JULIEN, J-L.; DREVET, J.R.; ROECKEL-DREVET, P. Two GPX-like proteins from Lycopersicon esculentum and Helianthus annuus are antioxidant enzymes with phospholipid hydroperoxide glutathione peroxidase and thioredoxin peroxidase activities. European Journal of Biochemistry, v. 269, p. 2414–2420, 2002.
HIRAGA, S.; SASAKI, K,; ITO, H.; OHASHI, Y.; MATSUI, H. A large family of class III plant peroxidases. Plant and Cell Physiology, v. 42, p. 462–468, 2001.
HSU, S.Y.; KAO, C.H.; Differential effect of sorbitol and polyethylene glycol on antioxidant enzymes in rice leaves. Plant Growth Regulation, v. 39, p. 83–90, 2003. HUNER, N.P.A.; ÖQUIST, G.; SARHAN, F. Energy balance and acclimation to light and cold. Trends in Plant Science, v. 3, p. 224–230, 1998.
HUSSAIN, K.; NISAR, M.F.; MAJEED, A.; NAWAZ, K.; BHATTI, K.H.; AFGHAN, S.; SHAHAZAD, A.; ZIA-UL-HUSSNIAN, S. What molecular mechanism is adapted by plants during salt stress tolerance? African Journal of Biotechnology, v. 9, p. 416– 422, 2010.
JONES, D.P. Redefining oxidative stress. Antioxidants & Redox Signaling, v. 8, p. 1865–1879, 2006.
JUNG, B.G.; LEE, K.O.; LEE, S.S.; CHI, Y.H.; JANG, H.H.; KANG, S.S.; LEE, K.; LIM, D.; YOON, S.C.; YUN, D.J.; INOUE, Y.; CHO, M.J.; LEE, S.Y. A Chinese cabbage cDNA with high sequence identity to phospholipid hydroperoxide glutathione peroxidases encodes a novel isoform of thioredoxin-dependent peroxidase. Journal of Biological Chemistry, v. 277, p. 12572–12578, 2002.
KATO, Y.; SAKAMOTO, W. Protein quality control in chloroplasts: a current model of D1 protein degradation in the photosystem II repair cycle. The Journal of Biochemistry, v. 146, p. 463–469, 2009.
KATO, Y.; SUN, X.; ZHANG, L.; SAKAMOTO, W. Cooperative D1 degradation in the photosystem II repair mediated by chloroplastic proteases in Arabidopsis. Plant Physiology, v. 159, p. 1428–1439, 2012.
KNIGHT, H.; KNIGHT, M.R. Abiotic stress signalling pathways: specificity and cross-talk. Trends in Plant Science, v. 6, p. 262–267, 2001.
KOWALTOWSKI, A.J.; SOUZA-PINTO, N.C.; CASTILHO, R.F.; VERCESI, A.E. Mitochondria and reactive oxygen species. Free Radical Biology and Medicine, v. 47, p. 333–343, 2009.
KRÖMER, S. Respiration during photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, v. 46, p. 45–70, 1995.
KUKREJA, S.; NADWAL, A.S.; KUMAR, N.; SHARMA, S.K.; UNVI, V.; SHARMA, P.K. Plant water status, H2O2 scavenging enzymes, ethylene evolution and membrane integrity of Cicerarietinum roots as affected by salinity. Biologia Plantarum, v. 49, p. 305–308, 2005.
LOGAN, B.A. Reactive oxygen species and photosynthesis. In: SMIRNOFF, N. (ed.). Antioxidants and reactive oxygen species in plants. Chennai: Blackwell Publishing, p. 250–267, 2005.
MANSOUR, M.M.F. Protection of plasma membrane of onion epidermal cells by glycinebetaine and proline against NaCl stress. Plant Physiology and Biochemistry, v. 36, p. 767–772, 1998.
MARGIS, R.; DUNAND, C.; TEIXEIRA, F.K.; MARGIS-PINHEIRO, M. Glutathione peroxidase family - an evolutionary overview. FEBS Journal, v. 275, p. 3959–3970, 2008.
MARSCHNER, P. Marschner’s mineral nutrition of higher plants. 3rd edition. London: Academic Press, 2012.
MATHUR, N.; SINGH, J.; BOHRA, S.; VYAS, A. Arbuscular mycorrhizal status of medicinal halophytes in saline areas of indian Thar desert. International Journal of Soil Science 2, v. 2, p. 119–127, 2007.
McCORD, J.M.; The evolution of free radicals and oxidative stress. The American Journal of Medicine, v. 108, p. 652–659, 2000.
MELIS, A. Photosystem-II damage and repair cycle in chloroplasts: what modulates the rate of photodamage in vivo? Trends in Plant Science, v. 4, p. 130–135, 1999. MIAO, Y.; LV, D.; WANG, P.; WANG, X–C.; CHEN, J.; MIAO, C.; SONG, C–P. An Arabidopsis glutathione peroxidase functions as both a redox transducer and a scavenger in abscisic acid and drought stress responses. The Plant Cell, v. 18, p. 2749–2766, 2006.
MILLA, M.A.R.; MAURER, A.; HUETE, A.R.; GUSTAFSON, J.P. Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signalling pathways. The Plant Journal, v. 36, p. 602–615, 2003. MILLER, G.; SUZUKI, N.; CIFTCI-YILMAZ, S.; MITTLER, R. Reactive oxygen species homeostasis and signalling during drought and salinity stress. Plant, Cell and Environment, v. 33, p. 453–467, 2010.
MILLS, G.C. Glutathione peroxidase, an erythrocyte enzyme which protects hemoglobin from oxidative breakdown. Journal of Biological Chemistry, v. 229, p. 189–197, 1957.
MITTLER, R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, v. 7, p. 405–410, 2002.
MØLLER, I. Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species. Annual Review of Plant Physiology and Plant Molecular Biology, v. 52, p. 561–591, 2001.
MUNNS, R. Genes and salt tolerance: bringing them together. New Phytologist, v. 167, p. 645–663, 2005.
MUNNS, R.; TESTER, M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, v. 59, p. 651–681, 2008.
MURATA, N.; TAKAHASHI, S.; NISHIYAMA, Y.; ALLAKHVERDIEV, S.I. Photoinhibition of photosystem II under environmental stress. Biochimica et Biophysica Acta, v. 1767, p. 414–421, 2007.
MURPHY, M.P.; HOLMGREN, A.; LARSSON, N-G.; HALLIWELL, B.; CHANG, C.J.; KALYANARAMAN, B.; RHEE, S.G.; THORNALLEY, P.J.; PARTRIDGE, L.; GEMS, D.; NYSTRÖM, T.; BELOUSOV, V.; SCHUMACHER, P.T.; WINTERBOURN, C.C. Unraveling the biological roles of reactive oxygen species. Cell Metabolism, v. 13, p. 361–366, 2011.
NAVROT, N.; COLLIN, V.; GUALBERTO, J.; GELHAYE, E.; HIRASAWA, M.; REY, P.; KNAFF, D.B.; ISSAKIDIS, E.; JACQUOT, J.P.; ROUHIER, N. Plant glutathione peroxidases are functional peroxiredoxins distributed in several subcellular compartments and regulated during biotic and abiotic stresses. Plant Physiology, v. 142, p. 1364–1379, 2006.
NAVROT, N.; ROUHIER, N.; GELHAYE, E.; JACQUOT, J-P. Reactive oxygen species generation and antioxidant systems in plant mitochondria. Physiologia Plantarum, v. 129, p. 185–195, 2007.
NELSON, D.L.; COX, M.M. Lehninger: principles of biochemistry. 6th edition. New York: W.H. Freeman, 2013.
NIYOGI, K.K.; TRUONG, T.B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology, v. 16, p. 307–314, 2013.
NOCTOR, G.; DE PAEPE, R.; FOYER, C.H. Mitochondrial redox biology and homeostasis in plants. Trends in Plant Science, v. 12, p. 125–134, 2007.
NUCCIO, M.L.; RHODES, D.; McNEIL, S.D.; HANSON, A.D. Metabolic engineering of plants for osmotic stress resistance. Current Opinion in Plant Biology, v. 2, p. 128– 134. 1999.
NUNES-NESI, A.; SULPICE, R.; GIBON, Y.; FERNIE, A.R. The enigmatic contribution of mitochondrial function in photosynthesis. Journal of Experimental Botany, v. 59, p. 1675–1684, 2008.
PADMASREE, K.; PADMAVATHI, L.; RAGHAVENDRA, A.S. Essentiality of mitochondrial oxidative metabolism for photosynthesis: optimization of carbon assimilation and protection against photoinhibition. Critical Reviews in Biochemistry and Molecular Biology, v. 37, p. 71–119, 2002.
PARVAIZ, A.; SATYAWATI, S. Salt stress and phyto-biochemical responses of plants – a review. Plant, Soil and Environment, v. 54, n. 3, p. 89–99, 2008.
PASSAIA, G.; CAVERZAN, A.; FONINI, L.S.; CARVALHO, F.E.L.; SILVEIRA, J.A.G.; MARGIS-PINHEIRO, M. Chloroplastic and mitochondrial GPX genes play a critical role in plant development. Biologia Plantarum, in press (DOI: 10.1007/s10535-014-0394-9), 2014.
PASSAIA, G.; FONINI, L.S.; CAVERZAN, A.; JARDIM-MESSEDER, D.; CHRISTOFF, A.P.; GAETA, M.L.; MARIATH, J.E.A.; MARGIS, R.; MARGIS-PINHEIRO, M. The mitochondrial glutathione peroxidase GPX3 is essential for H2O2 homeostasis and root and shoot development in rice. Plant Science, v. 208, p. 93–101, 2013.
PASSARDI, F.; COSIO, C.; PENEL, C.; DUNAND, C. Peroxidases have more functions than a Swiss army knife. Plant Cell Reports, v. 24, p. 255–265, 2005. POLLE, A. Dissecting the superoxide dismutase–ascorbate peroxidase–glutathione pathway in chloroplasts by metabolic modeling. Computer simulations as a step towards flux analysis. Plant Physiology, v. 126, p. 445–462, 2001.
PORCEL, R.; AROCA, R.; RUÍZ-LOZANO, J.M. Salinity stress alleviation using arbuscular mycorrhizal fungi: a review. Agronomy for Sustainable Development, v. 32, p. 181–200, 2012.
RHOADS, D.M.; UMBACH, A.L.; SUBBAIAH, C.C.; SIEDOW, J.N. Mitochondrial reactive oxygen species: contribution to oxidative stress and interorganellar signaling. Plant Physiology, v. 141, p. 357–366, 2006.
RHODES, D.; HANSON, A.D. Quaternary ammonium and tertiary sulfonium compounds in higher-plants. Annual Review of Plant Physiology and Plant Molecular Biology, v. 44, p. 357–384, 1993.
ROXAS, V.; LODHI, S. Stress tolerance in transgenic tobacco seedlings that overexpress glutathione S-transferase/glutathione peroxidase. Plant and Cell Physiology, v. 41, p. 1229–1234, 2000.
RUIZ-LOZANO, J.M.; PORCEL, R.; AZCÓN, C.; AROCA, R. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants: new challenges in physiological and molecular studies. Journal of Experimental Botany, v. 63, p. 4033–4044, 2012.
SCHEIBE, R. Malate valves to balance cellular energy supply. Physiologia Plantarum, v. 120, p. 21–26, 2004.
SCHEIBE, R.; BACKHAUSEN, J.E.; EMMERLICH, V.; HOLTGREFE, S. Strategies to maintain redox homeostasis during photosynthesis under changing conditions. Journal of Experimental Botany, v. 56, p. 1481–1489, 2005.
SERRANO, R.; CULIANZ-MACIA, F.A.; MORENO, V. Genetic engineering of salt and drought tolerance with yeast regulatory genes. Scientia Horticulturae, v. 78, p. 261– 269, 1999.
SHABALA, S.; CUIN, T.A. Potassium transport and plant salt tolerance. Physiologia Plantarum, v. 133, p. 651–669, 2007.
SHARMA, P.; JHA, A.B.; DUBEY, R.S.; PESSARAKLI, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, v. 2012, p. 1–26, 2012.
SHIGEOKA, S.; ISHIKAWA, T.; TAMOI, M.; MIYAGAWA, Y.; TAKEDA, T.; YABUTA, Y.; YOSHIMURA, K. Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental Botany, n. 53, p. 1305–1309, 2002.
ŚLESAK, I.; LIBIK, M.; KARPINSKA, B.; KARPINSKI, S.; MISZALSKI, Z. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses. Acta biochimica Polonica, v. 54, n. 39–50, 2007.
SUORSA, M.; JÄRVI, S.; GRIECO, M.; NURMI, M.; PIETRZYKOWSKA, M.; RANTALA, M.; KANGASJÄRVI, S.; PAAKKARINEN, V.; TIKKANEN, M.; JANSSON, S.; ARO, E-M. PROTON GRADIENT REGULATION5 is essential for proper acclimation of Arabidopsis photosystem I to naturally and artificially fluctuating light conditions. The Plant Cell, v. 24, p. 2934–2948, 2012.
SUZUKI, N.; KOUSSEVITZKY, S.; MITTLER, R.; MILLER, G. ROS and redox signalling in the response of plants to abiotic stress. Plant, Cell and Evironment, v. 35, p. 259–270, 2012.
SWEETLOVE, L.J.; HEAZLEWOOD, J.L.; HERALD, V.; HOLTZAPFFEL, R.; DAY, D.A.; LEAVER, C.J.; MILLAR, A.H. The impact of oxidative stress on Arabidopsis mitochondria. The Plant Journal, v. 32, p. 891–904, 2002.
SWEETLOVE, L.J.; LYTOVCHENKO, A.; MORGAN, M.; NUNES-NESI, A.; TAYLOR, N.L.; BAXTER, C.J.; EICKMEIER, I.; FERNIE, A.R. Mitochondrial uncoupling protein is required for efficient photosynthesis. Proceedings of the National Academy of Sciences of the United States of America, v. 103, p. 19587–19592, 2006.
TAKAHASHI, M.; ASADA, K. Superoxide production in aprotic interior of chloroplast thylakoids. Archives of Biochemistry and Biophysics, v. 267, p. 714–722, 1988. TAKAHASHI, S.; BADGER, M.R. Photoprotection in plants: a new light on photosystem II damage. Trends in Plant Science, v. 16, p. 53–60, 2011.
TAKAHASHI, S.; MURATA, N. Interruption of the Calvin cycle inhibits the repair of photosystem II from photodamage. Biochimica et Biophysica Acta, v. 1708, p. 352– 361, 2005.
TAKAHASHI, S.; MURATA, N. Glycerate-3-phosphate, produced by CO2 fixation in the Calvin cycle, is critical for the synthesis of the D1 protein of photosystem II. Biochimica et Biophysica Acta, v. 1757, p. 198–205, 2006.
TAKAHASHI, S.; MURATA, N. How do environmental stresses accelerate photoinhibition? Trends in Plant Science, v. 13, p. 178–182, 2008.
TANAKA, T.; IZAWA, S.; INOUE, Y. GPX2, encoding a phospholipid hydroperoxide glutathione peroxidase homologue, codes for an atypical 2-Cys peroxiredoxin in Saccharomyces cerevisiae. Journal of Biological Chemistry, v. 280, p. 42078– 42087, 2005.
TESTER, M.; DAVENPORT, R. Na+ tolerance and Na+ transport in higher plants. Annals of Botany, v. 91, p. 503–527, 2003.
TESTER, M.; LANGRIDGE, P. Breeding technologies to increase crop production in a changing world. Science, v. 327, p. 818–822, 2010.
TRIANTAPHYLIDES, C.; HAVAUX, M. Singlet oxygen in plants: production, detoxification and signaling. Trends in Plant Science, v. 14, p. 219–228, 2009. TÜRKAN, I.; DEMIRAL, T. Recent developments in understanding salinity tolerance. Environmental and Experimental Botany, v. 67, p. 2–9, 2009.
URBANCZYK-WOCHNIAK, E.; USADEL, B.; THIMM, O.; NUNES-NESI, A.; CARRARI, F.; DAVY, M.; BLASING, O.; KOWALCZYK, M.; WEICHT, D.; POLINCEUSZ, A.; MEYER, S.; STITT, M.; FERNIE, A.R. Conversion of MapMan to allow the analysis of transcript data from Solanaceous species: effects of genetic and environmental alterations in energy metabolism in the leaf. Plant Molecular Biology, v. 60, p. 773–792, 2006.
VINYARD, D.J.; ANANYEV, G.M.; DISMUKES, G.C. Photosystem II: the reaction center of oxygenic photosynthesis. Annual Review of Biochemistry, v. 82, p. 577– 606, 2013.
WU, J.; NEIMANIS, S.; HEBER, U. Photorespiration is more effective than the Mehler reaction in protecting the photosynthetic apparatus against photoinhibition. Botanica Acta, v. 104, p. 283–291, 1991.
YAMANE, K.; TANIGUCHI, M.; MIYAKE, H. Salinity-induced subcellular accumulation of H2O2 in leaves of rice. Protoplasma, v. 249, p. 301–308, 2012.
YOSHIDA, K.; WATANABE, C.; KATO, Y.; SAKAMOTO, W.; NOGUCHI, K. Influence of chloroplastic photo-oxidative stress on mitochondrial alternative oxidase capacity and respiratory properties: a case study with Arabidopsis yellow variegated 2. Plant and Cell Physiology, v. 49, n. 592–603, 2008.
YOSHIMURA, K.; MIYAO, K.; GABER, A.; TAKEDA, T.; KANABOSHI, H.; MIYASAKA, H.; SHIGEOKA, S. Enhancement of stress tolerance in transgenic tobacco plants overexpressing Chlamydomonas glutathione peroxidase in chloroplasts or cytosol. The Plant Journal, v. 37, p. 21–33, 2004.
ZHAI, C-Z.; ZHAO, L.; YIN, L-J.; CHEN, M.; WANG, Q-Y.; LI, L-C.; XU, Z-S.; MA, Y-Z. Two wheat glutathione peroxidase genes whose products are located in chloroplasts improve salt and H2O2 tolerances in Arabidopsis. PLoS One, v. 8, e73989, 2013. ZHANG, L-T.; ZHANG, Z-S.; GAO, H-Y.; MENG, X-L.; YANG, C.; LIU, J-G.; MENG, Q-W. The mitochondrial alternative oxidase pathway protects the photosynthetic apparatus against photodamage in Rumex K-1 leaves. BMC Plant Biology, v. 12, p. 40, 2012.
C
APÍTULO2
CRESCIMENTO, FOTOSSÍNTESE E METABOLISMO OXIDATIVO
DE ARROZ SILENCIADO PARA OS GENES
O
S
GPX1
OU
O
S
GPX3
CODIFICANTES PARA GPX MITOCONDRIAIS
RESUMO
A glutationa peroxidase pertence ao grupo de enzimas com função de remoção de espécies reativas de oxigênio (EROS) e está presente em vários grupos de organismos e em diferentes localizações subcelulares. Apesar disso, pouco é conhecido sobre esta enzima em plantas, especialmente a respeito das isoformas mitocondriais e da participação na fotoproteção. A proposta deste estudo foi analisar os efeitos da carência de GPX mitocondrial na fotossíntese e no crescimento. Para isso, plantas de arroz transgênicas (Oryza sativa L.) silenciadas para os genes OsGPX1 ou OsGPX3 foram produzidos pela técnica do RNAi. Mutantes silenciados para OsGPX1 exibiram menor crescimento e fotossíntese prejudicada, como mostrado por mensurações anatômicas e parâmetros de fluorescência da clorofila a e de trocas gasosas comparativamente a plantas não transformadas (NT). Ambos mutantes deficientes em GPX mitocondrial exibiram maiores concentrações de peróxido de hidrogênio e menores conteúdos de glutationa reduzida (GSH) comparados às NT. Os resultados são discutidos com o intuito de melhor entender o papel fisiológico das GPX mitocondriais relacionados ao processo fotossintético de crescimento. Em conjunto, os resultados sugerem que o silenciamento de GPX deve desencadear mudanças na expressão e na atividade de outros importantes genes/proteínas envolvidos em vários processos fisiológicos tais como fotossíntese e desenvolvimento.