UNIVERSIDADE FEDERAL DE SÃO CARLOS
CENTRO DE CIÊNCIAS EXATAS E DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
SELETIVIDADE DA CLINOPTILOLITA NATURAL POR METAIS
TÓXICOS EM SISTEMAS AQUOSOS
JUAN CARLOS TORRES FERNÁNDEZ
Orientador: Prof. Dr. José Carlos Gubulin
SÃO CARLOS – SP
2004
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária/UFSCar
T693sc
Torres Fernández, Juan Carlos.
Seletividade da clinoptilolita natural por metais tóxicos em sistemas aquosos / Juan Carlos Torres Fernández. -- São Carlos : UFSCar, 2005.
152 p.
Tese (Doutorado) -- Universidade Federal de São Carlos, 2004.
1. Engenharia química - saneamento. 2. Troca iônica Metais pesados. 3. Caracterização. 4. Clinoptilolita. 5. Modelos Termodinâmicos. I. Título.
Aos meus pais Juan (in memorian) e
Felícia. A Dany, Diana e Ana. A eles pelo
AGRADECIMENTOS
Ao Prof. Dr. José Carlos Gubulin, cuja orientação contribuiu a produzir mais do que este trabalho; pela sua vital contribuição à minha formação profissional. Pelos seus conselhos, dicas e amizade.
Aos professores do Departamento de engenharia Química da UFSCar pelos seus esforços na minha especialização, pelas vezes que precisei da sua ajuda. À Secretaria de Pós-Graduação; aos técnicos Rômulo e Espanhol e ao professor Ernesto do LIEC; a todos os funcionários. A todas aquelas pessoas da UFSCar que contribuíram de alguma forma à minha formação e realização deste trabalho.
À minha esposa Ana Isa pela sua força incomparável, sua paciência e imprescindível ajuda, pelos seus conselhos; pela sua espera; pelo seu amor.
Aos meus colegas do Laboratório de Sistemas Particulados: a Guto, Alexandre, Junior, Andréia. Pela sua amizade e ajuda em todo momento.
Aos meus amigos de Cuba e de todo o Brasil;. aos cubanos de São Carlos. Aos amigos e colegas de outros paises que conheci aqui. A eles que me brindaram sua amizade para sempre. A Miche, César, Erick y Emma. A Laura y Caro.
À minha família pelo seu carinho e apoio.
Ao Conselho Nacional de Pesquisa do Brasil (CNPq), pela bolsa de estudos concedida e pelo apoio financeiro para a realização do trabalho.
RESUMO
As zeólitas naturais constituem os trocadores iônicos inorgânicos mais importantes, as quais mostram elevada capacidade de troca iônica, seletividade e compatibilidade com o ambiente natural.
Os metais pesados são conhecidos pela sua toxicidade e seus depósitos constituem o maior problema quanto a despejos industriais.
Os objetivos básicos deste trabalho foram a interpretação do equilíbrio de adsorção e a avaliação da seletividade de um mineral de clinoptilolita purificado e homo-iônico por Pb2+, Zn2+, Cu2+ e Na+ aquosos à normalidade de 0,005 eq/L e temperatura de 303 K.
O estudo proposto foi feito obedecendo as seguintes etapas: (1) preparação e caracterização do material adsorvente; (2) preparação e análise de soluções eletrolíticas; (3) equilíbrio termodinâmico de clinoptilolita homo-iônica com soluções contendo os dois cátions competitivos; (4) análises, no equilíbrio, das soluções mediante EAA; (5) construção dos pontos experimentais e análise das isotermas; (6) testes de reversibilidade termodinâmica; (7) uso de modelos empíricos para a fase zeólita, admitida como uma pseudo-solução, e modelos de interação iônica para a solução eletrolítica; (8) análise da constante de equilíbrio e da energia livre de Gibbs das reações de troca binárias e interpretação fenomenológica dos parâmetros termodinâmicos.
Os resultados obtidos mostraram que os modelos adotados para a fase zeólita, considerada como uma mistura, junto com o modelo de Pitzer para os coeficientes de atividade na solução eletrolítica descrevem com sucesso o equilíbrio de troca binária dos sistemas estudados. A constante de equilíbrio calculada e a correspondente energia livre de Gibbs, para cada reação de troca binária à normalidade e temperatura estudadas, resultaram numa seqüência de seletividade dada por: Pb2+ >Na+ Cu2+ >Zn2+. Paralelamente, os parâmetros estimados através do o uso das equações de Margules, Van Laar e Wilson para os cations na mistura binária resultaram em valores úteis na quantificação das interações cátion – estrutura. Desta forma, a avaliação destes parâmetros constituiu uma alternativa na interpretação da seletividade do adsorvente pelos diferentes cátions de troca a partir do efeito do raio e da carga dos cátions.
Os parâmetros ternários obtidos através da aplicação de modelos clássicos de estrutura multicomponente resultaram não satisfatórios na interpretação fenomenológica da mistura de mais de dois componentes. Este resultado confirma o encontrado em estudos sobre a estrutura cristalina das zeólitas tipo heulandita: estes aluminosilicatos geralmente contêm grupos de sítios cristalográficos distinguíveis e, por outro lado, que os coeficientes de atividade dos íons em cada tipo de sítios é uma função fortemente dependente da composição e população destes. Desta forma, a inclusão de um terceiro componente torna extremamente complicada a predição e interpretação dos coeficientes de atividade fenomenológicos na “mistura sólida” multicomponente. Neste sentido e, a partir dos resultados deste estudo, acredita-se que a interpretação da não idealidade da mistura sólida multicomponente deve ser feita através do uso de modelos que considerem a heterogeneidade energética dos diferentes grupos de sítios dentro da zeólita, acoplado a considerações da termodinâmica estatística que têm em conta a população e composição em cada grupo de sítios, além da densidade de carga da rede cristalina do adsorvente.
ABSTRACT
Natural zeolites are the most important inorganic cationic exchangers exhibiting high ion exchange capacity, selectivity and environment compatibility.
Heavy metals are well known for toxicity and their disposal is a significant industrial waste problem.
The goal of this work was directed to evaluate the selectivity of a purified homo-ionic clinoptilolite mineral for aqueous Pb2+, Zn2+, Cu2+ and Na+ ions at 0,005 eq/L and 303 K, interpreted through the application of empirical thermodynamic models to the zeolite phase (Margules, Van Laar, Wilson) coupled with a well established ion-interaction approach for the electrolyte solution (Pitzer).
The present study considered the following stages: (1) adsorbent material: preparation and characterization; (2) aqueous solutions: nitrates of sodium, lead, zinc and copper; (3) equilibration of weighed amounts of homo-ionic clinoptilolite with a series of solutions containing the two competing cations; (4) analysis for aqueous cations by AAE; (5) construction of the equilibrium points; isotherm analysis; (6) test for thermodynamic reversibility; (7) empirical models for the zeolite phase (admitted as a solid solution) jointed to the ion-interaction model chosen for the aqueous solution; (8) equilibrium constant and Gibbs free energy for the ion-exchange reactions; phenomenological interpretation of the thermodynamic parameters obtained by means of the application of empirical models to the zeolite phase. The above procedure was, in the same way, followed for the ternary systems.
The results obtained in this work shown that the empirical models adopted for the solid phase coupled to Pitzer’s model for the activity coefficients in the electrolyte solution describe successfully the binary ion-exchange equilibria. The calculated equilibrium constant and the corresponding Gibbs free energy for each binary-exchange reaction resulted in a selectivity sequence, at the normality and temperature of this study, easily deduced as:
2 2 2
Pb + >Na+ Cu + >Zn +. Besides, the parameters estimated applying the Margules’, Van Laar’s and Wilson’s equations for cations in the solid binary mixture resulted in useful values quantifying adequately the cation – zeolite framework interactions, thus, an alternative way to interpret the adsorbent selectivity from the charge and cationic radius effect.
The ternary parameters obtained applying multi-component empirical models do not explain properly the non-ideality of ions in a solid mixture containing more than two components. This is in accordance with the results encountered in a number of publications on crystal structure of heulandite-group zeolites: these aluminosilicates are found to contain crystallographically distinct set of sites throughout the exchanger framework and that normally each set of sites is partially populated by the exchanging ions. As a consequence, activity coefficients for a multi-component exchange reaction cannot be predicted from appropriate binary data for a heterogeneous exchanger, since the phenomenological binary coefficients are complicated functions of each site set, population and composition, and both these properties will change on introducing other species of ion in the exchanger. In this sense, and from what were obtained here, is believed that multi-component solid phase non-ideality must, at least, be interpreted through the application of statistical thermodynamic models considering the energetic heterogeneity of a number of site set and the charge density of the specific zeolite framework.
ÍNDICE DE ASSUNTOS
RESUMO...i
ABSTRACT………...…ii
ÍNDICE DE ASSUNTOS...iii
ÍNDICE DE TABELAS...vii
ÍNDICE DE FIGURAS...ix
ÍNDICE DE DIAGRAMAS E ESQUEMAS...x
NOMENCLATURA...xi
CAPÍTULO 1 - INTRODUÇÃO...1
1.1 Importância do estudo e desenvolvimento de materiais adsorventes de metais tóxicos. Impacto ambiental. Avanços e projeções...2
1.2 Toxicidade dos metais pesados...4
1.3. Objetivos do trabalho...4
CAPÍTULO 2 - REVISÃO BIBLIOGRÁFICA...6
2.1 Zeólitas: Estrutura e propriedades físico-químicas...6
2.1.1 Estrutura...6
2.1.2 O mineral de clinoptilolita. Classificação, propriedades e estrutura...8
2.1.3 Monocristais de zeólitas do grupo da Heulandita:...12
2.2 Principais elementos da termodinâmica das soluções...14
2.2.1 A relação de Gibbs-Duhem...17
2.3 Misturas líquidas não eletrolíticas...18
2.3.1 Misturas líquidas binárias...18
2.3.2 Misturas líquidas multicomponentes...23
1. A Equação de Wilson...23
2. A Equação de Chien-Null...24
2.4 Misturas líquidas eletrolíticas...26
2.4.1 Formulações específicas...27
2.4.2 Aspectos da Teoria de Debye-Hückel...28
2.4.3 Modelo da interação iônica de Pitzer...31
2.5 Modelos empíricos para os coeficientes de atividade dos íons na fase sólida...39
2.5.2 Misturas binárias...40
1. Correlações do tipo equação de Margules...40
2. Correlação do tipo equação de Van Laar...40
3. Correlação do tipo equação de Wilson...41
4. Formulações baseadas em considerações da termodinâmica estatística...41
2.5.3 Correlações para a fase sólida multicomponente...41
1. A equação de Wilson...41
2. Outros modelos...41
2.6 O equilíbrio de troca iônica...42
2.6.1 Representações para a reação de troca iônica 2.6.2 Condição de equilíbrio...43
2.6.3 A isoterma de troca iônica binária...44
2.7 Sistemas de troca iônica ternária...46
2.7.1 A reação de equilíbrio de troca ternária...46
2.7.2 Isotermas de troca iônica ternária...47
2.8 Soluções de sistemas multicomponentes via equilíbrio de reação...48
2.8.1 Solução via equilíbrio de reação binária...48
2.8.2 Solução mediante o modelo heterogêneo da ação de massas (HMAM)...48
2.9 Solução de sistemas multicomponentes via equilíbrio de fases...49
2.10 Ajuste de modelos aos dados experimentais...50
CAPÍTULO 3 - MATERIAIS E MÉTODOS...52
3.1 Materiais...52
3.1.1 A clinoptilolita...52
3.1.2 A clinoptilolita homo-iônica...53
3.1.3 Reagentes...53
3.2 Equipamentos...54
3.3 Soluções eletrolíticas...54
3.4 Métodos...54
3.4.1 Análise das amostras sólidas...55
1. Análise química...55
2. Difração de raios X...55
3. Análise termogravimétrica...56
4. Espectroscopia no infravermelho...56
3.4.3 Determinação do tempo mínimo para o equilíbrio...57
3.4.4 Experimentos de troca iônica binária. Planejamento experimental...57
3.4.5 Testes de reversibilidade...59
3.4.6 Experimentos de troca iônica ternária e quaternária...59
3.5 Variáveis para o tratamento dos dados binários...60
3.5.1 Aspectos no avanço das técnicas experimentais...61
3.6 Equações de trabalho...61
3.6.1 Coeficientes de atividade dos íons na solução multicomponente...61
3.6.2 Coeficientes de atividade dos cátions numa mistura sólida binária...62
1. Modelo de Margules...62
2. Modelo de Van Laar...62
3. A equação de Wilson...62
3.7 Ajuste da isoterma binária...62
3.8 Incerteza absoluta nos dados das isotermas...63
3.9 Desvio e erro padrões...65
3.10Procedimento para o processamento dos dados experimentais...65
CAPÍTULO 4 - RESULTADOS E DISCUSSÃO...67
4.1 Caracterização físico-química do adsorvente...67
4.1.1 Análise química...67
4.1.2 Análise térmica...70
4.1.3 Análise por difração de raios X (DRX)...71
4.1.4 Espectrofotometria no infravermelho...72
4.2 Troca iônica binária...74
4.2.1 Isotermas: pontos experimentais e seletividade...74
4.2.2 Modelos: parâmetros binários e seletividade...87
4.2.3 Constante de equilíbrio e energia livre de Gibbs padrão de reação...92
4.2.4 As funções γ e gE...95
4.2.5 Avaliação dos modelos: fmod vs. fobs...104
4.2.6 Comparação com o modelo dielétrico...104
4.3 Reversibilidade e incertezas experimentais...106
4.4 Sistemas ternários...107
4.4.1 Pontos experimentais: seletividade...108
CAPÍTULO 5 – CONCLUSÕES E RECOMENDAÇÕES...116
REFERÊNCIAS BIBLIOGRÁFICAS...122
APÊNDICE A...127
APÊNDICE B...130
ÍNDICE DE TABELAS
Tabela 2.1. Composição química e propriedades físicas de algumas zeólitas...7
Tabela 2.2. Sistema de canais e parâmetros cristalinos...7
Tabela 2.3. Propriedades físicas do mineral de clinoptilolita...8
Tabela 2.4. Informação geral sobre o mineral de clinoptilolita...9
Tabela 2.5. Raios cristalográficos, eletronegatividade e ∆Gs M0, z+ de alguns cátions...11
Tabela 4.1. Resultados da análise química das amostras sólidas...67
Tabela 4.2. Fórmulas químicas experimentais das amostras sólidas...69
Tabela 4.3. Capacidade de troca e relação molar Si/Al das amostras de clinoptilolita...69
Tabela 4.4. Parâmetros calculados para sistemas binários através dos modelos...88
Tabela 4.5. Parâmetros dos sistemas binários (equação de Chien-Null)...89
Tabela 4.6. Comparação dos parâmetros usando dados experimentais da literatura...89
Tabela 4.7. Relação entre os parâmetros obtidos pelos modelos de Margules e Van Laar...90
Tabela 4.8. Coeficientes de atividade dos cátions a diluição infinita...91
Tabela 4.9. Diferença entre energias de interação de pares de cátions...92
Tabela 4.10. Energias de troca calculadas mediante o modelo dielétrico...105
Tabela A-1. Índices e Difração de raios X da clinoptilolita (HEU)...127
Tabela B-1. Dados experimentais do sistema de troca clinoptilolita-NaNO3/Cu(NO3)2...130
Tabela B-2. Dados experimentais do sistema de troca clinoptilolita-NaNO3/Zn(NO3)2...131
Tabela B-3. Dados experimentais do sistema de troca clinoptilolita-NaNO3/Pb(NO3)2...132
Tabela B-4. Dados experimentais do sistema de troca clinoptilolita-Zn(NO3)2/Cu(NO3)2....133
Tabela B-5. Dados experimentais do sistema de troca clinoptilolita-Cu(NO3)2/Pb(NO3)2....134
Tabela B-6. Dados experimentais do sistema de troca clinoptilolita-Zn(NO3)2/Pb(NO3)2....135
Tabela B-7. Incertezas globais e erros nas medidas experimentais...136
Tabela B-8. Sistema de troca clinoptilolita-NaNO3/Cu(NO3)2. TN: 0,006 eq/L...137
Tabela B-9. Experimentos inversos para a troca iônica binária da Tabela B-8...138
Tabela B-10. Parâmetros de interação do modelo de Pitzer...138
Tabela B-11. Dados experimentais do sistema clinoptilolita-NaNO3/Pb(NO3)2/Cu(NO3)2 (experimento 1)...139
Tabela B-13. Dados experimentais do sistema clinoptilolita-NaNO3/Pb(NO3)2/Cu(NO3)2 (experimento 3)...141 Tabela B-14. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Cu(NO3)2
(experimento 2)...142 Tabela B-15. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Cu(NO3)2
(experimento 1)...143 Tabela B-16. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Cu(NO3)2
(experimento DII_T02)...144 Tabela B-17. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Pb(NO3)2
(experimento 1)...145 Tabela B-18. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Pb(NO3)2 (experimento 2)...146 Tabela B-19. Dados experimentais do sistema clinoptilolita-NaNO3/Zn(NO3)2/Pb(NO3)2 (experimento 3)...147 Tabela B-20. Dados experimentais do sistema clinoptilolita-Cu(NO3)2/Zn(NO3)2/Pb(NO3)2...148 Tabela B-21. Dados experimentais do sistema
clinoptilolita-NaNO3/Cu(NO3)2/Zn(NO3)2/Pb(NO3)2...149 Tabela C-1. Equações polinomiais para lnKV vs.
1 ( )S M
ÍNDICE DE FIGURAS
Figura 2.1. Estrutura e anéis da clinoptilolita...9
Figura 2.2. Imagem eletrônica de cristais de clinoptilolita...10
Figura 2.3. Modelo tetraédrico da heulandita homo-iônica...12
Figura 2.4. Diferentes formas trocadas da clinoptilolita...13
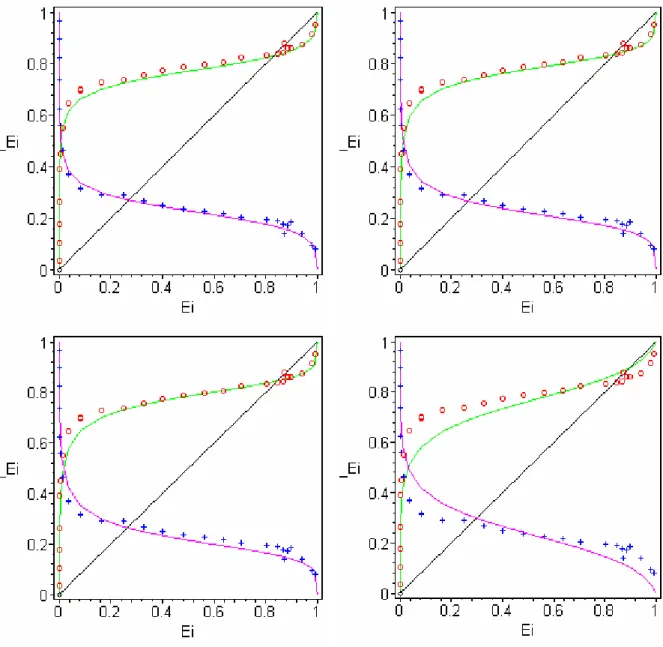
Figura 2.5. Isotermas. Trocador: (a) não seletivo; (b) seletivo; (c) seletividade reversa...45
Figura 2.6. Isotermas. Trocador: (d) não seletivo; (e) seletivo. (f): laço de histerese...46
Figura 2.7. Diagrama ternário. Superimposição de segmentos distorcidos...47
Figura 4.1. Análise térmica de amostras de clinoptilolita...70
Figura 4.2. Difratogramas da Na-clinoptilolita e a clinoptilolita calcinada...71
Figura 4.3. Diagramas FT-IR das amostras Na-clinoptilolita e NaCC...74
Figura 4.4. Isotermas para o sistema de troca iônica Na+−Cu2+...78
Figura 4.5. Isotermas para o sistema de troca iônica 2 Na+−Zn +...79
Figura 4.6. Isotermas para o sistema de troca iônica Na+−Pb2+...80
Figura 4.7. Isotermas para o sistema de troca iônica Zn2+−Cu2+...81
Figura 4.8. Isotermas de troca iônica para o sistema Cu2+−Pb2+...82
Figura 4.9. Isotermas para o sistema de troca iônica Zn2+−Pb2+...83
Figura 4.10. Constante de equilíbrio e energia livre de reação funções da relação entre as energias de hidratação e os raios cristalográficos dos cátions...94
Figura 4.11. Sistema Na+−Cu2+. Modelos e funções E/ g RT contra ( )S i x ...97
Figura 4.12. Sistema Na+−Zn2+. Modelos e funções gE /RT contra xi( )S ...98
Figura 4.13. Sistema Na+−Pb2+. Modelos e funções gE/RT contra xi( )S ...99
Figura 4.14. Sistema Zn2+−Cu2+. Modelos e funções gE/RT contra xi( )S ...100
Figura 4.15. Sistema Cu2+−Pb2+. Modelos e funções gE /RT contra xi( )S ...101
Figura 4.16. Sistema 2 2 Zn +−Pb +. Modelos e funções E/ g RT contra ( )S i x ...102
Figura 4.17. Sistema 2 Na+−Cu +: Isotermas; lnK% . Incertezas...106
Figura 4.18. Diagramas da troca iônica ternária Pb2+−Cu2+−Na+...110
Figura 4.19. Diagramas da troca iônica ternária Pb2+−Zn2+−Na+...111
Figura 4.20. Diagramas da troca iônica ternária 2 2 Zn +−Cu +−Na+...112
ÍNDICE DE DIAGRAMAS E ESQUEMAS
NOMENCLATURA
n
a : parâmetro numa expressão polinomial (n=0, 1, 2,...); idem An, Bn. i
a : atividade da espécie i na solução. ij
A : parâmetro de interação entre os componentes i e j numa mistura binária; i (ou j)=A, B; 1, 2, etc, no modelo de Margules; Aij', no modelo de Van Laar. E
A : energia livre excesso de Helmholtz. Aφ: parâmetro de Debye-Hückel.
MX
B : função dependente dos parâmetros de interação binária βMX(0) e βMX(1) específicos do sal MX puro.
MX
Bφ : função dependente dos parâmetros de interação binária de curta distância (λMM XX
λ e λMX) e da força iônica (B Iφ( )) do sal MX puro.
MX
Bγ : função dependente dos parâmetros de interação binários de curta distância βMX e da força iônica da solução.
ijk
C : parâmetro interação ternária soluto-soluto (ijk) na presença do solvente MX
C : função transformada de CMXφ . MX
Cφ : função em termos de parâmetros de interação ternária de curta distância (µMMX, MXX
µ ).
ji
D : parâmetros de interação binária ij; idem Rji, Vji, Sji. ( )
i
Eα : fração equivalente do íon i na solução.
f( )I : lei limite de Debye-Hückel função da força iônica.
fγ : função da força iônica contendo o parâmetro de Debye-Hückel. fφ : forma estendida do termo de Debye-Hückel.
( ) ˆ
i
f α : fugacidade da espécie i na fase α. id( )
ˆ i
f α : fugacidade da espécie i ideal na fase α.
F: quantidade que inclui o termo de Debye-Hückel e termos de interação. E
g : energia livre de Gibbs excesso por partícula. E
ij
( ) i
g α : energia livre de Gibbs parcial molar da espécie i na fase α. id( )
i
g α : energia livre de Gibbs parcial molar da espécie i ideal na fase α.
G: energia livre de Gibbs total do sistema. ( )
Gα : função energia livre de Gibbs total para a fase α. ( )
E
G α : função energia livre de Gibbs excesso na fase α. E
i
G : função energia livre de Gibbs parcial molar excesso da espécie ina mistura. E
G : função energia livre de Gibbs excesso para um eletrólito puro em solução. g: função da energia livre de Gibbs excesso, da composição e da temperatura.
ij
G : parâmetro de interação entre os íons i e j no modelo de Wilson.
K: constante termodinâmica de equilíbrio para a reação de troca (Ka, usada quando K é representada em termos das atividades).
i
jK: constante de equilíbrio para a reação de troca binária entre os íons i e j.
K%: coeficiente de seletividade corrigido para a não idealidade da solução; KV , coeficiente de Vanselow; KG ou *K% , coeficiente de Gaines e Thomas.
i j
K% : coeficiente de seletividade corrigido para a reação de troca binária ij. * i
j
K% : coeficiente de seletividade corrigido para a solução na convenção fração equivalente (Gaines e Thomas).
( ) i
mα : grandeza parcial molar genérica da espécie i na fase α. i
m : concentração molal da espécie i na solução eletrolítica. Μ: grandeza extensiva genérica da mistura.
i
M : concentração molar do componente i na solução eletrolítica. ( )
i
nα : número de moles do componente i na fase α.
N : número total de componentes de um sistema. M
v : número de íons positivos no eletrólito MX; vX , íons negativos. ( )
i
v α : volume parcial molar da espécie i na fase α. ( )
V α : volume total da fase α. i
x : fração molar do componente i na mistura líquida. ( )
i
i
z : número de cargas eletrônicas sobre o íon i (idem zM, zX).
Símbolos gregos
n
α : parâmetro de ajuste numa expressão polinomial. α: parâmetro universal na função BMXφ (α1, α2).
n
β : parâmetro de ajuste numa expressão polinomial. (0)
MX
β : parâmetro de interação binária de curta distância do sal MX (idem βMX(1) , βMX(2)). mixG
∆ : energia de Gibbs total para a mistura líquida. ε: permissividade dielétrica da água.
φ: coeficiente osmótico da solução eletrolítica. ( )
ˆ i α
φ : coeficiente de fugacidade do componente i em solução na fase α. ( )
i α
γ : coeficiente de atividade da espécie i na fase α (convenção fração molar). * ( )
i α
γ : coeficiente de atividade da espécie i na fase α (convenção fração equivalente). ( )
i α
γ∞
: coeficiente de atividade do componente i infinitamente diluído na fase α.
γ±: coeficiente de atividade iônico médio do sal Mz+Xz−.
κ: espessura recíproca (termo em lei limite de Debye-Hückel). ( )
ij I
λ : quantidade para a interação ij de curta distância na presença do solvente (segundo coeficiente do virial dependente de I; i e j, cátions ou ânions)
( ) i
α
µ : potencial químico da espécie i na fase α (usado também como µi, ' i
µ , etc.) id( )
i α
µ : potencial químico da espécie i ideal na fase α
ijk
µ : quantidade para a tripla interação ijk de curta distância na presença do solvente (terceiro coeficiente do virial independente de I)
Ω: número de moles de solvente contido num quilograma de água. Mc
Φ : parâmetro surgido da interação entre dois íons do mesmo sinal (parâmetro de mistura; idem Φcc', Φaa').
Mca
ψ : parâmetro surgido da interação entre três íons (parâmetro de mistura; idem
' cc a
Constantes
e: carga do elétron (=1, 6022 10× −19C) B
k : constante de Boltzmann (1,3807 10× −23JK−1) Av
N : constante de Avogadro (=6, 0221 10 mol× 23 −1) R: constante universal dos gases (=8, 3145 JK mol-1 -1)
0
INTRODUÇÃO
As zeólitas são reconhecidas como uns dos mais importantes silicatos autogênicos
existentes em rochas piroclásticas e vulcanoclásticas alteradas. Estas estão basicamente
formadas pela reação de “águas de poro” com vidro vulcânico e também por meio da
alteração de feldespatos pré-existentes, feldespatoides, argilas pouco cristalinas e sílica
biogênica [1].
Devido a suas características de sistemas de poros tridimensionais e pela grande
abertura destes poros, as zeólitas permitem de forma relativamente fácil a troca de certos
cátions entre soluções aquosas e sítios de troca intracristalinos.
O aspecto peculiar das zeólitas como trocadores catiônicos convertem estes minerais
em sistemas potencialmente muito interessantes do ponto de vista tecnológico, especialmente
na proteção ambiental [2].
Dois fatos fundamentais atraíram a atenção da comunidade cientifica pelas zeólitas
naturais como um material propício para propósitos ambientais:
1. A existência de uma seqüência de seletividade catiônica que pode ser muito útil na
remoção seletiva de poluentes na presença de cátions interferentes em fase aquosa [3].
2. Sua disponibilidade como enormes depósitos em todo o mundo o que torna seu custo
muito baixo [4].
Os sistemas de troca iônica mais simples contêm duas fases independentes. Uma
constituída pela solução e a outra pelo trocador de íons. A união entre estas fases coincide
com a fronteira geométrica. Neste caso cada fase contém três componentes. Na solução são
dois eletrólitos e um solvente e no trocador sólido, suas formas iônicas e o solvente. Desta
forma, os sistemas de troca mais simples são bi-iônicos com três componentes. Em geral, os
sistemas de troca podem ser especificados como n-iônicos, m-componentes (m>n) [5].
Os princípios básicos que sublinham a predição do equilíbrio de troca iônica a uma
temperatura constante sobre um intervalo de composições e concentrações da solução aquosa
foram estudados por vários autores [6]. Estes suportam o estudo sobre o fato de que a razão
dos coeficientes de atividade dos componentes que participam na troca dentro do trocador
sólido pode mudar muito (para uma dada composição nesta fase) na medida que a
concentração total da solução externa é alterada. A constância desta razão depende da
grau significativo de embevecimento de sais da solução aquosa no interior da fase sólida [7].
Se estas condições são satisfeitas, então, para composições na solução dada (por exemplo,
frações molares dos cátions), os coeficientes de seletividade corrigidos apropriados devem ser
constantes com as variações na concentração total da solução aquosa. As variações na
seletividade da fase sólida por cátions em solução dependem então só do comportamento não
ideal da fase solução [8]. Os princípios básicos na predição do comportamento de sistemas
binários, os processos de iteração requeridos, assim como exemplos de tais predições
aparecem também descritos por outros autores [9].
1.1 Importância do estudo e desenvolvimento de materiais adsorventes de metais tóxicos. Impacto ambiental. Avanços e projeções
Devido a sua capacidade de troca iônica, as zeólitas naturais constituem materiais de
grande demanda mundial na imobilização e recuperação de resíduos industriais poluentes (em
solução) que representam uma séria ameaça à saúde humana por sua mobilidade em sistemas
aquosos ambientais [10]. Em geral, as zeólitas são usadas onde considerações econômicas ou
com fluxo térmico e/ou de radiação exclui o uso de resinas. Conseqüentemente, as zeólitas
acham aplicação como amolecedores de água usados na preparação de fórmulas detergentes
[11], onde o baixo custo da zeólita A faz dela uma opção atrativa, assim como na remoção e
armazenamento de isótopos radiativos [12], onde a considerável resistência de algumas
zeólitas à radiação e temperatura faz destas uma opção óbvia. Como exemplo destes usos
temos a remoção de amônia de águas residuais municipais [13] e a imobilização de descartes
líquidos de 90Sr e 135,137Cs gerados no reprocessamento de combustíveis nucleares [14].
O uso de zeólitas naturais, em particular clinoptilolita, para remoção de amônia de
resíduos aquosos municipais é de um interesse crescente. Uma aplicação da clinoptilolita é o
tratamento de descargas de esgoto. Num projeto de demonstração conduzido pela “United
States Environmental Protection Agency” em Syracuse, Nova York, a clinoptilolita foi usada
tanto como trocador como meio de filtração secundário. Foi obtida uma redução dos níveis de
amônia abaixo de 0,02 mg/L, assim como uma redução significativa de organismos
demandantes de oxigênio, bactérias e outros poluentes orgânicos retidos no sistema
filtração-troca [15]. O diagramam 1 mostra o diagrama de fluxo simplificado do tratamento de águas
Cal Ar + Cal CLINO I Coagulante
Sólidos
Cal CLINO II
Diagrama 1. Diagrama de fluxo simplificado do tratamento de águas de descarte [11]. Descarte
doméstico
Tratamento primário
Misturador
Efluente industrial
Reservatório
Tanque de sedimentação
Reator de fluxo
Tanque Sedimentação
Reservatório de armazenagem
Descarte Rio Reciclagem
1.2 Toxicidade dos metais pesados
A integração de espécies aquosas de cádmio e chumbo às águas e aos solos, como
resultado de serem descartados em quantidades consideráveis por diversas indústrias, constitui
um perigo potencial para o ecossistema e para a saúde humana [16]. Os efeitos nos humanos
da intoxicação com cádmio, por exemplo, são sérios e provocam em muitos casos a elevação
da pressão sanguínea e problemas no rim e nos glóbulos vermelhos [17]. Na proteção dos
solos, revestimentos com camadas de argilas estão sendo usados como barreira de contenção
da migração destes metais tóxicos [18]. Diferentes tecnologias aparecem, também, descritas
na literatura, para a remoção de cádmio e chumbo e, como exemplos destas, aparece reportada
a precipitação química, a eletro-flutuação, a osmose reversa, a adsorção sobre carvão ativado
e a troca iônica [19].
1.3 Objetivos do trabalho
O presente trabalho foi projetado para avaliar a seletividade de um mineral natural
cristalino (clinoptilolita), como adsorvente, por metais de transição em solução aquosa a uma
concentração da solução externa de 0,005 eq/L e 303 K, através de reações de troca iônica
binárias e ternária, no equilíbrio. Este estudo compreendeu a construção das isotermas de
troca binárias e ternárias e a aplicação de modelos de interação iônica para a fase aquosa e
modelos da termodinâmica das soluções para a mistura sólida binária e multicomponente.
Assim, a interpretação fenomenológica dos parâmetros de interação binários obtidos através
da aplicação de modelos para a fase sólida e a relação entre as grandezas termodinâmicas e
parâmetros de interação calculados com propriedades intrínsecas dos cátions de troca
constituíram os caminhos para a quantificação da seletividade desta zeólita pelos diferentes
íons. Junto com isto, o estudo da variação dos coeficientes de atividade dos cátions e da
energia livre de Gibbs excesso de mistura (sólida) binária com a composição nesta fase
conformou um argumento sólido na interpretação da diferente seletividade de um adsorvente
dado por um ou outro cátion, ambos presentes em uma solução aquosa.
A comparação dos resultados obtidos a partir das diferentes alternativas de
interpretação aplicadas aos diferentes sistemas de troca em estudo, resultou na escolha de
formulações que são ou não adequadas no sentido da descrição (ajuste) e/ou predição do
A descrição do comportamento dos sistemas de troca multicomponente foi feita, numa
primeira tentativa, a partir da informação quantitativa (parâmetros e constantes) obtida ou
gerada pelos seus sistemas binários constituintes, quando aplicados diferentes modelos para a
fase adsorvente. Uma maneira alternativa de interpretar os dados de composição das fases
resultantes dos sistemas binários foi a partir da “adaptação” dos parâmetros ternários aos
dados binários mediante a aplicação de um mesmo modelo multicomponente para a fase
sólida.
Visando os objetivos centrais, o estudo foi desenvolvido nas seguintes etapas:
1. Purificação e caracterização do material adsorvente: o mineral de clinoptilolita.
2. Escolha dos cátions do estudo e preparação e análise das soluções eletrolíticas
iniciais.
3. Planejamento experimental dos equilíbrios de troca para cada sistema binário.
4. Construção e análise das isotermas das reações de troca iônica dos sistemas
binários, juntamente com a interpretação dos parâmetros de ajuste obtidos
mediante a aplicação de diferentes modelos. Comparação dos resultados
quantitativos em termos das propriedades termodinâmicas descritas, assim
como dos parâmetros de ajuste fenomenológicos para as diferentes reações
binárias.
5. Uso dos parâmetros de cada sistema binário independente como primeira
aproximação na interpretação do comportamento das composições dos sistemas
ternários na fase sólida mediante o uso de modelos adequados.
6. Aplicação de modelos multicomponentes que permitem a inclusão de termos
com parâmetros binários e termos com parâmetros multicomponentes.
Interpretação físico-química dos parâmetros de interação multicomponente.
7. Estabelecimento de uma série de seletividade de acordo com os resultados
obtidos para os sistemas de troca binários individuais e a partir dos parâmetros
obtidos para a troca multicomponente.
8. Discussão dos modelos e formulações multicomponentes usadas na descrição
REVISÃO BIBLIOGRÁFICA
Neste capítulo serão abordados tópicos relacionados com as estruturas e propriedades das zeólitas e, em específico, sobre a fase sólida deste estudo: a clinoptilolita. Por outro lado, serão tratados aspectos importantes relacionados com o estado da arte do equilíbrio de troca iônica entre uma solução eletrolítica e um adsorvente sólido do tipo zeólita.
2.1 Zeólitas: Estrutura e propriedades físico-químicas
2.1.1 Estrutura
Nesta seção não será feita uma descrição detalhada das estruturas das zeólitas (uma vez que aparece em obras muito referenciadas [20]), pretende-se apenas esboçar os fundamentos necessários para a compreensão dos aspectos físico-químicos em zeólitas.
A compreensão das propriedades das zeólitas, argilas e cristais porosos (adsorventes, trocadores iônicos, catalisadores, etc), necessita do conhecimento da estrutura cristalina destes materiais. Todas as suas propriedades estão intimamente relacionadas com a estrutura cristalina e morfologia.
As zeólitas são aluminosilicatos cristalinos cujas redes são formadas por tetraedros de 4
AlO− e SiO4, conectados de forma que cada átomo de oxigênio pertence a dois tetraedros e, de acordo com a regra de Lowestein [21], dois tetraedros de AlO4− não podem constituir vizinhos contíguos. Este fato implica que em uma zeólita a relação molar deve ser do tipo
(
Si Al/)
≥1. A carga negativa da rede aniônica Al− −O Si é compensada por cátionstrocáveis ou contra-íons que ocupam sítios específicos nas cavidades e canais da zeólita [22]. A composição geral das zeólitas pode ser representada mediante a fórmula: / ( 2( )) 2
m z m n m n
M Al Si O + ⋅qH O. Nesta representação, Mm z/ são os cátions trocáveis;
2( )
Existem diferentes classificações para as zeólitas. Assim, Breck [23] estabelece sete grupos de acordo com a unidade estrutural secundária (SBU) que conforma a rede cristalina. Por outro lado, Eberly [24] critica esta classificação e estabelece uma por grupos. Segundo esta classificação o Grupo da Heulandita (HEU) está constituído por: Heulandita, Clinoptilolita, Brewsterita, Stilbita, Stellerita e Barrerita.
Tabela 2.1. Composição química e propriedades físicas de algumas zeólitas.
Zeólita Composição da Cela Unitária Rede/Grupo espacial
Densidade 3 ( /g cm )
Porosidade 3 3 (cm /cm )
Analcima Na Al Si O16 16 32 96⋅16H O2
Cúbica 3
Ia d 1,85 0,18
Chabazita (Ca Na, 2 4) Al Si O12 24 72⋅40H O2 Trigonal 1,45 0,48 Faujazita (Ca Na, 2 4,5) Al Si O9 27 72⋅27H O2
Cúbica 3
Fd m 1,27 0,50
Heulandita Ca Al Si O4 8 28 72⋅24H O2
Monoclínica
C2/m 1,69 0,35
Zeólita A Na Al Si O12 12 12 48⋅27H O2
Cúbica 3
Fm c 1,27 0,47
MFI ZSM-5 Na Al Sin n 96−nO192⋅16H O2
Ortorrômbica
Pnma - 0,10
Mordenita Na Al Si O8 8 40 96⋅24H O2
Ortorrômbica
Cmcm 1,70 0,26
Tabela 2.2. Sistema de canais e parâmetros cristalinos. Entre parêntesis: quantidade de tetraedros que conformam os canais.
Zeólita Sistema de Canais
Abertura (Å) Direção
Parâmetros de Rede (Å)
Analcima 2,6 (6) ||(111) a=13, 7
Chabacita 3, 6 3, 7× (8) ||(010) a=13, 2 15,1 b= Faujacita 7,4 (12) ||(111) a=24, 67
Heulandita
4, 0 5, 5× 4, 7 7, 2× (8) (10) (8)
||(100) ||(001) ||(001) 17, 73 a= 17, 92 b= 7, 43 c=
LTA Zeólita A 4,1 ||(100) 24, 6a=
Mordenita
2.1.2 O mineral de clinoptilolita. Classificação, propriedades e estrutura
As tabelas 2.3 e 2.4 apresentam algumas propriedades da clinoptilolita, sua ocorrência, e principais aplicações.
As estruturas da clinoptilolita e da heulandita mostram diferenças nas suas estabilidades térmicas. Submetida a aquecimento entre 200-450oC, a heulandita passa por duas fases de contração antes de tornar-se amorfa, enquanto que a clinoptilolita pode reter sua integridade estrutural até 700oC, aproximadamente. Contudo, ambas são estruturalmente iguais.
A heulandita e a clinoptilolita são constituídas por redes tridimensionais de canais abertos possuindo cátions que compensam a carga negativa da rede gerada por átomos trivalentes através de ligações com átomos de oxigênio. Os canais estão definidos por anéis tetraédricos de 8 e 10 membros paralelos ao eixo a (canal C) e c (canais A e B), como aparece ilustrado na Figura 2.1. A imagem eletrônica de cristais de clinoptilolita mostrada na Figura 2.2 permite constatar a forma monoclínica dos cristais deste mineral.
Tabela 2.3. Propriedades físicas do mineral de clinoptilolita.
Cor Incolor, branco, rosa, amarelo, vermelho, verde e marrão claro. Brilho Vítreo a perolado.
Transparência Cristais de transparentes a transluzidos. Cristais Habituais Forma de blocos monoclínicos.
Fratura Desigual. Dureza 3,5-4 Peso Específico ~2,2 (leve)
Outras Adsorção de H2O; estabilidade térmica.
Minerais Associados
Calcita, Aragonita, Tenardita, Hectorita, Quartzo, Apofilita, Opal, Argilas, Pirita, Halita, Mordenita, Heulandita, Chabacita, Analcima, Erionita, Ferrierita, Dachiardita, Filipsita, boratos.
Ocorrência Geográfica
Tabela 2.4. Informação geral sobre o mineral de clinoptilolita.
Origem do Nome Do grego klino: “oblíquo”, ptylon: “pena”; lithos: “pedra”. Ocorrência Rochas de vidro vulcânico silícico.
Classe/ Subclasse Silicato/Tectosilicato Grupo Zeólitas Família Heulandita
Fórmula Química (Na, ,K Ca)4-6Al Al Si Si O6( , )4 26 7224H O2
Composição
K, 2,01%; K2O, 2,42%: Na, 2,36%; Na2O, 3,18%: Ca, 0,88%;
CaO, 1,23%: Al, 8,90%; Al2O3, 16,82%: Si, 27,79%; SiO2,
59,45%: H, 1,77%; H2O, 15,85%: O, 56,29%
Usos Filtro químico, absorvente, purificador de água, catalisador, etc
(a) (b)
(c) (d) (e)
Figura 2.1. Estrutura e anéis da clinoptilolita. (a): Vista topológica da rede ao longo do plano [001]; (b): no plano [010]; (c): anel de 10 membros: plano [001]; (d) e (e): anel de 8 membros: planos [001] e [100]. Canais: {[001] 10: 3,1 7,5× ; 8: 3,6 4,6× }; {[100]8:
Figura 2.2. Micrografia de cristais de clinoptilolita.
Os cátions de compensação de carga da estrutura cristalina são de importância vital nas propriedades de troca iônica. A posição detalhada dos cátions na estrutura HEU aparece descrita na literatura [22, 26] e existe hoje um volume grande de trabalhos relacionados ao tema. A cela unitária desta zeólita apresenta 4 posições catiônicas: M1, localizada no canal A
coordena 2 átomos de oxigênio e 5 moléculas de água; M2, localizada no canal B coordena 3
átomos de oxigênio e 5 moléculas de água; M3, posicionada no canal C coordena 6 átomos de
oxigênio e 3 moléculas de água; M4 no canal A [27].
A Figura 2.1 também mostra a estrutura tridimensional da clinoptilolita. Os parâmetros calculados para a cela desta estrutura são: a=17, 619, 17,805b= e c=7, 374Å. Os ângulos da cela unitária são: α =88, 311°, 116, 213°β = e γ =91,565° [28].
A capacidade de adsorção de uma zeólita está determinada pelo tamanho e forma das aberturas que controlam o acesso aos canais e cavidades, pelo tamanho das moléculas adsorvidas, pelo número, tamanho e posição dos cátions trocáveis que compensam a carga da rede aniônica e pela presença de defeitos estruturais.
Devido ao seu caráter inorgânico e cristalino, as zeólitas constituem matrizes de estruturas rígidas. Desta forma, seus parâmetros de rede e, portanto, seus volumes não mudam sensivelmente durante o processo de troca, como nos casos das resinas e argilas [30].
Na Tabela 2.5 aparecem listados os raios iônicos de alguns cátions trocáveis e as energias de hidratação associadas a cada espécie iônica.
Tabela 2.5. Raios cristalográficos, eletronegatividade e 0 , z s M G +
∆ de alguns cátions em solução.
Cátion Carga Raio Iônico (Å) Raio Atômico (Å) Eletronegatividade (Pauling) 0 , z s M G + ∆
(Kcal mol⋅ −1)
Cr 3+ 0,64 1,25 1,66 -263,36
Fe 2+, 3+ 0,82; 0,67 1,24 1,83 -262,15
Co 2+ 0,82 1,25 1,88 -134,70
Ni 2+ 0,69 1,25 1,91 -146,83
Cu 2+ 0,72 1,28 1,90 -143,92
Zn 2+ 0,83 1,33 1,65 -133,82
Ag 1+ 1,13 1,44 1,93 -123.69
Cd 2+ 0,95 1,49 1,69 -125,31
Pb 2+, 4+ 1,32; 0,84 1,75 2,33 -97,25
Na 1+ 0,98 1,90 0,93 -31,77
A energia livre de Gibbs de solvatação de um cátion vem definida por:
2 0
,
166, 027 1
0, 94 53,87 1 z
z s M
M
z
G z z
r ε
+
+
∆ = + − −
(2.1)
sendo rMz+ e z o raio e a carga do íon, respectivamente [31].
A capacidade máxima teórica CEC vem dada pela relação:
1 Al teor Av c N CEC
N ρV
= (2.2)
Aqui: NAl, número de átomos de alumínio por cela; NAv, número de Avogadro ( 1 mol− ); ρ, densidade da zeólita ( 3
g cm⋅ − ); Vc, volume da cela unitária ( 3
2.1.3 Monocristais de zeólitas do grupo da Heulandita: Refinamento mediante DRX
Yang e Armbruster [33] estudaram a estrutura de amostras de heulandita e clinoptilolita em diferentes formas homo-iônicas (Na-, K-, Rb- e Cs-) mediante difração de raios X em monocristais. O refinamento das estruturas de Na-, K- e Rb-heulandita foram feitas no grupo espacial monoclínico C2/m. As posições catiônicas gerais (II-1, C3 e B4) foram encontradas nas quatro amostras de heulandita estudadas.
Na Figura 2.3 aparece representado o modelo tetraédrico da estrutura HEU mostrando os canais A e B paralelos ao eixo c e o canal C de oito membros paralelo ao eixo a. “T” simboliza os tetraedros de silício e “O”, os átomos de oxigênio que ligam os tetraedros. Dois anéis de oito membros do canal B e dois anéis de oito membros no canal C da caixa I. Dois anéis de dez membros do canal A e dois anéis de oito membros do canal C da caixa II.
Figura 2.3. Modelo tetraédrico da heulandita homo-iônica. Projeção paralela ao plano (001), mostrando a distribuição dos cátions nos canais [33].
heulandita. Isto significa que uma posição catiônica no anel C é ideal para compensar a carga negativa sobre as paredes do anel. Conseqüentemente, o sítio C3 na heulandita homoiônica possui a maior população catiônica. O sítio A2 está situado perto de 2 O4× e 2 O6× . Este sítio só foi ocupado por Rb- e Cs-heulandita. Assim sendo, estes autores encontraram que as posições A2 são adequadas para cátions de maior tamanho (raio hidratado). O fenômeno da desordem catiônica observada por estes autores parece, segundo estes, ser o resultado de uma desordem Si, Al no interior da estrutura HEU governados pela interação dos cátions com a estrutura. Os sítios II-1 situam-se na caixa II e está constituído por dois anéis A e dois anéis C. Por outro lado, foi encontrada uma população catiônica no sítio II-1 em torno de 13-26%. Yan et al. [33] observaram também que, em geral, os cátions em II-1 manifestam uma fraca interação com a rede tetraédrica e mostraram parâmetros de deslocamento maiores. Um argumento similar foi sustentado para a posição A2.
Os quatro sítios principais de troca de Yang e Armbruster [33] na Cs-heulandita estão em conformidade com os resultados de Petrov et al. [34] e, a desordem nos sítios catiônicos justifica as conclusões de Smith et al. [35]. Os cátions Na+ nos sítios C3 e B4 ajustam-se à designação de Gunter et al. [26]. Estes autores concluíram que a Pb-heulandita apresenta um grupo espacial descentrado, em contraste com as formas natural e sódica desta zeólita. A causa deste tipo de grupo espacial (descentrado) não é compreendida ainda, mas esta pode ser devida a duas possibilidades: (1) A estrutura descentrada pode ser devida ao ordenamento Si,Al na rede da zeólita, onde os clusters Pb-H2O adotam uma simetria Cm. (2) A orientação
preferencial destes clusters nos canais da estrutura hóspede centrada é responsável pelo grupo espacial descentrado.
2.2 Principais elementos da termodinâmica das soluções
Na descrição termodinâmica de um sistema homogêneo α, é conveniente escrever a equação fundamental na forma de energia livre de Gibbs como:
G( )α =G( )α
(
T( )α ,P( )α ,n1( )α ,..., nn( )α)
com α =1, 2, ..., π (2.3)ou seja, como função da temperatura T( )α , da pressão P( )α e do número de moles ni( )α das n espécies presentes na fase α. Na forma de diferencial total se tem:
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) 1
, j , j , , j i
n
i
i i
P n T n T P n
G G G
dG dT dP dn
T α α P α α n α α α
α α α
α α α α
α α α
≠ = ∂ ∂ ∂ = + + ∂ ∂ ∂
∑
(2.4)(
)
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) 1 ( ) , , , ,..., j n P n GS T P n n
T α α
α
α α α α α
α
∂
= −
∂
(2.5)
(
)
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) 1 ( ) , , , ,..., j n T n GV T P n n
P α α
α
α α α α α
α
∂
=
∂
(2.6)
(
)
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) 1 ( ) , , , , ,..., j i i ni T P n
G
T P n n
n α α α
α
α α α α α
α µ
≠
∂
=
∂
(2.7)
As expressões 1, 2 e 3 representam a entropia, o volume e o potencial químico da espécie i na fase α. Por outro lado, a grandeza parcial molar de uma propriedade extensiva Μ numa fase α é definida por:
( ) ( ) ( ) ( )
( ) ( )
, , j i i i T P n
m
n α α α
α
α α
≠
∂Μ
≡
∂
(2.8)
( ) ( ) ( ) i i i
m n
α α α
Μ =
∑
(2.9)Assim, quando M( )α ≡G( )α se terá:
( ) ( ) ( ) ( )
( ) ( ) ( )
, , j i
i i
i T P n
G
g
n α α α
α α α α µ ≠ ∂ = = ∂
(2.10)
( ) ( ) ( ) i i i
Gα =
∑
gα nα ou ( ) i( ) i( ) igα =
∑
gα xα (2.11)Para um sistema composto por i componentes e π fases, resulta para a energia livre de Gibbs total e para o número total de moles:
( ) ( ) ( ) ( )
1 1 1
, n
i i i
i i
G G g n n n
π π
α α α α
α= α= = α
=
∑
=∑∑
=∑∑
(2.12)Tendo-se em conta que, no estado de equilíbrio, a segunda lei da termodinâmica estabelece que:
( )
( ) ( ) , , , , 0 i iT P n
i T P n
dG d g α nα
α
= =
∑∑
(2.13)então, no equilíbrio, se terá:
(1) (2) ( )
(1) (2) ( )
(1) (2) ( ) ...
...
... 1, 2,...,
i i i
T T T
P P P
i n
π π π
µ µ µ
= = =
= = =
= = = =
(2.14)
e, como a partir da Equação 2.4 pode-se obter que:
( )
( ) ( ) ( ) ( )
( ) ( )
( )
( ) ( )
, j , , j i
i
i i
T n T P n
V
v
P α α n α α α
α α α α α µ ≠ ∂ = ∂ = ∂ ∂
a partir da qual resulta:
( ) ( ) ( ) ( ) ( ) , ,
i i j
dµα =v αdPα T α nα Constantes (2.16)
Portanto, a partir de uma função V( ) V( )
(
T( ),P( ),ni( ),... nn( ))
α = α α α α α
, obtém-se vi( ) α
e, conseqüentemente, a função ( ) ( )
i gi
α α
µ = .
É usual, no tratamento das soluções substituir o potencial químico pela fugacidade a partir das definições:
( )
( ) ( )
( ) ˆ
ln i , i
d
d f T
RT α
α α
α µ
= =Constante (2.17)
e
( )
( ) ( ) 0
ˆ
lim i 1
P i f x P α α α → = , ( ) ( ) ( ) ( ) ˆ ˆ i i i f x P α α α α
φ ≡ (2.18)
onde φˆi( )α é o coeficiente de fugacidade do componente i em solução, na fase α.
A definição apresentada na Equação 2.17 tem como principal conseqüência, no equilíbrio, as relações:
(1) (2) ( )
(1) (2) ( )
(1) (2) ( ) ...
...
ˆ ˆ ... ˆ 1, 2,...,
i i i
T T T
P P P
f f f i n
π π π = = = = = = = = = = (2.19)
Com base na Equação 2.16, resulta para o cálculo da fugacidade:
( ) ( ) ( ) ( ) ˆ ln i i v dP d f RT α α α α
= T( )α ,n( )jα =Constantes (2.20)
sendo
( )
( ) ( ) ( ) 0ˆ
lim i i
P f x P
α α α
A Equação 2.20 resulta conveniente para o cálculo de fˆi( )α se
(
)
( ) ( ) ( ) ( ) ( ) , , ,...,
i i n
vα T α Pα nα nα for uma função conhecida. Quando este não é o caso, uma integração da Equação 2.17 entre um estado real da solução e um estado ideal resulta:
( ) ( ) id( )
id( ) ˆ ln ˆ i i i i f RT f α α α α
µ =µ + (2.22)
ou
( ) ( ) id( ) ( ) ( ) ln E
i i i i
g α =gα −g α =RT α γ α ,
( ) ( ) id( ) ˆ ˆ i i i f f α α α
γ ≡ (2.23)
onde giE( )α é a energia livre de Gibbs parcial molar excesso e γi( )α é o coeficiente de atividade do componente i na fase α. Aqui µid
i e id ˆ
i
f , dados pelas equações 2.22 e 2.23, mostram explicitamente como a definição de coeficiente de atividade depende do conceito de solução ideal. Através das equações 2.10 e 2.11 se terá:
( ) ( ) ( ) ( ) ( ) ( ) ( ) , , ln j i E i
i T P n
G
n RT α α α
α α α α γ ≠ ∂ =
∂ (2.24)
e
( )
( ) ( )
( ) ln
E i i i G x RT α α α
α =
∑
γ (2.25)As Equações 2.24 e 2.25 mostram a importância da função ( ) ( ) E G RT α
α para a termodinâmica das soluções.
2.2.1 A relação de Gibbs-Duhem
Diferenciando a Equação 2.10, junto com as definições dadas pelas equações 2.5, 2.6 e 2.7 e igualando este resultado à Equação 2.4, sendo gi( )α =µi( )α , resulta a relação:
( ) ( ) ( ) ( ) ( ) ( )
- i i 0
i
Esta equação é a conhecida relação de Gibbs-Duhem, particularmente útil nos processos a temperatura e pressão constante, quando pode ser escrita como:
( ) ( ) ( ) ( )
0 ( , constante)
i i
i
xα dµ α = T α Pα =
∑
(2.27)Na seqüência do texto, para aliviar a notação, será omitido o índice α relativo à fase. Será retomado, em momento oportuno quando se fizer necessário.
2.3 Misturas líquidas não eletrolíticas
Nesta seção não será indicada a fase líquida sobre os símbolos das grandezas e variáveis, por exemplo: xi em lugar de xi( )α , para a fração molar, sendo ( )α =( )L . Em seções posteriores retoma-se a simbologia especificando a fase e a convenção da grandeza.
A energia livre de Gibbs excesso GE, como todas as propriedades termodinâmicas, é em geral uma função da temperatura, pressão e composição da mistura; contudo, a dependência de GE com a pressão para as misturas líquidas fora das condições críticas é geralmente pequena, assim sendo, é freqüentemente ignorada. Desta forma, normalmente é assumido que:
(
, ,...1)
E E
n
G =G T n n ou gE =gE
(
T x, ,...1 xn)
(2.28)Para muitas aplicações, a dependência de gE com a composição constitui o problema de maior interesse, como por exemplo, no cálculo do coeficiente de atividade de qualquer espécie i na fase líquida, como mostrado na Equação 2.24.
2.3.1 Misturas líquidas binárias
Para as misturas binárias, é conveniente escolher como variável de correlação dependente a função g≡gE /x x RT1 2 =g( , )T x1 . Dada uma expressão para a dependência de
(
)
21 2 1 1
lnγ =x g+x dg/dx (2.29)
lnγ2 =x12
(
g -x d2 g/dx1)
(2.30)A função g é bem comportada, variando suavemente desde g(0)=lnγ1∞ para x1=0 até
2 (1)=lnγ∞
g em x1 =1. A aproximação mais simples para representar dados experimentais de
1 2 ( , ,T x x )
g é via expressões polinomiais na fração molar. Considerando os polinômios como séries truncadas de g, seleciona-se um número de termos para uma das expansões seguintes:
2 3
0 1 1 2 1 3 1
α α x α x α x ...
= + + + +
g (2.31)
g=β β0+ 1 2x +β2x22+β3 2x3+... (2.32)
g=a0+a x1( 1−x2)+α2(x1−x2)2+a x3( 1−x2)3+... (2.33)
21 1 12 2 ( 21 1 12 2) 1 2 ... A x A x B x B x x x
= + − + +
g (2.34)
As equações 2.33 e 2.34 (expansão de Redlich/Kister e de Margules, respectivamente) possuem vantagens de interpretação, o que as torna mais atrativas.
A inspeção da Equação 2.34 revela que:
g(0)=lnγ1∞ = A12 (2.35)
2 21 (1)=lnγ∞ = A
g (2.36)
Se na Equação 2.34 são mantidos apenas os dois primeiros termos, então é obtida a equação de Margules de dois parâmetros, para a qual g= A x21 1+A x12 2, ou
21 1 12 2 1 2
( )
E g
A x A x x x
RT = + (2.37)
As expressões correspondentes para os coeficientes de atividade dos componentes são:
[
]
2
1 2 12 21 12 1
lnγ =x A +2(A −A )x (2.38)
[
]
2
2 1 21 12 21 2
lnγ =x A +2(A −A )x (2.39)
Para uma mistura em conformidade com Equação 2.37, g é uma função linear de x1. Se nesta equação os parâmetros são iguais (A21 =A12 =A), então g é independente de x1, obtendo-se assim a equação de Porter dada por:
1 2 E
g
Ax x
RT = (2.40)
Nesta expressão:
2
1 2
lnγ = Ax (2.41)
2
2 1
lnγ = Ax (2.42)
21 1 12 2 1 2 A x A x Bx x
= + −
g (2.43)
Se a função g( , )T x1 mostra mudança no sinal da curvatura, então se faz necessária uma equação com quatro parâmetros.
Em principio, pode-se acomodar uma variedade de sutilezas mediante a inclusão de um número suficiente de termos numa representação polinomial de g. Um perigo particular quando usado um número grande de termos é que a correlação pode ser severamente distorcida com relação aos dados, gerando uma representação de g suave, porem fisicamente absurda e, conseqüentemente, dos coeficientes de atividade envolvidos. Uma boa regra aqui é “parar em quatro”: Se mais de quatro termos são requeridos para uma representação polinomial de g, então resulta mais sensato considerar outros métodos de correlação.
Uma alternativa para g( , )T x1 é oferecida através da expansão:
' ' ' '
1 2 12 1 21 2 12 1 21 2 1 2
' ' ' '
12 21 12 21 1
... E
RTx x A x A x B x B x
x x
g A A B B
+ +
= = − +
g (2.44)
A Equação 2.44 é a chamada de expansão de Van Laar. Nesta expressão, os parâmetros '
12 A e '
21
A são interpretados de forma similar a A12 e A21 na expansão de Margules (Equação 2.34). Independentemente do número de termos dentro da Equação 2.44, são válidas as relações:
g(0)=lnγ1∞ = A12' (2.45)
' 2 21 (1)=lnγ∞ = A
g (2.46)
A equação de Van Laar geralmente usada é a expansão truncada em dois parâmetros, para a qual:
' ' 12 21 1 2
' '
12 1 21 2 E
A A x x g
RT = A x +A x (2.47)

![Figura 2.4. Diferentes formas trocadas da heulandita. Projeções ao longo do plano [001]: (a) heulandita não trocada; (b) Na-heulandita; (c) Pb-heulandita [26]](https://thumb-eu.123doks.com/thumbv2/123dok_br/18604963.382962/31.892.203.734.810.1100/figura-diferentes-trocadas-heulandita-projeções-heulandita-heulandita-heulandita.webp)
![Figura 2.7. Diagrama ternário. Superimposição de segmentos distorcidos da fase solução sobre a fase sólida [68]](https://thumb-eu.123doks.com/thumbv2/123dok_br/18604963.382962/65.892.171.781.738.1011/figura-diagrama-ternário-superimposição-segmentos-distorcidos-solução-sólida.webp)