Desenvolvimento de metodologia analítica baseada em eletrodo de carbono vítreo
modificado com filme de bismuto: Aplicação em águas de chuva de regiões de Santa
Catarina
Ms. Marcel Silveira dos Santos*, Joyce Nunes Bianchin e Dr. Almir Spinelli
Departamento de Química, Universidade Federal de Santa Catarina, Florianópolis, SC 88040-900, Brasil.
e-mail para contato: silveiramarcel23@gmail.com
Resumo
______________________________________________________________________________
Neste estudo foi desenvolvida uma metodologia analítica para determinação de 2,4-dinitrofenol (2,4-DNP) em amostras de águas de chuva de regiões de Santa Catarina utilizando a voltametria de onda quadrada (VOQ) e de forma ex situ. O estudo envolveu a aplicabilidade de
utilizar o eletrodo de carbono vítreo modificado com filme de bismuto. A formação do filme de bismuto foi otimizada por voltametria cíclica e em seguida, estudos de pH e eletrólito de suporte foram investigados para a redução do 2,4-DNP. Os parâmetros analíticos que afetam a sensibilidade da VOQ foram otimizados. Na sequência, as figuras analíticas de mérito foram obtidas: faixa linear de trabalho de 3,2 x 10-7 – 4,6 x 10-6 mol L-1, coeficiente de correlação de 0,996, RSD% = 17,5 (1,3 x 10-6 mol L-1,
n = 6), 11,7 (2,5 x 10-6 mol L-1, n = 6) e 6,4 ( 4,5 x 10-6
mol L-1, n = 6), limite de detecção de 1,2 x 10-7 mol L-1. E, finalmente estudos de recuperação
WWW.SCIELO.BR/EQ
foram realizados para avaliar a exatidão da metodologia. Valores obtidos ficaram entre 84-112% (2,5 x 10-6 mol L-1) e 89 – 113% (4,5 x 10-6 mol L-1).
Palavras-chave: Voltametria; Filme de Bismuto; Eletrodo Modificado; 2,4-DNP
1. Introdução
Compostos aromáticos contendo substituintes nitro são compostos amplamente conhecidos, os quais são comumente utilizados na indústria petrolífera, têxtil, farmacêutica, de celulose, de inseticida e também na manufaturação de explosivos. Estes compostos são intermediários importantes na indústria de produtos químicos. Entre os compostos orgânicos, os nitrocompostos aromáticos estão entre as substâncias mais tóxicas encontradas no meio-ambiente. A elevada toxicidade dos nitrocompostos em geral, e os nitro-aromáticos em particular é de especial preocupação. O potencial de propagação destes compostos no meio ambiente através da lixiviação e infiltração a partir do lixo industrial em fontes de água leva a sérios efeitos deletérios sobre os humanos, organismos aquáticos e outras formas de vida [1,4].
Os nitrofenóis (NP) têm sido designados como poluentes prioritários por muitos países devido a sua toxicidade aguda e longa persistência no ambiente [5]. A Agência de Proteção Ambiental dos Estados Unidos (EPA) considera os nitrofenóis como substâncias nocivas à qualidade da água, incluindo o 2,4-dinitrofenol. A Comunidade Européia fixou a concentração máxima admissível destes compostos em água potável em até 10 µg L-1, e para águas de rios uma concentração máxima de 70 µg L-1 [6,7]. Não obstante, os nitrofenóis são um dos grupos orgânicos mais abundantes em águas de chuva [8,9]. Sendo assim, causa preocupação devido as suas propriedades fitotóxicas como agentes de desacoplamento da fosforilação oxidativa combinada com a sua capacidade de penetrar em tecidos vegetais [10,11]. Consequentemente, os nitrofenóis poderiam dar uma contribuição substancial para o declínio de áreas arborizadas em áreas poluídas [12]. A deposição de nitrofenóis da atmosfera para as águas superficiais é outro grave problema devido aos organismos aquáticos [13].
geralmente realizada por técnicas cromatográficas e espectroscópicas [15,16]. Várias técnicas eletroanalíticas têm sido aplicadas também para estes compostos: polarografia, voltametria cíclica (VC), voltametria de pulso diferencial (VPD) e voltametria de onda quadrada (VOQ) [17-20].
Eletrodos de carbono vítreo [21] e pasta de carbono [22] têm sido aplicados na redução eletroquímica de nitrofenóis. Um filme que vem se destacando para a construção de eletrodos modificados é o filme de bismuto. Wang et al. introduziram o eletrodo de filme de bismuto em
2000 (BiFE) representando uma alternativa muito atrativa em relação ao eletrodo de mercúrio [23]; demonstrando que os filmes de bismuto se depositam em vários tipos de superfícies de eletrodos, fornecendo sinal analítico com excelente resolução e reprodutibilidade para metais. Entre eles, zinco, cádmio, níquel, alumínio, urânio e cobalto [24-29]. O filme de bismuto também é aplicável aos compostos orgânicos, tais como os nitrocompostos sendo determinados por voltametria de pulso diferencial e amperometria [30]. Os eletrodos de filme de bismuto também são menos propensos a interferências pelo oxigênio dissolvidos em soluções não-desaeradas. A janela de potencial de todos os eletrodos de bismuto está na faixa de -1,3 a -0,2 V [23,31].
Neste trabalho, desenvolveu-se uma metodologia analítica baseada em eletrodo de carbono vítreo modificado com filme de bismuto para determinação de 2,4-dinitrofenol em águas de chuva de regiões de Santa Catarina por voltametria de onda quadrada. O comportamento da redução eletroquímica foi investigado através da voltametria cíclica.
2. Experimental
2.1. Instrumentação
quadrada foram obtidos em uma célula eletroquímica de 30 mL contendo três eletrodos, a saber: eletrodo de trabalho de carbono vítreo (CV) modificado com filme de bismuto, eletrodo de referência Ag/AgCl e um eletrodo auxiliar de platina. Outra célula de 20 mL foi utilizada para a formação do filme de bismuto; foram utilizados os mesmos eletrodos citados anteriormente. Um pHmetro (Mettler Toledo 320), banho de ultra-som (Ultra Cleaner 1450), e agitador magnético (MQAMA 301) também foram utilizados.
2.2. Reagente e soluções
Foram utilizados reagentes de grau analítico. Ácido bórico (Nuclear, Diadema, SP, Brasil), ácido orto-fosfórico (Nuclear) e ácido acético glacial (Nuclear) para formar o tampão Britton-Robinson 0,04 mol L-1. Ácido cítrico (Labsynth, Diadema, SP, Brasil) e citrato de sódio (Nuclear) para formar tampão citrato 0,05 mol L-1. Monohidrogenofosfato de sódio e dihidrogenofosfato de sódio (F. Maia, Cotia, SP, Brasil) para formar tampão 0,1 mol L-1. Ácido acético (Nuclear) e acetato de sódio (Labsynth) para formar tampão 0,05 mol L-1. Hidróxido de sódio 1 mol L-1 (Nuclear) e 1 mol L-1 ácido orto-fosfórico (Nuclear) foram utilizados para ajustes de pH.
O 2,4-dinitrofenol (2,4-DNP) foi obtido da Supelco (Bellefonte, PA, USA). Uma solução estoque de 2000 mg L-1 de 2,4-DNP foi preparada em metanol (Tedia, Fairfield, OH, USA). Uma solução de 1000 mg L-1 de nitrato de bismuto pentahidratado (F. Maia) foi preparado em ácido nítrico (Nuclear) 5% (m/m).
As águas de chuva na região oeste (Joaçaba), região centro-oeste (Lages), região sul (Criciúma) e região litorânea (Florianópolis) do Estado de Santa Catarina foram coletadas durante o mês de junho. Em Lages foram coletadas duas amostras, a saber: nas proximidades de uma indústria de papel e de um bairro distante de algum parque industrial. A coleta foi realizada nos primeiros 20 minutos de chuva e as amostras estocadas a -6ºC.
2.4. Preparação do BiFE e redução do 2,4-dinitrofenol
A superfície do eletrodo de carbono vítreo foi polida com alumina, lavada e sonificada por 40 segundos em metanol entre cada etapa. O filme de bismuto foi depositado ex situ sobre o
eletrodo de carbono vítreo. A formação do filme foi realizada em uma célula eletroquímica contendo 10 mL de tampão acetato 0,05 M na presença de oxigênio dissolvido, contendo 15 mg L-1 de íons Bi (III). A velocidade de agitação magnética utilizada foi de 200 RPM em todas as análises. O potencial e tempo de deposição foram de -500 mV e 120 segundos, respectivamente. A limpeza do eletrodo de CV modificado foi realizada por agitação de 300 RPM por 20 segundos.
A redução do 2,4-dinitrofenol foi realizada em uma célula de volume de 30 mL contendo 20 mL de uma solução tampão Britton-Robinson 0,04 mol L-1 (pH 3). A solução foi purgada com nitrogênio por 8 minutos em todas as análises. Todas as análises foram realizadas em duplicata.
3. Resultados
Devido à crescente necessidade de identificação e quantificação de analitos de forma rápida, específica e em quantidades de amostras pequenas, os eletrodos quimicamente modificados foram desenvolvidos. Comparado a eletrodos convencionais, maior controle de característica do eletrodo e reatividade são alcançadas através destas modificações na superfície. Estes eletrodos modificados originam frequentemente sinais de corrente mais elevadas do que na ausência do modificador [32].
Inicialmente foi avaliado o desempenho do eletrodo de carbono vítreo sem o filme de bismuto e modificando a superfície do carbono vítreo com filme de bismuto sem otimizar os parâmetros para tal.
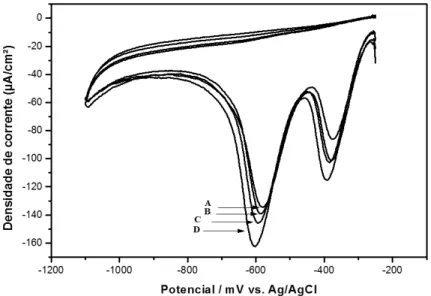
Fig. 1. Voltamogramas cíclicos da redução do 2,4-DNP (fortificação de 2 x 10-4 mol L-1). Onde
(A) é a curva do eletrodo de CV não-modificado e (B) com modificação. Voltametria cíclica: taxa de varedura: 40 mV s-1, incremento de varredura: 2 mV, potencial inicial e final: -250 mV, potencial de varredura reversa: -1,1 V.
As correntes obtidas para o primeiro pico para o eletrodo de CV sem e com modificação foram de -108,4 µA cm-2 e -122, 9 µA cm-2, respectivamente. Para o segundo pico, sem e com modificação, foram de -148,8 µA cm-2 e 185,8 µA cm-2, respectivamente. Observa-se também um leve deslocamento do potencial de redução do 2,4-DNP. Os resultados demonstram que a modificação da superfície do eletrodo de carbono vítreo com o filme de bismuto aumenta a sensibilidade da metodologia a ser aplicada.
3.3. Seleção do eletrólito de suporte para a formação do filme de bismuto
Um parâmetro importante sobre a resposta eletroanalítica é o eletrólito suporte, pois este influencia diretamente na intensidade da corrente de pico. O eletrólito de suporte pode modificar a termodinâmica e a cinética do processo eletródico, bem como o transporte de massa na célula. A escolha do eletrólito de suporte deve levar em conta a natureza do substrato empregado como eletrodo, bem como a natureza da investigação a ser realizada [33].
Neste estudo foram investigadas quatro soluções como eletrólito de suporte, a saber: tampão fosfato 0,1 mol L-1, ácido clorídrico 0,1 mol L-1, tampão citrato 0,05 mol L-1 e tampão acetato 0,05 mol L-1.
citrato 0,05 M. A ordem de sequência da intensidade de corrente para os diferentes eletrólitos de suporte testados foram iguais nos dois picos de redução.
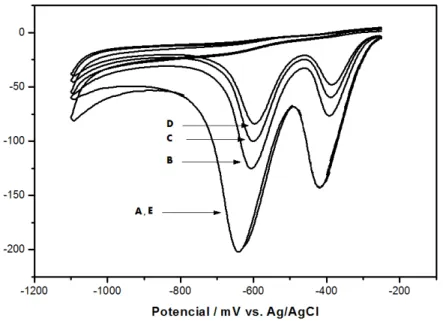
Fig. 2. Voltamogramas cíclicos da redução do 2,4-DNP utilizando eletrodo de carbono vítreo
modificado com filme de bismuto. Taxa de varredura: 40 mV s-1, incremento de varredura: 2 mV, potencial inicial e final: -250 mV, potencial de varredura reversa: -1,1 V. Onde a curva (A) é a curva do tampão fosfato 0,1 M, (B) ácido clorídrico 0,1 M, (C) tampão citrato 0,05 M e (D) tampão acetato 0,05 M. Fortificação de 2 x 10-4 mol L-1 de 2,4-DNP.
A sequência da intensidade obtida foi: tampão fosfato 0,1 M < ácido clorídrico 0,1 M < tampão citrato 0,05 M < tampão acetato 0,05 M. O melhor resultado obtido foi com a utilização do tampão acetato 0,05 M, logo, este foi selecionado para estudos posteriores.
3.4. Potencial e tempo de deposição do BiFE
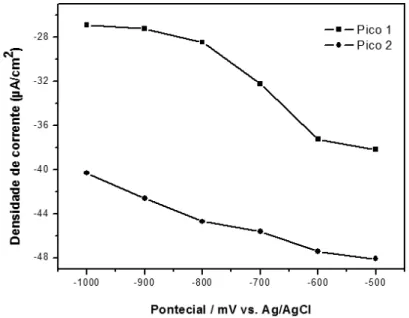
O efeito do potencial e tempo de deposição do BiFE foi avaliado utilizando a coulometria de potencial controlado. A Fig. 3 exibe o gráfico das densidades de corrente obtidas versus o potencial aplicado para os dois picos de redução. A formação do filme foi feita com 10 mL da solução tampão acetato 0,05 mol L-1 com 15 mg L-1 de íons Bi (III) e 60 segundos de deposição. A redução do 2,4-DNP foi realizada com a voltametria cíclica: taxa de varredura 40 mV s-1, incremento de varredura 2 mV, potencial inicial e final -250 mV, potencial de varredura reversa de -1,1 V. A intensidade do sinal analítico aumenta em todos os pontos para os 2 picos de redução. Há uma queda abrupta de -800 mV a -600 mV para o primeiro pico, comportamento não observado para o segundo pico. Também foi observado uma melhora na resolução do sinal em potenciais mais positivos que -800 mV. Logo, o potencial de -500 mV foi selecionado para estudar a influência do tempo de deposição.
Fig. 3. Comportamento da densidade de corrente em função do potencial de deposição. Redução
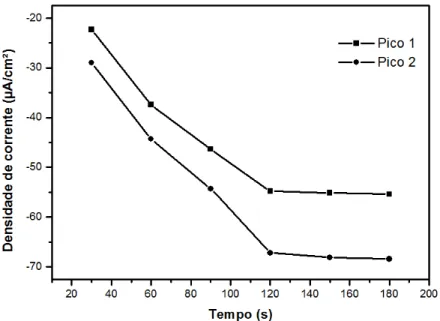
Fig. 4. Comportamento da densidade de corrente em função do tempo de deposição. Redução em
tampão BR 0,04 M. Fortificação de 1 x 10-4 mol L-1de 2,4-DNP.
De acordo com a Fig. 4, o tempo de deposição influencia na deposição do filme de bismuto na superfície do eletrodo de CV. A faixa estudada foi de 30 a 180 segundos. Há um aumento na densidade de corrente no intervalo de 30 a 120 segundos. Após os 120 segundos não há ganho de resposta, indicando que o equilíbrio foi atingido. Para demais estudos o tempo de 120 segundos foi selecionado.
3.5. Efeito do pH na redução do 2,4-DNP
Estudos anteriores sobre as propriedades eletroquímicas de compostos nitroaromáticos substituídos demonstraram que, o eletrodo em meio acidificado, os compostos nitroaromáticos são reduzidos em um processo envolvendo 4 elétrons e 4 prótons à hidroxilamina em 2 etapas:
R-NO2 + e- R-NO2- (Lenta)
R-NO2- + 3e- + 4H+ R-NHOH + H2O (Rápida)
De acordo com a etapa mais rápida da reação, a concentração de íons hidrogênio afeta a taxa de reação [35]. Já que a redução do grupo nitro envolve a protonação deste grupo. Portanto, é natural não observar picos de redução em valores próximos de pH 10. A Fig. 5 mostra o comportamento da densidade de corrente de pico em função do pH. O comportamento eletroquímico foi similar tanto para o pico 1 e para o pico 2. Ao longo do aumento do pH a resposta diminui até chegar ao pH 9. Para demais experimentos, o pH 3 foi selecionado.
3.6. Natureza do processo eletródico
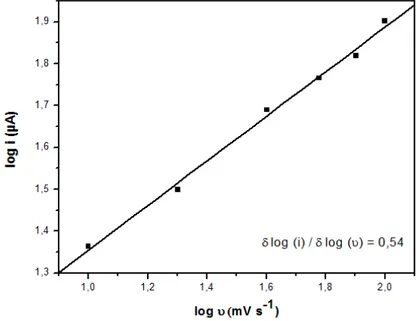
Dois critérios foram usados para estudar a natureza do processo eletródico sobre a superfície do eletrodo de CV modificado. São as análises das curvas log i em função de log v e i em função de v1/2. As Figuras 6 e 7 mostram esses gráficos para o 2,4-DNP (1 x 10-4 mol L-1). A redução foi realizada por voltametria cíclica com os seguintes parâmetros: incremento de varredura de 2 mV, potencial inicial e final de -250 V, potencial de varredura reversa de -1,1 V, tampão BR (pH 3). Velocidade variando de 10 mV s-1 a 100 mV s-1.
Fig. 6. Variação de log i com log v para 2,4-DNP (1 x 10-4 mol L-1).
processo de transporte de massa é controlado difusionalmente. Este resultado está de acordo com o estudo realizado por Smyth et al., 2004 [36].
Fig. 7. Variação de i com v1/2 para 2,4-DNP (1 x 10-4 mol L-1).
Após as otimizações um estudo sobre a limpeza do eletrodo foi realizado. A Fig. 8 exibe os resultados obtidos. O teste foi feito com a formação do filme otimizado: -500 mV e 120 segundos. Redução do 2,4-DNP em tampão BR 0,04 M, pH 3. Taxa de varredura 40 mV s-1, incremento de varredura de 2 mV, potencial inicial e final de -250 mV, potencial de varredura reversa de -1,1 V. A fortificação foi de 2 x 10-4 mol L-1.
Fig. 8. Voltamogramas cíclicos do estudo da limpeza do eletrodo. (A) corrida 1, (B), (C) e (D)
corrida 2, 3 e 4, respectivamente, sem a limpeza do eletrodo. (E) corrida após a agitação da solução por 300 RPM por 20 seg.
superfície do filme de bismuto. Para demais estudos, um único filme foi formado para cada otimização dos parâmetros de onda quadrada após a agitação da solução por 20 segundos a 300 RPM.
3.8. Parâmetros da voltametria de onda quadrada
Foi realizado o estudo dos parâmetros da VOQ, como frequência (f), altura de pulso ( H;
a = H/2) e incremento de varredura de potencial ( Es), buscando o maior sinal analítico do
eletrodo modificado com filme de bismuto.
3.8.1. Efeito do incremento de varredura de potencial
O efeito do incremento de varredura de potencial ( Es) foi estudado no intervalo de 1 a 6
mV em solução de tampão BR 0,04 M, pH 3, H de 25 mV, frequência de de 40 Hz e 1,5 x 10
-5 mol L-1 de2,4-DNP. Os resultados obtidos estão mostrados na Fig. 9.
Fig. 9. Efeito do incremento de varredura na densidade de corrente da redução de 1,5 x 10-5 mol
L-1 de 2,4-DNP. Frequência de 40 Hz e altura de pulso de 25 mV. Onde curva (A) é igual a 1 mV; (B) 2 mV; (C) 4 mV, (D) 6 mV.
3.8.2. Efeito da altura de pulso
O efeito da altura de pulso ( H) foi estudado no intervalo de 5 a 70 mV. Os resultados obtidos estão mostrados na Fig. 10.
Fig. 10. Efeito da altura de pulso na densidade de corrente da redução de 1,5 x 10-5 mol L-1 de
2,4-DNP. Frequência de 40 Hz e incremento de 2 mV.
3.8.3. Efeito da frequência
A frequência da onda quadrada é uma dos parâmetros mais importantes a ser analisado, pois determina a intensidade dos sinais, o que consequentemente, reflete diretamente na sensibilidade do método [38].
2,4-Fig. 11. Efeito da frequência na densidade de corrente da redução de 1,5 x 10-5 mol L-1 de
2,4-DNP. Altura de pulso de 40 mV e incremento de 2 mV. Onde (A), (B), (C), (D), (E), (F) e (G) representam a frequência de 10; 25; 40; 55; 70; 85 e 100 Hz, respectivamente.
O aumento da frequência até 100 Hz não prejudicou a resolução do primeiro pico. Para o segundo pico uma frequência acima de 55 Hz prejudica a resolução do sinal analítico. A frequência de 100 Hz foi selecionada.
A Tabela 1 abaixo resume a otimização dos parâmetros da voltametria de onda quadrada para o pico 1 (potencial mais positivo).
Tabela 1. Otimização dos parâmetros da voltametria de onda quadrada para o pico 1.
Parâmetro Faixa Maior resposta
Incremento (mV) 1 - 6 2
Altura de pulso (mV) 5 - 70 40
3.9. Figuras analíticas de mérito
A otimização da voltametria de onda quadrada foi voltada ao pico 1 pela melhor resolução alcançada. Após as otimizações as figuras analíticas de mérito foram obtidas através da curva de calibração realizada em água destilada. Os resultados estão apresentados na Tabela 2. O limite de detecção foi calculado como sendo 3 vezes a estimativa do desvio do coeficiente linear dividido pela inclinação da curva de calibração.
Tabela 2. Figuras analíticas de mérito obtidas na metodologia.
afortificação de 1,3 x 10-6 mol L-1, b2,5 x 10-6 mol L-1, c4,5 x 10-6 mol L-1.
Considerando a ausência de uma etapa de pré-concentração, ótimo limite de detecção de 1,3 x 10-7 mol L-1 foi obtido para a metodologia, valor bem abaixo do valor máximo admissível de 2,4-DNP em rios que a Comunidade Européia permite. Fischer et al., 2007 encontraram um limite de detecção duas vezes vezes mais alto para o 2,4-DNP em água potável utilizando eletrodo de mercúrio modificado com amálgama sólida de prata [39]. Satisfatórias precisões foram obtidas, calculadas como desvio padrão relativo de seis medidas sequenciais a 1,3 x 10-6 Faixa linear (mol L-1) 3,2 x 10-7 – 4,6 x 10-6
Coeficiente de correlação 0,996
Limite de detecção (mol L-1) 1,2 x 10-7
Um estudo de recuperação também foi realizado para verificar a exatidão da metodologia proposta. Para isso, a solução tampão BR 0,04 M foi preparada com as amostras de chuva coletadas e fortificadas com 2,5 x 10-6 mol L-1 e 4,5 x 10-6 mol L-1. A Tabela 3 exibe os resultados obtidos.
Tabela 3. Valores de recuperação paras as 5 amostras de água de chuva.
Amostras a Recuperação %, n = 3 b Recuperação %, n = 3
Amostra 1 107 9,5 113 6,3
Amostra 2 89 8,4 96 4,4
Amostra 3 112 8,4 108 3,8
Amostra 4 84 9,2 89 4,6
Amostra 5 102 7,2 109 4,9
a fortificado com 2,5 x 10-6 mol L-1, b fortificado com 4,5 x 10-6 mol L-1.
Onde a amostra 1 é água de chuva aos arredores de industria de celulose (Lages). Amostra 2 é água de chuva de um bairro distante de parque industrial (Lages). Amostra 3 é a coleta de um bairro de Criciúma. Amostra 4 é a coleta de um bairro de Joaçaba. Amostra 5 é a coleta de um bairro de Florianópolis. Isso representa amostras de quatro regiões diferentes do estado de Santa Catarina.
A metodologia proposta envolvendo modificação do eletrodo de carbono vítreo com filme de bismuto e determinação por voltametria de onda quadrada mostrou ser rápida, simples e com satisfatória sensibilidade, obtendo limite de detecção a nível traço. Todas as otimizações foram realizadas com sucesso, obtendo-se o aumento de sensibilidade desejado. Uma grande vantagem da metodologia foi a limpeza do eletrodo apenas por agitação, sendo assim, poupando o tempo que seria necessário para a formação de um filme novo. Um vasto campo de aplicações do filme de bismuto ainda deverá ser explorado, já que se trata de uma tecnologia recente com apenas uma década de existência.
Agradecimentos
Ao Laboratório de Grupo de Estudos Eletroquímicos e Eletroanalíticos.
Ao CNPq pelo apoio financeiro.
Referências Bibliográficas
[1] Y. Ni, L. Wang, S. Kokot. Anal. Chim. Acta 431 (2001) 101.
[2] L. E. Hallas, M. Alexander. Appl. Environ. Microbiol 45 (1983) 1234. [3] M. J. Christophersen, T. J. Cardwell. Anal. Chim. Acta 323 (1996) 39. [4] X. Lu, S. Yuan, M. Tian, Y. J. Cui. J. Hazard. Mater.137 (2006) 573. [5] S. Lacorte, I. Guiffard, D. Fraiss, D. Barceló. Anal. Chem. 72 (2000) 1430. [6] 4-Nitrophenol, Health and Environmental Effects Profile No. 135, U.S.
[8] D. Grosjean. Sci. Total Environ. 100 (1991) 367. [9] W. Schüssler, L. Nischke. Chemosphere 42 (2001) 277.
[10] P. J. Shea, J. B. Weber, M. R. Overcash. Residue Reviews 87 (1983) 1.
[11] M. Natangelo, S. Mangiapan, R. Bagnati, E. Benfenati, R. Fanelli. Chemosphere 38 (1999) 1495.
[12] L. W. Blank. A new type of forest decline in Germany. Nature 314 (1985) 311.
[13] G. E. Howe, L. L. Marking, T. D. Bills, J. J. Rach, F. L. Mayer. Environ. Toxicol. Chem. 13 (1994) 51.
[14] P. Caizares, C. Sez, J. Lobato, M. A. Rodrigo. Ind. Eng. Chem. Res. 43 (2004) p. 1944. [15] P. A. Realini. J. Chromatogr. Sci. 19 (1981) 124.
[16] E. Pocurrull, R. M. Marcé, F. Borrul, J. L. Bernal, L. Toribio, M. L. Serna. J.
Chromatogr. A (1996) 755 67.
[17] M. Zietek. Mikrochim. Acta 64 (1975) 463.
[18] J. Barek, H. Ebertova, V. Mejstrik, J. Zima. Collect. Czech. Chem. Commun. 59 (1994)
1761.
[19] L. Hernández, P. Hernández, J. Vicente. Fresenius J. Anal. Chem. 345 (1993) 712.
[20] I. N. Rodríguez, J. A. M. Leyva, H. Cisernos, J. L. Hidalgo. Anal. Chim. Acta 344 (1997) 167.
[21] T. Mccreedy, P. R. Fielden. Analyst 120 (1995) 2343.
[22] M. Cordero-Rando, M. Zamoro-Barea, J. B. Salvador, I. N. Rodríguez, J. A. Leyva, H. L. H. H. Cisernos. Mikrochim. Acta 132 (1999) 7.
[23] Wang, J.; Lu, J.; Hocevar, S. B.; Farias, P. A. M. Anal. Chem. 72 (2000) 3218.
[24] E. A. Hutton, S. B. Hocevar, L. Mauko, B. Ogorevc. Anal. Chim. Acta 580 (2006) 244. [25] J. Wang, J. Lu. Electrochem. Commun. 2, (2000) 390.
[26] G. Kefala, A. Economou, A. Voulgarropoulos. Electroanalysis, 18 (2006) 223. [27] G. Kefala, A. Economou, M. Sofoniou. Talanta. 68(2006) 1013
[28] A. Krolicka, A. Bobrowski, K. Kalcher, J. Mocak, I. Svancara, K. Vytras. Electroanalysis,15 (2003) 1859.
[29] A. Krolicka, A. Bobrowski. Electrochem. Commun. 6 (2004) 99. [30] O. Mikkelsen, K. H. Schroder. Anal. Lett. 33 (2000) 3253.
[32] Z. B. Vendrame. Eletrodos modificados e não modificados na determinação de compostos sulfurados – Um estudo comparativo. Tese de Doutorado em Química Analítica, Universidade Federal de Santa Maria, UFSM, Santa Maria, 2004.
[33] S. M. L. Agostinho, R. F. V. Villamil, A. Agostinho-Neto, H. Aranha. Quim. Nova 27 (2004) 813.
[34] A. M. O. Brett, M. A. Brett. Eletroquímica, princípios, métodos e aplicações, Oxford University Press, 1986, p. 418.
[35] V. D. Pedrosa, L. Codognoto, L. A. Avaca. J. Braz. Chem. Soc. 14 (2003) 530 2003. [36] M. R. Smyth, B. Ogorevc, E. A. Hutton. Electroanalysis. 16 (2004) 1616.
[37] C. D. S. Silveira. Desenvolvimento de metodologia eletroanalítica para a determinação de sulfonamidas empregando eletrodo de diamante dopado com boro. Dissertação de mestrado em Química Analítica, Universidade de Santa Catarina, UFSC, Florianópolis, 2008.
[38] M. F. Cabral, D. Souza, C. R. Alves, S. A. S. Machado. Eclet. Quim. 28 (2003) 41. [39] J. Fischer, L. Vanourkova, A. Danhel, V. Vyscocil, K. Cisek, J. Barek, K. Pechova, B.
Yosypchuk, T. Navratil. Int. Electrom. Sci.2 (2007) 226.
Development of analytical methodology based on glassy carbon electrode modified with
bismuth film: Application in rainwater samples of regions of Santa Catarina
Absctract
In this study an analytical methodology for determination of 2,4-dinitrofenol (2,4-DNP) in rainwater samples of regions of Santa Catarina was developed using the square wave voltammetry (SWV). The study involved the applicability to use the modified glass carbon electrode with bismuth film. The formation of the bismuth film was optimized by cyclic voltammetry and after that, studies of pH and electrolyte support were investigated for the reduction of 2,4-DNP (ex situ form). The analytical parameters that affect the sensitivity of the
limit of detection of 1,2 x 10-7 mol L-1. Recovery studies were performed to evaluate the accuracy of the methodology. The values obtained were between 84 – 112% (2,7 x 10-6 mol L-1 ) and 89 – 113% (4,3 x 10-6 mol L-1).