UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE FITOTECNIA
PROGRAMA DE PÓS-GRADUAÇÃO EM AGRONOMIA/FITOTECNIA
DOMINGOS FERREIRA DE MÉLO NETO
ANÁLISE PROTEÔMICA DE SEMENTES EM DESENVOLVIMENTO DE AÇAÍ
(
Euterpe oleracea
Mart.)
DOMINGOS FERREIRA DE MÉLO NETO
ANÁLISE PROTEÔMICA DE SEMENTES EM DESENVOLVIMENTO DE AÇAÍ
(
Euterpe oleracea
Mart.)
Dissertação apresentada ao Programa de Pós-
Graduação em Agronomia/Fitotecnia da UFC,
como parte dos requisitos para obtenção do
título de Mestre em Agronomia/Fitotecnia.
Área de concentração: Fisiologia, Bioquímica
e Biotecnologia Vegetal.
Orientador: Prof. Francisco de Assis de Paiva
Campos
Coorientador: Prof. Fábio César Sousa
Nogueira
DOMINGOS FERREIRA DE MÉLO NETO
ANÁLISE PROTEÔMICA DE SEMENTES EM DESENVOLVIMENTO DE AÇAÍ
(
Euterpe oleracea
Mart.)
Dissertação apresentada ao Programa de Pós-
Graduação em Agronomia/Fitotecnia da UFC,
como parte dos requisitos para obtenção do
título de Mestre em Agronomia/Fitotecnia.
Área de concentração: Fisiologia, Bioquímica
e Biotecnologia Vegetal.
Aprovada em: 29/03/ 2018.
BANCA EXAMINADORA
_____________________________________________
Prof. Francisco de Assis de Paiva Campos (Orientador)
Departamento de Bioquímica e Biologia Molecular
Universidade Federal do Ceará (UFC)
_____________________________________________
Prof. Fábio César Sousa Nogueira (Coorientador)
Instituto de Química (IQ)
Universidade Federal do Rio de Janeiro (UFRJ)
_____________________________________________
Dra. Emanoella Lima Soares
AGRADECIMENTOS
À
Deus
pela Vida.
Ao professor
Francisco A. P. Campos
pela oportunidade de realizar esse curso
de mestrado sob sua orientação, pelos ensinamentos, treinamento e confiança.
Ao professor
Fábio C. S. Nogueira
pela disponibilidade em participar da
avaliação desse trabalho e, sobretudo pelo treinamento em espectrometria de massas e
proteômica.
A Dr
aEmanoella L. Soares (Manu)
pela disponibilidade em participar da
avaliação desse trabalho, como também pelas orientações e ajuda na definição e coleta dos
frutos utilizados nesse estudo.
Ao professor
Gilberto B. Domont
pela receptividade e por todo entusiasmo com
a proteômica.
À professora
Rosilene Mesquita
pelas contribuições no projeto de qualificação.
Ao
Fabiano
pelas contribuições no projeto de qualificação e revisão dos textos
dessa dissertação, além da amizade.
Aos integrantes do Laboratório de Biologia Molecular de Plantas,
João
,
Magda
,
Jessica, Thais e Evanildo,
pelo companheirismo e ajuda no processamento do material
vegetal.
Ao
Moab
, meu amigo desde a graduação, o qual tive a honra de compartilhar
praticamente todos os momentos ao longo desse curso de mestrado.
Ao
Roberto,
por ter sido desde o início bastante atencioso, tanto nas orientações
laboratorias, como pela ajuda nas disciplinas e, sobretudo, pela amizade construída.
A
Raquel
por ter sido uma verdadeira guia nos experimentos na Unidade
Proteômica.
Ao
Daniel,
também meu amigo desde a gradução, um cara que admiro muito.
Ao Sr.
Erivan
pela ajuda na coleta dos frutos.
Ao pessoal dos laboratórios de Defesa de Plantas e Toxinas Vegetais da UFC,
Lucas, Helen, Thiago, Del e Raissa
pela ajuda na liofilização dos frutos.
Ao pessoal do Laboratório de Fisiologia Vegetal da UFC,
Ana Carla
,
Fabrício
e
Elieser
, por também ajudarem na liofilização dos frutos e fornecerem inibidor de protease.
Aos
professores do curso de Pós-Graduação em Agronomia/Fitotecnia
.
Aos meus pais,
Vanaldi
e
Lourinaldo
, e a minha irmã
Alaídes
, por todo amor,
carinho, confiança e, sobretudo pela base educacional que me deram.
À minha namorada
Aisla
pelo amor, carinho, paciência e palavras de conforto nos
momentos mais difíceis desse curso.
RESUMO
O açaí (
Euterpe oleracea
Mart) pertence à família Arecaceae e sua importância econômica
está centrada basicamente na colheita do fruto para produção de polpa. Nos últimos anos, a
demanda pela polpa de açaí aumentou de forma significativa, em função principalmente do
apelo funcional. No entanto, a maior parte da colheita corresponde à semente (caroço),
normalmente descartada como resíduo durante o processo produtivo, não havendo, pois,
alternativas viáveis para o seu aproveitamento em larga escala. Diante desse problema,
entende-se que estudos básicos, possam fornecer subsídios capazes de melhor direcionar sua
utilização. Nessa perspectiva, realizou-se uma análise proteômica livre de marcação de
sementes de
E. oleracea
em quatro estádios de desenvolvimento, designados E3, E6, E9 e
E11, o que resultou na identificação de 758, 897, 285 e 69 proteínas, respectivamente, e um
total de 1.080 proteínas. A categorização funcional dessas proteínas nos mostrou que a
maioria integra as classes de metabolismo de carboidrato, metabolismo de aminoácidos,
síntese de proteínas, parede celular, metabolismo secundário, metabolismo de lipídeos,
transportadores e metabolismo de EROS. Já, na quantificação relativa, realizada com base na
intensidade do íon precursor, foram identificadas 21, 43, 14, 37, 14 e 3 proteínas
diferencialmente expressas pelo teste t (
p
˂ 0,05), nos contrastes E6/E3, E9/E3, E11/E3,
E9/E6, E11/E6 e E11/E9, respectivamente. As proteínas com padrão de expressão semelhante
foram agrupadas em seis grupos distintos. A abundância relativa das enzimas sacarose sintase,
UTP-glucose-1-fosfato-uridilitransfe
rase,
α
-galactosidase,
manose-1-fosfato-guanililtranferase e peroxidase 72 foi aumentada no E6, sugerindo que nessa fase do
desenvolvimento, ocorrem simultaneamente os processos de deposição e modificação dos
polissacarídeos da parede celular e, indica a formação de polissacarídeos a base de manose,
que devem constituir a fração hemicelulósica. Proteínas de reserva do tipo globulina 63 KDa
e globulina 7S foram acumuladas até a maturidade, a partir do E6. Essa análise proteômica de
sementes em desenvolvimento de açaí, focou alguns aspectos da formação das paredes
celulares, ja que essas são o principal repositório de substâncias de reserva nas sementes dessa
espécie, como também, trata das principais proteínas de armazenamento, de modo a fornecer
conhecimento básico que ajude a melhor direcionar a utilização da semente de açaí.
ABSTRACT
Açaí (
Euterpe oleracea
Mart) belongs to the family Arecaceae and its economic importance is
centered mainly on fruit harvesting for pulp production. In recent years, the demand for açaí
pulp increased significantly, mainly due to the functional appeal. However, most of the
harvest corresponds to the seed, normally discarded as waste during the production process,
once there are no viable alternatives for its use on a large scale. Considering such problem, it
is understood that basic studies, can provide subsidies capable of improving seed use. In this
perspective, a label-free proteomic analysis of
E. oleracea
seed was carried out at four
developmental stages, designated E3, E6, E9 and E11, which resulted in the identification of
758, 897, 285 and 69 proteins respectively, and a total of 1,080 proteins. The functional
categorization of these proteins, showed that most of them integrated the classes of
carbohydrate metabolism, amino acid metabolism, protein synthesis, cell wall, secondary
metabolism, lipid metabolism, transporters and EROS metabolism. Already, in the relative
quantification using precursor ion intensity, 21, 43, 14, 37, 14 and 3 proteins were identified
as differentially expressed by the test t (
p
˂ 0,05), in the contrasts
E6/E3, E9/E3, E11/E3, E9/E6,
E11/E6 and E11/E9, respectively. Proteins with similar expression pattern were grouped into
six distinct groups. The relative abundance of the enzymes sucrose synthase,
UTP-glucose-1-phosphate-uridyl transferase,
α
-galactosidase, mannose-1-phosphate guanyliltranferase and
peroxidase 72 was increased at E6, suggesting that at this developmental stage both
deposition and modification of cell wall polysaccharides and indicates the formation of
polysaccharides based on mannose, which should constitute the hemicellulosic fraction.
Storage proteins type 63 KDa globulin like protein and 7S globulin were accumulated in seed
until maturity starting at E6. These proteomic analysis the seed in development of açaí,
focusing on some aspects of cell wall formation, since it is the main repository of reserve
substances in the seeds of this species, as well as the main storage proteins, in order to
provide basic knowledge that helps to better target the use of the acai seed.
LISTA DE FIGURAS
Figura 1 -
Euterpe oleracea
Mart. (açaí do Pará). A - Imagem da palmeira multicaule
E. oleracea
Mart. B
–
Inflorescência tipo raque de
E. oleracea
localizada
abaixo das folhas e com frutos maduros de coloração roxo púrpura. C
–
Fruto e semente de
E. oleracea
em corte transversal ...
16
Figura 2 - Importância econômica do açaí (
Euterpe oleracea
Mart.) no Brasil. A -
Produção histórica anual de açaí no Brasil (toneladas de frutos colhidos). B -
Receita histórica anual no Brasil (reais ao ano). C - Preço anual do quilo de
açaí no Brasil (reais por quilo). D - Número de publicações por ano com
açaí cadastradas no
web of science
...
17
Figura 3 - Modelo geral do ganho de massa de sementes durante o desenvolvimento .... 18
Figura 4 - Anatomia do desenvolvimento do embrião em
Euterpe oleracea
Mart. A -
Zigoto polarizado com celular apical menor e célula basal maior. B -
Evidência do proembrião com 19 células. C - Embrião em transição do
estádio de coração lateral para torpedo. D - Embrião maduro. Adaptado de
Pereira, 2017 ...
20
Figura 5 - Anatomia do desenvolvimento do endosperma em
Euterpe oleracea
Mart. A
- Estádio inicial do desenvolvimento do endosperma, evidenciando a
presença de núcleos livres adjacentes ao tegumento. B - Início da
celularização do endosperma. C- Endosperma maduro. Adaptado de Pereira,
2017 ...
21
Figura 6 - Estrutura dos principais polissacarídeos de reserva de parede celular. A -
(galacto)manano. B - Xiloglucano. C - Galactano. Adaptado de Buckeridge
et al., 2000 ...
23
Figura 7 - Representação esquemática da rota de biossíntese de ácidos graxos e
montagem de triacilgliceróis em plantas. (BAUD e LEPINIEC
,
2010) ...
27
Figura 8 - Comparação do número de estudos proteômicos entre diferentes plantas
cultivadas com base em uma pesquisa no PubMed (em 23 de setembro de
2014) ...
29
Figura 9 - Aspectos morfológicos dos frutos de açaí em desenvolvimento,
Figura 10 - Perfil eletroforético de proteínas totais extraídas da semente de açaí
(
Euterpe oleracea
Mart.) em quatro estádios de desenvolvimento ...
37
Figura 11 - Perfis cromatográficos de proteínas totais extraídas da semente de açaí
(
Euterpe oleracea
Mart.) em quatro estádios de desenvolvimento ...
38
Figura 12 - Espectros de massa ilustrativos. A - Espectro de MS1. B
–
Espectro de
fragmentação (MS2) ...
38
Figura 13 - Diagrama de Venn das proteínas identificadas nos diferentes estádios de
desenvolvimento da semente de açaí (
Euterpe oleracea
Mart.) ...
39
Figura 14 - Classificação funcional de todas as proteínas identificadas na semente de
açaí (
Euterpe oleeracea
Mart.) em desenvolvimento ...
41
Figura 15 -
Subcategorização das proteínas da classe ‘Metabolismo de Aminoácidos’
identificadas na semente de açaí (
Euterpe oleracea
Mart.) em
desenvolvimento ...
42
Figura 16 -
Subcategorização das proteínas da classe ‘Metabolismo de Carboidratos’
identificadas na semente de açaí (
Euterpe oleracea
Mart.) em
desenvolvimento ...
42
Figura 17 -
Subcategorização das proteínas da classe ‘Metabolismo de Lipídeos’
identificadas na semente de açaí (
Euterpe oleracea
Mart.) em
desenvolvimento ...
43
Figura 18 -
Subcategorização das proteínas da classe ‘Metabolismo Secundário’
identificadas na semente de açaí (
Euterpe oleracea
Mart.) em
desenvolvimento ...
43
Figura 19 - Classificação funcional das proteínas identificadas em cada estádio de
desenvolvimento da semente de açaí (
Euterpe oleeracea
Mart.) ...
44
Figura 20 - Quantificação relativa livre de marcação baseado na extração do
cromatograma de íons (XIC) de proteínas identificadas na semente de açaí
(
Euterpe oleracea
Mart.) em desenvolvimento utilizando o teste t ...
46
Figura 21 - Análise do agrupamento (
clusters
) das proteínas identificadas na semente de
LISTA DE TABELAS
Tabela 1 -
Características morfológicas dos frutos e das sementes de açaí
(
Euterpe oleracea
Mart.) de acordo com o estádio de
desenvolvimento...
31
Tabela 2 -
Proteínas envolvidas com a síntese e modificação da parede
celular, identificadas durante o desenvolvimento da semente de
açaí (
Euterpe oleracea
Mart.) ...
51
Tabela 3 -
Proteínas de reserva identificadas durante o desenvolvimento da
semente de açaí (
Euterpe oleracea
Mart.) ...
55
Tabela suplementar 1 - Proteínas totais identificadas na semente de açaí (
Euterpe
oleracea
Mart.) em diferentes estádios de desenvolvimento ...
62
Tabela suplementar 2 - Proteínas identificadas na semente de açaí em desenvolvimento
com expressão diferencial entre os estádios E3 e E6 ...
102
Tabela suplementar 3 - Proteínas identificadas na semente de açaí em desenvolvimento
com expressão diferencial entre os estádios E3 e E9 ...
103
Tabela suplementar 4 - Proteínas identificadas na semente de açaí em desenvolvimento
com expressão diferencial entre os estádios E3 e E11 ...
105
Tabela suplementar 5 - Proteínas identificadas na semente de açaí em desenvolvimento
com expressão diferencial entre os estádios E6 e E9 ...
106
Tabela suplementar 6 - Proteínas identificadas na semente de açaí em desenvolvimento
com expressão diferencial entre os estádios E6 e E11 ...
108
Tabela suplementar 7 - Proteínas identificadas na semente de açaí em desenvolvimento
SUMÁRIO
1
INTRODUÇÃO………...
13
2
CONTEXTUALIZAÇÃO TEÓRICA………...
15
2.1
Euterpe oleracea
Mart………....
15
2.2
Formação da semente……….
17
2.2.1
Desenvolvimento do embrião
……….
19
2.2.2
Desenvolvimento do endosperma
………...
20
2.2.3
Desenvolvimento da testa
………...
21
2.3
Polissacarídeos de reserva de parede celular... 22
2.4
Proteínas de reserva em sementes... 24
2.5
Lipídeos de armazenamento em semente... 25
2.6
Espectrometria de massas e proteômica
Shotgun
... 28
3
OBJETIVOS... 30
3.1
Objetivo geral... 30
3.2
Objetivos específicos... 30
4
MATERIAL E MÉTODOS... 31
4.1
Material Vegetal... 31
4.2
Extração das proteínas e 1D-SDS-PAGE... 32
4.3
Preparo das amostras para MS... 33
4.4
Análise por LC-MS/MS dos peptídeos... 34
4.5
Análise dos dados... 34
5
RESULTADOS E DISCUSSÃO... 37
5.1
Identificações... 37
5.2
Categorização funcional... 39
5.3
Proteínas diferencialmente expressas... 45
5.3.1
Proteínas relacionadas à formação da parede celular
... 49
5.3.2
Proteínas de reserva
... 54
6
CONCLUSÃO... 56
REFERÊNCIAS... 57
1 INTRODUÇÃO
A importância econômica do açaí (
Euterpe oleracea
Mart.) está concentrada na
colheita do fruto para produção de polpa, a qual tem ganhado espaço no mercado por
apresentar importantes aspectos nutricionais que o caracterizam como alimento funcional. A
intensificação na demanda e consumo de açaí nos últimos anos vem sendo acompanhada pelo
crescente número de estudos que buscam estabelecer as bases funcionais do fruto na dieta
humana. Dentre os principais compostos bioativos encontrados no fruto de açaí tem-se ácidos
graxos insaturados, antocianinas, outros flavonóides, vitaminas, minerais e fibras alimentares
(SCHAUSS
et al
., 2006a; SCHAUSS
et al
., 2006b; LUO
et al
., 2012; DUPUREUR
et al
.,
2012; DIAS
et al
., 2013; SMITH
et al
., 2012a; SMITH
et al
., 2012b).
Um grande problema associado à cadeia produtiva de polpa de açaí, diz respeito à
elevada geração de resíduos, visto que, a fração da colheita destinada à produção de polpa é
muito baixa. Cerca de 85-90% do diâmetro do fruto, e até 90% do peso corresponde a
semente (caroço), normalmente descartada como resíduo durante o processo de produção. A
elevada produção de resíduos, estimada em aproximadamente 300 toneladas de sementes
diárias na cidade de Belém-PA, umas das principais cidades produtoras de polpa de açaí
(MARTINS
et al
., 2009), é preocupante, em virtude de serem incipientes as alternativas
tecnológicas para seu aproveitamento. Uma pequena parte desse material é utilizada na
alimentação de suínos ou deixada no solo e usada como fertilizantes em plantações
(RODRIGUEZ
et al
., 2006). Sabe-se, porém, que o tecido de reserva na semente de açaí é o
endosperma e as principais substâncias armazenadas são polissacarídeos, sobretudo
hemiceluloses, depositadas em paredes celulares espessadas (PAULA, 1975). Nesse cenário,
algumas propostas de utilização da semente têm sido lançadas, como para a produção de
etanol de segunda geração, em razão do alto teor de carboidratos, alto poder calorífico e baixa
quantidade de cinzas (OLIVEIRA
et al
., 2015; RAMBO; SCHMIDT; FERREIRA, 2015), e
para servir de ingrediente em alimentos extrusados para cães em substituição à fibra de cana
de açúcar (FELSSNER
et al
., 2015).
endosperma, como também a presença de corpos proteicos e lipídicos, além de paredes
bastante espessas ricas em hemicelulose no endosperma. No trabalho desenvolvido por
Pereira (2017) foi detalhado o processo de embriogênese, onde verificou-se, no tegumento, a
presença de compostos fenólicos e uma diminuição no número de camadas celulares ao longo
do desenvolvimento, foi notada a presença de substâncias pécticas no endosperma maduro,
como também a constatação de modificações químicas ocorridas nas paredes desse tecido à
medida que os polissacarídeos são depositados.
2 CONTEXTUALIZAÇÃO TEÓRICA
2.1 Euterpe oleracea Mart.
Euterpe oleracea
Mart. é uma palmeira multicaule pertencente da família
Arecaceae, que na maturidade tem uma altura de 3-20 m e as estirpes apresentam diâmetro de
7 a 18 cm (Figura 1A); as inflorescência são do tipo raque e estão posicionadas abaixo das
folhas (Figura 1B; HENDERSON, 1995). A semente de
E. oleracea
é composta de um
embrião pequeno, em formato cônico e posicionado lateralmente; endosperma volumoso e
rígido, que na fase jovem, suas células apresentam paredes celulares finas pectocelulósicas, e
na maturidade essas paredes são espessadas, ricas em hemicelulose, constituindo a principal
composto de reserva; bitegumentada, em que os tegumentos emmitem projeções no
endosperma (Figura 1C; PEREIRA, 2017; PAULA, 1975).
A importância econômica dessa espécie está centrada basicamente na colheita do
fruto para produção de polpa. Nos últimos anos essa atividade tem se destacado no cenário
nacional, havendo um aumento significativo na produção, na ordem 75%, se comparada à
produção média de 2002 a 2010 com a de 2011 a 2016 (Figura 2A). A receita anual e o preço
do produto têm mostrado um aumento constante ao longo dos últimos 13 anos (Figura 2B e
2C), revelando esse importante papel sócio-econômico dessa espécie (IBGE, 2016).
A presença de compostos bioativos no fruto e consequentemente na polpa, tem
colocado o açaí como importante alimento funcional. Essa é, sem dúvida, a principal razão
que justifica a ascensão desse mercado. Tal fato vem sendo sustentado pelo crescente número
de publicações com
E. oleracea
(Figura 2D), entre as quais, a grande maioria comprova a
presença desses compostos e de suas benfeitorias a saúde humana.
atuar como biossorvente e reabilitar águas contaminadas com cobre e zinco. Enquanto
Felssner (2016) evidenciou a possibilidade de incluir a semente de açaí como ingrediente em
alimentos extrusados para cães adultos. Contudo, nenhum desses estudos tem mostrado ser
efetivo na capacidade de utilização dessa matéria-prima, de modo que esta não seja mais um
problema. Entende- se, porém, que estudos básicos, como uma análise proteômica de
sementes da espécie durante o desenvolvimento, possam fornecer subsídios capazes de
melhor direcionar sua utilização.
Figura 2 - Importância econômica do açaí (Euterpe oleracea Mart.) no Brasil. A- Produção histórica anual de açaí no Brasil (toneladas de frutos colhidos). B- Receita histórica anual no Brasil (reais ao ano). C- Preço anual do quilo de açaí no Brasil (reais por quilo). D- Número de publicações por ano com açaí cadastradas no web of science. As figuras 5A, 5B e 5C foram elaboradas com dados do IBGE e, a figura 2D com dados do web of science
Fonte: IBGE (www.ibge.gov.br) e Web of Science (www.webofknowledge.com)
2.2 Formação da semente
Por ocasião da polinização, o grão de pólen germina e a célula vegetativa guia o
crescimento do tubo polínico pelo estilete até alcançar o saco embrionário pela da micrópila.
Uma vez alcançado o saco embrionário, o tubo polínico penetra uma das sinérgidas e
descarrega os núcleos generativos. Um dos núcleos é direcionado à fertilizar a oosfera e o
outro aos núcleos polares, fenômeno conhecido como dupla fertilização, pelo qual dar-se o
início do desenvolvimento da semente (
CHEUNG et al., 2010).tecidos maternais, processo que ocorre concomitantemente a ocorre a formação do embrião e
do endosperma.
O desenvolvimento das sementes é representado graficamente por três fases
sobrepostas: a fase lag, caracterizada por elevada absorção de sacarose, que é rapidamente
convertida em hexoses, alta taxa de divisão celular e pouco ganho de massa
–
é nessa fase que
os diferentes tipos de tecidos são especificados e estabelecidos; a fase de enchimento, em que
há aumento linear da massa e volume, associada a expansão celular, acúmulo de compostos e
eventos de endorreduplicação nos tecidos de armazenamento; e uma fase final, marcada pela
redução da massa relacionada à desidratação, que culmina na maturidade fisiológica (Figura
3; ENGLI, 2006).
Figura 3 - Modelo geral do ganho de massa de sementes durante o desenvolvimento
Fonte: Elaborado pelo autor.
ubiquitina-proteassoma (INZÉ e DE VEYLDER, 2006
).2.2.1
Desenvolvimento do embrião
Após a fertilização da oosfera tem-se o início do desenvolvimento do embrião,
processo conhecido por embriogênese. A primeira divisão assimétrica do zigoto estabelece a
polaridade, a qual produz uma célula basal grande e vacuolada precursora do suspensor, e
uma célula apical menor de citoplasma denso que precede o proembrião (Figura 4A). Até o
estádio de embrião globular, muitos aspectos do desenvolvimento embrionário em
monocotiledôneas e dicotiledôneas são conservados (LAU
et al
., 2012). Apesar disso, o
alongamento e crescimento do zigoto em monocotiledôneas não ocorre, o que indica uma
regulação diferencial no estabelecimento da polaridade nesses dois grupos de plantas (SATO
et al
., 2010).
A especificação da polaridade apical/basal é crítica para definir a estrutura na qual
as células vão se diferenciar de acordo com a posição, dando assim origem ao promeristema
da parte aérea, normalmente ladeado pelo cotilédone (s), ligado ao promeristema da radicular
por meio do hipocótilo, a protoderme, a hipófise e o suspensor (LAU
et al
., 2012) (Figura
4C). Estudos recentes conseguiram identificar mecanismos moleculares que regulam esse
padrão de formação. Genes da família WOX marcam o destino celular ao longo do eixo
apical/basal e o transporte polar de auxina, mediado por PIN são dois principais mecanismos
conservados em dicotiledôneas (ZHAO
et al
., 2017). O gene AtZYG1 codifica a subunidade
11 (ACP 11) do complexo promotor da anáfase, uma ubiquitina ligase E3, conhecida por ter
ciclinas como alvo (PETERS, 2006). NtDRP codifica uma proteínas relacionada com
dinamina, envolvida na reorganização do citoesqueto. A redução da sua expressão provoca a
orientação incorreta das divisões e forma um embrião aparentemente sem suspensor (ZHAO
et al
., 2016).
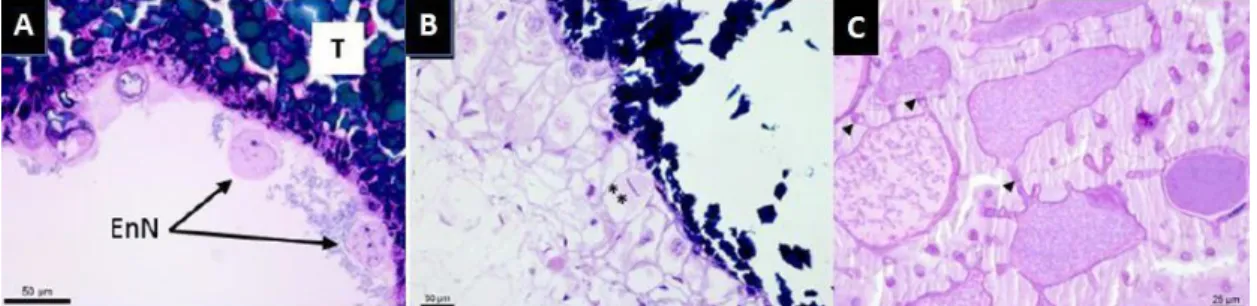
Figura 4 - Anatomia do desenvolvimento do embrião em Euterpe oleracea Mart. A- Zigoto polarizado com celular apical menor e célula basal maior. B- Evidência do proembrião com 19 células. C- Embrião em transição do estádio de coração lateral para torpedo. D- Embrião maduro. BC, Base Cotiledonar; CP, Cordões de Procâmbios; CS, Cotilédone Superior; E, Endosperma; Em, Embrião; M, Micrópila; MA, Meristema apical; MR, Meristema Radicular; PrEm, Pró-embrião; RD, Região Distal; RP, Região Proximal; S, Suspensor
Fonte: Adaptado de Pereira, 2017.
2.2.2
Desenvolvimento do endosperma
O desenvolvimento do endosperma do tipo nuclear, é o padrão comumente
encontrado nas Angiospermas, e no que tange aos seus primeiros estádios até a celularização,
é altamente conservado em monocotiledôneas e dicotiledôneas (BECRAFT e
GUTIERREZ-MARCOS, 2012). Nesse padrão de desenvolvimento, o núcleo primário do endosperma,
oriundo da fertilização de uma das células gaméticas masculina com a célula média, sofre
várias divisões nucleares formando um endosperma cenocítico (Figura 5A; OLSEN, 2004). O
início da celularização dár-se pela deposição anticlinal de parede celular nas periferias da
célula envolvendo núcleos individuais, formando alvéolos, seguido pela deposição periclinal
de parede e divisões celulares periclinais, sentido ao centro da célula e ocupando o espaço do
vacúolo central (Figura 5B). Completada a celularização, em espécies endospermáticas, o
endosperma persiste, passa por uma fase de expansão celular, seguido de maturação,
desidratação e latência (DANTE
et al
., 2014).
O endosperma exerce diversas funções durante o desenvolvimento da semente,
como também no processo germinativo e estabelecimento da plântula. Nas monocotiledôneas
sua principal função está concentrada no acúmulo de reservas, a exemplo do endosperma de
gramíneas, como o milho (
Zea mays
) e o arroz (
Oryza sativa
) que concentram amido, de
aspargo (
Asparagus officinalis
) e de palmeiras como
aparelho de golgi pela ação de glicosiltransferases, que catalisam a transferência de um
resíduo de açúcar de um açúcar-nucleotídeo para um aceptor específico. A ação das
glicosiltranferases depende da atividade de enzimas no citosol que sintetizam os açúcar-
nucleotídeos e de transportadores, que realizam o transporte destes para o lúmen das cicternas
do golgi onde são polimerizados (DRIOUICH
et al
., 2012). Finalizada a biossíntese, os
polissacarídeos são contidos em vesículas e secretados para o espaço extracelular onde são
montados segundo a orientação das microfibrilas de celulose.
Figura 5 - Anatomia do desenvolvimento do endosperma em Euterpe oleracea Mart. A- Estádio inicial do desenvolvimento do endosperma, evidenciando a presença de núcleos livres adjacentes ao tegumento. B- Início da celularização do endosperma (**) metafase. C- Endosperma maduro, evidenciando as paredes celulares espessadas e campos de pontoações de plasmodesmas (ponta da seta preta). EnN, Endosperma Nuclear, T-tegumento
Fonte: Adaptado de Pereira, 2017.
2.2.3
Desenvolvimento da testa
O(s) revestimento(s) da semente é originário do desenvolvimento do
integumento(s) do óvulo que encerra o nucelo, tendo início após a dupla fertilização e
seguindo estádios de divisão celular, alongamento, diferenciação e morte celular programada,
coordenado com o desenvolvimento do embrião e do endosperma (HAUGHN;
CHAUDHURY, 2005). Tal fato foi comprovado pela interrupção do alongamento das células
do revestimento por meio da mutação do fator de transcrição
transparent testa glabra 2
(ttg2)
que provocou redução do endosperma e consequentemente da semente (GARCIA
et al
.,
2005).
secundário. Por fim, na maturidade, a testa torna-se uma barreira protetora ao embrião, pode
conferir dormência e desenvolver estruturas que auxiliam na dispersão.
2.3 Polissacarídeos de reserva de parede celular
Os modelos de parede celular à representam em termos básicos de três domínios
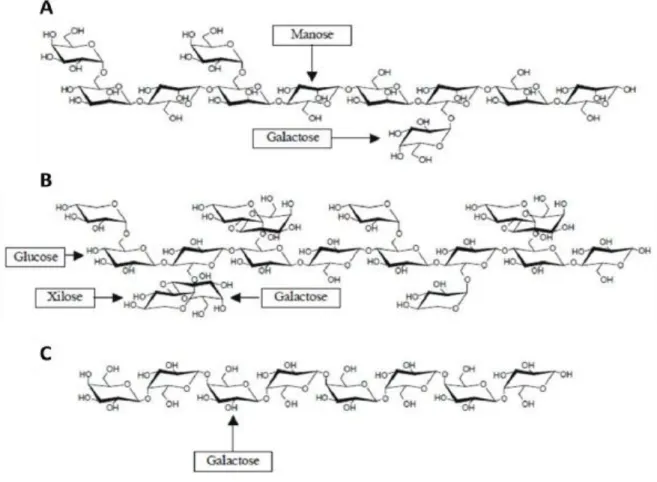
distintos (celulose-hemicelulose, pectinas e proteínas), em que as microfibrilas de celulose são
envolvidas e interligadas por hemiceluloses, e estas estão incluídas numa matriz cimentante
contendo pectina e proteínas (CARPITA e GIBEAUT, 1993). Os polissacarídeos de reserva da
parede celular (PSPC) são classificados em três grupos distintos: mananos, xiloglucanos e
(arabino)galactanos (Figura 6; BUCKERIDGE, 2010), e podem ser entendidos como variação
do modelo básico, onde um domínio é depositado em maior quantidade em relação ao outro.
Supõe-se que a deposição dos PSPC seja derivada do metabolismo de biossíntese da parede
primária, o que permite propor uma redução na síntese de celulose ou uma intensificação na
síntese de hemicelulose.
Os mananos são subdivididos em mananos puros, galactomananos e
glucomananos (MEIER e REID, 1982; BUCKERIDGE
et al
., 2000). Os mananos puros são
constituídos por mais de 90% de manose, em que os resíduos manosil estão unidos por
ligação β
-1,4-glicosídica. Esses polissacarídeos são encontrados no endosperma das sementes
de
Phoenix dactylifera
e
Phytelephas macrocarpa
(monocotiledôneas) e
Coffea arábica
(dicotiledônea) (REID, 1985). Quando a cadeia principal contem também resíduos de glicose,
o polissacarídeo é chamado glucomanano. Tanto mananos puros, quanto glucomananos
podem possuir ramificações por resíduos de galactose, ligados a cadeia principal por ligação
α
-1,6 (Figura 6A). Quando a proporção de ramificação ultrapassa 10%, o polímero passa a ser
chamado de galactomanano. Esses polissacarídeos são sintetizados por manosiltransferases
dependentes de GDP-manose e por galactosiltransferases dependentes de UDP-galactose. Em
espécies com alto grau de ramificação M/G=1,1 (proporção manose/galactose) como
Cyamopsis tetragonolobus
, essa proporção é determinada na síntese, enquanto nas sementes
de
Senna occidentalis
(M/G=2,3-3,2), o galactomanano sintetizado sofre edição pós-síntese
por α
- galactosidase (BUCKERIDGE, 2010).
Os xiloglucanos de sementes apresentam uma cadeia principal de β
-D-
(1→4)
-
glucano ramificada com ligações α
-
(1→6) por resíduos de D
-
xilopiranosídeos ou β
-D-
primárias, a diferença está na presença de um resíduo fucosil terminais ligado por [
-L-(1→2)]
nos grupos β
-Dgalactosídeos. Foi proposta uma nomenclatura para os blocos estruturais dos
xiloglucanos com base na cadeia principal (FRY
et al
., 1993).
Glicoses não substituídas são
denomicadas G; Glicoses ramificadas por xilose são denominadas X, e se há galactose ligada
à xilose, o trissacarídeo é denominado L.
Figura 6 - Estrutura dos principais polissacarídeos de reserva de parede celular. A- (galacto)manano. B- Xiloglucano. C- Galactano
Fonte: Adaptado de Buckeridge et al., 2000.
Em relação aos galactanos, com cadeia pr
incipal β
-
(1→4)
-D-galactano, estes
ocorrem de dois tipos: um formado por ligações β
-
(1→3),(1→6) com algumas ligações β
-(1→4) e o outro, mais frequente, é composto por ligações β
-
(1→4) com ramificações de L
-arabinofuranose a cada 16-21 resíduos da cadeia principal (Figura 4C). Esses polissacarídeos
de reserva de parede celular são encontrados nas sementes de lupino (AL-KAISEY e WILKIE,
1992).al
., (2015), é possível que estes polissacarídeos sejam próximos a mananos puros.
2.4 Proteínas de reserva em sementes
As proteínas de armazenamento em sementes (PAS) possuem duas características
especiais: se acumulam em quantidades maciças primeiramente e suas características
singulares de agregação permitem dessecação eficiente durante a maturação e reidratação da
semente durante a germinação (GALILI, 2004). Essas proteínas se acumulam em vacúolos de
armazenamento ou corpos proteicos derivados do retículo endoplasmático. Todas PAS
incluem um peptídeo sinal no N-terminal que medeia a translocação através das membranas
do RE para o lume durante a síntese em polissomos ligados a membrana. O peptídeo é
clivado, a PAS é glicosilada, sofre dobramento por chaperonas e depois é transportada para o
compartimento apropriado (
IBL e STOGER, 2012).
As sementes sintetizam três classes principais de proteínas de armazenamento:
prolaminas, albuminas e globulinas (SHEWRY
et al
.,1995; GALILI 2004). As albuminas 2S
são proteínas globulares compactas sintetizadas como precursores únicos que são clivados
proteolicamente, e estão amplamente distribuídas em sementes de dicotiledôneas. As
prolaminas são restritas a gramíneas e são os principais componentes protéicos da maioria dos
grãos de cereais. As globulinas são encontradas tanto em monocotiledôneas como em
ditotiledôneas, como tambem em esporos de samambaias. Elas estão separadas em dois
grupos: as 7S
vicilin-type
e as 11S
legumim-type
. As globulinas 11S são especialmente
encontradas em leguminosas e não são glicosiladas, enquanto as globulinas 7S são
tipicamente triméricas e sofrem processamento pós- traducional por proteólise e glicosilação.
2.5 Lipídeos de armazenamento em semente
Nas sementes, os lipídeos são armazenados na forma de triacilgliceróis
–
ésteres
de glicerol em que ácidos graxos são esterificados em cada um dos três grupos hidroxila do
glicerol. Essa é a forma mais eficiente de armazenamento de energia em sementes, pois os
carbonos nos ácidos graxos encontram-se altamente reduzidos, de tal maneira que sua a
oxidação libera duas vezes mais energia que a oxidação de carboidratos e proteínas
(GRAHAM, 2008). Alguns ácidos graxos comumente encontrados em triacilgliceróis também
estão presentes nos lipídeos de membrana, como o palmitato (16:0), estearato (18:0), oleato
(18:1), linoleato (18:2) e α
-linoleato (18:3) (VOELKER e KINNEY , 2001).
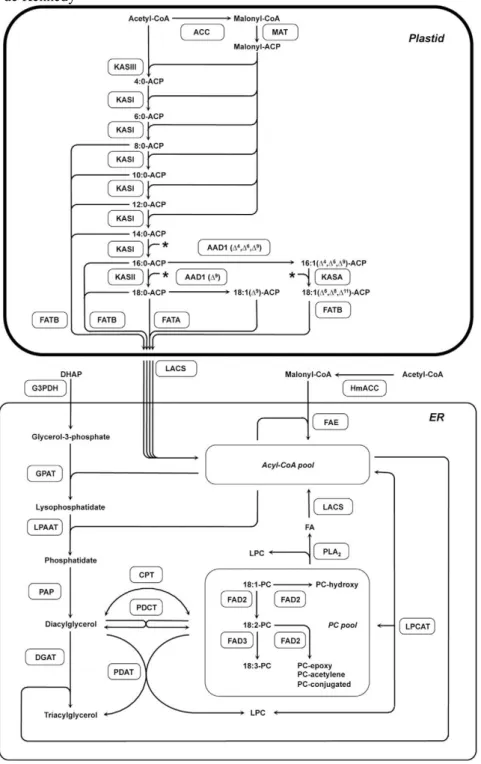
A sacarose é a principal forma de carbono assimilado fotossinteticamente
translocado pela planta. Ao ser descarregada no órgão dreno
–
aqui tratamos de sementes, a
sacarose é clivada e as hexoses fosfatos podem ser metabolizadas pela glicólise ou pela via
das pentoses fosfato. A via glicolítica dispõem dois importantes intermediários para a síntese
dos triacilgliceróis: primeiro, a conversão de dehidroxiacetona à glicerol-3-fosfato, pela
glicerol-3-fosfato desidrogenase prover o esqueleto básico de glicerol necessário para
biossíntese de triacilglicerol; segundo, a descarboxilação oxidativa do piruvato nos platídeos
produz acetil-Coa, utilizado para
síntese de novo
de ácidos graxos (BAUD e LEPINIEC,
2010
). A via das pentoses fosfatos dispõe ribulose-5-bifosfato, que por ação da hexoquinase
produz ribulose-1,5- bifosfato, com subsequente carboxilação pela Rubisco para produzir
3-fosfoglicerato (SCHWENDER
et al
., 2004), que pode ser metabolizado a piruvato, e em
seguida a ácidos graxos via acetil-CoA.
são hidrolisados por acil-ACP tioesterases (FATA ou FATB) que liberam ácidos graxos livres
(SALAS e OHLROGGE, 2002).
Figura 7 - Representação esquemática da rota de biossíntese de ácidos graxos e montagem de triacilgliceróis em plantas. Os ácidos graxos são sintetizados nos plastídeos, a partir de acetil-Coa, e transportados para o citosol na forma de acil- Coa. Os esqueletos de glicerol são derivados de dihidroxiacetona fosfato citosólico, pela ação da enzima glicerol-3-fosfato-desidrogenase. A montagem do triacilglicerol ocorre no retículo endoplasmático, através das enzimas da via de Kennedy
2.6 Espectrometria de massas e proteômica
Shotgun
Atualmente, a espectrometria de massas (MS) é a ferramenta mais poderosa para
identificar, quantificar e caracterizar proteínas. Tendo em vista que as proteínas em conjunto,
são responsáveis por catalisar e controlar todos os processos celulares, a MS é a técnica capaz
de identificar de maneira conclusiva e quantificar com precisão, um grande número de
proteínas presentes em amostras complexas (SAVARYN; TOBY; KELLEHER, 2016). Na
realidade, uma mistura complexa de proteínas é caracterizada pela análise dos seus peptídeos,
gerados por hidrólise numa etapa de digestão, utilizando uma protease que cliva a cadeia
polipeptídica em pontos específicos. Esse tipo de abordagem é chamado de proteômica
Shotgun
(WOLTERS; WASHBURN; YATES, 2001).
Os sistemas atuais de espectrometria de massas são acoplados
online
a um nano
cromatógrafo HPLC, em que a mistura complexa de peptídeos é primeiramente fracionada por
cromatografia líquida, antes de ingressar no espectrômetro de massas. O tipo de cromatografia
líquida normalmente empregada é em fase reversa, composta por uma fase estacionária
contendo grupos apolares ligados a sílica, malha C18, por exemplo, e uma fase móvel baseada
em soluções aquosas, contendo solvente orgânico miscível em água - acetonitrila, por
exemplo (LANÇAS, 2010). Nesse modo de cromatografia, os peptídeos são eluídos por
ordem de hidrofobicidade, em que os peptídeos mais hidrofílicos eluem primeiro.
À medida que eluem da coluna, os peptídeos são ionizados, por
Eletrospray
(WILM e MANN, 1996) ou MALDI (HILLENKAMP e KARAS, 1990) e conduzidos ao
espectrômetro de massas por um capilar de transferência. Um espectômetro de massas típico
consiste de três partes principais: uma fonte de ionização, um ou mais analisadores de massas,
e um detector. Basicamente, os diversos modelos de espectômetros de massas diferenciam
entre si em relação aos seus analisadores, mas todos são capazes de separar os diferentes íons
peptídeos de acordo com a relação massa/carga (m/z), haja vista que essa relação é
responsável pelo comportamento diferencial de cada um, quando submetidos a campos
elétricos no interior do analisador. Quando se deseja a estrutura de determinado peptídeo, as
formas iônicas são selecionadas e fragmentadas, para obtenção de espectros MS2, técnica
conhecida como espectrometria de massa em série ou MS/MS.
correspondentes (ZHANG
et al
., 2013) Esse tipo de experimento permite a identificação e
quantificação, com elevada precisão e acurácia, de milhares de proteínas, em um espaço curto
de tempo.
Nenhum experimento dessa natureza foi realizado com qualquer tecido de
E.
oleracea
, portanto, esse estudo é pioneiro. Até o momento, estudos proteômicos pelos
diversos métodos disponíveis, são escassos em plantas da Família Arecaceae (Figura 8;
CHAKRABORTY
et al
., 2015).
Figura 8 - Comparação do número de estudos proteômicos entre diferentes plantas cultivadas com base em uma pesquisa no PubMed (em 23 de setembro de 2014)
3 OBJETIVOS
3.1 Objetivo geral
Estudar a dinâmica do proteoma de sementes em desenvolvimento de
E. oleracea
.
3.2 Objetivos específicos
Comparar o proteoma de quatro estádios de desenvolvimento de sementes de
E.
oleracea
;
Determinar o padrão de deposição de proteínas relacionadas com a síntese e
modificação da parede celular ao longo do desenvolvimento das sementes.
4 MATERIAL E MÉTODOS
4.1 Material Vegetal
As sementes utilizadas nesse estudo foram provenientes de plantas presentes em
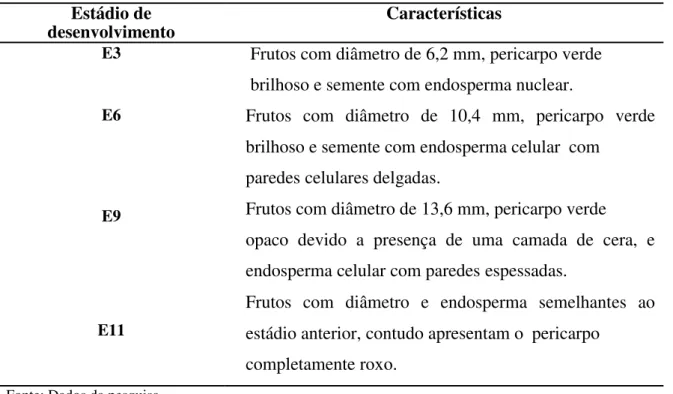
propriedade particular, no município de Taíba-CE. Foram coletados frutos em quatro estádios
de desenvolvimento, designados de E3, E6, E9 e 11, de acordo com as características
morfológicas descritas na Tabela 1, e ilustradas na Figura 9. Para cada estádio de
desenvolvimento foram coletadas três replicatas biológicas, em que uma replicata
correspondeu a uma planta-matriz.
Tabela 1 - Características morfológicas de frutos e sementes de açaí (Euterpe oleracea Mart.) de acordo com o estádio de desenvolvimento
Estádio de
desenvolvimento
Características
E3
Frutos com diâmetro de 6,2 mm, pericarpo verde
brilhoso e semente com endosperma nuclear.
E6
Frutos com diâmetro de 10,4 mm, pericarpo verde
brilhoso e semente com endosperma celular com
paredes celulares delgadas.
E9
Frutos com diâmetro de 13,6 mm, pericarpo verde
opaco devido a presença de uma camada de cera, e
endosperma celular com paredes espessadas.
E11
Frutos com diâmetro e endosperma semelhantes ao
estádio anterior, contudo apresentam o pericarpo
Figura 9 - Aspectos morfológicos dos frutos de açaí em desenvolvimento, evidenciando mudanças no tamanho, coloração do pericarpo e do endosperma
4 mm Fonte: Dados da pesquisa
Após a coleta, o material vegetal foi transportado para o Laboratório de Biologia
Molecular de Plantas, do Departamento de Bioquímica e Biologia Molecular, da Universidade
Federal do Ceará, lavado em água corrente, seco ao ar e liofilizado. Quando secos, as
sementes inteiras foram isoladas do pericarpo com auxílio de espátulas e lupa, trituradas com
martelo, moídas, transferidas para erlenmeyer de 250 ml e, deslipidadas por meio de três
lavagens com acetona. As trocas de acetona ocorreram à cada 12 horas, e durante esse tempo
as amostras permaneciam sob agitação em mesa agitadora. Após desllipidação, as amostras
foram novamente passadas no moinho, em que apenas a fração bem fina aderida a tampa era
coletada, transferida para tudos falcon de 15 ml, e armazenadas à -20 ºC.
4.2 Extração das proteínas e 1D-SDS-PAGE
A extração das proteínas se deu conforme o método descrito por Hurkman e
Tanaka (1986). Foram tomados 80 mg do pó fino de cada replicata biológica, e a este
adicionado 1.600 µl de tampão de extração (tris-HCl 500 mM, EDTA 50 mM, sacarose 700
mM, KCl 100 mM, β
- mercaptoetanol 2% e fenilmetilsulfonilfluorido 1 mM, pH 8,0). Essa
centrifugada durante 10 minutos a 5.500 x g e 4 ºC (“1”). A fase fenólica foi coletada
cuidadosamente, transferida para outro microtubo, a qual foi adicionada 1.600 µl de tampão
de extração, permaneceu sob agitação em vorté
x por 3 minutos e centrifugada como em “1”.
A fase fenólica foi novamente coletada, repartida entre dois novos microtubos, e mantida
overnight com 4 vezes a solução de precipitação (acetato de amônio 0,1 M preparada em
metanol gelado) à -
20 ºC. O material foi centrifugado nas condições de “1”, o sobrenadante
descartado e ao precitado adicionou- se 1 mL da solução de precipitação, seguindo-se com
agitação vigorosa, nova centrifugação e descarte do sobrenadante. Esse procedimento foi
repetido três vezes, e por fim o material sofreu uma última lavagem com 1 mL acetona gelada
e o precipitado foi seco em Speed Vacuum (Eppendorf).
Um dos tubos de cada replicata biológica contendo as proteínas foi utilizado para
análise do padrão eletroforético. As proteínas foram solubilizadas em 50 µl de uréia 7 M /
tiuréia 2 M e quantificadas pelo método de Bradford. Foram tomadas alíquotas
correspondentes a 20 µg de cada amostra e submetidas a análise 1D-SDS- PAGE, seguindo as
condições descritas por Shah, (2014).
4.3 Preparo das amostras para MS
As amostras de proteínas contidas no segundo tubo foram solubilizadas em 50 µl
de uréia 7 M / tiuréia 2 M e quantificadas pelo ensaio de Qubit (Invitrogen). Uma alíquota
correspondente à 40 µg de proteína foi retirada, reduzida com DTT 10 mM por 1 hora à 30
°C e, alquilada com iodoacetoamida (IAA) 40 mM por 30 minutos à temperatura ambiente e
protegido da luz. Em seguida a concentração de uréia foi diluída e o pH da solução elevado à
8, utilizando bicarbonato de amônio 50 mM na proporção 1:9 (amostra : bicarbonato de
amônio). Posteriormente, as proteínas foram digeridas com tripsina (Promega, Madison, WI,
EUA) por 18 horas à 37 ºC, obedecendo a proporção 1:50 (1 µg de tripsina, para cada 50 µg
de proteínas). A parada da reação da tripsina ocorreu pela adição de TFA 10%, até que o pH
da solução estivesse em torno de 2.
de ACN, e por fim pela aplicação de 50 µl de uma solução contendo TFA 0,1% e 70% de
ACN. Em seguida, os peptídeos foram secos em Speed Vac (CHRIST
–
RVC 2-25 CD plus),
ressuspensos em 15 µl de ácido fórmico 0,1%, e quantificados pelo ensaio de Qubit
(Invitrogen).
4.4 Análise por LC-MS/MS dos peptídeos
Uma alíquota referente a 2 µg de peptídeos de cada replicata biológica foi
retirada, diluída com ácido fórmico 0,1% para uma concentração final de 0,5 µg/µl e injetada
num sistema nano LC-EASY II (Proxeon Biosystems ) acoplado online a um espectrômetro
de massas ESI-LTQ Orbitrap Velos (Thermo Fisher Scientific). Os peptídeos eram carregados
inicialmente por uma pré-
coluna (100 μm
× ~
2 cm, ReproSil-Pur C18-
AQ, resina de 3 μm;
Dr. Maisch, Germany) e na sequência por uma coluna (75 µm x 20 cm) preenchida com a
mesma resina e eluídos utilizando um gradiente de 5-35% da fase B durante 160 minutos,
35-95% de B por 8 minutos e, finalizando com 35-95% da fase B por 12 minutos. Compunham a
fase A, 95% de água, 5% de acetonitrila e 0,1% de ácido fórmico e, a fase B, 5% de água,
95% de acetonitrila e 0,1% de ácido fórmico. Após cada corrida a coluna era reequilibrada.
Ao eluírem da coluna, os peptídeos eram ionizados por eletronebulização (
Electrospray
Ionization
, ESI) e tinham então suas massas/carga (m/z) analisadas pelo LTQ Orbitrap Velos
(Thermo Fisher Scientific). Os espectros MS1 foram adquiridos em modo positivo, e os
espectros MS/MS por
data dependent automatic
(DDA). Cada evento de
full scan
compreendeu um intervalo de 350-1800 m/z, resolução de 60.000 FWHM (para m/z 400)
e intensidade mínima de 1x10
4. Para obtenção dos MS2, os dez íons mais intensos eram
selecionados e fragmentados usando dissociação por colisão de alta energia (HDC) com
energia de colisão normalizada de 35 V, janela de isolamento de 2 m/z e exclusão dinâmica de
45 s. Para cada replicada biológica foram realizadas três análises nessas condições, de modo a
garantir a reprodutibilidade e confiabilidade dos dados.
4.5 Análise dos dados
Center for Biotechnology Information (
https://www.ncbi.nlm.nih.gov/protein
), mais o
proteoma de
Arabidopsis thaliana
baixado
do
UniProt
(
http://www.uniprot.org/uniprot/?query=Arabidopsis+thaliana&sort=score
),
ambos
em
Novembro de 2017, além de sequências de contaminantes comumente encontrados em
experimentos baseados em espectrometria de massas.
A primeira busca foi no solftware Proteome Discoverer 2.1 (Thermo Fisher
Scientific) utilizando os seguintes parâmetros: hidrólise tríptica, duas clivagens perdidas,
comprimento mínimo dos peptídeos de 6, tolerância de massa do íon precursor e íons
fragmento de 10 e 0,1 ppm, respectivamente, oxidação da metionina como modificação
variável e carbamidometilação de cisteína como modificação fixa e validação dos PSM por
Target Decoy. Após a busca, as proteínas foram filtradas, sendo consideradas para as análises
subsequentes apenas as
master protein
identificadas com ta
xa de descoberta falsa (FDR) ≤
1%, por pelo menos um peptídeo único, presentes em pelo menos duas replicatas técnicas
para incluírem a replicata biológica e presentes em pelo menos duas replicatas biológicas para
comporem o estádio de desenvolvimento. Essas proteínas foram utilizadas para as abordagens
qualitativas, que constaram do agrupamento pelo diagrama de Venn e categorização
funcional, nas seguintes categorias: metabolismo de aminoácidos (MA), metabolismo de
carboidratos (MC), proteínas de parede celular (PC), citoesqueleto (CT), fotossíntese e
fixação de carbono (FS), metabolismo de lipídeos (ML), metabolismo de nucleotídeos (MN),
peptidases e inibidores (PI), chaperonas, heat shock e proteínas relacionadas (CH),
ubiquitinização e proteassoma (UP), síntese de proteínas (SP), metabolismo de EROS,
metabolismo secundário (MS), proteínas de reserva (PR), fatores de transcrição (FT),
transporte (T), tráfego de vesículas (TV), não caracterizadas (NC) e outras (OT), em que essa
última, foi composta por proteínas que não se enquadraram em nenhuma das demais classes.
A classificação foi realizada manualmente com base no
Kegg
pathway
(
http://www.genome.jp/kegg/pathway.html
) e na descrição funcional da proteína no UniProt
(
http://www.uniprot.org/
). As categorias MA, MC, ML e MS foram divididas em
subcategorias e, três BLAST locais foram efetuados: um contra todas as sequências de
proteínas revisadas de
Arabidopsis thaliana
depositadas no UniProt, para identificação das
proteínas não caracterizadas, outro contra a base de dados
MEROPS
(RAWLINGS
et al
.,
2014) para identificação de peptidases e inibidores, e um último contra a base dados
WallProtDB
(CLEMENTE e JAMET, 2015) para identificações de proteínas de parede
celular.
mesmo banco de dados especificado acima, obedecendo os seguintes parâmetros: tolerância
de massa do precursor de 40 ppm, hidrólise tríptica semi-específica, duas clivagens perdidas,
oxidação da metionina como modificação variável e carbamidometilação de cisteína como
modificação fixa, com intervalo de massa de 550- 5000 m/z. Os arquivos
SQT
gerados,
contendo todas as proteínas identificadas, foram submetidos ao módulo
‘Search Engine
Processor (SEPro
–
for PSM)’
para cálculo do FDR e filtragem estatística. As proteínas
5 RESULTADOS E DISCUSSÃO
5.1 Identificações
Os perfis eletroforético e cromatográfico das proteínas extraídas da semente de
açaí nos quatro estádios de desenvolvimento são mostrados nas figuras 10 e 11,
respectivamente. Na figura 12 é ilustrado um espectro de massa de MS1 e o seu espectro de
fragmentação correspondente (MS2).
Foram identificadas 1.080 proteínas na semente de açaí em desenvolvimento,
levando em conta todos os critérios de filtro mencionados acima (Apêndice A - Tabela
suplementar 1). Dessas, 758, 897, 285 e 69 estavam presentes nos estádios E3, E6, E9 e E11,
respectivamente. Entre essas proteínas, 121 estiveram presentes exclusivamente no estádio
E3, 223 no estádio E6, 38 no estádio E9 e 8 no estádio E11; 440 foram comuns aos estádio E3
e E6, 35 aos estádios E6 e E9 e 14 aos estádios E9 e E11; 152 foram comuns aos estádios E3,
E6 e E9, e 40 proteínas foram identificadas em todos os estádios de desenvolvimento
estudados (Figura 13). É notado que cerca de 72% das proteínas identificadas estão
concentradas nos dois primeiros estádios de desenvolvimento (E3 e E6), o que reflete a
intensa atividade metabólica pela qual passa a semente no início da sua formação, em razão
principalmente da elevada taxa de divisão celular, e ao fato que nesses estádios de
desenvolvimento muitas das proteínas expressas nos tecidso apresentam abundância
semelhante, ao contrário dos estádios tardios de desenvolvimento, que poucos grupos de
proteínas, por exmplo proteínas de reserva, são muito abundantes, o que reduz a probalidade
de proteínas menos abundantes serem identificadas.
Figura 10 – Perfil eletroforético de proteínas da semente de açaí (Euterpe oleracea Mart.) em quatro estádios de desenvolvimento. A – Perfil eletroforético de proteínas da replicata biológica 1. B – Perfil eletroforético de proteínas da replicata biológica 2. M, marcador molecular
Figura 11 – Perfis cromatográficos de proteínas da semente de açaí (Euterpe oleracea Mart.) em quatro estádios de desenvolvimento, fracionadas em coluna de fase reversa C18, utilizando um fluxo de 200 nl/min durante 180 minutos. A – Perfil cromatográfico das proteínas do estádio E3. B - Perfil cromatográfico das proteínas do estádio E6. C - Perfil cromatográfico das proteínas do estádio E9. D - Perfil cromatográfico das proteínas do estádio E11
Fonte: Dados da pesquisa.
Figura 12 – Espectros de massa ilustrativos. A - Espectro de MS1. B – Espectro de fragmentação (MS2).
Fonte: Dados da pesquisa
A
B
A
C
Figura 13. Diagrama de Venn representando as proteínas identificadas nos diferentes estádios de desenvolvimento da semente de açaí (Euterpe oleracea Mart.).
Fonte: Dados da pesquisa.
5.2 Categorização funcional
As 1.080 proteínas identificadas foram classificadas em 19 classes (Figura 14). As
classes, metabolismo de carboidratos (MC), síntese de proteínas (SP), metabolismo de
aminoácidos (MA), parede celular (PC), metabolismo secundário (MS), metabolismo de
lipídeos (ML), transportadores (T), metabolismo de EROS (EROS) e chaperonas, heat schock
e proteínas relacionadas (CH), foram as que apresentaram maior representatividade, com 163,
107, 95, 86, 89, 70, 60, 57 e 50 proteínas, respectivamente. É importante salientar que
algumas proteínas foram classificadas em mais de uma classe funcional, dado o fato que
compartilham mais de uma via metabólica (Figura 14).
alongamento e degradação de ácidos graxos, e com o metabolismo de glicerolipídeos e
esfingolipídeos (Figura 17). Enquanto as proteínas do MS integram basicamente as rotas
biossintéticas de fenilpropanóides e flavonóides (Figura 18).
Figura 14. Classificação funcional de proteínas identificadas na semente de açaí (Euterpe oleeracea Mart.) em desenvolvimento, realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/).
Fonte: Dados da pesquisa
0 50 100 150 200 250
Núm
er
o
de pr
ot
eí
nas
Figura 15. Subcategorização das proteínas da classe ‘Metabolismo de Aminoácidos’ identificadas na semente de açaí (Euterpe oleracea Mart.) em desenvolvimento, realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/)
Fonte: Dados da pesquisa.
Figura 16. Subcategorização das proteínas da classe ‘Metabolismo de Carboidratos’ identificadas na semente de açaí (Euterpe oleracea Mart.) em desenvolvimento, realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/)
Fonte: Dados da pesquisa.
0 2 4 6 8 10 12 14 16 18 20 22 Biossíntese de arginina
Biossíntese de fenilalanina, tirosina triptofano Biossíntese de lisina Biossíntese de valina, leucina e isoleucina Degradação de lisina Degradação de valina, leucina e isoleucina Metabolismo de alanina, aspartato e glutamato Metabolismo de cisteina e metionina Metabolismo de fenilalanina Metabolismo de glicina, serina e treonina Metabolismo de tirosina Metabolismo de triptofano
Número de proteínas
Su bca teg or ias d o m etab olis m o de am in oác id os
0 10 20 30 40 50 60 70
Glicólise e Gliconeogênese Cíclo do ácido cítrico Via das pentoses fosfato Metabolismo de frutose e manose Metabolismo de galactose e sacarose Metabolismo de piruvato, glioxilato e
dicarboxilato
Proteínas relacionadas com metabolismo de carboidrato
Número de proteínas
Figura 17. Subcategorização das proteínas da classe ‘Metabolismo de Lipídeos’ identificadas na semente de açaí (Euterpe oleracea Mart.) em desenvolvimento, realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/)
Fonte: Dados da pesquisa.
Figura 18. Subcategorização das proteínas da classe ‘Metabolismo Secundário’ identificadas na semente de açaí (Euterpe oleracea Mart.) em desenvolvimento, realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/)
Fonte: Dados da pesquisa
0 5 10 15 20 25
Biossíntese e alongamento de ácidos graxos Degração de ácidos graxos Metabolismo de glicerolipídeos e
esfingolipídeos
Metabolismo de glicerofosfolipídeos Metabolismo do ácido araquidônico Metabolismo do ácido linoleico e do ácido
alfa-linoleico
Biossíntese de esteróis e hormônios esteróis Proteínas relacionadas ao metabolismo de
ácidos graxos
Número de proteínas
Su bca teg or ias d as p ro teín as do m etab olis m o de lip íd eo s
0 5 10 15 20 25 30
Biossíntese das unidades básicas dos terpenos Biossíntese de sesquiterpenos e triterpenos biossíntese de zeatina Biossíntese de flavonóides Biossíntese de isoflavonóides Biossíntese de antocianinas Biossíntese de fenilpropanóides Biossíntese de alcalóides de isoquinolina Biossíntese de alcalóides indol Biossíntese de tropane, piperidinas e …
Biossíntese de gligosinolatos Biossíntese de carotenóides Outras enzimas do metabolismo secundário
Número de proteínas
Figura 19. Classificação funcional das proteínas identificadas em cada estádio de desenvolvimento da semente de açaí (Euterpe oleeracea Mart.), realizada manualmente com base no Kegg pathway (http://www.genome.jp/kegg/pathway.html) e na descrição funcional disponível no UniProt (http://www.uniprot.org/).
Fonte: Dados da Pesquisa.
0
5
10
15
20
25
30
P
or
ce
ntag
em
(
%)
Classes funcionais
E3
E6
E9
5.3 Proteínas diferencialmente expressas
As proteínas diferencialmente expressas foram identificadas usando o módulo
TFold do PatternLab 4.0, que utiliza um estimador FDR teórico para maximizar as
identificações que satisfaçam o valor de corte do
fold change
que varia com P valor do teste t.
A quantificação relativa se deu pelas seis comparações possíveis entre os quatro estádios de
desenvolvimento estudados (Figura 20). Foram diferencialmente expressas 21, 43, 14, 37, 14
e 3 proteínas nas comparações E6/E3, E9/E3, E11/E3, E9/E6 e E11/E9, respectivamente
(Apêndices B, C, D, E, F e G - Tabelas suplementares 2, 3, 4, 5, 6 e 7, respectivamente).
A
B
Fonte: Dados da pesquisa.