Suplementação pós-natal com cacau melhora a qualidade óssea de ratas
submetidas ao desmame precoce
Postnatal cocoa supplementation improves bone quality in early weaning rats
DOI:10.34117/bjdv5n11-393
Recebimento dos originais: 07/10/2019 Aceitação para publicação: 02/12/2019
Letícia Monteiro da Fonseca Cardoso
Doutoranda do Programa de Pós-Graduação em Ciências Cardiovasculares Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: ticia.c@gmail.com
Juliana Arruda de Souza Monnerat
Mestranda do Programa de Pós-Graduação em Ciências Cardiovasculares Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: julianamonnerat@id.uff.br
Ana Clara Backer Boaretto Solér
Nutricionista graduada pela Universidade Federal Fluminense Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: anaclarabbsoler@hotmail.com
Igor Gonçalves Nimrichter
Nutricionista graduado pela Universidade Federal Fluminense Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: igorn@id.uff.br
Rafael Haubrich Santos da Silva
Nutricionista graduado pela Universidade Federal Fluminense Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: rafahaubrich@gmail.com
Douglas Moreira Muniz
Graduando em nutrição pela Universidade Federal Fluminense Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: douglasmmuniz@live.com
Nathalia da Silva Costa
Graduanda em nutrição na Universidade Federal Fluminense Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: tec.nathalia@gmail.com
Patrícia Pereira de Almeida
Mestranda do Programa de Pós-Graduação em Ciências Cardiovasculares Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: almeidapatricia@id.uff.br
Aline D’Ávila Pereira
Doutoranda do Programa de Pós-Graduação em Ciências Médicas Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: alinedape@gmail.com
Eduardo Moreira da Silva
Doutor em Odontologia pela Universidade de São Paulo Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: emsilva@vm.uff.br
Sergio Girão Barroso
Doutor em Fisiopatologia Clínica e Experimental pela Universidade do Estado do Rio de Janeiro Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: sgbarroso@yahoo.com
Caroline Fernandes dos Santos Bottino
Doutora em Biologia Humana e Experimental pela Universidade do Estado do Rio de Janeiro Instituição: Universidade Federal Fluminense
Endereço: Rua Dr. Silvio Henrique Braune, nº 22 - Centro, Nova Friburgo-RJ, Brasil. E-mail: cf_santos@id.uff.br
Gabrielle de Souza Rocha
Doutora em Ciências da Saúde pela Universidade Federal do Rio Grande do Norte Instituição: Universidade Federal Fluminense
Endereço: Rua Mário Santos Braga, nº 30 – Centro, Niterói-RJ, Brasil. E-mail: gabriellerocha@id.uff.br
RESUMO
O desmame precoce causa efeitos deletérios na saúde óssea. O cacau, devido à sua composição rica em polifenóis, pode ser capaz de reduzir esses efeitos deletérios. O objetivo deste estudo foi avaliar os efeitos da suplementação com cacau em pó nos parêmetros ósseos da prole de ratas Wistar submetidas ao desmame precoce. No nascimento, as mães e suas ninhadas foram separadas em 4 grupos: a) Controle (C); b) Controle suplementado com Cacau (C+Ca); c) Desmame precoce (DP); d) Desmame precoce suplementado com cacau (DP+Ca). Os filhotes separados da mãe no 21º dia (controle) e no 18º dia (desmame precoce) permaneceram nos grupos de origem (n=6/grupo). Massa corporal e consumo foram aferidos em balança de precisão. Após 90 dias, foram anestesiados e eutanasiados. Análises ósseas, composição óssea e propriedades biomecânicas do fêmur foram determinados. Resultados expressos como média±desvio padrão. Avaliados quanto sua normalidade utilizando teste Kolmogorov-Smirnov. Utilizado teste Kruskal-Wallis com pós-teste de Dunn ou ANOVA one way com pós-teste de Bonferroni quando apropriado. Resultados significativos quando
p≤0,05. Utilizou-se o software GraphPadPrisma versão 5.0. O consumo foi significativamente menor nos grupos C+Ca e DP+Ca (p<0,0001). Os grupos C+Ca e DP+Ca apresentaram massa corporal inical menor (p<0,0001) e, aos 90 dias de vida, o grupo C+Ca apresentou a massa corporal significativamente maior (p=0,002). Nos parâmetros ósseos observou-se que o grupo C+Ca apresentou largura do ponto médio da diáfise (p=0,008) e massa óssea (p=0,03) significativamente maiores que o grupo C. Em relação às propriedades biomecânicas, a força de ruptura do grupo DP+Ca foi significativamente menor quando comparado com C+Ca (p=0,05). Já o grupo DP apresentou módulo elástico significativamente menor que o C, e o grupo DP+Ca significativamente menor que o C+Ca e maior que o DP (p=0,016). Conclui-se que a suplementação com 10% de cacau em pó é capaz de melhorar a estrutura femoral em ratas em idade reprodutiva.
Palavras-chave: aleitamento materno, desmame precoce, saúde óssea, cacau ABSTRACT
Early weaning causes deleterious effects on bone health. Cocoa, because of its rich polyphenol composition, may be able to reduce these deleterious effects. The objective of this study was to evaluate the effects of supplementation with powdered cocoa on the bone parameters of offspring of Wistar rats submitted to early weaning. At birth, the mothers and their pups were separated into 4 groups: a) Control (C); b) Control supplemented with Cocoa (C + Ca); c) Early weaning (DP); d) Early weaning supplemented with cocoa (DP + Ca). The offspring separated from the mother on day 21 (control) and on day 18 (early weaning) remained in the groups of origin (n = 6 / group). Body mass and consumption were measured on a precision scale. After 90 days, they were anesthetized and euthanized. Bone analysis, bone composition and biomechanical properties of the femur were determined. Results expressed as mean ± standard deviation. Evaluated their normality using Kolmogorov-Smirnov test. Used Kruskal-Wallis test with Dunn post-test or ANOVA one way with Bonferroni post-test when appropriate. Significant results when p≤0.05. The software GraphPadPrisma version 5.0 was used. Consumption was significantly lower in the C + Ca and DP + Ca groups (p <0.0001). The C + Ca and DP + Ca groups showed lower initial body mass (p <0.0001) and, at 90 days of age, the C + Ca group had a significantly higher body mass (p = 0.002). In the bone parameters, it was observed that the C + Ca group had a significantly greater mean (P = 0.003) and bone mass (p = 0.03) width than the C group. Regarding the biomechanical properties, the strength of rupture of the DP + Ca group was significantly lower when compared to C + Ca (p = 0.05). The DP group presented a significantly lower elastic modulus than the C group, and the DP + Ca group was significantly lower than the C + Ca group and higher than the DP group (p = 0.016). It is concluded that the supplementation with 10% cocoa powder is capable of improving the femoral structure in rats of reproductive age.
Keywords: breastfeeding, early weaning, bone health, cocoa 1 INTRODUÇÃO
A recomendação do Ministério da Saúde é que a amamentação exclusiva seja feita até os 6 meses de idade, e que perdure até os 2 anos de idade ou mais com a alimentação complementar [1]. Atualmente, com a inserção das mulheres no mercado de trabalho e a introdução precoce da alimentação complementar, o aleitamento materno acaba sendo interrompido antes dos 6 meses de idade [2]. Outro motivo bastante relevante para o desmame precoce é o medo por parte das mães do seu leite não ser suficiente para as necessidades do bebê, alegando “leite fraco” ou “pouco leite” [3].
O desmame, quando ocorre precocemente, está associado com o desenvolvimento de diversas doenças, dentre elas as doenças ósseas [1].
O aleitamento materno proporciona efeitos benéficos tanto para a mãe quanto para a prole. Na mãe, beneficia a saúde da mulher, sendo um fator protetor para patologias como o câncer de mama, canceres ovarianos e fraturas ósseas por osteoporose. [4]. Na criança, proporciona uma nutrição completa para o crescimento e desenvolvimento, visto que fornece todos os nutrientes necessários para o desenvolvimento ósseo [5]. Em seu estudo, Jones et al. (2013), sugerem que a amamentação está associada a maior massa óssea e, consequentemente, um menor risco de fraturas em adolescentes [6]. Em outro estudo, Maia et al. (2012) observaram, em ratos neonatos, que o desmame precoce promove menor densidade e conteúdo mineral ósseo através da desregulação hormonal do metabolismo ósseo [7].
A massa óssea atingida durante a infância e adolescência é o principal fator que determina a saúde esquelética ao longo da vida e o risco de osteoporose [8]. Isso ocorre porque cerca de 40% da massa óssea corporal é atingida durante a adolescência, onde 90% é acumulada aos 18 anos e o pico é atingido pelo final dos 20 anos de idade [9]. O acúmulo de massa óssea ocorre até os 30 anos, sendo este maior nos homens do que nas mulheres. Depois desse período há perda de 0,3% por ano. Nos 10 anos após a menopausa, estima-se que a perda seja de 3% ao ano nas mulheres, caracterizando-as como o principal grupo de risco para o desenvolvimento de osteoporose em longo prazo [10].
Nesse contexto, vem aumentando a busca por fatores que atuem na manutenção da saúde óssea durante o crescimento e desenvolvimento. Os alimentos com propriedades funcionais ofererem vários benefícios à saúde pois são ricos em compostos bioativos com alta capacidade antioxidante, chamados de polifenóis [11]. Diante disso destaca-se o cacau, um alimento rico em polifenóis, principalmente flavonóis, que devido a sua alta capacidade antioxidante e anti-inflamatória, pode atuar beneficamente na manutenção da saúde óssea através da redução, da reabsorção e aumento da formação óssea [12].
Tendo em vista o quadro atual de desmame precoce e sua relação com a fragilidade óssea e os benefícios do cacau, é de suma importância verificar se o cacau é capaz de minimizar os efeitos negativos decorrentes do desmame precoce na saúde óssea na população de risco. Assim, o objetivo do presente estudo é avaliar os efeitos da suplementação com cacau em pó nos parâmetros ósseos da prole de ratas Wistar submetidas ao desmame precoce.
2 MATERIAIS E MÉTODOS
Este estudo foi aprovado pela Comissão de Ética no uso de animais da Universidade Federal Fluminense (CEUA/UFF nº 1032/2017) e foi realizado com Rattus novergicus, variedade albinus, linhagem Wistar provenientes do Biotério do Laboratório de Nutrição Experimental da Universidade Federal Fluminense (LABNE/UFF). Durante todo o período experimental os animais foram mantidos em gaiolas individuais de polipropileno, conforme a necessidade, em ambiente com temperatura controlada (24 ºC ± 2 ºC) e iluminação adequada (ciclo claro e escuro de 12 em 12 horas).
Para o acasalamento, as fêmeas foram colocadas em gaiolas coletivas, com machos na proporção de duas fêmeas para cada macho. Uma vez grávidas, as mesmas foram separadas em gaiolas individuais para o nascimento dos filhotes. Durante a gestação essas ratas receberam ração comercial NUVILAB® e água ad libitum.
Após o nascimento dos filhotes, para um melhor aproveitamento lactotrófico, a prole foi ajustada para 6 filhotes fêmeas para cada mãe. As mães e sua ninhada foram divididas em 4 grupos, em gaiolas coletivas, de acordo com a duração da lactação e alimentação materna durante a lactação (n=1 mãe/grupo e n=6 filhotes/grupo), onde receberam ração e água ad libitum:
a) Grupo controle (C): receberam ração comercial padrão (NUVILAB®) durante e após a lactação, desmame realizado no 21º dia após do nascimento dos filhotes;
b) Grupo controle suplementado com cacau (C+Ca): receberam ração comercial padrão (NUVILAB®) suplementada com 10% de cacau em pó durante e após a lactação, desmame realizado no 21º dia após do nascimento dos filhotes;
c) Grupo controle desmame precoce (DP): os filhotes receberam ração comercial padrão (NUVILAB®) durante e após a lactação, desmame realizado no 18º dia após do nascimento dos filhotes;
d) Grupo cacau desmame precoce (DP+Ca): os filhotes receberam ração comercial padrão (NUVILAB®) suplementada com 10% de cacau em pó durante e após a lactação, desmame realizado no 18º dia após do nascimento dos filhotes.
Após o desmame, os filhotes receberam as mesmas rações de acordo com os seus respectivos grupos de origem e foram acompanhados até completarem 90 dias de vida.
2.2 FORMULAÇÃO DAS RAÇÕES
Os animais receberam ração comercial padrão NUVILAB® suplementada ou não com 10% de cacau em pó. O quadro 1 apresenta a composição nutricional da ração comercial padrão e a composição da ração com a suplementação de cacau.
Quadro 1: Composição nutricional da ração controle e ração suplementada com cacau (g em 100g).
Informação nutricional (g/100g) Controle Suplementada com cacau (10%) Proteína 24,8 24 Carboidratos 44,8 41,32 Lipídios 3,4 3,9 Minerais 8,2 7,38 Vitaminas 1 0,9 Fibra alimentar 18,8 21
Valor energético Kcal 309 296,4
Composição da ração NUVLAB®: Carbonato de cálcio, farelo de milho, farelo de soja, farelo de trigo, fosfato bicálcico, cloreto de sódio, premix mineral vitamínico e aminoácidos.
Fonte: Ração comercial (Nuvilab-NUVITAL Nutrientes LTDA, Paraná, Brasil);
Fonte: Cacau utilizado para a confecção da ração suplementada (ArmaZen LTDA, Brasil). 2.3 EUTANÁSIA E COLETA DO FÊMUR
Após 90 dias de vida, os animais foram anestesiados por via intraperitoneal com uma solução contendo Ketamina® (0,8 mL/g) e Xilazina® (0,1 mL/100g), após, foram submetidos à incisão mento-pubiana com subsequente abertura das cavidades torácicas e abdominal. A abertura da cavidade abdominal foi feita removendo-se a pele e o peritônio e expondo as vísceras e o sangue foi coletado por punção cardíaca até exsanguinação total. Em seguida, o fêmur direito foi retirado e armazenado no -80ºC para as posteriores avaliações dos parâmetros ósseos.
2.4 PARÂMETROS ÓSSEOS 2.4.1 Dimenssões ósseas
O fêmur de cada animal, depois de limpo, foi pesado em balança analítica (precisão 0,0001 Bosch S2000, Brasil) para mensuração da massa óssea. Após, foi mensurado a distância entre as epífises com o auxílio de um paquímetro digital (JOMARCA, 0,01 mm) e com essa distância, foi calculado o ponto médio do fêmur e a partir deste, a largura da diáfise também através do paquímetro (JOMARCA, 0,01 mm).
2.4.2 Composição óssea
A composição óssea do fêmur foi realizada no Laboratório de Avaliação Nutricional e Funcional da UFF (LANUFF), através do Dual-energy X-ray Absorptiometry (DXA), foram avaliados: densidade mineral óssea (DMO), conteúdo mineral ósseo (CMO) e área do osso em cada fêmur foi determinado como descrito em 2017 por Cardoso et al [13].
Esta análise foi realizada no Laboratório Analítico de Biomateriais Restauradores da Faculdade de Odontologia da UFF, através de teste de flexão de três pontos universais na Máquina Universal de Ensaio (MUE) (DL 2000, EMIC, São José dos Pinhais, SP, Brasil), no qual a força foi aplicada perpendicularmente ao eixo longitudinal do osso, na porção medial sob velocidade constante de 0,5 cm/min até o momento da ruptura do osso com a capacidade da célula de carga de 200 kgf. As extremidades dos ossos foram apoiadas em dois rolos de diâmetro de 3 mm e o raio de 21,70 mm. A força máxima (N), a força de ruptura (N) e o módulo elástico (MPa) foram obtidos através do software.
3 ANÁLISES ESTATÍSTICAS
Os resultados foram expressos através da estatística descritiva como média e desvio padrão. Os dados foram avaliados quanto a sua normalidade utilizando o teste Kolmogorov-Smirnov. Para comparação entre os grupos foi utilizado ANOVA one way com pós teste de Bonferroni ou Kruskal-Wallis com pós teste de Dunn quando apropriado. Foram considerados significativos os resultados que apresentaram p≤0,05. Para estas análises utilizou-se o software GraphPad Prisma versão 5.0.
4 RESULTADOS
4.1 CONSUMO ALIMENTAR
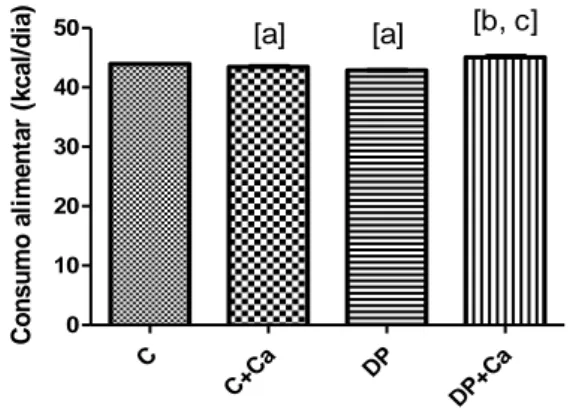
A figura 1 apresenta os resultados de consumo alimentar (kcal) dos animais aos 90 dias de vida.
É possível observar que o consumo foi significativamente menor nos grupos C+Ca e DP quando comparados ao grupo C e maior no grupo DP+Ca quando comparado aos grupos C+Ca e DP (p<0,0001).
Figura 1. Consumo alimentar (Kcal) dos animais.
C C+Ca DP DP+C a 0 10 20 30 40 50 [a] [a] [b, c] C o n s u m o a li m e n ta r (k c a l/ d ia )
Grupo Controle (C); Grupo Controle Cacau (C+Ca); Grupo Desmame Precoce (DP); Grupo Desmame Precoce Cacau (DP+Ca). [a] quando comparado ao grupo C, [b] quando comparado ao grupo C+Ca, [c] quando comparado ao grupo DP; significativo quando p≤0,05. ANOVA one-way com pós-teste de Bonferroni.
4.2 MASSA CORPORAL
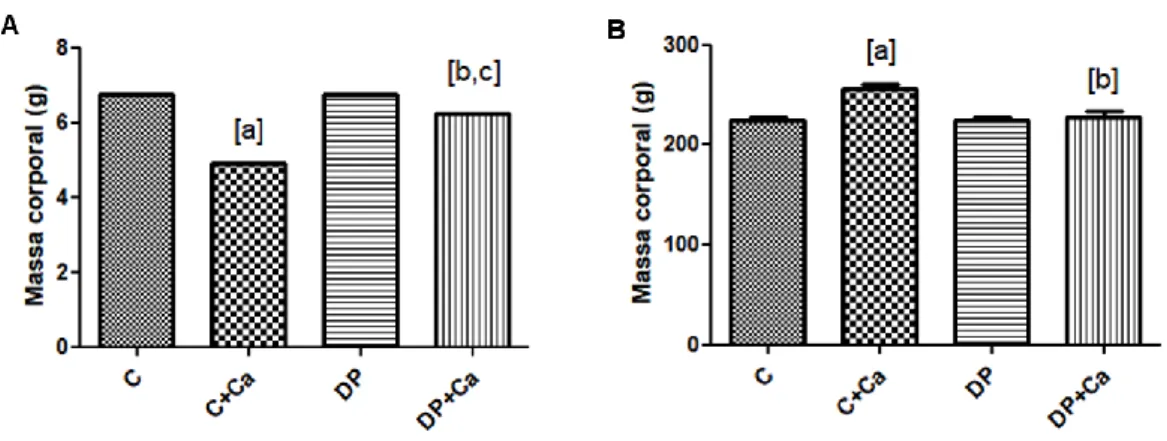
Na figura 2 são apresentados os resultados da massa corporal inicial, no dia do nascimento (A), e final (B), aos 90 dias de vida dos animais.
Foi possível observar que no inicio do período experimental, o grupo C+Ca apresentou massa corporal significativamente menor quando comparado ao grupo C e o grupo DP+Ca apresentou massa corporal signifiativamente menor quando comparado ao grupo DP e maior quando comparado com o grupo C+Ca (p<0,0001). Aos 90 dias de vida, o grupo C+Ca apresentou a massa corporal significativamente maior quando comparados aos grupos C e DP+Ca (p=0,002).
Figura 2. Massa corporal inicial (A) e massa corporal final (B) dos animais (n=6/grupo).
Grupo Controle (C); Grupo Controle Cacau (C+Ca); Grupo Desmame Precoce (DP); Grupo Desmame Precoce Cacau (DP+Ca).). [a] quando comparado ao grupo C, [b] quando comparado ao grupo C+Ca, [c] quando comparado ao grupo DP; significativo quando p≤0,05. ANOVA one-way com pós-teste de Bonferroni. 4.3 DIMENSSÕES ÓSSEAS
A Tabela 1 apresenta os resultados das análises ósseas do fêmur direito das ratas fêmeas aos 90 dias de vida.
É possível observar que a largura do ponto médio dos grupos C+Ca foi significativamente maior quando comparado ao grupo C. Quanto à massa, o C+Ca é significativamente maior do que o C. Não houve diferença significativa em outros parâmetros.
Tabela 1. Dimenssões do fêmur direito das ratas fêmeas aos 90 dias de vida (n=6/grupo). C C+Ca DP DP+Ca p Distância entre as Epífises (mm) 32,50±0,40 33,29±0,48 32,73±0,77 32,92±0,85 0,32 Larg. do Ponto médio (mm) 3,54±0,10 3,95±0,10a 3,58±0,05 3,79±0,22 0,0008 Massa (g) 0,65±0,01 0,72±0,02a 0,70±0,03 0,71±0,05 0,03
Grupo Controle (C); Grupo Controle Cacau (C+Ca); Grupo Desmame Precoce (DP); Grupo Desmame Precoce Cacau (DP+Ca). [a] quando comparado ao grupo C; significativo quando p≤0,05. ANOVA one-way com pós-teste de Bonferroni ou Kruskal-Wallis com pós-pós-teste de Dunn’s.
4.4 COMPOSIÇÃO ÓSSEA
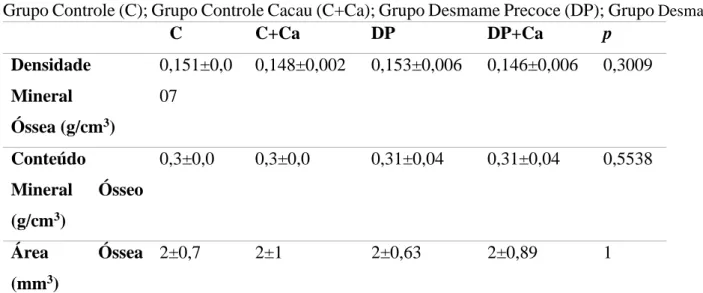
A Tabela 2 apresenta os resultados obtidos através do DXA realizado no fêmur direito das ratas fêmeas aos 90 dias de vida. Não houve diferença significativa nesses parâmetros.
Tabela 2. Composição óssea do fêmur direito das ratas fêmeas aos 90 dias de vida (n=6/grupo).
Grupo Controle (C); Grupo Controle Cacau (C+Ca); Grupo Desmame Precoce (DP); Grupo Desmame
Precoce Cacau (DP+Ca). ANOVA one-way com pós-teste de Bonferroni ou Kruskal-Wallis com pós-teste de Dunn’s.
4.5 PROPRIEDADES BIOMECÂNICAS
A Tabela 3 apresenta os resultados obtidos através do ensaio biomecânico realizado no fêmur direito das ratas fêmeas aos 90 dias de vida. É possível observar que o grupo DP+Ca apresentou força de ruptura significativamente menor quando comparado ao grupo C+Ca. Além disso, o grupo DP apresentou módulo elástico siginificativamente menor que o grupo C e o grupo DP+Ca apresentou
C C+Ca DP DP+Ca p Densidade Mineral Óssea (g/cm3) 0,151±0,0 07 0,148±0,002 0,153±0,006 0,146±0,006 0,3009 Conteúdo Mineral Ósseo (g/cm3) 0,3±0,0 0,3±0,0 0,31±0,04 0,31±0,04 0,5538 Área Óssea (mm3) 2±0,7 2±1 2±0,63 2±0,89 1
módulo elástico significativamente menor que o grupo C+Ca e siginificativamente maior que o grupo DP.
Tabela 3. Propriedades biomecânicas do fêmur direito das ratas fêmeas aos 90 dias de vida (n=6/grupo).
C C+Ca DP DP+Ca p Força máxima (N) 91,00±10,77 95,75±3,86 85,33±7,33 86±7,52 0,210 Força de ruptura (N) 90,60±10,95 98,25±1,258 83,40±6,269 86±7,528b 0,05 Módulo elástico (Mpa) 462982±49926 485234±70594 364430±14347a 411335±37163b,c 0,016
Grupo Controle (C); Grupo Controle Cacau (C+Ca); Grupo Desmame Precoce (DP); Grupo Desmame Precoce Cacau (DP+Ca). [a] quando comparado ao grupo C, [b] quando comparado ao grupo C+Ca, [c] quando comparado ao grupo DP; significativo quando p< ou = 0,05 ANOVA one-way com pós-teste de Bonferroni ou Kruskal-Wallis com pós-teste de Dunn’s.
5 DISCUSSÃO
De acordo com os resultados encontrados, no nascimento, o grupo C+Ca apresentou massa corporal significativamente menor quando comparado ao grupo C e o grupo DP+Ca apresentou massa corporal significativamente menor quando comparado aos grupos C+Ca e DP. Uma limitação para esse resultado é que a massa corporal dos grupos no momento do nascimento não demonstrou homogeneidade, uma vez que os grupos C+Ca e DP+Ca apresentaram massa corporal significativamente menor quando comparados aos demais grupos. Isso ocorreu porque o número de mães que deram à luz a ratas no mesmo dia não foi suficiente para que houvesse uma randomização dos grupos.
Entretanto, aos 90 dias de vida, o grupo C+Ca apresentou a massa corporal significativamente maior. Apesar da maior massa corporal, o grupo C+Ca não apresentou aumento no consumo alimentar nesse mesmo período, resultado que está relacionado com o efeito do cacau sobre a saciedade dos animais. No estudo de Yamashita et al., os polifenóis do cacau foram isolados e administrados mostrando resultados no aumento na secreção do peptídeo 1 semelhante ao glucagon (GLP-1, sigla
do inglês Glucagon-like peptide-1), que apresenta efeito anorexigênico. Além disso o cacau é rico em fibras que contribui para o aumento da saciedade [14].
Baseado nisso, sugere-se que a maior massa corporal possa estar relacionada com um possível aumento da massa magra nesses animais. Foi observado, no estudo de Gutierrez-Salmean et al. que o cacau pode promover o aumento da massa muscular levando à maior massa corporal, uma vez que o consumo de epicatequina e cacau leva ao aumento dos níveis de marcadores de crescimento muscular em ratos e humanos [15].
Esse aumento na massa corporal encontrado no grupo C+Ca pode ter contribuído para os resultados satisfatórios encontrados nesse grupo. No presente estudo, ao avaliar a largura do ponto médio da diáfise e a massa do fêmur, verifica-se que a suplementação com cacau exerce influência positiva na geometria óssea. Carvalho et al., demostraram que o aumento da massa corporal, gera um aumento na carga mecânica provocando microdeformações na geometria óssea, estimulando células osteoblásticas e, consequentemente, promovendo adaptações ósseas, relacionadas com menor reabsorção óssea e aumento na formação óssea [16]. Outro fator que contribui para o aumento da formação óssea é o acúmulo de massa óssea que ocorre nas fases iniciais da vida.
O acúmulo de massa óssea ocorre durante a infância, adolescência e a idade adulta jovem. Dependendo do pico de massa óssea obtido, esta diminui consideravelmente e pode ser caracterizado como o limite da fragilidade óssea, o que marca o início do processo de osteoporose e de fraturas ósseas principalmente em mulheres, este fator é influenciado principalmente pela qualidade e resistência óssea [17].
A resistência óssea é determinada pela massa, geometria e qualidade óssea, sendo que esta última característica inclui muitos aspectos dessa estrutura [18]. O ensaio biomecânico possibilita a observação das principais propriedades biomecânicas do tecido ósseo. De acordo com Meltonet al. (1986), essas propriedades correspondem a parâmetros importantes, cujo aspecto clínico é de maior relevância na osteoporose e referente ao risco de fraturas [19]. Como observado no presente estudo, o grupo DP+Ca apresentou força de ruptura e módulo elástico significativamente menor quando comparado ao grupo C+Ca, além disso, o grupo DP apresentou módulo elástico significativamente menor que o grupo C e o grupo DP+Ca, indicando que o desmame precoce foi o fator responsável pela redução nesses parâmetros que avaliam a resistência óssea.
Nos primeiros seis meses de vida, o nível de cálcio presente no leite materno é relativamente constante e sua absorção é mais eficaz quando comparado com fórmulas lácteas, gerando aumento de massa óssea e contribuindo para sua manutenção [20]. Isso pode explicar o fato de o grupo desmamado precocemente ter apresentados resultados inferiores.
Além desses resultados do ensaio biomecânico, observou-se também que o grupo DP+Ca apresentou módulo elástico significativamente maior que o grupo DP. Esse resultado aponta que a suplementação com cacau apresentou efeitos benéficos que podem ser capazes de reduzir o risco de fraturas, e que são atribuídos à sua composição.
A semente de cacau, o cacau em pó e os chocolates amargos são ricos em compostos fenólicos, sendo os principais encontrados nas sementes de cacau a (+) -catequina e a (–) -epicatequina [12]. Estudos vem comprovando os benefícios derivados da dieta suplementada com polifenóis na prevenção e tratamento da osteoporose. Os polifenóis são capazes de proteger a estrutura óssea através de quatro mecanismos: I) devido às suas propriedades antioxidantes, [21] através da redução da perda óssea uma vez que os radicais livres promovem um aumento na reabsorção óssea (9); II) ação anti-inflamatória, em que os polifenóis atuam na regulação de mediadores inflamatórios reduzindo a diferenciação de osteoclastos [22, 23, 24, 25]; III) efeitos anabólicos, promovendo aumento na diferenciação dos osteoblastos levando ao aumento na formação óssea [26, 27, 28]; IV) Através da apoptose dos osteoclastos [29, 30].
Embora, a suplementação com cacau tenha demonstrado efeitos positivos nas dimensões ósseas e propriedades biomecânicas, não foram encontradas diferenças significativas em relação à DMO, CMO e área óssea. Isso pode ser explicado pela idade das ratas, que se encontravam em idade reprodutiva. Durante esse período, o estrogênio desempenha um papel importante na manutenção óssea. Em mulheres adultas, o estrogênio retarda a remodelação óssea, mantendo o equilíbrio adequado entre a formação e a reabsorção óssea. Os efeitos da deficiência de estrogênio levam ao aumento da atividade de células responsáveis pela reabsorção óssea, os osteoclastos, levando ao aumento no risco de fratura [31].
O estudo de Cardoso et al, observou em ratas aos 150 dias de vida recebendo bebidas ricas em polifenóis, que o consumo dessas bebidas pode ser capaz de aumentar a DMO, uma vez que contribuem para o aumento das concentrações de estrogênio circulantes [13]. Os polifenóis presentes no cacau atuam como fitoestrógenos, sendo assim, potenciais substitutos para o estrogênio podendo atuar de maneira benéfica na saúde óssea, diante da deficiência deste hormônio como ocorre no período pós menopausa [32]. Sugere-se que a suplementação com cacau em ratas mais velhas poderia ter efeitos mais significativos na DMO e no CMO.
6 CONCLUSÃO
É possível concluir que o desmame precoce prejudica a estrutura e resistência femoral e que a suplementação com 10% de cacau em pó é capaz de promover aumento da qualidade óssea em ratas
em idade reprodutiva, podendo ser utilizada como estratégia terapêutica na prevenção da fragilidade óssea.
Mais estudos são necessários para avaliar o metabolismo ósseo diante do modelo estudado.
REFERÊNCIAS
[1] Ministério da Saúde. Saúde da criança: Aleitamento materno e alimentação complementar. Brasília, DF 2015.
[2] Chuang et al. Maternal return to work and breastfeeding: a population-based cohort study. Int J Nurs Stud. 2010; Apr; 47(4): 461-74
[3] Araújo OD, Cunha AL, Lustosa LR, Nery IS, Mendonça RCM, Campelo SMA. Aleitamento materno: fatores que levam ao desmame precoce. Rev Bras Enferm. 2008;61(4):488-492.
[4] Oliveira CS, Locca FA, Carrijo MLR, Garcia RATM. Amamentação e as intercorrências que contribuem para o desmame precoce. Rev Gaúcha Enferm. 2015;36(esp): 16-23.
[5] Lane JM. Diagnosis and managment of orthopaedic problems commonly found in women: osteoporosis. American Academy of Orthopaedic Surgeons 65th Annual Meeting, New Orleans, 1998.
[6] Jones G, Hynes KL, Dwyer T. The association between breastfeeding, maternal smoking in utero, and birth weight with bone mass and fractures in adolescents: a 16- year longitudinal study. Osteoporos. Int. 2013;24:1605-1611.
[7] Maia LA, Lisboa PC, de Oliveira E, Lima NS, da Costa CA, de Moura EG. Two models of early weaning decreases bone structure by different changes in hormonal regulation of bone metabolism in neonate rat. Horm. Metab. Res. 2012; 44: 1-6.
[8] Maggio D, Barabani M, Pierandrei M, Polidori MC, Catani M, Mecocci P, Senin U, Pacifici R, Cherubini A. Marked decrease in plasma antioxidants in aged osteoporotic women: results of a cross-sectional study. J Clin Endocrinol Metab. 2003;88:1523-1527.
[9] Callaway DA, Jiang JX. Reactive oxigen species and oxidative stress in osteoclastogenesis, skeletal aging and bone disease. J Bone Miner Metab. 2015.
[10] Tosi, L.L.: Diagnosis and managment of orthopaedic problems commonly found in women : osteoporosis. American Academy of Orthopaedic Surgeons 65th Annual Meeting, New Orleans, 1998.
[11] Guimarães MM, Figueiredo TVB, Machado BAS, Druzian JI Utilização de chocolates ricos em polifenóis e com ação antioxidante: busca em bases de patentes. Cadernos de Prospecção. 2012; 5(3): 168-177.
[12] Efraim P, Alves AB, Jardim DCP. Polifenóis em cacau e derivados: teores, fatores de variação e efeitos na saúde. Braz. J. Food.Technol. 2011; 14(3):181-201.
[13] Cardoso LMDF, Pimenta NDMA, Fiochi RDSF, Mota BFM, Monnerat JAS, Teixeira CC, et al. Effect sofred wine, grape juice and resveratrol consumption on boné parameters of Wistar rats submitted to high-fat diet andphysical training. NutrHosp. 2017 Oct 27;35(2):416-420.
[14] Yamashita Y, Okabe M, Natsume M, Ashida H. Cinnamtannin A2, a tetramericprocyanidin, increases GLP-1 and insulin secretion in mice. BiosciBiotechnolBiochem. 2013;77, 888–91.
[15] Gutiérrez-Salmeán G, Ortiz-Vilchis P, Vacaseydel CM, Rubio-Gayosso I, Meaney E, Villarreal F, et al. Effects of (-)-epicatechin on molecular modulators of skeletal muscle growth and differentiation. J Nutr Biochem. 2014;25(1):91-4.
[16] Carvalho, D. C., Rosim, G. C., Gama, L. O. R., Tavares, M. R., Tribioli, R. A., Santos, I. R., & Cliquet Jr, A. (2002). Tratamentos não farmacológicos na estimulação da osteogênese. Revista de
Saúde Pública, 36, 647-654.
[17] Renner E. Dairy Calcium, Bone Metabolism, and Prevention of Osteoporosis. J Dairy Sci. 1994 Dec; 77(12): 3498-505.
[18] Compston J. Bone quality: what is it and how is it measured? Arq Bras Endocrinol Metab. 2006; 50(4): 579-585.
[19] Melton III, LJ, et al. Osteoporosis and the risk of hip fracture. Am J Epidemiol.1986; 124: 254- 261.
[20] Andres A, Casey PH, Cleves MA, Badger TM. Body fat and bone mineral content of infants fed breast milk, cow`s milk formula, or soy formula during the first year of life. The Journal of Pediatrics. 2012; 163(1):49-54.
[21] Domazetovic V, Marcucci G, IantomasiT, Brandi ML, Vincenzini MT. Oxidative stress in boneremodeling: role of antioxidants. Clin Cases Miner Bone Metab. 2017 Oct 25; 14(2):209-216. [22] Bodet C, Chandad F, Grenier D. Cranberry components inhibit interleukin-6, interleukin-8, and prostaglandin E2 production by lipopolysaccharide-activated gingival fibroblasts. Eur J Oral Sci. 2007 Feb; 115(1):64-70.
[23] Palmqvist P, Persson E, Conaway HH, Lerner UH. IL-6, leukemia inhibitory factor, and on costatin M stimulate one resorption and regulate the expression of receptor activator of NF-kappa B ligand, osteoprotegerin, and receptor activatorof NF-kappa B in mouse calvariae. J Immunol. 2002 Sep 15; 169(6):3353-62.
[24] Park JY, Pillinger MH. Interleukin-6 in the pathogenesis of rheumatoid arthritis. Bull NYU HospJtDis. 2007; 65(1):4-10.
[25] Yao Z, Xing L, Qin C, Schwarz EM, Boyce BF. Osteoclast precursor interaction with boné matrix induces osteoclast formation directly by an interleukin-1-mediated autocrine mechanism. J BiolChem. 2008 Apr 11; 283(15):9917-24.
[26] Trzeciakiewicz A, Habauzit V, Mercier S, Lebecque P, Davicco MJ, Coxam V, et al. Hesperetin stimulates differentiation of primary rat osteoblastos involving the BMP signalling pathway. J NutrBiochem. 2010 May; 21(5):424-31.
[27] Byun MR, Sung MK, Kim AR, Lee CH, Jang EJ, Jeong MG, et al. (-)-Epicatechin gallate (ECG) stimulates osteoblast differentiation via Runt-related transcription factor 2 (RUNX2) and transcriptional coactivator with PDZ-binding motif (TAZ)-mediated transcriptional activation. J BiolChem. 2014 Apr 4; 289(14):9926-35.
[28] Santiago-Mora R, Casado-Díaz A, De Castro MD, Quesada-Gómez JM. Oleuropein enhances osteoblastogenesis and inhibits adipogenesis: the effecton differentiation in stemcells derived from boné marrow. Osteoporos Int. 2011 Feb; 22(2):675-84.
[29] Gao YH, Yamaguchi M. Inhibitory effect of genistein on osteoclast-like cell formation in mouse marrow cultures. BiochemPharmacol. 1999 Sep 1;58(5):767-72
[30] Yamaguchi M, Gao YH. Inhibitory effect of genistein on bone resorption in tissue culture. BiochemPharmacol. 1998 Jan 1; 55(1):71-6.
[31] Turner RT, Sibonga JD. Effects of Alcohol Use and Estrogen on Bone. Alcohol Res Health. 2001; 25(4):276-81.
[32] Sari ABT, Jati M, Pudjiastuti P, Baktir A. Uterus Weight of Ovariectomized Rats Given Cocoa Powder and Extract. Pelita Perkebunan. 2017 Apr; 33(1):45-50.