Analítica
Avançada
Profa. Dra. Viviane Gomes Bonifacio
gomesbonifacio@gmail.com
COMPLEXO – espécie química na qual um cátion metálico está covalentemente ligado a um ou mais grupos coordenantes.
Ex.: Ag(NH3)2+, Fe(CN)6
3-O cátion metálico geralmente recebe o nome de CENTRO METÁLICO
Os grupos coordenantes são chamados de LIGANTES
Formação de complexos do ponto de vista da definição de Lewis é uma reação ácido-base.
Ácido de Lewis – espécie com um orbital vazio capaz de receber um par de elétrons
o átomo central precisa estar hábil a aceitar o par de elétrons de cada ligante
Base de Lewis – espécie capaz de doar um par de elétrons para formar uma ligação covalente
• o ligante compartilha um par de elétrons com o átomo central na formação de uma ligação covalente.
• M = átomo central e
• :L = ligante com o par de elétrons não compartilhado.
• Qualquer uma das três espécies, M, :L, e M:L, podem ter uma carga elétrica.
M + :L
M:L
Átomo central Ligante
complexo
Número máximo de coordenação
ligante químico
• é um ânion ou uma espécie neutra, com comportamento de base de LEWIS.
• “dente” = uma carga aniônica ou a um par de elétrons disponível
para interações de coordenação
• um sítio de coordenação (monodentados): NH3, CN-, H 2O
• mais de um sítio de coordenação (polidentados): H2N-CH2-CH2-NH2 – Etilenodiamina (en) ligante Bidentado
Importante
•
Nas reações de complexação:
–
Concentrações Analíticas
–
Concentrações de Equilíbrio
–
Acidez do meio
–
Comportamento ácido-base
•
As Relações das espécies em equilíbrio são
fundamentais para o entendimento dos Métodos
Clássicos Analíticos de Complexação:
–
Separações Químicas,
–
Volumetria de Complexação,
–
Gravimetria,
–
Métodos Instrumentais baseados em formação de
Para o Íon Coordenante: O Número de Coordenação é o principal parâmetro.
Exemplo de formação de um íon complexo
•
reação entre o íon prata e amônia para produzir o
complexo diaminprata.
Ag
++ 2 NH
3
Ag(NH
3)
2+•
Cada molécula de amônia doa um par de elétrons para
íon prata, e a uma ligação covalente é formada entre as
duas espécies.
•
é uma reação ácido-base de Lewis
–
o íon prata é o
•
reação entre o íon hexaquacromo (III), Cr(H
2O)
6+++, e
cianeto para formar o ânion hexacianocromato (III):
Ligante molécula neutra Ligante íon cianeto Positivamente carregado Negativamente carregado
O crômio, está no mesmo estado de oxidação (tripositivo) em ambos os complexos.
•
É possível para um átomo central de um íon complexo
possuir estado de oxidação zero, como o níquel em
Ni(CN)
4-ou o ferro em Fe(CO)
.
Geometria octaédrica
Número de coordenação
• A água frequentemente funciona com um ligante em soluções aquosas de íons metálicos. Porém para simplificar é conveniente
omitir a água da fórmula do íon complexo, assim o hexaquacromo
(III) e é representado da seguinte forma:
Cr3+ + 6 CN- Cr(CN) 6
3-• Tal situação é comparável ao uso de H+ como próton hidratado em
• Embora a posição de equilíbrio para o sistema crômio (III) – cianeto
– água encontra-se bem para a direita para a reação como está escrita, o que demonstra a estabilidade relativamente alta do íon
hexacianocromato (III)
• a formação deste íon complexo ocorre apenas muito lentamente à temperatura ambiente, particularmente na ausência de um grande
excesso de íon cianeto.
• Esta lentidão da reação é indicativo do fato de que íons cianeto não podem facilmente deslocar as moléculas de água ligadas ao
LABILIDADE
•
É a capacidade do complexo de quebrar as suas
ligações e formar outras ligações com compostos
mais estáveis, tendo assim um caráter cinético.
•
Depende muito do íon metálico central e dos
ligantes.
•
Se o complexo for submetido a um composto onde
ele ficará mais estável ele pode ser chamado de
complexo lábil.
•
Se o complexo for submetido a outro composto
• Complexo inerte ou não lábil:
– crômio(III), cobalto(III), e platina (IV).
• Complexos reativos ou lábil:
– cobalto(II), cobre, chumbo, bismuto, prata, cadmio, níquel, zinco, mercúrio e alumínio.
• Muitos complexos de ferro (III) e ferro(II) são lábeis, mas os complexos com cianeto Fe(CN)63- e Fe(CN)
64- são exemplos
Teoria de equilíbrio químico também pode ser empregada para descrever a formação/dissociação de íons complexos.
M + L
⇄
ML
Ex.: Ag
++ 2NH
3
⇄
Ag(NH
3)
2+Equilíbrio de complexação
2 3 2 3
]
][
[
]
)
[Ag(NH
NH
Ag
K
+ +=
K é chamado de constante de formação ou constante de estabilidade[ ML ]
[ M ] [ L ]
K
f=
Equilíbrio de complexação
No que se refere a titulação complexométrica, o uso de um ligante monodentado possui pouca utilidade porque existe a possibilidade de uma distribuição de espécies com diferentes nº de ligantes. Ex
2 3 2 3 ] NH ][ Ag [ ] ) [Ag(NH K + + =
Ag+ + 2NH
3 Ag(NH3)2+
Porém, K na forma escrita refere-se ao equilíbrio global, na realidade, esta reação ocorre em etapas:
Ag+ + NH
3 Ag(NH3)+
] NH ][ Ag [ ] ) [Ag(NH K 3 3 1 + + =
Ag(NH3)+ + NH
3 Ag(NH3)2+ 2
2 3 2 ] NH ][ ) NH ( Ag [ ] ) [Ag(NH K + + =
= 2,5 x 103
Exemplo de equilíbrio de complexação
• interação entre o íon zinco hidratado e a amônia
• Zn (H2O)42+ + NH
3 Zn(NH3)(H2O)32+ + H2O
• Zn(NH3)(H2O)32+ + NH
3 Zn(NH3)2(H2O)22+ + H2O
• Zn(NH3)2(H2O)22+ + NH
3 Zn(NH3)3(H2O)2+ + H2O
• Zn(NH3)3(H2O)2+ + NH
3 Zn(NH3)42+ + H2O
Constantes de formação globais
• Algumas vezes, são usadas para caracterizar o equilíbrio em sistemas contendo íons complexos.
• Zn2+ + NH
3 Zn(NH3)2+
• Zn2+ + 2 NH
3 Zn(NH3)22+
• Zn2+ + 3 NH
3 Zn(NH3)32+
• Zn2+ + 4 NH
• Existe uma relação entre a constante de formação de cada etapa da reação e a constante de formação global para um dado sistema.
• K1 = 1
• K1K2 = 2
• K1K2K3 = 3
• K1K2K3K4 = 4
• 1 = 186, 2 = 4,08 x 104,
• Na reação formação do complexo, o íon complexo aparece como produto, e sua concentração está no numerador da expressão da
constante de equilíbrio correspondente.
• Na reação de dissociação de um complexo, esta espécie é exibida como um reagente, e a sua concentração está no denominador da
expressão para a constante de equilíbrio.
•
constante de estabilidade
–
que é sinônimo de
constante de formação:
–
quanto maior for o valor numérico da constante
de formação ou constante de estabilidade, mais
estável é o íon complexo.
•
constante de instabilidade - usado com um
sinônimo para a constante de dissociação:
–
quanto maior a magnitude destas constantes,
Cálculo da distribuição de um metal de uma
entre várias espécies complexas
•
Para a maioria dos íons metálicos e a maioria dos
ligantes monodentados, as estabilidades relativas
dos vários complexos dentro de uma família são tais
que vários complexos se encontram presentes numa
Exemplo 1
• 𝟒 = [𝒁𝒏(𝑵𝑯𝟑)𝟒𝟐+]
𝒁𝒏𝟐+ [𝑵𝑯𝟑]𝟒 = 𝟏, 𝟏𝟓 𝒙 𝟏𝟎𝟗
Ìon complexo e solubilidade
•
Na presença de amônia, a solubilidade do AgCl em água
é aumentada significativamente, devido a formação dos
complexos monoamin-prata e diamin-prata.
•
A dissolução de AgBr é maior em uma solução de
tiossulfato de sódio que em água pura por causa da alta
estabilidade dos complexos AgS
2O
3-e Ag(S
•
O íon cloreto pode reagir com o íon prata para
produzir complexos AgCl
2-, AgCl
32-
e AgCl
43-; para
uma alta concentração de cloreto, a formação destes
complexos pode superar o efeito do íon comum
tornando a solubilidade do cloreto de prata
consideravelmente maior que em água.
•
Portanto para alguns íons é importante considerar
tanto o equilíbrio de solubilidade quanto o equilíbrio
Ligantes polidentados → também chamados de agentes QUELANTES.
Íons complexos que possuem um ou mais ligantes polidentados são chamados de QUELATOS.
Ex.: Cu(en)22+
2
2 2
2
Quelatos apresentam elevada estabilidade.
O termo QUELANTE vem do grego:
“CHELE” = GARRA, DENTE – Associa-se a pares de elétrons que formam ligações
coordenadas na formação do complexo,
ou seja: “MORDENDO O ÍON”
Exemplo: o íon cobre
• Um complexo que é formado por um átomo metálico central e um ou mais ligantes polidentados é chamado de quelato ou
composto quelato, do grego que significa “garras”.
Cu
NH3 H3N
NH3 H3N
Comparando a estabilidade de complexos metálicos envolvendo ligantes polidentados com ligantes
•
Um complexo particularmente interessante é o do íon
prata com etilenodiamina.
•
Tipicamente, o íon prata possui dois sítios de
coordenação, como no Ag(NH
3)
2+e Ag(CN)
2-, cada
um desses íons possuem uma estrutura linear.
•
Dois íons prata podem coordenar duas moléculas
de etilenodiamina e o arranjo geométrico deste
complexo é razoavelmente estável:
EDTA
•
O ácido etilenodiaminotetracético, abreviado como
EDTA, é o mais importante e mais conhecido membro
de um grupo de ácidos aminopolicaboxílicos.
Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
• As soluções padrão de EDTA são geralmente preparadas pela dissolução de quantidades pesadas de Na2H2Y.2H2O e diluídas em balão volumétrico até a marca;
•
EDTA = H
4Y para mostrar o caráter tetraprótico deste
ácido.
•
O
ânion
etilenodiaminotetracetato
Y
4-,
forma
complexos
um-pra-um
muito
estáveis
com
praticamente todos os íons metálicos da tabela
periódica.
•
Essa característica um-pra-um dos complexos de
metal-EDTA resultam do fato de o íon Y
4-possuir um
total de seis grupos funcionais
–
quatro grupos
Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
Relação estequiométrica sempre 1:1,
pois possui 6 pontos de coordenação
(4 grupos carboxílicos e 2 átomos de N)
• Somente complexos um-pra-um metal-ligante são formados.
– os equilíbrios complicados encontrados em cada etapa das reações entre íons metálicos e ligantes monodentados não são encontrados com complexos com EDTA.
• Complexos metal-EDTA ganham particular estabilidade a partir dos anéis de cinco membros que são formados.
– Um anel de cinco membros é uma configuração especialmente estável porque os ângulos de ligação permitem que todos os cinco átomos do anel estejam em um plano.
Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
-H
+H-Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
H
4
Y
Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
H
3
Y
--H
+H-Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
H
2
Y
2
--H
+H-Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
HY
3
Ligantes Polidentados: o EDTA (Ethilene Diamine Tetraacetic Acid)
Y
4
•
H
4Y H
++ H
3
Y
-;
K
1= 1,00 x 10
-2•
H
3Y
-H
++ H
2
Y
2-;
K
2= 2,16 x 10
-3•
H
2Y
2-H
++ HY
3-;
K
3
= 6,92 x 10
-7•
HY
3-H
++ Y
4-;2
K
•
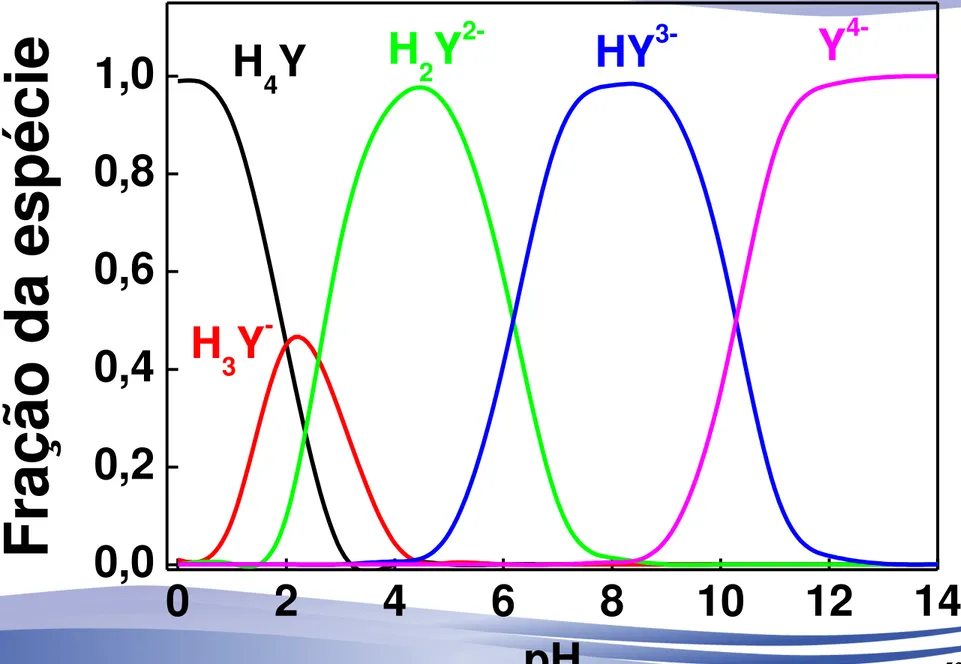
A partição ou distribuição do EDTA entre sua forma
totalmente não dissociada e suas quatro formas
dissociadas varia consideravelmente com o pH. Em
qualquer pH, a distribuição de espécies de EDTA
pode ser calculada a partir das constantes de
O efeito do pH sobre as formas do EDTA
É comum que consideremos apenas a quantidade total quando preparamos uma solução de EDTA, porém o “EDTA” pode estar em solução em
diferentes formas em função do pH do meio, assim:
CEDTA = [H4Y] + [H3Y-] + [H
2Y2-] + [HY3-] + [Y4-]
Todo o EDTA em solução está distribuído em diferentes espécies
A distribuição dessas espécies depende do pH e dos valores de
Ka1, Ka2, Ka3 e Ka4
0
2
4
6
8
10
12
14
0,0
0,2
0,4
0,6
0,8
1,0
Y
4-HY
3-H
2Y
2-H
3Y
-Fraçã
o da
es
péc
ie
pH
H
4Y
KMY =
[Mn+]
[MY(n-4)+]
[Y
4-]
M
n++ Y
4-MY
(n-4)+A concentração de [Y4-] é apenas uma fração da concentração analítica, ou
seja
[Y
4-] =
Y4-* C
EDTAO efeito do pH sobre as formas do EDTA
A reação da titulação é a formação do complexo metal-EDTA, e pode ser descrita pelo equilíbrio:
Constante de formação absoluta:
Valores de Y4- para o EDTA, a 25 °C e µ = 0,10 M
pH Y
4-0 1,3 X 10-23
1 1,4 X 10-18
2 2,6 X 10-14
3 2,1 X 10-11
4 3,0 X 10-9
5 2,9 X 10-7
6 1,8 X 10-5
7 3,8 X 10-4
8 4,2 X 10-3
9 0,041
10 0,30
11 0,81
12 0,98
Equilíbrio de complexação
Ex: K global de 1020 para Íon metálico M
com um número de coordenação igual a 4;
Curva A : Um ligante tetradentado D para formar o complexo MD
Curva B: Um ligante bidentado B para produzir MB2 em duas etapas com K1 = 1012
e K2 = 108
Curva C: Um ligante monodentado A que forma MA4 em quatro etapas com K1 = 108,
K2 = 106, K
3 = 104 e K4 = 102
Essas curvas demonstram que um ponto final muito mais nítido é obtido com a reação que ocorre em uma única etapa. Por essa razão, os ligantes
Métodos Titulométricos Empregando-se EDTA
Titulação Direta
Métodos Baseados em Indicadores para o Analito
Perto de 40 íons metálicos que podem ser determinados pela titulação direta com EDTA utilizando-se indicadores de íons metálicos
Ex.: 50 mL de Ca2+ 0,04 mol L-1 titulado com
EDTA 0,08 mol L-1 em pH 10.
Ca2+ + Y4- CaY
Titulações de complexação: Curvas de titulação
0 10 20 30 40 50 60 12 10 8 6 4 2 0
VOLUME de EDTA / mL
pCa pH = 8
pH = 10 pH = 12
50 mL de Ca2+ 0,01 mol L-1 titulado com EDTA 0,01 mol L-1
Em valores de pH
maiores, o 4 é mais
próximo de 1, a K’ é
maior e promove um
Titulações de complexação
O Zn em 0,7162 g de talco para os pés foi titulado com 21,27 mL de EDTA 0,01645 mol L-1. Calcule a porcentagem em massa de Zn2+
presente nessa amostra.
Titulação Direta
1) Quantidade de matéria de EDTA;
2) Relação estequiométrica (1mol Zn2+:1 mol EDTA);
3) Quantidade de matéria de Zn2+ na amostra;
4) Massa de Zn2+ na amostra;
5) % de Zn2+ na amostra.
Zn2+
Métodos Titulométricos Empregando-se EDTA
Mn+ + Y4- MY-(4-n)
Mg2+ + Y4- MgY
2-Métodos de Retrotitulação
Procedimentos de retrotitulação são utilizados quando não se dispõe de um indicador adequado quando a reação entre o analito e o EDTA é lenta, ou quando o analito forma precipitados no pH requerido para sua titulação.
Excesso conhecido
Um titulante que se dispõe de indicador
Uma amostra de 50,0 mL contendo Ni2+, foi tratada com 25,0 mL de
uma solução de EDTA 0,050 mol L-1 suficiente para complexar todo o
Ni2+ e manter um excesso de EDTA em solução. Esse excesso de
EDTA foi então titulado, consumindo 5,00 mL de uma solução de Zn2+
0,050 mol L-1. Qual a concentração de Ni2+ na amostra original?
1) mols de EDTA adicionado;
2) mols de EDTA em excesso – reagiu com Zn2+
3) Mols de EDTA que reagiu com Ni2+;
4) Relação estequiométrica (1mol Ni2+:1 mol EDTA);
5) mols de Ni2+ na amostra;
6) Concentração de Ni2+ na amostra.
Zn2+
Ni2+ + EDTA
Métodos Titulométricos Empregando-se EDTA
Mn+ + MgY2- MY-(4-n) + Mg2+
Métodos de Deslocamento
Um excesso não medido de uma solução contendo o complexo de EDTA com íons magnésio ou zinco é introduzido em uma solução do analito. O analito
deve formar um complexo mais estável que aquele de magnésio ou zinco, ocorre o seguinte deslocamento:
Uma solução contém 1,694 mg de CoSO4 (155,0 g/mol) por mililitro. Calcule o volume de EDTA 0,008640 mol L-1 necessário para titular
Zn2+ deslocado por Co2+ após a adição de um excesso não medido de
ZnY2- a uma alíquota de 25,00 mL da solução de CoSO
4. A reação é:
Co2+ + ZnY2- → CoY2- + Zn2+
1) mols de Co na solução (25 mL);
2) mols de Zn2+ livre após reação com Co2+;
3) mols de EDTA que reagirão com Zn2+;
4) Relação estequiométrica (1mol Zn2+:1 mol EDTA);
5) Volume de EDTA gasto.
Zn2+
Co2+ + ZnY
2-Métodos de Deslocamento
Titulações de complexação: Detecção visual do P.F.
Indicadores: quelantes cujos complexos apresentam uma coloração diferente do quelante livre. (INDICADORES METALOCRÔMICOS)
Indicador libera o íon metálico que será complexado pelo EDTA em um valor de pM tão próximo quanto possível do P.E.
N N NO2 -O 3S OH OH
NET (H2In-) N N NO2 -O 3S OH OH
NET (H2In-)
Ério T
M2+ + H
2In- MIn- + 2H+
MIn- + Y4- MY2- + In3- (H 2In-)
MIn- → vermelho-vinho
H2In-→ Azul
Intervalo de pH: 7 – 9 (H2In-)
K(MIn-) < K(MY2-)
Titulações de complexação: agentes mascarantes
Complexantes propositadamente adicionados para evitar interferências
Ex.: Pb2+ pode ser titulado com EDTA na presença de Ni2+, desde que a solução
contenha CN
-Ni2+ + 4CN- Ni(CN)
42- K = 1,0 x 1022
Pb2+ não forma complexo com cianeto.
NiY2- pK
abs = 18,62 PbY2- pKabs = 18,04
Titulações de complexação: complexantes auxiliares
Complexantes propositadamente adicionados para evitar precipitação do cátion metálico titulado
Ex.: Zn2+ é titulado com EDTA em meio alcalino tamponado com NH
3/NH4+
Zn2+ + 4NH