Medicamentos Não Sujeitos a Receita Médica
de Dispensa Exclusiva em Farmácia em
Portugal
Non-Prescription Medicinal Products Exclusively Dispensed in
Pharmacies in Portugal
Resumo
A automedicação é um processo através do qual o indivíduo assume um maior grau de responsabilidade para a gestão de um problema de saúde menor através da aquisição de um medicamento que se encontra acessível, sem a obrigatoriedade de obter uma receita médica.
O acesso aos cuidados de saúde está a alterar-se em toda a União Europeia. Na presença de fatores como o envelhecimento das populações e as restrições económicas nos sistemas de saúde, tem sido dado um maior destaque à utilização eficiente dos recursos de saúde. O autocuidado assume, neste contexto, um papel importante, no sentido de incentivar os indivíduos a assumir uma maior responsabilidade pela sua própria saúde e bem-estar, a optar por escolhas de vida saudáveis, a consultar o seu farmacêutico quando apropria-do e a saber se e quanapropria-do o tratamento médico deve ser procuraapropria-do.
Com o objetivo de promover o uso racional do medicamento, a subcategoria de medicamento não sujeito a receita médica tem ganho expressão nos diferentes países europeus. Como a sua designação indica, são incluídos nesta categoria medicamentos que, pelas suas características e dado o enquadramento da patolo-gia a que se destinam, sendo considerados seguros para a disponibilização ao utente sem a obrigatoriedade de uma receita médica, possuem algum atributo que os torna eletivos para a dispensa sob a supervisão de um profissional de saúde, neste caso o farmacêutico, por forma a promover a segurança e a eficiência na sua utilização.
Os diferentes Estados-membros avançaram em momentos diferentes com a implementação desta categoria de classificação quanto à dispensa ao público dos medicamentos. Portugal introduziu em 2013 no seu qua-dro legal esta categoria de medicamentos.
Se, por um lado, os grandes motores impulsionadores da classificação de mais fármacos na categoria de me-dicamento não sujeito a receita médica e meme-dicamento não sujeito a receita médica de dispensa exclusiva em farmácia têm sido o maior empoderamento do doente no que concerne à gestão da sua saúde e à redução da despesa com os medicamentos pelos sistemas de saúde, a utilização racional e segura dos medicamentos tem condicionado os avanços nesta matéria a nível europeu.
A reclassificação de um medicamento e/ou da indicação correspondente está associada a vários benefí-cios e vários riscos, os quais não afetam apenas o consumidor, tendo também impacto nos profissionais de saúde, médicos e farmacêuticos, companhias de seguro e instituições/autoridades do Estado. Salienta-se a
Elisabete Gonçalves1, Ana Marcelo1, Sérgio Vilão1, José Aranda da Silva2, Ana Paula Martins3 1. Formifarma, Lda., Lisboa, Portugal
2. INODES - Associação de Inovação e Desenvolvimento em Saúde Pública, Lisboa, Portugal 3. Faculdade de Farmácia da Universidade de Lisboa, Lisboa, Portugal
Correspondência:
Elisabete Gonçalves, elisabete.goncalves@formifarma.pt Recebido: 25/02/2016; Aceite: 29/02/2016
necessidade da discussão desta temática no nosso país, com a participação dos diferentes intervenientes envolvidos: a autoridade reguladora, os profissionais de saúde, a indústria farmacêutica e os doentes. Palavras-Chave: Automedicação; Farmácias; Medicamentos Sem Prescrição; Portugal; Preparações Far-macêuticas/classificação; União Europeia.
Abstract
Self-medication is a process through which the individual assumes a greater degree of responsibility for the management of a minor health problem, by acquiring a medicine that is accessible without the need to obtain a medical prescription.
Access to health care is undergoing important changes in the European Union. In the presence of factors such as aging populations and economic constraints on health systems, greater emphasis to the efficient use of health resources has been given. Self-care, which comprises self-medication assumes, in this context, an important role by encouraging individuals to take greater responsibility for their own health and wellbeing, choose healthy life choices, consult the pharmacist when appropriate and to establish whether and when medical treatment should be sought.
In order to promote the rational use of medicinal products, the subcategory of non-prescription medicinal products exclusively dispensed in pharmacies has gained expression in different European countries. As the name implies, this category includes medicines that, by their nature and given the framework of the condition for which they are intended, are considered safe for dispensing without the requirement of a prescription, possess some attribute that makes them elective for dispensing under the supervision of a health professional, in this case the pharmacist, in order to promote safety and efficiency in their use. The different Member States have advanced at different times with the implementation of this category of classification regarding the dispensing to the public of medicines. Portugal introduced in 2013 this category of medicines in its legal framework.
If, on one hand, the big drivers for the classification of more medicines in categories non-prescription medicinal products and non-prescription medicinal products exclusively dispensed in pharmacies have been the greater empowerment of the patient regarding the management of his health and the reduction of expenditure on medicines by health systems, the rational and safe use of medicines has conditioned the progress in this area at European level.
The reclassification of a medicine and / or the corresponding indication is associated with several benefits and risks, which affect not only the consumer, also having an impact on health professionals, doctors and pharmacists, insurance companies and institutions / state authorities. The need for the discussion of this issue in our country, with the participation of the different stakeholders involved: the regulatory authority, health professionals, the pharmaceutical industry and patients should be emphasized.
Keywords: European Union; Nonprescription Drugs; Pharmaceutical Preparations/classification; Pharmacies; Portugal; Self Medication.
Introdução
No contexto do autocuidado, a automedicação per-mite ao indivíduo tratar ou prevenir doenças a curto prazo ou crónicas quando considera que não é neces-sário consultar um médico, ou que a doença pode ser autogerida após um diagnóstico médico inicial.1 A automedicação responsável implica que:
- Tenha sido demonstrada a qualidade, segurança e eficácia dos medicamentos utilizados;
- Os medicamentos utilizados sejam os indicados para as condições que são reconhecidas pelo próprio
e para algumas condições crónicas ou recorrentes, após um diagnóstico médico inicial.2
A utilização de medicamento não sujeito a receita médica (MNSRM) deve ser encarada como uma res-ponsabilidade partilhada entre os doentes, os pro-fissionais de saúde, as autoridades competentes e a indústria farmacêutica.3
A reclassificação de medicamentos quanto à sua dis-pensa ao público para MNSRM pode contribuir para a melhoria da saúde pública, uma vez que:
- Permite um acesso mais rápido ao tratamento,
eliminando nomeadamente os tempos de espera para uma consulta;
- Permite aumentar o arsenal terapêutico disponível, particularmente para o tratamento de doenças meno-res;
- Permite libertar tempo alocado pelos médicos a consultas;
- Permite reduzir os gastos públicos em saúde. O comportamento dos doentes encontra-se também em mudança nos países Estados-membros da União Eu-ropeia (UE), nomeadamente no que diz respeito a um empoderamento crescente dos indivíduos para o auto-cuidado, novas rotas de acesso aos medicamentos e a aquisição de cuidados de saúde fora do país de origem.1 A nível do contexto europeu, dos 28 países que cons-tituem a UE, 11 têm autorização exclusiva de dispen-sa de MNSRM nas farmácias. Dos restantes 17 que permitem a distribuição fora das farmácias, 15 países têm definida uma lista de medicamentos que podem ser dispensados fora das farmácias e apenas dois pa-íses permitem a venda de todos os MNSRM fora das farmácias. Verifica-se assim que a esmagadora maio-ria dos países tem estabelecida uma lista restrita de medicamentos autorizados para a dispensa fora das farmácias e as condições específicas da sua comercia-lização, sendo os MNSRM fundamentalmente dis-pensados sob supervisão do farmacêutico.
Medicamentos Não Sujeitos
a Receita Médica de Dispensa
Exclusiva em Farmácia
Europa
Após a aprovação da Diretiva comunitária n.º 92/26, do Conselho Europeu, foram identifica-das, entre os Estados-membros, assimetrias no que ao estatuto legal quanto à dispensa ao público dizia respeito para medicamentos iguais, bem como a au-sência de normas implementadas, com a exceção do Reino Unido e da França, para a atribuição do estatu-to legal de MNSRM.
Na sequência desta constatação foi constituído em 1996 o Ad Hoc Working Group on Legal Status, com o objetivo de propor um conjunto de regras que pu-dessem verificar a harmonização do estatuto legal do medicamento no espaço europeu, nomeadamente em relação aos MNSRM.
Posteriormente foi aprovada, em 2006, a diretiva da Comissão Europeia de transferência do estatuto legal de medicamento sujeito a receita médica (MSRM) a MNSRM «A guideline on changing the
classifica-tion for the supply of a medicinal product for human use».
O artigo 70.º da Diretiva 2001/83/CE prevê duas clas-sificações para o fornecimento de medicamentos para uso humano na Comunidade Europeia:
- Medicamentos sujeitos a receita médica; - Medicamentos não sujeitos a receita médica. Esta diretiva não aborda as subcategorias de classifi-cações que podem estar disponíveis para os medica-mentos não sujeitos a receita médica, a nível nacional, tais como: dispensa exclusiva em farmácias após o diagnóstico médico inicial ou disponíveis para venda em geral.
A nível global verifica-se que cerca de metade de to-dos os medicamentos vendito-dos na UE possuem o es-tatuto de MNSRM. Destes, constata-se que a maioria possui uma autorização de introdução no mercado (AIM) nacional, emitida pelas autoridades nacionais competentes, que é válida apenas no país de origem. Embora esteja instituído um quadro regulamentar do medicamento comum na UE, coexistem diversas abordagens entre os Estados-membros na definição do controlo do acesso a MNSRM. Verifica-se que, nalguns países, o estatuto de MNSRM é determinado para cada medicamento ou marca, enquanto noutros a decisão tomada tem por base a substância ativa. Coexistem também diferentes abordagens sobre os limites para as condições de utilização de um MNSRM. Assim, mesmo que uma substância ativa es-teja disponível sem receita médica em vários Estados--membros, podem verificar-se diferenças em relação a, por exemplo, indicações terapêuticas, população de tratamento, dosagem, dose diária, contraindica-ções e tamanhos das embalagens dos medicamentos disponíveis.
Os Estados-membros adotaram também diferentes políticas nacionais sobre a distribuição de MNSRM, que vão desde a restrição da oferta pela disponibili-zação apenas em farmácias, medicamento não sujeito a receita médica de dispensa exclusiva em farmácia (MNSRM-EF), até a um acesso mais amplo em su-permercados e outros pontos de venda, bem como através da Internet, com ou sem a supervisão de um farmacêutico.1
No século passado, até 1980, as condições geral-mente considerados adequadas no contexto da automedicação, sem a intervenção de um médico, eram bastante limitadas. Estas situações incluíam a dor ligeira a moderada, tosses e constipação, obsti-pação e problemas de pele menores, tais como cortes
e contusões. Contudo, nas últimas décadas, os con-sumidores europeus têm demonstrado uma crescente disponibilidade para assumir a responsabilidade nas questões relacionadas com a sua saúde. Constata-se que os governos têm encorajado ativamente este au-mento da responsabilidade individual para a saúde dos cidadãos, desde o início da década de 1990, no-meadamente através da reclassificação de um número crescente de medicamentos para MNSRM.4
De um modo global, nos países desenvolvidos verifi-ca-se atualmente uma tendência para alargar as fron-teiras da automedicação a medicamentos destinados ao tratamento de doenças crónicas.5
A liberalização da venda de medicamentos over the counter (OTC) fora das farmácias verifica-se, de um modo geral, quando ocorre a desregulamentação da legislação do estabelecimento e propriedade das far-mácias comunitárias. O exemplo mais recente é o da Suécia, onde cessou o monopólio de farmácias detido pela companhia do Estado, a Apoteket, e ocorreu a li-beralização da venda de MNSRM.6,7 Por outro lado, também se verificou a liberalização do setor das far-mácias em países mais regulamentados, como foi o caso da Dinamarca em 2001.8,9
De um modo geral, a desregulação do setor farmacêu-tico tem como objetivo aumentar a acessibilidade dos medicamentos e a redução dos preços dos MNSRM, embora estas expetativas nem sempre se concretizam.10 A evolução da distribuição dos MNSRM na Europa tem sido pautada por uma série de marcos notáveis nos últimos anos. Estes incluem a desregulamentação do mercado de MNSRM na Dinamarca, com a auto-rização de venda fora das farmácias de determinado conjunto de OTC em locais definidos (2001); a auto-rização da dispensa fora das farmácias de MNSRM de categorias terapêuticas-chave na Noruega (2003); a autorização de venda de todos os MNSRM em esta-belecimentos não farmacêuticos em Portugal (2005); a disponibilidade de todos os OTC em supermerca-dos sob supervisão farmacêutica em Itália (2006); a liberalização do mercado OTC na Hungria (2007); e a dissolução do monopólio de farmácias detidas pelo Estado na Suécia e liberalização de vendas de MNSRM fora das farmácias (2009).11
Com o desenvolvimento e criação de general sales list (GSL) tem-se verificado também um afastamento do modelo tradicional da farmácia para novos modelos dentro de farmácia (por exemplo, em França, onde a autosseleção de medicamentos na farmácia evo-luiu) e também fora das farmácias (disponibilidade de MNSRM fora das farmácias no Reino Unido e Portugal).11
Apesar deste novo paradigma, verifica-se que as far-mácias mantêm um papel central na dispensa e acon-selhamento de MNSRM, quer pela sua proximidade à população quer pelas suas competências técnico- -científicas. Assim, a criação em diversos países da categoria de MNSRM-EF reflete as preocupações das autoridades sanitárias e o reconhecimento da impor-tância da intervenção farmacêutica neste grupo de medicamentos.
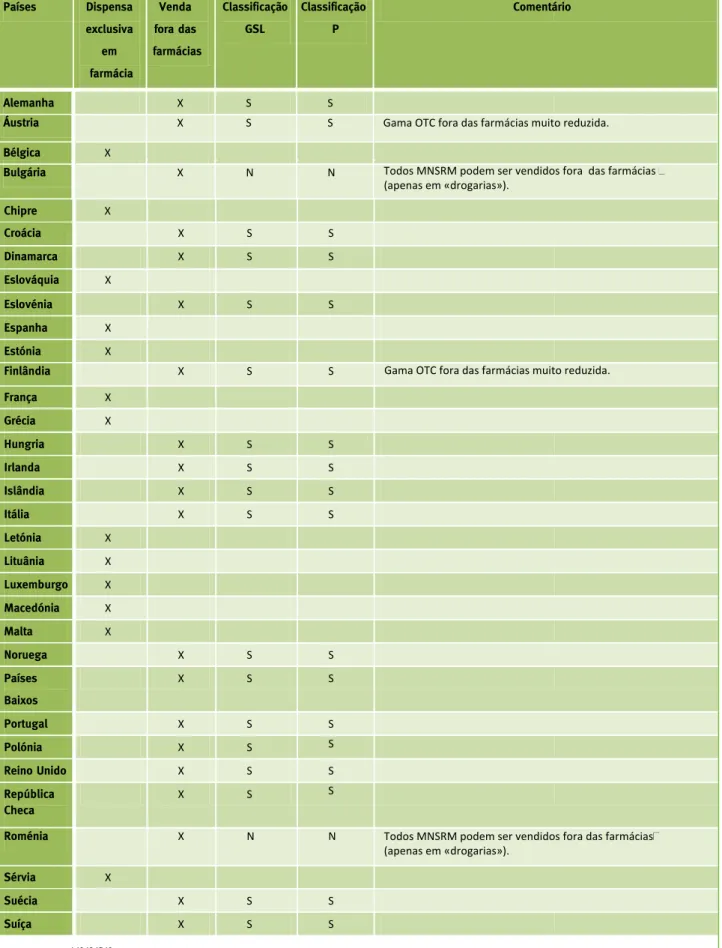
Em termos do contexto europeu, num total de 33 países (os quais incluem os 28 países que atual-mente pertencem à UE e a Islândia, a Macedónia, a Noruega, a Sérvia e a Suíça), 13 têm autorização exclu-siva de dispensa de todos os MNSRM nas farmácias. Os países que se encontram nesta situação são os se-guintes: Bélgica, Chipre, Eslováquia, Espanha, Estónia, França, Grécia, Letónia, Lituânia, Luxemburgo, Macedónia, Malta e Sérvia. Dos restantes 20 que per-mitem a distribuição de alguns medicamentos fora das farmácias, apenas dois (Bulgária e Roménia) o permitem para todos os MNSRM, não existindo nes-tes uma lista restrita de MNSRM com dispensa ex-clusiva em farmácia.
Constata-se então que a grande maioria dos países europeus considera necessária a existência de uma lista de medicamentos, definida de acordo com cri-térios de segurança e risco-benefício, que devem ser dispensados sob a supervisão do farmacêutico. Nos países que aplicam esta classificação na dispensa in-cluem-se, por exemplo, o Reino Unido, a Alemanha, a Dinamarca, a Holanda, a Itália, a Irlanda, a Islândia, a Noruega, a Polónia, a República a Checa, a Suécia e a Suíça.1,12-15 A Fig. 1 apresenta o modelo de distribuição dos MNSRM no contexto dos 33 países europeus. A Tabela 1 apresenta a informação detalhada para cada país.
De acordo com um estudo efetuado pela Associação da Indústria Europeia de Automedicação (AESGP), em janeiro de 2011, apenas cinco moléculas se en-contravam disponíveis de alguma forma sem receita médica em 24 países europeus (paracetamol, ácido acetilsalicílico, pantoprazol, orlistato e cetoconazol), e dez moléculas encontravam-se disponíveis sem prescrição médica em 22 países europeus, sobretudo Estados-membros da UE.
Na base desta diversidade incluem-se fatores como: diferentes decisões nacionais em matéria de classificação de medicamentos, não obstante os Es-tado-membros operarem dentro de um quadro re-gulamentar comum; políticas nacionais distintas em matéria de distribuição de medicamentos não sujei-tos a receita médica; diferentes abordagens sobre o
Figura 1 – Distribuição de MNSRM em 33 países europeus
Contexto europeu
UE + Islândia, Macedónia, Noruega, Sérvia e Suíça (total 33 países)
Dispensa de MNSRM fora das farmácias
Lista definida de MNSRM autorizados para dispensa
fora das farmácias
18 países: Reino Unido, Alemanha, Áustria, Croácia, Dinamarca, Eslovénia, Finlândia, Holanda, Hungria, Itália, Irlanda, Islândia,
Noruega, Polónia, Portugal, República Checa, Suécia e Suíça.
Dispensa autorizada de todos os MNSRM fora das
farmácias
2 países: Roménia e Bulgária
Dispensa MNSRM é exclusiva em farmácias
13 países
Bélgica, Chipre, Eslováquia, Espanha, Estónia, França, Grécia,
Letónia, Lituânia, Luxemburgo, Macedónia, Malta e Sérvia
reembolso e preços dos medicamentos e organização dos sistemas de saúde; e as diferentes realidades cultu-rais no que diz respeito à automedicação. Verificam--se também diferentes abordagens no que respeita à aplicação dos regulamentos relativos à publicidade e à prestação de informações sobre os MNSRM. Com vista a uma maior harmonização seria inte-ressante consagrar no conteúdo da guideline da European Medicines Agency (EMA) da classificação de medicamentos a categoria de MNSRM-EF. Apesar do estatuto jurídico de um medicamento permanecer uma competência nacional, mais ações poderiam ser encetadas de forma a compartilhar ex-periências e pontos de vista entre os reguladores da UE e entre os diferentes agentes que intervêm no pro-cesso.
Entre os exemplos de reclassificações que demonstra-ram benefícios para a saúde pública particularmente elevados encontram-se a terapia de substituição da nicotina e a contraceção hormonal de emergência.1 Em 2001, a AESGP, patrocinada pela EU,16 liderou uma task force para avaliar a possível expansão de MNSRM. Esta task force contou com a participação de representantes dos organismos europeus de médi-cos, farmacêuticos e consumidores, bem como de as-sociações nacionais de médicos e farmacêuticos, e das autoridades reguladoras. O grupo estabelecido efetuou uma revisão das indicações ou condições que poderão ser consideradas no âmbito da automedicação.
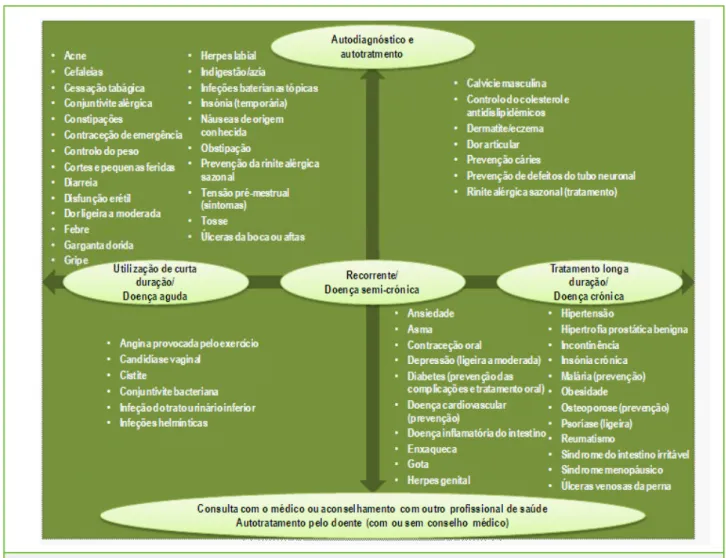
Da análise efetuada resultou um gráfico (Fig. 2) no qual as indicações terapêuticas foram mapeadas de acordo com duas dimensões:
- Condição aguda, que requer o uso a curto prazo de um medicamento, ou de uma condição semicrónica, que exige o uso recorrente de um medicamento, ou
uma condição crónica, que necessita do uso a longo prazo de um medi-camento;
- Condição que pode fa-cilmente ser autodiag-nosticada e autogerida ou uma condição que exige consulta prévia e diag-nóstico por um médico. As condições incluídas no quadrante inferior es-querdo estão a tornar-se gradualmente disponí-veis no contexto da au-tomedicação em alguns países, muitas vezes num ambiente de cuidados co-laborativos. Tal significa que o utente consulta ini-cialmente um médico quando apresenta os sintomas destas condições pela primeira vez. Depois do mé-dico estabelecer um diagnóstico mémé-dico, o utente é capaz, posteriormente, de reconhecer os sintomas quando se repetem e de gerir a doença com recurso a um medicamento disponível sem receita médica. Neste cenário, o farmacêutico pode também fornecer informações valiosas ao doente acerca do tratamento adequado e da necessidade de consultar um médico novamente.
Portugal
O Decreto-Lei n.º 209/94, de 6 de agosto, atualizou a classificação dos medicamentos quanto à dispensa, introduzindo a designação de MNSRM, que se man-tém até à data.5 Foi posteriormente publicada uma lista das situações clínicas passíveis de ser abordadas com MNSRM (Anexo ao Despacho n.º 17 690/2007, de 10 de agosto). Este despacho inclui 66 situações passíveis de automedicação, distribuídas por nove sistemas, e inclui afeções do foro digestivo, respirató-rio, cutâneo, nervoso/psique, muscular/ósseo, ocular, ginecológico e vascular.
Em Portugal, a comercialização de MNSRM fora das farmácias é possível desde 2005, na sequência da aprovação do Decreto-Lei n.º 134/2005, de 16 de agosto, em locais devidamente autorizados pelo INFARMED, I.P. e que cumpram os requisitos legais e regulamentares estabelecidos.
No âmbito do licenciamento, os responsáveis téc-nicos dos estabelecimentos autorizados para a co-mercialização de MNSRM são obrigados a assegu-rar que a dispensa é efetuada por pessoal qualificado,
Países Dispensa exclusiva em farmácia Venda fora das farmácias Classificação GSL Classificação P Comentário Alemanha X S S Áustria X S S Bélgica X Bulgária X N N Chipre X Croácia X S S Dinamarca X S S Eslováquia X Eslovénia X S S Espanha X Estónia X Finlândia X S S França X Grécia X Hungria X S S Irlanda X S S Islândia X S S Itália X S S Letónia X Lituânia X Luxemburgo X Macedónia X Malta X Noruega X S S Países Baixos X S S Portugal X S S Polónia X S S Reino Unido X S S República Checa X S S Roménia X N N Sérvia X Suécia X S S Suíça X S S S: Sim; N: Não .2,8,29,31,17
Gama OTC fora das farmácias muito reduzida.
Todos MNSRM podem ser vendidos fora das farmácias � (apenas em «drogarias»).
Gama OTC fora das farmácias muito reduzida.
Todos MNSRM podem ser vendidos fora das farmácias� (apenas em «drogarias»).
Tabela 1 – Caracterização da venda de medicamentos nos países da UE
44
Figura 2 – AESGP: mapeamento das condições clínicas passíveis de ser incluídas no âmbito da automedicação
nomeadamente farmacêuticos ou técnicos de farmácia, ou pessoal sob a sua supervisão, de acordo com as re-gras e os procedimentos em vigor, de forma a garantir a qualidade e a segurança da utilização destes medica-mentos.
A classificação de MNSRM-EF foi instituída em Portugal em 2013, com a publicação do Decreto-Lei n.º 128/2013, de 5 de setembro, como um novo paradigma no âmbito da dispensa do medicamento. Esta classificação permite aliar as vantagens para os utilizadores do es-tatuto de MNSRM no que diz respeito à maior aces-sibilidade/comodidade, com o reforço da garantia da segurança na utilização dos medicamentos que, pelas suas características, requeiram um aconselhamento farmacêutico mais detalhado, nomeadamente através de protocolos específicos relativos à dispensa. Foi, assim, criada uma subcategoria de MNSRM cuja dispensa é realizada em local com atividade forte-mente regulada (farmácia) e que, atendendo ao seu perfil de segurança ou às suas indicações terapêuti-cas, exige a intervenção do farmacêutico. O
reconhe-45
cimento desta necessidade cria um novo contexto na distribuição do medicamento em Portugal, no qual, a par da acessibilidade, é privilegiada em maior grau a segurança.
No que diz respeito aos procedimentos regulamentares instituídos, a alteração da classificação para MNSRM-EF poderá ocorrer a pedido do titular de AIM ou por reclassificação de iniciativa do INFAR-MED, I.P., sendo implementado como uma alteração aos termos da AIM. Os protocolos de dispensa aprova-dos estabelecem as condições de dispensa do medica-mento pelo farmacêutico, tendo em conta as precauções e contraindicações, definindo as situações em que o far-macêutico deve reencaminhar o utente para o médico. Pretende-se que a atualização das listas da denomi-nação comum internacional (DCI) incluída na lista de MNSRM-EF seja um processo permanente, sis-temático, flexível e adequado às necessidades dos titulares de AIM e dos cidadãos, tendo por objetivo a melhoria permanente da acessibilidade do cidadão aos medicamentos.
46
A nível nacional verifica-se, no entanto, uma evolu-ção relativamente lenta da categoria de MNSRM-EF. Efetivamente, além de ter sido dos últimos países a criar esta terceira categoria, desde a deliberação que implementou a classificação de MNSRM-EF em 2013, apenas são consideradas 13 DCI (que incluem associações de substâncias) para esta categoria, com protocolos definidos.
Segurança e Monitorização
A promoção do uso racional dos MNSRM e a moni-torização da sua segurança são missões das agências nacionais do medicamento, tratando-se de um esfor-ço estruturado contínuo e orientado.
Com a legislação europeia mais recente, todos os pa-íses europeus criaram sistemas de reporte e notifi-cação das reações adversas a medicamentos (RAM), possibilitando aos consumidores notificar os efeitos adversos. Foram realizados poucos estudos sobre os efeitos adversos dos MNSRM nos consumidores. Asseray et al. constataram que 1% das entradas de do-entes nas urgências se devem aos efeitos adversos dos MNSRM.19
MNSRM: Riscos Identificados
O aumento da acessibilidade aos medicamentos pode também, para lá dos benefícios identificados para os cidadãos e para os sistemas de saúde, acarretar riscos associados à sua utilização no tratamento de doenças que tenham sido indevidamente autodiagnosticadas e resultar no uso excessivo de medicamentos inade-quados.3
Os riscos associados à automedicação incluem, no-meadamente, o uso indevido (utilização durante um período prolongado de tempo ou de uma dose superior à recomendada), o atraso potencial no tratamento de uma doença grave, a ocultação dos sintomas de uma doença grave através da utilização de um MNSRM e o aumento da polimedicação e de interações com outros medicamentos usados regularmente.20
São vários os riscos que foram associados à utilização incorreta de um MNSRM.
Numa primeira instância, a má utilização de um MNSRM pode advir do facto de, por um lado, alguns consumidores terem dificuldade em compreender a informação contida no folheto informativo do medi-camento, ou dever-se a, por outro lado, não conside-rarem importante compreender o folheto informativo antes de iniciar a toma do medicamento. Como resul-tado, diferentes situações podem ocorrer:
- Recurso à automedicação, na sequência de uma
avaliação incorreta dos sintomas, com pouca eficácia para a doença em causa, atrasando desta forma o tra-tamento de uma condição clinicamente importante; - Utilização do MNSRM associado a outros medica-mentos que se predispõem a interações medicamen-tosas;
- Utilização do MNSRM para fins diferentes dos es-pecificados no folheto informativo, reduzindo desta forma o benefício associado à toma do medicamento, mas mantendo o risco inerente a esta ação;
- Utilização do MNSRM na presença de uma condi-ção médica que aumenta o risco de desenvolvimento de toxicidade;
- Utilização do MNSRM numa dose superior à re-comendada, redução do intervalo entre as doses em relação ao recomendado ou administração do medi-camento por um período superior ao recomendado. Muitas vezes, apenas são autorizados como MNSRM medicamentos com grandes margens de segurança e sem potencial de risco elevado, mesmo em situações de utilização incorreta. Algumas estratégias que po-derão contornar esta limitação incluem a melhoria da informação contida no folheto informativo e na rotu-lagem e a restrição do acesso, para garantir um nível de aconselhamento profissional, nomeadamente pelo farmacêutico, no caso do estatuto de MNSRM-EF, que podem reduzir a frequência com que os compor-tamentos de risco dos utilizadores de medicamentos ocorrem.
Adicionalmente, a monitorização da segurança dos medicamentos após a comercialização torna-se mais difícil com a diversidade e o aumento dos locais de venda ao público.
Por outro lado, certos grupos da população são mais suscetíveis a problemas com a utilização de MNSRM do que outros, tais como a população pediátrica/jo-vem e a população idosa.
Efetivamente, no caso dos idosos, o envelhecimento traz alterações farmacodinâmicas e farmacocinéticas, e consequentemente no metabolismo de medicamen-tos, levando a uma maior ação medicamentosa neste grupo do que na população mais jovem. Assim, doses terapêuticas consideradas normais para a população jovem e adulta tornam-se tóxicas e têm um maior po-tencial para interações medicamentosas na população idosa. Por outro lado, este é um grupo que tende a uti-lizar mais medicamentos, tanto de prescrição como de não prescrição, e verifica-se que, quando se dimi-nui a quantidade de medicamentos prescritos, os do-entes tendem a compensar recorrendo a MNSRM.21
47
MNSRM: Benefícios Identificados
São várias as etapas identificadas no processo de acesso a um MSRM. Em primeiro lugar, o indivíduo deve ser ava-liado pelo médico, obter uma receita para o medica-mento e deve depois adquiri-lo numa farmácia. Cada um destes passos representa uma barreira ao acesso ao medicamento, cuja magnitude varia de acordo com o sistema de saúde específico de cada país e com os recursos do indivíduo. A título de exemplo, para os indivíduos sem um médico assistente, o acesso a um médico pode ser difícil, demorado e dispendioso. Em tal situação, o indivíduo pode optar por tolerar os sintomas da doença, assumindo que se trata de uma condição autolimitada, e arcará com as conse-quências potenciais de morbilidade resultantes desse comportamento.A melhoria do acesso a medicamentos eficazes pode traduzir-se em melhores resultados clínicos. Para o tratamento de sintomas como dor ligeira ou febre, os melhores resultados clínicos podem resultar de um acesso mais rápido aos medicamentos. O alívio rápi-do e eficaz rápi-dos sintomas é altamente valorizarápi-do pelos consumidores, dado que aumenta o seu status funcio-nal, produtividade e qualidade de vida.
Por outro lado, na ausência de uma opção terapêutica não sujeita a receita médica, os consumidores podem utilizar alternativas menos eficazes ou mais perigo-sas, incluindo produtos não regulamentados.
A maior acessibilidade aos medicamentos permite também o tratamento atempado e rápido de situa-ções patológicas, o qual, em certos casos, pode limi-tar a duração da doença e/ou evilimi-tar a sua evolução, reduzindo assim os custos associados a tratamentos mais agressivos e dispendiosos.22
Mecanismos de Controlo
e Monitorização da Segurança
dos MNSRM
A alteração do estatuto quanto à dispensa de qual-quer medicamento para um nível de menor controlo exige que sejam reunidos dados de farmacovigilância que permitam assegurar que o seu perfil de seguran-ça é aceitável. Assim, nenhum medicamento a nível europeu é objeto de uma reclassificação quanto à sua dispensa ao público sem uma revisão completa do seu perfil de segurança e a opinião fundamentada de que este pode ser usado com segurança sem uma interven-ção médica. A maioria dos dados de segurança é reuni-da a partir reuni-da experiência pós-comercialização com o medicamento, quando este é sujeito a receita médica.1
Nas situações em que ocorre uma alteração com-provada no perfil de segurança ou no risco de um MNSRM, incluindo utilização incorreta ou abuso, os reguladores tomam as medidas adequadas e propor-cionais. As medidas podem incluir:
- Redução do tamanho da embalagem; - Adição de avisos na rotulagem;
- Restrição do fornecimento apenas às farmácias; - Reclassificação para MSRM ou MNSRM-EF. A legislação europeia da farmacovigilância já transposta para Portugal pelo Decreto-Lei n.º 20/2013, de 14 de fe-vereiro, prevê a apresentação pelos titulares da AIM de planos de gestão de risco (PGR) para MNSRM, que per-mitem a monitorização, o registo e a análise de possíveis efeitos adversos, e também a apresentação de estudos de segurança pós-autorização dos MNSRM e MNSRM-EF, que permitem um acompanhamento adequado da evolu-ção do perfil de benefício-risco dos medicamentos.
O Papel do Farmacêutico
A existência de uma subcategoria de MNSRM-EF vem enfatizar o papel do farmacêutico no sistema de saúde, contribuindo de forma decisiva para a utilização em segurança de todos os medicamentos, e em particular deste grupo específico de produtos.
O apoio ao autocuidado é reconhecido pelos farmacêu-ticos em todos os Estados-membros como uma ativi-dade central da sua profissão. Com efeito, o farmacêu-tico está facilmente acessível às populações e é muitas vezes o primeiro, e por vezes o único, profissional de saúde a prestar assistência a um doente na sua jornada de autocuidado, nomeadamente através de:
- Assessoria na gestão de sintomas;
- Aconselhamento sobre a manutenção de uma boa saúde e o modo de evitar a doença;
- Seleção do medicamento mais adequado, quando aplicável.
Os farmacêuticos têm também um papel importante a desempenhar no sentido de incentivar os utilizadores a ler o folheto informativo e no reforço da informação crítica nele incluída, de modo a garantir a utilização segura e eficaz dos MNSRM, particularmente quan-do há um risco de uso incorreto ou abuso. Além disso, os farmacêuticos desempenham um papel importan-te no reencaminhamento de doenimportan-tes para um médico, ou outro serviço de saúde adequado, quando são ne-cessários exames ou o tratamento com um MSRM.1 Apesar dos médicos continuarem a ter um papel pre-ponderante no sentido de incentivar o autocuidado
48
e a automedicação responsável, as novas oportunida-des para os farmacêuticos decorrentes das reclassifi-cações dos medicamentos quanto à sua dispensa ao público são significativas. Os farmacêuticos podem constituir uma fonte confiável e conveniente de acon-selhamento para os utentes, sobretudo nas situações em que os medicamentos viram o seu estatuto de dis-pensa ao público recentemente alterado.
Por fim, o desenvolvimento de modelos de farmaco-vigilância aplicados nas farmácias comunitárias per-mite a recolha de informação relativa à segurança do medicamento de modo sistemático. Dado que os far-macêuticos são considerados um ponto de contacto importante no que respeita à automedicação, estão numa posição privilegiada para monitorizar os efei-tos adversos associados aos MNSRM, podendo dar um contributo importante às autoridades no contex-to da farmacovigilância e dos estudos de segurança pós-autorização destes novos MNSRM-EF.23
Em Portugal, o sistema de disponibilização de MNSRM-EF, mediante o seguimento de protocolos de dispensa implementados pelo farmacêutico, vem reforçar o papel destes profissionais como elementos da equipa prestadora de cuidados de saúde.
O Papel do Médico
O papel desempenhado pelo médico no contexto da automedicação reveste-se de extrema importância, nomeadamente para determinadas patologias de ca-ráter recorrente ou crónico, uma vez que o diagnósti-co e o tratamento iniciais são definidos pelo médidiagnósti-co assistente do doente.
No contexto da automedicação, uma das principais pre-ocupações dos médicos está relacionada com os possíveis riscos associados ao encobrimento de doenças graves subjacentes pela toma do MNSRM. No entanto, a uti-lização de MNSRM não implica a exclusão do médico das vias de prestação de cuidados de saúde, e o desenvol-vimento de modelos de prestação de cuidados de saúde destes profissionais em colaboração com o farmacêutico e o doente poderão permitir identificar e abordar as preo-cupações relativas à segurança decorrentes da utilização destes medicamentos.1
É essencial sensibilizar os doentes para informar o seu médico sobre os MNSRM que tomam e, por outro lado, assegurar o envolvimento dos médicos no acon-selhamento e promoção da adesão ao tratamento com MNSRM, nomeadamente questionando os doentes sobre a toma destes medicamentos. De igual modo, é importante divulgar informação aos médicos sobre os MNSRM disponíveis e promover a sua formação
nes-te connes-texto, levando assim a um incremento no uso racional dos medicamentos e a uma maior segurança dos consumidores.24-26
Reclassificação de Medicamentos
quanto à Dispensa ao Público
À luz da natureza complexa do processo de reclassi-ficação de MSRM para MNSRM, e atendendo aos vá-rios stakeholders envolvidos neste processo, certamen-te que um único racional não é aplicável para todas as reclassificações. As motivações para a reclassificação dos produtos são muito diversificadas e multifatoriais. Além da indústria farmacêutica, o fator intrinsecamen-te mais importanintrinsecamen-te para a reclassificação dos medica-mentos está relacionado com a implementação de me-didas de contenção de custos associados com a saúde e com o objetivo de transferir estes custos do governo para o consumidor individual.27
A reclassificação de um medicamento, e/ou da indica-ção correspondente, está associada a vários benefícios e riscos, os quais não afetam apenas o consumidor, tendo também impacto nos profissionais de saúde, médicos e farmacêuticos, companhias de seguro e instituições/autoridades do próprio governo.
No caso dos MNSRM-EF colocam-se desafios adicio-nais à sua implementação em Portugal, relacionados com a recente introdução desta categoria de medica-mentos e com a consequente falta de conhecimento acerca da mesma por parte dos profissionais de saú-de, nomeadamente médicos e farmacêuticos, e dos utilizadores de medicamentos. A abordagem desta questão poderá passar pelo reforço da divulgação ins-titucional de informação acerca deste grupo de medi-camentos, por forma a garantir que todos os interve-nientes no processo possuem a informação necessária para a utilização segura e racional dos MNSRM-EF. O facto de estar prevista a intervenção de um profis-sional de saúde, neste caso o farmacêutico, permite assegurar que a utilização do medicamento é efetua-da num contexto que garante a segurança do doente, não apenas no que diz respeito ao diagnóstico da con-dição clínica, muitas vezes já efetuado pelo médico assistente, mas também pelo reforço da informação relativa a reações adversas, interações medicamen-tosas, contraindicações, advertências de utilização, entre outros aspetos.
O acesso ao MNSRM-EF sem a obrigatoriedade de uma receita médica reduz ainda a possibilidade do doente recorrer, por constrangimentos financeiros ou outras razões, a produtos não regulamentados e potencialmente perigosos.
49
Em termos de benefícios para a sociedade, a dispo-nibilização de um maior número de medicamentos como MNSRM-EF permitirá promover a qualidade de vida dos doentes com condições agudas ou cró-nicas, o que resultará também em benefícios sociais, como a diminuição do absentismo laboral.
Reflexões Finais
Uma das questões mais relevantes que se colocam no contexto da dispensa de medicamentos sob a for-ma de MNSRM e MNSRM-EF prende-se com a sua utilização em segurança por parte da população. As autoridades competentes nacionais estão obrigadas, através da legislação de farmacovigilância atualmen-te em vigor na UE, a aumentar a acessibilidade da in-formação destinada ao doente, ou seja, o resumo das caraterísticas do medicamento (RCM) e o folheto in-formativo, publicando-os nos seus sítios da Internet. A Internet e as possibilidades que oferece na aquisi-ção de MNSRM tem sido, e continuará a ser, um fator relevante na potenciação da reclassificação dos medi-camentos para MNSRM.
Com efeito, a promoção mundial de um medicamento e a venda transfronteiriça de medicamentos através da Internet são fatores que afetam o comportamento dos consumidores, devendo vir a impulsionar a pro-cura deste tipo de medicamentos. Previsivelmente, no futuro, a venda de MNSRM através da Internet tenderá a aumentar. Este aspeto poderá colocar uma pressão adicional na reclassificação de medicamentos para MNSRM e MNSRM-EF.28
Num âmbito global, as decisões clínicas e regulamen-tares no âmbito dos MNSRM requerem a integração de diferentes tipos de informação, incluindo as taxas de reações adversas, os comportamentos dos consu-midores e os benefícios de um melhor acesso a trata-mentos eficazes.
Os esforços conjuntos da indústria e dos reguladores devem satisfazer as expetativas dos consumidores, disponibilizando medicamentos seguros, eficazes, com vantagens económicas e acompanhados de in-formações completas e relevantes. A divulgação de informação sobre os medicamentos, práticas promo-cionais e de publicidade, deve reger-se por normas éticas apertadas. Com efeito, o conteúdo e a qualida-de qualida-dessas informações, e o modo como é efetuada a sua comunicação, permanecerão elementos-chave na educação dos consumidores para a automedicação responsável.
Tem sido sugerido o reforço do processo de reclassi-ficação a nível nacional em cada Estado-membro, em
oposição a uma decisão centralizada, dado que se tem verificado que países com uma atitude mais conserva-dora no que diz respeito à reclassificação de medica-mentos para MSRM e MNSRM-EF têm impedido a concretização de mais decisões a nível centralizado. A nível nacional importa referir que o modelo de dis-ponibilização de medicamentos às populações atual-mente existente em Portugal não encontra paralelo nos restantes países da UE. Constata-se que os países que permitem a disponibilização de medicamentos fora das farmácias efetuaram uma restrição do leque de medicamentos a algumas substâncias ativas, ape-nas em algumas doses e para embalagens de pequeape-nas dimensões.
A experiência com a utilização dos medicamentos com a classificação de MNSRM e MNSRM-EF tem inclusivamente, em algumas situações, conduzido à alteração do estatuto quanto à dispensa ao público de alguns medicamentos, em países em que a imple-mentação da categoria de MNSRM-EF conta já com vários anos de experiência, novamente para a classifi-cação de MSRM, o que revela a eficácia dos sistemas de avaliação implementados.
Seria relevante iniciar uma discussão, a nível nacio-nal, com o intuito de impulsionar a reclassificação de mais fármacos para a categoria de MNSRM-EF, que pelas suas características e indicações terapêuticas beneficiariam de um acesso sem a obrigatoriedade de uma prescrição médica, ainda que, dadas as suas características e as da patologia a que se destinam, devem ser dispensados sob a supervisão de um far-macêutico.
Mais concretamente, tendo em conta o contexto na-cional, no qual um elevado número de medicamentos que, sendo classificados como MNSRM, podem ser adquiri-dos sem a supervisão de um farmacêutico, ao contrário do que acontece em muitos outros países europeus, importa analisar a importância de, com o objetivo de assegurar a utilização segura e racional dos medicamentos, repensar a classificação de vários fármacos classificados atualmente como MNSRM, por um lado, e como MSRM, por outro, em MNSRM-EF, tendo em conta a experiência de outros países europeus.
Conflitos de Interesse
Os autores declaram a inexistência de conflitos de in-teresse na realização do presente trabalho.
Fontes de Financiamento
Não existiram fontes externas de financiamento para a realização deste artigo.
50
Referências
1. European Commission. Report of The Working Group on Promoting Good Governance of Non-Prescription Drugs in Europe. Brussels: EC; 2013.
2. World Health Organization. The Role of the Pharmacist in Self-Care and Self-Medication: Report of the 4th WHO Consultative Group on the Role of the Pharmacist. Geneva: WHO; 1998. 3. Gilbert A, Rao D, Quintrell N. A review of pharmaceutical scheduling processes in six countries and the effect on consumer access to medicines. Int J Pharm Pract. 2006;14:95-140
4. World Self-Medication Industry. The story of self-care and self-medication, 40 years of progress, 1970-2010. [accessed 2015 November 2] Available from: http://www.wsmi.org/wp-content/ data/pdf/storyofselfcare_brochure.pdf
5. Cruz PS, Caramona M, Guerreiro MP. Uma reflexão sobre a automedicação e medicamentos não sujeitos a receita médica em Portugal. Rev Port Farmacoter. 2015;7:83-90.
6. Balgård M. The new pharmacy market in Sweden. Eur J Hosp Pharm Sci Pract. 2012;19:23–5.
7. Nordén-Hägg A, Shamoon M, Kälvemark Sporrong S. Deregulation of nonprescription medicines in Sweden—a look at the control system. Res Social Adm Pharm. 2012;8:567–73. 8. Larsen JB, Vrangbæk K, Traulsen JM. Advocacy coalitions and pharmacy policy in Denmark—solid cores with fuzzy edges. Soc Sci Med. 2006;63:212–24.
9. Vogler S, Habimana K, Arts D. Does deregulation in community pharmacy impact accessibility of medicines, quality of pharmacy services and costs ? Evidence from nine European countries. Health Policy. 2014;117:311–27.
10. Vogler S, Arts D, Sandberger K. Impact of pharmacy deregulation and regulation in European countries - Summary Report. Vienna: Gesundheit Österreich GmbH; 2012 [accessed 2015 November 2] Available from: http://www.goeg.at/cxdata/media/download/ berichte/pharmacy_regulation_summary_2012pdf.pdf
11. Tisman A. The rising tide of OTC in Europe: Trends, challenges and new potential in a rapidly evolving market. Norwalk: IMS; 2010. 12. Kanavos P, Schurer W, Vogler S. Pharmaceutical Distribution Chain in the European Union: Structure and Impact on Pharmaceutical Prices. London: EMINet / LSE / GÖG; 2011. 13. Martins SF, van Mil JF, Costa FA. The organizational framework of community pharmacies in Europe. Int J Clin Pharm. 2015;37:896-905.
14. European Union. Global Forum on Competition: Competition issues in the distribution of pharmaceuticals - contribution from the European Union. [accessed 2015 July 30] Available from: http:// ec.europa.eu/competition/international/multilateral/2014_feb_ distribution_of_pharmaceuticals_en.pdf
15. PMR. PMR Insight: Slovakia as the only CEE country not allowing non-pharmacy sales of OTC medicines. [accessed
2015 July 30] Available from: http://www.ceepharma.com/ news/118799/pmr-insight-slovakia-as-the-only-cee-country-not-allowing-non-pharmacy-sales-of-otc-medicines
16. AESGP. Development of an information policy for medicinal products. [accessed 2015 July 30] Available from: http:// www.aesgp.eu/media/cms_page_media/68/FinalReport%20 information%20policy.pdf. 2002.
17. Medicines Evaluation Board. Legal status of supply and OTC medicinal products. [accessed 2015 July 30] Available from: http://english.cbg-meb.nl/human/for-marketing-authorisation- holders/contents/legal-basis-of-a-medicinal-product/legal-status-of-supply-and-otc-medicines
18. European Observatory on Health Systems and Policies. The Health Systems and Policy Monitor. [accessed 2015 July 30] Available from: http://www.hspm.org/mainpage.aspx
19. Asseray N, Ballereau F, Trombert-Paviot B, Bouget J, Foucher N, Renaud B, et al. Frequency and severity of adverse drug reactions due to self-medication: a cross sectional multicentre survey in emergency departments. Drug Saf. 2013;36:1159-68. 20. Nunes de Melo M, Madureira B, Nunes Ferreira AP, Mendes Z, Miranda AC, Martins AP. Prevalence of self-medication in rural areas of Portugal. Pharm World Sci. 2006;28:19-25. 21. Pitkala KH, Strandberg E, Tilvis RS. Is it possible to reduce polypharmacy in the elderly? A randomised controlled trial. Drugs Aging. 2001;18:143-9.
22. Mann S. Tamsulosin as a “P” medicine for benign prostatic hyperplasia. SelfCare J. 2010;1: 44–9.
23. Layton D, Sinclair HK, Bond CM, Hannaford PC, Shakir SA. Pharmacovigilance of over-the-counter products based in community pharmacy: methodological issues from pilot work conducted in Hampshire and Grampian, UK. Pharmacoepidemiol Drug Saf. 2002;11:503-13.
24. Francis SA, Barnett N, Denham M. Switching of prescription drugs to over-the-counter status: is it a good thing for the elderly? Drugs Aging. 2005;22:361-70.
25. Shiffman S, Sweeney CT. Ten years after the Rx-to-OTC switch of nicotine replacement therapy: what have we learned about the benefits and risks of non-prescription availability? Health Policy. 2008;86:17-26
26. Lionis C, Petelos E, Shea S, Bagiartaki G, Tsiligianni IG, Kamekis A, et al.Irrational prescribing of over-the-counter (OTC) medicines in general practice: testing the feasibility of an educational intervention among physicians in five European countries. BMC Fam Pract. 2014;15:34.
27. Bond C. The over-the-counter pharmaceutical market – policy and practice. Eurohealth. 2004; 14:19-24.
28. World Health Organization. General Policy Issues - the benefits and risks of self-medication. WHO Drug Information. 2000;14:1-2.