FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA VEGETAL
CARACTERIZAÇÃO DOS EFEITOS
PROVOCADOS PELA ACUMULAÇÃO
DE S-ADENOSIL-HOMOCISTEÍNA NA
EXPRESSÃO DOS GENES ENVOLVIDOS NA
BIODISPONIBILIDADE DE ÓXIDO NÍTRICO
Maria Madalena Henriques Serras Vicente Barroso
MESTRADO EM BIOLOGIA MOLECULAR HUMANA
2009
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA VEGETAL
CARACTERIZAÇÃO DOS EFEITOS
PROVOCADOS PELA ACUMULAÇÃO
DE S-ADENOSIL-HOMOCISTEÍNA NA
EXPRESSÃO DOS GENES ENVOLVIDOS NA
BIODISPONIBILIDADE DE ÓXIDO NÍTRICO
Maria Madalena Henriques Serras Vicente Barroso
Dissertação de mestrado orientada
pela Professora Doutora Anita Gomes
Unidade de Imunologia Molecular Instituto de Medicina Molecular
e pela Professora Doutora Margarida Meireles
Departamento de Química e Bioquímica Faculdade de Ciências – Universidade de LisboaMESTRADO EM BIOLOGIA MOLECULAR HUMANA
2009
| ii O trabalho apresentado foi realizado no Centro de Patogénese Molecular – Faculdade de Farmácia da Universidade de Lisboa, no grupo de Metabolismo e Genética integrado no iMed – Instituto de Ciências Médicas e Farmacêuticas.
| iii A doença vascular, nos países ditos industrializados, constitui a principal causa de mortalidade e morbilidade. Recentemente foi sugerido o possível envolvimento de
alterações epigenéticas na toxicidade vascular observada em situações de
hiper-homocisteinémia (HHcy), promovidas pela acumulação intracelular do precursor da homocisteína: a S-adenosil-homocisteína (SAH).
R
ESUMO
No presente estudo procurou esclarecer-se o efeito da acumulação intracelular de SAH na expressão dos genes envolvidos na biodisponibilidade da principal molécula anti-trombótica endógena - o óxido nítrico (NO). Foi estudada a expressão da enzima responsável pela síntese de NO, a sintase de óxido nítrico endotelial (eNOS) e das enzimas envolvidas no metabolismo do seu inibidor endógeno - a dimetilarginina assimétrica. Foi ainda analisada a proteína responsável pela inibição da eNOS, essencialmente ao nível cavéolar - Caveolin-1 (Cav-1).
Como modelo de estudo foram utilizadas culturas de células endoteliais humanas isoladas da veia de cordão umbilical, nas quais a acumulação intracelular de SAH foi conseguida através da manipulação do metabolismo da homocisteína.
Os resultados obtidos mostram que o estado de hipometilação induzido pela acumulação de SAH foi responsável pelo aumento da transcrição de todos os genes estudados. No entanto, ao nível da tradução, foram observadas alterações significativas apenas para a expressão das proteínas: eNOS e Cav-1, nomeadamente, uma diminuição e aumento, respectivamente. O contraste entre a diminuição da expressão de eNOS e o aumento de Cav-1 sugere que a diminuição da produção de NO observada poderá resultar de um aumento de Cav-1, a qual, para além de exercer um efeito inibitório sobre a eNOS ao nível membranar e citosólico, poderá ainda contribuir para uma degradação ou translocação subcelular da enzima.
Assim, o mecanismo proposto poderá contribuir para a elucidação do binómio HHcy-doença vascular, e futuramente, possibilitar o desenvolvimento estratégias terapêutico-preventivas que permitam a redução da incidência da principal causa de morte, a doença cardiovascular.
- Homocisteína - S-adenosil-homocisteína - metilação
P
ALAVRAS-C
HAVE| iv Cardiovascular diseases are the leading cause of mortality and morbility in the developed countries. Recently, the involvement of epigenetic modifications in the vascular toxicity has been suggested in hiperhomocysteinemia situations, as a result of the accumulation of homocysteine´s precursor, S-adenosylhomocysteine (SAH).
A
BSTRACT
The central aim of this study was to elucidate whether SAH accumulation, through an epigenetic mechanism mediated by cellular hypomethylation, alters the expression patterns of genes related to the availability of the most important endogenous anti-trombotic molecule – nitric oxide (NO). With this purpose we studied the expression of gene products involved either in NO synthesis (endothelial nitric oxide synthase, eNOS) or in the metabolism of its endogenous inhibitor - asymmetric dimethylarginine (ADMA). In addition, we studied Caveolin-1 (Cav-1) expression, which is responsible for eNOS inhibition essentially at caveola´s level.
Cultured human umbilical vein endothelial cells were used to assess the impact of SAH accumulation on NO production. Intracellular SAH accumulation was promoted by homocysteine´s metabolism manipulation.
The results demonstrate that SAH accumulation was responsible for increased transcription rates for all of the target genes. However, at translation level, only two proteins showed significant alterations, namely eNOS and Cav-1, whose expression was decreased and increased, respectively, relative to control samples. The disparity between eNOS and Cav-1 expression pattern seems to be determinant for a reduction of NO biosynthesis. We propose that Cav-1 could not only inhibit eNOS at the membranar and cytosolic level, but also induce sub-cellular translocation or degradation.
In the future, the proposed mechanism may contribute for the elucidation of the connection between HHcy and vascular disease, further allowing the development of new therapies and the implementation of prevention strategies to reduce the major cause of death, the cardiovascular diseases.
- Homocysteine - S-adenosylhomocysteine - methylation
K
EYWORDS| v
A
GRADECIMENTOS
Agradeço a todos aqueles que tornaram possível a realização deste trabalho…
À Professora Rita Castro que esteve comigo no “campo de batalha” e viveu todas as aventuras e desventuras desta caminhada, obrigada pelo disponibilidade e preocupação constante e por tudo o que me ensinou, me deu a descobrir e a viver;
À Professora Anita o apoio e orientação “em tempo real” e de última hora; À Professora Margarida Meireles por ter aceite ser minha orientadora interna;
À Professora Isabel Tavares de Almeida por me ter acolhido no seu grupo, pela preocupação com o meu trabalho, e pelo esforço e dedicação com que orienta todo o grupo; A todas as Professoras do Met&Gen sempre disponíveis para ajudar e ensinar, em particular à professora Isabel Rivera e à Professora Paula Leandro por todas as sugestões no delineamento do trabalho experimental e ensinamentos científicos;
A todos os colegas e amigos do grupo Met&Gen, sem os quais não teria sido possível trabalhar, por tornarem o meu dia-a-dia bem disposto e por toda a ajuda e ensinamentos preciosos. Em particular às Anas e à Mónica que comigo partilharam o “laboratório do DNA”, à Cátia e ao Ruben pela boa disposição, ao Israel pelas proteínas, ao Esse sempre disposto a ajudar e a pôr a saúde em primeiro lugar;
À Mónica, à Marisa e a todos os que na VU contribuíram para que as quantificações de SAM/SAH chegassem a Portugal;
A todas os elementos do CPM que sempre se mostraram disponíveis a ajudar e partilhar experiências. Agradeço, a partilha de conhecimentos laboratoriais, ao grupo das células da glia, e em particular à Eduarda com quem o dia começa sempre melhor;
A todos os meus amigos que, fora do ambiente académico, salpicaram de alegria e boa disposição este tempo, nem sempre fácil;
À minha Jô, por tudo, por estar sempre comigo;
A toda a minha família... Aos meus tios sempre dispostos a acolher-me e a apoiar-me, ao tio Zé e à tia Fátima agradeço os ensinamentos clínicos e a disponibilidade para revisões a toda e a qualquer hora. Ao João e ao Dida, verdadeiras pílulas de boa disposição. À Joanaz e ao Jorgez pela amizade e por todo o precioso apoio. À Tota por toda a ajuda e incentivo fazendo com que, mesmo “em bolinhas”, tudo faça sentido.
Ao meu irmão, pela amizade e por tudo o que teve de aturar,
Aos meus pais, sem os quais nada seria possível, pelo apoio e amizade, conselhos e, acima de tudo, pelo exemplo de vida.
| vi
A
BREVIATURAS
5,10-MeTHF 5,10-metileno-tetrahidrofolato 5-MTHF 5-metil-tetra-hidrofolato Abs Absorvência ADA Adenosina-2,3-dialdeídoADMA Dimetilarginina assimétrica
ATP5B Subunidade β da ATP sintase mitocondrial
BCA Ácido bicinconínico
BH4 Tetra-hidrobiopterina
BHMT Betaína-homocisteína metiltransferase
BSA Albumina de soro bovino
Cav-1 Caveolin- 1
CBS Cistationina beta sintase
cDil-Ac-LDL Fluorescein isothiocyanate (Dil)-labeled acetylated LDL
cDNA DNA complementar
cGMP Guanosina-monofosfato cíclico
Ctrl Controlo
Cys Cisteína
DDAH Dimetilarginina dimetilamina-hidrolase
DNA Ácido desoxirribonucleico
dNTP Trifosfato de desoxinucleótido
DTT Ditiotreitol
EDRF Endothelium-derived relaxant factor
EIF4A2 Eukaryotic Translation Initiation Factor 4A, Isoform 2 eNOS (NOS-3) Sintase de NO endotelial
FAD Flavina-adenina-dinucleótido FMN Flavina Mononucleótido GC Guanilato ciclase GTP Guanosina trifosfato Hcy Homocisteína HHcy Hiper-homocisteinémia
HRP Horse radish peroxidase
Hsp90 Heat shock protein 90
HUVEC Células endoteliais de cordão umbilical Humano
KCl Cloreto de potássio
kb Kilo-bases
Km Constante de Michaelis-Menten
iNOS (NOS-2) Sintase de NO indutível
L-Arg L-arginina
LDH Lactato Desidrogenase
LDL Lipoproteína de baixa densidade
MAT Metionina adenosil transferase
Met Metionina
MgCl2 Cloreto de magnésio
| vii
mRNA RNA mensageiro
MS Metionina sintase
MTHFR 5,10-metileno-tretra-hidrofolato redutase
NAD+ Nicotinamida Adenina Dinucleótido
NADH Nicotinamida Adenina Dinucleótido Reduzida
NADPH Fosfato de Nicotinamida Adenina Dinucleótido Reduzido
nNOS (NOS-1) Sintase de NO neuronal
NO Óxido nítrico
NO2- Ião nitrito
NOSs Sintases de NO
ONOO- Ião peroxinitrito
pb Pares de bases
PCR Polymerase chain reaction
PMSF Fluoreto de fenil-metil-sulfonilo
PRMTs Proteína-arginina metiltransferases
PVDF Difluoreto de polivinidileno
RNA Ácido ribonucleico
RNP Ribonucleoproteínas
ROS Espécies reactivas de oxigénio
RP-HPLC Cromatografia líquida de alta resolução em fase reversa
RT Transcrição Reversa
SAH S- adenosil-homocisteína
SAHH SAH hidrolase
SAM S- adenosilmetionina
SDMA Dimetilarginina simétrica
SDS Dodecil sulfato de sódio
SDS-PAGE SDS-Polyacrylamide Gel Electrophoresis
-SH Grupo sulfidrilo
SHMT Serina hidroxi-metiltransferase
TBS-T Solução tampão Tris com 0,1% de Tween-20
tHcy Homocisteína total
THF Tetra-hidrofolato
Tris Tris(hidroximetil)amina
UBC Ubiquitin C
| viii
Introdução Teórica 1
Í
NDICE
1. Homocisteína e Doença vascular 1
1.1 Hiper-homocisteinémia 1
1.2 Metabolismo da Homocisteína 2
I. Via da Transulfuração II. Via da Remetilação
1.3 Homocisteína e a sua Regulação 3
1.4 Determinantes de Hiper-homocisteinémia 4
1.5 Hiper-homocisteinémia e Doença Vascular 4
1.6 Homocisteína e Metilação 5
I. Metilação de DNA
II. Metilação de Proteínas
2. Óxido Nítrico e Disfunção endotelial 6
2.1 Endotélio e Fisiologia das Células Endoteliais 6
2.2 Disfunção Endotelial 6
3. Biodisponibilidade de Óxido Nítrico (NO) 7
3.1 Molécula e Relevância Fisiológica 7
3.2 Sintases de NO - eNOS 7
I. Gene – NOS3
II. Proteína – eNOS
3.3 Regulação de eNOS 8
I. Expressão e Localização Subcelular II. Modificações Pós-Traducionais
III. Mecanismo de Activação Induzido por Agonistas IV. Relação com a Concentração de Substrato
3.4 Inibidores Endógenos de eNOS 10
I. Síntese de ADMA – PRMT1
II. Degradação de ADMA – DDAH2
4. Objectivos 11
5. Materiais e Métodos 12
5.1 Cultura de Células 12
5.2 Análise da Libertação de Óxido Nítrico 12
5.3 Determinação da Concentração de Proteína 13
5.4 Determinação dos Níveis de Hcy total, ADMA e SDMA 13
5.5 Determinação de SAM e SAH 13
5.6 Extracção de RNA e RT-PCR quantitativo 13
5.7 Extracção de Proteína e Western Blot 14
5.8 Extracção de DNA e Determinação da Metilação Específica 15
| ix
6. Resultados 16
6.1 Avaliação da Citotoxicidade de ADA 16
6.2 Análise da Libertação de Óxido Nítrico 16
6.3 Avaliação do Export de Hcy, ADMA e SDMA 17
6.4 Razão SAM/SAH 17
6.5 Avaliação dos Níveis de Transcrição 18
I. eNOS II. PRMT1 III. DDAH2 IV. Cav-1
6.6 Avaliação da Expressão Proteica 19
6.7 Análise de metilação Especifica 20
7. Discussão 21
7.1 Diminuição dos Níveis de NO 21
7.2 Razão SAM/SAH e Estado de Hipometilação 22
7.3 Avaliação do Export de Hcy 22
7.4 Avaliação do Export de ADMA e SDMA 22
7.5 Acumulação de SAH e Regulação da Transcrição 23
I. eNOS II. PRMT1 III. DDAH2 IV. Cav-1
7.6 Análise de Expressão Proteica 25
I. eNOS
II. PRMT1
III. DDAH2
IV. Cav-1
7.7 Interacção eNOS – Cav-1 26
7.8 Efeito da Acumulação de SAH na biodisponibilidade de NO 27
8. Conclusões e Perspectivas Futuras 28
9. Bibliografia 29
Anexos
Figuras e Tabelas A1
| 1
Int
ro
duç
ão
A ruptura da placa aterosclerótica, com consequente emergência para o lúmen do vaso do material aterogénico, desencadeia uma situação de aterotrombose. As plaquetas ao serem activadas agregam, contribuindo, no local, para a formação de um rolhão hemostático que vai determinar a formação do trombo. Estão criadas as condições hemodinâmicas para a interrupção da corrente sanguínea. É assim o despoletar daquela que é maior das causas de morte no mundo – A Doença Cardiovascular –.
I
NTRODUÇÃO
De acordo com a Organização Mundial de Saúde, as doenças cardiovasculares são responsáveis por cerca de 30% das mortes a nível mundial, assumindo maior relevância nos países desenvolvidos1. A sua causa é multifactorial e diversos são os factores de risco conhecidos, entre os quais a hiper-homocisteinémia.
1.
H
OMOCISTEÍNA ED
OENÇAV
ASCULARA Hiper-homocisteinémia (HHcy) caracteriza-se pelo aumento dos níveis plasmáticos de homocisteína total (tHcy). Em jejum, os níveis plasmáticos de tHcy considerados normais estão compreendidos entre 5 e 15 µM; valores superiores conduzem ao estado de hiperhomocisteinémia. A HHcy classifica-se em moderada, intermédia ou severa consoante os valores acumulados de tHcy se encontram entre 16 - 30, 31-100 ou >100 µM, respectivamente
1.1HIPER-HOMOCISTEINÉMIA
2, 3
A homocisteína (Hcy) é um pequeno aminoácido sulfurado que deriva da desmetilação da metionina (Met) ingerida na dieta alimentar
.
4. Esta desmetilação é essencial
e ubíqua pois liberta grupos metilo necessários para actividades celulares tão fundamentais como a síntese de DNA, de hormonas esteróides e de algumas proteínas4. Em 1960, a Hcy assume relevância clínica com a descrição de uma perturbação metabólica rara no metabolismo da Met – a homocistinúria (níveis elevados de Hcy no plasma e na urina)3, 4. Contudo, foi em 1969 que McCully estabeleceu, pela primeira vez, a relação entre Hcy e doença vascular ao observar, post-mortem, artérias com graves lesões ateroscleróticas num doente com HHcy severa5, 6. Com efeito, nos últimos 20 anos, evidências epidemiológicas permitiram classificar a HHcy como um factor de risco para a doença vascular independente de factores há muito conhecidos, como a hiperlipidémia, hipertensão arterial, diabetes mellitus e tabaco5
Níveis elevados de Hcy estão igualmente associados a outras patologias como alterações na formação do tubo neural, epilepsia, doença de Alzheimer, osteoporose ou problemas renais
.
| 2
Int
ro
duç
ão
1.2A produção de Hcy inicia-se através de uma reacção de transmetilação, na qual o aminoácido essencial Met é convertido num composto altamente energético – S-adenosilmetionina (SAM). A formação de SAM é catalisada pela enzima metionina adenosil-transferase (MAT), com gasto de uma molécula de ATP. SAM é o dador universal de grupos metilo na célula, transferindo-o, por acção de metiltransferases, para inúmeros
substratos (incluindo DNA e proteínas) e resultando na formação de
S-adenosil-homocisteína (SAH), a qual funciona como inibidor das metiltransferases dependentes de SAM atrás referenciadas
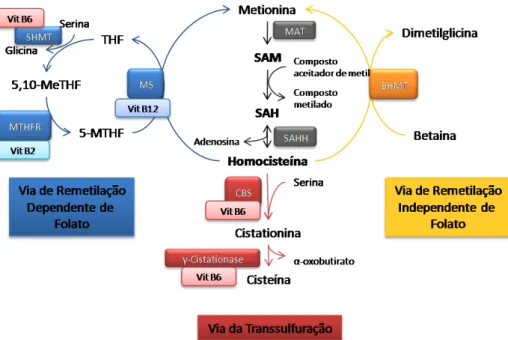
METABOLISMO DA HOMOCISTEÍNA
11, 12. A SAH é então hidrolisada pela enzima SAH
hidrolase, resultando na formação de adenosina e Hcy, através de uma reacção que é reversível e com um equilíbrio dinâmico que favorece a síntese de SAH em detrimento da sua hidrólise (Figura 1)12. Assim, em casos de HHcy, o aumento intracelular de Hcy resulta na acumulação, também intracelular, de SAH. Por esta razão, a remoção rápida e eficiente da Hcy acumulada é crucial para que esta reacção ocorra no sentido da formação de Hcy. Deste modo, e tal como observado quer in vitro, quer in vivo, qualquer perturbação metabólica que conduza a um aumento da concentração intracelular de Hcy promove, igualmente, o aumento dos níveis intracelulares de SAH13, 14
O metabolismo da Hcy compreende duas vias alternativas: a via da transsulfuração e a via da remetilação.
.
I.
A Hcy é irreversivelmente metabolizada pela via da transsulfuração (Figura 1). Esta via ocorre essencialmente no fígado e rim e inicia-se com a condensação da Hcy com uma serina, formando cistationina, numa reacção catalisada pela cistationina β-sintase (CBS). A
VIA DA TRANSSULFURAÇÃO
| 3
Int
ro
duç
ão
cistationina é posteriormente clivada em cisteína (Cys) e α-oxobutirato pela γ-cistationase. Quer a CBS quer a γ-cistationase utilizam fosfato de piridoxal como co-factor12, 15, 16
II.
.
Alternativamente, a Hcy pode ser remetilada a Met através da via da remetilação, utilizando o 5-metil-tetra-hidrofolato (5-MTHF) ou a betaína como dadores de grupos metilo consoante esta remetilação seja dependente ou independente de folato, respectivamente (Figura 1)
VIA DA REMETILAÇÃO
12, 15, 16
Na via de remetilação dependente de folato a enzima metionina sintase (MS) utiliza a vitamina B
.
12 como co-factor para catalisar a transferência do grupo metilo do 5-MTHF para a
Hcy formando-se Met e tetra-hidrofolato (THF)12, 15, 16. Nesta via, o metabolismo da Hcy encontra-se directamente associado ao ciclo do folato. Com efeito, a enzima MS é a única fonte de produção de THF e este pode ser ainda convertido em 5,10-metileno-tretrahidrofolato (5,10-MeTHF) pela serina hidroxi-metiltransferase (SHMT), que recorre à vitamina B6 como co-factor, o qual é posteriormente reduzido a 5-MTHF pela enzima
5,10-metileno-tretrahidrofolato redutase (MTHFR) e vitamina B2 na sua forma activa12, 15
A via de remetilação independente de folato utiliza a enzima betaína-homocisteína metiltransferase (BHMT) para catalisar a transferência do grupo metilo da betaína (intermediário da oxidação da colina) para a Hcy formando-se Met e dimetilglicina. A enzima BHMT é expressa principalmente no rim e fígado, ao contrário da MS que é expressa em praticamente todas as células
.
12
1.3
.
A Hcy é estruturalmente semelhante à Cys, sendo que ambas possuem um grupo sulfidrilo (-SH), mas diferindo num átomo de carbono e no tamanho da cadeia alifática que é maior na Hcy. As suas características químicas são também semelhantes, permitindo ambas a formação de pontes persulfureto com outras moléculas detentoras de um grupo -SH livre.
HOMOCISTEÍNA E A SUA REGULAÇÃO
As concentrações intracelulares de Hcy são estritamente controladas, sendo as concentrações óptimas essencialmente reguladas pela via de remetilação dependente de folato. As células hepáticas e renais são excepções pois também recorrem às vias da transsulfuração e de remetilação independente de folato. Quando existe um excesso de Hcy intracelular esta começa a ser activamente exportada para o meio extra-celular12, 17. No plasma, devido à reactividade do grupo –SH e às condições oxidativas do meio, apenas 1% da Hcy se encontra sob a sua forma livre, a grande maioria encontra-se associada a proteínas (principalmente albumina) (70-80%) ou a outras moléculas, como outra molécula de Hcy, formando um dímero, ou a outros tióis (20-30%)17.
| 4
Int
ro
duç
ão
O catabolismo e excreção da Hcy são essencialmente conseguidos por via hepática e renal. O fígado e rins expressam grandes concentrações de CBS e BHMT que promovem o catabolismo da Hcy. O fígado é principalmente responsável por metabolizar uma proporção substancial de Hcy associada a proteína, enquanto o rim cataboliza essencialmente os dissulfitos de Hcy. A excreção ocorre durante o processo de filtração do sangue, onde graças ao meio intracelular redutor a Hcy será libertada12
O conhecimento do metabolismo da Hcy é fundamental para a compreensão da etiologia das várias formas de HHcy.
.
1.4
Quando a Hcy se acumula no meio intracelular é continuamente exportada para o plasma até que se reponham os seus níveis homeostáticos intracelulares, instalando-se assim uma situação de HHcy. Os seus determinantes podem ser de natureza genética ou não genética. Os de
DETERMINANTES DE HIPER-HOMOCISTENÉMIA
terminantes genéticos resultam de alterações nos genes que codificam para as enzimas intervenientes no seu metabolismo e que conduzem à acumulação da Hcy que fica assim por metabolizar12, 15
Nos
.
determinantes não genéticos encontramos factores como a idade, já que os níveis de Hcy duplicam desde a infância até à terceira idade, e o sexo, uma vez que os homens possuem valores de Hcy superiores aos indivíduos de sexo feminino12, 15. O estilo de vida pode igualmente condicionar os níveis circulantes de Hcy, nomeadamente os hábitos tabágicos e o consumo elevado de álcool ou de café estão associados a um aumento dos mesmos15. Da maior importância nos determinantes não genéticos encontramos as deficiências em vitaminas do grupo B, as quais participam como co-factores no metabolismo da Hcy. Com efeito, níveis insuficientes de vitaminas B6, B12 e folato
resultam em níveis circulantes de Hcy aumentados. Finalmente, porque os rins são os órgãos responsáveis pela excreção da Hcy do organismo, uma função renal deficiente é igualmente um importante determinante não-genético de HHcy12, 15.
1.5
Apesar da já estabelecida a relação entre HHcy e doença vascular, os mecanismos subjacentes a esta causalidade continuam por esclarecer. No entanto, sabe-se que um aumento de Hcy promove a disfunção endotelial, primeiro passo para o desencadear do processo ateroesclerótico
HIPERHOMOCISTENÉMIA E DOENÇA VASCULAR
18
Entre os mecanismos de toxicidade directa propostos encontra-se o stress oxidativo. Com efeito, a oxidação do grupo -SH da Hcy gera espécies reactivas de oxigénio (ROS), nomeadamente, radicais superóxido e peróxido de hidrogénio, que contribuem para a disfunção endotelial
.
12, 18. Indirectamente, estes radicais podem ainda promover a oxidação
| 5
Int
ro
duç
ão
disfunção do endotélio; pensa-se ainda que sejam igualmente responsáveis pela proliferação das células musculares lisas dos vasos que também contribuem para a aterogénese4, 19. Alternativamente, outros estudos revelam que a HHcy pode acelerar o processo de inflamação vascular através da indução da libertação de citocinas pró-inflamatórias18
Mais recentemente surgiu a hipótese de que a HHcy pode induzir alterações epigenéticas responsáveis pelo aparecimento da disfunção endotelial
.
13, 20
1.6
contexto em que se enquadra o presente trabalho.
O campo da epigenética revela-nos outro modo de regulação da expressão genética que vai para além de alterações na sequência de nucleótidos do DNA. A SAM, intermediário da via de transmetilação (Figura 1), é dador de grupos metilo em praticamente todas as reacções biológicas de metilação, tornando-se assim um composto chave no campo de epigenética onde se inserem as variações do estado de metilação do DNA, histonas e factores de transcrição. As enzimas metiltransferases recorrem a SAM para a manutenção dos padrões de metilação, daí resultando a formação de SAH. Uma diminuição da razão SAM/SAH é utilizada como um marcador de hipometilação e está associada a casos de HHcy
HOMOCISTEÍNA E METILAÇÃO
13, 20
I. .
A metilação de DNA corresponde a um mecanismo de regulação epigenética e a sua importância é clara durante os processos de embriogénese e diferenciação celular. Em mamíferos ocorre quase exclusivamente na posição 5’ da citosina constituinte de um dinucleótido CpG e, em células somáticas normais, 70 a 80% destes dinucleótidos encontram-se metilados
METILAÇÃO DE DNA
21, 22. No entanto, existem regiões onde estes dinucleótidos se
encontram preferencialmente desmetilados, sendo estas usualmente conhecidas como ilhas CpG. Estas regiões são especialmente ricas em CG (≥60%) e com um rácio CpG/GpC de pelo menos 60%. As ilhas CpG são encontradas na região reguladora 5´ de cerca de metade dos genes presentes no genoma22, 23. A metilação de DNA está geralmente associada a uma repressão da transcrição através de três mecanismos: interferindo directamente com activadores de transcrição e impedindo a sua associação ao DNA, permitindo o reconhecimento por repressores específicos da transcrição ou induzindo a formação de cromatina estruturalmente inactiva22
II.
.
Para além do DNA também as proteínas são alvo de metilação, por exemplo, as histonas possuem como principal função a regulação da cromatina e da expressão génica. A metilação de histonas, ao contrário da sua acetilação, não apresenta um efeito linear sobre
| 6
Int
ro
duç
ão
a transcrição. No caso dos resíduos de lisina a activação ou repressão da transcrição depende do resíduo de lisina metilado e do grau de metilação (mono-, di- ou tri-metilada)23
2.
.
Ó
XIDON
ÍTRICO ED
ISFUNÇÃO ENDOTELIALO endotélio vascular corresponde à monocamada de células que cobre a superfície interna dos vasos sanguíneos, estabelecendo assim a barreira entre o sangue e os tecidos. É um tecido bastante activo respondendo a estímulos, quer físicos, quer químicos, a fim de garantir a manutenção da homeostase do tecido vascular. Com efeito, tem a propriedade de produzir moléculas agonistas e antagonistas que modulam o relaxamento e a contracção das células musculares lisas dos vasos
2.1ENDOTÉLIO E FISIOLOGIA DAS CÉLULAS ENDOTELIAIS
24. O endotélio intervém ainda na proliferação e
migração celular, na adesão e activação de leucócitos e nos processos imunológicos e inflamatórios24, 25
Uma das particularidades da célula endotelial consiste no facto de 1/3 da superfície da sua membrana celular ser constituída por invaginações com formas irregulares muito ricas em lípidos, esfingomielina, estruturas proteicas complexas e receptores, designadas por cavéolas. Estas estruturas conferem diversas funções ao endotélio vascular, entre as quais o armazenamento e transporte de substâncias
.
24, 26
Os factores de risco da doença cardiovascular reduzem a capacidade do endotélio manter a homeostase vascular, favorecendo o desenvolvimento de processos inflamatórios patológicos e a instalação da doença vascular.
.
A disfunção endotelial é actualmente considerada como passo chave no desenvolvimento do processo aterosclerótico. Com efeito, quando o endotélio perde a capacidade de manter a homeostase vascular, instalam-se as condições apropriadas para este ser invadido por lípidos e leucócitos; a resposta inflamatória é incitada e surgem estrias lipídicas, o primeiro passo na formação da placa ateromatosa. Se a situação persistir, as estrias lipídicas progridem e a placa fica exposta a ruptura, predispondo o endotélio à ocorrência de trombogénese e oclusão vascular
2.2DISFUNÇÃO ENDOTELIAL
24, 27
A disfunção endotelial é também caracterizada por uma redução na biodisponibilidade de vasodilatadores, em particular de óxido nítrico, enquanto os factores contrácteis derivados do endotélio estão aumentados. Deste modo, instala-se um estado específico designado por “activação endotelial” que é caracterizado por um meio pró-inflamatório, proliferativo e pró-coagulante, favorecendo assim todos os estados de aterogénese
.
| 7
Int
ro
duç
ão
3. B
IODISPONIBILIDADE DE ÓXIDO NÍTRICO (NO)
O relaxamento vascular dependente de acetilcolina foi reconhecido pela primeira vez em 1980 por Furchgott e Zawadzki como sendo mediado por um factor difusível libertado pelo endotélio (endothelium-derived relaxant factor, EDRF) com um tempo de semi-vida de escassos segundos
3.1MOLÉCULA E RELEVÂNCIA FISIOLÓGICA
28, 29. Durante 6 anos, a natureza do EDRF permaneceu desconhecida
até Furchgott e Ignarro reconhecerem que este se tratava de uma simples molécula inorgânica – o óxido nítrico30, 31
O NO é uma molécula apolar que se difunde livremente através das membranas celulares, possuindo um vasto número de destinos possíveis dependendo da célula alvo e da entidade química com a qual vai interagir. A libertação de NO na corrente sanguínea e nos fluidos tecidulares permite a sua participação numa variedade de reacções químicas, como a combinação com oxigénio (formando [NO
.
2-]), com o anião superóxido (formando
[ONOO-]) e com grupos -SH de péptidos, proteínas, aminoácidos e outras pequenas moléculas para formar nitroso-tióis32
Nas células musculares lisas, a ligação do NO à enzima guanilato ciclase (GC) induz uma alteração conformacional de que resulta a exposição do domínio catalítico da GC para o substrato GTP, conduzindo à formação de guanosina-monofosfato cíclico (cGMP)
.
33
. Posteriormente, segue-se uma activação de proteína-cinases dependentes de cGMP e a fosforilação de proteínas intracelulares, incluindo as cinases da cadeia leve de miosina e canais de potássio activados por cálcio que completam a cascata mediada pelo NO, responsável pela indução do relaxamento vascular34
Para além de induzir vasodilatação, o NO inibe a adesão e agregação de plaquetas, contribuindo para as propriedades anti-trombóticas da parede vascular. Apresenta também um papel na inibição da adesão de monócitos e leucócitos ao endotélio e inibe a proliferação das células musculares lisas dos vasos. O NO reduz ainda a produção vascular de radicais superóxido, actuando como inibidor da oxidação de LDL
.
35.
A biosíntese de NO a partir da L-arginina e do oxigénio molecular é mediada por uma família de 3 enzimas – as sintases de NO (NOSs). A sintase de NO endotelial (eNOS), assim como a sintase de NO neuronal (nNOS), foram inicialmente caracterizadas como tendo uma actividade constitutiva responsável por gerar os níveis basais de NO
3.2SINTASES DE NO- ENOS
36. Estas
contrastavam com a iNOS (NOS indutível) que requer um estímulo inflamatório para a sua expressão37. As NOSs são também conhecidas por NOS-1 (nNOS), NOS-2 (iNOS) e NOS-3 (eNOS) consoante a cronologia com que foram identificadas38.
| 8
Int
ro
duç
ão
I.O gene que codifica para a eNOS, gene NOS3, localiza-se no cromossoma 7q35-36 e possui 26 exões que ocupam cerca de 21 kb de DNA genómico
GENE – NOS3
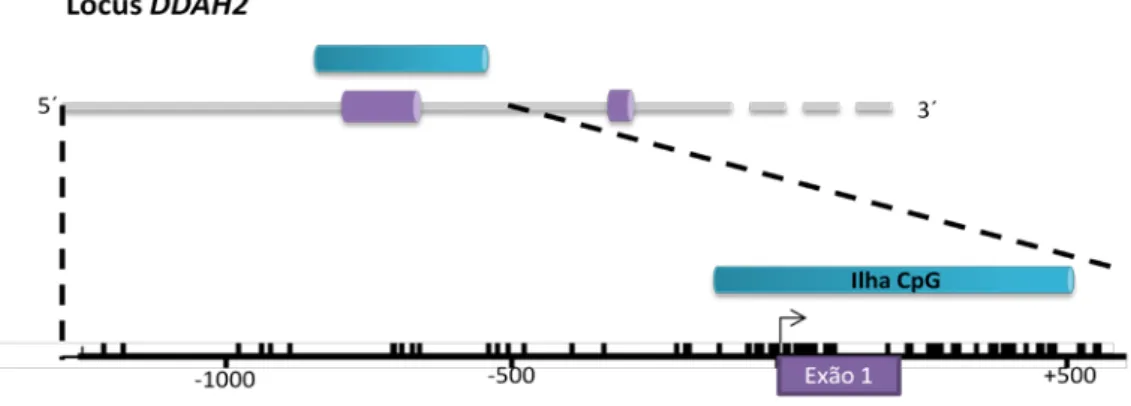
38, 39. O seu promotor não
possui TATA box e exibe elementos consistentes com os genes expressos constitutivamente nas células endoteliais (GATA; SP1), elementos de resposta ao “stress por deformação” (Shear Stress), entre outros como NF-1, AP-1 e AP-2 (Anexo 1 - Figura 1A)40, 41. O promotor de NOS3 não se encontra numa ilha CpG, no entanto, é extremamente rico em dinucleótidos CG e a metilação do DNA assume especial importância na regulação da expressão do gene de eNOS humano40
II.
.
Tal como as restantes isoformas, a eNOS tem um domínio com actividade de redutase no terminal carboxílico (C-terminal) e um domínio oxidativo no terminal amina (N-terminal)
PROTEÍNA - ENOS
38. A forma activa da eNOS corresponde a um homodímero que catalisa a
formação de NO a partir do aminoácido L-arginina e do oxigénio molecular numa reacção que envolve a oxidação dos 5 electrões do terminal azoto do grupo guanidino da L-arginina. O NADPH é um co-substrato para esta reacção, que também envolve os co-factores FAD (flavina-adenina-dinucleótido), FMN (mononucleótido de flavina), calmodulina, tetra-hidrobiopterina (BH4) e o grupo heme associado à enzima. A arginina é oxidada a
L-citrulina – um co-produto formado em quantidades equimolares com o NO38, 42. Os sítios de ligação a FAD, FMN, calmodulina e NADPH estão localizados no C-terminal do domínio redutase. O sítio de ligação ao heme/arginina está menos bem caracterizado mas pensa-se que se encontra no domínio N-terminal38.
I.
3.3REGULAÇÃO DE ENOS
A eNOS é regulada a diversos níveis, desde a transcrição até às modificações pós-traducionais. A transcrição do gene NOS3 ocorre especificamente ao nível do endotélio por uma regulação epigenética. Com efeito, esta resulta da desmetilação do seu promotor, ao invés do que se verifica nas células não-endoteliais onde este se encontra altamente metilado
EXPRESSÃO E LOCALIZAÇÃO SUBCELULAR
40
. A nível transcricional, a expressão da eNOS é ainda regulada por activadores específicos. Um exemplo de regulação positiva acontece na presença de shear stress, na qual se verifica uma expressão aumentada de eNOS43. Encontra-se descrito um elemento específico de resposta ao shear stress no promotor de NOS3 composto por uma sequência de 6 pb (Anexo 1 - Figura 1A)44
Existe também regulação ao nível pós-transcricional; o mRNA de eNOS é geralmente bastante estável o que se verificou ser dependente de vários elementos da região 3’ não traduzida (3’UTR) que formam complexos de ribonucleoproteínas (RNP)
| 9
Int
ro
duç
ão
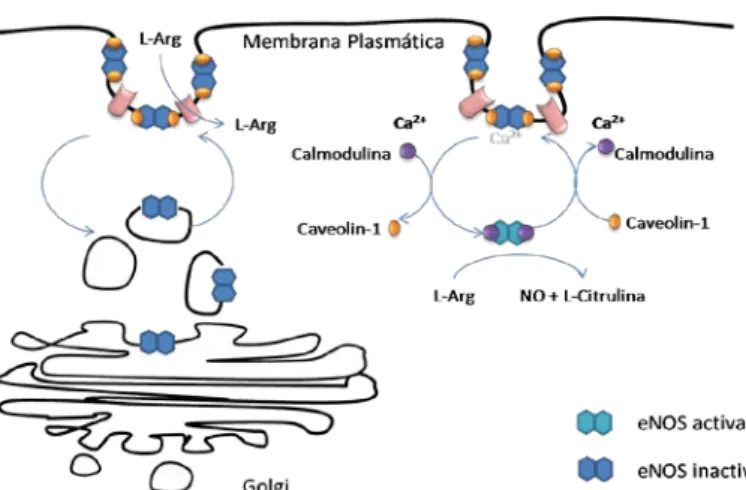
Figura 2 – Mecanismo de activação de eNOS dependente de Ca2+.
Modificações pós-traducionais de eNOS determinam a sua localização ao nível membranar onde se encontra inactiva por interacção com a proteína caveolin-1. A presença de Ca2+ determina a activação da proteína calmodulina e a sua associação a eNOS, com consequente dissociação de caveolin-1, sendo assim accionada a síntese de NO. A enzima pode posteriormente voltar a ser incorporada na caveola. estáveis. Diversos estudos sobre a formação dos complexos RNP-mRNA NOS3 sugerem a interacção de várias proteínas que devem funcionar em conjunto para regular a estabilidade dos transcritos de eNOS41
A eNOS foi inicialmente isolada do endotélio onde é essencialmente expressa, mas sabe-se que existe noutros tipos celulares
.
45
. Encontra-se funcionalmente activa no citosol mas está também presente a nível da membrana celular, em particular nas cavéolas, onde se encontra associada a um dos seus principais componentes, a proteína Caveolin-1 (Cav-1), e num estado funcionalmente inactivo46. Esta interacção envolve uma região conservada de 20 aminoácidos da Cav-1 e uma região de ligação à Cav-1 no domínio N-terminal da eNOS47. A ligação de eNOS à membrana é determinada pelas modificações de que é alvo, pela adição de ácido miristíco e/ou palmitoilação na região N-terminal48, 49
II.
.
Sabe-se que a eNOS é alvo de modificações pós-traducionais as quais regulam a sua actividade. Com efeito, ao contrário do processo de
MODIFICAÇÕES PÓS-TRADUCIONAIS
miristilação, o processo de palmitoilação/despalmitoilação que sofre é reversível, constituindo assim mais um modo de regulação da enzima49. Para além da miristilação e palmitoilação que determinam a sua localização subcelular, a eNOS sofre também fosforilação nos resíduos de serina, alteração que ocorre após a exposição ao shear stress e que tem sido associada à translocação para o citosol através de um mecanismo independente de Ca2+/calmodulina50, 51
III.
.
O aumento da actividade de eNOS, quando exposto a moléculas agonistas, parece ser dependente de níveis aumentados de cálcio intracelular e é mediado pela ligação de eNOS à proteína dependente de cálcio – calmodulina
MECANISMO DE ACTIVAÇÃO INDUZIDO POR AGONISTAS
52
A proteína Cav-1 exerce um efeito inibidor sobre a eNOS, pois impede a associação da calmodulina à eNOS. A presença de Ca
. Esta ligação e activação parecem estar associadas à dissociação da eNOS da Cav-1.
2+ induz a
activação da função catalítica de eNOS por dissociação de eNOS de Cav-1 (Figura 2)38 O microambiente da cavéola constitui também um modo de regulação de eNOS pois a concentração local de substrato e de co-factores é limitada
.
| 10
Int
ro
duç
ão
IV.O aminoácido L-arginina existe no plasma em concentrações entre 50-100µM e já foram determinadas concentrações endoteliais intracelulares de 800µM
RELAÇÃO COM A CONCENTRAÇÃO DE SUBSTRATO
53. Estas
concentrações são muito superiores ao Km da enzima para a L-arginina (1-4 µM) pelo que, o substrato não parece ser um factor limitante38, 54.
3.4INIBIDORES ENDÓGENOS DE ENOS
Em 1992, Vallence et al., identificaram como inibidores endógenos de eNOS, os análogos da L-arginina: a monometilarginina (MMA) e a dimetilarginina assimétrica (ADMA)55. No entanto, as quantidades intracelulares de MMA são muito reduzidas, sendo a ADMA o inibidor endógeno de eNOS mais abundante35
Os resíduos de arginina metilados resultam da hidrólise das proteínas das quais eram parte constituinte e são normalmente libertados para o plasma e excretados na urina
.
55.
Estes compostos podem igualmente contribuir para uma diminuição da concentração de arginina (substrato) intracelular, impedindo a sua entrada através do transportador y+56.
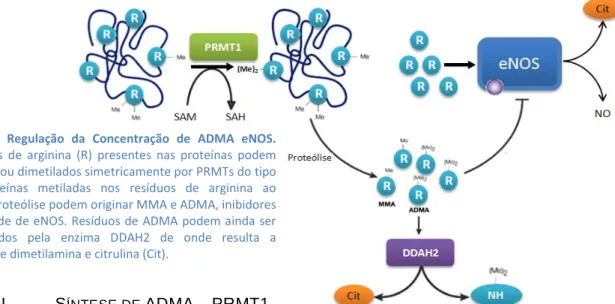
A metilação de resíduos de arginina é uma modificação pós-traducional comum que aumenta a diversidade estrutural das proteínas e pode modular a sua função. Existem três tipos de resíduos de arginina metilados: MMA, ADMA e SDMA (dimetilarginina simétrica), sendo a ADMA o mais abundante dos três. A síntese destes resíduos nas células de mamíferos é promovida por uma família de enzimas: as proteína-arginina metiltransferases (PRMTs) (Figura 3)55, 57. São conhecidas e bem caracterizadas 6 PRMTs que se subdividem em PRMT do tipo I e do tipo II. As enzimas da família PRMT diferem em actividade, especificidade de substrato e localização subcelular. Todas as PRMTs metilam, a partir de SAM, azotos do grupo guanidino dos resíduos de arginina nos seus substratos, para formar MMA. Num segundo passo, as PRMTs catalisam a dimetilação das argininas alvo sendo classificadas consoante esta metilação é realizada de forma simétrica ou assimétrica.
Figura 3 – Regulação da Concentração de ADMA eNOS. Os resíduos de arginina (R) presentes nas proteínas podem ser mono-, ou dimetilados simetricamente por PRMTs do tipo I. As proteínas metiladas nos resíduos de arginina ao sofrerem proteólise podem originar MMA e ADMA, inibidores da actividade de eNOS. Resíduos de ADMA podem ainda ser metabolizados pela enzima DDAH2 de onde resulta a formação de dimetilamina e citrulina (Cit).
| 11
Int
ro
duç
ão
PRMTs do tipo I (PRMT1, -3, -4 ou CARM1, -6 e -8) produzem resíduos metilados assimetricamente (ADMA) enquanto as PRMT do tipo II (PRMT5) catalisam a formação de resíduos metilados de forma simétrica (SDMA)57
A proteína PRMT1 do tipo I é a responsável pela maior parte da produção de ADMA nas células de mamífero (85%), possuindo uma grande variedade de possíveis substratos tanto no núcleo como no citosol
.
58. Os principais alvos de PRMT1 foram identificados como
proteínas nucleares que interactuam com os ácidos nucleicos, tais como as histonas H3 e H4, e componentes das ribonucleoproteínas (RNP) particularmente envolvidas no processamento e transporte do mRNA58, 59
O gene que codifica para a PRMT1 localiza-se no cromossoma 19q13.3-q13.4 e é formado por 12 exões, apresentando homologia estrutural com os outros genes PRMT. Existem 3 variantes de PRMT1 que resultam de splicing alternativo; a comparação das sequências amino-acídicas das diferentes variantes indica que todas são enzimaticamente activas, mas com diferentes regiões hidrofóbicas N-terminal
.
59.
A ADMA é libertada durante os processos de proteólise e não volta a ser incorporada nas proteínas. A enzima dimetilarginina dimetilamina-hidrolase (DDAH), hidrolisa a ADMA em citrulina e dimetilamina (Figura 3)
II. DEGRADAÇÃO DE ADMA – DDAH2
60
Existem duas isoformas humanas de DDAH, DDAH1 e DDAH2, sendo a última expressa essencialmente em tecidos muito vascularizados que expressam eNOS ou iNOS
.
60
. O gene DDAH2 encontra-se no cromossoma 6p21.3 e a região codificante está dividida em 8 exões61. A transcrição de DDAH2 pode ser iniciada a partir de 3 sítios diferentes e o mRNA é ainda alvo de splicing alternativo. Sabe-se que o gene da DDAH2 tem um promotor sem TATA-box e possui uma ilha CpG que se sobrepõe ao primeiro exão (Anexo 1 - Figura 2A)60, 61. Já foi demonstrado o envolvimento de DDAH2 na regulação positiva da síntese de NO, visto ser responsável pela hidrólise de ADMA, inibidor da eNOS61
4.
.
O presente trabalho visa aprofundar os conhecimentos sobre a patofisiologia do metabolismo da Hcy e a sua correlação com a disfunção endotelial, primeira etapa da doença vascular e aterosclerose.
O
BJECTIVOSPostulamos que um dos mecanismos envolvidos na toxicidade vascular promovida pela Hcy, nomeadamente, na diminuição da biodisponibilidade do NO, pode resultar de alterações epigenéticas induzidas pela acumulação de SAH. Por esta razão, o presente trabalho visa a elucidação do possível efeito da acumulação intracelular de SAH na expressão dos genes directa ou indirectamente responsáveis pelos níveis de NO no endotélio vascular.
| 12
M
ét
od
os
5.15.
M
ATERIAIS E
M
ÉTODOS
Para a realização deste trabalho foram utilizadas células endoteliais isoladas da veia do cordão umbilical humano (Human Umbilical Vein Endothelial Cells – HUVEC). Os cordões umbilicais utilizados foram provenientes de fetos saudáveis nascidos após gestações normais através de partos pélvicos de mães igualmente saudáveis. Os cordões foram armazenados numa solução tampão contendo (4 mM KCl, 140 mM NaCl, 11 mM D-glucose [Merck], 10 mM HEPES [Gibco], 1% solução antibiótico-antimicótico [Sigma]). As células endoteliais foram isoladas entre 24 a 48 horas após o parto. O isolamento foi efectuado a partir da veia dos cordões umbilicais por tratamento com colagenase (Gibco), segundo protocolo adaptado de Jaffe et al
CULTURA DE CÉLULAS
62
As HUVEC utilizadas deram origem a 5 linhas celulares independentes que provieram de 5 culturas celulares diferentes e encontravam-se na quarta passagem, num estado de 70-80% de confluência, aquando da realização das várias experiências. O meio de cultura foi substituído por meio controlo (sem adenosina-2,3-dialdeído [ADA]) ou por meio de teste (ADA 5, 10, 15 e 20 µM), tendo sido recolhidas aliquotas de meio às 12h (100µL) para análise da libertação de NO, e às 24h (2mL) para análise da libertação de NO e quantificação de tHcy, ADMA e SDMA.
. As HUVEC sofreram sucessivas passagens
até obtenção do número de frascos necessários para a extracção de RNA, DNA e proteínas
(condições de cultura – Anexo 2). A caracterização das células endoteliais foi realizada através da utilização de um marcador celular fluorescente específico para as mesmas (Dil-Ac-LDL) (Anexo 2).
Após 24h de incubação recorreu-se ao Cytotoxicity Detection Kit (Roche Molecular Biochemicals) para avaliar a citotoxicidade de ADA pela libertação de Lactato Desidrogenase (LDH) para o meio de cultura (Anexo 2).
5.2 ANÁLISE DA LIBERTAÇÃO DE ÓXIDO NÍTRICO
Os níveis de NO foram quantificados indirectamente através dos seus produtos estáveis, nitritos, de acordo com a reacção de Griess
63
a partir do meio de cultura. O
reagente de Griess (sulfanilamide e N-(1-naphthyl)ethylenediamine dihydrochloride
[Sigma-Aldrich], 1:1) foi adicionado ao meio de cultura formando-se um composto corado. A
absorvência, medida a 550nm (Abs550) (Leitor de Microplacas Asys – Expert Plus), permitiu
quantificar a concentração de nitritos por comparação com a Abs550 de uma solução padrão
de nitrito de sódio diluída em meio de cultura. Os valores resultantes desta quantificação foram normalizados em função do valor da concentração de proteína total.
| 13
M
ét
od
os
5.3A concentração de proteína, expressa em µmol/mg, foi determinada pelo ensaio do
ácido bicinconínico (BCA) com recurso ao BCA protein assay kit (Pierce). Este método
combina a redução de Cu
DETERMINAÇÃO DA CONCENTRAÇÃO DE PROTEÍNA
2+ a Cu+ pelas proteínas, num meio alcalino, com a detecção por
espectofotometria do produto da reacção colorimétrica entre o cobre reduzido e o BCA. Para cálculo das concentrações recorreu-se a uma curva padrão com albumina de soro bovino
(BSA)64
5.4
. A mistura reaccional foi exposta a uma incubação a 37ºC durante 30 minutos e posteriormente determinada a absorvência a 562nm (Leitor de Microplacas Asys – Expert Plus).
Os níveis de Hcy total, ADMA e SDMA foram quantificados no meio de cultura, após
24h de incubação, por cromatografia líquida de alta resolução em fase reversa (RP-HPLC)
com detecção fluorimétrica, como descrito anteriormente (Anexo 2). Os cromatogramas típicos para os tióis e metilargininas encontram-se representados nas figuras 3A e 4A (Anexo 1)
DETERMINAÇÃO DOS NÍVEIS DE HOMOCISTEÍNA TOTAL,ADMA E SDMA
65,66.
5.5
Para determinação de SAM e SAH foram preparados lisados celulares (solução de lise – Anexo 2) das HUVEC após 24 horas de incubação com os diferentes meios de teste e controlo. Os lisados foram centrifugados a 7500rpm (Centrífuga Sigma 202 MK Rotor 12045), a 4ºC, durante 10 minutos, para separação do material nuclear e restante meio intracelular. O sobrenadante (meio intracelular), foi posteriormente desproteinizado por adição de igual volume de ácido perclórico a 10% e analisado por cromatografia líquida acoplada a espectrometria de massa em tandem com diluição isotópica, como descrito por Struys et al
DETERMINAÇÃO DE S-ADENOSILMETIONINA E S-ADENOSILHOMOCISTEÍNA
67
5.6
. A quantificação proteica das amostras foi realizada antes de se proceder à desproteinização para normalização dos resultados.
A extracção de RNA das HUVEC foi realizada com recurso ao ‘RNeasy Mini kit’
(Qiagen) incluindo um tratamento com DNAse durante o processo (RNase-free DNase set -
Qiagen). Após quantificação do RNA por espectrofotometria a 260 nm (ND-1000 -
NanoDrop) procedeu-se à síntese de cDNA (Anexo 2).
EXTRACÇÃO DE RNA E RT-PCRQUANTITATIVO
Análise por PCR em tempo real – O PCR em tempo real foi realizado no termociclador 7300 real time pcr system (Applied Biosystems). Para a detecção do produto formado foi utilizado SYBR Green e foram desenhados primers específicos para o cDNA de NOS3, PRMT1, DDAH2 e Cav-1 dirigidos para exões distintos de modo a evitar a detecção
| 14
M
ét
od
os
de DNA genómico (Anexo 1 - Tabela 1A). Foram ainda utilizados primers específicos para o cDNA de 3 genes housekeeping: ATP5B, EIF4A2, e UBC.
A reacção de PCR é de 2-passos: 1 ciclo de desnaturação a 95ºC durante 10 minutos e 40 ciclos de uma incubação inicial a 95ºC durante 15 segundos (desnaturação) seguida de outra a 60ºC durante 1 minuto (hibridação e extensão). Cada reacção é realizada em triplicado num volume total de 25 µL; sendo constituída por 12,5 µL de SYBR GREEN PCR Master Mix (Applied Biosystems), primers forward e reverse (numa concentração de 300nM cada) e 30 ng do cDNA de cada amostra.
Foi efectuada uma curva padrão com 5 pontos, com diluições seriadas de 5x, também em triplicado, do cDNA produzido a partir de uma mistura de RNAs provenientes das várias condições experimentais. Após a reacção de PCR os dados foram processados a partir do programa ‘7300 system Software’ (AppliedBiosystems), e a quantificação foi feita pelo método da curva padrão descrito em Mamic et al 68
5.7
. Foi ainda realizada uma análise das curvas de desnaturação dos produtos de amplificação para verificar a especificidade da reacção.
A lise de 4x10
EXTRACÇÃO DE PROTEÍNA E WESTERN BLOT
5
A concentração de proteína foi normalizada para todas as amostras de acordo com as quantificações obtidas (pelo método descrito em 5.3), utilizando-se sempre a maior quantidade de proteína possível, num volume de 16 ou 40 µL (14 - 30 mg). Os lisados celulares foram desnaturados (Anexo 2) e sujeitos a electroforese num gel desnaturante de poliacrilamida (SDS-PAGE), numa concentração de 7-10% no gel de separação e 4% no gel de concentração. Foi utilizado o marcador de massas moleculares Prestained SDS-PAGE
Standards Low-Range (BioRad) para confirmação da massa molecular das proteínas. Após
a electroforese as proteínas foram electrotransferidas (240 mA, ≤100V, 45min) para uma
membrana de difluoreto de polivinidileno (PVDF) (Amersham Hybond-P [GE Healthcare])
com recurso ao sistema Mini Trans-Blot cell (Bio-Rad).
células foi efectuada com 250uL Cell Lysis Buffer (CellSignaling). O
lisado foi sonicado em gelo durante 40 segundos (UP100H ultrasonic processor - Hielscher)
e posteriormente centrifugado a 13000g durante 10minutos a 4ºC, para eliminação de células intactas, núcleos e outro material insolúvel. A concentração de proteína foi determinada pelo método BCA acima descrito.
As membranas foram expostas a um bloqueio de 3 horas numa solução de tampão Tris com 0,1% de Tween-20 (TBS-T) contendo 5% de leite magro em pó (solução de bloqueio). Após 3 lavagens com TBS-T foram incubadas com anticorpos específicos para
eNOS, PRMT1, DDAH2 ou Cav-1, e para a proteína β-actina que foi utilizada como controlo
| 15
M
ét
od
os
sempre realizadas a 4ºC, durante cerca de 14horas, e após três lavagens com TBS-T as membranas foram incubadas, à temperatura ambiente, com um anticorpo secundário
associado à enzima Horse Radish Peroxidase (HRP) (Rabbit polyclonal to Goat IgG - H&L
(HRP) [Abcam], numa diluição de 1:5000; peroxidase-conjugated goat anti-mouse antibody [Bio-Rad], numa diluição de 1:5000) diluído em solução de bloqueio.
5.8 Extracção de DNA e Determinação da Metilação específica
As bandas imuno-reactivas foram reveladas por quimioluminescência com o reagente de detecção LumiGLO (Cell Signaling). A análise da densidade das bandas foi efectuada com recurso ao software Quantity One 4.6 (BioRad).
Para extracção do DNA foi utilizado o pellet nuclear obtido em 5.5. O DNA foi
extraído e purificado com o ‘kit de purificação de DNA genómico’ (Citogene) e
posteriormente quantificado por espectrofotometria a 260nm no ND-1000 (NanoDrop).
Foram utilizados 350ng de DNA para conversão das citosinas desmetiladas em uracilos por
tratamento com bissulfito (EpiTect Bisulfite Kit – Qiagen). Depois de efectuada a
amplificação por PCR os produtos foram sequenciados.
O promotor de NOS3 (GenBank NG_011992) foi subdividido em 4 fragmentos para se desenharem primers específicos de modo a ser possível a amplificação de toda a região promotora (Anexo 1 – Figura 6A). Inicialmente foi amplificado o fragmento de -484 a -145
com primers específicos para PCR após tratamento com bissulfito:
Fw:GAGAGAATTTGTATGATTTTAGAGGTT e Rev: AACTCTAAAACCTCAACTCCAC. O programa de PCR utilizado inicia-se com um ciclo de desnaturação de 5 min a 95ºC ao que se seguem 50 ciclos de 30 segundos a 95ºC, 45 segundos a 55ºC e 45 segundos a 72ºC; finalmente um ciclo de 7 minutos de extensão a 72ºC. Os produtos de PCR são posteriormente purificados com recurso ao QIAquick Gel Extraction Kit (Qiagen) e analisados por sequenciação directa pelo método enzimático de Sanger (ABI Prism BigDye Terminator Cycle Sequencing Ready Reaction Kit) no sequenciador ABI Prism 310 Genetic Analyzer (Applied Biosystems).
5.9
Todos os valores descritos no texto e figuras estão expressos como média±desvio-padrão (média±DP). As diferenças estatísticas foram calculadas a partir do teste t-student para amostras independentes, com valores de p utilizando duas caudas. Significância estatística foi considerada para valores de p <0,05.
| 16
Res
ult
ad
os
6.16.
R
ESULTADOS
A libertação da enzima lactato desidrogenase (LDH) das células, após incubação com diferentes concentrações do inibidor de SAH hidrolase - adenosina-2,3-dialdeído (ADA), foi utilizada como método para avaliar o nível de citotoxicidade desta molécula. Como é visível na tabela 1, não se observaram variações significativas na presença de diferentes concentrações de ADA adicionadas ao meio de cultura (5, 10 e 20 µM) relativamente ao controlo, o que permitiu excluir um potencial efeito tóxico do inibidor usado neste estudo.
AVALIAÇÃO DA CITOTOXICIDADE DE ADA
Este ensaio foi confirmado em 4 linhas celulares independentes, pelo menos em triplicado.
Tabela 1 - Libertação de LDH – Absorvência a 490nm, proporcional à libertação de LDH para o meio extracelular, após 24horas de incubação, de HUVEC com diferentes concentrações de ADA.
Concentração de
ADA (µM) 0 (n=3) 5 (n=3) 10 (n=3) 20 (n=3)
Abs 490nm
(média±DP) 2,458±0,058 2,517±0,152 2,520±0,045 2,550±0,035
6.2
A libertação de NO foi determinada pela reacção de Griess. Os níveis de nitritos no meio extracelular foram quantificados após 12 e 24 de incubação com as diferentes concentrações de ADA.
ANÁLISE DA LIBERTAÇÃO DE ÓXIDO NÍTRICO
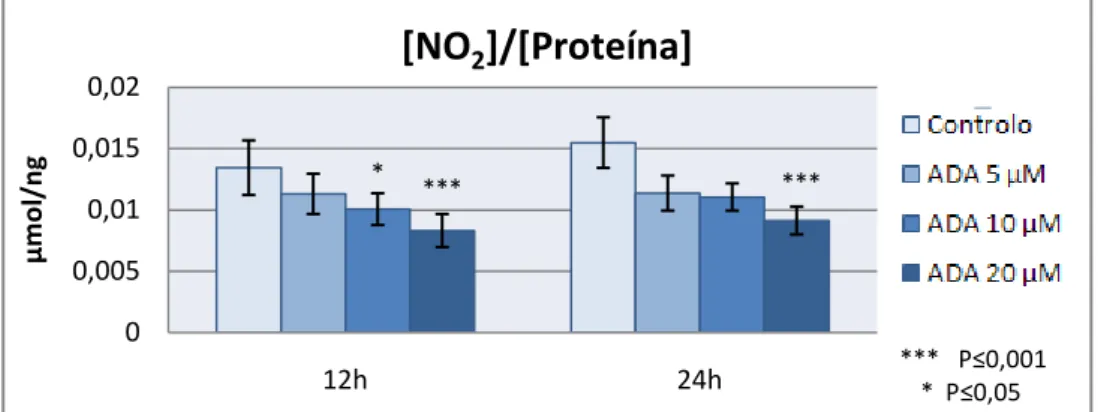
Figura 4 - Quantificação da Libertação de nitritos pelas HUVEC para o meio extracelular, para as diferentes concentrações de ADA utilizadas (5, 10 e 20 µM), normalizados pela quantidade de proteína total, após 12 e 24 horas de incubação.
Como é visível na figura 4 as concentrações de NO no meio extracelular diminuíram com a presença de ADA no meio de cultura. A incubação com ADA conduziu, após 12 horas, a uma diminuição dos níveis de NO sintetizado pelas HUVEC, com significado estatístico para as concentrações de 10 e 20µM. Após 24 horas de incubação, apenas na presença de uma concentração de 20 µM de ADA se observou uma diminuição significativa
* *** *** 0 0,005 0,01 0,015 0,02 12h 24h µmo l/ ng
[NO
2]/[Proteína]
*** P≤0,001 * P≤0,05| 17
Res
ult
ad
os
* * 0,00 0,50 1,00 1,50 2,00 2,50 µm ol /LConcentração extracelular de Hcy
Ctrl ADA 5 µM ADA 10 µM ADA 20 µM* P≤0,05
da produção de NO quando comparada com o controlo. Estes ensaios foram sempre realizados pelo menos em triplicado e em 5 linhas de HUVEC diferentes.
6.3
A presença de ADA no meio de cultura provocou uma diminuição dos níveis de Hcy extracelular, que se mostrou dependente da
concentração de ADA utilizada (Figura 5). Às 0 horas a presença de Hcy, bem como a de ADMA e SDMA, deve-se à sua existência no soro do meio de cultura (Anexo 1 - Tabela
3A). Após 24 horas de incubação,
verificou-se uma diminuição significativa no export de Hcy para as concentrações de ADA de 10 e 20µM (Figura 5).
AVALIAÇÃO DO EXPORT DE HOMOCISTEÍNA,ADMA E SDMA
Relativamente às concentrações de ADMA (Figura 6), foi observado um decréscimo que foi significativo para as concentrações de ADA 10 e 20 µM, quando comparadas com o controlo. Em relação aos níveis de SDMA não foram observadas variações significativas.
Estes dados resultaram da análise de 4 linhas celulares independentes, pelo menos em duplicado.
6.4
Como é visível na tabela 2, ao contrário das concentrações de SAM intracelular que não variaram significativamente com a presença de ADA no meio de cultura, a concentração de SAH aumentou significativamente (p<0,0001) com as diferentes concentrações de ADA utilizadas. A razão SAM/SAH, utilizada como marcador da capacidade de metilação da célula, diminuíu significativamente (p<0,005) para as diferentes concentrações de ADA utilizadas, quando comparadas com o controlo.
RAZÃO SAM/SAH * * 0,0 100,0 200,0 300,0 400,0 500,0 ADMA SDMA nmo l/ L
Concentrações extracelulares de ADMA e SDMA
Controlo ADA 5 µM ADA 10 µM ADA 20 µM* P≤0,05
Figura 6 - Concentrações de ADMA e SDMA extracelulares (nM), para as diferentes concentrações de ADA utilizadas (0, 5, 10 e 20 µM), após 24 horas de incubação.
Figura 5 - Concentrações de tHcy extracelular (µM), para as diferentes concentrações de ADA utilizadas (0, 5, 10 e 20 µM), após 24 horas de incubação.
| 18
Res
ult
ad
os
Os resultados obtidos para as concentrações de SAM e SAH foram reproduzidos em 3 linhas celulares diferentes.
Tabela 2 - Concentração intracelular de SAM e SAH normalizada pela concentração de proteína solúvel, para as diferentes concentrações de ADA utilizadas (0, 5, 10 e 20 µM), após 24 horas de incubação. Média da razão SAM/SAH.
Ctrl (n=4) 5 (n=4) 10 (n=4) 20 (n=4)
SAM (nmol/mg) 201,7 ± 50,3 207,9 ± 19,2 147,3 ± 38,7 203,9 ± 51,4 SAH (nmol/mg) 31,7 ± 3,4 117,4 ± 25,2 158,4 ± 6,4 230,4 ± 37,2
SAM/SAH 6,33 ± 1,26 1,82 ± 0,31 0,94 ± 0,28 0,88 ± 0,08
6.5
Com o objectivo de avaliar o efeito da acumulação de SAH intracelular nos níveis de transcrição dos genes de interesse foi utilizada a técnica de PCR em tempo real. Os resultados mostram um aumento significativo dos níveis de mRNA de todos os genes em estudo (Figura 7).
AVALIAÇÃO DOS NÍVEIS DE TRANSCRIÇÃO
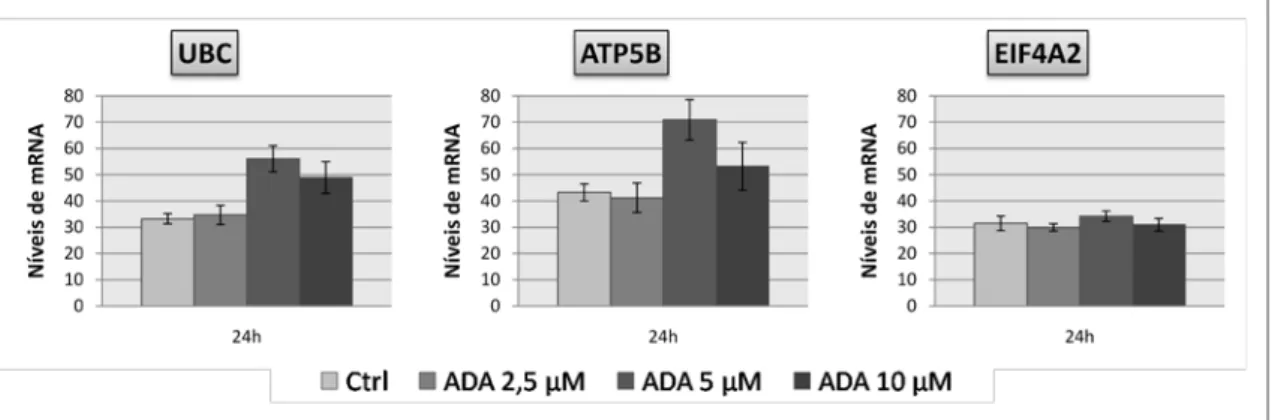
Os resultados foram normalizados relativamente ao gene endógeno utilizado para controlo das reacções de PCR em tempo real (EIF4A2), que foi seleccionado de entre 3 (ATP5B, EIF4A2, UBC) por ser aquele que apresentou menor variação com as condições em estudo (diferentes concentrações de ADA) (Anexo 1 – Figura 5A). Assim, a quantificação de todos os transcritos em estudo foi normalizada relativamente aos níveis de mRNA de
Figura 7 – Gráficos correspondentes aos níveis de mensageiro dos diferentes genes em estudo (NOS3 (A), PRMT1 (B), DDAH2 (C) e Cav-1 (D)) normalizados com EIF4A2, para as diferentes concentrações de ADA utilizadas nas incubações de HUVEC durante 24 horas.
| 19
Res
ult
ad
os
EIF4A2. Todos os resultados de PCR em tempo real foram realizados em triplicado e confirmados em 3 linhas celulares diferentes de HUVEC.
I. ENOS- Em relação à eNOS (Figura 7[A]), enzima directamente responsável pela síntese de óxido nítrico, verificou-se um aumento significativo nos níveis de RNA mensageiro com o incremento da quantidade de ADA, aumentando cerca de 40%, 68% e 74%, em relação ao controlo, para as concentrações de ADA 5, 10 e 20µM, respectivamente,
II. PRMT1 - O aumento de ADA parece promover a transcrição do gene PRMT1;
no entanto, este aumento foi menos acentuado do que o dos restantes transcritos em estudo (Figura 7[B]). A incubação de 24 horas com ADA 10µM resultou num aumento de 26% do mRNA, e com ADA 20µM de 41%, em relação ao meio controlo.
III. DDAH2 - Com é visível na figura 7(C), também a transcrição do gene DDAH2
sofreu um aumento significativo, de cerca de 38% e 53% na presença de ADA 10 e 20 µM, respectivamente.
IV. CAV-1 - Observaram-se níveis de mRNA de Cav-1 significativamente aumentados para concentrações superiores de ADA em comparação com o controlo, aumentando cerca de 62% para a concentração de ADA 10µM e 68% para ADA 20µM (Figura 7[D]).
6.6 AVALIAÇÃO DA EXPRESSÃO PROTEICA
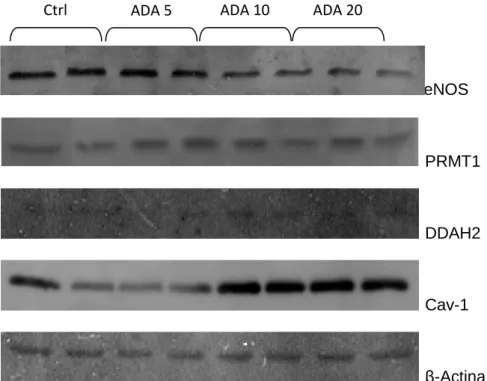
Para avaliar o efeito da acumulação de SAH intracelular, quer ao nível da transcrição, quer ao nível da tradução, a expressão proteica foi avaliada pela técnica de Western blot. A expressão da proteína β-Actina foi utilizada como controlo pois a sua expressão mantém-se na presença das diferentes concentrações de ADA utilizadas (Figura 8).
Na figura 8 pode ser observado um decréscimo na quantidade de eNOS em consequência da incubação com ADA. A diminuição parece ser dependente da concentração de ADA; para a maior concentração utilizada verificou-se um decréscimo de aproximadamente 25% em relação ao controlo (Figura 8).
Para a PRMT1 verificou-se que a concentração de proteína intracelular não variou significativamente com as incubações realizadas (Figura 8).
Em relação à proteína DDAH2, como é visível na figura 8, a proteína parece não apresentar variação sendo apenas detectada, sob a forma de bandas muito ténues, talvez devido ao facto de esta ter níveis de expressão muito reduzidos sendo difícil a sua detecção pela técnica utilizada.
| 20
Res
ult
ad
os
Foi também analisada a expressão de Cav-1 tendo-se observado um aumento significativo dependente da presença de ADA no meio.
Estes resultados foram também confirmados em 3 linhas celulares diferentes de HUVEC com ensaios sempre realizados em duplicados (ou triplicados).
eNOS
PRMT1
DDAH2
Cav-1
β-Actina
Figura 8 – Efeito da incubação de HUVEC com ADA na expressão proteica. Análise por Western blot de eNOS, PRMT1, DDAH2, Cav1 e β-actina em HUVEC incubadas durante 24horas com meio controlo (ctrl) ou de teste (concentrações de ADA de 5, 10 e 20 µM)).
6.7
Os resultados preliminares da análise do promotor de NOS3 incidiram sobre a região de -484 a -145 que possui 6 dinucleótidos CpG (posições: -412, -360, -352, -209, -198, -194). Os resultados não revelaram qualquer alteração dependente da concentração de ADA, visto que a região se apresentou sempre completamente desmetilada. Todos os cromatogramas apresentavam todas as citosinas convertidas em timinas nestes locais, tanto para a concentração de ADA 20 uM como para o controlo (Anexo 1 – Figura 6A).
ANÁLISE DE METILAÇÃO ESPECÍFICA
| 21
D
isc
ussã
o
A Hcy corresponde a um factor de risco considerado emergente e cuja relação com a disfunção endotelial ainda não se encontra completamente esclarecida. Tendo em conta a importância da regulação epigenética a todos os níveis da actividade celular e o efeito que a HHcy pode ter sobre esta, procurou-se neste estudo estabelecer uma relação entre a hipometilação (resultante da acumulação de SAH) e uma variação dos níveis de óxido nítrico, por alteração da expressão dos genes que estão envolvidos na sua biodisponibilidade.
7.
D
ISCUSSÃO
As células endoteliais da veia de cordão umbilical humano (HUVEC) foram o modelo celular utilizado neste estudo. Estas células são semelhantes às do endotélio vascular humano adulto e encontram-se bem caracterizadas, sendo por isso frequentemente utilizadas em estudos de biologia vascular.
Para promover o estado de hipometilação celular interrompeu-se a via da metabolização de SAH, pela inibição da enzima SAH hidrolase, responsável pela hidrólise de SAH em adenosina e Hcy (Figura 1). Esta inibição tem como consequência uma acumulação de SAH, forte inibidor das metiltransferases dependentes de SAM, e a consequente diminuição do estado de metilação celular. A hipometilação induzida pela acumulação de SAH pretende simular um estado de HHcy, permitindo excluir outras possíveis vias de toxicidade relacionadas com a molécula de Hcy. A inibição de SAH hidrolase foi conseguida com o recurso ao seu inibidor adenosina-2,3-dialdeido (ADA)69, cujo possível efeito citotóxico foi excluído pelo ensaio de libertação de LDH.
A reacção de Griess, conjuntamente com a utilização de uma curva padrão de nitrato de sódio, foi o método utilizado para determinar uma concentração aproximada dos nitritos resultantes da oxidação do NO, permitindo assim inferir sobre a sua variação.
7.1DIMINUIÇÃO DOS NÍVEIS DE ÓXIDO NÍTRICO
Os resultados revelaram a existência de uma relação consistente e significativa entre o aumento da concentração de ADA no meio extracelular e uma diminuição da produção de NO pelas células endoteliais (Figura 4). A diminuição de NO é o ponto de partida para a disfunção endotelial devido às suas propriedades que condicionam a homeostase do endotélio. Com efeito, como referido anteriormente, a molécula de NO actua como vasodilatador e possui muitas outras propriedades que contribuem para que seja classificado como uma ‘molécula anti-aterosclerótica endógena’, pelo que a sua diminuição é crucial no desencadear da disfunção do endotélio35
É possível ainda verificar que as diferenças entre os níveis de NO para as várias concentrações de ADA utilizadas se atenua com o passar do tempo. Após 24 horas de