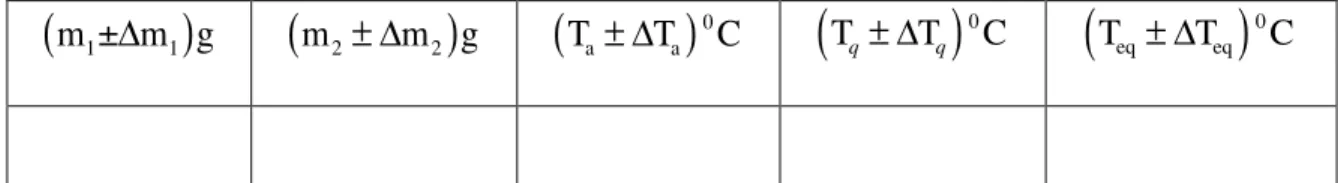Data: ______/__________ /______ Nome: ______________________________________________________________________ Nome: ______________________________________________________________________ Nome: ______________________________________________________________________ Nome: ______________________________________________________________________ Nome: ______________________________________________________________________ Nome: ______________________________________________________________________
P
ROCEDIMENTOE
XPERIMENTALE
XPERIMENTO:
02
T
ÍTULO:
CALORIMETRIA1. INTRODUÇÃO
A preparação antes de vir ao laboratório, a maneira de proceder dentro do laboratório e forma de execução dos experimentos são apresentadas no Plano de Ensino da disciplina. Os alunos devem lê-lo integralmente; em especial, os alunos que nunca frequentaram um ambiente de laboratório.
O aluno deve trazer o Roteiro do Experimento, disponibilizado previamente pelo professor, e ter estudado o roteiro antes do início do experimento. No relatório final devem constar as operações necessárias para a obtenção das respostas solicitadas em termos de tabelas, gráficos, cálculos, diagramas, esquemas, etc. Respostas sem o procedimento utilizado para obtê-las não serão consideradas.
2. OBJETIVOS GERAIS
Neste experimento, você estudará o processo de troca de calor e equilíbrio térmico através da utilização de um calorímetro.
• Aplicação da lei zero da termodinâmica.
• Medir a temperatura de equilíbrio de um sistema.
• Determinar experimentalmente a capacidade térmica de um calorímetro.
• Determinar experimentalmente o calor específico de alguns metais.
4. MATERIAL UTILIZADO
• Tipos • Calorímetro;
• Termômetros Digitais;
• Balança; • Trena; • Régua;
• Peças metálicas de materiais diferentes; • Aquecedor de água resistivo.
Observações:
I. Todo instrumento de medida é delicado. Deve-se sempre manuseá-lo de maneira adequada, com muito cuidado para não o danificar.
II. O material disponibilizado nas bancadas é de responsabilidade dos alunos que a ocupam. Ao final de cada experimento, o material deve ser arrumado sobre a bancada. Todo e qualquer material que for extraviado ou danificado será reposto pelos integrantes da equipe de estudantes responsável por ele. As bancadas serão inspecionadas depois de cada experimento.
5. PROCEDIMENTO/ATIVIDADE EXPERIMENTAL
5.1. DETERMINAÇÃO DA CAPACIDADE TÉRMICA DO CALORÍMETRO
Para obtenção da capacidade térmica do calorímetro proceda da forma descrita abaixo.
3 Para determinar a capacidade térmica do calorímetro, C, será utilizado o método das misturas com a Lei Zero e a Primeira Lei da Termodinâmica. Neste método, aquecendo uma quantidade de água a uma temperatura maior que a da água contida no calorímetro que está, por exemplo, à temperatura ambiente, quando elas são misturadas no calorímetro, a água que está a uma temperatura maior irá ceder calor à água e ao calorímetro que estão a uma temperatura menor.
i. Meça a altura da água de massa m1 juntamente com uma amostra de massa ma (a
amostra utilizada pode ser uma única peça ou um conjunto de peças). Observe que a amostra deve ficar submersa na água. Utilizaremos este nível de água h para todas as amostras.
ii. Meça a massa do calorímetro, m0, vazio.
iii. Preencha o calorímetro com uma quantidade de água, à temperatura ambiente, que cubra ligeiramente (alguns mm) a peça metálica mais alta, ou o maior conjunto de peças. Marque a altura h com um lápis, como mostra a Fig. 1.
iv. Retire a amostra e complete com água até que o nível de água atinja aproximadamente a metade de h (só se for necessário, ou seja, se ao retirar a amostra o nível de água ficou menor que h/2). Chamaremos de m1 a massa desta
quantidade de água (ou seja, a massa de água do item 1 com a do item 2 se houver). v. Meça m1 medindo a massa do calorímetro com água, M1, e subtraindo a massa do
calorímetro, M0 . Meça a temperatura Ta de M1 colocando o termômetro.
Fig.1 Diagrama esquemático da primeira parte do procedimento experimental.
vi. Meça a temperatura da água quente Tq antes de misturar com m1, (mantenha o
termômetro longe do aquecedor). 𝐓𝐪 𝐦𝟏 𝐡
𝐓𝐞𝐪 𝐦𝟐
𝐌𝟐 𝐌𝟏
( M ± ∆M ) g ( M ± ∆M ) g ( M ± ∆M ) g
𝐌𝟎≡ massa do calorímetro; 𝐌𝟏≡ massa do calorímetro + massa 𝐦𝟏 𝐌𝟐≡ massa do
𝐦𝟏 𝐦𝟐
( m ± ∆m ) g ( m ± ∆m ) g ( T ± ∆T ) °C ( T ± ∆T ) °C ( T ± ∆T ) °C
𝐡 𝐦𝟎
𝐓𝐚
vii. Ponha uma quantidade de água quente no calorímetro até que a mistura alcance a altura h.
viii. Tampe o calorímetro e coloque o termômetro no furo da tampa (resfrie o termômetro em água corrente, antes de introduzi-lo no calorímetro). Agite a mistura levemente por alguns segundos e aguarde pelo menos 5 minutos para o sistema atingir o equilíbrio térmico e meça a temperatura final de equilíbrio Teq.
ix. Meça a massa da água quente, m2, medindo a massa do calorímetro após a
colocação da água quente, M2, e subtraindo de M1.
a) (3)Calcule e preencha a Tabela 1 com os valores das massas e suas incertezas associadas.
Tabela 1: M0º massa do calorímetro; M1º massa do calorímetro + massa m1; M2º massa
do calorímetro + massa m1 + massa m2.
M0±ΔM0
b) (5)Calcule e preencha a Tabela 2 com os valores das massas e temperaturas, com suas respectivas incertezas.
Tabela 2: Massas e temperaturas, necessárias à determinação da capacidade térmica do calorímetro.
m1±Δm1
(
)
g(
m2±Δm2)g
(
Ta±ΔTa)
0C Tq ±ΔTq
(
)
0C T
eq±ΔTeq
(
)
0c) (6)Deduza uma equação e determine a capacidade térmica do calorímetro.
𝐶 (𝑐𝑎𝑙/℃) 𝐶#$%&%' (𝑐𝑎𝑙/℃) Δ𝐶(𝑐𝑎𝑙/℃)
Tabela 3
5.2. DETERMINAÇÃO DOS CALORES ESPECÍFICOS DE ALGUNS METAIS CONHECIDOS
i. Coloque a peça metálica no calorímetro e preencha com água até a altura h. Retire a peça e meça a massa do calorímetro com água. Obtenha o valor da massa de água, m0, à temperatura ambiente usando o mesmo procedimento do 1° experimento.
Agite um pouco o termômetro até que a temperatura Ta se estabilize.
ii. Meça a massa da peça de metal, ma.
iii. Coloque a peça de metal, por 5 minutos, no recipiente com água fervente e meça a temperatura Tq, (mantenha o termômetro longe do aquecedor).
iv. Retire a peça rapidamente, mas com cuidado, e a coloque no calorímetro com água, tampe o calorímetro e coloque o termômetro.
v. Agite, periodicamente e suavemente, o calorímetro e acompanhe o aumento da temperatura.
vi. Meça a temperatura de equilíbrio, Teq, do sistema. Lembre-se de aguardar pelo
menos 5 minutos para o sistema atingir o equilíbrio térmico.
vii. (10)Realize este procedimento para as peças de latão e alumínio e preencha as tabelas 4 e 5.
Tabela 4: Massas e temperaturas para a peça de latão.
Tabela 5: Massas e temperaturas para a peça de alumínio.
m0±Δm0
(
)
g(
ma±Δma)
g Ta±ΔTa
(
)
0C T
q±ΔTq
(
)
0C T
eq±ΔTeq
(
)
0C
m0±Δm0
(
)
g(
ma±Δma)
g Ta±ΔTa
(
)
0C T
q±ΔTq
(
)
0C T
eq±ΔTeq
(
)
0h) (6)Preencha a Tabela 6 com os resultados finais encontrado na forma adequada. Material 𝑐#23$4&25 (𝑐𝑎𝑙/𝑔℃) ∆𝑐(𝑐𝑎𝑙/𝑔℃) 𝑐#23$4&25 ± ∆𝑐(𝑐𝑎𝑙/𝑔℃)
Tabela 6
Material Erro%
Tabela 7
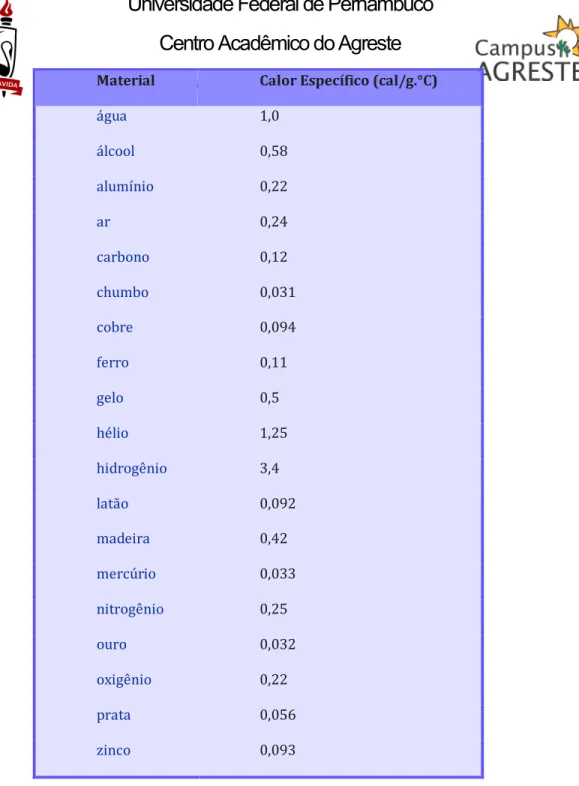
Tabela 8: Valores de cp para algumas substâncias (calor específico à pressão constante
de 1 atm).
álcool 0,58
alumínio 0,22
ar 0,24
carbono 0,12
chumbo 0,031
cobre 0,094
ferro 0,11
gelo 0,5
hélio 1,25
hidrogênio 3,4
latão 0,092
madeira 0,42
mercúrio 0,033
nitrogênio 0,25
ouro 0,032
oxigênio 0,22
prata 0,056