Universidade de Trás-Os-Montes e Alto Douro
Doenças Infeciosas em Animais de Companhia
Dissertação de Mestrado em Medicina Veterinária
Diana Maria Nogueira Carvalho
Orientador: Nuno Francisco Fonte Santa Alegria
Coorientador: Ana Cláudia Correia Coelho
Universidade de Trás-Os-Montes e Alto Douro
Doenças Infeciosas em Animais de Companhia
Dissertação de Mestrado em Medicina Veterinária
Diana Maria Nogueira Carvalho
Orientador: Nuno Francisco Fonte Santa Alegria
Coorientador: Ana Cláudia Correia Coelho
Composição do Júri:
___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________
i O conteúdo do presente trabalho é da inteira responsabilidade do autor.
ii Aos meus pais, pelo apoio incondicional e por sempre terem acreditado em mim. Ao meu namorado, por toda a compreensão e carinho. A todos os Professores que fizeram parte desta etapa da minha vida.
iii
Agradecimentos
Quero agradecer, em primeiro lugar, à Drª Ana Rita Pires e ao André Mendonça por me terem dado a oportunidade de estagiar no Hospital Veterinário das Travessas (HVT).
À Drª Ana Rita, o meu mais sentido obrigada por todas as vezes que me tirou dúvidas, por todas as explicações e por todas as vezes que me ajudou ao Domingo.
Ao André, por exigir de mim aquilo que eu não pensava ser capaz de fazer.
A toda a equipa médica do HVT, o meu muito obrigada. À Dr.ª Paula Pinho, à Dr.ª Catarina Esteves, à Dr.ª Inês Fontes e ao Dr. Leandro Rocha, obrigada pela paciência, por todas as dúvidas esclarecidas, pelo apoio e compreensão mas, sobretudo pela amizade.
À equipa de enfermeiros e auxiliares, obrigada.
À Dulce que sempre me deu oportunidade de praticar, que sempre me tirou dúvidas mesmo tendo tanto trabalho, pelas conversas, simpatia, pelo sorriso todos os dias e pela amizade, obrigada!
Ao André, obrigada por me ter apoiado nos momentos em que quase desisti, pela força, pela boa disposição e pela amizade.
À Diana, pelas conversas tontas ao almoço e ao lanche, pela paciência que tiveste ao ensinar-me a ensinar-mexer no programa informático, pela simpatia, apoio, boa disposição e amizade, obrigada! À Cláudia, por me ter permitido ajudar nas tosquias, por toda a ajuda que me deu e por me ter ensinado técnicas de como controlar gatos stressados, obrigada!
À Andreia, muito obrigada por todo o apoio, pela força, pela confiança, pela ajuda, pelo sorriso mesmo nos dias maus e pela amizade.
À Cátia, pela boa disposição, pelas conversas e confiança, por todas as vezes que me ajudou e pela amizade, obrigada!
À equipa médica da Clínica Veterinária SuilPark, obrigada por me terem feito crescer enquanto pessoa e profissionalmente, por sempre estarem dispostas a ajudar-me, por me deixarem “fazer parte da mobília”, pelo carinho e por toda a amizade, obrigada Dr.ª Andreia e Dr.ª Susana!
A toda a equipa do Hospital Veterinário de Gaia, em especial ao Dr. Sérgio Alves, por me ter permitido estagiar pela 1ª vez. Pela responsabilidade que me incutiu, por me ter deixado auxiliar em todas as cirurgias e por me ter mostrado que esta é a vida que eu sempre quis, obrigada!
iv A toda a equipa do Hospital Veterinário de Santa Marinha, o meu muito obrigada. Em especial à Dr.ª Diana Meireles, por me ter dado a oportunidade de estagiar lá, ao Dr. Bruno Silva, Bruno Lopes e Vânia Teixeira, obrigada pelo esclarecimento de todas as dúvidas, por me incentivarem a praticar, por me tratarem como uma verdadeira estagiária e também pela amizade.
À Rita Moutinho e Diogo Nogueira pela amizade durante todo o curso. Obrigada por o terem tornado mais especial e menos desesperante. Foram um dos maiores apoios. Obrigada!
À Raquel Reis, por todas as vezes que me chamou semáforo, pela companhia, pelo apoio e, acima de tudo, por teres sido a primeira amiga que fiz em Vila Real. Obrigada por todas as vezes que te riste comigo e me secaste as lágrimas.
Ao Ezequiel, D. Elisa e Sr. Carlos Moura, obrigada por terem tornado os 2 últimos anos de curso mais felizes e completos e, acima de tudo, por me terem mostrado que uma família não tem de ter o mesmo sangue.
Ao meu namorado Daniel, aos pais – Sr.ª Fernanda e Sr. Fernando Castro e ao meu “cunhado” Diogo, obrigada por terem surgido na minha vida, por me fazerem mais feliz e por todo o carinho demonstrado. Obrigada, devo-vos muito!
Ao Fábio, amigo do Daniel, obrigada por todos os cafés que tomámos todos juntos, por todas as sangrias e por te teres revelado um amigo espetacular.
Aos meus pais, o meu mais profundo obrigada por me terem permitido tirar Medicina Veterinária, por me terem apoiado todos os dias, por me acalmarem sempre que quis desistir, por me terem deixado seguir o meu sonho, pela compreensão, carinho, amor, amizade e por serem o meu pilar há 27 anos. Obrigada pai e mãe!
Ao Rex, à Boneca, à Lady, à Daisy, à Putchi, à Maria, ao Riscas, à Pipocas, à Maçarica, ao Tico, ao Patas e Princesa, obrigada meus amores por sempre me terem confortado, por fazerem parte dos meus dias, por todo o carinho que me deram/dão, por todas as asneiras que fazem e por tornarem os meus dias mais coloridos. São os melhores animais de estimação que podia ter.
v
RESUMO
A Panleucopenia Felina é uma das doenças infeciosas mais graves nos gatos afetando todos os membros da família Felidae, bem como as espécies das famílias Mustelidae,
Procyonidae e Vivernidae. O agente etiológico é o Vírus da Panleucopenia Felina, pertencente
ao subgrupo do Parvovírus Felino, género Parvovirus e acomete animais jovens cujo título de anticorpos maternos é reduzido ou ausente, gatos jovens ou adultos com histórico de vacinação desconhecido (incompleto ou ausente) e gatos adultos seronegativos.
Nos 4 meses de estágio realizado para a obtenção do grau de Mestre em Medicina Veterinária foram acompanhados 11 casos clínicos de Panleucopenia Felina. Dos 11 animais, apenas existiam registos da idade de 8, sendo que a média das idades foi de 6,6 meses (2m – 1 ano idade). Um animal apresentou a forma hiperaguda da doença. Os sinais clínicos mais frequentes foram a prostração (11/11) e anorexia (10/11), a diarreia sanguinolenta (9/11) e a febre (9/11) foram os sinais clínicos mais frequentes, seguindo-se o vómito (5/11) e a hipotermia (4/11). Foi recolhido sangue de 4 animais para análise hematológica, verificando-se a preverificando-sença de leucopenia em todos. Não verificando-se verificou hipocalemia. O tratamento consistiu em fluidoterapia, antibioterapia e administração de protetores da mucosa digestiva. A transfusão de plasma fresco congelado foi realizado em 5 dos 11 animais.
Por análise da cronologia e do aparecimento dos sinais clínicos dos animais, foi possível identificar o paciente 0 e, com base neste pressuposto, admitir que dos 11 gatos, 8 foram infetados nas instalações do Hospital Veterinário. Assim, foram também inseridas neste documento a descrição e análise crítica das medidas de higiene que vigoraram durante este surto.
Palavras-chave: Panleucopenia Felina, Vírus da Panleucopenia Felina, Plasma Fresco Congelado, Surto, Higiene e Desinfeção
vi
ABSTRACT
Feline panleukopenia is one of the most severe infectious diseases of cats, afecting all members of the family Felidae and some species of the families Mustelidae, Procyonidae and
Vivernidae. The Feline Panleukopenia Virus (FPV), the etiological agent, belongs to the feline
Parvovirus subgroup, genus Parvovirus. FPV infects young animals wich have low or absent maternal antibody titres, young and adult cats with an unknown vaccination protocol and seronegative adult cats.
In the 4 months of internship, 11 cases of feline panleukopenia were followed up. Out of the 11 cats, onlyeight had an age record, with an average of 6.6 months (range 2 months – 1 year). Only one animal showed the hyperacute form. The most frequent clinical manifestation was prostration (11/11), followed by anorexia (10/11), hemorrhagic diarrhea (9/11), fever (9/11), vomiting (5/11) and hypothermia (4/11). Blood for hematologic analysis was collected from four animals, all showing leukopenia. Hypokalemia was not observed. Treatment was based on fluid therapy, use of large spectrum antibiotics and administration of digestive mucosal protectors. Fresh frozen plasma was administrated to five of the 11 animals.
By analyzing the chronology and the observation of clinical signs, it was possible to identify the “zero” patient and to conclude that eight cats were infected at the Hospital facilities. Do to that fact, a chapter about the measures of hygiene and disinfection has been written to serve when there is an infected animal, including the rules that need to be followed in case of an outbreak.
The present dissertation begins with a detailed description of feline panleukopenia, followed by the presentation of the above mentioned 11 clinical cases, ending with the comparison between the information collected from the references and what was observed from the several clinical cases.
Keywords: Feline panleukopenia, feline panleukopenia virus, fresh frozen plasma, outbreak, hygiene and disinfection
vii
ÍNDICE GERAL
INTRODUÇÃO ... 1
Capítulo I. Revisão Bibliográfica ... 2
1. Taxonomia do Parvovírus ... 2
2. Origem e Evolução do Parvovírus Felino ... 2
3. Parvovírus Canino e Infeção em Gatos ... 4
4. Epidemiologia ... 5
5. Etiologia ... 7
6. Fisiopatogenia ... 8
6.1. Transmissão do vírus in utero ... 9
7. Sinais Clínicos ... 11
8. Diagnóstico ... 13
8.1. Isolamento Viral ... 13
8.2. Microscopia Eletrónica... 13
8.3. Determinação do Título de anticorpos neutralizantes ... 13
8.4. Inibição da Hemaglutinação ... 14 8.5. Testes Serológicos ... 14 8.6. PCR ... 15 8.7. Necropsia e Histopatologia ... 16 9. Tratamento ... 17 9.1. Fluidoterapia ... 17 9.2. Antibioterapia ... 18
9.3. Antieméticos e Protetores da mucosa digestiva ... 18
9.4. Citocinas ... 19
viii
9.6. Soro Imune e Hiperimune ... 20
9.7. Nutrição ... 21 9.8. Transfusão de Plasma ... 23 10. Prognóstico ... 27 11. Imunidade ... 28 11.1. Imunidade Passiva ... 28 11.2. Imunidade Ativa ... 29
11.3. Vacinação em Gatos Imunocomprometidos... 30
11.4. Reações Adversas à Imunização Ativa ... 31
12. Medicina Preventiva ... 32
13. Controlo e Gestão de Surtos de Panleucopenia Felina ... 33
13.1. Desinfetantes ... 33
13.2. Mãos dos Técnicos ... 35
13.3. Calçado ... 35
13.4. Vestuário ... 36
13.5. Controlo do Programa de Limpeza e Desinfeção ... 36
13.6. Ocorreu um surto, e agora? ... 37
Capítulo II. Casos Clínicos ... 39
1. Animal K ... 39 2. Animal P ... 40 3. Animal N ... 41 4. Animal T ... 43 5. Animal U ... 45 6. Animal Pi ... 46 7. Animal Mc ... 47 8. Animal MA ... 48 9. Animal Pp ... 50
ix
10. Animal Z ... 51
11. Animal M ... 53
Capítulo III. Discussão ... 54
CONCLUSÕES ... 66
BIBLIOGRAFIA ... 68
Anexos ... 75
Anexo 1 – Resultados laboratoriais e Tratamento instaurado ... 75
x
ÍNDICE DE FIGURAS
Figura 1| Microscopia eletrónica de viriões de parvovírus. ... 8 Figura 2| Hipoplasia cerebelar num gatinho infetado com o VPLF in utero (em baixo). Em cima observa-se um cérebro de um gatinho saudável. ... 10 Figura 3| Gatinho com Panleucopenia Felina exibindo um elevado grau de desidratação (afundamento dos globos oculares).. ... 11 Figura 4|Porção de intestino onde se observa uma enterite hemorrágica. ... 12 Figura 5| Teste SNAP®Parvo da IDEXX. ... 15 Figura 6| Inclusão intranuclear em linhas celulares renais felinas (CrFK) infetadas com o VPLF.. ... 16 Figura 7|Análise histopatológica de uma porção do intestino.. ... 16 Figura 8|Porção de intestino compatível com PLF.. ... 18 Figura 9| O teste de tipificação sanguínea fornecido pelo Banco de Sangue Animal baseia-se na técnica de imunocromatografia. Observa-se um teste com tipo sanguíneo A, B e AB. ... 26 Figura 10| Lacuna imunitária que ocorre entre as 8 e as 12 semanas... 28
xi
ÍNDICE DE TABELAS
Tabela 1| Análise bioquímica para avaliação hepática e renal de K. ... 75
Tabela 2|Terapêutica instaurada a K aquando do internamento... 75
Tabela 3|Terapêutica instaurada a P aquando do internamento. ... 76
Tabela 4| Terapêutica instaurada a N aquando do internamento... 76
Tabela 5| Tratamento farmacológico instaurado a N após a remoção da cauda e da ovariohisterectomia. ... 77
Tabela 6| Tratamento farmacológico instaurado a N após ter voltado a ser internado. ... 77
Tabela 7| Terapêutica instaurada a T aquando da consulta. ... 78
Tabela 8| Análise bioquímica aos valores hepáticos e renais de T. ... 78
Tabela 9| Tratamento farmacológico de T quando é internado. ... 78
Tabela 10| Análise bioquímica aos valores hepáticos e renais de U quando é internado pela 2ª vez. ... 79
Tabela 11| Resultados e valores de referência do ionograma realizado a U quando é internado pela 2ª vez... 79
Tabela 12| Resultados e valores de referência do hemograma de U quando é internado pela 2ª vez. ... 79
Tabela 13| Terapêutica instaurada a U quando é internado pela 2ª vez. ... 80
Tabela 14| Repetição do hemograma realizado a U. ... 80
Tabela 15| Resultado do 3º hemograma realizado a U. ... 81
Tabela 16| Terapêutica instaurada a Pi aquando do internamento. ... 81
Tabela 17| Terapêutica instaurada a Mc aquando do internamento. ... 82
Tabela 18| Terapêutica instaurada a MA aquando do internamento. ... 83
Tabela 19| | Resultado do hemograma realizado a MA. ... 83
Tabela 20| Esquematização da administração de Trivetrin® e Vetalgin® a MA mediante os valores de temperatura obtidos em cada dia. ... 84
Tabela 21| Tratamento farmacológico instaurado quando MA volta a ser internada. ... 84
Tabela 22| Terapia farmacológica instaurada aquando do internamento de Pp. ... 84
Tabela 23| Análise bioquímica para avaliação da função hepática e renal de Pp. ... 85
Tabela 24| Tratamento farmacológico instaurado a Pp aquando do 2º internamento. ... 85
Tabela 25| Fármacos que fizeram parte da terapia farmacológica de Z. ... 86
xii
Tabela 27| Resultado do hemograma realizado a Z quando foi internado pela 2ª vez. ... 87
Tabela 28| Análise bioquímica para avaliação da função hepática e renal de M. ... 87
Tabela 29| Resultados e valores de referência do ionograma realizado a M. ... 87
Tabela 30| Resultado do hemograma realizado a M. ... 88
Tabela 31| Fármacos que fizeram parte da terapêutica de M. ... 88
Tabela 32| Apresentação esquematizada dos sinais clínicos observados em cada um dos animais. ... 89
Tabela 33| Relação entre as idades dos 11 animais e a sua sobrevivência/ não-sobrevivência. ... 90
Tabela 34| Relação entre as datas de entrada dos 11 animais no Hospital Veterinário e o aparecimento dos seus sinais clínicos. ... 90
xiii
LISTA DE ABREVIATURAS, SIGLAS, SÍMBOLOS E ACRÓNIMOS
ALT - Alanina aminotransferase BID – 2 vezes por dia
BSA – Banco de Sangue Animal BUN – Nitrogénio Ureico Sanguíneo CID – Coagulação Intravascular Disseminada
CMSP – Células Mononucleares do Sangue Periférico
CVF – Calicivírus Felino
EDTA - ácido etilenodiamino tetra-acético FAT – Família de Acolhimento Temporário FeLV – Vírus da Leucemia Felina
FIV – Vírus da Imunodeficiência Felina GPT – Transaminase Glutâmica Pirúvica HVF-1 – Herpesvírus Felino tipo 1 Ig’s – imunoglobulinas
IgA – imunoglobulina A IgG – imunoglobulina G IgM – imunoglobulina M
IH – Inibição da Hemaglutinação NPO – Nada Per os
NPT – Nutrição Parenteral Total ORF – Open Reading Frame
PCR – Polymerase Chain Reaction (reação em cadeia da polimerase)
PFC – Plasma Fresco Congelado PI – Período de incubação PLF – Panleucopenia Felina PO – per os
PVC - Parvovírus Canino
PVC-1 - Parvovírus Canino tipo 1 PVC-2 – Parvovírus Canino tipo 2 PVC-2a - Parvovírus Canino tipo 2a PVC-2b - Parvovírus Canino tipo 2b PVC-2c - Parvovírus Canino tipo 2c PVF – Parvovírus Felino
q12h – a cada 12 horas q24h – a cada 24 horas q8h – a cada 8 horas SC – subcutâneo SID – 1 vez por dia TID – 3 vezes por dia
VEV – Vírus da Enterite dos Visons VP1, 2, 3 – Cápside viral 1, 2, 3
VPLF – Vírus da Panleucopenia Felina VVM – Vacina Viva Modificada
1
INTRODUÇÃO
A Panleucopenia Felina é uma doença infeciosa, cujo agente etiológico se denomina Vírus da Panleucopenia Felina. Apesar de não terem sido encontrados estudos de prevalência em Portugal, esta doença na prática clínica não é muito comum, sendo-o, no entanto, em abrigos de animais. Gatinhos que não ingeriram o colostro, gatos adultos com protocolo vacinal desconhecido, desatualizado ou incompleto e aqueles que nunca contactaram com a doença são os mais sensíveis. A doença transmite-se mais frequentemente por via direta, quase sempre digestiva, ou indireta, através de fómites ou insetos.
Apesar de não se tratar de uma doença muito frequente, durante este estágio foi possível acompanhar 11 casos clínicos de Panleucopenia Felina. Devido à inusitada elevada casuística observada, decidimos aprofundar e consolidar os conhecimentos relativos a esta doença. Deste modo, este trabalho é constituído por uma revisão bibliográfica do tema, seguida da descrição e discussão dos casos clínicos, tendo ficado bem patente a importância das medidas de biossegurança na contenção deste surto.
2
Capítulo I. Revisão Bibliográfica
1. Taxonomia do Parvovírus
A família Parvoviridae possui duas subfamílias: Parvovirinae, que inclui os vírus que afetam os vertebrados e Densovirinae, que contém os vírus que infetam artrópodes (Hueffer & Parrish, 2003; Decaro et al., 2008; Chen & Qiu, 2010; Cotmore et al., 2014). A subfamília
Parvovirinae é constituída por 3 géneros (Cotmore et al., 2014) e 2 grupos genéricos (Battilani et al., 2006):
Género Parvovirus: constituído pelo Vírus da Panleucopenia Felina (VPLF), Parvovírus Canino tipo 2 (PVC-2) e Vírus da Enterite dos Visons (VEV) (Marks, 2008). O Vírus da Panleucopenia Felina e o Parvovírus Canino (PVC) são membros do subgrupo do Parvovírus Felino (PVF) (Yang et al., 2010; Decaro et al., 2012) sendo parvovírus autónomos, uma vez que não requerem outros vírus para se replicarem (Nakamura et al., 2001; ABCD, 2006; Chen & Qiu, 2010; Streck et al., 2013).
Género Erytharovirus: o parvovírus humano B19 é o único membro que está confirmado como sendo patogénico para seres humanos (Clegg et al., 2012). Pode provocar doenças em crianças, crises aplásticas transitórias em doentes com anemia hemolítica crónica, aplasia eritrocitária em caso de infeções persistentes em doentes imunocomprometidos e hidropsia fetal em mulheres grávidas (Chen & Qiu, 2010).
Género Dependovirus: são vírus defetivos que requerem um adenovírus ou herpesvírus de forma a conseguirem replicar-se eficazmente. Não têm importância clínica, sendo utilizados como vetores em terapia genética.
Género Amdovirus: possui apenas uma espécie, o Vírus da doença da marta aleutiana (Aleutian Mink Disease Virus) que afeta visons e provoca essencialmente sintomas gastrointestinais, anemia aplástica e linfopenia.
Género Bocaparvovirus: inclui o Parvovírus Canino tipo 1 (PVC-1) (Carter &Wise, 2005; MacLachland & Dubovi, 2017) que afeta o trato gastrointestinal provocando enterite com diarreia severa e o sistema reprodutor com a morte dos cachorros recém-nascidos e, mais raramente, aborto espontâneo dos fetos (Chen & Qiu, 2010).
2. Origem e Evolução do Parvovírus Felino
O Vírus da Panleucopenia Felina foi descrito pela primeira vez em 1928 (Steinel et al., 2000; Nakamura et al., 2001; Hartmann, 2007; Decaro et al., 2008) mas apenas em 1965 foi
3 associado à doença (Clegg et al., 2012). Mais tarde em 1947, no Canadá, foi descoberta uma variante do PVF, tendo sido denominada Vírus da Enterite dos Visons (Tratschin et al., 1982). Em 1978 foi detetado um outro agente, muito semelhante ao da Panleucopenia Felina (PLF), em cães (Tratschin et al., 1982; Steinel et al., 2000), tendo sido denominado Parvovírus Canino tipo 2, de forma a distingui-lo de outro, isolado em 1970 e denominado Parvovírus Canino tipo 1 (ABCD, 2006; Yang et al., 2010). Quando o PVC-2 foi isolado, este não tinha capacidade para se replicar em gatos (Horiuchi et al., 1998; Steinel et al., 2000; ABCD, 2006). No entanto, devido a alterações genéticas ao longo do tempo, desenvolveram-se novas estirpes no cão com capacidade para infetarem gatos (Clegg et al., 2012; Decaro et al., 2012).
Em 1980 foi detetado um novo subtipo da estirpe original do PVC-2, designando-se 2a (PVC-2a) devido a mutações que se traduzem em alterações em 5 ou 6 aminoácidos na proteína maioritária da cápside viral – VP2 (Yang et al., 2010; Decaro et al., 2012); em 1984 (segundo Yang e colaboradores (2010) foi em 1986) foi descoberta outra variante designada então por PVC-2b, possibilitando que ambas as estirpes, devido às adaptações genéticas, se repliquem e disseminem de forma mais eficaz na população canina (Battilani et al., 2006; Decaro et al., 2008), replicando-se também nos gatos (Yang et al., 2010). Buonavoglia e colaboradores, em 2001, descreveram uma nova variante do PVC, designando-a por PVC-2c. Atualmente circulam na população canina 3 variantes do PVC - PVC-2a, PVC-2b e PVC-2c, tendo todas a capacidade de infetar gatos e provocar doença que não é distinguível da Panleucopenia Felina (Battilani et
al., 2006; Decaro et al., 2012). Em termos taxonómicos, o Parvovírus Canino e o Vírus da
Panleucopenia Felina definem-se como uma única entidade (ABCD, 2006). O Parvovírus Canino é antigenicamente semelhante ao Parvovírus Felino. Steinel e colaboradores (2000) referem que 98% do genoma é homólogo entre ambos os vírus, no entanto, Hueffer e Parrish (2003) referem que a sequência do ácido desoxirribonucleico (ADN) do PVC é >99% semelhante à sequência de ADN do PVF. Apesar das semelhanças, enquanto os gatos infetados com as variantes caninas desenvolvem a doença, a replicação do Vírus da Panleucopenia Felina nos cães apenas é encontrada nos tecidos linfoides como o timo, baço e medula óssea mas não no intestino (Horiuchi et al., 1998; ABCD, 2006; Hoelzer & Parrish, 2010; Clegg et al., 2012). Desta forma os cães não excretam o Parvovírus Felino pelas fezes nem manifestam sinais clínicos (Hartmann, 2007; Clegg et al., 2012).
De acordo com Tratschin e colaboradores (1982) tanto o VPLF, como o VEV, como o PVC conseguem replicar-se em células felinas em cultura. No entanto, em cultura de células caninas,
4 apenas o PVC se propaga (Nakamura et al., 2001). Embora o PVC seja “parente” do PVF, o padrão de evolução do VPLF difere do padrão de evolução do PVC, uma vez que, aparentemente o VPLF se encontra em “estase evolutiva”, indo de encontro com a ideia de que o ancestral do PVC tenha surgido do PVF ou de um PVF-like como resultado de mutações genéticas aleatórias (Horiuchi et al., 1998).
3. Parvovírus Canino e Infeção em Gatos
As novas variantes anteriormente referidas aparentemente são capazes de infetar gatos e outros hospedeiros como pumas, leopardos, leões (Steinel et al., 2000), coiotes, lobo cinzento, lince, guaxinim e lagartos listrados (striped skink), uma vez que estas conseguem ligar-se ao recetor da transferrina felino (Truyen, 2007), bem como aos recetores similares dos outros hospedeiros.
Ikeda e colaboradores (2000) referem que a substituição de 1 aminoácido específico na proteína VP2 do PVC-2c reduziu a capacidade do vírus em infetar as células caninas, parecendo melhorar a adaptação à infeção de células felinas, além de aumentar a estabilidade do vírus no ambiente.
Battilani e colaboradores (2007) descreveram a coinfecção por várias variantes do PVC num gato, sendo que infeções mistas por PVC-2 e VPLF também já foram descritas (Decaro et al., 2008; Miranda et al., 2014). Ikeda e colaboradores (2000) reportaram elevadas frequências de PVC em amostras recolhidas de gatos domésticos e silváticos no Japão e no Vietname, sendo que no Sudeste Asiático, o autor demonstrou que o PVC-2a e 2b são prevalentes na população de gatos.
Battilani e colaboradores (2006) procederam a um estudo molecular das estirpes do PVF isoladas de gatos domésticos em Itália. Foi demonstrada a presença do PVC e do PVF na população estudada. Os autores afirmaram que prevalecia o PVC-2a com uma variante antigénica N/D426E que foi isolada naquele país no ano 2000 e que se estava a espalhar rapidamente pela população canina. Não foram encontradas novas variantes do PVF.
Enquanto o PVC-2 não se replica nos gatos, a sua variante PVC-2a replica-se (Nakamura et al., 2001; Miranda et al., 2014), tendo este facto já sido demonstrado por Mochizuki e colaboradores (1996) que isolaram uma estirpe de PVC-2a de um gato que mostrava sinais clínicos típicos de Panleucopenia Felina. Também Miranda e colaboradores, em 2014
5 identificaram um gato infetado com PVC-2c com sinais clínicos graves. No entanto, a variante PVC-2a já foi isolada de fezes de gatos aparentemente saudáveis (Hoelzer & Parrish, 2010). Devido às diferenças em termos de gravidade e sinais clínicos encontrados pelos autores mencionados, Leutenegger e colaboradores (2015) propuseram-se confirmar que gatos saudáveis podem excretar as diversas estirpes do PVC-2. No grupo dos gatos saudáveis, 58% destes excretavam parvovírus pelas fezes. Dentro dos 58%, 21% destes estavam a excretar uma grande carga vírica, encontrando-se infetados, sendo que 6% dos gatinhos revelaram-se positivos para a presença do PVC-2a.
O estudo conduzido por Nakamura e colaboradores em 2001 demonstrou factos diferentes relativamente ao 2a. Referem que, após a inoculação em gatos de duas variantes de PVC-2a, provenientes de cães e gatos domésticos japoneses, os animais em estudo ficaram infetados mas o vírus replicou-se de uma forma muito leve, não se tendo observado sinais clínicos nestes animais com a exceção de uma leucopenia transitória. Também Kruse e colaboradores (2010) referem que a infeção experimental de gatos utilizando o PVC-2b causou apenas um ligeira leucopenia com uma marcada linfopenia mas sem mais alterações a registar. Relativamente à excreção viral, tanto os animais inoculados com o VPLF como os inoculados com as estirpes PVC-2a (V154) e PVC-2c (V203), cessaram a excreção até ao 10º dia após a inoculação (Nakamura et al., 2001).
Dos estudos atrás mencionados conclui-se que é de extrema importância a separação entre cães e gatos, tanto em canis como em ambiente hospitalar, uma vez que existe a possibilidade de gatos saudáveis excretarem o PVC-2, infetando cães suscetíveis (Clegg et al., 2012; Leutenegger et al., 2015). Miranda e colaboradores (2014) mencionam ainda que, o facto das novas variantes do PVC-2 poderem infetar e provocar doença nos gatos, o isolamento de cães e gatos com Parvovirose Canina e Panleucopenia Felina, deve ser realizado com todas as normas de biossegurança, uma vez que pode ocorrer a transferência do PVC-2 de um cão para um gato, não se excluindo, no entanto a possibilidade de transferência de gato para gato. É de notar também que os gatos que recuperaram da infeção pelo parvovírus podem excretar o vírus durante 6 semanas, tornando-se um foco de infeção para animais sensíveis (Carter, 2005).
4. Epidemiologia
O Vírus da Panleucopenia Felina é responsável por uma das doenças infeciosas mais graves nos gatos (Porporato et al., 2016), afetando todos os membros da família Felidae (Carter,
6 2005; ABCD, 2006), bem como as espécies das famílias Mustelidae, Procyonidae e Vivernidae (Stuetzer & Harmann, 2014). É um parvovírus fortemente relacionado com outros que infetam cães, raposas, guaxinins, visons, raposas do ártico (blue fox parvovirus – BFPV), leões, tigres, linces, leopardos entre outros (Horiuchi et al., 1998; ABCD, 2006; Hoelzer & Parrish, 2010). Yang e colaboradores (2010) referem que em 2008, na China, foram observados macacos com sinais clínicos semelhantes aos da Parvovirose Canina/Panleucopenia Felina. Segundo o autor, não existiam casos reportados da infeção pelo PVF ou PVC em primatas. Do conteúdo intestinal de um macaco afetado isolaram um PVF chegando à conclusão que existia uma mutação neste PVF. Este estudo tem particular importância uma vez que se encontra estabelecido a nível científico, que doenças infeciosas bastante graves para os seres humanos como a Síndrome Respiratória Aguda Severa e a Influenza aviária (H5N1 e H1N1) tiveram origem em hospedeiros não humanos. As mutações genéticas em pontos-chave destes vírus têm-se mostrado responsáveis pela capacidade de atingir outros hospedeiros devido à sua virulência. O isolamento de um PVF mutante num primata gerou alguma preocupação, sendo no entanto necessários mais estudos para avaliar a sua patogenicidade em seres humanos. No ano de 2014 em Zhengzhou e em 2015 em Guangyuan (províncias da China), foi reportada a infeção de pandas gigantes por PVF (Kang et al., 2017).
A Panleucopenia Felina habitualmente ocorre com morbilidade e mortalidade consideráveis que, dependendo da forma da doença – aguda ou hiperaguda, variam entre os 25-90% e os 100%, respetivamente (Stuetzer & Harmann, 2014).
Devido ao aumento do uso de vacinas eficazes contra a Panleucopenia Felina, a opinião geral dos clínicos privados é que a prevalência desta doença tem diminuído ao longo dos últimos 20 anos. Contrariamente, na clínica de abrigo o mesmo não se verifica (Marks, 2008). O período de incubação (PI) varia entre os 2 a 14 dias, embora Carter & Wise (2005) refiram que varia entre os 4 e os 10 dias. Desta forma, gatos expostos ao vírus podem parecer saudáveis enquanto incubam a infeção, surgindo os sinais clínicos dias após terem entrado no abrigo ou na família adotiva (Litser & Benjanirut, 2014). Uma vez que gatos infetados com o VPLF podem infetar outros 2 a 3 dias antes dos sinais clínicos se manifestarem, a entrada de um animal com protocolo vacinal desconhecido deve ser evitada onde existam animais suscetíveis – animais jovens cujo título de anticorpos maternos diminuíram ou animais adultos não vacinados e que nunca tenham entrado em contacto com o agente (Carter & Wise, 2005; Hoelzer & Parrish, 2010). A viremia máxima em gatos sem anticorpos ocorre 2 a 7 dias após a exposição (Lappin,
7 2013). A excreção do vírus continua durante 2 a 6 semanas após a recuperação do animal (Newbury, 2007) tal como nos gatos assintomáticos (Clegg et al., 2012). Um gato ao recuperar da infeção desenvolve uma resposta imunitária que perdura por muitos anos (Cai et al., 2015). É importante frisar que a PLF induz portadores assintomáticos de longo termo, existindo uma elevada prevalência de coinfeções com o Calicivírus felino (CVF) e com o Herpesvírus felino tipo 1 (HVF-1) (Kang et al., 2017).
A transmissão do VPLF pode ocorrer de forma direta, pelo contacto e ingestão de fezes, urina, sangue e secreções nasais (Carter, 2005; Lappin, 2013) de gatos infetados ou de forma indireta através de fómites e insetos (Stuetzer & Harmann, 2014). Apesar de ser menos provável que gatos indoor contraiam a doença (Kruse et al., 2010), para Stuetzer & Harmann (2014) a transmissão por fómites tem grande importância, uma vez que os tutores podem transportar o vírus na sua roupa ou calçado, infetando animais exclusivamente indoor. Existe ainda outra forma de transmissão do vírus - via intrauterina ou nos dias a seguir ao parto (Carter & Wise, 2005) dando origem à Síndrome Atáxica Cerebelar Felina, que afeta o sistema nervoso central (ABCD, 2006).
O VPLF é extremamente estável no ambiente (ABCD, 2006) podendo permanecer viável durante muitos meses (Carter & Wise, 2005; Litser & Benjanirut, 2014). Devido a este facto, e por ser muito resistente a fatores físicos e químicos (Hoelzer & Parrish, 2010), as jaulas contaminadas, liteiras, bebedouros/comedouros, calçado da equipa e a sua roupa têm um papel importante na transmissão da doença, sendo a higiene de extrema importância no combate à propagação desta doença (Truyen, 2007). Dada a estabilidade do vírus no ambiente, torna-se necessária uma desinfeção com produtos próprios para vírus nus (Litser & Benjanirut, 2014) tais como formaldeído, hipoclorito/hidróxido de sódio, peróxido de hidrogénio acelerado e peroximonosulfato de potássio. Os vapores de formaldeído podem ser utilizado para desinfetar a área onde os animais estiveram alojados (ABCD, 2006; Sparkes, 2012; Stuetzer & Harmann, 2014).
5. Etiologia
A Panleucopenia Felina é uma doença provocada por um vírus ADN com uma cápside com simetria icosaédrica (Figura 1) (Carter e Wise, 2005; Newbury, 2007; Truyen, 2007; Kruse
8 Possui uma cápside com cerca de 25nm de diâmetro (Clegg et al., 2012; Kang et al., 2017) e um genoma que contém aproximadamente 5000 bases (Chen & Qiu, 2010; Truyen & Parrish, 2013). O genoma de cadeia simples possui duas grelhas abertas de leitura (do inglês open reading frames – ORF). A grelha aberta de leitura 1 (ORF1) codifica duas proteínas não estruturais do virião, a NS1 e a NS2 (Horiuchi et al., 1998; Kang et al., 2017). A NS1 é produzida em grandes quantidades e tem como funções a determinação do início da replicação do ADN viral (Cotmore et al., 2014) por ligação desta ao genoma viral, a separação de cadeias duplas de ADN viral que se formam durante o processo de replicação viral, além de interferir na replicação do ADN celular induzindo a morte da célula hospedeira na fase S da síntese de ADN (Truyen & Parrish, 2013). A NS2 participa na regulação da expressão dos genes virais. A grelha aberta de leitura 2 (ORF2) codifica as duas proteínas estruturais da cápside, a VP1 e a VP2 (Horiuchi et al., 1998; Kang et al., 2017) que se associam em capsómeros, enquanto a terceira proteína estrutural - VP3 é produzida pela clivagem enzimática de uma porção da VP2 e só se encontra nos viriões infeciosos. As cápsides dos parvovírus são altamente antigénicas e desempenham um papel fundamental, quer na escolha do hospedeiro, quer no tropismo celular. A replicação dos parvovírus requer o uso de vários componentes da replicação de ADN da célula hospedeira (Kang et al., 2017) necessitando, por isso de células em mitose, uma vez que não conseguem induzi-la para se replicarem (Hoelzer & Parrish, 2010; Streck et al., 2013). Os viriões replicam-se no núcleo dessas células com posterior lise das mesmas (Carter e Wise, 2005).
6. Fisiopatogenia
O Parvovírus Felino provoca uma infeção sistémica (Truyen, 2007). Inicialmente replica-se nos tecidos da orofaringe durante 18 a 24 horas, distribuindo-replica-se por viremia, para diversos tecidos nos 2 a 7 dias seguintes (Carter & Wise, 2005). O vírus possui tropismo para células de rápida divisão, que se encontrem na fase S da divisão mitótica (Truyen, 2007) como as criptas epiteliais do intestino, tecido linfoide e células estaminais da medula óssea (Litster & Benjanirut, 2014). Este tropismo existe porque a sua replicação necessita das polimerases do
Figura 1| Microscopia eletrónica de viriões de parvovírus. Fonte: Hartmann, 2007
9 ADN da célula infetada para, por complementaridade, sintetizar a outra banda de ADN viral (Garigliany et al., 2016). Este é o primeiro passo na replicação do ADN viral e um pré-requisito para a transcrição (ABCD, 2006). O vírus infeta rapidamente o tecido linfoide, provocando uma depleção celular e consequentemente imunossupressão (Truyen, 2007), sendo que a linfopenia pode surgir diretamente como resultado da linfocitólise ou indiretamente devido à migração dos linfócitos para os tecidos afetados (Decaro et al., 2012). A medula óssea é também afetada (Lappin, 2013). No intestino, devido à rápida regeneração do mesmo, o VPLF infeta as criptas de Lieberkuhn (Truyen, 2007), originando o característico encurtamento das vilosidades intestinais e prejudicando a regeneração do epitélio intestinal, ocorrendo também perda das suas células epiteliais (Parrish, 2006). A severidade das lesões mencionadas aparentam estar também relacionadas com uma possível coinfecção com vírus felinos entéricos como o coronavírus que, em conjunto, podem incrementar a severidade da doença (ABCD, 2006; Sparkes, 2012). Dado que o parvovírus só infeta células em mitose, as manifestações clinicas da doença encontram-se fortemente dependentes da idade do hospedeiro, sendo os sintomas semelhantes nos animais domésticos e silváticos (Garigliany et al., 2016). Em animais com uma idade superior às 4 semanas, devido à citólise na medula óssea e nos tecidos linfoides, ocorre uma linfopenia ou leucopenia, decrescendo também o número de trombócitos circulantes, eritrócitos, granulócitos e mastócitos (Hoelzer & Parrish, 2010). Já a perda das células intestinais pode dar origem a uma enterite hemorrágica (Stuetzer & Harmann, 2014).
A indução da morte celular pelos membros do género Parvovirus é célula-tipo dependente. Em amostras recolhidas de gatos com Panleucopenia Felina, demonstrou-se que a apoptose contribuiu significativamente para a difusão das lesões tecidulares causadas pela infeção. Do ponto de vista imunológico, pensa-se que a indução da apoptose durante a infeção vírica seja uma forma do hospedeiro se defender da invasão viral. No entanto, a apoptose pode representar um passo crucial na patogenia e ciclo de vida do vírus, uma vez que as células em apoptose permitem a libertação do vírus e induzem uma menor resposta imunitária do que a lise celular, uma vez que esta última liberta componentes que ativam a resposta inflamatória, estimulando, portanto, as defesas do hospedeiro (Chen & Qiu, 2010).
6.1. Transmissão do vírus in utero
Se a imunidade materna não estiver presente, a infeção dos animais recém-nascidos ou fetos pode ocorrer. Em casos raros a infeção in utero pode originar aborto ou replicação viral generalizada fatal (Decaro et al., 2012). Em animais recém-nascidos não se observa diarreia,
10 provavelmente porque a taxa de replicação das células intestinais é diminuta (Hoelzer & Parrish, 2010). A infeção in utero pode induzir uma forma de tolerância imunitária, levando os gatinhos a excretarem o vírus durante um grande período de tempo após o nascimento (ABCD, 2006).
A hipoplasia cerebelar foi reconhecida no gato em meados de 1888. Os sinais clínicos são geralmente simétricos e incluem ataxia cerebelo-vestibular com membros espásticos, dismetria, tremores da cabeça, perda de equilíbrio, e marcha com abertura dos membros. Alguns animais têm dificuldade em manter-se de pé, não conseguindo dar mais que alguns passos sem cair. Pode observar-se rinite e neurite ótica (Lappin, 2013), sendo que a degeneração da retina e a atrofia do nervo ótico podem originar algum grau de cegueira (Decaro et al., 2012).
Até 1967 pensava-se que esta doença era genética. Foram Johnson, Margolis e Kilham que identificaram o VPLF como sendo a etiologia. A patogenia encontra-se bem esclarecida. O vírus tem tropismo para as células da camada germinal externa do cerebelo, mantendo-se no estado ativo até às 10 semanas de idade (Schatzberg et al., 2003). O vírus destrói esta camada celular que, em condições normais daria origem às células granulares cerebelares, originando hipoplasia da camada granular (hipoplasia
granuloprival) com depleção das células granulares e heterotopia das células de Purkinje até uma completa falta de neurónios (Decaro et
al., 2012).
Como resultado, o animal apresenta uma hipoplasia difusa ou atrofia do cerebelo (Figura 2). O PVF pode ainda persistir em células endoteliais e macrófagos (Schatzberg et al., 2003). Agenesia cerebelar ou hipoplasia juntamente com hidrocéfalo e hidranencefalia também já foram reportados em gatinhos infetados in utero com parvovírus, possivelmente devido à vacinação da progenitora (Vite, 2006).
Figura 2| Hipoplasia cerebelar num gatinho infetado com o VPLF in utero (em baixo). Em cima observa-se um cérebro de um gatinho saudável. Fonte: Hartmann, 2007.
11 A infeção do tecido nervoso pelo PVF nunca foi descrita em gatos adultos, embora se tenham obtido resultados positivos para o PVC através da técnica de imunomarcação (immunostaining) em neurónios cerebrais felinos (Url et al., 2003). O estudo conduzido por Garigliany e colaboradores em 2016 demonstrou grande evidência da infeção de neurónios cerebrais pelo PVF em gatinhos e gatos adultos.
Contrariamente à Parvovirose Canina, o miocárdio não aparenta ser um local de replicação para o PVF. No entanto, o ADN do PVF ou até mesmo o próprio vírus já foram identificados num número significativo de gatos adultos que faleceram devido a cardiomiopatias. Eventualmente o PVF poderá ter influência na patogenia das doenças cardíacas em gatos mas esta teoria ainda não foi provada (Stuetzer & Harmann, 2014).
O diagnóstico da PLF baseia-se na idade, espécie, anamnese, histopatologia, imunofluorescência ou amplificação do ADN por PCR (do inglês Polymerase Chain Reaction). Segundo Schatzberg e colaboradores (2003) a PCR é mais sensível na deteção da infeção em cérebros de gatos com hipoplasia cerebelar, comparativamente à imunohistoquímica. Uma vez que não se trata de uma doença progressiva, o prognóstico é favorável. Não existe tratamento (Vite, 2006).
7. Sinais Clínicos
A severidade dos sinais clínicos depende da idade, do estado imunitário e da presença de outras infeções (Stuetzer & Harmann, 2014). A doença, em termos clínicos varia entre uma infeção subclínica e uma síndrome hiperaguda com morte súbita (Lappin, 2013; Truyen & Parrish, 2013). Na forma hiperaguda os gatos podem morrer em 12 horas devido ao profundo choque sético, desidratação (Figura 3) e hipotermia, sendo que os sinais clínicos serão mínimos ou inexistentes. A forma aguda é a mais comum caraterizando-se por uma história de pirexia de 3 a 4 dias, depressão, anorexia progressiva, vómito e, por vezes, diarreia. Na maioria dos gatos, os sinais gastrointestinais coincidem com uma leucopenia grave (Truyen & Parrish, 2013) e uma neutropenia que se inicia
Figura 3| Gatinho com Panleucopenia Felina exibindo um elevado grau de desidratação (afundamento dos globos oculares). Fonte: Hartmann, 2007.
12 e agrava rapidamente, devido quer à perda de neutrófilos pelo trato gastrointestinal, quer pela supressão da medula óssea (Kruse et al., 2010; Decaro et al., 2012).
Tipicamente, os sinais clínicos iniciais incluem febre, letargia, anorexia, depressão, fraqueza (Newbury, 2007; Decaro et al., 2012), decúbito esternal com membros afastados e cabeça pendente, corrimento nasal e ocular com conjuntivite (Carter, 2005; Streck et al., 2013). Seguem-se os vómitos e, com menor frequência, uma diarreia hemorrágica
(Figura 4) (Kim, 2011), sendo que esta tem maior probabilidade de ocorrer em gatinhos com mais de 5 semanas de vida (Truyen & Parrish, 2013).
Os animais morrem devido a complicações associadas a infeções bacterianas secundárias, septicemia, desidratação e coagulação intravascular disseminada (CID) (Newbury, 2007). A diarreia hemorrágica desenvolve-se como consequência de uma enterite severa com lesões ao nível da mucosa intestinal, CID (Estrin et al., 2006) ou coinfecções com outros microrganismos (Stuetzer & Harmann, 2014).
A hipoalbuminemia usualmente é a alteração bioquímica mais frequente. Isto ocorre quer devido à diminuição da ingestão de proteína quer devido à perda da mesma pelo trato gastrointestinal. A hipocalemia pode ser explicada pela anorexia, vómito, aumento das perdas gastrointestinais de potássio e pode também refletir a severidade da enterite (Kruse et al., 2010). No estudo conduzido por Kruse e colaboradores em 2010, a segunda alteração hematológica encontrada foi uma trombocitopenia atribuída à destruição de megacariócitos ou o aumento do seu consumo devido à CID, podendo esta refletir um estado mais avançado da doença. Devido à vida relativamente longa dos eritrócitos, uma marcada anemia só é comum quando a perda intestinal de sangue é severa, contudo uma anemia não regenerativa pode ser observada numa infeção por Parvovírus Felino (Kruse et al., 2010).
Figura 4|Porção de intestino onde se observa uma enterite hemorrágica. Fonte: Hartmann, 2007.
13
8. Diagnóstico
O diagnóstico da Panleucopenia Felina é usualmente obtido usando a combinação de uma boa anamnese (animais não vacinados, recentemente vacinados, quando não se sabe se o animal foi exposto ao vírus ou um animal com um protocolo vacinal incompleto), com a presença de sinais clínicos compatíveis, a presença de leucopenia (a inexistência de alterações nos leucócitos não exclui a infeção) e um teste antigénico contra parvovírus positivo (Newbury, 2007). No entanto, existem diversas formas de obter um diagnóstico definitivo.
8.1. Isolamento Viral
O isolamento dos vírus em linhas celulares pode ser realizado, contudo esta técnica requer um período de tempo de 3 a 4 semanas, sendo que algumas estirpes não possuem efeitos citopáticos claros nas células (Carter, 2005; Marks, 2008; Streck et al., 2013).
8.2. Microscopia Eletrónica
Técnica que compreende a visualização dos viriões nas fezes, desenvolvida nos anos 30, possuindo grande impacto no desenvolvimento da Virologia mas que acabou por ser ultrapassada pelas provas serológicas e técnicas moleculares como a PCR. Em investigação continua a ter uso na identificação dos vírus e da sua estrutura devido à elevada capacidade de detalhe da estrutura viral, permitindo, em combinação com outras técnicas, obter detalhes de resolução quase atómica (Roingeard, 2008).
8.3. Determinação do Título de anticorpos neutralizantes
No passado, a titulação da excreção viral a partir das fezes servia como meio de monitorização, sendo comummente aceite que esta refletia a proliferação do vírus entre gatos. No entanto, o VPLF também tem tropismo para os tecidos linfoides (Nakamura et al., 2001). Em 1999, Miyazaga e colaboradores descobriram que o PVF era frequentemente isolado mesmo na presença de elevados títulos de anticorpos neutralizantes do vírus. A excreção fecal do vírus deveria terminar assim que ocorre uma resposta imunitária por parte do hospedeiro. Sabia-se que o PVC se replicava de forma eficiente nas células mononucleares do sangue periférico (CMSP) (linfócitos e monócitos) caninos e felinos enquanto o VPLF se replicava in
vitro apenas nos linfócitos do sangue periférico dos gatos. Desconhecia-se até então se o PVF
podia ou não ser isolado das CMSP de gatos naturalmente infetados. Assim Miyazaga e colaboradores (1999) isolaram PVF de CMSP de gatos infetados independentemente da
14 presença de anticorpos neutralizantes do virus, concluindo que o PVF infeta, de facto, in vivo as CMSP. Pegando neste estudo, Nakamura e colaboradores, em 2001 realizaram um de forma a determinar durante quanto tempo o PVF se encontrava presente nas CMSP de gatos infetados. Os resultados obtidos foram: no grupo infetado com VPLF o vírus foi isolado das CMSP 1 a 3-4 semanas após inoculação; no grupo inoculado com PVC-2a (V153-4) o virus foi isolado de apenas 1 animal 2-3 semanas após inoculação mas onde não foram observados sinais clínicos; no grupo infetado com PVC-2c (V203) o virus foi isolado 1 a 2 semanas após a inoculação em todos os gatos.
8.4. Inibição da Hemaglutinação
Teste laboratorial que quantifica anticorpos contra determinados vírus. O PVF aglutina os eritrócitos de suínos, pelo que, quando os anticorpos estão presentes na amostra, não ocorre adesão entre o antigénio e o anticorpo, inibindo assim a aglutinação entre o vírus e os eritrócitos. Esta técnica não pode ser realizada na clínica e a leitura do resultado é sempre subjetiva, podendo levar a falsos positivos e falsos negativos. Mende e colaboradores (2014) consideraram que a inibição da hemaglutinação (IH) era o golden standard para a medição de anticorpos contra o PVF, embora ainda seja discutível qual o título de anticorpos que confere proteção em gatos adultos (cut-off point). Num estudo, considerava-se que os animais estavam protegidos da infeção pelo PVF se tivessem um título ≥1:40 (IH) antes da vacinação (Mende et
al., 2014). Atualmente considera-se que um animal se encontra protegido se tiver sido vacinado
depois dos anticorpos maternos terem diminuído ou se tiver recuperado da infeção pelo vírus, com a presença de anticorpos, mesmo em baixa concentração (1:20) (Lappin, 2012). É de referir que este método depende da estrutura da cápside viral, sendo que vírus que exibem substituições de aminoácidos podem alterar o resultado do teste (Streck et al., 2013).
8.5. Testes Serológicos
Identificam a presença de anticorpos contra uma determinada doença numa amostra, demonstrando, não que o animal esteja infetado mas sim que já esteve exposto à infeção (Lloret, 2008), possuindo por isso um valor de diagnóstico limitado (ABCD, 2006).
15 Como anteriormente referido, o vírus pode ser excretado pelas fezes. Os testes antigénicos rápidos (kit’s) que usam fezes podem ser usados tanto no diagnóstico da doença como também no controlo e na gestão de um surto, de forma que os animais com um teste positivo possam ser identificados e devidamente isolados. Estes
testes, apesar de desenhados e formulados para detetarem o Parvovírus Canino nas fezes de cães infetados com Parvovirose Canina, possuem, muitos deles, uma boa especificidade para a deteção do Parovirus Felino nas fezes dos gatos, como é o caso do Teste SNAP®Parvo da marca IDEXX (Figura 5) que aparenta ser mais específico que outras marcas (ABCD, 2006; Marks, 2008; Lappin, 2013). No entanto os falsos positivos podem ocorrer entre o 1º e o 14º dia após a administração de uma vacina viva modificada (VVM) (Litser & Benjanirut, 2014).
8.6. PCR
As técnicas moleculares de diagnóstico, principalmente a PCR revolucionaram o diagnóstico das doenças infeciosas nas últimas décadas ao permitirem uma rápida e fácil deteção dos agentes patogénicos, caracterizando-se pela sua grande sensibilidade e especificidade. No entanto os resultados devem ser interpretados cautelosamente e de acordo com o diagnóstico presuntivo do clínico, uma vez que um agente patogénico pode ser isolado mas não ser ele o causador da doença. Quando o resultado de uma amostra analisada por PCR é negativo, não significa que o animal não está infetado, mas sim, que a amostra pode não ser suficiente ou inadequada ou então ter sido obtida de um tecido para o qual aquele agente patogénico não possui tropismo.
O PVF pode facilmente ser detetado por PCR em amostras de fezes ou sangue, no entanto o seu uso é incomum, devido à sugestiva história clinica, sinais clínicos e a existência de testes rápidos que detetam antigénios felinos nas fezes. A técnica pode sim, ser utilizada no diagnóstico de casos de Panleucopenia Felina atípica (Lloret, 2008).
Aquando da comparação entre a técnica PCR e a técnica PCR em tempo real, observou-se que esta última possui maior sensibilidade levando à substituição de técnicas de diagnóstico como
Figura 5| Teste SNAP®Parvo da IDEXX. Fonte:
16 o isolamento do virus e a hemaglutinação como protocolo standard em estudos de vigilância e de diagnóstico do vírus. O estudo levado a cabo por Streck e colaboradores em 2013 teve como objetivo desenvolver um método de qPCR (do inglês quantitative PCR - q), aplicado à tecnologia TaqMan para a deteção e quantificação de PVC-2 e VPLF em amostras de soro e amostras fecais. Esta forma de diagnóstico demonstrou uma grande sensibilidade, quer nas amostras fecais quer nas de soro, provando ser um excelente método no diagnóstico tanto de Panleucopenia Felina como Parvovirose Canina. Esta sensibilidade permite ainda distinguir animais positivos quando existe total ausência de sinais clínicos. Ao contrário de outros métodos de diagnóstico que apenas detetam PVF ou PVC, este foi desenvolvido para detetar ambos os vírus. A taxa evolutiva dos parvovírus e a substituição de diversos nucleótidos pode originar falsos negativos. Naquele estudo os primers foram selecionados melhorando a técnica para a deteção destes vírus mutados, reduzindo-se o número de falsos negativos. Adicionalmente, a elevada sensibilidade assegura a deteção da infeção no estado inicial, bem como a identificação de animais portadores.
8.7. Necropsia e Histopatologia
Aquando da necropsia pode observar-se desidratação, emaciação, enterite aguda particularmente do intestino delgado, linfadenomegalia mesentérica e esplenomegalia (Decaro
et al., 2012). Amostras do intestino delgado, pulmão, fígado, linfonodos e baço devem ser
colhidas para a deteção de lesões características por análise histopatológica. Inclusões intranucleares (Figura 6) tipo B nas células epiteliais intestinais são significativas (Kim, 2011; Lappin, 2013).
Figura 6| Inclusão intranuclear em linhas celulares renais felinas (CrFK) infetadas
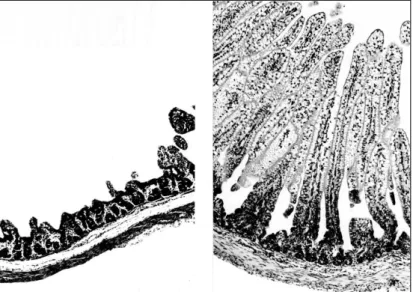
com o VPLF. Fonte: Hartmann, 2007. Figura 7|Análise histopatológica de uma porção do intestino. Observa-se perda de vilosidades intestinais e o achatamento da lâmina própria (esq.). Porção de intestino normal (dir.). Fonte: Hartmann, 2007.
17 Outras alterações microscópicas do intestino delgado incluem dilatação das criptas e o seu preenchimento com muco ou até necrose das mesmas, perda de vilosidades (Figura 7) ou o seu achatamento e colapso da lâmina própria – estas lesões histológicas são muito valorizadas para o diagnóstico definitivo post-mortem (Carter, 2005; Newbury, 2007).
Contudo, os sinais clínicos em combinação com uma panleucopenia e a demonstração do vírus nas fezes denotam uma boa evidência da doença em causa (Marks, 2008; Sparkes, 2012).
9. Tratamento
Um gato que apresente sinais clínicos graves ou alterações laboratoriais compatíveis com PLF deve ser imediatamente isolado e receber cuidados intensivos (ABCD, 2006), passando o tratamento por uma terapia de suporte, excelentes cuidados de enfermagem, administração de antibióticos para controlar/prevenir uma septicemia e, sendo possível, a administração de plasma fresco congelado (Hartmann, 2007; Decaro et al., 2012).
9.1. Fluidoterapia
O aspeto mais importante do tratamento sintomático é o restauro do balanço hidro-eletrolítico e ácido-base, preferencialmente por via intravenosa, que deve ser mantido enquanto o vómito ou a diarreia persistirem (Marks, 2008; Decaro et al., 2012).
Este pode ser realizado através da administração de cristaloides como o lactato de Ringer ou NaCl 0,9% (Litser & Benjanirut, 2014). Os animais que desenvolvem hipoproteinemia requerem a administração de plasma ou de coloides sintéticos como por exemplo Hetastarch® se se evidenciar edema por diminuição da pressão oncótica (Adamantos, 2014), devendo ter-se em atenção que estes nunca devem ser administrados até que o grau de desidratação seja corrigido (Hartmann, 2007).
A acidose metabólica e hipocalemia são comuns e devem ser corrigidas. Em caso de acidose, pode optar-se pela administração de lactato de Ringer, uma vez que o ião lactato é convertido em bicarbonato no fígado (pressupondo que a função hepática se encontra normal) ou, em casos graves, pode optar-se pela administração de bicarbonato de sódio. No caso de hipocalemia decorrente das perdas de potássio pelo vómito, diarreia e anorexia, podemos suplementar os fluidos com cloreto de potássio. A hipoglicemia pode estar presente e deve também ser corrigida (Hartmann, 2007) com a suplementação dos fluidos com soluções de dextrose a 2.5-5% (Marks, 2008). Os gatos por vezes desenvolvem deficiência em tiamina, sendo que a
18 suplementação com vitaminas do complexo B previne ou reverte esta situação (Hartmann, 2007; Stuetzer & Harmann, 2014).
9.2. Antibioterapia
Devido à destruição da barreira mucosa intestinal (Figura 8) a flora microbiana intestinal pode rapidamente entrar em circulação e provocar uma bacteriemia (Stuetzer & Harmann, 2014) que, pela existência de neutropenia, pode originar septicemia (ABCD, 2006).
A prevenção desta é fundamental e, por isso, devem ser administrados antibióticos de largo espetro com eficácia comprovada contra bactérias gram negativas e anaeróbias (Lappin, 2013). Como exemplos temos amoxicilina-ácido clavulânico ou piperacilina, juntamente com aminoglicosídeos, fluoroquinolonas ou cefalosporinas. Os antibióticos devem ser administrados por via parenteral, preferencialmente por via intravenosa (IV) (Hartmann, 2007; Marks, 2008; Sparkes, 2012). Stuetzer & Harmann (2014) recomendam o uso de amoxicilina-ácido clavulânico juntamente com uma cefalosporina de 3ª geração (cefatriaxona). Devido à toxicidade renal, os aminoglicosídeos só devem ser administrados a animais bem hidratados. Com a utilização de fluoroquinolonas deve ter-se em atenção às doses utilizadas, uma vez que a utilização desta está associada a toxicidade da retina. Litser & Benjanirut (2014) referem ainda a utilização de metronidazol (15mg/kg q24h PO/SC/IV) e doxiciclina (10mg/kg q24h PO).
9.3. Antieméticos e Protetores da mucosa digestiva
Sendo o vómito um dos sinais clínicos que mais deprime o animal e impede a sua melhoria (Mazzaferro, 2011), a administração de antieméticos é fundamental. Litser & Benjanirut (2014) fazem referência à metoclopramida (0.2-0.4mg/kg q8h SC/IV). Marks (2008) acrescenta a proclorperazina e refere que a metoclopramida é mais eficaz se administrada de forma continua (1mg/kg/24h) com a fluidoterapia instaurada. Para Stuetzer & Harmann (2014) o citrato de maropitant é o antiemético que melhor atua nos gatos, contudo este não pode ser
Figura 8|Porção de intestino compatível com PLF. A perda e lise de enterócitos provoca uma diminuição da espessura do mesmo favorecendo a translocação bacteriana. Fonte: Hartmann, 2007.
19 administrado por mais de 5 dias nem a animais com menos de 16 semanas (Mazzaferro, 2011). Deve ter-se em atenção que os fármacos que alteram a motilidade intestinal, tais como a ranitidina e a metoclopramida, ambas consideradas pró-cinéticas, devem ser evitadas por longos períodos de tempo devido ao risco aumentado de intussusceção (Mazzaferro, 2011).
Devido à possibilidade de ocorrer uma esofagite secundária ao vómito, recomenda-se a administração de antagonistas dos recetores H2 como a famotidina (0.5-1mg/kg q12-24h SC) ou a ranitidina. De forma a proteger o estômago, recomenda-se a administração de um penso digestivo como o sucralfato (Marks, 2008).
9.4. Citocinas
O filgastrim é um fator estimulador dos granulócitos humanos obtido por via recombinante que aumenta o número de neutrófilos circulantes em vários animais, quer saudáveis, quer em certas doenças (Hartmann, 2007), podendo ser utilizado no tratamento de neutropenias severas induzidas por parvovírus (Marks, 2008). Hartmann (2007) refere um estudo com gatos com neutropenia severa e diagnóstico positivo para PLF, não se evidenciando diferenças entre os animais tratados com este fármaco e o grupo que recebeu o placebo. A falha no tratamento com este composto exógeno deve-se provavelmente ao facto de já existirem elevadas quantidades deste composto endógeno de forma a estimular a produção de neutrófilos. Mais se acrescenta que o uso de filgastrim pode exacerbar a doença, uma vez que o parvovírus se replica em células em mitose (Hartmann, 2007).
9.5. Terapia Antiviral
Os vírus, parasitas intracelulares obrigatórios, utilizam mecanismos celulares no seu processo de replicação. Desta forma, qualquer tentativa de interferir com a replicação vírica pode muitas vezes ser tóxica para a célula hospedeira devido à pequena margem terapêutica dos antivíricos. Os principais fármacos antivíricos disponíveis para gatos são o interferão, análogos dos nucleósidos e aminoácidos (Radford, 2006). Contudo não foram encontrados estudos que referissem a utilização dos análogos dos nucleósidos ou de aminoácidos no tratamento da Panleucopenia Felina.
O interferão é um químico natural, componente da resposta imunitária inata e que é produzido em resposta a uma infeção viral, mais precocemente que a resposta imunitária específica (Kang et al., 2017). Liga-se a recetores celulares levando à indução de um estado denominado “estado antiviral”. Existem dois tipos de interferão, o tipo I (αβω) e o tipo II (γ).
20 Apesar de o interferão de uma espécie poder atuar noutra, como é o caso do interferão humano em gatos, este atua melhor quando as espécies estão relacionadas (o interferão felino atua tanto em gatos como cães). Virbagen ómega (Virbac) é um interferão ómega felino produzido por tecnologia de ADN recombinante que inibe a replicação in vitro do PVC (Radford, 2006). Hartmann, 2007 refere um estudo com 29 cachorros Beagle de aproximadamente 3-4 meses de idade onde, quando comparado com o grupo placebo, os animais que receberam o interferão-ω mostraram sinais clínicos menos severos. A replicação do VPLF também pode ser inibida in
vitro pelo interferão-ω. Apesar de não terem sido encontradas referências quanto à sua
utilização na PLF, os autores afirmam esperar-se um efeito benéfico aquando do seu uso em gatos infetados (Martin et al., 2002; Hartmann, 2007).
9.6. Soro Imune e Hiperimune
O soro “imune” é obtido de animais saudáveis que recuperaram de uma doença específica, enquanto o soro hiperimune ou imunização passiva, é obtido de animais repetidamente vacinados contra determinadas doenças (Hartmann, 2007).
O soro “imune” pode ser administrado em animais sensíveis como profilaxia, em caso de contato com um animal infetado, ou como adjuvante no tratamento, tendo a sua eficácia já sido demonstrada em cães, esperando-se os mesmos efeitos benéficos em gatos (Stuetzer & Harmann, 2014). Embora não se conheça a quantidade mínima necessária que confira proteção (Levy & Crawford, 2000), recomendam-se 2 a 4ml de soro/kg, podendo ser administrado por via SC em adultos e de forma intraperitoneal em gatinhos (ABCD, 2006; Lappin, 2013). O soro hiperimune pode ser usado quer na prevenção quer no tratamento de uma infeção por parvovírus se contiver os anticorpos capazes de neutralizar o vírus. Se o soro for administrado de forma profilática, com a transferência de anticorpos específicos para prevenir uma determinada doença denomina-se imunização passiva. Esta pode ser usada em abrigos de animais uma vez que confere proteção imediata. A eficácia da utilização de imunoglobulinas (Ig’s) na prevenção de uma infeção, incluindo o PVF, foi experimentalmente provada, quer em laboratório quer em estudos de campo há 50 anos. A eficácia depende de vários fatores, incluindo o título de anticorpos contra o agente específico, o volume administrado e o tempo que medeia entre a administração e a exposição ao agente (ABCD, 2006). Em alguns países da Europa são comercializados soros hiperimune para gatos contendo uma elevada concentração de imunoglobulinas (preparação heteróloga produzida a partir de cavalos contendo uma
21 combinação de anticorpos contra PVF, CVF e HVF-1). Se usados de forma terapêutica, devem ser administradas 3 injeções por animal, SC, q24h. O efeito protetor destes anticorpos dura 24 horas, no entanto este efeito permanece durante 2 a 4 semanas (ABCD, 2006). Durante este período, a imunização ativa não é recomendada uma vez que estes anticorpos neutralizariam o vírus vacinal (Newbury, 2007). A repetição do tratamento com um intervalo superior a 1 semana não é recomendada pois o animal pode desenvolver um choque anafilático (ABCD, 2006).
9.7. Nutrição
Até há bem pouco tempo, a retirada da água e da comida (nada Per Os – NPO) durante 24 a 48 horas ou até o vómito estar controlado seguindo-se a reintrodução de pequenas quantidades de uma dieta facilmente digestível, 4 a 6 vezes por dia, durante 3 a 7 dias, fazia parte do consenso geral relativamente ao tratamento de uma doença que provocasse alterações gastrointestinais, incluindo a Panleucopenia Felina (Mazzaferro, 2011). A utilização NPO baseava-se na teoria do “descanso” do intestino pela redução da quantidade de nutrientes que não eram absorvidos e que poderiam contribuir para a manutenção de uma diarreia osmótica, diminuindo o substrato disponível para a flora bacteriana intestinal e reduzindo os estímulos antigénicos, uma vez que a integridade da mucosa poderia estar comprometida.
O procedimento feeding through significa alimentar o animal durante a diarreia, oralmente com comida sólida ou com uma dieta liquida através de um tubo enteral, sendo utilizado também na Medicina Humana (Armstrong, 2006). Têm sido conduzidos estudos que desafiam o procedimento NPO versus feeding through com resultados positivos para esta segunda metodologia. Mesmo quando não existe enterite, o jejum de um único dia, em ratos provoca uma diminuição significativa na altura das vilosidades e/ou criptas no jejuno, íleo e, em menor extensão, no cólon (Ziegler et al., 2003). Adicionalmente, o jejum está associado a alterações prejudiciais nas células da mucosa do intestino devido à reduzida concentração de glutationa, o maior antioxidante intracelular, provocando um aumento da permeabilidade a macromoléculas, translocação bacteriana do lúmen intestinal e aumento da taxa de apoptose dos enterócitos. Mesmo com Nutrição Parenteral Total (NPT) após 14 dias de jejum em gatos, observou-se atrofia das vilosidades do intestino delgado, fusão e infiltração da lâmina própria com linfócitos, plasmócitos e neutrófilos (Lippert et al., 1989), além de uma severa atrofia do tecido linfoide associado ao intestino (Armstrong, 2006). O jejum também reduz significativamente a atividade e expressão de determinadas enzimas digestivas na mucosa do intestino delgado como as