OCORRÊNCIA DE SCCmec TIPO IV DE Staphylococcus aureus EM INFECÇÕES COMUNITÁRIAS E HOSPITALARES EM UM HOSPITAL UNIVERSITÁRIO DE
MINAS GERAIS
KARINNE SPIRANDELLI CARVALHO NAVES
UBERLÂNDIA - MG ABRIL/2011
UNIVERSIDADE FEDERAL DE UBERLANDIA
INSTITUTO DE CIÊNCIAS BIOMÉDICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM IMUNOLOGIA E PARASITOLOGIA APLICADAS
OCORRÊNCIA DE SCCmec TIPO IV DE Staphylococcus aureus EM INFECÇÕES COMUNITÁRIAS E HOSPITALARES EM UM HOSPITAL UNIVERSITÁRIO DE
MINAS GERAIS
Karinne Spirandelli Carvalho Naves Prof º Dr. Paulo P. Gontijo Filho (Orientador) Profª Drª Elsa Massae Mamizuka (Co-orientadora)
KARINNE SPIRANDELLI CARVALHO NAVES
UNIVERSIDADE FEDERAL DE UBERLANDIA
INSTITUTO DE CIÊNCIAS BIOMÉDICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM IMUNOLOGIA E PARASITOLOGIA APLICADAS
CURSO DE DOUTORADO
Aos meus amores, Winkler e Ana Clara,
que alegram minha vida e fazem
"A vida é o campo experimental onde têm lugar as lutas e onde cada um
vence ou é derrotado; mas é, também, o cenário onde o espírito se
tempera verdadeiramente e onde, pouco a pouco, com vontade e
entusiasmo grandes, vai se lavrando um novo e elevado destino".
AGRADECIMENTOS
Agradeço a Deus pela oportunidade de mais uma vitória;
Aos meus pais, avós e irmãos pela confiança, paciência, carinho, apoio e dedicação;
À minha família, Winkler, Ana Clara, Yan e Yago pelo amor, apoio, compreensão e carinho;
À minha sogra Ana Rosa pela colaboração e cuidados, comigo e com minha família;
Ao meu Orientador Prof. Dr. Paulo P. Gontijo Filho que generosamente me deu esta oportunidade e, com paciência e confiança me ajudou a concluir este trabalho;
À minha Co-orientadora Profª Drª Elsa Massae Mamizuka pela enorme colaboração e também pelo carinho com que me recebeu;
Às estudantes Lara Almeida e Tayná Guimarães do laboratório de análises clínicas e toxicológicas da USP pelas contribuições prestadas;
À Profª Drª Eloísa Amália Vieira Ferro, coordenadora da pós-graduação, pelas colaborações e orientações;
Ao amigo Prof. Dr. Geraldo Batista de Melo pela amizade e ensinamentos; À amiga Maria Christina Mouta Rink que continua sendo um grande exemplo; Às professoras Rosineide e Denise pelo apoio e pela colaboração;
Aos técnicos do laboratório, Claudete e Ricardo, pela colaboração sempre certa, pela amizade e paciência;
Às amigas Renata e Lizandra pelos momentos felizes e incentivos; À amiga Natália pela rica colaboração prestada a este trabalho;
Aos colegas pós-graduação e laboratório Juliana, Cristiane, Lilian, Nayara, Marcília, Ana Paula, Dayane, Raquel, Monique, Deivid, Michel e Elias pelo companheirismo;
À Lucileide, Lucélia e Jorge pela colaboração e amizade;
Aos amigos José Renato, André, Rodrigo, Marcelo, João Henrique, Tony, Juliana Bisinotto, Juliana Jacob, Mirna, Fúlvia, Marília, Zelma, Juliana Faquim, Geiza, Denielle, Celi, Valdirene, Frederico, Natália e Roberta;
ÍNDICE
Lista de Abreviaturas Lista de Tabelas Lista de Figuras Lista de Anexos Resumo
Abstract
1 - INTRODUÇÃO 2 - OBJETIVOS
3 - MATERIAL E MÉTODOS 3.1 Hospital
3.2 Modelo do estudo 3.3 Vigilância 3.4 Definições
3.5 Técnicas microbiológicas 3.5.1 Coleta
3.5.2 Cultivo Primário
3.5.3 Sensibilidade “in vitro” aos antimicrobianos 3.6 Testes moleculares
3.7 Análise estatística
3.8 Aprovação pelo Comitê de Ética 4 - RESULTADOS
5 - DISCUSSÃO 6 - CONCLUSÕES
LISTA DE ABREVIATURAS E SÍMBOLOS MRSA – Staphylococcus aureus resistente à meticilina
MR-MRSA – MRSA multirresistente
Não MR-MRSA – MRSA não-multirresistente
CA-MRSA – Staphylococcus aureus resistentes à meticilina de aquisição comunitária HA-MRSA – Staphylococcus aureus resistente à meticilina de aquisição hospitalar
MSSA - Staphylococcus aureus sensível à meticilina IH – Infecções Hospitalares
NNISS – National Nosocomial Infection Surveillance Sistem NCCLS – National Committee for Clinical Laboratory Standards IrAS – Infecção relacionada à assistência à de saúde
HC-UFU - Hospital de Clínicas da Universidade Federal de Uberlândia ISC - Infecção de Sítio Cirúrgico
ICS - Infecção de Corrente Sangüínea
PAV – Pneumonia associada à prótese ventilatória DPOC – Doença pulmonar obstrutiva crônica UTI - Unidade de Terapia Intensiva
PBPs - Proteínas Ligadoras de Penicilina
UFC/ ml - Unidade Formadora de Colônia por mL PCR – Polimerase Chain Reaction
PFGE – Pulsed Fiel Gel Electrophoresis
MLST – Multilocus Sequence Typing
PVL – Leucocidina Panton-Valentine
CDC – Center for Disease Control and Prevention NNIS – National Nosocomial Infection Surveilance
EMRSA – epidemic methicillin-resistant Staphylococcus aureus ≤ – Menor ou igual
– maior ou igual
µg/ml – micrograma por mililitro
ÍNDICE DE TABELAS
Página Tabela 1. Infecções por Staphylococcus aureus susceptíveis ou resistentes à
meticilina em pacientes internados no HC-UFU, de setembro de 2006 a setembro de 2008.
37
Tabela 2. Sítios de infecção / infecções por amostras de MRSA em pacientes internados no HC da UFU, de setembro de 2006 a setembro de 2008.
37
Tabela 3. Classificação das infecções por Staphylococcus aureus em pacientes internados no HC-UFU, quanto à origem e evolução clínica dos pacientes, no período de setembro de 2006 a setembro de 2008.
38
Tabela 4. Fatores de risco relacionados aos pacientes com infecção por Staphylococcus aureus no HC-UFU, no período de setembro de 2006 a setembro de 2008.
39
Tabela 5. Fatores de risco extrínsecos para infecção por Staphylococcus aureus diagnosticados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
40
Tabela 6. Análise multivariada dos fatores de risco para infecção por microrganismos multirresistentes diagnosticados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
41
Tabela 7. Susceptibilidade aos agentes antimicrobianos de amostras de MR-MRSA e não-MR isolados de pacientes internados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
42
Tabela 8. Características das amostras de Staphylococcus aureus SCCmec tipo IV isolados no HC-UFU, de setembro de 2006 a setembro de 2008.
43
Tabela 9. Fatores de risco relacionados aos pacientes com infecção por Staphylococcus aureus SCCmec tipo IV isolados no laboratório de microbiologia do HC-UFU, no período de setembro de 2006 a setembro de 2008.
44
Tabela 10. Fatores de risco extrínsecos para infecção por amostras de Staphylococcus aureus SCCmec tipo IV isoladas no período de setembro de 2006 a setembro de 2008.
44
Tabela 11. Fatores de risco intrínsecos relacionados aos pacientes com infecção por MRSA e MRSA SCCmec IV no HC-UFU, no período de setembro de 2006 a setembro de 2008.
45
Tabela 12. Fatores de risco extrínsecos para infecção por MRSA e MRSA SCCmec IV diagnosticados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
47
Tabela 13. Análise multivariada dos fatores de risco para infecção por MRSA SCCmecIV e MRSA diagnosticados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
ÍNDICE DE FIGURAS
Página Figura 1. eBURST analysis of S. aureus. Data from the MLST website
(http://www.mlst.net/) and eBURST software (http://eburst.mlst.net/), 23 December 2009. Major CC and ST types are indicated. (Yamamoto et al., 2010)
20
Figura 2: Global distribution of predominant successful clones of community-associated meticillin-resistant Staphylococcus aureus. PVL+=Panton-Valentine leukocidin positive. PVL–=PVL negative. SWP=southwest Pacifi c. WA=western Australia. (Otter & French,2010)
23
Figura 3. Genótipos do PFGE das oito amostras não MR-MRSA, SCCmecIV, isoladas de pacientes do hospital de clínicas da UFU.
LISTA DE ANEXOS
Página Anexo I. Aprovação do Comitê de Ética da Universidade Federal de
Uberlândia
81
Anexo II. Termo de Consentimento Livre e Esclarecido 82
Anexo III. Ficha sócio-demográfica 83
Resumo
Desde o primeiro relato de MRSA (―Methicillin resistant Staphylococcus aureus‖), este microrganismo se disseminou nos hospitais em diferentes regiões do mundo e, atualmente, é considerado como o principal agente de infecções hospitalares causando infecções benignas, como as de pele e tecido mole, e graves, como pneumonia e sepse. A partir da década de 80, amostras de MRSA / CA-MRSA
(―Community-acquired-Methicillin-resistant Staphylococcus aureus‖) foram isoladas a partir infecções comunitárias em indivíduos sem a presença de fatores de risco. Na última década houve um aumento na participação destas amostras em infecções de natureza hospitalar, sobretudo nos EUA. Este estudo teve como objetivo investigar a ocorrência de amostras de CA-MRSA e HA-MRSA
(―Hospital-acquired-Methicillin-resistant Staphylococcus aureus‖) associadas a infecções comunitárias e hospitalares considerando aspectos epidemiológicos clássicos e moleculares no Hospital de Clínicas da Universidade Federal de Uberlândia (HC-UFU), no período de Setembro de 2006 a Setembro de 2008. As culturas de S. aureus foram obtidas no laboratório de microbiologia clínica do HC-UFU e, aquelas classificadas como não-multirresistentes foram submetidas aos testes genotípicos (―Polimerase Chain Reaction‖, ―Pulsed Field Gel Electrophoresis‖ e ―Multilocus Sequence Typing‖). No total, foram selecionadas 206 amostras de MRSA, com apenas 45 (21,8%) não-multirresistentes. Após a realização dos testes genotípicos oito amostras foram identificadas como SCCmec
3,8%) à relatada nos Estados Unidos, com predomínio de um clone (CC5/ST5, PVL-) de HA-MRSA isolado de pacientes com diversos tipos de infecções hospitalares e fatores de risco. Em apenas uma criança foi recuperada uma amostra do tipo SCCmecIV de origem comunitária correspondente a um episódio de otite, também caracterizado como do clone ST5.
As amostras SCCmecIV mostraram resistogramas distintos e 100% de susceptibilidade ao sulfametoxazol-trimetoprim. Foram fatores de risco independentes relacionados às infecções pelo microrganismo multirresistente evolução para óbito e relacionada a infecção pela amostra não-multirresistente infecção de pele e tecido mole e internação em unidades pediátricas. A mortalidade hospitalar no prazo de 30 dias foi de 47,8% de entre MRSA multirresistentes e 26,6% entre amostras não-multirresistentes. Não houve óbitos entre os pacientes infectados por MRSA SCCmecIV. A vigilância epidemiológica das diversas linhagens / clones de MRSA, hospitalares ou comunitárias, por sua importância médica e hospitalar, deve ser motivo de investigação preocupação pelos serviços de saúde pública.
Summary
Since the first MRSA(Methicillin resistant Staphylococcus aureus) report, this pathogen has spread in hospitals in different regions of the world and is currently regarded as the major nosocomial infections agent, causing benign infections, such as skin and soft tissue and serious, like pneumonia and sepsis. In early 80’s MRSA samples were
resistant organism infections and skin / soft tissue infection or hospitalization in pediatric units to non-multiresistant infection, were independent risk factors. Hospital mortality was 47.8% among multidrug-resistant MRSA and 26.6% among non-multidrug-resistant samples. There were no deaths among patients infected with MRSA SCCmecIV. Epidemiological studies of different MRSA strains, in hospital or community, for the medical and hospital relevance, should be cause for public health
services concern and additional investigations.
1-
Introdução
As infecções associadas à assistência à saúde (IrAS) representam um sério problema de saúde pública tanto em países em desenvolvimento quanto em países desenvolvidos causando aumento significativo na morbidade, mortalidade e custos hospitalares (BOYCE, 2001). Nos Estados Unidos da América (EUA), 5,0 a 10,0% dos pacientes adquirem infecção hospitalar, resultando em aproximadamente 80.000 mortes e um custo financeiro adicional de US$ 4 bilhões por ano (YALCIN, 2003).
Staphylococcus aureus está associado com vários tipos de infecções destacando-se as de pele e tecidos moles como impetigo bolhoso, abscesso e furunculodestacando-se. Adicionalmente, causa infecções sistêmicas e potencialmente fatais como bacteremias, endocardites e pneumonias, além de doenças associadas às toxinas estafilocócicas como intoxicação alimentar e síndrome do choque tóxico (SAFDAR & BRADLEY, 2008, DURUPT et al., 2007).
Staphylococcus aureus é um dos principais agentes associados às IrAS (EYKYN, GRANSDEN & PHILLIPS, 1990) predominando as de sítio cirúrgico (ISC), e está relacionado entre os três principais agentes de pneumonias (18,8%) e infecções de corrente sanguínea (12,6%), sendo estas últimas em pacientes internados em Unidades de Terapia Intensiva (UTIs) (CDC, 2006). Dados do ―Sentry‖ no Brasil
revelam que ele é o patógeno mais frequentemente associado a infecções de corrente sanguínea, pele e tecido mole e pneumonias em pacientes hospitalizados, especialmente em unidades de terapia intensiva (GALES et al., 2009).
Desde o primeiro relato de Staphylococcus aureus resistente à meticilina
infecções estafilocócicas devido ao fenótipo resistente supera o atribuído à amostra susceptível à meticilina / oxacilina (SHUKLA et al., 2004). MRSA é considerado como o principal agente de IrAS (DEURENBERG & STOBBERINGH, 2008). Atualmente,
na casuística NNIS (―National Nosocomial Infection Surveilance‖), ele responde por
62,0% das infecções de sítio cirúrgico (ISC), 60,0% das pneumonias (WUNDERINK et al., 2003) e 20,0 % das infecções de corrente sanguínea (TENOVER, BIDDLE & LANCASTER, 2001), causadas por S. aureus. No Hospital de Clínicas da Universidade Federal de Uberlândia as freqüências de estafilococcias e bacteremias hospitalares por este fenótipo foram de 44,0% (SADOYAMA & GONTIJO FILHO, 2000) e 39,2%, respectivamente (RIBAS, MELO & GONTIJO FILHO, 2003).
O mecanismo de resistência à meticilina nas amostras de MRSA / ORSA ocorre
pela presença de uma proteína ligadora de penicilina (―Penicillin Binding Protein‖ -
PBP) de baixa afinidade para esse antibiótico, PBP2’ ou PBP2a na membrana
plasmática, codificada pelo gene cromossômico mecA (CHAMBERS, 2001; ROBINSON & ENRIGHT, 2004; OTTER & FRENCH, 2010). Este gene, que é
carreado por um elemento genético móvel (―staphylococcal cassete chomossome mec‖ - SCCmec) (ROBINSON & ENRIGHT, 2003), e confere resistência a todas as penicilinas, cefalosporinas e carbapenêmicos (HANSSEN & SOLLID, 2005), e está usualmente associado a genes de resistência a outras classes de antimicrobianos incluindo macrolídeos, fluorquinolonas, clindamicina e rifampicina, entre outros, resultando em multirresistência das amostras (BOYCE et al.,1994; DEURENBERG & STOBBERINGH, 2008).
Estudos experimentais demonstram que as amostras sensíveis (―methicillin -sensitive Staphylococcus aureus - MSSA) não diferem das resistentes (MRSA) quanto à destruição por fagócitos, produção de hemolisinas, enzimas e toxinas e letalidade em modelos animais (YOON et al., 2005). A maior parte dos estudos caso-controle não apresentam diferenças quanto à morbi-mortalidade quando pacientes com infecções por MRSA são comparados àqueles com infecções por MSSA. Entretanto, há relatos que sugerem maior virulência de MRSA (HARTSTEIN, SEBASTIAN & STRAUSBAUGH, 2004). Um estudo recente sustenta que infecções de corrente sanguínea causadas por MRSA estão associadas a uma taxa de mortalidade maior que aquelas por MSSA (HURLEY, 2002).
MRSA é primariamente um patógeno hospitalar e está usualmente presente em centros terciários e de grande porte (YAMAMOTO et al., 2010). Entretanto, também pode colonizar pacientes idosos internados em ―Nursing Homes‖, de forma que, os
pacientes cuidados nestas instituições representam reservatórios potenciais deste microrganismo (KAUFFMAN, BRADLEY & TERPENNING, 1990). Algumas amostras de MRSA apresentam maior habilidade de disseminação hospitalar e eventualmente comunitária. São denominadas Staphylococcus aureus resistentes à
meticilina epidêmicos (―epidemic methicillin-resistant Staphylococcus aureus‖ – EMRSA) e relatadas principalmente no Reino Unido (COOKSON & PHILLIPS, 1988).
prévia a antimicrobianos (FRENCH, 2004; DEURENBERG & STOBERINGH, 2009). Apesar das políticas de controle e prevenção empregadas para evitar a sua disseminação, este patógeno permanece endêmico na maioria dos hospitais (FRENCH, 2004).
Figura 1. eBURST analysis of S. aureus. Data from the MLST website (http://www.mlst.net/) and eBURST software (http://eburst.mlst.net/), 23 December 2009.
Major CC and ST types are indicated. (Yamamoto et al., 2010)
Entre os principais sistemas de tipagem de MRSA baseados em características
SILVA COIMBRA et al., 2003), caracterizados pela multirresistência a diferentes classes de antibióticos e acometem pacientes com fatores de risco descritos anteriormente. Os clones de MRSA mais freqüentes associados aos serviços de assistência à saúde estão, atualmente, agrupados em cinco complexos clonais: CC5, CC8, CC22, CC30 e CC45, relacionados na figura 1.
A partir da década de 80 amostras de MRSA foram isoladas de aborígenes australianos e crianças da comunidade, sem a presença de fatores de risco clássicos para aquisição de infecções por MRSA (CHAMBERS & DE LEO, 2009; YAMAMOTO, 2010) e, atualmente, de outros grupos populacionais sem histórico de internação no último ano, bem como, de forma crescente, em pacientes hospitalizados (TENOVER et al., 2006; REDZINIAK et al., 2009), com evidência de aquisição do microrganismo na
comunidade (―community-acquired methicillin-resistant Staphylococcus aureus‖ - CA-MRSA). Estas amostras são classificadas na sua maioria como SCCmec tipos IV e V (YAMAMOTO et al., 2010; SKOV & JENSEN, 2009).
Recentemente, foram propostos alguns fatores de risco para infecções por CA-MRSA: história de colonização / infecção por CA-MRSA, contato íntimo com pessoa colonizada / infectada por CA-MRSA, praticantes de esportes que envolvem contato físico, usuários de drogas injetáveis, presidiários, militares e homossexuais masculinos (REDZINIAKet al., 2009). Estes grupos têm em comum, de acordo com definições do
CDC (―US Centers for Disease Control and Prevention’s‖), os 6 ―Cs‖para transmissão:
contato cutâneo com superfícies contaminadas (―Contact‖), limpeza / higiene precária
(―Cleanliness‖), pele comprometida (―Compromised skin integrity‖), itens
compartilhados (―Contaminated objects‖) e aglomeração (―Crowded living conditions‖),
diferenciada para colonizar e infectar indivíduos saudáveis na comunidade. São ainda, amostras não relacionadas aos clones internacionais de HA-MRSA uma vez que exibem sensibilidade a algumas drogas antimicrobianas (VANDENESCH et al., 2003).
O fenótipo CA-MRSA abriga o gene SCCmec tipo IV, que confere resistência apenas a -lactâmicos e heterorresistência à meticilina e, freqüentemente, os genes lukS-lukF que codificam a leucocidina (―Panton-Valentine leucocidin‖ - PVL). As diferenças entre estas linhagens de MRSA e a hospitalar incluem características como
crescimento mais rápido ―in vitro” e características adicionais de virulência como a produção de PVL, elementos móveis do catabólito da arginina (OKUMA et al., 2002) e modulinas solúveis em fenol ainda não demonstradas no HA-MRSA (DUFOUR et al., 2002). CA-MRSA usualmente apresenta valores baixos de MIC para oxacilina (≤32
µg/ml) e imipenem (~1µg/ml) que podem ser utilizados como marcadores (TAKANO & HIGUCHI, 2009) e sensibilidade a vários antimicrobianos como: sufametoxazol-trimetoprim, fluorquinolonas, clindamicina e gentamicina (POPOVICH et al., 2007) que podem ser combinados para fornecer informações importantes no estudo epidemiológico de CA-MRSA (POPOVICH, WEINSTEIN & HOTA, 2008).
As formas clínicas relacionadas às infecções por CA-MRSA envolvem doenças de pele e tecido mole (GILLET et al., 2002; VAN DER FLIER et al., 2003) incluindo infecções piogênicas de pele (NAIMI et al., 2003). CA-MRSA pode também causar infecções de sítio cirúrgico, infecções de trato urinário, infecções oculares, meningite e sinusites (YAMAMOTO et al., 2010) bem como infecções graves como pneumonia necrosante e sepse (TRINDADE et al., 2005).
al., 2005; MIRANDA et al., 2007; SCHUENCK et al., 2009). A identificação de CA-MRSA, na comunidade ou no ambiente hospitalar, deve ser realizada a partir de dados epidemiológicos, perfil de susceptibilidade aos antimicrobianos e caracterização genotípica, utilizando as técnicas: tipagem do SCCmec, identificação dos genes codificadores de PVL e proteína A (―spa type‖) e além da determinação da
clonalidade por PFGE e MLST (DIEP et al., 2006; YAMAMOTO et al., 2010).
As características moleculares e a epidemiologia dos principais clones de CA-MRSA têm sido amplamente estudadas e incluem os STs: ST8-IV, PVL+ (USA300) e ST1-IV, PVL+ (USA400) nos Estados Unidos e Canadá (YAMAMOTO et al., 2010); ST80-IV, PVL+ na Europa; ST59-VII, PVL+ e ST30-IV, PVL+ (OSPC) na Ásia e ST1-IV, PVL- (WA-1), ST129-IV, PVL- (WA-2), ST93-IV, PVL+ (Queensland) e ST30-IV, PVL+ (OSPC) na Oceania (Austrália), mostrados na figura
2 (OTTER & FRENCH, 2010).
leukocidin positive. PVL–=PVL negative. SWP=southwest Pacifi c. WA=western Australia. (Otter & French,2010)
2- Objetivos
2.1- Objetivo Geral
Investigar a ocorrência de CA-MRSA e / ou HA-MRSA associados a infecções
comunitárias e hospitalares no Hospital de Clínicas da Universidade Federal de Uberlândia (HC-UFU), no período de Setembro de 2006 a Setembro de 2008.
2.2- Objetivos Específicos
Analisar a participação de CA-MRSA e / ou HA-MRSA nas infecções de pele e
tecidos moles incluindo aquelas de sítio cirúrgico (infecções incisionais), pneumonias, pneumonias associadas à ventilação mecânica (PAVs) e sangue;
Descrever a natureza hospitalar ou comunitária das infecções associadas aos dois fenótipos.
Identificar fatores de risco que possam estar associados às infecções pelos dois fenótipos.
Avaliar antimicrobianos como marcadores fenotípicos para identificação presuntiva de amostras de CA-MRSA.
Definir perfis genotípicos das amostras de CA-MRSA através da técnica de tipagem por Eletroforese em Campo Pulsátil (PFGE);
Definir perfis genotípicos das amostras de CA-MRSA através da técnica de tipagem
por ―Multilocus Sequence Typing‖ (MLST);
3- Material e métodos
3.1- Hospital
O estudo foi realizado no Hospital de Clínicas da Universidade Federal de Uberlândia (HC-UFU), que possui 570 leitos e oferece atendimento de nível terciário, após aprovação no comitê de ética (Parecer 218/06) (Anexo I).
3.2- Modelo de Estudo
Foi realizada uma investigação da ocorrência de CA-MRSA e HA-MRSA em amostras de infecções de pele, tecidos moles incluindo pus, de pacientes com infecção de sítio cirúrgico e corrente sanguínea; de pacientes internados ou atendidos no ambulatório do hospital que apresentaram diagnóstico de infecção por S. aureus. Estes fenótipos foram também pesquisados a partir do aspirado endotraqueal de pacientes com pneumonia associada a prótese ventilatória (PAV) internados na UTI de adultos com resultado positivo de infecção por Staphylococcus aureus. As amostras foram coletadas no período de Setembro de 2006 a Setembro de 2008.
Os responsáveis pelos pacientes internados na UTI assinaram um termo de consentimento livre e esclarecido (Anexo II) autorizando a coleta do aspirado endotraqueal.
3.3- Vigilância
Uma ficha clínica e epidemiológica contendo o perfil demográfico e fatores de risco (intrínsecos e extrínsecos) relacionados aos pacientes (Anexo III) foi preenchida para todas as amostras obtidas a partir do laboratório de microbiologia e para as coletas realizadas na UTI. As informações para o preenchimento das fichas foram obtidas no Setor de Prontuários do HC-UFU.
3.4- Definições
CA-MRSA: MRSA de origem comunitária isolado de infecções em pacientes sem fatores de risco clássicos, com perfil de susceptibilidade aos antimicrobianos considerados como marcadores fenotípicos e carreando SCCmecIV ou V (MILLAR et al., 2007).
HA-MRSA: MRSA isolado a partir de infecções em pacientes com pelo menos um fator de risco, usualmente multirresistente e carreando SCCmecI, II, III ou IV (MILLAR et al., 2007; OTTER e FRENCH, 2010).
Infecção Hospitalar: é definida pelo ―Center for Disease Control and Prevention‖
(CDC) como toda infecção adquirida 72 horas após a admissão do paciente no hospital ou após 48 horas, quando da presença de cateter vascular central ou prótese ventilatória, e que se manifeste durante o tempo de internação ou após a alta, quando esta puder ser relacionada com a internação ou com os procedimentos hospitalares (HORAN, ANDRUS & DUDECK et al., 2008).
Infecção comunitária: é definida pelo CDC (―Center for Disease Control and
Prevention‖) como toda infecção diagnosticada microbiologicamente nas primeiras
Pneumonia associada a ventilação mecânica: toda pneumonia diagnosticada através de critérios clínicos, radiológicos, laboratoriais e microbiológicos, sendo este, por meio de cultura quantitativa de aspirado endotraqueal com contagem 106 UFC/mL (HUNTER, 2006).
Bacteremia / Sepse primária: definida pela presença de pelo menos um dos sinais e sintomas relacionados: febre, hipotensão, oligúria, quando de cultura de sangue positiva, sem outros focos reconhecidos. (HORAN, ANDRUS, DUDECK et al., 2008).
Bacteremia / Sepse secundária: Definida como a sepse que ocorre na presença de um sítio anatômico extra-vascular infectado (EGGIMANN & PITTET, 2002).
Infecção de pele e tecidos moles: lesões com drenagem purulenta, febre, dor e rubor no local; a cultura da secreção, quando do isolamento de microrganismos deve ser em cultura pura, ou isolamento de microrganismo no sangue (MAYHALL, 2004).
Infecção de sítio cirúrgico incisional superficial: infecções diagnosticadas no período de 30 dias após a cirurgia desde que a infecção esteja localizada apenas em pele ou tecido subcutâneo no local da incisão, apresentando drenagem purulenta e com características clínicas de febre, rubor e edema (MANGRAM et al., 1999).
3.5- Técnicas microbiológicas 3.5.1- Coleta
As amostras de aspirado endotraqueal foram coletadas em frascos estéreis e transportadas ao laboratório de ensino da UFU sendo submetidas a diluições decimais em tubos contendo salina estéril.
3.5.2- Cultivo primário
As amostras de S. aureus obtidas a partir do laboratório do HC-UFU foram estocadas em tubos contendo caldo ―Brain Heart Infusion‖ (BHI) e glicerol (10,0%) e congeladas a -20ºC para posterior estudo.
As amostras clínicas de secreção traqueal e suas respectivas diluições (1:1000 e
1:10.000) foram inoculadas em Ágar BHI (―Brain Heart Infusion‖) e incubadas a 37 º C
por 24-48 horas e, as placas contendo colônias com contagens 106 UFC/mL foram,
novamente, subcultivadas em Ágar TSA (―Triptic Soy Agar) e após crescimento as
colônias sugestivas de Staphylococcus foram submetidas aos testes fenotípicos para identificação realizada pelas características morfo-tintoriais (coloração de Gram), fermentação do manitol, e teste de coagulase ligada, e estocadas como descrito no parágrafo anterior.
3.5.3- Sensibilidade “in vitro” aos antimicrobianos
Teste de triagem em ágar incorporado de oxacilina e NaCl
Foram utilizadas placas de ágar Mueller-Hinton contendo 6 g de oxacilina por
mL e 4,0% de NaCl onde foram cultivadas as amostras de S. aureus para a identificação daquelas resistentes à oxacilina, de acordo com as indicações do
―Clinical Laboratory Standards Institute‖ – CLSI (2008). Os inóculos foram
preparados por subcultivo em caldo Mueller-Hinton e os ―spots‖, correspondendo a
utilizados foram Staphylococcus aureus ATCC29213, como amostra sensível e Staphylococcus aureus ATCC43300, como amostra resistente.
Teste de difusão em ágar – segundo a técnica do Clinical Laboratory Standards Institute (CLSI, 2008).
As amostras foram subcultivadas em ―Tryptic Soy Agar‖ (TSA) e incubadas a
37 º C por 24 – 48 horas. Três ou quatro colônias representativas foram semeadas em
caldo ―Tryptic Soy Broth‖ (TSB) e novamente incubadas a 37 º C até a turvação
correspondente ao tubo 0,5 da escala MacFarland (1 – 2 x 108 UFC/mL) e semeadas
com o auxílio de ―swab‖ estéril na superfície do ágar Mueller-Hinton. Os discos de antimicrobianos foram posicionados e as placas incubadas a 35ºC por 24 horas. A sensibilidade foi testada para: oxacilina (1g), clindamicina (2 g), levofloxacina (5
g), eritromicina (15 g), tetraciclina (30 g), gentamicina (10 g), rifampicina (5
g), sulfametoxazol/trimetoprim (25g), e vancomicina (30g). Foi usada como
controle a cepa de Staphylococcus aureus ATCC® 25923.
Foram considerados como não-multirresistentes (não-MR-MRSA) as amostras sceptíveis a mais de três classes de antimicrobianos, particularmente, aqueles considerados como marcadores fenotípicos do microrganismo comunitário: sulfametoxazol-trimetoprim, gentamicina, tetraciclina, clindamicina e levofloxacina.
Determinação da Concentração Inibitória Mínima – segundo a técnica do Clinical Laboratory Standards Institute (CLSI, 2008)
As amostras de S. aureus resistentes à oxacilina e sensíveis a mais de três
antimicrobianos foram selecionadas e subcultivadas em ―Tryptic Soy Agar‖ (TSA) e,
semeadas na superfície do ágar com o auxílio de swabs estéreis e as fitas de E-teste, posicionadas na superfície do ágar. As placas foram incubadas a 35 º C por 24 horas e, após este período realizada a leitura do teste. Os controles utilizados foram Staphylococcus aureus ATCC 29213, como amostra sensível e Staphylococcus aureus ATCC 43300, como amostra resistente.
3.6- Técnicas moleculares
Os testes moleculares foram realizados no Laboratório de Análises Clínicas e Toxicológicas da Faculdade de Ciências Farmacêuticas da USP, sob orientação da Profª Drª Elsa Massae Mamizuka.
3.6.1- Reação em cadeia da polimerase (PCR) para detecção da presença dos genes mecA, regulatórios (mecI / mecR1), IS1272 e ccr pertencentes ao SCCmec
Extração do DNA bacteriano
A extração foi ser realizada por lise térmica após o subcultivo em tubo com 5
mL de caldo TSB (―Tryptic Soy Broth‖). Uma alíquota de 1 mL de suspensão resultante foi submetida a centrifugação por 4 minutos a 2500 x g, e o sobrenadante descartado; o sedimento lavado três vezes em 1 mL de tampão TE (Tris 10 mM, EDTA 1 mM, pH 7,8) e ressuspenso em 100 L deste mesmo tampão. A suspensão
resultante foi mantida à temperatura de 100ºC por 10 minutos e em seguida centrifugada por 30 segundos a 9000 x g a 4 ºC. O sobrenadante foi coletado e utilizado nas reações de PCR.
Reações de PCR
descrito por Okuma et al. (2002), com a utilização dos ―primers‖ descritos na Tabela 1.
Tabela 1. ―Primers‖ utilizados nas reações de PCR
Estrutura Iniciador ―Primer‖ Tamanho
Fragmento
mecA mA1
mA2
5´- TGC TAT CCA CCC TCA AAC AGG – 3´ 5´- AAC GTT GTA ACC ACC CCA AGA – 3´
200 bp
mecI / mecR1
mI4 McR5
5´- CAA GTG AAT TGA AAC CGC CT – 3´ 5´- CAG GGA ATG AAA ATT ATT GGA – 3´
180 bp 320 bp ccr Bc (B2)
a1 (a2) a2 (a3) a3 (a4)
5´- ATT GCC TTG ATA ATA GCC TCT – 3´ 5´- AAC CTA TAT CAT CAA TCA GTA CGT – 3´ 5´- TAA AGG CAT CAA TGC ACA AAC ACT – 3´
5´- AGC TCA AAA GCA AGC AAT AGA AT – 3´
560 bp 700 bp 1 kbp 1,6 kbp IS1272 IS5
MA6
5´- AAC GCC ACT CAT AAC ATA TGG AA – 3´ 5´- TAT ACC AAA CCC GAC AAC – 3´
2 kbp
Os tubos contendo 50 L desta solução foram adicionados de 50 L do DNA extraído por lise térmica e processados em um termociclador (Gene Amp PCR
System 2400– Applied Biosystems) como descrito a seguir: pré-desnaturação a 94º C por 5 minutos, 30 ciclos de amplificação, cada um consistindo de 95º C por 30 segundos, 50º C por 1 minuto e 72º C por 2 minutos.A reação foi concluída com um ciclo de 5 minutos a 72º C. Posteriormente, 10L deste material foi aplicado em gel
de agarose (AcaKem LE 2,0%) e visualizado após coloração do gel com brometo de etídio sob luz ultravioleta (UV).
A tabela 2 mostra os ―primers‖ utilizados nas reações para identificação dos
genes que codificam a produção de leucocidina Panton-Valentine e Hemolisina A.
Para amplificação das estruturas gênicas foi utilizado o protocolo descrito por Okuma et al. (2002): um volume de 20 µL de uma mistura para reação contendo 2 µL de DNA, 0,5 U de Taq polimerase, 200µM de cada dNTP; 1,5mM de MgCl2; 75mM Tris-HCl pH 9,0; 20 mM (NH4)2SO4; 0,01%Tween 20; 250 nM de cada um dos iniciadores. As reações forma amplificadas no temociclador (Gene Amp PCR
System 2400– Applied Biosystems) como descrito a seguir: pré-desnaturação a 94º C por 5 minutos, 30 ciclos de amplificação, cada um consistindo de 95º C por 30 segundos, 55º C por 1 minuto e 72º C por 2 minutos.A reação foi concluída com um ciclo de 5 minutos a 72º C. Posteriormente, 10L deste material foi aplicado em gel
de agarose (AcaKem LE 2,0%) e visualizado após coloração do gel com brometo de etídio sob luz ultravioleta (UV).
Tabela 2. ―Primers‖ utilizados nas reações de PCR (REINERT, 2006)
Toxina Iniciador Sequência (5’ –3’) Cepa
Padrão Leucocidina
Panton Valentine
PVL1 PVL2
ATC ATT AGG TAA AAT GTC TGG ACA TGA TCC A
GCA TCA AAT GTA TTG GAT AGC AAA AGC
MR 108
Leucocidina Panton Valentine
LUKDE1 LUKDE2
TGA AAA AGG TTC AAA GTT GAT ACG AG
TGT ATT CGA TAG CAA AAG CAG TGC A
N315
Hemolisina A HLA1 HLA2
CTG ATT ACT ATC CAA GAA ATT CGA TTG
CTT TCC AGC CTA CTT TTT TAT CAG T
N315
3.6.2- Tipagem molecular pela técnica de Eletroforese em campo pulsátil - PFGE
em ágar sangue por 24 horas e, após este período algumas colônias foram repicadas em 5 mL de caldo BHI e incubadas a 37o C durante 24 horas com agitação constante, de modo a atingirem sua fase exponencial de crescimento. Uma alíquota de 1,5 mL da cultura foi transferida para um tubo eppendorf e centrifugada por 2 minutos a 12.000 rpm a 4oC. As células foram lavadas em 500L de PIV (10Mm Tris, 1.0M NaCl),
novamente centrifugadas, e o sobrenadante descartado. O ―pellet‖ foi ressuspenso em
200L de PIV e 150L da suspensão transferido para um novo tubo eppendorf e
colocado em banho maria à 48OC por 5 a 10 minutos para o equilíbrio da temperatura. Em seguida, 150L de agarose (1,5% Agarose Ultra Pure), foi adicionada ao tubo.
Os discos de agarose foram colocados em solução de lise EC acrescentando-se RNase a uma concentração final de 20g/mL e incubados por 4 a 5
horas a 37O C. Ao final deste período, o tampão EC foi substituído por tampão ES acrescido de proteinase K, incubando-se por um período de 18-24 horas a 50O C. Os discos de agarose foram lavados 5 vezes com 13mL do tampão TE por 30 minutos. Um único disco foi colocado em 100L de tampão e deixado a 37OC por 30 minutos. Em
seguida, a solução foi substituída por tampão fresco e adicionado 30 unidades de enzima de restrição SmaI seguindo-se incubação em banho maria por 18 a 20 horas a 37OC. O gel de agarose (Agarose Ultra Pure) (150mL a 1,0%) em TBE 0,5x.
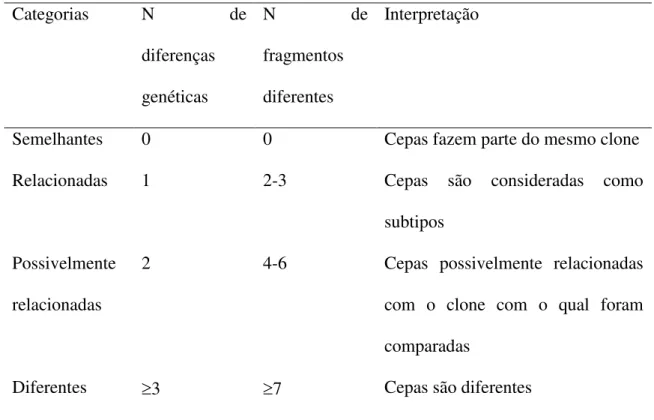
A análise das bandas obtidas após a eletroforese foi realizada visualmente por mais de um observador de acordo com o guia de interpretação de Eletroforese de campo pulsado proposto por TENOVER et al. (1995, 1997) como mostrado na Tabela 2. Tabela 3. Critérios para interpretação de Eletroforese de campo pulsado
Categorias N de
diferenças genéticas
N de
fragmentos diferentes
Interpretação
Semelhantes 0 0 Cepas fazem parte do mesmo clone Relacionadas 1 2-3 Cepas são consideradas como
subtipos Possivelmente
relacionadas
2 4-6 Cepas possivelmente relacionadas com o clone com o qual foram comparadas
Diferentes 3 7 Cepas são diferentes
3.6.3- Tipagem molelcular pela técnica de “Multilocus sequene typing”
Sete genes foram amplificados de acordo com a técnica: arc (carbamato quinase), aroE (Chiquimato desidrogenase), glpf (glicerol quinase), gmk (guanilato quinase), pta (fosfato acetiltransferase), tpi (triosefosfato isomerase) e yqil (acetil coenzima A acetiltransferase) (Enright et al., 2000). A amplificação foi realizada através da Triple Master PCR System (Eppendorf, Hamburg, Germany). As reações
Após amplifiação, os produtos do PCR foram purificados utilizando o kit WizardSV Gel e PCR Clean-up System (Promega, Madison, EUA).
Após as reações de sequenciamento de cada um dos genes (―forward‖ e
―reverse‖) as seqüências gênicas foram identificadas através da comparação cós as
seqüências disponíveis na base de dados acessível em www.mlst.net .
3.7- Análise Estatística
As análises estatísticas univariada, através de tabela 2 x 2 e teste-t, e multivariada, por regressão logística múltipla, foram realizadas pelo programa BioEstat5.0.
3.8- Aprovação pelo Comitê de Ética
4
–
Resultados
No período da investigação, entre os meses de setembro de 2006 e setembro de 2008, foram registrados 633 episódios de infecções por Staphylococcus aureus, dos quais episódios, foram excluídas 141 amostras por serem duplicatas de pacientes (93) e pela falta de dados (48). No total foram incluídas no estudo 492 amostras: 286 (58,0%) de MSSA e 206 (42,0%) de MRSA; e, as últimas, subdivididas como multirresistentes (MR-MRSA) e não multirresistentes (não MR-MRSA) (Tabela 1).
Tabela 1. Infecções por amostras de Staphylococcus aureus susceptíveis ou resistentes à meticilina em pacientes internados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
S. aureus Número de amostras / infecções (%)
492 (100) MSSA
MRSA
MR-MRSAa Não MR-MRSAb
286 (58,0) 206 (42,0) 161 (78,1)
45 (21,9)
a:
Staphylococcus aureus resistente à meticilina multirresistente, b: Staphylococcus aureus resistente à
meticilina não-multirresistente
Tabela 2. Sítios de infecção MRSA em pacientes internados no HC-UFU, de setembro de 2006 a setembro de 2008.
Sítio de Infecção N=206 (%)
Corrente sanguínea Sítio Cirúrgico Pneumonia Pele e tecido mole
As infecções por MRSA foram predominantemente de corrente sanguínea (43,2%), sítio cirúrgico (27,2%) e pneumonia (18,4%) e, excetuando-se quatro, de natureza hospitalar, tanto por MR quanto por não MR-MRSA (Tabelas 2 e 3). As infecções de natureza comunitária responderam por apenas 1,9% do total. Observou-se predomínio de óbitos entre pacientes com infecção pelo microrganismo multirresistente (P≤0,01) (Tabela 3).
Tabela 3. Classificação das infecções por Staphylococcus aureus em pacientes internados no HC-UFU, quanto à origem e evolução clínica dos pacientes, no período de setembro de 2006 a setembro de 2008.
Característica MRSA OR (IC 95%)
MR-MRSA N=161 (%)
Não MR-MRSA N=45 (%)
P Comunitária 2 (1,2)
159 (98,8)
84 (52,2) 77 (47,8)
2 (4,4) 43 (95,6)
33 (73,4) 12 (26,6)
0,20 0,27 (0,03-2,80)
Hospitalar 0,20
Evolução Alta Óbito
0,01 0,01
0,40 (0,18-0,87)
MR-MRSA e em 46,6% daqueles infectados com amostras não MR-MRSA. Entretanto, embora fossem mais freqüentes as infecções por MR-MRSA em pacientes com diabetes mellitus (OR=3,86; IC=0,50-81,30), não foram observadas diferenças significativas quanto ao agente etiológico nas freqüências observadas destes fatores predisponentes. Tabela 4. Fatores de risco relacionados aos pacientes para infecção por e não MR-MRSA no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Característica MR-MRSA N=161
Não MR-MRSA N=45
P OR (IC 95%)
Sexo (M / F) 106 / 55 30 / 15 0,91 0,96 (0,45-2,05)
Idade: média (variação)a 50,1 (0 - 90) 27,5 (0 – 85) 0,001 - Tempo de internaçãob 47,51 (0-348) 76,51 (0-1080) 1,00 - Sítio de infecção
Corrente Sanguínea Pele e tecidos moles Sítio cirúrgico Pneumonia Pneumonia VM 69 (42,8) 10 (6,2) 50 (31,0) 12 (7,4) 20 (12,4) 20 (44,4) 13 (28,8) 6 (13,3) 5 (11,1) 1 (2,2) 0,25 0,001 0,01 0,30 0,03 0,68 (0,33-1,39) 0,13 (0,05-0,36) 3,40 (1,19-10,46) 0,64 (0,19-2,24) 6,24 (0,85-128,33)
Trauma 47 (29,2) 9 (20,0) 0,22 1,65 (0,70-4,01)
a Média (variação) em anos; b Média (variação) em dias.
Tabela 5. Fatores de risco extrínsecos para infecções por amostras e não MR-MRSA diagnosticadas no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Característica MR-MRSA
N=161 (%)
Não MR-MRSA N=45 (%)
P OR (IC 95%)
Cirurgia 105 (65,2) 22 (48,8) 0,04 1,96 (0,95-4,03) Procedimento invasivo
Cateter vascular central Cateter vascular periférico Tubo Endotraqueal Sonda Vesical 84 (52,2) 63 (39,1) 59 (36,6) 85 (52,8) 23 (51,1) 7 (15,5) 10 (22,2) 14 (31,1) 0,89 0,003 0,06 0,01 1,04 (0,51-2,13) 3,49 (1,38-9,16) 2,02 (0,88-4,73) 2,48 (1,17-5,32) 2 procedimentos invasivos 64 (39,7) 7 (15,5) 0,002 3,58 (1,42-9,40)
Antimicrobianos 137 (85,1) 38 (84,4) 0,91 1,05 (0,38-2,82) 2 antimicrobianos 44 (27,3) 15 (33,3) 0,43 0,75 (0,35-1,63)
Unidade de internação UTI adultos
Unidades Cirúrgicas Moléstias Infecciosas Pronto Socorro
Unidade de Queimados Clínica Médica
Unidades pediátricasa Ambulatório Indeterminado 31 (19,2) 47 (29,2) 10 (6,2) 20 (12,4) 3 (1,8) 29 (18,0) 10 (6,2) 10 (6,2) 1 (0,6) 3 (6,6) 6 (13,3) 1 (2,2) 7 (15,5) 0 4 (8,8) 19 (42,2) 4 (8,8) 1 (2,2) 0,04 0,03 0,26 0,58 0,47 0,14 0,001 0,36 0,39 3,34 (0,91-14,46) 2,68 (1,00 – 7,57) 2,91 (0,37-62,48) 0,77 (0,28-2,88) - 2,25 (0,70-8,05) 0,09 (0,03-0,23) 0,68 (0,18-2,72) 0,28 (0,01-10,29)
infecções pelos microrganismos multirresistentes e não multiresistentes evidenciou, como fatores independentes, pior prognóstico (óbito) para infecções por amostras MR e infecções de pele e tecido mole em neonatos e crianças quando de infecções por amostras não MR de MRSA (Tabela 6).
Tabela 6. Análise multivariada dos fatores de risco para infecções por amostras MR- e não MR-MRSA diagnosticadas no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Fator de risco P OR IC 95%
Infecções de pele e tecido mole 0,01 0,226 0,07 – 0,74 Infecção de Sítio Cirúrgico 0,49 1,532 0,45 – 5,19
Uso de CVC 0,31 0,590 0,21 – 1,65
Uso de > 2 procedimentos invasivos 0,96 0,972 0,28 – 3,40
Cirurgia 0,19 1,863 0,73 – 4,73
Internação prévia em UTI 0,35 2,020 0,46 – 8,86
Internação em unidades pediátricas < 0,001 0,101 0,03 – 0,33
Evolução para óbito 0,01 3,04 1,20 – 7,69
(70,0%) e Cloranfenicol (68,3%). Os resultados obtidos pelo E-test mostraram resistência entre 1-2 µg/mL em 75% das amostras. Em apenas duas amostras, 455 e 321, o MICs foi mais elevado, 50 e 75 µg/mL, respectivamente.
Tabela 7. Susceptibilidade aos agentes antimicrobianos de amostras e não MR-MRSA isolados de pacientes internados no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Antimicrobiano MR-MRSA N=161 (%)
Não MR-MRSA N=45 (%)
P OR (IC)
Eritromicina Levofloxacina Clindamicina Tetraciclina Gentamicina Rifampicina Sulfazotrim Cloranfenicol Vancomicina 7 (4,3) 62 (38,5) 12 (7,4) 19 (11,8) 24 (14,9) 113 (70,2) 15 (9,3) 110 (68,3) 161 (100) 5 (11,1) 30 (66,6) 17 (37,7) 42 (93,3) 41 (91,1) 42 (93,3) 41 (91,1) 37 (82,2) 45 (100) 0,09 0,001 < 0,001 < 0,001 < 0,001 0,003 < 0,001 0,10 -
0,36 (0,10 – 1,41) 0,31 (0,15 – 0,66) 0,13 (0,05 – 0,33) 0,01 (0,00 – 0,04) 0,02 (0,00 – 0,06) 0,17 (0,04 – 0,62) 0,01 (0,00 – 0,03) 0,47 (0,19 – 1,14)
-
Resistência ≥3 161 (100) 38 (84,4) < 0,001 -
(37,5%). Quatro amostras (50,0%) exibiram resistência à clindamicina associada a este macrolídeo (Tabela 8).
Tabela 8. Características das amostras de Staphylococcus aureus SCCmec tipo IV isoladas no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Amostra Data de isolamento
Sítio de infecção Perfil de resistência SCCmec
229 25/05/2007 Pele ERI2, CLI3 IV
321 18/09/2007 Sangue ERI IV
333 20/09/2007 Sangue ERI, CLO4 IV
U70 04/03/2008 Aspirado traqueal ERI, CLI, LEVO5, CLO IV
455 17/03/2008 Aspirado traqueal ERI, CLI, LEVO IV
495 06/05/2008 Sangue ERI IV
508 21/05/2008 Secreção (Otite) ERI, CLO, CLI IV
533 18/06/2008 ISC1 ERI IV
ISC1– Infecção de Sítio Cirúrgico; 2Eritromicina, 3Clindamicina, 4Cloranfenicol, 5Levofloxacina
Tabela 9. Fatores de risco relacionados aos pacientes com infecção por Staphylococcus aureus SCCmec tipo IV isolados no período de setembro de 2006 a setembro de 2008. Amostra Sexo Idade
(anos)
Internação anterior
Trauma Comorbidades Origem
229 Masculino 0,05 Não Não - Hospitalar
321 Masculino 0,66 Sim Não Cardiopatia Hospitalar
333 Masculino 0,7 Não Não Cardiopatia Hospitalar
U70 Masculino 62 Não Sim - Hospitalar
455 Masculino 62 Não Sim - Hospitalar
495 Feminino 25 Sim Não SIDA Hospitalar
508 Masculino 1 Não Não - Comunitária
533 Masculino 43 Sim Sim - Hospitalar
Os fatores predisponentes extrínsecos relacionados com infecções por estas amostras são mostrados na tabela 10, destacando-se a distribuição abrangente (unidades cíticas e não críticas) no hospital, além de, predomínio de pacientes submetidos a procedimentos cirúrgicos (62,5%) e invasivos (75,0%), bem como em uso de duas ou mais classes de antimicrobiano (62,5%).
Tabela 10. Fatores de risco extrínsecos para infecção por amostras de Staphylococcus aureus SCCmec tipo IV isoladas no período de setembro de 2006 a setembro de 2008. Amostra Unidade de
internação1
Cirurgia Procedimentos invasivos2 Uso de Antimicrobianos3
229 Neonatologia Não CVC OXA, AMC, VAN
321 Ambulatório Sim - VAN, MER
333 Neonatologia Sim CVC, CVP VAN, MER
U70 UTI Sim CVC, TET, SV CLI, CEF
455 UTI Sim CVC, TET, SV VAN
495 MI Não CVP VAN
1UTI- Unidade de Terapia Intensiva de Adultos, MI- Moléstias Infecciosas, PS- Pronto Socorro; 2 CVC-
Cateter Vascular Central, CVP- Cateter Vascular Periférico, TET- Tubo Endotraqueal, SV- Sonda Vesical; 3 CLI – Clindamicina; CEF – Cefepime; OXA – Oxacilina; AMC – Amicacina; VAN –
Vancomicina; MER – Meropenem; CTX – Ceftriaxone; AMX – Amoxicilina; CLV – Clavulin
Tabela 11. Fatores de risco intrínsecos relacionados aos pacientes com infecção por amostras de MRSA versus MRSA SCCmec IV no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Características MRSA N=198
MRSA SCCmecIV
N=8
P OR (IC 95%)
Sexo (M / F) 130 / 68 7 / 1 0,18 0,27 (0,01-2,28)
Idade: média (variação)a 50,1 (0 - 90) 24,12 (0 – 62) 0,013 - Tempo de internaçãob 53,09 (0-1080) 67 (0-360) 1,00 - Sítio de infecção
Corrente sanguínea Pele e tecidos moles Sítio cirúrgico Pneumonia Pneumonia VM 86 (43,4) 21 (10,6) 55 (27,7) 16 (8,0) 20 (10,1) 3 (37,5) 2 (25,0) 1(12,5) 1 (12,5) 1 (12,5) 0,51 0,22 0,30 0,50 0,58 1,28 (0,26-6,97) 0,36 (0,06-2,74) 2,69 (0,32-59,56) 0,62 (0,07-14,13) 0,79 (0,09-17,87) Comorbidades: Cardiopatia Imunocompromentimento Outras1 16 (8,0) 10 (5,0) 73 (36,8) 2 (25,0) 1 (12,5) 0 0,14 0,26 0,001 0,26 (0,04-2,07) 2,91 (0,37-62,48) -
Trauma 53 (26,8) 3 (37,5) 0,37 0,61 (0,12-3,35)
MRSA SCCmec IV (Tabela 11) mostrou diferenças significativas (P<0,05) quando da análise univariada para os seguintes itens: idade, infecções graves (infecção de corrente sanguínea e pneumonias) e de sítio cirúrgico e trauma (P<0,05), mais expressivos no primeiro grupo de pacientes, excetuando-se as pneumonias, com (P = 0,05) e sem (P = 0,03) ventilação mecânica, que foram mais freqüentes entre os pacientes com infecção por SCCmec IV.
Tabela 12. Fatores de risco extrínsecos para infecções por MRSA versus MRSA SCCmec IV diagnosticadas no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Característica MRSA
N=198
MRSA SCCmec IV
N=8
P OR (IC 95%)
Cirurgia 123 (62,1) 4 (50,0) 0,36 1,64 (0,33-8,09)
Procedimento invasivo Cateter vascular central Cateter vascular periférico Tubo Endotraqueal Sonda Vesical 103 (52,0) 67 (34,0) 67 (34,0) 97 (49,0) 4 (50,0) 3 (37,5) 2 (25,0) 2 (25,0) 0,59 0,53 0,46 0,16 1,08 (0,22-5,33) 0,85 (0,17-4,66) 1,53 (0,27-11,32) 2,88 (0,51-21,19) 2 procedimentos invasivos 69 (34,8) 2(25,0) 0,43 1,60 (0,28-11,84)
Antimicrobianos 167 (84,3) 7 (87,5) 0,63 0,77 (NC) 2 antimicrobianos 57 (28,8) 2 (25,0) 0,58 1,21 (0,21-8,97)
Unidade de internação UTI adultos Moléstias Infecciosas Pronto socorro Ambulatório Unidades Pediátricas Outras1 32 (16,1) 10 (5,0) 26 (13,1) 12 (6,0) 27 (13,6) 91 (46,0) 2 (25,0) 1 (12,5) 1 (12,5) 2 (25,0) 2 (25,0) 0 0,40 0,36 0,71 0,09 0,31 0,008 0,60 (0,10-4,51) 0,37 (0,04-8,82) 1,06 (0,12-23,81) 0,19 (0,03-1,56) 0,47 (0,08-3,59) -
Tabela 13. Análise multivariada dos fatores intrínsecos de risco para infecções por MRSA SCCmec IV versus SCCmecII / III diagnosticadas no HC-UFU, no período de setembro de 2006 a setembro de 2008.
Fatores de risco P OR IC 95%
Trauma 0,135 0,246 0,04 – 1,55
Infecções de Corrente Sanguínea 0,237 3,322 0,45 – 24,32 Infecção de Sítio Cirúrgico 0,113 10,663 0,57 – 199,92
Pneumonia 0,409 2,753 0,25 – 30,47
Comorbidade (Cardiopatia) 0,105 0,221 0,04 – 1,37
O perfil alélico obtido pela análise por MLST (1-4-1-4-12-1-10) indicou que as amostras SCCmecIV isoladas em nosso estudo pertencem ao complexo clonal ST5 (CC5), clone USA800, excetuando-se a amostra 333 (Figura 1, linha2) correspondente ao padrão A5 do PFGE que não teve seu ST definido devido a três alelos inconclusivos. A tipagem molecular demonstrou, pela técnica de PFGE, a presença de apenas um clone (A), subdividido em seis subtipos (Figura 1), sendo ―A‖ (padrão) o mais freqüente,
Figura 3. Genótipos do PFGE das oito amostras não-MR MRSA, SCCmecIV, isoladas de pacientes do Hospital de Clínicas da UFU. Amostras - linhas 2 a 9; ladder - linhas
5
–
Discussão
Neste estudo detectamos uma freqüência baixa de amostras não MR-MRSA, incluindo amostras SCCmecIV, associadas à infecções hospitalares quando comparadas às frequências relatadas nos Estados Unidos. Adicionalmente, merece destaque a prevalência de apenas um clone entre as mesmas tanto pela técnica MLST (ST5) e quanto pela de PFGE (A).
Uberlândia, onde foi realizado o presente estudo, 63,7% de infecções de corrente sanguínea e 46,7% das pneumonias associadas à ventilação mecânica (PAV´s) por S. aureus foram atribuídas a MRSA (CARVALHO & GONTIJO FILHO, 2007). Em outra investigação (MOREIRA & GONTIJO FILHO, 2008), considerando apenas PAVs em pacientes internados na UTI do mesmo hospital relataram uma participação significativa de S. aureus, com 41,2% das amostras correspondendo a MRSA.
Neste estudo, considerando apenas infecções de corrente sanguínea, a avaliação de 51 amostras recuperadas de pacientes hospitalizados revelaram proporção semelhantes de infecções por MRSA (56,8%) e MSSA (43,2%), e mortalidade total de 47,0%, predominantemente entre pacientes com infecção por MRSA (70,8% vs. 29,2%, P=0.05). (Dados do artigo de qualificação em anexo - Anexo IV)
As infecções hospitalares por HA-MRSA estão tradicionalmente associadas aos seguintes fatores predisponentes: pacientes idosos, presença de comorbidades e tempo de internação, entre os associados ao paciente; e, cirurgia, procedimentos invasivos, uso de antimicrobianos e internação em unidades críticas como fatores extrínsecos (CHAMBERS & DE LEO, 2009).
dos trabalhos referentes a hospitais do hemisfério norte onde as infecções por este fenótipo são mais evidentes em pacientes de unidades críticas (CHAMBERS & DE LEO, 2009).
A partir dos anos 90 emergiram as amostras de CA-MRSA, usualmente associadas com infecções cutâneas e de tecidos moles, sobressaindo o impetigo, e especialmente em crianças (YAMAMOTO et al., 2010), mas também em infecções graves como pneumonias necrotizantes e infecções de corrente sanguínea (ROSSNEY et al., 2007; DEURENBERG & STOBBERINGH, 2008). O único caso de origem comunitária, com isolamento de CA-MRSA, detectado na população estudada em Uberlândia foi de uma criança de um ano de idade, atendida no ambulatório, correspondendo a um episódio de otite. As infecções por este microrganismo se desenvolvem usualmente em indivíduos sadios sem a existência de fatores de risco para aquisição de MRSA, como hospitalização prévia (CDC, 2004).
Há sugestões de que CA-MRSA evoluiu espontaneamente a partir de amostras de MSSA, pela aquisição do gene mecA independentemente em muitas áreas geográficas (ENRIGHT et al., 2002; OTTER & FRENCH, 2010) e, ao contrário das amostras de HA-MRSA, usualmente restritas a pacientes hospitalizados e com fatores de risco predisponentes já referidos anteriormente, disseminou-se na comunidade (YAMAMOTO et al., 2010; CHAMBERS & DE LEO, 2009). A expansão da linhagem comunitária foi relatada em diferentes regiões geográficas como Canadá, Ásia, América do Sul, Austrália e Europa, incluindo, neste último continente, países onde historicamente a prevalência de MRSA é baixa como: Noruega, Holanda, Dinamarca e Finlândia (CHAMBERS & DE LEO, 2009).
(Infecções relacionadas à assistência à saúde) (SEYBOLD et al., 2006; HUANG et al., 2007; DEURENBERG & STOBBERINGH, 2008; PATEL et al., 2008; POPOVICH, WEINSTEIN e HOTA, 2008; WANG et al., 2008). POPOVICH et al. (2008) relataram que a participação de amostras de CA-MRSA na etiologia de infecções de corrente sanguínea por MRSA aumentou de 24,0% para 49,0% em um hospital de Chicago, evidenciando a substituição das amostras hospitalares tradicionais de MRSA (FENG et al., 2008).
Em nossa avaliação este estudo é o primeiro no país, centrado em população hospitalar, a abordar a epidemiologia de infecções por MRSA considerando amostras multirresistentes e não-multirresistentes por métodos clássicos e moleculares.
No Brasil, os primeiros relatos sobre a presença de CA-MRSA foram relativos a infecções comunitárias, usualmente de pele e tecido subcutâneo e um caso de artrite séptica, nos estados do Rio Grande do Sul (RIBEIRO et al. 2005, 2007) e Rio de Janeiro (SCHUENCK et al., 2009). A seguir, outras publicações descreveram estas amostras recuperadas de infecções de corrente sanguínea (TRINDADE et al., 2005; MIRANDA et al., 2007; SCHUENCK et al., 2009), tecido mole (RIBEIRO et al., 2007) e sítio cirúrgico (MIRANDA et al., 2007; SCHUENCK et al., 2009), em pacientes apresentando fatores de risco tradicionais. O presente estudo refere-se exclusivamente a amostras de natureza hospitalar, excetuando-se duas, de atendimento ambulatorial: uma criança com otite anteriormente referida e um paciente com infecção cutânea. No total, entre os 45 pacientes com amostras não multirresistentes de MRSA, observamos o predomínio de infecções de corrente sanguínea (43,2%), seguidas de infecções de sítio cirúrgico e pele e tecido mole (38,3%) e pneumonia (18,4%).
quando de decisões terapêuticas (POPOVICH et al., 2007). Entretanto, vem-se observando a aquisição crescente de genes de resistência a outras classes de antimicrobianos (BOYLE-VAVRA et al., 2005; RAMDANI-BOUGUESSA et al., 2006; DIEP et al., 2008).
Alguns clones de CA-MRSA, como o Europeu (ST80-SCCmecIV), apresentam um perfil específico de resistência incluindo o ácido fusídico, tetraciclina, canamicina e resistência variável à ciprofloxacina (VANDENESCH et al., 2003; TRISTAN et al., 2007). Entre as amostras de não MR-MRSA isoladas em nossa investigação o espectro de resistência aos antimicrobianos incluiu predominantemente eritromicina (88,8%), clindamicina (62,3%), fluorquinolona (33,4%), cloranfenicol (17,7%) e sulfametoxazol-trimetoprim (S+T) (8,8%). Entre as oito amostras que apresentaram o SCCmecIV 37,5% apresentou um resistograma comum com resistência apenas à eritromicina.
A susceptibilidade a antimicrobianos como tetraciclina, S+T, gentamicina, fluorquinolonas e clindamicina é considerada como marcador fenotípico para a detecção laboratorial presuntiva de CA-MRSA (MILLAR et al., 2007; POPOVICH et al., 2007). Embora a susceptibilidade à ciprofloxacina seja recomendada como teste de triagem
primário para esta identificação pelo ―HPA Staphylococcus Reference Laboratory‖ a
MR-sensibilidade, especificidade e valor preditivo positivo, respectivamente: 50,0%, 94,4%, 80,0%; 75,0%, 66,6%, 50,0%. Por outro lado, dados de dois estudos realizados no país (TRINDADE et al., 2005 e SCHUENCK et al., 2009) sugerem a utilização da susceptibiliade ao S+T como marcador fenotípico de CA-MRSA. Aproximadamente 90,0% das amostras não-multirresistentes, bem como 100,0% das oito com genótipo SCCmecIV recuperadas no HC-UFU foram susceptíveis a este antimicrobiano.
Adicionalmente à susceptibilidade a diversas classes de antimicrobianos que não
os β-lactâmicos, esta linhagem caracteriza-se pela resistência heterogênea à
meticilina/oxacilina (OKUMA et al., 2002; YAMAMOTO et al., 2010), refletida pelos baixos valores de MIC para estas penicilinas, em torno de 32 µg/mL (RIBEIRO et al., 2005). Os nossos resultados obtidos pelo E-test mostraram a maioria das amostras (75,0%) com resistência entre 1-2 µg/mL e apenas duas amostras, 455 e 321, com MICs de 50 e 75 µg/mL, respectivamente.
al., 2007) mas, sua contribuição na patogenia das infecções de pele, tecido mole e outras infecções estafilocócicas invasivas é controversa (ELLINGTON et al., 2007).
Considera-se que as amostras que produzem PVL representem um problema grave de saúde pública devido à sua virulência aumentada, bem como o potencial de transmissão desta característica, que torna este microrganismo uma ameaça real se importado para o interior de hospitais (NASS et al., 2005). No entanto, amostras que carreiam estes genes não estão associadas de forma clara com síndromes clínicas mais graves (MESRATI et al., 2010). Schuenck et al. (2009) relataram ausência de leucocidina em 85,0% de amostras não multirresistentes SCCmecIV pertencentes a clones distintos no Rio de Janeiro, recuperados na sua maioria de pacientes internados. Este genótipo não foi detectado em nenhuma das amostras incluídas na nossa investigação. Outro fator de virulência pesquisado em nosso estudo foi a produção de α -hemolisina, esta sim, documentada nas oito amostras pesquisadas. Entretanto, a associação destas hemolisinas com síndromes clínicas específicas ainda não foi descrita.
Em nosso estudo, a taxa de mortalidade hospitalar total, no prazo de trinta dias pós o diagnóstico, foi de 43,2% e, significante (P≤0,01) entre os pacientes com infecção
observado com as infecções comunitárias quando, aquelas por CA-MRSA apresentam evolução menos favorável do que as por CA-MSSA (DAVIS et al., 2007).
O uso intenso e indiscriminado de antimicrobianos, tanto na comunidade quanto em hospitais, é um problema de saúde pública, particularmente em países em desenvolvimento como no Brasil (NETTLEMAN, 1993; GOULD, 2009), justificando a situação, cada vez mais preocupante, de emergência e prevalência de microrganismos multirresistentes (GOLDMANN & HUSKINS, 1997). Em relação ao CA-MRSA, sugere-se que a presença do SCCmecIV seja uma vantagem para o microrganismo, com os níveis mais baixos de antimicrobianos utilizados na comunidade suficientes para sua disseminação sem maior custo biológico (LEVIN, 2001; DIEP et al., 2008), em contraste com amostras SCCmecII e III, multirresistentes, endêmicas nos hospitais gerais, cujo maior número de genes impõe um custo biológico e seriam favorecidas pela força pressora resultante dos níveis elevados de antimicrobianos no ambiente hospitalar, mas que restringiriam sua disseminação na comunidade (ENDER et al., 2004; LEE et al., 2007; DIEP et al., 2008). Entretanto, uma vez introduzido em hospitais pela admissão de doentes infectados ou portadores, as amostras de MRSA SCCmecIV, particularmente USA300, causam infecções nosocomiais, em pacientes com a presença de fatores predisponentes clássicos, como já referido anteriormente (MORAN et al., 2006; POPOVICH et al., 2008), e observado no nosso estudo. Contudo as infecções de pele e tecido mole, assim como a internação em unidades pediátricas, foram fatores de risco independentes para infecções por amostras não MR-MRSA, enquanto as recuperadas de corrente sanguínea, sítio cirúrgico e pneumonia sobressaíram entre as multirresistentes.
(CHAMBERS & DE LEO, 2009), é usualmente utilizada na definição de tipos e clones de CA-MRSA (OTTER & FRENCH, 2010). Amostras idênticas de acordo com a análise pela técnica de MLST são consideradas como de um mesmo ―sequence typing‖
(ST) e os STs que diferem em menos de três loci gênicos são agrupados em complexos clonais (CC) (OTTER & FRENCH, 2010). Assim como ocorreu com o MRSA multirresistente associado a instituições de saúde, clones bem sucedidos de CA-MRSA estão usualmente relacionados com regiões geográficas específicas por razões ainda não bem compreendidas, mas que, provavelmente, incluem fatores sócio-econômicos, práticas de prescrição de antimicrobianos e surtos comunitários e hospitalares (VANDENESCH et al., 2003; TRISTAN et al., 2007; DEURENBERG & STOBBERINGH, 2008).
principais clones circulantes relacionados com infecções comunitárias são ST1-IV, PVL- e ST30-IV, PVL+ (OTTER & FRENCH, 2010), também associados com surtos hospitalares (DAVID et al., 2006; HPA, 2006). Adicionalmente, os clones ST59-IV, PVL+ e ST30-IV, PVL+ (Southwest Pacific Clone / OSPC) sobressaem em Taiwan e, este último, além do ST1, ST93, e ST29 são mais representativos na Oceania/Austrália (HUANG et al., 2007; STAM-BOLINK et al., 2007).
No Brasil, amostras de HA-MRSA pertencentes ao BEC (―Brazilian epidemic clone‖, ST239-IIIA) se disseminaram entre hospitais gerais tornando-se