FACULDADE DE MEDICINA
DEPARTAMENTO DE CIRURGIA
GUSTAVO RÊGO COÊLHO
FATORES RELACIONADOS À DISFUNÇÃO E NÃO FUNÇÃO
PRIMÁRIA DO ENXERTO NO TRANSPLANTE DE FÍGADO
GUSTAVO RÊGO COÊLHO
FATORES RELACIONADOS À DISFUNÇÃO E NÃO FUNÇÃO PRIMÁRIA DO ENXERTO NO TRANSPLANTE DE FÍGADO
Dissertação apresentada ao Programa de Pós-Graduação em Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Cirurgia.
Orientador: Prof. Dr. José Huygens Parente Garcia
C616a Coêlho, Gustavo Rêgo
Fatores relacionados à disfunção e não função primária do enxerto no transplante de fígado/ Gustavo Rêgo Coêlho. 2007.
92 f.
Orientador: Prof. Dr. José Huygens Parente Garcia
Dissertação (Mestrado) – Universidade Federal do Ceará. Faculdade de Medicina, Fortaleza, 2007.
1. Transplante de Fígado. 2. Doadores de Órgãos. 3.Insuficiência Hepática.
FATORES RELACIONADOS À DISFUNÇÃO E NÃO FUNÇÃO PRIMÁRIA DO ENXERTO NO TRANSPLANTE DE FÍGADO
Dissertação apresentada ao Programa de Pós-Graduação em Cirurgia, da Faculdade de Medicina, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Cirurgia.
Aprovada em _____/_____/______
BANCA EXAMINADORA
__________________________________________________________________ Prof. Dr. José Huygens Parente Garcia (Orientador)
Universidade Federal do Ceará (UFC)
____________________________________________ Profa. Dra. Claudia Regina Fernandes
Universidade de Fortaleza (UNIFOR)
______________________________________________ Prof. Dr. Ben-Hur Ferraz-Neto
Hospital Albert Einstein (São Paulo-SP) Pontifícia Universidade Católica (PUC-SP)
Ao meu pai, Clovis, valorizador da vida e do saber.
À minha mãe, Yolanda, exemplo de amor maternal, solidariedade, honestidade e responsabilidade.
Ao meu futuro filho, Pedro Otávio, novo horizonte em minha vida.
Ao meu irmão, Clovinho, pelo qual tenho um amor incondicional.
AGRADECIMENTOS
Ao Prof. Dr. PAULO ROBERTO LEITÃO DE VASCONCELOS, professor associado do Departamento de Cirurgia e coordenador do Programa de Pós-Graduação em Cirurgia da Universidade Federal do Ceará, pela incansável dedicação à Pós-Graduação dessa instituição.
Ao Prof. Dr. JOSÉ HUYGENS PARENTE GARCIA, Chefe do Departamento de Cirurgia da Universidade Federal do Ceará e do Centro de Transplante de Fígado do Hospital Universitário Walter Cantídio, orientador, exemplo de dedicação a profissão, liderança, perseverança e determinação.
Ao Dr. JOÃO BATISTA MARINHO DE VASCONCELOS, cirurgião geral do Hospital Universitário Walter Cantídio, exemplo de profissional, competência, inquietude científica, pela orientação a mim dispensado em todos os momentos da minha formação humana e cirúrgica.
A Profa. Dra. CLAUDIA REGINA FERNANDES, professora da Universidade de Fortaleza e chefe do Serviço de Anestesiologia da equipe de transplante de fígado do Hospital Universitário Walter Cantídio, pelo constante incentivo à pesquisa.
Ao Prof. Dr. TELMO VALENÇA JUNIOR, professor do Departamento de Patologia e Medicina Legal da Universidade Federal do Ceará, responsável por todas as análises histopatológicas desse estudo.
Ao Prof. Dr. JOÃO ARAGÃO XIMENES FILHO, professor visitante do Departamento de Cirurgia da Universidade Federal do Ceará, pelo apoio e contribuição na analise estatística desse estudo, me ensinando e ajudando de forma incondicional.
Ao Prof. Dr. MARCELLUS HENRIQUE LOYOLA PONTE DE SOUZA, gastroenterologista e professor adjunto do Departamento de Fisiologia e Farmacologia dessa universidade, pela contribuição no desenho dessa dissertação.
A todos MÉDICOS, ENFERMEIROS, FISIOTERAPEUTAS, PSICÓLOGOS, ASSISTENTES SOCIAIS, FUNCIONÁRIOS envolvidos com o Centro de Transplante de Fígado do Hospital Universitário Walter Cantídio.
Universitário Walter Cantidio BRONNER PAMPLONA e FERNANDA CAVALCANTE, por ajudarem na elaboração dessa dissertação.
A bibliotecária Sra. ROSANE MARIA COSTA, pelas orientações bibliográficas.
O tempo é muito lento para os que esperam Muito rápido para os que têm medo
Muito longo para os que lamentam Muito curto para os que festejam E eterno para os que amam.
RESUMO
Título: Fatores relacionados à disfunção e não função primária do enxerto no transplante de fígado.
Programa de Pós-Graduação em Cirurgia da Universidade Federal do Ceará Dissertação de Mestrado
Autor: Gustavo Rego Coelho Orientador: José Huygens Parente Garcia
Fortaleza 22 de Novembro de 2007
A insuficiência hepática do enxerto no pós-operatório pode se manifestar como uma Disfunção Primaria do Enxerto (DPE) ou uma Não Função do Enxerto (NFE). O Objetivo desse trabalho é avaliar os fatores relacionados ao doador e ao receptor com a disfunção primária e a não função do enxerto em pacientes submetidos ao transplante de fígado. Foram avaliados 176 transplantes de fígado no Hospital Universitário Walter Cantídio da Universidade Federal do Ceará (HUWC/UFC). A mortalidade em 30 dias dos pacientes com evolução enzimática normal foi de 5%; dos pacientes com DPE foi 19,7% e dos pacientes com NFE foi de 100%. Os pacientes que evoluíram no pós-operatório com DPE e NFE tiveram 3,69 vezes mais chances de óbito em 30 dias que os pacientes que tiveram evolução normal. Nesse estudo, foram avaliados diversos fatores do doador e do receptor: idade, níveis séricos de sódio, transaminases, grau de esteatose do enxerto, escore MELD, Tempo de Isquemia Fria (TIF) e Tempo de Isquemia Quente(TIQ). O TIF maior que 600 minutos, TIQ maior que 55 minutos e o grau de esteatose hepática maior que 30% foram fatores de risco para o desenvolvimento de DPE/NFE. A correlação entre TIF em minutos com a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, revelou significância estatística no 1o PO, 2o PO, 3o PO, 4o PO, 6o PO e 7o PO para AST. Em relação a ALT houve significância estatística no 1o PO, 2o PO, 3o PO, 4o PO, 5o PO, 6o PO e 7o PO. A correlação entre TIQ em minutos com a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, revelou significância estatística no 1o PO, 5o PO, 6o PO e 7o PO para AST. Em relação a ALT houve significância estatística no 1o PO. Conclui-se que o grau de esteatose no enxerto maior que 30%, o aumento do TIF e do TIQ tem correlação com aumento das transaminases no pós-operatório e conseqüentemente maior risco de DPE/NFE.
ABSTRACT
Title: Evaluation of factors related to primary graft dysfunction and nonfunction in the liver transplantation.
Pos-Graduate Program of Surgery of The Federal University of Ceará Author: Gustavo Rêgo Coêlho
Superviser: José Huygens Parente Garcia Fortaleza, November 22th 2007
A hepatic insufficiency of the graft after liver transplantation can be defined with Primary Graft Dysfunction (PGD) or Primary Nonfunction (PNF). The Objective of this work is to evaluate the factors related to the donor and the recipient with PGD or PNF in patients submitted to the liver transplant. 176 patients were submitted a liver transplantation in the Walter Cantidio University Hospital of the Federal University of Ceara. The mortality, in 30 days, of the patients with normal enzymatic evolution was of 5%; of the patients with PGD was 19.7% andthe patients with PNF was of 100%. The patients who had evolved in the postoperative (PO) with PGD and PNF had had 3,69 times more possibilities of death in 30 days than the patients who had had normal evolution. In this work, we evaluated donors and recipients vaiables: age, peak serum sodium, aminotransferases, liver steatosis, score MELD, the Cold Ischemia Time of Isquemia Fria (CIT) and the Warm Ischemia Time (WIT). The TIF bigger that 600 minutes, the WIT bigger that 55 minutes and liver steatosis > 30% were factors of risk for the PGD/PNF development. The correlation between the CIT, in minutes, with the evolution aminotransferases of the first one to the seventh postoperative day, it disclosed to significance statistic in 1st PO, 2nd PO, 3rd PO, 4th PO, 6th PO and 7th PO for AST. In relation the ALT had significance statistics in 1st PO, 2nd PO, 3rd PO, 4th PO, 5th PO, 6th PO and 7th PO. The correlation between WIT, in minutes, with the evolution of aminotransaminases the first one to the seventh postoperative day, revealed a significance statistic in 1st PO, 5th PO, 6th PO and 7th PO for AST. In relation the ALT we had significance statistic in the 1st PO. The liver steatosis > 30%, the increase of the CIT and the WIT consequently have correlation with increase of aminotransaminases in postoperative and the bigger risk of DPE/NFE.
ABTO - Associação Brasileira de Transplante de Órgãos AST - Aspartato Aminotransferase
ALT – AlaninaAminotransferase
DCE - Doador com Criterios Expandidos DPE - Disfunção Primária do Enxerto DVA – Drogas Vasoativas
HUWC - Hospital Universitário Walter Cantídio MELD - Model End-Stage Liver Disease
NFE – Não Função do Enxerto
OPTN – The Organ Procurement and Ttransplantation Network PCR - Parada Cardiorrespiratória
PO - Pós-Operatório
RNI - Relação Normatizada Internacional do Tempo de Protrombina TIF - Tempo de Isquemia Fria
TIQ - Tempo de Isquemia Quente UFC - Universidade Federal do Ceará
LISTA DE FIGURAS
LISTA DE TABELAS
Tabela 1 Pacientes excluídos do estudo em 207 transplantes... 31 Tabela 2
Causas de indicação do transplante hepático em 176 pacientes... 32 Tabela 3
Prevalência da indicação do transplante hepático em 176 pacientes (%)... 32 Tabela 4
Causa do óbito após o transplante de fígado em 30 dias em 176 pacientes... 33 Tabela 5 Mortalidade pós-operatório em 30 dias dos pacientes que evoluíram com
DPE/NFE em 176 pacientes... 33 Tabela 6 Variáveis ordenadas dos 176 doadores de fígado – média, mediana e desvio
padrão... 34 Tabela 7
Varáveis dicotômicas dos 176 doadores de fígado – número e proporção... 35 Tabela 8 Variáveis ordenadas dos 176 receptores de fígado – média, mediana e desvio
padrão... 36 Tabela 9 Evolução AST no pós-operatório nos 176 receptores de fígado – média,
mediana e desvio padrão... 36 Tabela 10 Evolução ALT no pós-operatório nos 176 receptores de fígado – média,
mediana e desvio padrão... 37 Tabela 11 Variáveis dicotômicas dos 176 receptores de fígado – número e proporção 37 Tabela 12 Variáveis dicotômicas relacionadas aos receptores analisadas para DPE/NFE n
176 transplantes... 38 Tabela 13 Variáveis dicotômicas relacionadas aos doadores analisadas para DPE/NFE
nos 176 transplantes... 39 Tabela 14 Idade dos doadores correlacionada com a evolução de AST no pós-operatório
dos 176 transplantes... X Tabela 15 Idade dos doadores correlacionada com a evolução de ALT no pós-operatório
dos 176 transplantes... X Tabela 16 Sódio sérico dos doadores correlacionado com evolução enzimática de
AST no pós-operatório dos 176 transplantes... 39 Tabela 17 Sódio sérico dos doadores correlacionado com evolução enzimática de
ALT no pós-operatório dos 176 transplantes... 40 Tabela 18 Idade dos receptores correlacionada com evolução enzimática de AST
no pós-operatório dos 176 transplantes... 40 Tabela 19 Idade dos receptores correlacionada com evolução enzimática de ALT
no pós-operatório dos 176 transplantes... 41 Tabela 20 MELD dos receptores correlacionado com evolução enzimática de AST
no pós-operatório dos 176 transplantes... 41 Tabela 21 MELD dos receptores correlacionado com evolução enzimática de ALT
no pós-operatório dos 176 transplantes... 42 Tabela 22 Tempo de Isquemia Fria (TIF) dos receptores correlacionado com evolução
enzimática de AST no pós-operatório nos 176 transplantes... 42 Tabela 23 Tempo de Isquemia Fria (TIF) dos receptores correlacionado com evolução
evolução enzimática de ALT no pós-operatório nos 176 transplantes... 44
SUMÁRIO RESUMO ABSTRACT LISTA DE ABREVIATURAS E SIGLAS LISTA DE FIGURAS LISTA DE TABELAS 1 INTRODUÇÃO... 15
2 OBJETIVO... 22
3 CASUÍSTICA E MÉTODO... 23
3.1 Critérios de exclusão... 24
3.2 Cirurgia de captação de fígado... 24
3.3 Hepatectomia do receptor e implante do enxerto... 26
3.4 Imunossupressão... 27
3.5 Exames de controle no pós-operatório... 27
3.6 Critérios para diagnóstico de Disfunção primária do enxerto (DPE) e Não Função do Enxerto (NFE)... 28 3.7 Critérios de alta hospitalar... 28
3.8 Tratamento estatístico... 28
3.8.1 Variáveis de desfecho... 28
3.8.2 Variáveis analisadas... 29
3.9 Análise estatística... 30
4 RESULTADOS... 31
4.1 Características da população estudada... 31
4.2 Variáveis relacionadas aos doadores e receptores... 34
5 DISCUSSÃO... 45
6 CONCLUSÃO... 53
REFERÊNCIAS... 54
APÊNDICES... 65
1 INTRODUÇÃO
A hepatite crônica é definida como uma reação inflamatória crônica do fígado com duração de três a seis meses, com anormalidade das enzimas hepáticas e alterações histológicas do fígado. As principais causas de hepatite crônica são infecção pelo vírus C, vírus B, vírus D, hepatopatia alcoólica, hepatite auto-imune, hepatite crônica medicamentosa e doença de Wilson (FRIEDMAN, 1999).
Segundo o Ministério da Saúde do Brasil (2002), as duas principais causas de doença crônica do fígado em adultos foram a hepatite pelo vírus C e a cirrose alcoólica. Os portadores crônicos do vírus C correspondem a cerca de 1,5% da população (3,2 milhões de brasileiros).
O principal tratamento da doença hepática crônica terminal é o transplante hepático. Esses pacientes devem ser alocados em lista de espera para transplante quando a expectativa de vida conforme a historia natural da doença for menor que 90% em um ano, de acordo com o consenso da Sociedade Americana de Transplante e da Associação Americana para Estudo das Doenças do Fígado (LUCEY et al., 1997). As mais comuns indicações para transplante em adultos no mundo são infecção pelo vírus C e cirrose alcoólica (REYES; MAZARIEGOS, 1999; KEEFFE, 2001). Outras indicações são cirrose biliar primaria, hepatite auto-imune, hepatite crônica pelo vírus B, doenças metabólicas, carcinoma hepatocelular e falência hepática aguda.
A idéia de substituir um órgão doente por outro sadio, data do segundo século da era cristã, com o registro do milagre de São Cosme e São Damião que substituíram a perna necrosada de um cristão por a de um mouro morto em combate (NOTHEN, 2005).
Os transplantes de órgãos sólidos passaram a ser o tratamento de escolha para a doença renal, hepática, cardíaca e pulmonar, na sua fase final. A historia dos transplantes de órgãos sólidos iniciou-se com o desenvolvimento de técnicas de sutura vascular por Alexis Carrel no inicio do século XX (STARZL, 1993), que permitiram dessa forma que o sonho de transplantar órgãos pudesse se concretizar, dando a Aléxis Carrel o prêmio Nobel de medicina em 1912.Welch (1955) implantou um fígado heterotópico na pelve de um cão e Cannon (1956) implantou um fígado de maneira ortotópica também em cão, mas ambos sem sucesso.
1988). Tal fato foi comprovado pelo estudo das biopsias dos fígados transplantados (PORTER, 1969; SNOVER et al., 1984; DEMETRIS et al., 1985).
Starzl et al. (1963), em Denver, após oito anos do início dos estudos experimentais, realizaram o primeiro transplante de fígado em humano. O paciente era uma criança de 3 anos de idade portadora de atresia das vias biliares, tendo evoluído para óbito por sangramento durante o procedimento. Posteriormente, Starzl e sua equipe realizaram mais dois transplantes com sobrevida de 7 e 22 dias, respectivamente. (STARZL et al., 1963). Starzl et al. (1967) realizaram o primeiro transplante de fígado com sobrevida prolongada. A paciente era uma criança de 2 anos de idade, portadora de um colangiocarcinoma, sobrevivendo 1 ano e seis meses.
Em 1960, Peter Medawar, ganhou o Prêmio Nobel de Medicina por seus estudos relacionados com as bases imunológicas de rejeição da pele e a tolerância adquirida, abrindo espaços para diversos outros estudos em imunossupressão (MEDAWAR, 1944; MEDAWAR, 1945; BILLINGHAM et al., 1953).
Durante o período de 1967 a 1972, foram realizadas diversas tentativas de transplantes de fígado em todo o mundo. Como os resultados não eram satisfatórios, somente quatro grandes centros continuaram com seus programas de transplante: o serviço de Thomas Starzl, em Pittsburgh, nos Estados Unidos. O de Roy Calne, em Cambridge, na Inglaterra, o de Ruud Krom, em Gröningen, na Holanda, e o de Rudolf Pichlmayr, em Hannover, na Alemanha (STARZL et al., 1984; ROLLES et al., 1984; KROM et al., 1984; PICHLMAYR et al., 1984).
Em 1978, Calne introduziu na prática clínica a ciclosporina, uma nova droga imunossupressora, inicialmente usada em transplantes renais (CALNE et al., 1979). Strarzl et al.(1981) associaram a ciclosporina à prednisona e posteriormente à azatioprina, tendo
resultados animadores com os pacientes transplantados. No início da década de noventa surgiu então o FK506, inibidor de calcineurina como a ciclosporina, mas com maior potência, contribuindo para uma sobrevida de um ano maior que 90% (STARZL et al., 1989).
Em 1983 mais de 500 transplantes de fígado já haviam sido realizados. Assim sendo, o Governo Americano promoveu uma reunião em Washington, com o intuito de definir consensualmente aspectos controversos, passando o transplante de fígado a ser considerado um procedimento terapêutico e não mais experimental (National Intstitutes of Health Consensus Development Conference Statement, 1984). Por esse consenso, o transplante de fígado deveria
O surgimento de uma nova solução de preservação de órgãos: UW-Belzer, apresentada à comunidade científica em 1987 por Folkert Belzer da Universidade de Wisconsin (JAMIESON et al., 1988; KALAYOGLU et al., 1988), possibilitou a preservação do fígado por um tempo
bem maior, permitindo captação de enxertos em outras regiões, facilitando a programação cirúrgica(JAMIELSON et al., 1988).
Na América Latina, o primeiro transplante de fígado com sucesso foi realizado em 1985 no Hospital das Clínicas da Universidade de São Paulo pela equipe da Unidade de Fígado (MIES et al., 1998). A paciente tinha 20 anos, era portadora de um tumor primário de fígado, e teve boa evolução pós-operatória com sobrevida de 13 meses. A partir de então, a Unidade de Fígado do Hospital das Clinicas da Universidade de São Paulo (USP), passou a realizar o procedimento de maneira rotineira. Raia et al. (1989) descreveram o primeiro transplante intervivos de fígado do mundo com doador relacionado.
No Estado do Ceará, Brasil, a idéia de transplantar órgãos sólidos surgiu com o Professor Antonio Lacerda Machado. Em 1976, foi criado o Centro de Doenças Hepato-Renais do Hospital Universitário Walter Cantídio da Universidade Federal do Ceará, tendo sido realizado o primeiro transplante renal da Região Norte-Nordeste.
No inicio do ano 2000, foi iniciado, no Hospital Universitário Walter Cantídio (HUWC) da Universidade Federal do Ceará, um programa de transplante de fígado em suínos, etapa inicial no treinamento da equipe multidisciplinar. Em 18 de Maio de 2002, a equipe coordenada pelo Prof. José Huygens Parente Garcia realizou com sucesso o primeiro transplante de fígado do Estado do Ceará (GARCIA et al., 2005).
concluindo que a sobrevida do enxerto e do paciente permaneciam excelentes. Merion et al.(2005) após analisarem 12996 pacientes transplantados entre 2001 e 2003 nos Estados
Unidos da América, sugeriram que pacientes com baixo MELD (6-11) teriam sobrevida maior em um ano se não fossem transplantados; entretanto, se o MELD fosse maior que 18 o benéfico de um transplante de fígado era inquestionável. Dessa forma, em julho de 2006, o Ministério da Saúde do Brasil passou a adotar também o sistema MELD em substituição a ordem cronológica. A escassez de órgãos passou a ser a grande limitação dos transplantes, pois o transplante de fígado ainda é a única opção terapêutica para pacientes com doença hepática em estágio terminal. No ano 2000, segundo a UNOS (The United Network for Organ Sharing), foram realizados aproximadamente 4800 transplantes de fígado nos Estados Unidos, entretanto existiam mais de 17000 pacientes na fila de espera (BUSUTTIL; TANAKA, 2003). No ano de 2006, a proporção doador/receptor foi de 6000/20000 (1:3,3), com uma disparidade muito grande entre o número de transplantes necessários e os realizados, ocasionando altas taxas de mortalidade na fila de espera (CAMERON et al., 2006).
Devido a necessidade de aumentar a disponibilidade de órgãos, várias equipes transplantadoras iniciaram em seus programas transplantes alternativos ao transplante clássico proveniente de enxerto total de doador falecido. Instituíram de maneira rotineira o transplante intervivos, o “split-liver” (divisão anatômica do fígado de doador falecido para dois receptores), o transplante dominó (um paciente portador de Polineuropatia Amiloidótica Familiar recebe um fígado de um doador falecido e doa o seu a outro receptor) e o uso de enxertos provenientes de doadores falecidos com critérios expandidos (DCE) (BUSUTTIL; TANAKA et al., 2003).
A definição do DCE ainda não está bem estabelecida, mas conceitualmente é todo aquele doador que possua características que possam acarretar uma insuficiência hepática pós-transplante no receptor, seja uma Disfunção Primaria do Enxerto (DPE) ou uma Não Função do Enxerto (NFE) (CAMERON et al., 2006). Makowka et al. (1987) caracterizaram DPE como o pico sérico de AST maior que 1500U/L e/ou ALT maior que 1000U/L nos sete primeiros dias de pós-operatório, refletindo um mau funcionamento dos hepatócitos e lesão celular. A NFE é caracterizada pela necessidade de retransplante em até 72 horas pós-transplante, relacionada a função do enxerto.
resultados obtidos com a utilização de órgãos de DCE (OJO et al., 2001; DELMONICO; WYNN, 2002; PORT et al., 2002). O DCE é comumente chamado de “doador marginal”, palavra traduzida do inglês, que atualmente deve-se evitá-la, por trazer um tom pejorativo ao doador.
A incidência de DPE e NFE no transplante de fígado ocorre em mais de 20% dos pacientes (BROKELMAN et al., 1999). O receptor com DPE evolui com insuficiência funcional do fígado transplantado, podendo ter alterações clínicas e laboratoriais importantes. A DPE pode comprometer órgãos vitais, que entram em falência e favorecem infecções com evolução rápida para o óbito. A NFE tem quadro clinico de evolução catastrófica no receptor (coma, acidose metabólica, anúria, aumento persistente das enzimas hepáticas, distúrbios de coagulação), necessitando retransplante com urgência.
Vários estudos têm demonstrado variáveis responsáveis pela diminuição da função inicial do enxerto, podendo acarretar perda do enxerto e óbito do paciente (MOR et al., 1992; STRASBERG et al., 1994). Uma revisão da literatura mostrou que pelo menos 15 variáveis estão implicadas na DPE e NFE: idade do doador, sexo, raça, proporção peso doador receptor, compatibilidade sangüínea ABO, Classificação de Child-Turcotte-Pugh (Anexo B), causa da morte cerebral, tempo de internamento hospitalar, uso de drogas vasoativas, parada cardíaca antes da captação, alteração dos testes de função hepática, hipernatremia no doador, esteatose hepática, tempo de isquemia fria, tempo de isquemia quente, sorologias positivas para vírus C e B, idade e “status” clínicos do receptor (STRASBERG et al., 1994; AVOLIO, et al., 1999; CAMERON et al., 2006).
Nas últimas duas décadas, a idade dos doadores vem aumentando progressivamente. Em 1991, somente 13% dos doadores de fígado tinham mais de 50 anos; em 2001, esse número ultrapassou os 30% (OPTN, 2003). Diversos estudos têm demonstrado uma forte relação com idade do doador superior aos 50 anos e DPE, entretanto sem contra-indicar a doação (MOR et al., 1992; KARATZAS et al., 1997; BRICENO et al., 1997; GRANDE et al., 1998; OH et al.,
2000).
Figueras et al. (1996) sugeriram pela primeira vez, que níveis elevados de sódio (>155mEq/L) no sangue do doador, ocasionariam efeitos deletérios ao enxerto, entretanto sem contra-indicar o transplante.
A esteatose hepática tem sido encontrada nos doadores com uma freqüência de 9-26% (D’ALESSANDRO et al., 1991; LOINAZ; GONZALEZ, 2000). A obesidade, idade avançada, alcoolismo e diabetes mellitus estão relacionadas. Pacientes que receberam fígados com
esteatose apresentaram maior chance de NFE e DPE nas primeiras semanas pós-transplante (TODO et al., 1989; D’ALESSANDRO et al., 1991; ADAM et al., 1991; CHUI et al., 2000b).
Enxertos com mais de 60% de esteatose não devem ser usados, a não ser em casos de extrema urgência e como ponte para outro transplante (LOINAZ; GONZALEZ, 2000). Enxertos com 30-60% de esteatose podem ser usados, mas com cautela. Já os enxertos com menos de 30% de esteatose podem ser utilizados com segurança(BUSUTTIL; TANAKA, 2003).
O Tempo de Isquemia Fria (TIF) é iniciado na cirurgia de captação no momento em que a aorta é ocluida e o fígado é perfundido com soluções de preservação, até o momento em que o enxerto é retirado do acondicionamento hipotérmico e colocado sobre o campo cirúrgico do receptor. O Tempo de Isquemia Quente (TIQ) compreende o final do TIF até a reperfusão portal do enxerto do receptor. Quanto maior o TIF (principalmente após 10 horas), e o TIQ (principalmente após 45 minutos), menor a sobrevida do enxerto e do receptor (CAMERON et al., 2006). No transplante de fígado, o evento isquêmico termina com a reperfusão do órgão. Ao
restaurar o fluxo sangüíneo , impõe-se nova agressão ao fígado enxertado, agravando a lesão causada pelo período de isquemia. Esse fenômeno é conhecido como lesão de isquemia e reperfusão e envolve mecanismos e vias metabólicas celulares complexas, em que o resultado final poderá ser a disfunção do enxerto ( MIRANDA et al., 2004).
Atualmente, diversos trabalhos têm tentado introduzir o conceito de que há uma influência no somatório dos fatores de risco para DCE (MUENHLBACHER et al., 2005; CAMERON et al., 2006; FENG et al., 2006; MERION et al., 2006). Acredita-se que a quantificação do risco doador deve ser utilizada na alocação dos enxertos hepáticos (MERION et al., 2006). DCE com mais de três critérios contribuirão de forma significativa para DPE
(PORKONY et al., 2005). Castagneto et al.(2006) não aconselham o uso de enxertos provenientes de DCE em pacientes com MELD elevado (>25), pois há diminuição na sobrevida do enxerto e do receptor.
controlá-los, com conseqüente diminuição da perda dos enxertos e da morbidade e mortalidade dos receptores.
OBJETIVO
3 CASUÍSTICA E MÉTODO
Foram inicialmente avaliados 207 transplantes de fígado no Hospital Universitário Walter Cantídio da Universidade Federal do Ceará (HUWC/UFC), no período de maio de 2002 a dezembro de 2006. Após o emprego dos critérios de exclusão, permaneceram para este estudo 176 transplantes.
Todos os casos tiveram seus dados coletados e catalogados em fichas previamente padronizadas (Apêndice A e Apêndice B). O estudo foi de caráter prospectivo do tipo coorte histórico. O tempo de seguimento laboratorial foi de sete dias, enquanto para avaliação de infecção e mortalidade este período foi de 30 dias. Foram consideradas infecções hospitalares aquelas que ocorreram pelo menos 48 horas após realização do transplante de fígado.
A biópsia do enxerto foi realizada durante a cirurgia para captação de múltiplos órgãos em doador falecido com retirada de um fragmento com 0,5 cm de diâmetro do lobo esquerdo do fígado. O material foi submetido a processamento histológico e corado com hematoxilina/eosina. A mensuração do grau de esteatose do tipo macrovesicular nos enxertos foi dividida qualitativamente em esteatose leve (<30%), esteatose moderada (30-60%) e esteatose acentuada (>60%), sendo realizado pelo serviço de Anatomia Patológica da Universidade Federal do Ceará.
O projeto foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Walter Cantídio da Universidade Federal do Ceará sob o nº 005.06.01 (Apêndice C).
Foram coletados os seguintes dados do prontuário do receptor e do doador: 1. Fatores relacionados ao doador
- Parada cardiorrespiratória, uso de drogas vasoativas, idade, causa do óbito, níveis séricos de sódio, transaminases, grau de esteatose hepática, tempo de isquemia fria e quente do enxerto.
2. Fatores relacionados ao receptor
3.1 Critérios de exclusão
Foram excluídos da pesquisa todos os receptores que evoluíram para óbito nas primeiras 24 horas do transplante não relacionado com a função do enxerto, apresentaram trombose de artéria hepática ou veia porta nos primeiros sete dias de transplante com repercussão clinica e laboratorial. Foram excluídos também aqueles com coleta de dados incompleta e os que faziam parte de outros protocolos de estudo como o protocolo do projeto sódio. (20 doadores com sódio sérico > 155mEq/L tiveram seus enxertos lavados com dextrose a 5%) .
3.2 Cirurgia de captação de fígado
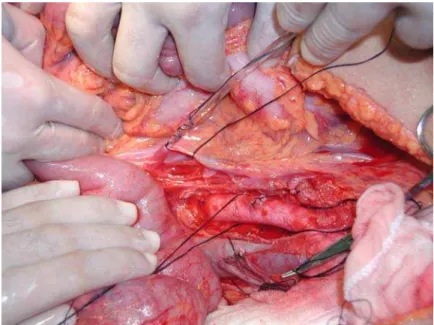
A cirurgia de captação de múltiplos órgãos foi iniciada com uma incisão mediana que se estendia da fúrcula esternal até a sínfise púbica do doador. O fígado era avaliado quanto a sua textura e coloração. Os ligamentos redondo, falciforme e triangular esquerdo eram seccionados. Palpava-se o hilo hepático com intuito de identificar a artéria hepática e suas possíveis variações anatômicas.
O cólon direito e o duodeno eram mobilizados até exposição da raiz da artéria mesentérica superior e da superfície anterior da veia cava infra-hepática e da aorta. A aorta distal era dissecada imediatamente acima da bifurcação das ilíacas, sendo a artéria mesentérica inferior ligada e seccionada. A aorta era circulada com fios de algodão. A veia cava infra-renal era então dissecada e reparada com fio algodão. A artéria mesentérica superior era dissecada e reparada com o intuito de se identificar variações anatômicas. Biópsia hepática era realizada de rotina. O pilar diafragmático direito era seccionado, para melhor exposição da aorta, que em seguida era reparada com fios. A veia mesentérica inferior era dissecada e reparada.
junção da veia cava com o átrio direito era seccionada na cavidade pericárdica para drenagem livre da solução de perfusão.
Figura 1 – Aorta, veia cava e veia mesentérica inferior dissecadas durante a captação de órgãos. A veia cava infra-renal era ligada e seccionada para facilitar a drenagem das soluções de preservação. Nessa ocasião, os órgãos abdominais envolvidos no processo de captação eram resfriados com gelo.
Após confirmação da viabilidade do enxerto caracterizada por uma perfusão homogênea e completa, a equipe cirúrgica era autorizada para iniciar a cirurgia do receptor.
A vesícula biliar era aberta e irrigada com ringer lactato gelado. Após o término da perfusão, o colédoco distal era seccionado. Em seguida, a artéria hepática era dissecada em direção da aorta com ligadura das artérias gastroduodenal, esplênica e gástrica esquerda. A artéria mesentérica superior era dissecada cerca de 3 centímetros distalmente à aorta com o intuito de localizar uma possível variação anatômica (artéria hepática direita ramo da artéria mesentérica superior). A aorta era seccionada logo acima das artérias renais e abaixo do diafragma. A veia cava infra-renal e supra-renal eram seccionadas. O enxerto hepático era retirado da cavidade abdominal com parte do diafragma direito. O Fígado era colocado em um recipiente de inox sobre dois sacos plásticos contendo gelo triturado. Iniciava-se uma nova perfusão do enxerto com 1000 ml de solução de Belzer, sendo 500 ml pela artéria hepática, 300 ml pela veia porta e 200 ml pelo colédoco.
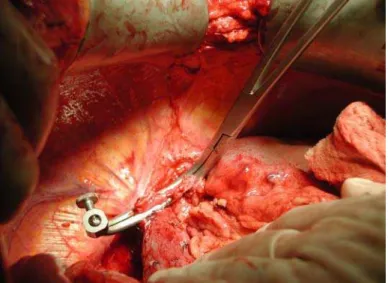
frênicas. A veia porta era separada do tecido conectivo até próximo à bifurcação. O tronco celíaco era dissecado até a artéria hepática comum, com ligadura das artérias esplênica e
gástrica esquerda (Figura
2).
Figura 2 – Cirurgia de banco com dissecção do tronco celíaco.
3.3 Hepatectomia do receptor e implante do enxerto
mais próximo possível do parênquima hepático após aposição de pinça vascular junto a veia cava. Uma pinça vascular longa e curva era posicionada no tronco da veia hepática média e esquerda, a qual era seccionada logo após a bifurcação, com retirada do órgão. Neste momento, procedia-se a hemostasia rigorosa do leito hepático e retroperitônio. Em seguida, uma pinça vascular especifica longa e curva era posicionada transversalmente a cava com o cabo voltado para a esquerda, ocluindo, assim, as três veias hepáticas (Figura 3). Uma trava de segurança era posicionada na extremidade desta pinça, para evitar que durante o manuseio houvesse acidentes graves, como embolia gasosa e hemorragias, ocasionados pelo deslocamento desta pinça. Fazia-se então, uma abertura comum na junção da veia hepática média e esquerda e da veia cava em direção a veia hepática direita.
Figura 3 – Pinça Vascular ocluindo as três veias hepáticas
vasculares, realizava-se colecistectomia seguida de reconstrução da via biliar principal através de anastomose término-terminal sem dreno.
3.4 Imunossupressão
Após revascularização do fígado pela veia porta era administrado por via intravenosa 1,0 g de metilprednisolona. No pós-operatório, a maioria dos pacientes era mantida com esquema de imunossupressão duplo baseado em tacrolimus e prednisona. Os níveis desejados do tacrolimus eram entre 10 e 15 ng/ml no primeiro mês. Caso o paciente apresentasse nefrotoxicidade (creatinina > 1,5mg/dl) pelo tacrolimus, a dose do mesmo era diminuída em 50% , sendo associado micofenolato mofetil.
3.5 Exames de controle no pós-operatório
Durante os primeiros dias de pós-operatório (PO), o paciente era avaliado pelo nível de consciência, capacidade de síntese dos fatores de coagulação, níveis de bilirrubina, níveis de transaminases, hemograma, plaquetas, glicemia, uréia, creatinina, sódio, cloro, potássio, cálcio iônico, magnésio, gama-glutamiltransferase e fosfatase alcalina. Estes testes eram solicitados diariamente nos primeiros sete dias de transplante. Os níveis séricos de tacrolimus eram aferidos 3 vezes por semana.
O Ultra-som abdominal era realizado em todos os pacientes pelo menos uma vez durante o internamento com o intuito de avaliar vasos hepáticos, vias biliares e a presença de coleções abdominais.
3.6 Critérios para diagnóstico de Disfunção Primária do Enxerto (DPE) e Não Função do
Enxerto (NFE)
3.7 Critérios de alta hospitalar
A alta hospitalar ocorria no mínimo com sete dias de pós-operatório após normalização da função hepática, ausência de sinais clínicos e laboratoriais de rejeição aguda e sem sinais de infecção.
3.8 Tratamento Estatístico
3.8.1 Variáveis de desfecho analisadas foram as seguintes:
- Evolução enzimática padrão – pacientes que durante os sete primeiros dias de pós-operatório não tiveram elevação da AST > 1500 U\L e/ou elevação da ALT > 1000 U\L.
- Disfunção Primaria do Enxerto – elevação da AST >1500U\L e/ou elevação da ALT >1000U\L nos primeiros sete dias de pós-operatório.
- Não Função do Enxerto – Necessidade de retransplante ou óbito nas primeiras 72 horas relacionada com insuficiência hepática.
- Óbito em 30 dias
3.8.2 Variáveis analisadas
As variáveis relacionadas aos doadores foram: - Ordenadas
- Idade em anos
- Transaminases hepáticas AST e ALT (U\L) - Sódio sérico (mEq/L)
- Dicotômicas
- Uso de drogas vasoativas - Grau de esteatose hepática
- Presença de parada cardiorrespiratória previamente a captação - Idade do doador maior que 55 anos
- Sódio sérico maior que 155 mEq/L
As variáveis relacionadas aos receptores foram: - Ordenadas
- Idade em anos - Escore MELD
- Tempo de isquemia fria em minutos - Tempo de isquemia quente em minutos - Dicotômicas
- Escore MELD maior que 25
- Tempo de isquemia fria maior que 600 minutos - Tempo de Isquemia quente maior que 55 minutos
As variáveis dicotômicas: idade doador maior que 55 anos, sódio sérico maior que 155 mEq/L, transaminases hepáticas (AST e ALT) maior que 150U/L, MELD maior que 25, tempo de isquemia fria maior que 600 minutos e tempo de isquemia quente maior que 55 minutos foram adotadas como valor de corte após revisão da literatura consultada.
3.9 Análise estatística
Considerando a não normalidade da amostra, após realização do teste de Komolgorov-Smirnov, foi utilizado o teste de correlação de Spearman (rs) para análise de correlação bivariada dos dados dos doadores e receptores com a evolução das transaminases hepáticas no pós-operatório. Também foi utilizado o teste do Qui-quadrado para complementar a análise das variáveis dicotômicas. O valor do p bicaudal foi considerado significante com 95% de probabilidade alfa ( *p < 0,05) para rejeitar a hipótese de nulidade. Foi utilizado o programa Graphpad Prism versão 4.0.
Coeficiente de Correlação de Spearman (rs)
Valor de (rs) Interpretação
rs = 0 não há correlação entre as variáveis
-1 > rs > 0 uma variável aumenta e a outra diminui rs = -1.0 correlação inversa entre as variáveis
4 RESULTADOS
4.1 Características da população estudada
Durante o período de maio de 2002 a dezembro de 2006, foram realizados no Hospital Universitário Walter Cantídio 207 transplantes de fígado, sendo 206 com doadores falecidos e 1 com doador vivo. Dos 207 transplantes, foram excluídos da amostra 31 (15%) transplantes devido a diversos fatores (Tabela 1).
Tabela 1 - Transplantes excluídos do estudo
Transplantes excluídos do estudo Número de
transplantes
Protocolo sódio 20
Trombose artéria hepática com repercussão clinica 4
Dados incompletos 2
Sangramento pós-operatório imediato 1
Outros 4 Fizeram parte do estudo 176 transplantes, que apresentavam como principal indicação
para o transplante a hepatopatia crônica pelo vírus C (39%) e a cirrose alcoólica ( 28%) (Tabela 2 e Tabela 3).
A maioria dos receptores era do sexo masculino (72,5%). A média de idade dos receptores era de 48,8 anos, variando de 11 a 68 anos.
A distribuição pela classificação de Child-Turcotte-Pugh para doenças hepáticas crônicas se comportou da seguinte maneira: Child A 17 (10%), Child B 96 (56%) Child C 55 (34%) (Gráfico 1 – Apêndice D). Oito pacientes não se enquadravam nesta classificação por apresentarem hepatite aguda fulminante.
A incidência de retransplante foi de 5% (9), sendo 7 casos devido a trombose de artéria hepática, 1 caso por não função do enxerto e 1 caso por disfunção do enxerto. A incidência geral de trombose da artéria hepática foi de 4%.
Tabela 2 – Causas de indicação de transplante hepático
Causas de indicação do transplante de fígado Número
de pacientes
Hepatopatia crônica pelo vírus C 36
Hepatopatia crônica pelo vírus C associados ao hepatocarcinoma 19 Hepatopatia crônica pelo vírus C associado a cirrose alcoólica 14
Cirrose alcoólica 37
Hepatopatia crônica pelo vírus B 11
Hepatopatia crônica pelo vírus B associado ao hepatocarcinoma 2
Cirrose criptogênica 17
Hepatite aguda fulminante 8
Trombose de artéria hepática 6
Colangite esclerosante primária 4
Cirrose biliar primária 3
Hepatite autoimune 3
Hepatopatia crônica por doença de Wilson 2
Hepatocarcinoma sem cirrose 2
Cirrose ductopênica 1
Cirrose biliar secundaria 1
Cirrose colestatica idiopatica 1
Síndrome hepato-pulmonar 1
Metástase de tumor carcinóide 1
Glicogenolise 1
Esteato hepatite não alcoólica 1
Hemocromatose com hepatocarcinoma 1
DPE seguido de NFE 1
Doença de Caroli 1
Hepatopatia crônica pelo vírus C e vírus B 1 Hepatopatia crônica pelo vírus B e vírus D 1
Total de Pacientes 176
Tabela 3 – Prevalência da indicação do transplante hepático(%)
Prevalência (%)
Hepatopatia crônica pelo vírus C 39%
Cirrose alcoólica 28%
Hepatocarcinoma 13%
Cirrose criptogênica 10%
Hepatopatia crônica pelo vírus B 8%
Hepatite aguda fulminante 4%
Trombose de artéria hepática 4%
Colangite esclerosante primária 2%
Hepatite autoimne 2%
Outros 10%
A mortalidade após o transplante de fígado em 30 dias foi de 14%, tendo como principais causas de óbito a disfunção primaria do enxerto seguido de infecção grave, a não função do enxerto e a trombose de artéria hepática (Tabela 4).
Tabela 4 – Causa do óbito após o transplante de fígado em 30 dias
Causa do óbito Número de
pacientes (%)
Disfunção Primária do Enxerto 11(6%)
Não Função do Enxerto 6(3,25%)
Trombose de Artéria Hepática 2(1,%)
Trombose de Veia Porta 1(0,5%)
Outros motivos 6(3,25%)
Mortalidade em 30 dias 26/176 (14%)
Cinqüenta e quatro por cento dos transplantes apresentaram evolução enzimática padrão, 43% evoluíram com disfunção primaria do enxerto e 3% com não função do enxerto. A mortalidade em 30 dias dos pacientes com evolução enzimática padrão foi de 5%; dos pacientes com DPE foi 19,7% e dos pacientes com NFE foi de 100%. Os pacientes que evoluíram no pós-operatório com DPE e NFE tiveram 3,69 vezes mais chances de óbito em 30 dias que os pacientes que tiveram evolução padrão (Tabela 5).
Tabela 5 – Mortalidade pós-operatório em 30 dias dos pacientes que evoluíram com DPE/NFE .
Variável Risco
Relativo
Intervalo de
Confiança (95%)
P
Mortalidade em 30 dias dos pacientes com DPE/NFE
3,69 2,54 – 5,36 < 0,001
4.2 Variáveis relacionadas aos doadores e receptores
Com relação aos doadores, foram 175 doadores falecidos e 1 doador vivo. Cento e vinte doadores (68%) eram do sexo masculino e 56 (32%) do sexo feminino. A média de idade dos doadores era de 34 anos e 6 meses, variando de 2 a 68 anos (Gráfico 3 – Apêndice F).
A principal causa de óbito dos doadores foi traumatismo crânio encefálico em 112 (65%), acidente vascular cerebral em 52 (30%), tumor de sistema nervoso central em 5 (2%) e outras causas em 6 (3%) (Gráfico 4 – Apendice G).
Em relação ao uso de drogas vasoativas como dopamina e noradrenalina, 107(61%) doadores utilizavam pelo menos uma droga, 64(36%) duas drogas e 5(3%) não utilizavam nenhuma droga (Gráfico 5 – Apêndice H).
Quando avaliado o grau de esteatose hepática dos enxertos, 162 (93%) enxertos apresentavam esteatose < 30%, 10 (5%) enxertos entre 30-60% e 4(2%) com mais de 60% de esteatose (Gráfico 6 – Apêndice I)
As variáveis ordenadas relacionadas aos doadores encontram-se na tabela 6 e as dicotômicas na tabela 7.
Tabela 6 – Variáveis ordenadas dos 176 doadores de fígado – média, mediana e erro padrão
Variável Média Mediana Erro
Padrão
Idade (anos) AST (U\L) ALT (U\L)
Sódio sérico (mEq/L)
34,56 85,76 63,03 152,7
31 56 42 151
Tabela 7 – Varáveis dicotômicas dos 176 doadores de fígado – número e proporção
Variável Número Proporção
Uso de Drogas Vasoativas
Sim 171 97,2%
Não 5 2,8%
Grau de Esteatose Hepática > 30%
Sim 15 8,5%
Não 161 91,5%
Grau de Esteatose Hepática
< 30% 162 92,2%
30-60% 10 5,6%
> 60% 4 2,2%
Presença de Parada Cardiorrespiratória
Sim 31 17,6%
Não 145 82,4%
Idade do doador > 55 anos
Sim 14 7,9%
Não 162 92,1%
Sódio sérico >155mEq/L
Sim 72 40,9%
Não 104 59,1%
AST > 150U/L
Sim 25 14,2%
Não 151 85,8%
ALT > 150U/L
Sim 13 7,3%
Não 163 92,7%
Tabela 8 – Variáveis ordenadas dos 176 receptores de fígado – média, mediana e erro padrão
Variável Média Mediana Erro
Padrão
Idade (anos) MELD
Tempo de Isquemia Fria (min) Evolução Padrão (n = 94) DPE/NFE ( n = 82) Tempo de Isquemia Quente (min) Evolução Padrão ( n = 94) DPE/NFE (n = 92)
48,81 16,4 390,7 361,2 424,2* 53,99 51,41 56,95* 52 16 360 350 380 50 50 55 1,01 0,54 8,59 8,79 14,64 1,39 1,46 2,44 * p < 0,05, quando foram comparados o TIF e o TIQ dos pacientes que tiveram evolução padrão com os que apresentaram DPE/NFE.
Quando comparado os TIF do grupo com evolução enzimática padrão ao grupo que evoluiu com DPE/NFE houve significância estatística (TIF evolução padrão: 361,2+8,79; TIF DPE/NFE: 424,2+14,64*, p < 0,05). Em relação ao TIQ, houve também diferença significativa entre o grupo com evolução padrão e o grupo com DPE/NFE (TIF evolução padrão: 51,41+1,46; TIQ DPE/NFE: 56,95+2,44*, p < 0,05) (Gráfico 8 – Apêndice K) (Gráfico 9 – Apêndice L).
Tabela 9 – Evolução AST no pós-operatório nos 176 receptores de fígado – média, mediana e erro padrão
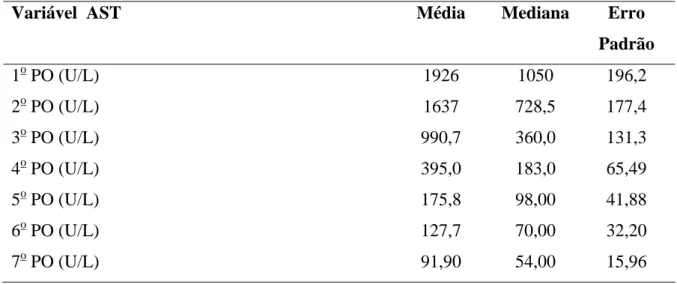
Variável AST Média Mediana Erro
Padrão
1o PO (U/L) 2o PO (U/L) 3o PO (U/L) 4o PO (U/L) 5o PO (U/L) 6o PO (U/L) 7o PO (U/L)
Tabela 10 – Evolução ALT no pós-operatório nos 176 receptores de fígado – média, mediana e erro padrão
Variável ALT Média Mediana Erro
Padrão
1o PO (U/L) 2o PO (U/L) 3o PO (U/L) 4o PO (U/L) 5o PO (U/L) 6o PO (U/L) 7o PO (U/L)
1197 1090 827,0 477,2 320,8 255,4 218,6 722,0 546,0 356,0 239,5 150,0 142,5 115,5 118,7 101,1 90,47 54,08 32,37 26,64 24,84
As variáveis dicotômicas relacionadas aos receptores encontram-se na tabela 11.
Tabela 11 – Variáveis dicotômicas dos 176 receptores de fígado – número e proporção
Variável Número Proporção
MELD > 25
Sim 9 5,1%
Não 159 90,4%
Hepatite Fulminante 8 4,5%
Tempo de isquemia fria > 600 minutos
Sim 10 5,6%
Não 166 94,4%
Tempo de Isquemia quente > 55 minutos
Sim 71 40,3%
Não 105 59,7%
Tabela 12 – Variáveis dicotômicas relacionadas aos receptores analisadas para DPE/NFE nos 176 transplantes
Variável Risco Relativo Intervalo de Confiança (95%) p
MELD > 25 0,99 0,5873 - 1,673 0,97
TIF > 600 minutos 2,77 0,7960 - 9,647 0,02*
TIQ > 55 minutos 1,48 1,081 - 2,046 0,009*
* p < 0,05
Tabela 13 – Variáveis dicotômicas relacionadas aos doadores analisadas para DPE/NFE nos 176 transplantes
Variável Risco
Relativo
Intervalo de Confiança
(95%)
p
Uso de Drogas Vasoativas 0,74 0,2518 - 2,195 0,54 Grau de Esteatose Hepática > 30% 2,82 1,018 - 7,848 0,006* Presença de Parada Cardiorrespiratória 0,90 0,6444 - 1,264 0,56 Idade do doador > 55 anos 0,69 0,5074 – 0,9424 0,06
Sódio > 155mEq/L 1,28 0,9494 - 1,725 0,09
AST > 150U/L 1,03 0,6881 - 1,546 0,87
ALT > 150U/L 0,99 0,5873 - 1,673 0,97
* p < 0,05
Quando aplicado o teste de correlação (Sperman r) entre a idade dos doadores e a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, não foi evidenciada significância estatística (Tabela 14 e Tabela 15).
Tabela 14 – Idade dos doadores correlacionada com a evolução de AST no pós-operatório dos 176 transplantes
Variável Sperman (rs) P
Tabela 15 – Idade dos doadores correlacionada com a evolução de ALT no pós-operatório dos 176 transplantes
Variável Sperman (rs) P
IDADE x 1o PO ALT (U/L) -0,01752 0,8185 IDADE x 2o PO ALT (U/L) 0,01868 0,8078 IDADE x 3o PO ALT (U/L) 0,03022 0,6948 IDADE x 4o PO ALT (U/L) 0,02966 0,7010 IDADE x 5o PO ALT (U/L) 0,04200 0,5877 IDADE x 6o PO ALT (U/L) 0,04473 0,5648 IDADE x 7o PO ALT (U/L) 0,02628 0,7352
Quando aplicado o teste de correlação Sperman (rs) entre o sódio sérico dos doadores e a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, não foi evidenciada significância estatística (Tabela 16 e Tabela 17).
Tabela 16 – Sódio sérico dos doadores correlacionado com a evolução de AST no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
Tabela 17 – Sódio sérico dos doadores correlacionado com evolução de ALT no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
SÓDIO (mEq/L) x 1o PO ALT (U/L) -0,0007469 0,9922 SÓDIO (mEq/L) x 2o PO ALT (U/L) -0,06826 0,3736 SÓDIO (mEq/L) x 3o PO ALT (U/L) -0,06045 0,4322 SÓDIO (mEq/L) x 4o PO ALT (U/L) -0,04277 0,5797 SÓDIO (mEq/L) x 5o PO ALT (U/L) -0,01317 0,8651 SÓDIO (mEq/L) x 6o PO ALT (U/L) -0,03135 0,6867 SÓDIO (mEq/L) x 7o PO ALT (U/L) -0,02152 0,7819
Quando aplicado o teste de correlação Sperman (rs) entre a idade dos receptores e a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, não foi evidenciada significância estatística (Tabela 18 e Tabela 19).
Tabela 18 – Idade dos receptores correlacionada com evolução de AST no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
Tabela 19 – Idade dos receptores correlacionada com evolução de ALT no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
IDADE x 1o PO ALT (U/L) -0,1092 0,1513 IDADE x 2o PO ALT (U/L) -0,09774 0,2021 IDADE x 3o PO ALT (U/L) -0,08908 0,2466 IDADE x 4o PO ALT (U/L) -0,1054 0,1712 IDADE x 5o PO ALT (U/L) -0,08903 0,2497 IDADE x 6o PO ALT (U/L) -0,1040 0,1797 IDADE x 7o PO ALT (U/L) -0,09599 0,2158
Quando aplicado o teste de correlação (Sperman r) entre o MELD do receptor e a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, não foi evidenciada significância estatística (Tabela 20 e Tabela 21).
Tabela 20 – MELD dos receptores correlacionado com evolução de AST no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
MELD x 1o PO AST (U/L) -0,03285 0,6744 MELD x 2o PO AST (U/L) -0,08632 0,2717 MELD x 3o PO AST (U/L) -0,06932 0,3793 MELD x 4o PO AST (U/L) -0,02995 0,7060
MELD x 5o PO AST (U/L) -0,0255 0,7478
MELD x 6o PO AST (U/L) 0,05921 0,4556
Tabela 21 – MELD dos receptores correlacionado com evolução de ALT no pós-operatório dos 176 transplantes
Variável Sperman (rs) p
MELD x 1o PO ALT (U/L) -0,002980 0,9696 MELD x 2o PO ALT (U/L) -0,07700 0,3271 MELD x 3o PO ALT (U/L) -0,1007 0,2011
MELD x 4o PO ALT (U/L) -0,1345 0,0879
MELD x 5o PO ALT (U/L) -0,07862 0,3215 MELD x 6o PO ALT (U/L) -0,08942 0,2608 MELD x 7o PO ALT (U/L) -0,06845 0,3898
A avaliação da correlação pelo Teste de Sperman r do TIF em minutos com a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, revelou significância estatística no 1o PO, 2o PO, 3o PO, 4o PO, 6o PO e 7o PO para AST. Em relação a ALT houve significância estatística no 1o PO, 2o PO, 3o PO, 4o PO, 5o PO, 6o PO e 7o PO (Tabela 22 e Tabela 23).
Tabela 22 – Tempo de Isquemia Fria (TIF) dos receptores correlacionado com evolução de AST no pós-operatório nos 176 transplantes
Variável Sperman (rs) p
Tabela 23 – Tempo de Isquemia Fria (TIF) dos receptores correlacionado com evolução enzimática da ALT no pós-operatório nos 176 transplantes
Variável Sperman (rs) p
TIF (min) x 1o PO ALT (U/L) 0,1768 0,0196* TIF (min) x 2o PO ALT (U/L) 0,1793 0,0186* TIF (min) x 3o PO ALT (U/L) 0,2052 0,0071* TIF (min) x 4o PO ALT (U/L) 0,1829 0,0170* TIF (min) x 5o PO ALT (U/L) 0,1815 0,0182* TIF (min) x 6o PO ALT (U/L) 0,2249 0,0034* TIF (min) x 7o PO ALT (U/L) 0,2087 0,0066* * p < 0,05
A avaliação da correlação pelo Teste de Sperman r do TIQ em minutos com a evolução das transaminases hepáticas do primeiro ao sétimo pós-operatório, revelou significância estatística no 1o PO, 5o PO, 6o PO e 7o PO para AST. Em relação a ALT houve significância estatística no 1o PO (Tabela 24 e Tabela 25).
Tabela 24 – Tempo de Isquemia Quente (TIQ) dos receptores correlacionado com a evolução de AST no pós-operatório nos 176 transplantes
Variável Sperman (rs) P
Tabela 25 – Tempo de Isquemia Quente (TIQ) dos receptores correlacionado com a evolução de ALT no pós-operatório nos 176 transplantes
Variável Sperman (rs) p
5 DISCUSSÃO
O transplante de fígado, atualmente, é o único tratamento curativo para pacientes portadores de hepatopatia crônica terminal e falência hepática aguda. A sobrevida em 5 anos tem sido superior a 80% nos grandes centros transplantadores. Os excelentes resultados obtidos com o transplante de fígado se devem ao refinamento da técnica cirúrgica, ao aprimoramento da anestesia, à otimização dos cuidados pós-operatórios e aos novos imunossupressores (FEIERMAN et al., 2004; STEADMAN, 2004; STARZL et al., 2005; MOORE et al., 2005; JAIN et al., 2005; KLUPP et al., 2005). Entretanto, a desproporção entre o número de doadores e de receptores na lista de espera continua a crescer de forma progressiva, acarretando altas taxas de mortalidade (UNOS, 2000).
Em cinco anos, foram realizados mais de 240 transplantes de fígado pela equipe de transplantes do HUWC/UFC, sendo atualmente uma das principais do Brasil. Apesar do crescente aumento das listas de espera nos últimos anos, não houve aumento do número de doadores falecidos. Em 2006, houve cerca de 6 doadores por milhão de habitantes no Brasil, número insuficiente para atender a demanda crescente. Dados da Organização Mundial da Saúde apontam para a necessidade de 20 a 30 doadores de fígado por milhão de habitantes por ano (ABTO, 2007).
Dados recentes do Hospital Universitário Walter Cantídio da Universidade Federal do Ceará revelaram que a mortalidade na fila de espera ultrapassou 30% (BRASIL et al, 2006). Por este motivo, vários centros têm utilizado doadores com critérios expandidos como estratégia para minimizar a mortalidade em lista de espera (TECTOR et al, 2006).
O transplante hepático, por ser um procedimento de alta complexidade, possui altas taxas de morbidade e mortalidade. Os pacientes podem evoluir com disfunção primária do enxerto, não função do enxerto, trombose de artéria hepática, rejeição aguda, rejeição crônica, recidiva da infecção do enxerto pelo vírus B ou C, recidiva de neoplasias, óbito intra-operatório por sangramento, etc(MONGE et al., 2002).
Diversos fatores vinculados às características dos doadores, ao trans-operatório e aos receptores podem implicar em disfunção primária do enxerto e até na não função do enxerto. Neste estudo, foram avaliados os fatores que poderiam contribuir para que o paciente evoluísse com DPE ou NFE.
mesmas proporções da literatura mundial (UNOS, 2007). A média de idade dos receptores foi de 48,8 anos com prevalência do sexo masculino. Noventa por cento dos receptores eram Child B ou C, demonstrando assim que esses pacientes só tinham nessa fase de suas vidas o transplante como única opção terapêutica.
Em julho de 2006, o Ministério da Saúde do Brasil adotou o escore MELD para alocar os pacientes na lista de espera, mudando da forma cronológica para o modelo de gravidade. Um estudo multicêntrico, que se encontra em andamento no Brasil, foi apresentado com dados parciais no último congresso da ABTO em setembro de 2007, sugerindo que a mudança para critério MELD não teve impacto na mortalidade na lista de espera, como também não aumentou a mortalidade pós-operatória.
Avolio et al.(2006) concluíram que pacientes com MELD acima de 25 tinham maior risco de óbito após o transplante quando os enxertos eram provenientes de DCE. O MELD médio dos receptores do presente estudo foi de 16,4, tendo apenas nove pacientes MELD superior a 25. O escore maior que 25 não foi fator de risco para DPE/NFE, provavelmente porque 95% dos pacientes apresentavam escore menor que 25. Tal fato pode ser explicado pela implantação do sistema MELD no Brasil em julho de 2006 e pela maior parte dos transplantes desta casuística terem sido realizados antes deste período (era pré MELD). Dados ainda não publicados da Universidade Federal do Ceará revelam que o MELD médio atual dos pacientes transplantados é de 23,5, demonstrando que os pacientes atuais são mais graves.
A incidência de retransplante hepático foi de 5%, tendo como principal causa a trombose de artéria hepática. Busuttil et al. (2005) relataram 3200 transplantes com taxa de retransplante >10%. É possível que a incidência do HUWC /UFC tenha sido menor por falta de doadores para realizar o retransplante de urgência em tempo hábil.
encefálico como principal causa de óbito (65%). A média e idade dos doadores de fígado nos Estados Unidos é de 42 anos e na Espanha 45 anos (UNOS, 2007, CUENDE et al., 2005).
Receptores que recebem órgãos de doadores com prolongado tempo de hipotensão têm maior chance de perda do enxerto pós-transplante, principalmente aqueles que receberam altas doses de drogas vasoativas (MIMEAULT et al., 1989; OPELZ; WUJCIAK, 1994; MARKMANN et al., 2001). Por outro lado, Busuttil et al. (2005) demonstraram que PCR e o uso de drogas vasoativas não influenciaram de forma isolada no risco de mortalidade ou sobrevida em 60 meses nos receptores. No presente estudo, o uso de drogas vasoativas como noradrenalina e dopamina e a parada cardiorrespiratória (PCR) nos doadores previamente à cirurgia de captação, não apresentaram impacto na incidência de DPE/NFE. 97% dos doadores usaram pelo menos uma droga vasoativa e 17% tiveram PCR antes da captação. É importante ressaltar que o uso de drogas vasoativas foi muito alto, talvez pelo fato do processo de doação e captação ser por demais extendido.
Schemmer et a.l (2007) consideraram transaminases do doador três vezes acima do valor normal como fator de risco para DPE/NFE. Entretanto, concluíram que AST e ALT nestes valores elevados não favoreceram DPE/NFE. No presente estudo, foi estabelecido um ponto de corte de AST e ALT maior que 150U/L, não tendo sido evidenciado risco relativo aumentado para DPE/NFE.
O nível sérico de sódio do doador tem sido implicado como fator de risco para DPE/NFE em diversos trabalhos (STRASBERG et al., 1994; FIGUERAS et al., 1996; SCHEMMER et al., 2007). Avolio et al. (1991) sugeriram pela primeira vez, que a hipernatremia do doador tinha impacto adverso na evolução das enzimas hepáticas no pós-operatório do receptor. Gonzalez et al.(1994) demonstraram em análise multivariável de 187 pacientes que há correlação entre sódio
encontrando alteração hepática relacionada com esta anormalidade. Tector et al. (2006) analisaram o uso de doadores falecidos com critérios expandidos em 571 transplantes e demonstraram que doadores com sódio elevado (>170mEq/L) não representavam risco para NFE ou DPE, sugerindo que doadores com sódio sérico elevado não sejam considerados como doadores com critérios expandidos. No presente estudo, a análise univariada do sódio sérico >155mEq/L não foi fator de risco para que o receptor evoluísse com NFE ou DPE. Tal fato foi previamente validado em 2005 na Universidade da Califórnia, onde foram avaliados 3200 transplantes e não houve evidências de que o sódio sérico elevado do doador poderia ser um fator de risco para má evolução do enxerto. As razões pelas quais a hipernatremia não interferiu na função do enxerto dos receptores permanecem incertas, mas é possível que o aprimoramento das técnicas cirúrgicas e o manejo mais adequado do doador na unidade de terapia intensiva tenham contribuído (BUSUTTIL et al., 2005).
O enxerto ideal é aquele proveniente de um doador entre 18 e 40 anos com morte cerebral causada por traumatismo crânio-encefálico (FENG, 2005). No entanto, a idade dos doadores tem aumentado significativamente em todo o mundo. Em 1991, 13% dos doadores falecidos tinham mais de 50 anos; 10 anos depois, esses doadores superam os 30% (OPTN, 2001). Na década passada, o número de doadores nos Estados Unidos da América com idade superior a 50 anos mais do que dobrou, passando de 844 em 1994 para 1867 em 2003 (DELMONICO et al., 2005). Inicialmente, doadores com idade superior a 50 anos têm sido associados com disfunção primária do enxerto. Entretanto, outros estudos têm demonstrado que doadores com mais de 50 anos, que não apresentam outros fatores para DPE, têm em seus enxertos sobrevida comparada a de doadores jovens, não representando assim contra-indicação absoluta para doação do fígado (WALL et al., 1990; MOR et al., 1992; KARATZAS et al., 1997; BRICENO et al., 1997; OH et al., 2000) . Doadores com mais de 70 anos, entretanto, tem sido associados com alta taxa de perda de enxertos e receptores (BUSQUETS et al., 2001) O risco relativo de perda do enxerto aumenta com a idade, pois fígados de doadores com 60 a 69 anos e maior que 70 anos possuem risco relativo de perda do enxerto de 1,49 e 1,88 respectivamente (FENG, 2005). Cameron et al.(2005) sugeriram que fígados provenientes de doadores idosos devem ser usados com cautela se outros fatores de risco forem concomitantes. O tempo de isquemia fria deve ser minimizado e esses enxertos devem ser evitados em pacientes com cirrose por vírus C (ANGELICO et al, 2005; AVOLIO et al, 2005).
fato se deve talvez pela alta taxa de reserva funcional do fígado, grande capacidade de regeneração e necessidades metabólicas (POPPER, 1986). Fígados provenientes de doadores com mais de 50 anos de idade apresentam maior susceptibilidade a lesões endoteliais, a isquemia fria e a diminuição da síntese de ATP após reperfusão, podendo influenciar de forma negativa na capacidade de regeneração do fígado. Outro fato interessante é que doadores com idade elevada têm maior incidência de esteatose hepática, podendo contribuir de forma direta na lesão celular durante a fase de isquemia fria (KIMURA et al., 1996).
No presente estudo, não foi encontrado significado estatístico quando aplicado teste de correlação entre a idade do doador e a evolução enzimática no pós-operatório, mesmo quando estabelecido idade de corte de 55 anos para cálculo do risco relativo de DPE/NFE. A idade dos doadores não teve correlação com a curva enzimática no pós-operatório, provavelmente devido a baixa idade dos doadores, quando comparado aos doadores americanos e europeus.
A esteatose hepática está presente em 9 a 26 % dos doadores de fígado (D’ALESSANDRO et al, 1991; LOINAZ;GONZALEZ, 2000). É ocasionada por diversos fatores como obesidade, idade avançada, alcoolismo, diabetes mellitus e alterações nutricionais pós-morte encefálica. A esteatose hepática pode ser dividida em microvesicular ou macrovesicular, dependendo do padrão de armazenamento lipídico no citoplasma celular. Recentes estudos têm demonstrado que o fígado com esteatose microvesicular não é fator de risco para o desenvolvimento de DPE/NFE nos receptores (FISHBEIN et al., 1997; URENA et al., 1998; BRICENO et al., 2000; ROSSI et al., 2001). Os fígados esteatóticos, do padrão
contribuem para a função inadequada dos fígados esteatóticos (THURMAN et al., 1995). A migração dos leucócitos e aderência ao endotélio vascular parece ser o evento desencadeador da lesão de isquemia-reperfusão, estando associada a três classes de moléculas de adesão: selectinas, integrinas e globulinas imune. As selectinas recrutam os leucócitos e as plaquetas na fase inicial, favorecendo o rolamento pelo endotélio vascular (SAWAYA et al., 1999). A lesão de isquemia e reperfusão é um evento dinâmico que inclui a produção de radicais livres, ativação das células de Kupffer e Ito e adesão de plaquetas e leucócitos. Todos esses eventos resultam na diminuição do fluxo sanguíneo sinusoidal, apoptose de células endoteliais, necrose celular e dano aos hepatócitos (BUSUTTIL; TANAKA et al, 2003).
No presente estudo, o grau de esteatose hepática do tipo macrovesicular < 30% foi encontrado em 92,2% dos enxertos; 5,6% dos enxertos apresentavam 30-60% de esteatose e 2,2% mais de 60% de esteatose. Todos os enxertos (n = 4) com grau de esteatose maior que 60% evoluíram com DPE(n = 3) ou NFE(n = 1). O teste de Qui-quadrado foi significante com p < 0,05 para DPE/NFE quando o enxerto apresentava mais de 30% de esteatose. Assim sendo, estes resultados são semelhantes aos da literatura, sugerindo que esteatose hepática maior que 30% no enxerto pode ser um fator de risco para DPE/NFE.
Estudos experimentais sugerem que os diferentes tipos de células hepáticas se comportam de maneira diferente frente a um insulto isquêmico, sendo as células sinusoidais do endotélio mais susceptíveis a isquemia fria (MCKEOWN et al., 1988; CALDWELL et al., 1991; IKEDA et al., 1992). O prolongado tempo de isquemia fria é um dos principais fatores responsáveis por dano ao enxerto (BRICENO et al., 2002). Enxertos com mais de 14 horas de isquemia fria evoluem com lesão maior nos hepatócitos, acarretando aumento do tempo de internamento hospitalar, complicações biliares e diminuição da sobrevida do enxerto (PLOEG et al., 1993; PIRATVISUTH et al, 1995; HOOFNAGLE et al., 1996; BRICENO et al., 2002).