“
ESTUDO DAS RELAÇÕES EN TRE
I MUN I DADE HUMORAL E CARGA
PARASI TÁRI A EM CÃES
N ATURALMEN TE I N FECTADOS POR
Leishm ania ( Leishm ania) infant um chagasi
”
Ouro Pret o – M G
“ESTUDO DAS RELAÇÕES EN TRE I MUN I DADE
HUMORAL E CARGA PARASI TÁRI A EM
CÃES N ATURALMEN TE I N FECTADOS POR
Leishm ania ( Leishm ania) infantum chagasi
”
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Biológicas do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como requisito parcial para a obtenção do título de Mestre em Ciências – Área de Concentração em Imunoparasitologia.
Orient ador: Dr. Alexandre Barbosa Reis Laboratório de Imunopatologia
Núcleo de Pesquisas em Ciências Biológicas / UFOP
Co- orient adora: Dra. Célia Maria Ferreira Gontijo Laboratório de Leishmanioses
Instituto René Rachou / FIOCRUZ
Catalogação: sisbin@sisbin.ufop.br
T266e Teixeira Neto, Rafael Gonçalves.
Estudo das relações entre imunidade humoral e carga parasitária em cães naturalmente infectados por Leishmania infantum chagasi [manuscrito] / Rafael
Gonçalves Teixeira Neto. - 2008. x, 101 f.: il., color; graf., tabs.
Orientador: Prof. Dr. Alexandre Barbosa Reis.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Área de concentração: Imunobiologia de protozoários.
1. Leishmaniose - Teses. 2. Imunoglobinas - Teses. 3. Carga parasitária -
Teses. I. Universidade Federal de Ouro Preto. II. Título.
DRA.CLÁUDIA MARTINS CARNEIROI
DR.RICARDO WAGNER DE ALMEIDA VITORII DR.RODOLFO CORDEIRO GIUNCHETTII MS.WENDEL COURA VITALII
MS.PATRÍCIA FLÁVIA QUARESMAIII ICHENRIQUE GAMA KERI
ICSHELER MARTINS DE SOUZAI
I – LABORATÓRIO DE IMUNOPATOLOGIA – NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS - NUPEB/UFOP
II – DEPARTAMENTO DE PARASITOLOGIA - INSTITUTO DE CIÊNCIAS BIOLÓGICAS -UNIVERSIDADE FEDERAL DE MINAS GERAIS –ICB/UFMG III – LABORATÓRIO DE LEISHMANIOSES – INSTITUTO RENÉ RACHOU – FIOCRUZ/MG
Apoio
UFOP – Universidade Federal de Ouro Preto
I RR – Instituto René Rachou
UFMG – Universidade Federal de Minas Gerais
Aos meus Pais
Romeu e Eliana
Aos meus irmãos
Vanessa, Janaína e Victor
A minha “vida”
“As falhas entram na composição das
virtudes, como os venenos na composição
dos remédios”
Ao Prof. Dr. Alexandre Barbosa Reis, m eu orient ador, por t er m e acolhido em seu laborat ório, pela am izade const ruída durante o m estrado, agradeço os conselhos e ensinam ent os. Você soube m e incent ivar e m e frear nos m om entos cert os e m e m ost rou a im port ância de sem pre desenvolver um t rabalho sério. Meus sinceros agradecim ent os.
À Prof. Dra. Célia Maria Ferreira Gontij o, m inha orient adora, você que nunca deixou de acredit ar na m inha capacidade, seu espírit o m at erno dem onst ra o carinho que t em pelos seus alunos. Agradeço sinceram ent e por t udo e espero que possam os t rabalhar j unt os por m uit os anos.
À Prof. Dra. Cláudia Mart ins Carneiro, pela am izade e paciência. Obrigado pelo apoio em m uitos m om ent os difíceis, seus conselhos foram essenciais e m e aj udaram a m ant er a calm a.
Ao Prof. Dr. Ricardo Wagner de Alm eida Vitor e à Rosa, obrigado pelo auxílio indispensável para realização dos t est es de avidez. A aj uda de vocês engrandeceu m uit o est e t rabalho.
Ao am igo e colaborador Rodolfo, obrigado pela aj uda nos t rabalhos de cam po e na const rução do art igo.
Ao am igo Wendel, agradeço pela aula prat ica de ELI SA, sua experiência aj udou m uit o na realização do proj et o.
À Pat rícia, agradeço pelas dicas indispensáveis nos procedim ent os de biologia m olecular e pela grande am izade const ruída durant e est es anos.
Aos alunos de I C Henrique e Sheler, obrigado pelo t em po que disponibilizaram para a realização deste proj eto, a aj uda de vocês foi indispensável.
Ao Prof. Dr. Eduardo Sérgio da Silva, por t er m e encam inhado na carreira de pesquisador.
conversas.
Aos am igos do Laborat ório de Pat ologia da UFOP: Am anda, Paula, Raquel, Nádia, Jú, Rodolfo, Rodrigo, Bruno, Sam uel, Wendel, Henrique, Ana, Sheler, Carol e Jerusa. Obrigado pela am izade e pelos bons m om ent os j unt os. Um abraço especial para Paula e Nádia por m e acolherem quando precisei.
Aos am igos de Laborat ório de Leishm anioses de I RR: Dani, Karla, Érika, Gust avo Paz, Gustavo Mayr, Ricardo, Leco, Shara, Jú, Lú m uit o obrigado pela am izade de t odos vocês.
Obrigado especialm ent e aos am igos da “ salinha” : Eduardo, Pat y, Tina, Cynt hia, Filipe e Lut i. Espero que nossa am izade dure por t oda a vida.
À Dona Alda Lim a Falcão, pelas boas conversas e pelo exem plo de vida.
Às secret árias do NUPEB e do Laborat ório de Leishm anioses do René, Cida e Lú. Obrigado pela am izade e pelo apoio em t odos os m om entos que precisei de vocês.
À Maria, t écnica do Laborat ório de I m unopat ologia agradeço pela at enção e aj uda indispensável para a realização dest e proj et o.
Aos funcionários do Cent ro de Cont role de Zoonoses da Prefeit ura de Belo Horizont e: Maria do Carm o, Adam ast or e Kólia obrigado por disponibilizar o seu est abelecim ent o, t em po e funcionários, e pelos anim ais doent es que foram a font e de est udo para o desenvolvim ento dest e t rabalho.
Aos m ot orist as do I RR, por seus serviços prest ados durant e o período de colet a do m at erial de cam po.
Aos am igos e colegas do m est rado com quem vivi m om ent os de est udo e descontração. Muito obrigado a t odos.
À Anna Carolina Lust osa Lim a pela aj uda na análise est at íst ica dos dados.
Aos cães que foram sacrificados para o desenvolvim ento deste t rabalho.
deixaram de acredit ar na m inha capacidade. Obrigado pela am izade.
Aos Tios, Tias, Prim os, Prim as e m inha avó que t orceram pelo bom desenvolvim ent o dest e t rabalho e pelo m eu sucesso.
Aos m eus Pais, Rom eu e Eliana e aos m eus irm ãos Vanessa, Janaína e Vict or, pelo am or, com preensão e apoio incondicional, vocês são os pilares que m e sust ent am . Tenho orgulho de fazer part e dest a fam ília.
À Grazielly, exem plo de dedicação e am or incondicional. Você m e com pleta. Te am o.
A Deus, que colocou em m inha vida pessoas m aravilhosas com o todos vocês. Obrigado por est arem sem pre present e nos m om ent os bons ou ruins.
SUMÁRI O
List a de Tabelas _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ I V List a de Figuras _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ V List a de Abreviat uras _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ VI I Resum o_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ I X Abst ract _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ X I nt rodução _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ XI
1 . Leishm aniose visceral _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2
2 . Leishm aniose Visceral Canina ( LVC) _ _ _ _ _ _ _ _ _ _ _ _ _ _ 7
2.1. Aspectos Imunopatológicos na LVC _________________ 11 2.2. Teste de Avidez na LVC __________________________ 15 2.3. Densidade parasitária e resposta imune na LVC. _______ 15
Just ifica t iva _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 1 7 Obj et ivos _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 1 9 1 . Obj et ivo Geral _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 0 2 . Obj et ivos específicos _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 0 Mat eriais e Mét odos _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 1 1 . Anim ais _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 2
2 . Caract erização Clínica dos Anim ais _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 2
3 . Colet a Das Am ost ras Biológicas. _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 3
4 . Ext ração de DN A das am ost ras biológicas _ _ _ _ _ _ _ _ _ 2 4
4.1. Sangue periférico total e medula óssea ______________ 25 4.2. Amostras de Fígado e Baço _______________________ 25 4.3. Amostras de Pele e Linfonodo______________________ 26
5 . Dosagem das am ost ras de DN A _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 7
6 . Diagnóst ico m olecular e caract erização
espécie-específica._ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 2 7
6.1. PCR para o gênero Leishmania _____________________ 27 6.2. PCR-RFLP _____________________________________ 28
7 . Técnica de quant ificação da carga parasit ária _ _ _ _ _ _ 2 9
8 . ELI SA isot ipos e ELI SA avidez _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 3 1
8.1. Pesquisa de anticorpos através do teste imunoenzimático (ELISA)___________________________________________ 31 8.2. Teste de Avidez de IgG através da técnica de ELISA ____ 32
1 . Classificação Clínica dos anim ais _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 3 6 2 . Dosagem do DN A _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 3 7
3 . Confirm ação da infecção por L. infa nt um chagasi at ravés
da PCR- RFLP _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 3 7
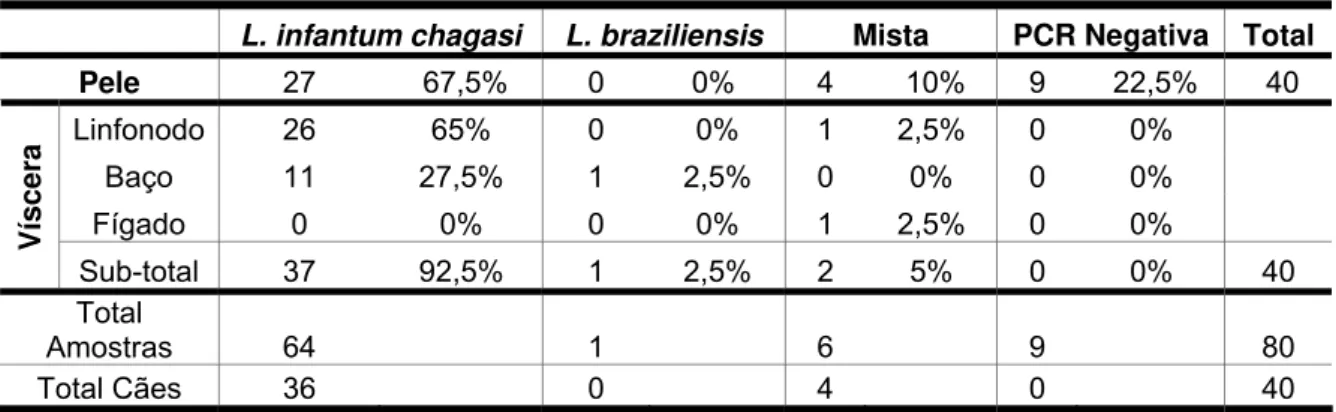
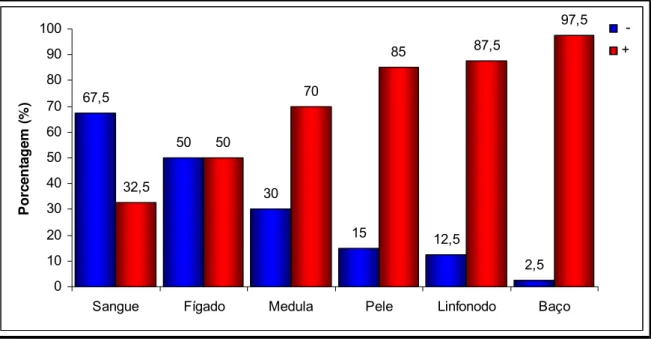
4 . PCR para o gênero Leishm ania _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 3 9
4.1. Positividade da PCR de acordo com a forma clínica _____ 40 4.2. Comparação entre a PCR e método parasitológico
convencional ______________________________________ 43
5 . Quant ificação da densidade parasit ária at ravés da
t écnica Leishm an Donovan Unit s ( LDU) _ _ _ _ _ _ _ _ _ _ _ _ _ _ 4 4
6 . Avaliação dos perfis de im unoglobulinas em cães
nat uralm ent e infect ados por leishm ania infant um chagasi 4 7
6.1. Reatividade de IgG, IgG1 e IgG2 em relação a forma clínica
47
6.2. Carga parasitária X reatividade de IgG, IgG1 e IgG2 ____ 48
6.3. Análise da correlação entre reatividade de imunoglobulinas e carga parasitária nos diferentes grupos de cães ___________ 51
7 . Avaliação da avidez de I gGt ot al em relação à form a
clínica e à carga parasit ária _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 5 2
7.1. Avidez de IgGem relação à forma clínica apresentada pelo cão 52
7.2. Carga parasitária X avidez de IgG __________________ 54
Discussão _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 5 6 1 . Aspect os Clínicos da LVC _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 6 0
2 . I dent ificação da espécie de Leishm ania at ravés da
PCR-RFLP _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 6 2
3 . A PCR com o Ferra m ent a de diagnóst ico na LVC_ _ _ _ _ 6 4
4 . Avaliação da carga parasit ária na pele e no baço de cães
nat uralm ent e infect ados _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 6 7
5 . Avaliação do perfil das subclasses de I gG ( I gG1 e I gG2)
na LVC _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 6 9
6 . Avaliação da avidez de I gG na LVC _ _ _ _ _ _ _ _ _ _ _ _ _ _ 7 2
Conclusões _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 7 4 Apêndice _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 7 7
1 . Soluções para ELI SA convencional e avidez. _ _ _ _ _ _ _ 7 8
1.7. Solução de PBS/Tween com uréia 6M________________ 79
Anexo _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 8 0
1 . Ficha clínica epidem iológica canina _ _ _ _ _ _ _ _ _ _ _ _ _ _ 8 1
2 . Padronização da t écnica de ELI SA _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 8 2
3 . Esboço da divisão da placa de ELI SA para realização do
t est e de avidez _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 8 3
4 . Correlação ent re a reat ividade de I g e a LDU no baço e
LI STA DE TABELAS
Tabela 1 : Enzimas de restrição e tamanho dos fragmentos obtidos
após a digestão do kDNA das espécies L. am azonensis, L. braziliensis e L. infant um chagasi.___________________________________ 28
Tabela 2 : Painel de anticorpos anti-Ig de cão utilizados no protocolo
de ELISA Isotipos. ______________________________________ 31
Tabela 3 : Identificação da espécie de Leishm ania através da
PCR-RFLP em amostras de diferentes tecidos de cães naturalmente infectados. ____________________________________________ 38
Tabela 4 : Resultados da PCR em diferentes tecidos de cães
naturalmente infectados por L. i. chagasi portadores das formas clínicas polares da LVC. __________________________________ 39
Tabela 5 : Comparação do resultado da PCR entre as diferentes
amostras clínicas dos 40 cães naturalmente infectados por L. infant um chagasi. ______________________________________ 40
Tabela 6 : Número de tecidos positivos na PCR para o gênero
Leishm ania de acordo com a forma clínica apresentada pelo animal. ____________________________________________________ 41
Tabela 7 : Comparação do resultado da PCR entre as diferentes
amostras clínicas dos cães assintomáticos.___________________ 42
Tabela 8 : Comparação do resultado da PCR entre as diferentes
amostras clínicas dos cães sintomáticos com sorologia positiva para
L. infant um chagasi. ____________________________________ 43
Tabela 9 : Comparação da sensibilidade do método parasitológico
direto e da PCR em amostras de cães assintomáticos e sintomáticos. ____________________________________________________ 44
Tabela 1 0 : Densidade parasitária no baço e na pele dos animais com
LI STA DE FI GURAS
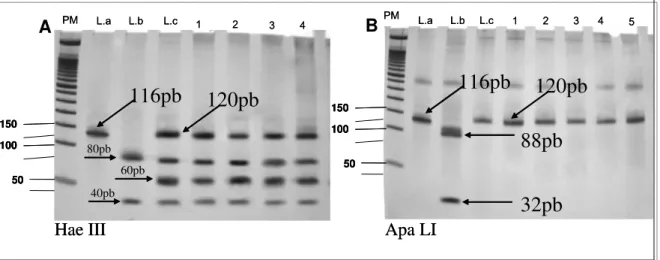
Figura 1 : Perfil de digestão do fragmento de 120pb do kDNA de
Leishm ania spp pelas enzimas Hae III (A) e APA LI (B). ________ 29
Figura 2 : Fotografia de lâmina de pele (ponta de orelha) realizada
por aposição corada por GIEMSA. Campo apresentando macrófagos densamente parasitados (aumento 1500X). __________________ 31
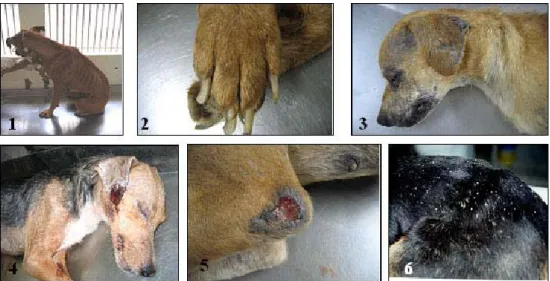
Figura 3 : Sinais clínicos observados nos cães provenientes do
CCZ-BH.__________________________________________________ 37
Figura 4 : Perfis de bandas gerados após a digestão do produto
amplificado utilizando a enzima Apa LI na PCR-RFLP. __________ 38
Figura 5 : Porcentagem de cães positivos na PCR para o gênero
Leishm ania de acordo com os diversos tecidos avaliados. _______ 40
Figura 6 : Porcentagem de cães positivos na PCR para o gênero
Leishm ania de acordo com os diversos tecidos avaliados em cães assintomáticos. ________________________________________ 42
Figura 7 : Porcentagem de cães positivos na PCR para o gênero
Leishm ania de acordo com os diversos tecidos avaliados em cães sintomáticos. __________________________________________ 43
Figura 8 : Comparação entre a carga parasitária no baço (A) e na
pele (B) de animais com as formas clínicas polares da LVC. _____ 46
Figura 9 : Distribuição de cães com as formas clínicas polares da LVC
de acordo com a carga parasitária nas amostras de Pele (A) (p=0,006) e Baço (B) (p = 0,102)._________________________ 46
Figura 1 0 : Presença de IgG (A), IgG1 (B) e IgG2 (C) em soros de
cães naturalmente infectados por L. infant um chagasi em relação aos animais não infectados.__________________________________ 47
Figura 1 1 : Presença de IgG (A), IgG1 (B) e IgG2 (C) em soros de
cães naturalmente infectados por L. infant um chagasi e portadores de diferentes formas clínicas.________________________________ 48
Figura 1 2 : Reatividade de IgG, IgG1 e IgG2 no soro de cães
naturalmente infectados por L. infant um chagasi com diferentes cargas parasitárias avaliadas pelo LDU nas amostras de pele e baço.
Figura 1 3 : Correlação entre os valores de LDU no baço e a reatividade de IgG (A) e IgG2 (B) no soro de cães assintomáticos
naturalmente infectados por L. infant um chagasi. _____________ 51
Figura 1 4 : Correlação entre os valores de LDU no baço e a
reatividade de IgG (A) e IgG2 (B) no soro do grupo total de cães
naturalmente infectados por L. infant um chagasi. _____________ 51
Figura 1 5 : Correlação entre os valores de LDU no baço e a
reatividade de IgG1 no soro de cães naturalmente infectados por L. infant um chagasi. ______________________________________ 52
Figura 1 6 : Avidez de IgG no soro de cães experimentalmente
infectados por L. infant um chagasi com diferentes tempos de infecção. _____________________________________________ 53
Figura 1 7 : Índice de Avidez de IgG em soros de cães assintomáticos
e sintomáticos. ________________________________________ 53
Figura 1 8 : Avidez de IgG em soros de cães com diferentes graus de
parasitismo no Baço (A) e na Pele (B). ______________________ 54
Figura 1 9 : Correlação entre o Indice de Avidez (IA) de IgG e os
LI STA DE ABREVI ATURAS
µg - Micrograma µl - Microlitro
AP - Alto Parasitismo
Apa LI - Enzima de restrição utilizado na PRC-RFLP BP - Baixo Parasitismo
CA - Cães Assintomáticos CC - Cães controle
CCZ-BH - Centro de Controle de Zoonoses de Belo Horizonte
CD4 + - Marcador de superfície celular da subpopulação de linfócitos T auxiliar
CD8 + - Marcador de superfície celular da subpopulação de linfócitos T citotóxico
CR1 - Receptor 1 do complemento CR3 - Receptor 3 do complemento CS - Cães Sintomáticos
DAT - Teste de aglutinação direta DNA - Ácido Desoxirribonucléico DO - Densidade Óptica
ELISA - Enzim e Lynked I m m unosorbent Assay
fg - Fentograma
gp 63 - Glicoproteína de 63 KD
Hae III - Enzima de restrição utilizado na PRC-RFLP IA - Índice de Avidez
Ig - Imunoglobulina
IgA - Imunoglobulina da classe A IgE - Imunoglobulina da classe E IgG - Imunoglobulina da classe G
IgG1 - Imunoglobulina da subclasse G1 IgG2 - Imunoglobulina da subclasse G2 IgM - Imunoglobulina da classe M
IL-5 - Interleucina 5 INF-γ - Interferon gama kDNA - DNA de Cinetoplasto LDU - Leishm an Donovam Unit s
LPG - Lipofosfoglicano
LTA - Leishmaniose Tegumentar Americana LV - Leishmaniose Visceral
LVC - Leishmaniose Visceral Canina M - Molar
mg - Miligrama mL - Mililitro mm - Milimetro mM - Milimolar
MP - Médio Parasitismo
n - Número de cães por amostra ng - Nanograma
nm - Nanômetro
NNN - Meio de cultura Novy- McNeal- Nicole
NO - Não Observado pb - Pares de Base
PCR – Polym erase chain react ion
PCR-RFLP - Polym erase chain react ion - Rest rict ion Fragm ent Lengt h Polym orphism
pH - Potencial Hidrogeniônico PM - Peso Molecular
RIFI - Reação de Imunofluorescência Indireta rpm - Rotação por minuto
SMF - Sistema Mononuclear Fagocitário SRD - Sem raça definida
Th1 - Células TCD4 + secretoras de citocinas do padrão 1 (IL-2 e
INF-γ)
Th2 - Células TCD4 + secretoras de citocinas do padrão 2 (4, IL-5,IL-6 e IL-10)
RESUM O
No presente estudo foi avaliado um grupo de 45 cães composto de animais não infectados e naturalmente infectados por L. infantum chagasi (identificação através da PCR-RFLP). Após avaliação clínica os animais foram divididos em três grupos: Cães controle (CC), cães assintomáticos (CA) e cães sintomáticos (CS). Foi avaliada a carga parasitária nas amostras de pele e baço destes animais através da técnica de quantificação “Leishman Donovan Units” (LDU). De acordo com densidade parasitária separamos os animais nos seguintes grupos: baixo parasitismo (BP), médio parasitismo (MP) e alto parasitismo (AP). Neste contexto estudamos o índice de positividade da PCR em diferentes amostras clínicas, o perfil da resposta humoral (IgG e suas subclasses IgG1 e IgG2) e a avidez de IgGtotal com relação à forma clínica e ao
parasitismo apresentado pelo cão. A análise dos resultados da PCR mostrou que não houve diferença estatística na positividade da reação entre os grupos com diferentes formas clínicas. Os animais foram positivos em pelo menos dois tecidos avaliados e as amostras clínicas com melhor desempenho seguiram a seguinte ordem: baço, linfonodo, pele, medula óssea, fígado e sangue. Com relação ao parasitismo tecidual foi observada diferença estatística significante na carga parasitária das amostras de pele ao compararmos os grupos CA e CS (p=0,0011). Em ambos tecidos onde foi avaliada a carga parasitária observou-se que no grupo CA houve um maior número de animais com baixo parasitismo, já no grupo CS a maioria dos animais apresentava alto parasitismo. A avaliação do perfil de Ig mostrou que os níveis séricos de IgG1 apresentavam-se mais elevados nos animais
assintomáticos, sugerindo uma possível associação com mecanismos imunoprotetores da infecção, por outro lado os níveis séricos de IgG2
parecem estar associados com a presença de sintomas na LVC. Correlacionando o perfil de Ig com a carga parasitária, foi constatado que à medida que aumentava a intensidade parasitária (baço e pele) os valores de IgG e IgG2 também subiam. Observamos também uma
correlação negativa entre os valores de IgG1 e a densidade parasitária
no baço. O índice de avidez (IA) de IgGtotal nos animais sintomáticos foi
mais alto quando comparado ao IA dos animais assintomáticos. Além disso, animais mais parasitados tanto no baço quanto na pele possuem maior IA que os animais com baixo parasitismo. Com base nestes achados sugerimos que a LVC se inicia a partir de uma forma clínica assintomática, com baixo parasitismo, alta produção de IgG1 e baixa
afinidade das moléculas de IgGtotal evoluindo para uma forma clínica
sintomática, com maior densidade parasitária, níveis de IgG2 mais
elevados e alta afinidade de IgGtotal. Além disso, confirmamos a eficácia
ABSTRACT
In the present study, a group of 45 dogs composed of uninfected and naturally infected animals with L. infantum chagasi (identification by means of PCR-RFLP) was evaluated. Following clinical evaluation, the animals were divided into three groups: Uninfected dogs (UD), asymptomatic dogs (AD), and symptomatic dogs (SD). The parasitary burden was assessed taken into account samples of the skin and spleen of those animals, by using the quantification technique “Leishman Donovan Units” (LDU). According to the parasitary burden, the animals were separated into the following groups: low parasitism (LP), median parasitism (MP), and high parasitism (HP). In this context, we studied the positivity index of PCR using different clinical samples, the profile of the humoral response (IgG and its sub-classes IgG1 and IgG2), as well as
the IgGtotal avidity in relation to the clinical form and the parasitism
presented by the dog. Analysis of the results obtained by means of PCR showed that there was no significant statistical difference related to the reaction positivity among the groups with different clinical forms. The animals were found to be positive in at least two of the evaluated tissues, and the clinical samples showing the best results were as follows: spleen, lymph node, skin, bone marrow, liver and blood, respectively. In relation to the tecidual parasitism, a significant statistical difference could be observed in the parasitary burden of the skin samples, when the groups AD and SD were compared (p = 0.0011). In both tissues used to evaluate the parasitary burden, it could be observed that in the group AD there was a higher number of animals with low parasitism, whereas in the group SD the great majority of the animals presented high parasitism. Evaluation of the Ig profile showed that the seric levels of IgG1 were higher in the asymptomatic animals,
suggesting a possible association with immunoprotector mechanisms of the infection. On the other hand, the seric levels of IgG2 seem to be
associated with the presence of symptoms in the Canine Visceral Leishmaniasis (CVL). Correlating the Ig profile with the parasitary burden, it was observed that the more intense the parasitary burden was (spleen and skin), higher were the IgG and IgG2 values too. We
also observed a negative correlation between the IgG1 values and the
parasitary density in the spleen as well. The avidity index (AI) of IgGtotal
in the symptomatic animals was higher, when compared with the AI of the asymptomatic animals. Moreover, the animals with a higher parasitary burden either in the spleen or skin showed a higher avidity index than the animals with lower parasitism. Based on these findings, we suggest that CVL commences with an asymptomatic clinical form with low parasitism, high production of IgG1 and low affinity of the
IgGtotal molecules, evolving to a symptomatic clinical form, with higher
parasitism intensity, higher IgG2 levels, and high affinity of IgGtotal.
1 . LEI SH M AN I OSE VI SCERAL
A leishmaniose visceral (LV) possui uma grande importância em saúde pública devido a sua ampla distribuição e alta letalidade, principalmente em crianças desnutridas, idosos, pacientes portadores de co-infecção com o vírus da imunodeficiência humana (HIV) e em pacientes não tratados (HOMMEL et al., 1995; GUERIN et al., 2002; WHO, 2004).
É uma doença zoonótica e antroponótica de grande significância médica e veterinária causada por protozoários tripanossomatídeos do gênero Leishm ania (ROSS, 1903), pertencentes ao complexo
Leishm ania ( Leishm ania) donovani (LAINSON & SHAW, 1987). Neste
complexo agrupam-se três espécies: Leishm ania ( Leishm ania) donovani (LAVERAN & MESNIL, 1903), que é o agente causador de
antroponose na Índia e regiões da África; L. ( L.) infant um (NICOLE, 1908) encontrada em áreas do continente asiático, africano e europeu, e a Leishm ania ( L.) chagasi (CUNHA &CHAGAS, 1937) que é o agente etiológico da zoonose no Novo Mundo.
A inclusão da L. chagasi no complexo L. ( L.) donovani é amplamente aceita embora sua identificação taxonômica e origem no novo mundo sejam uma questão polêmica e muito discutida desde seu descobrimento em 1937 por CUNHA & CHAGAS, que caracterizaram a Leishm ania ( L.) chagasi como uma nova espécie responsável pela doença nas Américas. Existem controvérsias se o agente etiológico da LVA foi recentemente introduzido no Novo Mundo na época da colonização européia - e neste caso deveria ser classificado como L.
infant um - ou se ele tem uma origem antiga, tendo sido introduzido
juntamente com os canídeos na América do Sul há milhões de anos e deveria ser classificado como L. chagasi.
chagasi e L. infantum são muito semelhantes, e por esta razão alguns
autores acreditam que os parasitos são de uma única espécie com origem recente nas Américas (KILLICK-KENDRICK et al., 1985; GRIMALDI JR. et al., 1987; RIOUX et al., 1990; MAURÍCIO et al., 2000). LAINSON E RANGEL, (2005) baseados em diferenças observadas nas técnicas de RFLP e kDNA (JACKSON et al.; 1984, 1986) têm usado a nomenclatura
L. L. infant um infant um e L. L. infant um chagasi, sugerindo que a
separação taxonômica dos parasitos poderia ser no nível subespecífico. Por outro lado, DANTAS-TORRES, (2006) acredita que L.
chagasi e L. infant um devem ser consideradas espécies sinônimas
sem que haja mudança no nome no nível de subespécie, pois isso implicaria em toda uma reclassificação do gênero Leishm ania. Contudo, SHAW, (2006) comenta que de acordo com o código da Comissão Internacional de Nomenclatura em zoologia, os nomes L. L. infant um infant um e L. L. infant um chagasi seriam absolutamente
corretos. Neste estudo iremos seguir a nomenclatura Leishm ania ( Leishm ania) infant um chagasi sugerida por LAINSON & RANGEL, (2005)
para tratar do agente etiológico da leishmaniose visceral no Novo Mundo.
Estes protozoários são parasitos intracelulares obrigatórios do sistema mononuclear fagocitário (SMF) dos hospedeiros vertebrados (onde são encontradas formas arredondadas, denominadas amastigotas) e do tubo digestivo do inseto vetor (onde são observadas as formas flageladas denominadas promastigotas) (WHO, 2004).
LV clássica apresentam febre, hepatoesplenomegalia, perda de peso, linfoadenopatia, anemia e leucopenia (BADARÓ et al., 1986).
A leishmaniose visceral (LV) é a mais devastadora entre as formas clínicas de leishmaniose, estimam-se 500.000 novos casos da doença e 59.000 mortes todos os anos (DESJEUX, 2004; WHO 2004). A LV possui um amplo espectro epidemiológico podendo ocorrer em regiões de clima tropical, subtropical e temperado, (DEANE & DEANE., 1962; ALVAR et al., 2004). É endêmica em 87 países sendo 66 no velho mundo e 21 no novo mundo. Porém, aproximadamente 90% dos casos notificados ocorrem na Índia, Sudão, Bangladesh, Nepal e no Brasil (WHO, 2005).
Nas Américas, a LV humana ocorre desde o sul do México até o norte da Argentina sendo o Brasil responsável por 90% dos casos ocorridos no continente americano (MONTEIRO et al., 1994). Observa-se que 19 das 27 unidades federativas já registraram casos da doença com aproximadamente 1.600 municípios apresentando transmissão autóctone. A LV atinge as cinco regiões brasileiras e sua
maior incidência encontra-se no Nordeste, com aproximadamente
70% do total de casos notificados, seguido pela região Sudeste,
Norte, e, finalmente, a região Centro-Oeste. No Brasil, registra-se em
média cerca de 3.500 casos de LV/ano e a incidência é de 20,4 casos/100.000 habitantes, em algumas localidades de estados nordestinos, como Piauí, Maranhão e Bahia (Manual de LV, MS, 2007).
periferias. Assim, observou-se no início da década de 80 um surto epidêmico em Teresina (PI) e, de lá para cá, já foram diagnosticados casos autóctones em São Luís (MA), Fortaleza (CE), Natal (RN), Aracajú (SE), Belo Horizonte (MG), Santarém (PA), Corumbá (MS), Campo Grande (MS), Palmas (TO) e Araçatuba (SP). A região metropolitana de Belo Horizonte é um bom exemplo desse processo de urbanização, onde o grande crescimento populacional, a susceptibilidade da população à infecção e a adaptação do vetor ao ambiente urbano levaram a um crescimento no número de municípios com notificações de LV, indicando uma ampliação da taxa de transmissão da doença nestas áreas nos últimos anos (CUNHA et al., 1995; PROFETA DA LUZ et al., 2001; SILVA et al., 2001ª; GONTIJO & MELO, 2004).
A transmissão do agente etiológico da LV junto ao hospedeiro vertebrado ocorre através da picada de fêmeas de flebotomíneos (Díptera: Psychodidae; Phlebot om inae) pertencentes ao gênero
Phlebot om us no velho mundo e Lut zom yia no novo mundo (KILLICK
-KENDRICK, 1999). A infecção do inseto vetor ocorre no momento do repasto sanguíneo. Ao picarem um animal infectado, estes insetos sugam juntamente com o sangue formas amastigotas que após atingirem o tubo digestivo se transformam em promastigotas e se multiplicam intensamente. Em seguida, as formas promastigotas migram para as partes anteriores do tubo digestivo possibilitando que ao realizar um novo repasto o vetor possa regurgitar as formas promastigotas metacíclicas infectantes. Estas são internalizadas por células do SMF, principalmente os macrófagos. Este processo envolve a ligação de moléculas de superfície dos parasitos como o lipofosfoglicano (LPG) e a glicoproteína de 63 KD (gp 63), a receptores expressos na superfície de macrófagos, incluindo os receptores 1 e 3 do complemento (CR1 e CR3), receptor manose-fucose e receptor de fibronectina (GREEN et al., 1994; BRITTINGHARM et
tornando-se arredondados ou ovóides e então passam a ser denominados de amastigotas, formas que residem no interior dos fagolisossomos, onde sobrevivem e se multiplicam.
Alguns macrófagos infectados se rompem e liberam as amastigotas, que são então internalizadas por macrófagos vizinhos. Durante um novo repasto sangüíneo, o inseto vetor ingere macrófagos infectados com amastigotas de Leishm ania, reiniciando assim, o ciclo no hospedeiro invertebrado.
No Brasil a principal espécie de flebótomo incriminada na transmissão da LV é a Lut zom yia longipalpis, cuja distribuição se superpõe às áreas endêmicas da doença (LAINSON &RANGEL,2005).
Animais silvestres principalmente as raposas Dusicyon vet ulus e
Cerdocyon t hous são considerados os principais reservatórios e os
responsáveis pela manutenção do parasito no ambiente silvestre (LAINSON & SHAW, 1987). Já o cão doméstico (Canis fam iliares) é considerado o principal reservatório do parasito no ciclo rural e urbano e sua importância tem sido apontada, principalmente por estudos realizados em algumas cidades brasileiras, como responsável pelo aumento no número de casos humanos, já que estes se correlacionam com a ampliação da ocorrência de casos de LVC (BEVILAQUA et al., 2001; OLIVEIRA et al., 2001).
2 . LEI SH M AN I OSE VI SCERAL CAN I N A ( LVC)
O cão representa um importante elo no ciclo de transmissão da LV, e fatores como a presença de intenso parasitismo cutâneo facilitam a infecção do flebotomíneo (DEANE & DEANE, 1954; MOLINA et
al., 1994; GIUNCHETTI et al., 2006). Além disto, MOLINA et al. (1994)
demonstraram que mesmo cães assintomáticos podem ser fontes ativas de infecção para os vetores. Observa-se ainda que a maioria dos focos de LV humana no Brasil está intimamente relacionada às áreas onde se encontram altos índices de soroprevalência canina.
Devido a estes fatores, a LVC torna-se do ponto de vista epidemiológico tão ou mais importante que a própria doença humana, pois o controle eficaz destes animais reduz de forma considerável o número de reservatórios e, conseqüentemente, a taxa de infecção em humanos. Entretanto, as dificuldades operacionais e políticas impedem a execução das medidas de controle que deveriam ser executadas nas inúmeras áreas endêmicas de todo o país.
Com relação ao diagnóstico clínico os cães podem ser classificados em três diferentes grupos (MANCIANTE et al., 1988): cães assintomáticos (CA), animais que não apresentam nenhum sinal clínico sugestivo da infecção por Leishm ania; cães oligossintomáticos (CO), são aqueles que possuem no máximo três sinais clínicos da doença entre eles opacificação das córneas, perda moderada de peso, alopecia localizada e ou adenopatia linfóide; e cães sintomáticos (CS), animais com três ou mais sinais clínicos característicos da LVC como lesões cutâneas, perda severa de peso, onicogrifose, ceratoconjuntivite, apatia, paresia dos membros posteriores, entre outros. Neste trabalho optou-se por usar somente as formas polares da classificação clínica descrita por MANCIANTE et al. 1988 para a LVC (assintomáticos e sintomáticos).
métodos laboratoriais para a confirmação da infecção torna-se altamente necessária. Os métodos utilizados no diagnóstico podem ser divididos da seguinte forma: isolamento do parasito, métodos moleculares de detecção do DNA do parasito e técnicas de imunodiagnóstico (GONTIJO & MELO, 2004).
Dentre os métodos diretos de detecção do parasito encontram-se: a pesquisa de amastigotas de Leishm ania em lâminas, contendo esfregaços ou im print s de tecidos corados pelas técnicas de Giem sa
ou Leishm am (DEANE & DEANE, 1955; FERRER, 2002) e o isolamento de promastigotas em meios de culturas como o NNN (Novy-McNeal-Nicole) ou em modelos experimentais como o Ham st er aurat us m esocricet us. Estas técnicas são consideradas padrão ouro para o
diagnóstico da LVC, já que a observação direta do parasito não deixa dúvidas sobre a infecção. Entretanto, mesmo sendo técnicas de certeza possuem algumas desvantagens, dentre elas encontram-se: punções ou coletas de amostras clínicas que são procedimentos invasivos, a cultura é laboriosa, lenta e apresenta baixa sensibilidade, o que a torna inadequada para o diagnóstico de rotina laboratorial além de necessitar de pessoal treinado e acompanhamento sistemático (FERRER, 1997). Já no diagnóstico microscópico em lâminas coradas por Giem sa ou Leishm am a observação das formas amastigotas torna-se mais difícil em animais com baixa carga parasitária e a leitura completa da lâmina exige tempo e treinamento adequado (ASHFORD et al., 1995; FERRER, 1997). Outro método parasitológico que pode ser realizado é a inoculação experimental em mamíferos susceptíveis e o xenodiagnóstico, entretanto estes métodos são extremamente laboriosos, demorados e devem ser realizados com extrema cautela, por isso, ficando restrita a realização em centros de referência (ALVAR et al., 2004).
et al., 1988; BOURDOISEAU et al., 1997; TAFURI et al., 2004). Esta
técnica facilita a visualização de formas amastigotas nos tecidos, devido à utilização de anticorpos específicos marcados que se ligam com especificidade ao antígeno presente nos cortes histológicos.
Técnicas de imunodiagnóstico são métodos indiretos que buscam demonstrar a presença de infecção através da detecção de alterações no sistema imune. Como a resposta imune hurmoral presente na LVC é muito intensa e os níveis de Ig anti-Leishm ania
são altos, a utilização das técnicas de imunodiagnóstico tornam-se ferramentas indispensáveis no diagnóstico da LVC (ALVAR et al., 2004).
baixos, problema este que já tem diminuído com a pesquisa de novos antígenos solúveis e recombinantes (RAJ et al., 1999).
O teste DAT é uma técnica de diagnóstico baseada na detecção de anticorpos anti-Leishm ania em soros caninos com a utilização de antígeno estável e liofilizado (HARITH et al., 1988). Os resultados apresentados por OSKAM et al. (1996) mostraram sensibilidade e especificidade elevadas, 100% de 98,8% respectivamente. Em estudo recentemente publicado pelo nosso grupo, FERREIRA et al. (2007) demonstrou que a técnica do DAT se compara à técnica de ELISA em índices de sensibilidade e especificidade demonstrando superioridade no diagnóstico quando comparada à RIFI. Outra grande vantagem da utilização desta técnica é a facilidade de execução o que a torna um método muito promissor no diagnóstico da LVC.
detecção de cães assintomáticos (BERRAHAL et al., 1996), já que estes animais são extremamente relevantes na manutenção da doença.
2 .1 . ASPECTOS IM UN OPATOLÓGI COS N A LVC
O papel do cão como principal reservatório doméstico de
Leishm ania leva a um crescente interesse de pesquisadores que
tentam entender melhor quais fatores seriam responsáveis pela sua resistência ou susceptibilidade à infecção. Assim, alguns grupos de pesquisa vêm concentrando esforços no sentido de melhor compreender os mecanismos imunopatológicos envolvidos com a história natural da doença no cão, buscando correlacionar clínica com a resposta imune celular e humoral (PINELLI et al., 1994; PINELLI et al., 1995; BOURDOISEAU et al., 1997b; SOLANO-GALLEGO et al., 2001b; CORDEIRO DA-SILVA et al., 2003; QUINNEL et al., 2003; ALMEIDA et al., 2005; GIUNCHETTI et al., 2006; REIS et al., 2006a; REIS et al., 2006b; REIS et al., 2006c). Em relação à imunidade protetora e aos processos imunopatológicos, durante a infecção por parasitos do gênero
Leishm ania, evidências experimentais demonstram que os aspectos
referentes ao parasito e ao hospedeiro podem influenciar de maneira crucial na infecção. A incapacidade do hospedeiro em controlar a infecção pode estar relacionada a dois fatores principais: o estabelecimento de um perfil de imunidade celular e humoral pelo hospedeiro vertebrado capaz de favorecer a formação de um microambiente apropriado para a instalação do parasito; e a habilidade de algumas cepas de Leishm ania resistirem aos efeitos microbicidas ocorridos durante os processos de imunidade inata e adaptativa do hospedeiro (GRIMALDI & TESH, 1993).
imunidade celular e humoral. Neste contexto, a leishmaniose torna-se uma disfunção imunológica específica resultante do parasitismo do SMF por Leishm ania, produzindo um grande número de manifestações clínicas e imunológicas, reversíveis com o tratamento específico ou espontaneamente nos indivíduos imunologicamente competentes. Assim, a leishmaniose apresenta-se como um bom modelo para estudo da resposta imune humoral e da imunidade mediada por células nos hospedeiros infectados.
Devido a estes fatores a leishmaniose tem sido amplamente investigada, permitindo o entendimento da imunidade protetora bem como dos mecanismos imunopatológicos desencadeados por este patógeno. Em determinados modelos murinos parecia ocorrer uma dicotomia na resposta imune, sendo dividida inicialmente em Th1 e Th2 (COFFMAM & MOSMANN, 1989). Atualmente, a resistência do hospedeiro tem sido associada com a ativação seletiva e diferenciação de um padrão de imunidade do tipo 1, no qual, citocinas como o INF-γ, e TNF-α são de fundamental importância para o estabelecimento de mecanismos de proteção. Por outro lado, a infecção progressiva e fatal está relacionada a uma resposta predominantemente do tipo 2, com participação de citocinas como a IL-4, IL-5 e IL-10 (COFFMAM & MOSMANN, 1989; HEINZEL et al., 1991; ERB et al., 1996; MIRALLES et al., 1994; SACKS & TRAUTH, 2002).
Entretanto, no modelo canino os estudos realizados até o momento ainda são insuficientes para estabelecer um padrão de resposta imune do tipo resistência versus suscetibilidade em cães naturalmente e/ou experimentalmente infectados por Leishm ania
spp. (BARBIERI, 2006; REIS et al., 2008). Estudos pioneiros indicam que a resistência está associada a baixos níveis de anticorpos específicos e a presença de uma forte resposta mediada por células levando a produção de IL-2, INF-γ e TNF-α (PINELLI et al., 1994). Tais
resposta tipo 1 (PINELLI et al., 1995; VOULDOUKIS et al., 1996). Já a susceptibilidade estaria correlacionada a altos níveis de anticorpos e a ausência de uma resposta mediada por células, correspondente a uma resposta tipo 2 (ALVAR et al., 2004), como observada em modelos murinos.
Mais recentemente nosso grupo de pesquisa somou informações interessantes a respeito da resposta imune na LVC. Em estudo realizado em cães naturalmente infectados com L. infant um chagasi, (REIS,2001; REIS et al., 2006c) observaram uma elevação no
percentual de linfócitos T CD8 + em culturas in vitro estimuladas com antígenos de L. infant um chagasi, em relação a culturas controle, no grupo de cães assintomáticos. O detrimento da habilidade de cães sintomáticos em recrutar células T CD8 + antígeno-específicas estaria comprometendo o estabelecimento de mecanismos imunoprotetores. Estes autores também mostraram que animais sintomáticos apresentavam predomínio de linfócitos T CD8 + circulantes, quando comparados aos animais sintomáticos. A razão (CD4 +/CD8 +) na população de esplenócitos totais apresentou-se diminuída apenas no grupo de cães assintomáticos, devido a um aumento seletivo da sub-população de esplenócitos T CD8 + (REIS, 2001; REIS et al., 2006c). Estes dados reforçam o papel protetor de células T CD8 + na LVC, sugerindo ainda que uma migração preferencial dessas células para o baço possa ocorrer com o objetivo de promover a lise de macrófagos infectados. Consistente com esta hipótese, REIS et al. (2006c) demonstraram a existência de um menor parasitismo esplênico em cães assintomáticos.
Em estudo pioneiro de histopatologia da LVC KEENAN et al. (1984) preconizaram que a presença de anticorpos específicos
anti-Leishm ania não seria suficiente para promover a proteção da doença,
resposta produzida durante o processo de infecção no hospedeiro (BOURDOISEAU et al., 1997; SOLANO-GALLEGO et al., 2001b; CORDEIRO
DA-SILVA et al., 2003; QUINNEL et al., 2003; ALMEIDA et al., 2005; REIS
et al., 2006a).
Inicialmente, DEPLAZES et al. (1995), observaram a presença de maiores níveis de IgG2 em cães assintomáticos enquanto que em
animais sintomáticos os níveis mais elevados seriam de IgG1. A partir
daí diversos estudos passaram a sugerir novos perfis de classes e subclasses de Ig como biomarcadores de resistência versus susceptibilidade em relação ao status clínico na LVC. Alguns pesquisadores demonstraram que os níveis de IgG anti-Leishm ania
eram maiores em cães que apresentavam características clínicas da LVC (SOLANO-GALLEGO et al., 2001b; ALMEIDA et al., 2005; INIESTA et
al., 2005; REIS et al., 2006a). Além disso, foi relatado que altos níveis
de IgG específica anti-Leishm ania estavam correlacionados com baixa imunidade celular específica (PINELLI et al., 1994; MARTINEZ-MORENO et
al., 1995; RHALEM et al., 1999; FERNANDEZ-PEREZ et al., 2003). Estudos
recentes demonstraram que os níveis de IgE estão diretamente correlacionados com a susceptibilidade do animal à L. infant um
(ALMEIDA et al., 2005; INIESTA et al., 2005; REIS et al., 2006). Níveis elevados de IgM foram detectados em cães sintomáticos infectados por L. infant um no Brasil e na Espanha (RYAN et al., 2002; RODRIGUEZ
et al., 2006), porém REIS et al. (2006ª) não encontraram relação
entre status clínico e níveis de IgM.
Resumindo, os estudos referentes aos eventos imunológicos associados à imunoproteção e patologia na LVC mostram, até o momento, que os padrões de imunidade protetora em cães infectados por Leishm ania são semelhantes àqueles observados em modelos murinos e em humanos. Este padrão de imunoproteção requer o estabelecimento de uma resposta imune celular, antígeno-específica, com a produção de um padrão específico de citocinas e de imunoglobulina antígeno-específica.
2 .2 . TESTE DE AVI DEZ N A LVC
A técnica de avidez de IgG vem sendo amplamente empregada para diferenciar a fase aguda da fase crônica em doenças como a toxoplasmose. A avidez de IgG é mensurada pela resistência da ligação do complexo antígeno-anticorpo que é testada através da adição de uréia 6M. Recentemente REDHU et al. (2006) conseguiram demonstrar que o grau de avidez da imunoglobulina G ao antígeno de
Leishm ania era capaz de predizer o “tempo” de infecção em pacientes
com leishmaniose visceral. Esta afinidade foi capaz de diferenciar os pacientes com infecção recente (< 6 meses) daqueles com infecção crônica (> 6 meses).
Entretanto, até o momento, ainda não foi investigada o desempenho diagnóstico e prognóstico da reação de avidez no sentido de correlacionar o grau de afinidade de IgG com a forma clínica e grau de parasitismo em cães naturalmente infectados.
2 .3 . DEN SI DADE PARASI TÁRI A E RESPOSTA I MUN E N A LVC.
estudos que buscam uma associação da densidade parasitária com a clínica e com a resposta imune. Neste sentido REIS et al. (2006a) demonstraram que a pele e o baço foram os órgãos mais intensamente parasitados independente da forma clínica. Além disso, cães com alta densidade parasitária medida pelo LDU – “Leishman Donovan Units” apresentam maior expressão de IL-10 quando comparados aos cães com baixa densidade parasitária (LAGE et al., 2007).
Além das técnicas de LDU (REIS, 2001), outros métodos de quantificação da carga parasitária já foram aplicados em diversos trabalhos, dentre eles: quantitative nucleic acid sequence-based amplification (QT-NASBA) (VAN DER MAID et al., 2005), imunohistoquímica (STERNBERGER et al., 1986; TAFURI et al., 2004; GIUNCHETTI et al., 2006) e PCR em tempo real (qPCR). Esta última técnica tem sido considerada uma ferramenta muito promissora para a detecção e quantificação de parasitos e tem sido empregada com sucesso em infecções por Plasm odium falciparum (BRUÑA-ROMERO et
al., 2001; HERMSEN et al., 2001), Toxoplasm a gondii (JAUREGUI et al.,
2001), Neospora caninum (COLLANTES-FERNANANDEZ et al., 2002) e
Leishm ania (BRETAGNE et al., 2001; NICOLAS et al., 2002; ROLÃO et al.,
2004; VITALE et al., 2004).
1 . OBJETI VO GERAL
Estudar as correlações entre carga parasitária, perfil das imunoglobulinas da classe IgG e subclasses IgG1 e IgG2, avidez
das moléculas de IgGtotal e forma clínica de cães naturalmente
infectados por L. infant um chagasi.
2 . OBJETI VOS ESPECÍ FI COS
• Avaliar a eficiência da reação em cadeia da polimerase no
diagnóstico de cães naturalmente infectados por L. infant um
chagasi.
• Avaliar o perfil das imunoglobulinas IgG, IgG1 e IgG2 em cães
naturalmente infectados por L. infant um chagasi considerando o quadro clínico e a carga parasitária.
• Avaliar a avidez de IgG e correlacionar com a reatividade das subclasses IgG1 e IgG2, o parasitismo na pele e baço e a
1 . AN I M AI S
O presente trabalho foi realizado com base em uma amostra de 45 cães (Canis fam iliaris) de ambos os sexos, idades variadas e sem raça definida (SRD). Destes, 40 animais eram naturalmente infectados por L. infant um chagasi provenientes do município de Belo Horizonte e fornecidos pelo Centro de Controle de Zoonoses de Belo Horizonte (CCZ-BH) e cinco animais não infectados (testes sorológicos, parasitológicos e moleculares negativos), nascidos e criados no canil da Universidade Federal de Ouro Preto. O diagnóstico sorológico dos animais naturalmente infectados foi realizado pelo laboratório do CCZ-BH aplicando as técnicas de RIFI e ELISA.
2 . CARACTERI ZAÇÃO CLÍ N I CA DOS AN I M AI S
Inicialmente foi realizada uma avaliação clínica detalhada dos animais por um médico veterinário e os dados clínicos foram observados e anotados em ficha clínica individual (Anexo 1).
A classificação clínica utilizada foi a descrita por MANCIANTI et al. (1988) que separam os animais nos grupos: cães assintomáticos (CA), cães oligossintomáticos (CO) e cães sintomáticos (CS), conforme descrito anteriormente no item introdução.
3 . COLETA DAS AMOSTRAS BI OLÓGI CAS.
Para coleta das amostras de sangue e medula óssea os animais foram submetidos à indução anestésica com Tiopental Sódico (Thiopentax®) 1,0g de pó liofilizado diluído em 40 mL de água destilada, resultando uma concentração de 25mg/mL. Então foram aplicados 25 mg por Kg de peso via intravenosa na veia radial. Após a confirmação da indução anestésica foram realizados os procedimentos de coleta de sangue e medula descritos a seguir.
As amostras de sangue total foram coletadas por via intravenosa na veia radial, utilizando seringa descartável de 20 mL e agulha descartável 21 G 25X8. Foram confeccionados dois esfregaços para diagnóstico parasitológico. Parte do sangue total foi utilizado para realização das técnicas de biologia molecular e o restante foi estocado em dois tubos com ativador de coágulo para obtenção do soro. As amostras de soro foram armazenadas em tubos de criopreservação de 2 mL estéreis e estocadas a -20ºC para futura avaliação do perfil das Ig.
As amostras de medula óssea foram coletadas através de punção da tíbia. Para a coleta a perna do animal foi dobrada de tal forma que a tíbia ficasse em ângulo de 90º em relação à mesa, uma agulha 18 G 40X12 era inserida verticalmente sobre a crista da tíbia utilizando uma seringa descartável de 20mL para aspiração da medula. Parte do material coletado foi utilizado para confecção de esfregaços e o restante foi transferido para tubos de criopreservação, de 2mL para realização dos procedimentos de biologia molecular.
Para a coleta das amostras de pele de ponta de orelha, fígado, baço e linfonodo poplíteo foi realizado o protocolo descrito a seguir:
Amostras foram coletadas utilizando lâminas de bisturi descartáveis individuais para que não houvesse o risco de contaminação entre as diferentes amostras de tecidos. Um fragmento de cada tecido foi armazenado em tubos de 50 mL contendo formol 10% tamponado para confecção dos cortes histológicos utilizados nos procedimentos de imunopatologia, outro fragmento foi reservado em tubos de 2 mL estéreis para realização das técnicas de biologia molecular e um terceiro fragmento foi imediatamente congelado em nitrogênio líquido com resina de criopreservação (Tissue Freezing Médium® - JUNG, Nussloch, Germany). Além disso, foram confeccionados dois esfregaços por aposição para cada um dos tecidos citados anteriormente, para posterior diagnóstico parasitológico e avaliação da densidade parasitária pelo LDU no baço e na pele.
4 . EXTRAÇÃO DE DN A DAS AM OSTRAS BI OLÓGI CAS
4 .1 . SAN GUE PERI FÉRI CO TOTAL E M EDULA ÓSSEA
Para a extração de DNA das amostras de sangue periférico e medula óssea foi utilizado o Kit de Cromatografia em Coluna - GFX™ Genomic Blood DNA Purification (GE®, Pittsburgh, Pennsylvania, USA) seguindo as especificações do fabricante. Resumidamente 300 μl da amostra foram adicionados a 900 μl da solução de lise RBC (10mM KHCO3, 155mM NH4CL, 0,1mM EDTA), após incubado e centrifugado,
descartou-se a solução de lise e o sedimento contendo as células brancas foi incubado por 5 minutos com a solução de extração. O material foi então transferido para a coluna GFX e centrifugado. Posteriormente adicionou-se à coluna solução de lavagem (tampão Tris-EDTA acrescido de etanol absoluto) e novamente o material foi centrifugado. Para eluir o DNA da coluna acrescentou-se a esta 200μl de H2O destilada e deionizada aquecida a 70ºC, após eluição o DNA
foi dosado, aliquotado e estocado à -20ºC.
4 .2 . AM OSTRAS DE FÍ GADO E BAÇO
A extração do DNA a partir das amostras de fígado e baço foi realizada pela técnica do fenol-clorofórmio. Brevemente, as amostras foram pesadas e fragmentos de 10mg de pele e 5 mg de linfonodo, foram mergulhados em 600 μl de solução de lise e proteinase K na concentração de 100 μg/mL. Os tubos foram incubados a 37ºC
a fase aquosa transferindo-a para um novo tubo (este passo pode ser repetido para se obter uma amostra mais pura de DNA). Acrescentou-se à fase aquosa igual volume de clorofórmio álcool isoamílico, seguido de agitação e centrifugação.
Para a precipitação do DNA foram adicionados 2X o volume da fase aquosa de etanol 100% gelado e 1/10 do volume de acetato de sódio 3M pH 5,2. Os tubos foram incubados em freezer -20ºC “overnight” ou em -70ºc por 1 hora e depois centrifugados por 10 minutos a 4ºC na velocidade de 8.000 r.p.m. Os tubos foram acondicionados em papel absorvente para evaporação do etanol e depois de secas as amostras de DNA foram ressuspendidas em H2O
destilada e deionizada a 37ºC, após um período de hidratação das moléculas de DNA na temperatura ambiente estas foram dosadas, aliquotadas e estocadas à -20ºC.
4 .3 . AM OSTRAS DE PELE E LI N FON ODO
A extração do DNA a partir das amostras de pele e linfonodo foi realizada através da utilização do Kit Genomic Prep Cells and Tissue DNA Isolation (GE®, Pittsburgh, Pennsylvania, USA), segundo o protocolo descrito pelo fabricante. As amostras de tecidos foram pesadas (10mg), maceradas e mergulhados em solução de lise adicionada de proteinase K na concentração de 20μg/mL o material foi incubado a 55ºC “overnight”. Após a precipitação das proteínas por centrifugação, o sobrenadante contendo DNA foi transferido para um novo tubo contendo etanol 100% e centrifugado (6.000 rpm) para a obtenção de um precipitado branco de DNA. Por fim, o etanol foi descartado e os tubos secaram por aproximadamente 2 horas. O DNA foi hidratado com H2O destilada e deionizada, dosado,
5 . DOSAGEM DAS AM OSTRAS DE DN A
Após os procedimentos de extração as amostras de sangue, medula, pele, baço, fígado e linfonodo foram submetidas à dosagem de DNA, esse procedimento foi realizado para confirmar a presença de DNA nas amostras após o processo de extração, assegurando que as amostras negativas na PCR para o gênero Leishm ania spp realmente continham DNA.
Para isso alíquotas de 5μl foram diluídas 10X em água Mili-q, o DNA diluído foi então submetido à leitura em espectrofotômetro com comprimento de onda de 260nm e 280 nm. A correlação entre as duas leituras fornecia o valor referente à pureza da amostra de DNA e a quantidade de moléculas foi expressa em ng/μl.
6 . DI AGN ÓSTI CO M OLECULAR E CARACTERI ZAÇÃO ESPÉCI E-ESPECÍ FI CA.
6 .1 . PCR PARA O GÊN ERO LEI SH MAN I A
Para realização da PCR foram utilizados iniciadores que flanqueiam a região conservada do minicírculo de kDNA de
Leishm ania: iniciador A: 5’(C/G)(C/G)(G/C) CC(C/A) CTA T(T/A)T TAC
ACC AAC CCC3’ e iniciador B: 5’GGG GAG GGG CGT TCT GCG AA3’ (DEGRAVE et al., 1994), que amplifica um fragmento de 120 pb. As reações foram preparadas para um volume final de 25μl contendo
tampão 1X 1,5mM MgCl2, 50mM KCl, 10mM Tris-HCl (pH 8,0), dNTP
200μM, iniciador A1 e A2 a 5pmol e iniciador B a 10pmol, taq-polymerase a 2,5U e 1μl de DNA. A amplificação foi realizada em
segundos para desnaturação, 60ºC por 30 segundos para anelamento e 72ºC por 30 segundos para extensão. A extensão final foi feita a 72ºC por 10 minutos. As amostras foram submetidas à eletroforese em gel de poliacrilamida 6% corado por nitrato de prata a 0,2%. O marcador de peso molecular utilizado foi o φx174, digerido por Hae III, apresentando 11 fragmentos variando de 72 a 1357 pb.
6 .2 . PCR- RFLP
A PCR-RFLP foi realizada para confirmar a infecção dos animais selecionados por L. infant um chagasi. Esta ratificação ocorre através da análise do padrão de digestão nos fragmentos de kDNA resultantes da amplificação realizada na PCR genérica. Os fragmentos de restrição obtidos pela digestão do kDNA e seus tamanhos (Tabela 1) foram comparados com o perfil gerado após a digestão de kDNA de cepas referência de Leishm ania ( L) . infant um chagasi
(MHOM/BR/74/PP75), Leishm ania ( V) . braziliensis
(MHOM/BR/75/M2903) e Leishm ania ( L) . am azonensis
(IFLA/BR/67/PH8).
Tabela 1 : Enzimas de restrição e tamanho dos fragmentos obtidos após a digestão
do kDNA das espécies L. am azonensis, L. braziliensis e L. infant um chagasi.
Enzima de Restrição
Hae III ApaL I
Espécie
Tamanho dos fragmentos após a digestão (pb)
L. am azonensis 116 116
L. braziliensis 80, 40 88, 32
L. infant um chagasi 120, 80, 60, 40 120
da enzima de restrição e o seu tampão apropriado (1x). Cada amostra foi incubada com a enzima Hae III (Promega®, Madison, Wisconsin, USA) e Apa LI (GE®, Pittsburgh, Pennsylvania, USA). A mistura foi incubada a 37ºC por 3 horas e os fragmentos de restrição foram separados através de eletroforese em gel de poliacrilamida 10% e visualizados após coloração por nitrato de prata 0,2% (Figura 1).
Figura 1 : Perfil de digestão do fragmento de 120pb do kDNA de Leishm ania spp pelas enzimas Hae III (A) e APA LI (B). PM = Peso Molecular 50 pb. L.a = Controle de L. am azonensis (PH8). L.b = controle de L. braziliensis (M2903). L.c = Controle de L. infantum chagasi (PP75). 1 a 4 = amostras clínicas.
7 . TÉCN I CA DE QUAN TI FI CAÇÃO DA CARGA PARASI TÁRI A
As amostras de pele e baço foram escolhidas para a quantificação da carga parasitária tecidual utilizando-se a técnica descrita incialmente por Stauber, 1955 para avaliação da densidade parasitária em hamster, modificada por Reis, (2001) e Reis et al. (2006) para avaliação da carga parasitária na LVC (Figura 2). Os resultados obtidos a partir da análise da densidade parasitária de animais portadores das formas clínicas polares da LVC foram posteriormente correlacionados ao perfil da resposta imune humoral. Após a avaliação da carga parasitária nos tecidos citados, as
Hae III Apa LI
1 2 3 4 5
PM
118pb
120pb
88pb
32pb
100 150PM 1 2 3 4
50
80pb
60pb
40pb
118pb 120pb
L.a L.b L.c L.a L.b L.c
100 150
50
Hae III Apa LI
1 2 3 4 5
PM
116pb
120pb
88pb
32pb
100 100 150 150PM 1 2 3 4
50 50
80pb
60pb
40pb
116pb 120pb
L.a L.b L.c L.a L.b L.c
100 100 150 150 50 50
amostras foram divididas em três grupos que apresentavam baixo parasitismo (BP), médio parasitismo (MP) ou alto parasitismo (AP).
Inicialmente foram feitos “imprints” em duas lâminas de vidro desengorduradas em éter-álcool de tamanho 26X76 mm e 1,2 mm de espessura. Para fixação do material as lâminas foram cobertas com metanol P.A até secarem completamente, posteriormente as lâminas foram coradas pelo sistema citohematológico Giem sa na proporção de 2 gotas/mL de água destilada, após quinze minutos as lâminas foram lavadas em água corrente e acondicionadas para secagem. O processo de quantificação parasitária pela LDU consiste na relação entre o número de amastigotas para mil células nucleadas.
Figura 2 : Fotografia de lâmina de pele (ponta de orelha) realizada por aposição corada por GIEMSA. Campo apresentando macrófagos densamente parasitados (aumento 1500X). Para realização da LDU deve-se contar o número de células e relacionar com o número de formas amastigotas.
8 . ELI SA I SOTI POS E ELI SA AVI DEZ
8 .1 . PESQUI SA DE AN TI CORPOS ATRAVÉS DO TESTE I M UN OEN ZI MÁTI CO
( ELI SA)
A pesquisa de anticorpos anti-Leishm ania da classe IgG e das subclasses IgG1 e IgG2 foi realizada de acordo com técnica descrita
por VOLLER et al. (1979), empregando um painel de conjugados anti-Ig específicos para cão de acordo com a Tabela 2.
Tabela 2 : Painel de anticorpos anti-Ig de cão utilizados no protocolo de ELISA Isotipos.
Anticorpos específicos anti – Ig – Cão para avaliação sorológica (ELISA)
Classes e Sub-classes de
Imunoglobulinas Conjugado Afinidade Molecular
Anti IgGtotal HRPO Molécula total
Anti IgG1 HRPO Específico para cadeia pesada
Anti IgG2 HRPO Específico para cadeia pesada
Para prática da técnica de ELISA o seguinte protocolo foi realizado: no dia anterior a realização da técnica as placas (NUNC®, Nova York, EUA) foram sensibilizadas com 2µg/poço de antígeno de
Leishm ania (MHOM/BR/1972/BH46) diluído em tampão carbonato pH
9,6 e mantidas por 12 horas (overnight) na geladeira coberta por papel alumínio. No dia da reação o soro foi diluído em placa de hemocultura de 96 poços na concentração de uma parte de soro para 40 partes de PBS/Tween. A solução com o antígeno foi desprezada e a placa lavada por quatro vezes com solução de lavagem. Realizou-se então o bloqueio da placa com 100µl/poço da solução de bloqueio durante 45 minutos a 37ºC. O material foi novamente desprezado e a placa lavada por duas vezes. Então foi aplicado 50µl do soro diluído anteriormente acrescido de 50µl de PBS/Tween por poço, resultando em uma concentração final de 1:80. A placa foi incubada a 37ºC durante 45 minutos e lavada por quatro vezes. Foram aplicados 100µl/poço do conjugado na concentração desejada e a placa foi novamente incubada a 37ºC por 45 minutos. Novamente as placas foram lavadas quatro vezes e 100µl/poço do substrato foi aplicado. A placa foi levada à estufa na temperatura de 37ºC por 10 minutos, coberta com papel alumínio. A reação foi interrompida com 32µl/poço de solução de bloqueio e a placa levada para leitura em leitor de ELISA com filtro para comprimento de onda de 490nm.
A diluição ótima dos conjugados foi determinada por titulação em bloco (REIS, 2001), empregando-se soros padrões positivos e negativos (Anexo 2).
8 .2 . TESTE DE AVI DEZ DE IGG ATRAVÉS DA TÉCN I CA DE ELI SA
convencional de ELISA com uma lavagem extra de PBS/Tween após a aplicação do soro. Nas colunas da direita (7 a 12) foi realizada uma lavagem dos poços com solução de PBS/tween e uréia 6M através da adição de 100µl desta solução sendo a placa encubada a 37ºC por 10 minutos.
A leitura foi realizada em leitor de ELISA com comprimento de onda de 490nm e os valores expressos em índice de avidez (IA). Este índice foi determinado pela razão entre os valores de densidade óptica das amostras tratadas com uréia e a densidade óptica das amostras não tratadas. Os resultados foram expressos em porcentagem.
Soros controles positivos com diferentes tempos de infecção experimental, pertencentes a soroteca do Laboratório de Imunopatologia do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto foram utilizados como padrão do perfil da avidez de IgG de acordo com o curso da infecção.
9 . AN ÁLI SE ESTATÍ STI CA
Para avaliação do índice de positividade na PCR entre os diferentes tecidos foi utilizado o teste Qui-quadrado (χ2) com a
correção de Bonferroni, que divide o nível de significância global (α=0,05) pelo número de comparações. Esta metodologia também foi aplicada para comparar a distribuição da carga parasitária entre os diferentes grupos clínicos.
Para avaliar se havia diferença estatística entre os valores de densidade óptica, obtidos através do teste de ELISA, com o perfil clínico apresentado pelos animais naturalmente infectados juntamente com os animais não infectados foi empregado o teste de ANOVA, seguido de comparações múltiplas pelo método de Tukey ou o teste não paramétrico de Kruskal-Wallis, seguido de comparações múltiplas de Dunn’s. A mesma metodologia foi aplicada para comparar os valores de ELISA e o índice de avidez com a carga parasitária apresentada pelo cão.