Universidade de Trás-os-Montes e Alto Douro
AVALIAÇÃO DA FREQUÊNCIA DE ANTICORPOS
EM PACIENTES COM SUSPEITA DE SÍNDROME ANTIFOSFOLIPÍDICO
Dissertação de Mestrado em Biologia Clínica Laboratorial
Filipe Ferreira Martins
Orientadores:
Dra. Teresa Maria Leal Campos Ferreira Professor Doutor Rui Manuel Furtado Bezerra
Universidade de Trás-os-Montes e Alto Douro
AVALIAÇÃO DA FREQUÊNCIA DE ANTICORPOS
EM PACIENTES COM SUSPEITA DE SÍNDROME ANTIFOSFOLIPÍDICO
Dissertação de Mestrado em Biologia Clínica Laboratorial
Filipe Ferreira Martins
Orientadores:
Dra. Teresa Maria Leal Campos Ferreira Professor Doutor Rui Manuel Furtado Bezerra
Composição do Júri:
Professora Doutora Maria Cristina Guiomar Antunes Dra. Teresa Maria Leal Campos Ferreira Professor Doutor José Albino Alves Dias
“As doutrinas expostas no presente trabalho são da exclusiva responsabilidade do autor.”
vii
AGRADECIMENTOS
Apesar de só constar o nome de um autor na capa, a realização deste trabalho não teria sido possível sem a ajuda de várias pessoas que merecem algumas palavras de apreço.
Cada um a seu tempo e do seu modo, na sua competência, habilidade e disponibilidade proporcionaram-me as condições materiais e emocionais necessárias para fazer este trabalho.
O meu sincero obrigado aos meus orientadores, Dra. Teresa Campos e Prof. Doutor Rui Bezerra e à coordenadora deste mestrado Prof. Doutora Ana Sampaio, pela dedicação, disponibilidade, partilha de conhecimento e paciência demonstrada.
Agradeço à minha família, em especial à minha esposa Diana Fernandes, pela constante preocupação e disponibilidade para me ajudar em tudo. A sua importância assume no caso presente uma valia tão preciosa que, sem estes, com toda a certeza, teria sido muito difícil atingir o objetivo.
Agradeço ainda aos meus colegas de trabalho, por me terem propiciado as condições necessárias à elaboração desta dissertação.
E, para não cometer a injustiça de deixar alguém esquecido, termino com o meu muito obrigado a todos os que contribuíram e me apoiaram na conclusão desta etapa, fazendo-me acreditar sempre que é possível.
ix
ÍNDICE
AGRADECIMENTOS ... vii
ÍNDICE ... ix
ÍNDICE DE FIGURAS ... xi
ÍNDÍCE DE TABELAS ... xiii
RESUMO ... xvii ABSTRACT ... xix 1. INTRODUÇÃO ... 1 1.1. Histórico ... 1 1.2. Etiologia/patogénese ... 3 1.3. Epidemiologia... 3 1.4. Manifestações clínicas ... 4
1.5. Classificação e critérios de diagnóstico ... 7
1.6. Diagnóstico laboratorial ... 9
2. OBJETIVO DO ESTUDO ...13
3. METODOLOGIA ...15
3.1. População estudada...15
3.2. Recolha e processamento das amostras ...15
3.3. Análise laboratorial ...15
3.4. Recolha/análise dos dados ...16
3.5. Análise estatística dos resultados ...16
4. RESULTADOS E DISCUSSÃO ...17
4.1. Caracterização geral da amostra...17
4.1.1. Caracterização demográfica da amostra ...17
4.1.2. Caracterização da amostra relativamente ao serviço requisitante ...17
4.1.3. Caracterização da amostra relativamente à patologia ...18
x
4.2.1. Prevalência geral de aFL’s em primeira determinação ...19
4.2.2. Prevalência de aFL’s em primeira amostra por proveniência da amostra ...22
4.2.3. Prevalência de aFL’s por género e idade ...23
4.2.4. Prevalência de aFL’s por patologia associada ...25
4.2.5. Confirmação de positividades em segunda amostra ...27
4.2.6. Anticoagulante lúpico ...31
5. CONSIDERAÇÕES FINAIS ...33
xi
ÍNDICE DE FIGURAS
Figura 1: Prevalência de amostras de pacientes com pelo menos um aFL positivo em primeira amostra. ...19
Figura 2: Prevalência de aFL’s positivos na amostra total. ...20 Figura 3: Prevalência de pacientes que confirmaram positividade em segunda amostra. ...27 Figura 4: Prevalência na população geral de positividades por teste determinada em primeira amostra. ...31
xiii
ÍNDICE DE TABELAS
Tabela 1: Manifestações clínicas do SAF. ... 7
Tabela 2: Critérios de classificação de SAF de Sapporo revistos em 2006. ... 9
Tabela 3: Interferência da terapêutica anticoagulante nos testes de AL ...12
Tabela 4: Distribuição da amostra por género e faixa etária. ...17
Tabela 5: Distribuição da amostra por serviço requisitante. ...18
Tabela 6: Distribuição da amostra por manifestações clínicas. ...19
Tabela 7: Prevalência por perfil de positividade determinada em primeira amostra. ...21
Tabela 8: Prevalência geral de amostras positivas por proveniência da amostra. ...22
Tabela 9: Prevalência de positividades por aFL e proveniência da amostra. ...23
Tabela 10: Prevalência geral de amostras positivas por idade. ...24
Tabela 11: Prevalência geral de amostras positivas por género. ...24
Tabela 12: Prevalência de positividades por aFL e por género. ...25
Tabela 13: Prevalência geral de amostras positivas por manifestações clínicas. ...26
Tabela 14: Prevalência de aFL’s positivos por manifestações clínicas. ...28
Tabela 15: Prevalência de confirmação em segunda amostra por aFL. ...29
Tabela 16: Análise do perfil de confirmação de positividades em segunda amostra em relação à primeira amostra. ...29
xv
LISTA DE ABREVIATURAS E ACRÓNIMOS
aβ2GPI – anticorpos anti-beta-2-glicoproteína I aCL – anticorpos anti-cardiolipina
aFL – anticorpos antifosfolipídicos AL – anticoagulante lúpico
AIT – acidente isquémico transitório aPT – anticorpos anti-protrombina AVC – acidente vascular cerebral β2GPI – beta-2-glicoproteína I
BCSH – British Society on Thrombosis and Haemostasis CHTS- Centro Hospitalar do Tâmega e Sousa, E.P.E. CLSI – Clinical and Laboratory Standards Institute dRVVT – teste de veneno diluído da víbora de Russel ELISA – ensaio de imunoabsorção enzimática
ISTH – International Society on Thrombosis and Haemostasis LES – lúpus eritematoso sistémico
FEIA – método de fluoroenzimaimunoensaio SAF – síndrome antifosfolipídico
SCT – teste de sílica clotting time SIH – serviço de imunohemoterapia SNC – sistema nervoso central
SPSS – IBM statistical package for the social sciences TEP – tromboembolismo pulmonar
TP – tempo de protrombina
TTPa – tempo de tromboplastina parcial ativado TVP – trombose venosa profunda
xvii
RESUMO
O síndrome antifosfolipídico é uma doença autoimune, sistémica, caracterizada por trombose e/ou complicações obstétricas, que ocorrem em associação com anticorpos antifosfolipídicos persistentes. No laboratório, estes anticorpos são avaliados por três testes laboratoriais: dois ensaios em fase sólida, que detetam anticorpos anti-cardiolipina e anti-β2-glicoproteína-I e um ensaio funcional, o teste anticoagulante lúpico. Os critérios de Sapporo, usados na classificação desta doença foram apresentados em 1999 e revistos em 2006. A introdução destes critérios permitiu uma uniformização na classificação do síndrome antifosfolipídico, representando um avanço considerável no diagnóstico desta patologia. No entanto, ainda permanecem algumas dúvidas relativas aos testes de diagnóstico atualmente existentes. Estes apresentam várias limitações relativas à sua robustez, reprodutibilidade e padronização. Para além disto, existe alguma controvérsia sobre o seu papel diagnóstico e prognóstico.
Assim, com este trabalho, pretendeu-se fornecer um contributo à problemática do diagnóstico do síndrome antifosfolipídico, através da avaliação da prevalência de anticorpos utilizados na deteção laboratorial desta patologia e da associação entre eventos clínicos e testes laboratoriais, na população do Centro Hospitalar do Tâmega e Sousa, EPE.
Foram avaliadas 1179 amostras de pacientes com suspeita de síndrome antifosfolipídico relativas a um período de três anos, compreendido entre janeiro de 2015 e dezembro de 2017. Incluíram-se neste estudo amostras provenientes de serviços de internamento e urgência e serviços de ambulatório. A população estudada foi constituída maioritariamente por indivíduos do sexo feminino e a idade média foi de 46,8 anos. As manifestações clínicas mais frequentemente encontradas foram: acidente vascular cerebral/acidente isquémico transitório, doenças inflamatórias/osteoarticulares e eventos obstétricos.
A positividade geral encontrada foi de 17,8% e o anticorpo antifosfolipídico mais frequentemente encontrado em todas as patologias foi o anticoagulante lúpico. Os anticorpos encontrados surgiram tanto isolados como em associação. A prevalência de tripla positividade nas amostras positivas foi de 4,4% e de dupla positividade 10,0%. A positividade encontrada foi maior em serviços de internamento e urgência comparativamente com os serviços de ambulatório. Verificou-se também que a positividade foi maior na população com idade superior a 41 anos e no sexo masculino.
xviii Avaliando a positividade por manifestação clínica, verificou-se que, a prevalência de positividade foi maior no lúpus eritematoso sistémico, nas complicações renais e na trombose venosa profunda/tromboflebite.
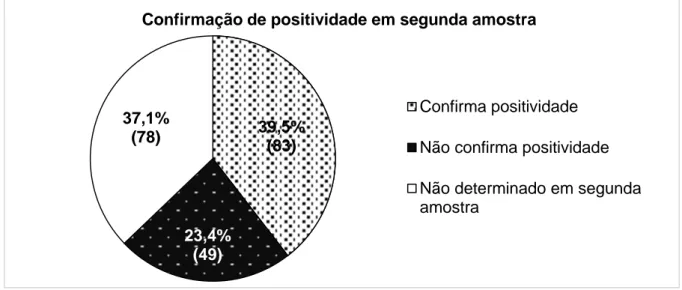
Analisando a confirmação de positividade em segunda amostra, verificou-se que, 39,5% das amostras positivas confirmaram em segunda amostra. Nas amostras positivas, 50,6% confirmaram pelo mesmo perfil e 17,3% por um perfil diferente. Verificou-se ainda que, 2,5% das amostras confirmaram positividade por um anticorpo diferente do detetado previamente.
Relativamente à avaliação da pertinência da utilização do teste de sílica clotting time, concluiu-se que, este permitiu identificar 4,8% de amostras positivas que não concluiu-seriam identificadas apenas com o teste de veneno diluído da víbora de Russel. Concluiu-se ainda que, 7,9% dos pacientes com determinação positiva em primeira amostra teriam negativado caso não tivessem sido utilizados os dois testes na confirmação da positividade
Estudos que incluam um maior número de pacientes poderão ser úteis para determinar com mais certeza, os resultados obtidos no presente estudo.
Palavras-chave: síndrome antifosfolipídico, anticorpos antifosfolipídicos, anti-cardiolipina, anti-β2-glicoproteína-I, anticoagulante lúpico, eventos trombóticos, eventos obstétricos, critérios de Sapporo.
xix
ABSTRACT
The antiphospholipid syndrome is an autoimmune, systemic disorder characterized by thrombosis and/or obstetric complications in association with persistent antiphospholipid antibodies. In laboratory, these antibodies are evaluated with three tests: two solid-phase assays detecting anti-cardiolipin and anti-β2-glycoprotein-I antibodies and a functional assay, lupus anticoagulant test. The Sapporo criteria, used in the classification of this disease were presented in 1999 and revised in 2006. The introduction of these criteria allowed some standardization in antiphospholipid syndrome classification and represented a great advance in the diagnosis of this pathology. However, some questions still remain about the diagnostic tests that currently exist. They have several limitations regarding their robustness, reproducibility and standardization. In addition, there is some controversy about its diagnostic and prognostic role.
The aim of this study was contribute to the diagnosis of antiphospholipid syndrome by the assessment of prevalence of antibodies used in the laboratory detection of this disease and making the association between clinical events and laboratory tests in the population of the Centro Hospitalar do Tâmega e Sousa, EPE.
We evaluated 1179 samples from patients with suspected antiphospholipid syndrome in a period of three years understood between January 2015 to December 2017. All samples from inpatient and outpatient services were included in this study. The population consisted mainly of female subjects and the mean age was 46,8 years. The most frequent clinical manifestations found were: stroke/transient ischemic attack, inflammatory/osteoarticular diseases and obstetric events.
Overall positivity in this population was 17.8% and the most frequent antiphospholipid antibody found in all pathologies was lupus anticoagulant. Antibodies found were determined isolated and in association. In the positive samples, the prevalence of triple positivity was 4.4% and double positivity 10.0%. The positivity found was higher in inpatient services compared to outpatient services. It was also verified that, the positivity was higher in mans and in the population over 41 years.
Evaluating the positivity by clinical manifestation, it was verified that, the positivity prevalence was higher in systemic lupus erythematosus, renal complications and deep venous thrombosis/thrombophlebitis.
Analyzing the positivity confirmation in second sample, it was verified that, 39.5% of positive samples confirmed positivity in the second sample. In positive samples, 50.6% was
xx confirmed with same positivity profile and in 17.3% with different profile. It was also verified that 2.5% of the samples confirmed positivity by a different antibody of previously detected.
In the evaluation of the pertinence of the silica clotting time test, it was concluded that this test allowed to identify 4.8% of positive samples that would not be identified with dilute Russell's viper venom time test only. It was also concluded that 7.9% of the patients with positive determination in first sample became negative if two tests had not been used in positivity confirmation.
Studies that include a larger number of patients may be useful to determine with more confidence the results obtained in the present study.
Key words: antiphospholipid syndrome, antiphospholipid antibodies, anti-cardiolipin, anti- β2-glycoprotein-I, lupus anticoagulant, thrombotic events, obstetric events, Sapporo criteria.
1
1. INTRODUÇÃO
O síndrome antifosfolipídico (SAF) descrito originalmente por Hughes em 1983, é uma doença autoimune sistémica, que é diagnosticada com base em manifestações clínicas e laboratoriais (Hanly, 2003; Keeling, 2012; Puerta e Cervera, 2014). É caracterizado como primário quando não há evidências de outra patologia associada ou secundário, quando ocorre associado a outra patologia autoimune (Hanly, 2003; Rigante et al., 2008). O seu diagnóstico pressupõe a demonstração da presença e persistência de anticorpos antifosfolipídicos (aFL) em pacientes que sofreram de trombose arterial ou venosa e/ou morbilidade gestacional. Estas patologias, por si só, não são critérios específicos para classificação de SAF, o que faz com que o diagnóstico esteja sempre dependente da deteção laboratorial de aFL (Garcia et al., 2007; Sangle e Smock, 2011).
1.1. Histórico
Os primeiros aFL’s foram detetados por Wasserman em 1906, através de ensaios utilizados para o diagnóstico de sífilis (Wasserman, 1906). Em 1941, Pangborn demonstrou que no ensaio de venereal disease research laboratory (VDRL) para a sífilis, um dos componentes principais continha antigénio de cardiolipina. Durante os primeiros anos de uso deste teste, verificou-se que muitos indivíduos que não padeciam de sífilis apresentavam resultados positivos neste teste (Pangbom, 1941). Com o desenvolvimento de testes mais específicos para a sífilis, como o teste de imobilização de Treponema pallidum, tornou-se claro que, para além da sífilis, outras condições poderiam produzir um teste Wassermann ou VDRL positivos, criando-se desta forma, o conceito de falso-positivos biológicos para a sífilis (Arachchillage e Greaves, 2014). Lubinski em 1947 e Moore e Mohr em 1952, enumeraram várias situações implicadas que incluíam: malária, lepra, infeções víricas, reações transitórias, tais como, vacinações, e induzidas por drogas e ainda outras doenças não infeciosas, nomeadamente, lúpus eritematoso sistémico (LES), síndrome de Sjogren e artrite reumatoide. Estes pesquisadores relataram ainda que, de entre os resultados biológicos falso-positivos, cerca de 20% se deviam a casos de LES e artrite reumatoide. Ainda em 1952, Conley e Hartmann descreveram um caso de um inibidor que prolongava os ensaios coagulométricos dependentes de fosfolípidos (Lubinski, 1947; Moore e Mohr, 1952). Esta observação foi complementada por Frick e Weimer, que em 1955 relataram três casos de pacientes com inibidores da coagulação, inclusive um deles com LES confirmado (Frick e Weimer, 1955). Como estes pacientes tinham LES como diagnóstico principal, passou-se a denominar estes inibidores circulantes como inibidores do anticoagulante lúpico (AL). A
2 partir deste momento, aumentaram os casos reportados de pacientes com AL e reações falso-positivas para a sífilis. As primeiras associações clínicas do AL foram reportadas em 1954 em pacientes com anticoagulantes circulantes e complicações obstétricas e, em 1963, foram descritos três casos de anticoagulantes circulantes em pacientes com LES que sofreram de trombose venosa profunda (TVP). Passou a ser cada vez mais reconhecida a hipótese de que o fenómeno anticoagulante in vitro no LES, poderia estar associado a uma diátese trombótica e não hemorrágica (Bowie et al., 1963).
Exner e colaboradores, em 1975 ao estudarem o plasma de um homem com LES, demonstraram que, neste paciente a coagulação era inibida na presença de uma baixa concentração de fosfolípidos e também que, este inibidor interferia com a ligação dos fosfolípidos e o complexo formado pelos fatores Xa, V e tromboplastina (Exner et al., 1975). Partindo deste pressuposto, Thiagaranjan e colaboradores, utilizaram o veneno de víbora de Russell, que ativa o fator X na presença do fator V e fosfolípidos, para a deteção deste inibidor, demostrando que este é um teste sensível para AL (Thiagaranjan et al.,1986). Após esta descoberta, este teste tornou-se num dos pilares no diagnóstico do AL (Pengo et al., 2009; Keeling et al., 2012; Puerta e Cervera, 2014).
Tendo em conta a associação entre VDRL e o AL, pensou-se que os aFL’s poderiam ser anticorpos com especificidade contra a cardiolipina. Assim, no inicio da década de 80 desenvolveu-se um teste de radioimunoensaio com o objetivo de detetar a presença de anticorpos anticardiolipina (aCL) (Harris et al., 1983). Este teste e a sua posterior substituição por um teste de imunoabsorção enzimática (ELISA), veio facilitar os estudos clínicos e epidemiológicos feitos subsequentemente, bem como, a descrição do SAF (Harris et al., 1988). A partir deste momento, os pacientes com aFL’s e que apresentavam histórico de complicações clínicas trombóticas ou obstétricas, passaram a ser denominados por pacientes com SAF. Caracterizou-se o SAF como uma patologia autoimune definida pela presença de aFL’s no plasma de pacientes com complicações trombóticas (venosas ou arteriais) e/ou com complicações obstétricas (Bingley e Hoffbrand,1987).
Outro avanço fundamental na história dos aFL’s, ocorreu em 1990, quando se evidenciou que os aFL’s se ligam aos fosfolipídicos aniónicos de uma forma indireta, ligando-se inicialmente à beta-2-glicoproteína I (β2GPI), uma proteína com alta afinidade para os fosfolípidos. Esta proteína foi reconhecida como o principal cofator dos aFL’s presentes em pacientes com SAF. Com a descoberta desta proteína, rapidamente se desenvolveram ensaios imunológicos para detetar anticorpos anti-β2GPI (aβ2GPI) (Matsuura et al., McNeil et al., Gali et al., 1990).
3 Outro marco importante ocorreu em 1999, quando foram oficialmente publicados os primeiros critérios clínicos e laboratoriais de diagnóstico do SAF. Ficaram conhecidos como os critérios de SAF de Sapporo, a cidade japonesa onde se realizou a reunião de consenso entre especialistas do tema (Wilson et al., 1999). Estes critérios foram atualizados em Sidney em 2006 (Miyakis et al., 2006), e desde aí, apenas têm surgido atualizações nos critérios de diagnóstico do AL. Em 2009 foram revistos pela “International Society on Thrombosis and Haemostasis” (ISTH) (Pengo et al., 2009), em 2012 pelo “British Society for Haematology” (BCSH) (Keeling et al., 2012) e mais recentemente, em 2014, foram atualizados pelo “Clinical and Laboratory Standards Institute” (CLSI) (Ledford-Kraemer et al., 2014).
1.2. Etiologia/patogénese
O mecanismo responsável pela trombose e complicações obstétricas nos pacientes com aFL’s ainda não foi completamente esclarecido (Puerta e Cervera, 2014), apesar de já terem surgido algumas tentativas de explicação para este fenómeno. A trombose, característica principal da doença, poderá ter origem em vários mecanismos, dependentes das células endoteliais, dos monócitos, das plaquetas e da cascata da coagulação e complemento (Hanly, 2003). A principal explicação será que os aFL’s se ligam a recetores nas células alvo, provocando a sua ativação e levando a tromboses nos grandes vasos (Vivian et al., 2013). Vários processos foram implicados como promotores de um estado protrombótico no SAF, nomeadamente, a inibição dos anticoagulantes naturais proteína C, proteína S e antitrombina III, a inibição da fibrinólise e regulação aumentada da atividade do fator tecidular (Boles e Mackman, 2010), ativação do complemento (Samarkos et al., 2012), ativação das plaquetas (Proulle et al., 2014), ativação do recetor da protease dos monócitos (Pedrera et al., 2006) e ativação dos neutrófilos (Barrera et al., 2017).
1.3. Epidemiologia
A prevalência do SAF na população geral ainda permanece indeterminada, no entanto, estima-se que, a prevalência dos aFL’s na população saudável varie entre 1 a 5% dos indivíduos, e que destes, apenas uma pequena minoria desenvolverá SAF ao longo da sua vida (Petri, 2000; Puerta e Cervera, 2014). As estimativas indicam que a incidência de SAF rondará os 5 novos casos por 100 mil pessoas por ano e a prevalência será de 40 a 50 casos por 100 mil pessoas (Mehrania e Petri, 2009). Recentemente, um grupo de investigadores levou a cabo o primeiro estudo populacional, em indivíduos com idade superior a 18 anos e determinaram que, a incidência anual de SAF foi de 2 casos por 100
4 mil habitantes. Observaram que esta incidência é idêntica em ambos os sexos e que a maior percentagem de SAF foi observada na população com idade superior a 75 anos. Verificaram também que a taxa de mortalidade é idêntica à da população geral (Garcia et al., 2017).
1.4. Manifestações clínicas
O SAF pode apresentar várias manifestações clínicas e afetar qualquer órgão ou sistema no corpo humano (Hanly, 2003). A ocorrência mais frequente é a TVP, no entanto, as suas manifestações não se limitam ao sistema venoso, podendo ocorrer também trombose arterial (Puerta e Cervera, 2014). Das principais manifestações provocadas pelo SAF destacam-se:
Doenças coronárias: o SAF está associado com o aumento de aterosclerose, e tem vindo a ser associado como uma das causas da doença arterial coronária. A aterosclerose pode originar tromboses nas artérias coronárias, bloqueando o fluxo sanguíneo nestas artérias, provocando consequentemente enfarte agudo do miocárdio. Para além desta doença, pode provocar doença valvular cardíaca, sendo a manifestação mais comum, o espessamento das válvulas cardíacas, principalmente da válvula mitral, originando um incorreto fluxo sanguíneo (Hanly, 2003; Keeling et al., 2012). O SAF é caracterizado por um estado de hipercoagulabilidade, podendo originar a formação de trombos nas câmaras cardíacas. Estes trombos podem causar uma disfunção cardíaca grave e também embolizar para outros órgãos, provocando oclusão dos vasos que irrigam o cérebro, rins e outros órgãos vitais (Hanly, 2003; Puerta e Cervera, 2014; Keeling et al., 2012). Vários estudos têm relacionado um aumento da incidência destas doenças em pacientes com aFL’s (Chighizola et al., 2015).
Doenças respiratórias: a trombose venosa é uma das consequências mais comuns causadas pelo SAF e destas, cerca de 1/3 dos casos estão associadas com embolia pulmonar (Cervera et al., 2002; Stojanovich et al., 2012). Dependendo do seu tamanho, o trombo pode ocluir uma das artérias pulmonares e, desta forma, interferir com as trocas gasosas, originando uma oxigenação inadequada do sangue. Embora seja menos frequente, o SAF pode originar também trombose pulmonar (Stojanovich et al., 2012). Neste caso, o trombo forma-se numa das artérias do pulmão, podendo afetar vários vasos pulmonares. Outra condição associada com o SAF é a hipertensão pulmonar, e normalmente, está associada com embolia pulmonar recorrente (Asherton e Cervera, 2007).
Complicações obstétricas: cerca de 2 a 5% das mulheres em idade fértil, sofrem dois ou mais abortamentos. O SAF está associado com perda fetal precoce e tardia e o abortamento
5 recorrente pode ser a primeira e por vezes a única manifestação do SAF nestas mulheres (Marchetti, 2013). A percentagem de abortamento recorrente em mulheres com positividade para os aFL’s é significativamente mais alta quando comparada com mulheres sem aFL’s (Chighizola et al., 2015), o que faz com que, nestes casos, a deteção de aFL’s seja importante para o diagnóstico e prognóstico desta patologia (Miyakis et al., 2006). A percentagem de mulheres que sofre de pré-eclâmpsia na gravidez (quadro de hipertensão arterial e de proteinúria que se inicia após as 20 semanas de gestação e pode provocar lesão de órgãos importantes, tais como fígado, rim, pulmões e cérebro), é mais elevada em pacientes com SAF (Chighizola et al., 2015). Nestes pacientes, a pré-eclâmpsia ocorre mais frequentemente na fase inicial da gravidez e é mais severa do que em mulheres sem SAF (Hanly, 2003). O parto pré-termo também é uma situação frequente. É normalmente induzido pelo clínico, em casos de pré-eclâmpsia ou atraso no crescimento fetal. Para além das complicações fetais, os aFL’s também podem causar tromboses durante a gravidez, o que afeta negativamente a saúde materna e a gravidez (Branch e Khamashta, 2003; Marchetti, 2013).
Manifestações cutâneas: o envolvimento da pele no SAF pode ocorrer por vários mecanismos, mas o mais comum resulta de tromboses nos pequenos vasos. A manifestação mais frequente é o livedo reticularis, que é caracterizado por um padrão de descoloração cianótica. Ocorre em maior frequência em pacientes com SAF secundário associado com LES. Outro achado frequente são ulceras da pele, que normalmente aparecem nas ancas e nos pés. A necrose superficial da pele também pode ser encontrada em pacientes com SAF, isoladamente ou associada a outros estados de hipercoagulabilidade (Cervera et al., 2002).
Sistema nervoso central: a manifestação mais frequente que afeta o sistema nervoso central (SNC) é o acidente vascular cerebral (AVC) (Hanly, 2003; Rodrigues et al., 2010). Pode ser resultante de trombose intracerebral, trombose nos grandes vasos que irrigam o cérebro, ou devido a embolia dos trombos formados na artéria aorta do coração. Qualquer uma destas manifestações pode levar a uma interrupção do fluxo sanguíneo e da oxigenação a uma ou várias partes do cérebro, provocando danos no tecido cerebral destes pacientes (Rodrigues et al., 2010). Dependendo da área cerebral afetada, estes danos podem resultar em paralisias, dificuldades na fala ou compreensão, perda de consciência ou mesmo morte. O risco de AVC é maior em pacientes com aFL’s quando comparados com pacientes sem estes anticorpos. Sabe-se também que, em adultos jovens com SAF, o AVC ocorre algumas décadas mais cedo em comparação com a população geral (Chighizola et al., 2015).
O SAF está também associado a outras patologias do cérebro, nomeadamente a demência, resultando de enfartes cerebrais recorrentes originados por pequenos eventos trombóticos,
6 que levam à diminuição das capacidades cognitivas (Rodrigues et al., 2010). Para além da demência, o SAF tem vindo a ser associado à epilepsia e enxaqueca (Mayer et al., 2010; Rodrigues et al., 2010). A origem da epilepsia não é bem clara, no entanto, sabe-se que a epilepsia manifestada por convulsões, resulta de algum tipo de lesão cerebral. Têm sido descritos alguns casos de pacientes com epilepsia e que também apresentam SAF com aFL's (Mayer et al., 2010). Um possível mecanismo patogénico da epilepsia no caso do SAF, poderá ser explicado pela trombose, seguida de enfarte e lesão cerebral. Se a lesão cerebral provocar uma disfunção na região motora do cérebro, isso poderá explicar as convulsões (Cimaz et al., 2006). A enxaqueca é um sintoma bastante frequente em pacientes com SAF, no entanto, a sua associação com os aFL’s é controversa (Mayer et al., 2010). Alguns autores verificaram que há uma correlação em casos específicos, como por exemplo, em pacientes que sofreram de paralisia transitória ou enfarte cerebral. Embora não haja uma evidência que permita concluir que os aFL’s são um agente causal da enxaqueca, pensa-se que contribuem para esta (Roldan e Breu, 2007).
Para além das doenças já referidas, o SAF tem sido relacionado com outras patologias do SNC, tais como, esclerose múltipla e síndrome de Guillain-Barré. Vários estudos têm correlacionado estas doenças com a presença de aFL’s (Rodrigues et al., 2010).
Manifestações hematológicas: a trombocitopenia é um achado frequente nos pacientes com SAF, mas na grande maioria dos casos é ligeira. A trombocitopenia severa com contagens de plaquetas inferiores a 50 000/mL é pouco comum (Ho et al., 2017; Pablo et al., 2017). Por esta razão, as complicações hemorrágicas espontâneas nestes pacientes são pouco frequentes, uma vez que, normalmente só ocorrem com contagens de plaquetas inferiores a 20 000/mL. A púrpura trombocitopénica idiopática parece estar relacionada com os aFL’s. Vários estudos têm verificado que uma grande percentagem de pacientes que sofrem desta patologia apresentam aFL’s em circulação (Bidot et al., 2006; Despujol et al., 2008). A anemia também é um achado frequente (Klak et al., 2013), especialmente em indivíduos com SAF catastrófico (Espinosa et al., 2013). Pensa-se que o mecanismo que origina a anemia nos pacientes com SAF poderá ter uma causa autoimune, com produção de autoanticorpos dirigidos contra antigénios eritrocitários. Tem-se constatado que os aFL’s estão presentes numa percentagem significativa de pacientes com anemia hemolítica, o que leva a crer que, estes autoanticorpos estejam envolvidos na destruição dos eritrócitos (Rottem et al., 2006; Scaramucci et al., 2012, Tassies e Reverter, 2010). A anemia e trombocitopenia nos pacientes com SAF podem manifestar-se isoladamente ou em conjunto, embora, apenas uma minoria destes pacientes manifeste as duas condições em simultâneo. A leucopenia também pode ocorrer nos pacientes com SAF, sendo mais frequente em pacientes com SAF secundário do que primário (Tassies e Reverter, 2010).
7 Síndrome antifosfolipídico catastrófico: é uma variante rara do SAF, ocorrendo em menos de 1% dos casos. Caracteriza-se por uma oclusão acelerada dos pequenos vasos, que leva a uma falência multiorgânica. Normalmente tem um inicio agudo, afetando pelo menos três órgãos ou sistemas em menos de uma semana (Asherson, 2003; Cervera et al., 2009). Trata-se de uma doença microvascular oclusiva agressiva que afeta rins, fígado, SNC, coração, pulmões e pele (Cervera et al., 2009; Espinosa et al., 2013).
Outras complicações: estão descritas outras complicações também associadas com o SAF, nomeadamente complicações renais, provocadas por tromboses que bloqueiam as artérias renais, levando a hipertensão (Cruz, 2009; Stoian e Stoica, 2017). Pode provocar perda auditiva, originada pela diminuição do suprimento sanguíneo ao nervo coclear, em resultado do bloqueio dos pequenos vasos por trombos originados pelos aFL’s (Carpintero et al., 2007; Heller et al., 1998). O envolvimento da visão no SAF também é relativamente frequente, podendo ser encontrado na grande maioria dos pacientes (Rodrigues et al., 2010). Normalmente é provocado pela diminuição do fluxo sanguíneo na região ocular, ou pelo comprometimento da área visual do cérebro (Rodrigues et al., 2010). Pensa-se que o SAF também possa estar relacionado com patologias do sistema endócrino, tais como hipopituitarismo, hiper e hipotiroidismo e hiperparatiroidismo (Versini, 2017).
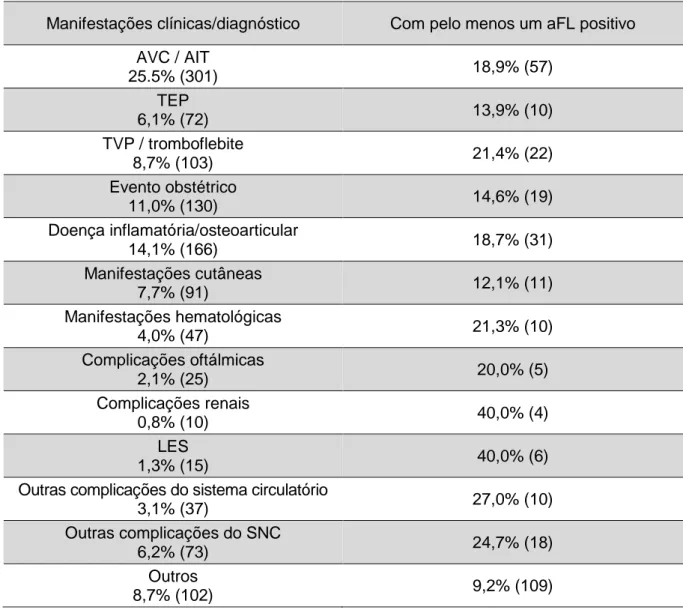
A frequência das diversas manifestações relacionadas com o SAF pode ser observada na tabela 1:
Tabela 1: Manifestações clínicas do SAF.*
Frequentes (>20% dos casos) Tromboembolismo venoso
Abortamento ou perda fetal Enxaqueca
Trombocitopenia
AVC / acidente isquémico transitório (AIT) Livedo reticular
Menos frequentes (10-20% dos casos) Doença valvular cardíaca
Nascimento prematuro Doença arterial coronária
Pré-eclâmpsia ou eclâmpsia Anemia hemolítica
Incomuns (<10% dos casos) Epilepsia Coreia Amaurose fugaz Úlceras da perna Osteonecrose Isquemia mesentérica Demência
Trombose da veia ou artéria retinária Hipertensão pulmonar
Gangrena digital Microangiopatia renal
Raras (<1% dos casos) Hemorragia suprarrenal
Síndrome de Budd-Chiari
Mielite transversa
8 1.5. Classificação e critérios de diagnóstico
O SAF deve ser pesquisado quando um paciente apresenta episódios trombóticos sem fatores de risco associados. Neste caso, é sugerida a pesquisa laboratorial dos aFL’s, que incluem, aCL, aβ2GPI e pesquisa de AL (Miyakis et al., 2006).
O SAF pode ser classificado como SAF primário, quando ocorre na ausência de uma doença autoimune concomitante ou SAF secundário, quando ocorre associado a outra doença do tecido conjuntivo, como por exemplo, o LES ou artrite reumatoide (Keeling et al., 2012; Dhir e Pinto, 2014). O diagnóstico do SAF nem sempre é fácil, uma vez que, nestes pacientes, para além da trombose, podem ocorrer muitas outras manifestações clínicas concomitantes que dificultam o seu diagnóstico. Neste sentido, em 1999, a International Society on Thrombosis and Haemostasis (ISTH) apresentou o primeiro consenso para a classificação do SAF. Neste consenso foram apresentados os primeiros critérios de diagnóstico do SAF que ficaram conhecidos como “Critérios de SAF de Sapporo” (Devreese e Hoylaerts, 2010). Estabeleceu-se que, o paciente deve apresentar um evento clínico de trombose e/ou perda fetal e concomitantemente deverá ser demonstrado em laboratório a presença de anticorpos aCL IgG/IgM e/ou AL. Ficou também definido que estes anticorpos deverão ser detetados em duas ocasiões com pelo menos seis semanas de intervalo (Wilson et al., 1999). Estes critérios foram atualizados em 2006, data em que se definiram novos critérios laboratoriais (tabela 2).
Nesta altura foi incluída a pesquisa de anticorpos aβ2GPI e foi definido que são necessários títulos de aCL IgG ou IgM superiores a 40 unidades (ou superiores ao 99º percentil) e títulos de aβ2GPI superiores ao 99º percentil, ambos detetados em duas ocasiões com um intervalo mínimo de 12 semanas. Ficou ainda estabelecido que o tempo entre o evento clínico e a determinação laboratorial não deverá ultrapassar os 5 anos. Os critérios clínicos não foram alterados (Devreese et al., 2018; Hoylaerts e Devreese, 2010; Miyakis et al., 2006).
Mais recentemente, têm vindo a ser referenciados na literatura outros testes de deteção dos aFL’s, nomeadamente, os anticorpos anti-protrombina (aPT), os aCL IgA, fosfatidilserina e fosfatidiletanolamina, ou anticorpos contra proteínas que se ligam a fosfolípidos como a antitrombina e antianexina V. Embora estes testes ainda não estejam incluídos nos critérios de diagnóstico do SAF, parecem ter alguma utilidade clínica, no entanto, o seu uso como testes de diagnóstico de rotina é desaconselhado, uma vez que, estes testes carecem de estudos prospetivos mais alargados que validem a tua utilidade diagnóstica (Devreese e Hoylaerts, 2010; Miyakis et al., 2006; Sangle e Smock, 2011).
9 Tabela 2: Critérios de classificação de SAF de Sapporo revistos em 2006.*
Critérios Clínicos Trombose vascular
- Um ou mais episódios clínicos de trombose arterial, venosa ou dos pequenos vasos, ocorrendo em qualquer órgão ou tecido, confirmada por exames de imagem ou histopatológicos.
Morbidade gestacional
- Uma ou mais mortes inexplicáveis de feto morfologicamente normal com mais de 10 semanas de gestação; ou
- Um ou mais nascimentos prematuros de fetos morfologicamente normais com 34 semanas ou menos, em virtude de pré-eclâmpsia, eclâmpsia ou retardo do crescimento intrauterino; ou
- Três ou mais abortamentos espontâneos consecutivos antes da 10ª semana de gestação com exclusão de causas genéticas, anatómicas ou hormonais.
Critérios Laboratoriais Anticorpo anticoagulante lúpico
Presente no plasma em duas ou mais ocasiões com intervalo mínimo de 12 semanas, detetados de acordo com as recomendações da ISTH.
Anticorpo anti-cardiolipina
Presença do anticorpo IgG ou IgM, em títulos moderados ou elevados (> 40 unidades), detetados em duas ou mais ocasiões, separadas por um intervalo mínimo de 12 semanas, determinados por ELISA.
Anticorpo anti-β2GPI
Presença do anticorpo IgG ou IgM, em títulos moderados ou elevados, detetados em duas ou mais ocasiões, separadas por um intervalo mínimo de 12 semanas, determinados por ELISA.
*Adaptado de Miyakis et al., 2006.
1.6. Diagnóstico laboratorial
Anticorpos anti-cardiolipina: os aCL estão presentes em cerca de 80 a 90% dos pacientes com diagnóstico de SAF (Cervera, 2002; Forastiero, 2016), o que torna este teste bastante sensível para a deteção deste síndrome. A correlação entre estes anticorpos e as manifestações clínicas é maior quando os títulos de aCL são mais elevados e persistentes ao longo do tempo. Os mais frequentes são os aCL de classe IgG, no entanto, os anticorpos de classe IgM ou mesmo IgA também podem ocorrer (Cervera et al., 2002). A literatura refere que todas as classes de anticorpos estão associadas com manifestações clínicas do SAF, e que a presença de aCL de classe IgG parece indicar um risco aumentado de eventos trombóticos (Cervera et al., 2002; Miyakis et al., 2006).
10 No laboratório os aCL são detetados por testes de ELISA, que utilizam a cardiolipina como antigénio, na presença de β2GPI sérica de origem bovina (Devreese, 2014). No último consenso para o diagnóstico da SAF, definiu-se que, é necessário a presença de aCL do tipo IgG ou IgM, no soro ou plasma em níveis moderados a altos (acima de 40 unidades), em duas ou mais ocasiões separadas por um intervalo mínimo de 12 semanas (Miyakis et al., 2006). Títulos baixos ou moderados de aCL poderão ser transitórios e aparecer como resultado de infeções, daí a importância da sua repetição (Devreese e Hoylaerts, 2010).
Anticorpos anti-β2-glicoproteína I: a β2GPI é uma proteína sérica com capacidade de ligação a moléculas com carga negativa, incluindo os fosfolípidos. Os aCL ligam-se à β2GPI que está ligada à cardiolipina. A ligação entre a β2GPI e a cardiolipina liberta um ponto de ligação na β2GPI, que permite a ligação dos autoanticorpos a este local. Uma grande parte de anticorpos do AL são direcionados para a β2GPI. Os anticorpos aβ2GPI estão presentes em cerca de 40% dos pacientes com SAF (Forastiero, 2016) e a sua presença aumenta o risco de trombose, estando relacionados com enfarte do miocárdio, trombose venosa e abortamentos recorrentes (Cervera et al., 2002; Miyakis et al., 2006). Estes anticorpos têm alta especificidade para o SAF, no entanto, a sua sensibilidade é baixa, o que faz com que, o doseamento dos aβ2GPI não deva ser usado isoladamente, mas sempre em associação com os aCL (Gezer, 2003; Miyakis et al., 2006).
No laboratório, os aβ2GPI são detetados pela técnica de ELISA em placas revestidas com β2GPI humana. O seu doseamento deverá apresentar um resultado superior ao 99º percentil, em duas ou mais ocasiões, separadas por um intervalo mínimo de 12 semanas (Miyakis et el., 2006)
Anticoagulante lúpico: os AL’s são autoanticorpos (de classe IgG, IgM ou ambos) que têm a capacidade de prolongar in-vitro os testes coagulométricos dependentes de fosfolípidos, comportando-se assim, como um inibidor adquirido da coagulação (Marlar e Husain, 2008). Normalmente, existe uma correlação entre os testes de laboratório e a coagulação dos pacientes in-vivo, ou seja, a presença de um inibidor da coagulação em circulação origina um prolongamento dos testes coagulométricos, traduzindo-se numa menor tendência para desenvolver coágulos. No caso do AL, e contrariamente a outros inibidores, a sua presença in vivo confere um estado de hipercoagulabilidade e, consequentemente, um risco acrescido de formação de trombos (Dhir e Pinto, 2014). Devido à natureza heterogénea do AL, torna-se necessário a realização de mais de um teste no torna-seu diagnóstico (Moore, 2014). Ao longo dos últimos anos, foram feitos alguns avanços que permitiram formular diretrizes que vieram esclarecer quais os testes a utilizar para a sua determinação (Keeling et al., 2012; Ledford-Kraemer et al., 2014; Miyakis et al., 2006; Pengo et al., 2009). As “guidelines” mais recentes, de uma forma mais ou menos consensual, têm sugerido a utilização de dois testes,
11 recomendando o teste de veneno diluído da víbora Russel (dRVVT), pela sua especificidade para anticorpos clinicamente significativos e um teste de tempo de tromboplastina parcial ativado (TTPa) com baixa concentração de fosfolípidos pela sua sensibilidade. Reconhecem que, a combinação destes dois testes permite uma boa deteção do AL. Acrescentam também que, o risco de resultados falso-positivos aumenta para níveis inaceitáveis se forem usados mais de dois testes. Ressalvam ainda que, embora a combinação dos testes de dRVVT e TTPa, permitam fazer um diagnóstico eficiente, os reagentes de TTPa utilizados na deteção do AL deverão ser escolhidos criteriosamente, uma vez que, muitos reagentes de TTPa destinados ao rastreio de coagulação de rotina, são formulados para detetar principalmente deficiências de fatores da coagulação e/ou monitorizar a terapêutica com heparina, não contendo uma composição de fosfolípidos adequada para detetar AL (Moore, 2016).
Mais recentemente, o CLSI, veio fazer uma atualização nas guidelines, sugerindo a utilização de dois reagentes de TTPa: um reagente de TTPa insensível a AL, para ser usado na coagulação de rotina e outro para pesquisar especificamente AL. Isto possibilita uma melhor interpretação dos ensaios de AL, permitindo descartar fatores interferentes, quando o TTPa de rotina é normal. Para além disto, reconhece que o dRVVT é um bom teste de diagnóstico confirmatório, propondo que, conjuntamente com este, deverá ser usado um reagente de TTPa que utilize a sílica como ativador, como por exemplo o teste sílica cloting time (SCT). Desaconselha o uso de reagentes de TTPa ativados por ácido elágico, uma vez que, são menos sensíveis a AL (Ledford-Kraemer et al., 2014).
Os AL’s estão presentes em cerca de 50% dos pacientes com SAF (Cervera, 2002; Forastiero, 2016). Este teste é bastante específico para o diagnóstico desta patologia, uma vez que, tem uma grande associação com eventos trombóticos e perdas fetais (Devreese e Hoyaerts, 2010). Tem vindo a ser relacionado com TVP nos membros inferiores ou noutros locais menos frequentes, como os rins, fígado e cérebro. É um achado frequente em jovens que sofreram de AVC’s, bem como, em mulheres com complicações obstétricas tais como: abortamentos espontâneos, pré-eclâmpsia, retardo do crescimento fetal intra-uterino e perda fetal no segundo ou terceiro trimestre (Marlar e Husain, 2008).
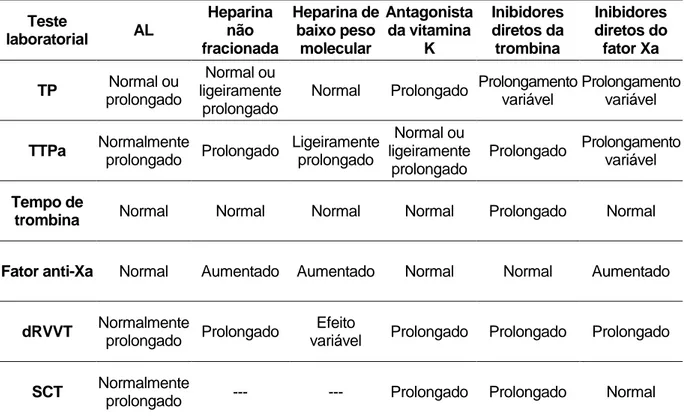
Testes de coagulação de rotina: O tempo de protrombina (TP) e o TTPa não estão incluídos na avaliação do AL, no entanto, a sua determinação conjuntamente com o estudo de AL é de grande utilidade, uma vez que, permite descartar outras alterações da coagulação não relacionadas com AL e detetar o uso de terapêutica com anticoagulantes orais e heparinas não fracionadas. Outros testes, como por exemplo, o tempo de trombina, ou o doseamento do fator anti-Xa, também poderão ser úteis na identificação de anticoagulantes orais de inibição direta ou heparinas de baixo peso molecular (Moore, 2016; Pengo et al., 2009). O uso de terapêutica anticoagulante pode interferir nos testes de AL (dRVVT e SCT)
12 prolongando os tempos de coagulação e dificultando a sua interpretação. As principais interferências já se encontram descritas na literatura e estão sumarizadas na tabela 3. A terapêutica anticoagulante normalmente não interfere com os testes de aCL ou aβ2GPI (Ortel, 2012).
Tabela 3: Interferência da terapêutica anticoagulante nos testes de AL.*
Teste laboratorial AL Heparina não fracionada Heparina de baixo peso molecular Antagonista da vitamina K Inibidores diretos da trombina Inibidores diretos do fator Xa TP Normal ou prolongado Normal ou ligeiramente prolongado
Normal Prolongado Prolongamento variável Prolongamento variável TTPa Normalmente prolongado Prolongado Ligeiramente prolongado Normal ou ligeiramente prolongado Prolongado Prolongamento variável Tempo de
trombina Normal Normal Normal Normal Prolongado Normal
Fator anti-Xa Normal Aumentado Aumentado Normal Normal Aumentado
dRVVT Normalmente
prolongado Prolongado
Efeito
variável Prolongado Prolongado Prolongado
SCT Normalmente
prolongado --- --- Prolongado Prolongado Normal *Adaptado de Ortel, 2011, Ortel, 2012 e Wong et al., 2016.
Outros anticorpos antifosfolipídicos: a determinação de outros testes como por exemplo os aPT, os aCL IgA, a fosfatidilserina, a fosfatidiletanolamina e a antianexina poderão ser uteis em situações específicas (Devreese e Hoylaerts, 2010; Petri, 2000; Sangle e Smock 2011). Como estes ensaios ainda não estão padronizados e não existem evidências sobre a sua utilidade clínica no diagnóstico do SAF, estes não deverão ser utilizados como testes de rotina. Quando utilizados, deverão ser avaliados de acordo com o quadro clínico do doente (Devreese, 2014).
13
2. OBJETIVO DO ESTUDO
Os testes laboratoriais usados na deteção e classificação do SAF apresentam várias limitações relativas à sua robustez, reprodutibilidade, estandardização e relevância clínica. A correlação entre os ensaios laboratoriais e as manifestações clínicas da doença também não está bem esclarecida (Hoylaerts e Devreese, 2010). Neste sentido, com este trabalho, pretende-se fornecer um contributo à problemática do diagnóstico do SAF, através da avaliação da prevalência de anticorpos utilizados na deteção laboratorial desta patologia. A informação resultante da associação entre eventos clínicos e testes laboratoriais na nossa população, poderá contribuir para um melhor conhecimento da realidade local do SAF e auxiliar na tomada de decisões clínicas e laboratoriais, permitindo um uso mais racional e adequado dos testes atualmente disponíveis para o diagnóstico desta patologia. Para além disto, poderá ainda fornecer um contributo na formulação de orientações futuras ou consolidação das já existentes.
Para a concretização desta finalidade, estabeleceram-se como objetivos específicos:
Determinar a prevalência geral de aFL’s na população do Centro Hospitalar do Tâmega e Sousa, E.P.E. (CHTS);
Determinar a prevalência de aFL’s por proveniência da amostra, sexo, idade e patologia associada;
Comparar a prevalência de aFL’s entre doentes internados e provenientes do ambulatório, por sexo, por faixas etárias e por patologia associada;
Determinar a prevalência de doentes em que a positividade para os aFL’s se confirma em segunda amostra;
Determinar o perfil de confirmação em segunda amostra;
Avaliar a vantagem de utilização de um segundo teste na determinação do AL;
Comparar os dados obtidos no nosso estudo com os dados dos estudos mais recentes.
15
3. METODOLOGIA
3.1. População estudada
Os dados usados neste trabalho são provenientes dos serviços de Imunohemoterapia (SIH) e Patologia Clínica do CHTS. Foram recolhidos dados provenientes de amostras de doentes com suspeita de SAF, analisadas no período compreendido entre janeiro de 2015 e dezembro de 2017. Incluíram-se neste estudo pacientes de ambos os sexos, sem restrições de idade, aos quais foi requisitado o perfil laboratorial completo de SAF que inclui: os aCL IgG e IgM, aβ2GPI IgG e IgM, e pesquisa de AL (dRVVT, SCT, TP e TTPa). Foram excluídas as amostras de pacientes que continham apenas pedidos isolados de análises, amostras em que foi detetado que o doente estava sob efeito de anticoagulantes ou que se encontrava com um processo infecioso.
3.2. Recolha e processamento das amostras
As amostras foram colhidas por venopunção utilizando o sistema de colheita por vácuo. A cada paciente foram colhidos dois tubos, um de citrato trisódico 3,2% e outro de gel separador sem anticoagulante (Greiner Bio-One GmbH, Frickenhausen - Germany). As amostras colhidas em tubo citrato foram duplamente centrifugadas, primeiro 15 minutos a 3800 rpm, separadas para um tubo secundário, novamente centrifugadas 10 minutos a 4500 rpm e processadas no autoanalisador ACL TOP (Werfen Group, Barcelona, Spain). As amostras colhidas em tubo seco foram centrifugadas a 3800 rpm durante 10 minutos e processadas no autoanalisador Phadia 250 (Thermo Fisher Scientific, Waltham, USA).
3.3. Análise laboratorial
Todas as amostras foram processadas segundo os procedimentos habituais do laboratório. Os métodos utilizados foram os seguintes:
aCL e aβ2GPI: A determinação dos aCL IgG e IgM e aβ2GPI IgG e IGM foi feita no autoanalisador Phadia 250 pelo método de fluoroenzimaimunoensaio (FEIA), utilizando os reagentes ELIATM Cardiolipin IgG e IgM e ELIATM β2-Glycoprotein I IgG e IgM (Thermo Fisher Scientific, Waltham, USA). Foram considerados positivos valores de aCL IgG e IgM >40 MPL-U/ml e valores de aβ2GPI IgG e IgM >10 MPL-U/ml.
AL: A determinação do AL foi feita no autoanalisador ACL TOP através de ensaios coagulométricos. Para a determinação do teste dRVVT foram utilizados os reagentes
16 dRVVT screen e dRVVT confirm (Werfen Group, Barcelona, Spain). O resultado foi determinado pela seguinte fórmula:
𝑹𝒂𝒄𝒊𝒐 𝒅𝑹𝑽𝑽𝑻 =
(Média do intervalo normal do dRVVT screen (em segundos)Resultado do dRVVT screen do paciente (em segundos) ) (Média do intervalo normal do dRVVT confirm (em segundos)Resultado do dRVVT confirm do paciente (em segundos) )
Na determinação do teste de SCT, foi utilizado o reagente Silica Clotting Time (Werfen Group, Barcelona, Spain). O resultado foi determinado pela seguinte fórmula:
𝑹𝒂𝒄𝒊𝒐 𝑺𝑪𝑻 =
(Média do intervalo normal do SCT screen (em segundos)Resultado do SCT screen do paciente (em segundos) ) (Média do intervalo normal do SCT confirm (em segundos)Resultado do SCT confirm do paciente (em segundos) )
O resultado do o AL foi considerado positivo, quando o rácio normalizado do teste dRVVT e/ou SCT foi superior a 1,2.
TP e TTPa: na determinação do TP foi utilizado o reagente Recombiplastin 2G e para determinação do TTPa o reagente Synthasil (Werfen Group, Barcelona, Spain). Estes testes foram utilizados para descartar outras alterações da coagulação não relacionadas com AL.
3.4. Recolha/análise dos dados
A recolha dos dados foi efetuada no aplicativo informático CliniData®XXI, que contém os dados referentes ao laboratório de Imunohemoterapia e Patologia Clínica e no aplicativo SClínico Hospitalar, onde foi consultada a história clínica dos doentes. O instrumento de pesquisa utilizado foi a análise documental com variáveis classificatórias (sexo, idade, serviço, informação clínica/patologia associada e perfil de positividade para os aFL’s).
3.5. Análise estatística dos resultados
Os dados recolhidos foram organizados em folha de cálculo do Microsoft Excel, e posteriormente exportados e analisados no programa estatístico IBM Statistical Package for the Social Sciences (SPSS), versão 21 para Windows. O tratamento estatístico incluiu a análise descritiva, com frequências absolutas e relativas, médias aritméticas e desvios-padrão, entre outros parâmetros, sendo os resultados apresentados sob a forma de tabelas e/ou gráficos. Quando apropriado, foi usado o teste do chi-quadrado de Pearson (χ2) para comparação das variáveis. Foram considerados estatisticamente significativos valores de ρ inferiores a 0,05.
17
4. RESULTADOS E DISCUSSÃO
4.1. Caracterização geral da amostra
Foram incluídas neste estudo 1179 amostras de pacientes com suspeita de SAF de ambos os sexos e sem restrições de idade que foram avaliadas no período compreendido entre janeiro de 2015 e dezembro de 2017.
4.1.1. Caracterização demográfica da amostra
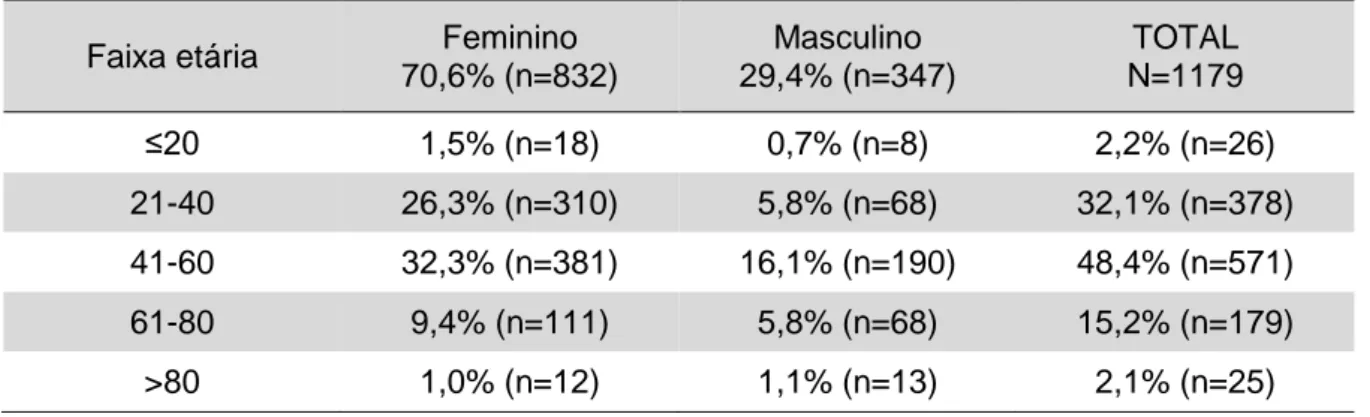
A amostra foi dividida por género e estratificada em 5 faixas etárias. As idades dos indivíduos da população estudada variaram entre os 9 e os 88 anos, sendo a idade média 46,8 (±14,9) anos. Verificou-se uma maior predominância de indivíduos do sexo feminino (70,6%) com um ratio mulheres:homens de 2,4:1. A faixa etária mais frequentemente encontrada em ambos os sexos foi de indivíduos com idades compreendidas entre os 41 e os 60 anos (48,4%) (tabela 4).
Tabela 4: Distribuição da amostra por género e faixa etária. Faixa etária Feminino
70,6% (n=832) Masculino 29,4% (n=347) TOTAL N=1179 ≤20 1,5% (n=18) 0,7% (n=8) 2,2% (n=26) 21-40 26,3% (n=310) 5,8% (n=68) 32,1% (n=378) 41-60 32,3% (n=381) 16,1% (n=190) 48,4% (n=571) 61-80 9,4% (n=111) 5,8% (n=68) 15,2% (n=179) >80 1,0% (n=12) 1,1% (n=13) 2,1% (n=25)
4.1.2. Caracterização da amostra relativamente ao serviço requisitante
Das 1179 amostras estudadas, 397 (33,7%) foram provenientes de serviços de internamento e urgência e 782 (66,3%) de serviços de ambulatório. Os principais serviços requisitantes foram os serviços de medicina interna, tanto nas amostras provenientes do ambulatório como do internamento e urgência (34,3% e 31,5%, respetivamente) (tabela 5).
18 Tabela 5: Distribuição da amostra por serviço requisitante.
Proveniência Serviço Doentes
N = 1179
Internamento/ Urgência
33,7% (n=397)
INT - medicina interna 31,5% (369)
INT - ginecologia/obstetrícia 0,4% (5)
INT - unidades de Cuidados Intensivos 0,3% (4)
INT – cardiologia 0,5% (6) INT – cirurgia 0,3% (4) URG – geral 0,3% (4) URG/INT – outros 0,4% (5) Ambulatório 66,3% (n=782) HDI – neurologia 1,3% (15)
CON - medicina interna 34,3% (403)
CON - cirurgia vascular 3,7% (44)
CON – medicina e doenças vasculares cerebrais 3,2% (38)
CON – neurologia 7,6% (90)
CON - hipertensão na gravidez 3,0% (35)
CON - pré-conceção 4,4% (52)
CON - obstetrícia / trombofilias 1,4% (17)
CON – obstetrícia 1,0% (12)
CON - patologia fetal 0,3% (3)
CON - imuno-hemoterapia 4,1% (48)
CON – ginecologia 0,3% (4)
CON – pediatria 0,5% (6)
CON – cardiologia 0,4% (5)
CON – outros 0,8%(10)
4.1.3. Caracterização da amostra relativamente à patologia
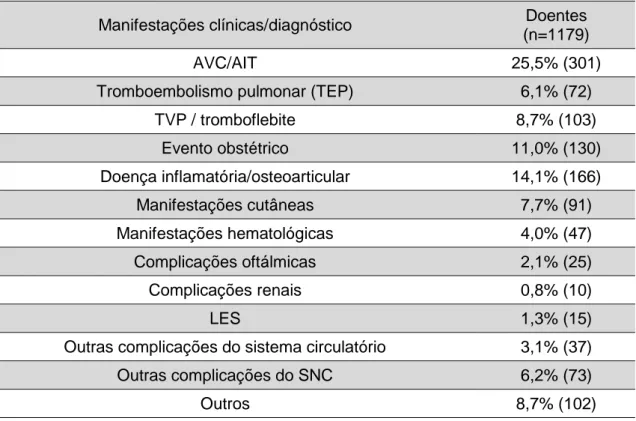
As amostras foram classificadas com base na informação clínica fornecida pelo médico do paciente. Nos pacientes com diagnóstico de múltiplas patologias, considerou-se o diagnóstico mais relevante para o estudo. As manifestações mais frequentemente encontradas foram o ACV/AIT (25,5%), as doenças inflamatórias/osteoarticulares (14,1%), os eventos obstétricos (11,0%) e a TVP/tromboflebite (8,7%) (tabela 6).
19 Tabela 6: Distribuição da amostra por manifestações clínicas.
Manifestações clínicas/diagnóstico Doentes (n=1179)
AVC/AIT 25,5% (301)
Tromboembolismo pulmonar (TEP) 6,1% (72)
TVP / tromboflebite 8,7% (103) Evento obstétrico 11,0% (130) Doença inflamatória/osteoarticular 14,1% (166) Manifestações cutâneas 7,7% (91) Manifestações hematológicas 4,0% (47) Complicações oftálmicas 2,1% (25) Complicações renais 0,8% (10) LES 1,3% (15)
Outras complicações do sistema circulatório 3,1% (37)
Outras complicações do SNC 6,2% (73)
Outros 8,7% (102)
4.2. Prevalência de anticorpos
4.2.1. Prevalência geral de aFL’s em primeira determinação
Para calcular a prevalência geral de anticorpos em primeira amostra, foram selecionados todos os pacientes com perfil laboratorial completo de SAF (AL, aCL e aβ2GPI), na primeira determinação, independentemente de terem confirmação em segunda amostra. No total, foram avaliados 1179 resultados. A prevalência de amostras de pacientes com pelo menos um aFL positivo na população estudada foi de 17,8% (figura 1).
Figura 1: Prevalência de amostras de pacientes com pelo menos um aFL positivo em primeira amostra. 82,2%
(969) 17,8%
(210)
Positividade geral na população estudada
Sem qualquer anticorpo positivo
Com pelo menos um anticorpo positivo
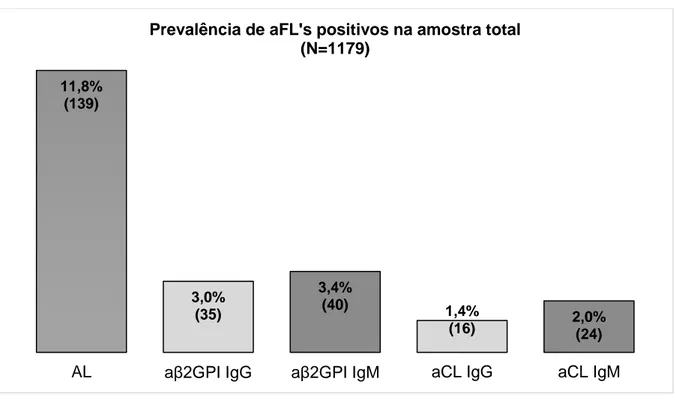
20 Avaliando a positividade de cada aFL individualmente, verificou-se que o AL foi o aFL mais frequentemente encontrado, sendo positivo em 11,8% das amostras estudadas. A positividade para os restantes aFL’s variou entre os 1,4% no caso dos aCL IgG e os 3,4% no caso dos aβ2GPI IgM (figura 2).
Figura 2: Prevalência de aFL’s positivos na amostra total.
Não foram encontrados trabalhos na literatura que reportem dados da prevalência de aFL’s positivos na primeira determinação e antes do SAF ser diagnosticado. No entanto, comparando os dados deste estudo com outros que avaliam os aFL’s em doentes com SAF diagnosticado, verifica-se que, a prevalência de aFL’s encontrada na população estudada foi menor para a maioria dos anticorpos. Les e colaboradores, num estudo que envolveu 70 pacientes determinaram uma prevalência de positividade para o AL de 28,6%, 8,6% para os aCL e 4,3% para os aβ2GPI (Les et al., 2018). Em outro estudo, Stojanovich e colaboradores, ao avaliarem uma população de 162 indivíduos com SAF primário, reportaram uma prevalência de AL de 53,7%, 32,1% de aβ2GPI IgG, 44,4% de aβ2GPI IgM, 33,3% de aCL IgG e 52,5% de aCL IgM (Stojanovich et al., 2012). Fujieda e colaboradores, ao estudarem eventos de trombose arterial numa população Japonesa com SAF, encontraram uma prevalência de AL de 82,3%, 31,3% de aβ2GPI IgG, 7,1% de aβ2GPI IgM, 35,5% de aCL IgG e 5,7 de aCL IgM (Fujieda et al., 2012). Embora a prevalência de anticorpos neste estudo seja na generalidade inferior à encontrada na literatura, a distribuição de aFL’s positivos é idêntica à referida noutros trabalhos. Neste estudo, e tal como noutros trabalhos, o AL foi o aFL mais frequentemente encontrado. Na
11,8% (139) 3,0% (35) 3,4% (40) 1,4% (16) 2,0%(24)
AL aβ2GPI IgG aβ2GPI IgM aCL IgG aCL IgM
Prevalência de aFL's positivos na amostra total (N=1179)
21 literatura, a frequência dos restantes aFL’s é bastante variável, não permitindo fazer comparação.
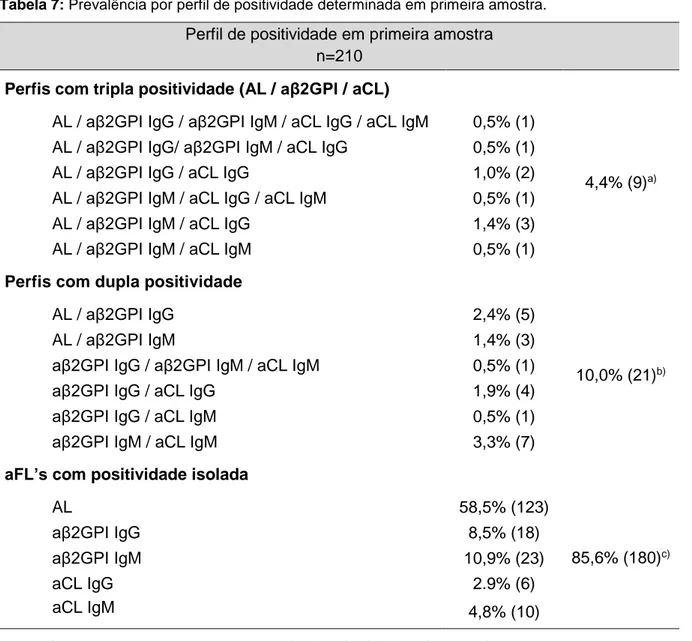
Avaliando o perfil de positividades, verificou-se que os anticorpos tanto podem surgir isoladamente como associados entre si. As combinações de aFL’s encontradas nas amostras positivas encontram-se sumarizadas na tabela 7.
Tabela 7: Prevalência por perfil de positividade determinada em primeira amostra. Perfil de positividade em primeira amostra
n=210 Perfis com tripla positividade (AL / aβ2GPI / aCL)
AL / aβ2GPI IgG / aβ2GPI IgM / aCL IgG / aCL IgM 0,5% (1)
4,4% (9)a) AL / aβ2GPI IgG/ aβ2GPI IgM / aCL IgG 0,5% (1)
AL / aβ2GPI IgG / aCL IgG 1,0% (2)
AL / aβ2GPI IgM / aCL IgG / aCL IgM 0,5% (1)
AL / aβ2GPI IgM / aCL IgG 1,4% (3)
AL / aβ2GPI IgM / aCL IgM 0,5% (1)
Perfis com dupla positividade
AL / aβ2GPI IgG 2,4% (5)
10,0% (21)b)
AL / aβ2GPI IgM 1,4% (3)
aβ2GPI IgG / aβ2GPI IgM / aCL IgM 0,5% (1)
aβ2GPI IgG / aCL IgG 1,9% (4)
aβ2GPI IgG / aCL IgM 0,5% (1)
aβ2GPI IgM / aCL IgM 3,3% (7)
aFL’s com positividade isolada
AL 58,5% (123) 85,6% (180)c) aβ2GPI IgG 8,5% (18) aβ2GPI IgM 10,9% (23) aCL IgG 2.9% (6) aCL IgM 4,8% (10)
Comparação com a população total (N=1179): a) 0,8%; b) 1,8%; c) 15,3%.
Fazendo uma avaliação dos perfis de múltipla positividade, verificou-se que, nas amostras positivas, a percentagem com tripla positividade foi de 4,4% e naquelas com dupla positividade foi de 10,0%. Considerando as amostras com dupla e tripla positividade, incluindo o AL, a percentagem é de 8,2%.
Os estudos clínicos encontrados na literatura confirmam que, a presença de tripla positividade em pacientes com SAF ou apenas portadores de aFL’s, representa um risco acrescido de eventos trombóticos e/ou obstétricos, principalmente quando associados ao AL
22 (Gómez-Puerta et al., 2016; Mustonen et al., 2014; Pengo et al., 2010; Pengo et al., 2015; Ruffatti et al., 2006). Yelnik e colaboradores, ao estudarem a persistência de tripla positividade como fator de risco trombótico em 98 pacientes concluíram que, nos pacientes com tripla positividade o risco trombótico foi maior (Yelnik et al., 2016). Les e colaboradores, também associaram a persistência de positividade para múltiplos aFL’s com um elevado risco trombótico (Les et al., 2018). Pengo e colaboradores, ao estudarem o risco trombótico associado ao AL, concluíram igualmente que, o risco trombótico é menor em pacientes apenas com AL positivo, quando comparados com outros com tripla positividade (Pengo et al., 2015). Já os pacientes com dupla positividade, mas com AL negativo, apresentam um risco menor. Provavelmente porque, nestes pacientes o nível de aβ2GPI não é suficiente para induzir a positividade do AL (Pengo et al., 2007). Os pacientes com positividade isolada, são menos propensos para desenvolver eventos relacionados com os aFL’s, no entanto, no caso do SAF relacionado com complicações obstétricas e com tromboses arteriais, a positividade para o AL, independentemente de ter outros aFL’s associados, foi considerada o principal preditor (Miyakis et al., 2006).
4.2.2. Prevalência de aFL’s em primeira amostra por proveniência da amostra
No que respeita à proveniência, verificou-se que, das 397 amostras oriundas de serviços de internamento e urgência, 21,4% apresentaram positividade em pelo menos um aFL e nas 782 provenientes do ambulatório, a positividade foi de 16,0%. A avaliação da significância entre os dois grupos, permite concluir que existe diferença estatisticamente significativa na positividade geral entre os serviços de internamento/urgência e os serviços de ambulatório (χ2= 5,296; ρ=0,021). As diferenças encontram-se sumarizadas na tabela 8.
Tabela 8: Prevalência geral de amostras positivas por proveniência da amostra. Internamento/ Urgência
(n=397)
Consulta/HDI
(n=782) χ2 (ρ)
Amostras com pelo menos
um anticorpo positivo 21,4% (85) 16,0% (125) 5,296 (0,021)
Foram considerados estatisticamente diferentes valores de p <0,05.
Foi ainda determinada a prevalência de positividades por aFL, de acordo com a proveniência da amostra do paciente. Os resultados obtidos encontram-se apresentados na tabela 9. Após avaliação destes dados, verificou-se que, a diferença estatística na avaliação geral da positividade deveu-se ao AL (χ2=10,797; ρ=0,001). No caso do AL, a prevalência de positividade foi maior nos serviços de internamento/urgência (16,1%), quando comparada
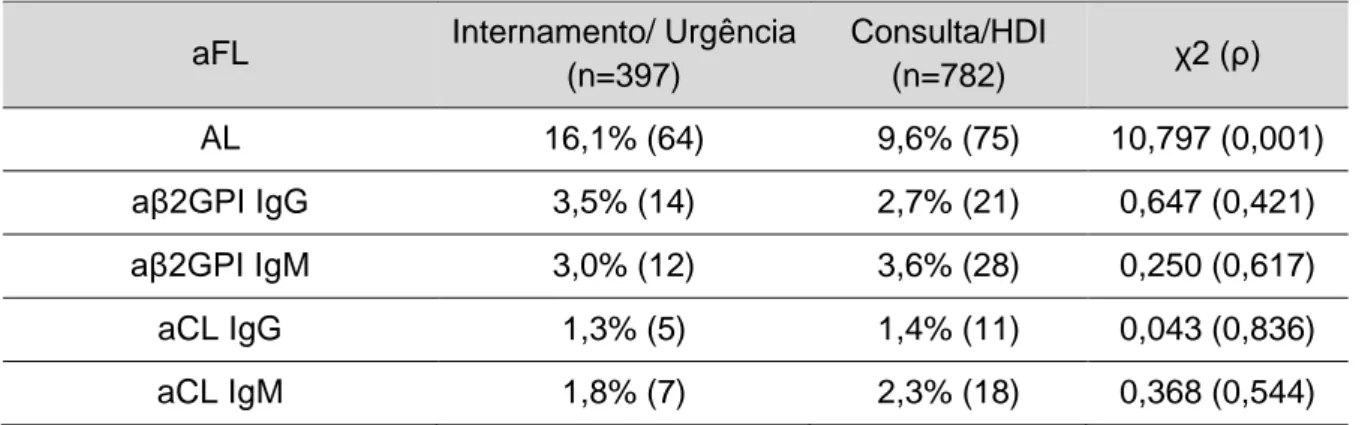
23 com os serviços de ambulatório (9,6%). Nos restantes aFL’s, não foi encontrada diferença estatisticamente significativa.
Tabela 9: Prevalência de positividades por aFL e proveniência da amostra. aFL Internamento/ Urgência
(n=397) Consulta/HDI (n=782) χ2 (ρ) AL 16,1% (64) 9,6% (75) 10,797 (0,001) aβ2GPI IgG 3,5% (14) 2,7% (21) 0,647 (0,421) aβ2GPI IgM 3,0% (12) 3,6% (28) 0,250 (0,617) aCL IgG 1,3% (5) 1,4% (11) 0,043 (0,836) aCL IgM 1,8% (7) 2,3% (18) 0,368 (0,544)
Foram considerados estatisticamente diferentes valores de p <0,05.
A diferença observada entre os pacientes internados e os provenientes do ambulatório, indicia que os aFL’s possam estar associados a estados agudos da doença. Estes resultados estão de acordo com as recomendações encontradas na literatura, que aconselham que, idealmente, a determinação dos aFL’s deve ser feita quando o paciente está clinicamente estável e não durante um evento agudo. A interpretação dos resultados dos testes laboratoriais realizados próximo de um evento tromboembólico agudo pode ser dificultada, uma vez que, os fatores de fase aguda, tais como, o fator VIII e o fibrinogénio, tendem a estar aumentados, podendo interferir com o resultado dos testes coagulométricos. Para além disso, os eventos agudos podem desencadear o aparecimento de aCL transitórios (Ortel, 2012; Out et al., 1989). Caso a determinação dos aFL’s seja efetuada na fase aguda da doença, tal como referido nas guidelines, é recomendado que os resultados positivos sejam confirmados para diferenciar se os aFL’s são persistentes ou transitórios (Devreese et al., 2018; Ortel, 2012).
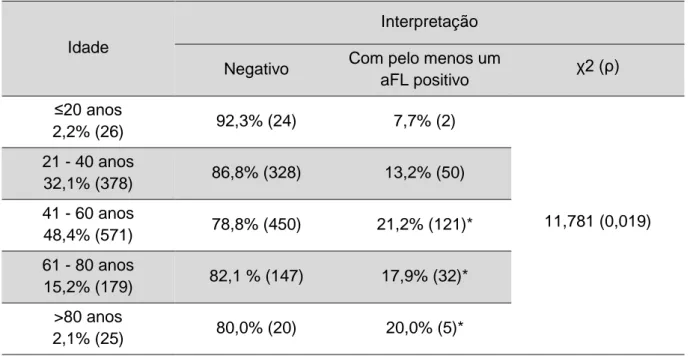
4.2.3. Prevalência de aFL’s por género e idade
A avaliação de doentes com aFL’s positivos em primeira amostra por faixa etária apresenta-se na tabela 10. A análise estatística permite concluir que, na população estudada, existe uma associação estatística entre a prevalência de positividades e a idade (χ2=11,781; ρ=0,019). A avaliação da distribuição de positividade, parece indicar que a prevalência de aFL’s positivos aumenta com a idade. Neste estudo, a frequência de positividades observada foi superior nos indivíduos com idade superior a 41 anos (59,1%).