Síndrome de Apneia Obstrutiva do Sono na Gravidez
Carolina Lourenço Drumonde Melo
2
Síndrome de Apneia Obstrutiva do Sono na Gravidez
Carolina Lourenço Drumonde Melo
Orientado por:
3
Abstrat
Obstructive sleep apnea (OSA) is characterized by repeated parcial or complete episodes of upper airway obstruction, resulting in intermitent hypoxemia, intrathoracic pressure swings and sleep fragmentation. The prevalence of these disturb increase during the pregnancy, due to physical, physiological and hormonal changes which occur in this period, presenting obesity as one major risk factor. OSA has been associated to maternal and foetal morbidity and mortality, standing out preeclampsia, gestacional diabetes, preterm delivery, and low birth weight. These outcomes arise from sympathetic activation, increased oxidative stress and generalized inflammatory response caused by OSA. Thus, early identification of sintoms, diagnosis and treatment of OSA are needed. The gold standard diagnosis is obtained by polysomnography and the treatment most recommended is CPAP, such as in general population given the lack of specific guidelines. The current information is still limited, more studies are needed about these pathology in pregnancy.
Keywords: OSA, pregnancy, preeclampsia; gestational diabetes; foetal morbidity, CPAP
Resumo
A Apneia Obstrutiva do Sono (AOS) caracteriza-se por episódios recorrentes de obstrução parcial ou completa da via aérea superior, resultando em hipoxemia intermitente, oscilações da pressão intratorácica e fragmentação do sono. A prevalência deste distúrbio aumenta durante a gravidez, devido a alterações físicas, fisiológicas e hormonais que ocorrem neste período, apresentando-se a obesidade como um dos fatores de risco mais importantes. A AOS tem sido associada a morbilidade e mortalidade materna e fetal, destacando a pré-eclâmpsia, a diabetes gestacionais, o parto pré-termo e o baixo peso à nascença. Estes efeitos adversos devem-se à ativação simpática, ao aumento do stress oxidativo e a uma resposta inflamatória generalizada provocados pela AOS. Portanto, a identificação precoce dos sintomas, diagnóstico e tratamento de AOS são necessários. O diagnóstico formal é obtido através da polissonografia e o tratamento mais recomendado é o CPAP, tal como na população em geral dada a ausência de guidelines específicas. A informação atual é ainda limitada, sendo necessários mais estudos sobre esta patologia na gravidez.
Palavras-chave: AOS, gravidez, pré-eclâmpsia, diabetes gestacionais, morbilidade fetal, CPAP.
4
Índice de Siglas
• Distúrbios Respiratórios do Sono (DRS) • Apneia Obstrutiva do Sono (AOS)
• Síndrome de Apneia Obstrutiva do Sono (SAOS) • Índice Apneia-Hipopneia (IAH)
• Índice de massa corporal (IMC) • Capacidade Residual Funcional (CRF)
• Rapid Eye Movement (REM) / Movimentos rápidos dos olhos
• Non-rapid eye movement (NREM) / Movimentos não-rápido dos olhos • Diabetes gestacionais (DG)
• Escala de Sonolência de Epworth (ESS) • Hipertensão Pulmonar (HP)
• Polissonografia (PSG)
• Dispositivos de pressão positiva contínua das vias aéreas (CPAP) • Dispositivos intra-orais de Avanço Mandibular (DAM)
5
Introdução e Definição
Os Distúrbios Respiratórios do Sono (DRS) englobam um vasto espectro de distúrbios respiratórios relacionados com o sono, incluindo Apneia Obstrutiva do Sono (AOS), apneia do sono central e hipoventilação relacionada com o sono.[1]
Um episódio de apneia ocorre quando o doente tem uma cessação de fluxo aéreo mais prolongada do que 10 segundos; a hipopneia ocorre com uma diminuição de 50% ou mais do fluxo aéreo com uma diminuição de 3% ou mais de saturação de oxigénio.[2]
O Síndrome de Apneia Obstrutiva do Sono (SAOS) constitui a forma mais comum de DRS e é caracterizada pelo colapso completo ou parcial repetitivo da via aérea superior resultando na redução do fluxo respiratório, interrupção do sono e hipoxemia.[1]
O índice apneia-hipopneia (IAH) representa o número de apneias/hipopneias por hora durante o sono e é usado para indicar a gravidade da apneia do sono. Um IAH < 5 é normal, 5 ≤ IAH <15 é considerada leve AOS, 15≤IAH <30 é considerada moderada AOS, e IAH≥30 é considerada severa AOS.[1]
Mulheres com apneia do sono muito frequentemente não sofrem de sintomas típicos de SAOS.[3] Os sintomas clássicos incluem sonolência diurna excessiva, sensação ofegante ou sufocante
durante o sono e apneias testemunhadas.[4] Além disso, na gravidez muitas mulheres experienciam
qualidade do sono reduzida e um funcionamento diário comprometido devido a outras alterações fisiológicas, como por exemplo, insónia, síndrome das pernas inquietas, aumento da frequência urinária, lombalgias e desconforto do aumento do útero, particularmente no terceiro trimestre.[5] Os distúrbios do sono e as alterações nos padrões do sono começam aproximadamente às onze semanas de gestação.[6] Portanto, disrupção subjetiva do sono e queixas de sonolência diária excessiva e fadiga na gravidez não são específicas de AOS e podem ser multifactoriais.[4]
O SAOS tem uma forte associação com o aumento do índice de massa corporal (IMC - superior a 25 - 30kg/m2), assim como o aumento de peso na gravidez.Outros fatores a considerar durante a gravidez são: ressonar habitual, hipertensão crónica e idade materna avançada.[5,2] Como determinantes anatómicos, além das alterações relacionadas com a gravidez, temos o grau de visualização da obstrução da via respiratória (classificada com um score Mallampati), a circunferência do pescoço, resposta fraca do músculo dilatador da via aérea superior (genioglosso) durante o sono, sensibilidade excessiva do sistema de controlo ventilatório e limite baixo de despertar respiratório.[4,7,8]
6
Efeitos da Gravidez na Respiração e no Sono
Alterações na anatomia e fisiologia do aparelho respiratório.
O aumento do perímetro abdominal e a redução da capacidade residual funcional pode reduzir o calibre da via aérea superior através de mecanismos dependentes dos volumes pulmonares. O estreitamento da via aérea superior pode ocorrer como resultado do edema da mucosa, que frequentemente ocorre durante a fase tardia da gravidez relacionada com o aumento da volémia e níveis elevado de estrogénio.[4]
Durante a gravidez ocorre um aumento no diâmetro anterior-posterior do tórax e diafragma superior, de modo a compensar o aumento do útero, provocando o estreitamento traqueal e reduções progressivas na capacidade residual funcional (CRF) em 20-25%, no volume de reserva expiratório em 15-20% e no volume residual em 22%.[5,8,9]
O consumo de oxigénio e a ventilação por minuto aumentam progressivamente durante a gravidez em 20% e 30-50%, respetivamente. O aumento da tendência ventilatória pode provocar episódios de obstrução respiratória ao aumentar o esforço do diafragma, criando pressão inspiratória negativa na via aérea superior hiperémica.[8] Além disso, a pressão parcial de oxigénio está aumentada e a pressão parcial de dióxido de carbono está diminuída (abaixo de 30mmHg).[3,9]
A obesidade e um útero aumentado resultam na redução da CRF em 20%, que se manifesta de forma mais acentuada no decúbito e durante o sono. A redução na CRF resulta na diminuição da oxigenação da mãe devido a uma aumento no gradiente alvéolo-arterial e aumento do desequilíbrio na relação ventilação-perfusão.[10]
O estreitamento anatómico e o aumento da resistência no sistema respiratório podem ocorrer uma vez que aumentos nos níveis de estrogénio e progesterona causam congestão capilar, hipersecreção e edemas na mucosa das vias aéreas superiores.[8]
Alterações hormonais
As alterações que ocorrem na gravidez devem-se principalmente à ação de estrogénio e de progesterona.
O aumento dos níveis de estrogénio durante a gravidez pode levar a um estreitamento da via aérea superior devido a rinite vasomotora, congestão nasal e edema da mucosa faríngea. A rinite gestacional foi verificada em mais de 20% das grávidas, o que pode potenciar o surgimento de SAOS.[7,4] A rinite na gravidez ocorre em até 42% das mulheres no terceiro semestre de gravidez,
7
sem reações alérgicas conhecidas. A congestão nasal pode ainda causar um aumento da resistência nasofaríngea e provocar uma pressão intrafaríngea mais elevada durante o sono.[7,8,9] O aumento da
circunferência do pescoço pode ser o reflexo destas alterações.
Relativamente à progesterona, o seu aumento sérico na gravidez pode, por um lado, assumir um efeito protetor através de um aumento da atividade do músculo dilatador da via aérea superior (genioglosso) e de uma resposta aumentada dos quimiorrecetores perante hipóxia e hipercapnia.[5,4] Por outro lado, um efeito a favor do aparecimento de SAOS através da ação da progesterona consiste no aumento do impulso ventilatório, o que contribui para instabilidades respiratória e maior pressão negativa intraluminal, portanto agravando a AOS.[7,4]
Resumidamente, as alterações fisiológicas que ocorrem durante a gravidez e que aumentam o risco de AOS são:[2]
• Aumento ponderal gestacional
• Edema faríngeo devido ao aumento dos níveis de estrogénio • Músculos dilatadores faríngeos sob o efeito progesterona • Estreitamento/Diminuição do calibre da traqueia
• Carga massa abdominal aumentada • Diminuição do volume pulmonar • Congestão nasal
Alterações no sono
A AOS resulta da ativação recorrente do sistema nervoso simpático e em vários estádios de micro ou macro-fragmentação do sono.[7]
Durante o primeiro trimestre da gravidez ocorre um aumento total do tempo de sono mas diminui a eficiência do mesmo, bem como as ondas lentas do sono, comparadas com as avaliadas antes da gravidez.[6]
Com a progressão para o fim do segundo trimestre, o tempo total de sono diminui, o número de despertares noturnos aumenta e o sono REM (Movimentos rápidos dos olhos) diminui.[6,11] Esta diminuição do sono REM constitui um fator protetor para a patologia respiratória do sono porque os eventos obstrutivos são mais comuns nesta fase do sono, durante a qual o tónus muscular da via aérea superior diminui. Os sonos REM, NREM (Movimento não-rápido dos olhos), e as fases 3 e 4 do sono estão reduzidas no terceiro trimestre. O aumento de sintomas de refluxo gastroesofágico (devido ao relaxamento do esfíncter esofágico inferior que se deve a um efeito direto do aumento de
8
progesterona), noctúria, contrações uterinas e movimentos fetais perturbam ainda mais o sono no terceiro trimestre. [6, 12]
Perda de sono e hipóxia intermitente têm sido associadas a alterações no metabolismo lipídico, sensibilidade à leptina e à grelina, que regulam o apetite, saciedade e metabolismo energético. Dados recentes sugerem que a resistência à insulina, dislipidémia e desregulação da leptina e grelina podem contribuir para a fisiopatologia da diabetes gestacionais e pré-eclâmpsia. No entanto, é desconhecido se estes ocorrem independentemente da obesidade.[8]
Em suma, no primeiro trimestre verifica-se um aumento do tempo total de sono e dos despertares nocturnos, assim como uma diminuição da qualidade global do sono. No segundo trimestre, ocorre uma normalização do tempo de sono, mas com aumento dos despertares nocturnos. No terceiro trimestre, os despertares nocturnos aumentam, apesar de se verificar a diminuição do tempo total de sono e do sono REM.
Consequências fisiopatológicas
Estes eventos resultam em consequências fisiopatológicas que incluem indução do stress oxidativo, atividade simpática, ativação do eixo hipotálamo-hipófise, inflamação, e alterações na regulação das hormonas do apetite, que por sua vez contribui para a disfunção endotelial e metabólica.[2]
O stress oxidativo tem sido reconhecido como o mecanismo crucial em vários distúrbios, incluindo patologia cardiovascular, inflamação, resistência à insulina, intolerância à glucose, dislipidémia e complicações na gravidez, como a AOS.A gravidade da AOS, em particular o índice de dessaturação de oxigénio, está indiretamente associado com o stress oxidativo. Pensa-se que a ligação entre a AOS e o stress oxidativo está relacionada com a hipoxemia intermitente.[2,13] A hipoxemia intermitente recorrente, a limitação do fluxo e os despertares são todas características de AOS e podem levar a stress oxidativo, estimulação simpática, e inflamação. Portanto, é biologicamente plausível que AOS pode, através de uma ou mais desta vias, ter um impacto negativo na oxigenação e perfusão tecidual placentária, predispondo potencialmente ao desenvolvimento de outcomes negativos mediados pela placenta.[14,15]
Uma ativação simpática desproporcionada persistente durante o dia leva ao aumento da reatividade vascular periférica e à produção de catecolaminas, à diminuição da sensibilidade do barorreflexo, ao impedimento da secreção pancreática de insulina e à libertação alterada de glucose hepática. Todos estes efeitos posteriores da AOS estão ligados ao desenvolvimento de hipertensão,
9
disfunção endotelial, compromisso do metabolismo da glucose e disfunção fisiopatológica, por vezes observada na pré-eclâmpsia. A secreção crónica de cortisol também aumenta a suscetibilidade à resistência à insulina e predispõe ao desenvolvimento de diabetes gestacionais.[2]
Em seguida é apresentada a Tabela 1 que sumariza os fatores protetores e promotores de AOS.[16]
Tabela 1: Fatores da gravidez que influenciam o risco de AOS
Fatores promotores de AOS Fatores protetores contra AOS Físicos
Hormonais
Aumento de peso Elevação do diafragma Estrogénio
• Hiperémia, edema da mucosa • Rinite vasomotora
Progesterona
• Hiperventilação, redução da pressão arterial de CO2, alcalose respiratória
• Impulso ventilatório aumentado, com pressão inspiratória mais negativa causando colapso da via aérea
Decúbito lateral durante o sono
Redução do sono REM numa fase mais tardia da gravidez
Progesterona
• Aumentado volume por minuto protegendo contra a oclusão
AOS - apneia obstrutiva do sono; CO2 – dióxido de carbono; REM – rapid eye movement
Adaptado de: Fung AM, Wilson DL, Barnes M, Walker SP. Obstructive sleep apnea and pregnancy: the effect on perinatal outcomes. Journal of Perinatology 2012; 32: 399–406
As grávidas que ressonam têm um risco aumentado de cardiomiopatia, embolismo pulmonar, pré-eclâmpsia e eclâmpsia. Adicionalmente a mortalidade materna é aumentada dentro destas circunstâncias.[3,8, 17] A hipoxemia noturna associada com AOS é um factor de risco independente de morte súbita cardíaca.[12]
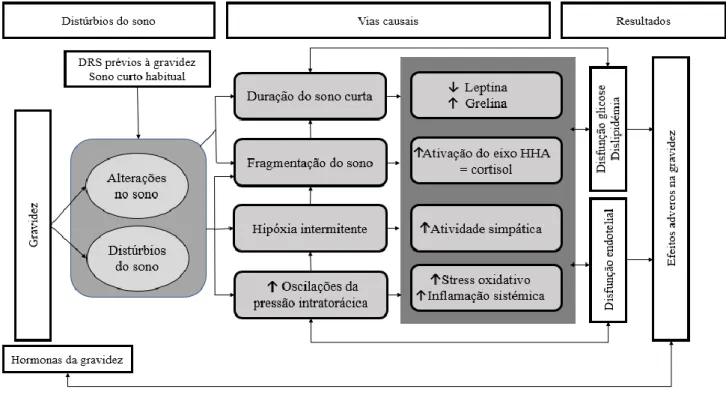
Pode concluir-se, com a leitura da Figura 1 abaixo apresentada, que a AOS ocorre como consequência de episódios repetidos de colapso parcial ou completo da via aérea superior durante o sono. Tal pode resultar em hipoxemia intermitente, oscilações da pressão intratorácica e fragmentação do sono secundária a despertares repetitivos. Estas consequências fisiológicas de DRS podem aumentar o risco de outcomes adversos durante a gravidez através de um mecanismo intermediário que inclui stress oxidativo, inflamação sistémica e hiperatividade do sistema nervoso
10
simpático, que levam a disfunção endotelial e, possivelmente, disfunção metabólica (deficiente metabolismo de glicose e lípidos).[8]
Figura 1: Potenciais vias causais que ligam a AOS durante a gravidez com efeitos adversos na
gravidez. HHA – hipotálamo-hipófise-adrenal; AOS - apneia obstrutiva do sono. Adaptado de Izci Balserak B. Sleep disordered breathing in pregnancy. Breathe 2015: 11: 268–277.
Prevalência
Apesar de atualmente a verdadeira incidência e prevalência permaneçam desconhecidas, estudos epidemiológicos sugerem uma prevalência de 2 a 13% de AOS. Ressonar, um dos sintomas chave da AOS, é apresentado por 15 a 25% das mulheres grávidas. A roncopatia aumenta ao longo da gravidez e segundo Facco et al os valores mais baixos foram observados no primeiro trimestre (3,6%) e os mais elevados observados no terceiro trimestre (8.3%).[18]
Existem vários questionários de rastreio disponíveis para detetar quem está em risco de AOS, incluindo os questionários escala de sonolência de Epworth (ESS), Berlin, Stop and Stop-Brang. Embora estes métodos sejam económicos e acessíveis, têm sucesso variável em estudos anteriores.[5]
Facco et al. demonstraram que um modelo com 4 variáveis, entre as quais idade, IMC, ressonar e hipertensão crónica tinham um valor preditivo mais elevado para diagnósticos de apneia
11
na população de grávidas de alto risco, do que o questionário de Berlim e a ESS, ambos usados para monitorizar a apneia de sono em populações não-grávidas.[7]
Dado o rápido aumento do índice de obesidade em todo o mundo, DRS vão tornar-se mais prevalentes nas grávidas e é uma mais valia estar a rastreá-los.[19]
Complicações maternas
Existem estudos reportando que o SAOS está relacionado com obesidade, doença do refluxo
gastroesofágico, doença cardiovascular, doença cerebrovascular como paralisia e Acidente Vascular Cerebral, diabetes mellitus, hipotiroidismo, Doença Pulmonar Obstrutiva Crónica, asma, síndrome do ovário poliquístico, artrite e depressão.A hipertensão é detetada em aproximadamente 30-50% das grávidas com SAOS.[20]
A hipertensão pulmonar (HP) é observada em 20-40% dos doentes com AOS. A circulação pulmonar não está apta, em mulheres com HP, para se adaptar às mudanças hemodinâmicas fisiológicas da gravidez e a pressão pulmonar aumenta quando o débito cardíaco se eleva. A disfunção ventricular direita associada com HP pode levar a dispneia, insuficiência cardíaca e sincope. As mulheres com AOS moderada a grave apresentam um risco elevado de mortalidade peri-parto, sendo, por isso, considerada esta condição uma contra-indicação para engravidar.[12]
Pré-eclâmpsia
Os distúrbios hipertensivos são as complicações médicas mais comuns na gravidez, afetando 5-10% das gravidezes, podendo ser estabelecida uma associação relevante com morbilidade e mortalidade materna e neonatal.[8] Estes são divididos em três categorias: hipertensão crónica, hipertensão gestacional e pré-eclâmpsia. A hipertensão gestacional é definida como uma pressão arterial mais elevada do que 140/90mmHg diagnosticada após as 20 semanas de gestação, enquanto a pré-eclâmpsia é caracterizada cumulativamente pelo aparecimento de hipertensão gestacional de
novo, proteinúria ≥300 mg/24horas e lesão de órgão que ocorre devido a redução da perfusão
secundária a vasospasmo e ativação endotelial.[1,8]
Os factores de risco de pré-eclâmpsia incluem história familiar de pré-eclâmpsia, primíparas, idade materna avançada, estado de hipercoagulação, obesidade, hipertensão pré-existente, diabetes e residência a elevada altitude. A pré-eclâmpsia pode complicar-se até 2-5% das gravidezes.[21]
Os mecanismos fisiopatológicos propostos entre a AOS e a hipertensão gestacional/pré-eclâmpsia sobrepõem-se, nomeadamente a inflamação e disfunção endovascular e hipóxia e/ou lesão
12
oxidativa.[7] No entanto, segundo um estudo de Bourjeily et al. é menos provável que a
eclâmpsia cause DRS, sendo mais provável que a AOS leve a alterações que predisponham a pré-eclâmpsia, ou mesmo que os dois distúrbios possam simplesmente coexistir.[15]
As complicações da pré-eclâmpsia incluem insuficiência renal, coagulação intravascular disseminada, lesão hepática, complicações neurológicas, edema pulmonar, restrição crescimento fetal e/ou sequestro placentário.Insuficiência placentária e o resultado hipoxia/isquémia têm mostrado ser cruciais na progressão da pré-eclâmpsia.[17,22] Um estudo realizado por Blyton et al. demonstrou existir uma diminuição dos movimentos fetais durante o sono materno em grávidas com pré-eclâmpsia e apneia do sono leve.[12]
Diabetes
DRS podem ser considerados indicadores de diabetes mellitus no futuro na população não-gestante, através de mecanismos tais como hiperatividade simpática, inflamação e stress oxidativo. Estes distúrbios podem contribuir para disfunções metabólicas durante a gravidez, tal como diabetes gestacionais.[1,5]
A prevalência de DRS em mulheres com diabetes gestacionais não tem sido estudada extensivamente, mas tem sido reportado ser entre 30-71%. A prevalência sobe com o aumento da taxa de obesidade materna.[8,17,23,24]
Hipóxia intermitente pode levar a diabetes gestacionais pela desregulação do sistema
hipotálamo- hipófise causando sensibilidade diminuída aos glucocorticoides.[19] Dados recentes
sugerem que a resistência à insulina, dislipidémia e desregulação da leptina e grelina podem contribuir para a fisiopatologia da DM gestacionais e pré-eclâmpsia. No entanto, é desconhecido se estes ocorrem independentemente da obesidade. A diabetes gestacional está associada com numerosos outcomes maternos, fetais e neonatais negativos, incluindo pré-eclâmpsia, cesariana, parto pré-termo, macrossomia e morte.[8]
Meslier et al. diagnosticaram DM no teste de tolerância à glicose com 2h em 30.1% da grávidas diagnosticadas com SAOS com PSG e em 13,9% das grávidas que o SAOS não foi diagnosticado. Stoohs et al. mostraram a relação entre a resistência à insulina e SAOS associada com obesidade.[20]
Em seguida, são apresentadas as figuras 2 e 3 que sumarizam o conteúdo
13
Figura 2: Potencial interação entre Apneia Obstrutiva do Sono e Pré-eclâmpsia. Adaptado de: Fung
AM, Wilson DL, Barnes M, Walker SP. Obstructive sleep apnea and pregnancy: the effect on perinatal outcomes. Journal of Perinatology 2012; 32: 399–406
Figura 3: Potencial interação entre Apneia Obstrutiva do Sono e Diabetes Gestacionais. Adaptado
de: Fung AM, Wilson DL, Barnes M, Walker SP. Obstructive sleep apnea and pregnancy: the effect on perinatal outcomes. Journal of Perinatology 2012; 32: 399–406
Complicações fetais
A inflamação aumentada, especialmente no início da gravidez, pode perturbar a normal remodelação das artérias espiraladas uteroplacentárias maternas e pode levar a placentação anormal, que é associada com disfunção endotelial, pré-eclâmpsia e parto pré-termo. Placentação anormal pode resultar em atraso no crescimento fetal, disfunção mitocondrial e disfunção metabólica nos bebés após o parto.[8]
14
Blyton et al. sugerem que a redução da atividade fetal e as desacelerações da frequência cardíaca fetal podem ser melhores substitutos dos marcadores de bem-estar fetal em grávidas com OSA. A redução nos movimentos fetais é um sinal de restrição do crescimento fetal ou nado-morto, e pode correlacionar-se com os eventos apneicos maternos. Blyton et al. realizaram polissonografia durante a noite em 20 grávidas com pré-eclâmpsia e 20 controlos e descobriram que a pré-eclâmpsia estava associada com o aumento da limitação do fluxo inspiratório ao longo da noite, aumentava a frequências da dessaturações de oxigénio e reduzia os movimentos fetais durante a noite.[25]
Uma meta-análise realizada por Ding et al. demonstrou que a AOS moderada-a-severa está associada com a maioria dos outcomes perinatais negativos, incluindo baixo peso à nascença (<2500g), admissão em unidades de cuidados intensivos neonatais, restrição de crescimento intrauterino e scores APGAR ao 1º e ao 5º minutos < 7.A relação entre AOS na gravidez e o peso à nascença, idade gestacional ou scores de APGAR < 7 aos 5 minutos foi estatisticamente insignificante.[12,17,19]
No entanto, apesar de alguns estudos sugerirem uma associação de DRS com crescimento fetal, score APGAR e prematuridade, outros estudos não encontraram tal efeito no feto. Estes dados conflituosos podem ser atribuídos à utilização de amostras pequenas, falta de medidas objetivas, incluindo mulheres com gravidezes complicadas e falhando o controlo de covariáveis importantes tais como obesidade, diabetes e hipertensão.[8]
Diagnóstico
Estudos de apneia na gravidez tendem a relatar uma classificação mais ampla de DRS do que AOS. Tal acontece porque estes estudos, por vezes, apoiam-se mais em questionários com sintomas do que em polissonografias em laboratório, o que não permite uma diferenciação objetiva entre as várias formas de DRS.[26]
O ressonar e as pausas respiratórias relatados pelo parceiro são mais fiáveis do que os testes de rastreio na gravidez.[8] Como explicado anteriormente, a sintomatologia da AOS nas mulheres, especialmente nas grávidas, é menos específica. Além disso, muitas pessoas acreditam que a qualidade do sono reduzida e a sonolência diária excessiva são normais durante a gravidez, pelo que as grávidas adiam ou não se dirigem a um profissional de saúde.[5] Estes factores, conjugados com baixa alerta entre os médicos, têm como consequência o atrasos no reconhecimento e AOS subdiagnosticada.[26]
15
Grávidas com suspeita de DRS devem ser referenciadas para um centro do sono para obterem evidências sobre os eventos respiratórios anormais e submetidas a um polissonografia (PSG) durante a noite. Monitores do sono domiciliários portáteis podem ser convenientes e uma alternativa mais barata ao PSG, mas os dados são insuficientes na sua validação e fiabilidade nas grávidas.[8]
Durante o primeiro trimestre, as grávidas de alto risco, nomeadamente aquelas com IMC>25 kg/m2, perímetro do pescoço aumentado, multíparas, idade avançada e hipertensão crónica devem ser rastreadas para DRS/AOS. Todas as grávidas com AOS deviam também ser rastreadas para diabetes gestacionais com uma prova de tolerância oral à glicose, pois estas têm elevada resistência à insulina e podem ter diabetes pré-existentes.[12]
Mulheres com DRS pré-existente podem igualmente necessitar de serem reavaliadas, particularmente após os seis meses de gravidez, porque os sintomas podem reaparecer ou piorar com a congestão nasal e o aumento de peso.[8]
Tratamento
Não existem guidelines específicas para a gravidez para o tratamento de DRS. Muitos médicos seguem as recomendações do tratamento para a população em geral. As modalidades de tratamento incluem aparelhos médicos (a seguir explicitados), modificações no estilo de vida e cirurgia da via aérea superior. Não existem medicamentos que previnam ou tratem DRS.[8]
CPAP (dispositivos de pressão positiva contínua das vias aéreas)
Mulheres com AOS pré-existente e tratamento estabelecido com CPAP devem continuá-lo durante a gravidez. O CPAP pode necessitar de ser reajustado por volta das 24 semanas de gravidez devido à congestão nasal e aumento do IMC induzido pela gravidez. [8]
O benefício do tratamento com CPAP foi várias vezes demonstrado quando a hipersonolência diurna e a qualidade do sono são analisados como parâmetros. No entanto, mesmo em populações não-grávidas, é inconclusivo se o tratamento de DRS pode reduzir o risco de desenvolvimento de hipertensão ou diabetes.[18] Nenhum estudo investigou sistematicamente o efeito da terapêutica com CPAP no controlo da glicémia e nos outcomes na gravidez em mulheres com diabetes gestacionais e DRS.[1]
O CPAP é uma hipótese segura e eficaz de tratamento, tendo sido demonstrado que melhora o controlo da pressão arterial, o bem-estar do feto, assim como a evolução do feto e da mãe.[1,8] O objetivo do CPAP é eliminar os eventos respiratórios anormais (IAH<5 por hora) e prevenir
16
dessaturações recorrentes de hemoglobina abaixo de 90%.[8] Abaixo de IAH<5 pode-se apenas vigiar.
O CPAP automático é provavelmente superior ao CPAP fixo, dado que a pressão pode necessitar de ser aumentada em 1-2 cmH20 às 24 semanas de idade gestacional.[1,27]
Um estudo recente de Blyton et al. demonstrou que mulheres com pré-eclâmpsia tinham limitação do fluxo inspiratório e dessaturações noturnas que foram associadas com a redução dos movimentos fetais noturnos, tendo a terapia com CPAP aumentado os movimentos fetais. Apesar destes estudos serem promissores, são necessários outros de maior dimensão para se conseguir avaliar os benefícios da terapia com CPAP na hipertensão gestacional, pré-eclâmpsia e diabetes gestacionais. [8]
Embora exista alguma evidência de que o tratamento materno com CPAP possa ser benéfico na diminuição da pressão arterial em grávidas com hipertensão pré-existente e pré-eclâmpsia, o que não se sabe é se o tratamento ameniza o risco de outras complicações se a hipertensão materna não estiver presente. Existe alguma evidência de que o uso de CPAP nasal noturno melhora os movimentos fetais em grávidas com pré-eclâmpsia. Embora o mecanismo responsável não seja claramente elucidado, é possível que a oxigenação fetal seja melhorada pela combinação de uma melhor oxigenação materna e perfusão placentária.[14, 19] Não obstante, o tratamento com CPAP pode
ter efeitos adversos, incluindo dor, náusea e alterações musculoesqueléticas permanentes. [8] Alternativas ao CPAP
Tratamentos alternativos como aparelhos orais, modificações no estilo de vida e, em casos limitados, cirurgia reconstrutiva de via aérea superior, provaram não serem tão eficazes como CPAP.[2]
Os dispositivos intra-orais de avanço mandibular (DAM) são uma alternativa à terapia com CPAP nos DRS leve a moderado. Os DAM são considerados ajustáveis quando contêm um mecanismo para aumentar o grau de avanço mandibular, ou fixos quando são fabricados numa posição fixa. Os DAM feitos por medida e ajustáveis proporcionam melhores resultados do que os fixos e pré-fabricados. Trazem o palato mole, a língua e o osso hióide para a frente e ativam os músculos masséter e submaxilares, prevenindo o encerramento.[1]
Os DAM podem não ser práticos dado a necessidade de múltiplos encaixes ou reencaixes devido ao ganho rápido de peso durante a gravidez. Estes levam semanas a meses para ser devidamente ajustados, sendo, por isso, recomendado o CPAP como primeira linha de terapêutica
17
para tratar DRS na gravidez. Os DAM permanecem uma opção viável nos DRS leves a moderados nas grávidas que não toleram CPAP.[1]
Embora a perda de peso frequentemente diminua a gravidade de DRS e potencialmente possa prevenir o desenvolvimento desta patologia na população em geral, não é uma opção muito adequada para as grávidas. Porém, controlando o ganho de peso durante a gravidez e atingindo posteriormente o peso normal prévio a esta é possível diminuir o risco de DRS de novo e as suas complicações associadas. Mulheres sem dessaturações da oxihemoblogina significativas ou complicações hipertensivas podem possivelmente beneficiar de dormir em decúbito lateral ou com a cabeceira elevada. Outras modificações de estilo de vida que podem ser úteis nos DRS incluem evitar medicamentos que destabilizem a respiração, um horário de sono-vigília irregular, fumar, congestão nasal noturna, e, por fim, comidas pesadas ou picantes antes de adormecer. [8]
A cirurgia eletiva não está recomendada durante a gravidez.Estas cirurgias incluem avanço mandibular e cirurgia ao palato mole. Uma série de casos sugerem que o avanço maxilo-mandibular tem uma eficácia cirúrgica superior de 86% e cirurgia ao palato mole tendo uma eficácia de 35-50%. [28]
A Figura 4 resume a abordagem sugerida por Pien e Schwab[29] para a avaliação da AOS nas grávidas.
18
Figura 4: Recomendações para a avaliação e tratamento de grávidas com suspeita de Apneia
Obstrutiva do Sono. IAH (Índice de apneia/hipopneia), Apneia Obstrutiva do Sono (AOS), Continuous Positive Airway Pressure (CPAP), Saturação arterial de Oxigénio (SaO2). Adaptado de
Pien GW, Schwab RJ. Sleep disorders during pregnancy. Sleep 2004;27:1405–17.
Período Parto e Pós-parto
A AOS está associada a um aumento de 2.5-3.5 vezes o risco de complicações no parto, incluindo cardiomiopatia, insuficiência cardíaca congestiva e histerectomia. A duração da estadia no hospital e a probabilidade de admissão numa unidade de cuidados intensivos é maior nas grávidas com AOS. [30]
AOS pode melhorar ou resolver-se no período pós-parto. Considera-se que tal esteja relacionado com a queda dos estrogénios, progesterona, perda de peso e aumento da capacidade residual funcional após o parto.[1] Ocorre também uma melhoria dos sintomas de roncopatia e apneia, tornando-se estes semelhantes ao estado antes da gravidez.
Não existem atualmente guidelines para o rastreio pós-parto ou permanente manutenção da AOS diagnosticada durante a gravidez. No pós-parto, a sonolência diária não é um marcador útil de
19
AOS dada a privação de sono associada com os cuidados com o bebé.Deverá ser considerada uma repetição da polissonografia após a estabilização do peso para monitorizar a persistência de DRS. A terapia via CPAP deverá ser continuada até nova reavaliação. Futuras gravidezes devem ser acompanhadas de perto relativamente ao retorno dos DRS.[1]
Embora ninguém tenha demonstrado nenhuma diferença na avaliação motora ou comportamental durante as 48h que se seguem ao parto entre mulheres com e sem AOS, um estudo demonstrou que os filhos de grávidas com AOS vs sem AOS têm menores scores de desenvolvimento social e mais bebés ressonam no primeiro ano de vida.[4]
Grávidas com DRS devem levar os seus dispositivos CPAP para usar durante o período de admissão no periparto. Os DRS estão associados com elevada frequência de cesarianas não planeadas e, assim, com elevado risco de anestesia geral. Grávidas com DRS que são submetidas a anestesia têm risco aumentado de no pós-operatório sofrerem hipóxia, insuficiência respiratória, eventos cardíacos e transferência para Unidade de Cuidados Intensivos. Os médicos devem estar sensibilizados para os diagnósticos de DRS e quanto às precauções perioperatórias, tais como antecipação de uma possível dificuldade respiratória, uso de agentes anestésicos de curta ação, evitar opioides e a entubação deve ser realizada numa posição que não a supinação.[1]
A decisão para controlar o DRS após o parto deve ser individualizada de acordo com a gravidade dos sintomas, perda de peso e comorbilidades. A gravidade de DRS diminui após o parto devido à perda de peso e diminuição do edema nasofaríngeo. A gravidade de DRS e a gestão do plano devem ser reavaliados por um especialista do sono para todas as mulheres que tiveram DRS pré-existente, foram diagnosticadas com DRS de novo ou houve suspeita de DRS durante a gravidez. Um PSG pós-parto pode ser necessário para estas mulheres após a estabilização do peso (aproximadamente 3 meses após o parto). [8]
Conclusão
Dos distúrbios respiratórios do sono que ocorrem na gravidez, a AOS é a mais frequente, podendo aparecer de novo ou ser desmascarada pela gravidez. A AOS resulta em hipóxia intermitente, oscilações da pressão intratorácica e fragmentação do sono secundária a despertares repetitivos. A AOS deve-se a alterações específicas da gravidez, nomeadamente anatómicas, hormonais e do sono. Podem-se realçar o aumento da carga abdominal, o edema faríngeo causado pelo aumento dos níveis séricos de estrogénio e o aumento do impulso ventilatório devido à subida dos níveis séricos de progesterona.
20
A sintomatologia da AOS nas grávidas não é passível de ser identificada pelos meios de rastreio que são utilizados na população em geral devido a alguma sobreposição com as alterações fisiológicas específicas da gravidez. O diagnóstico final é feito pela polissonografia. É necessário que durante o acompanhamento da gravidez os médicos estejam alerta para o diagnóstico desta patologia para que não permaneça subdiagnosticada.
A AOS é especialmente relevante na gravidez devido aos riscos que apresenta para a saúde materna, nomeadamente o aparecimento de pré-eclâmpsia e diabetes gestacionais, e para o feto, como por exemplo, o parto pré-termo e o baixo peso à nascença. As condições atrás referidas têm etiologia multifatorial.
Atualmente, não existem guidelines específicas para o tratamento da AOS na gravidez, sendo recomendado o CPAP, o mesmo que é utilizado na população em geral. São necessários mais estudos sobre o impacto da terapia com CPAP na gravidez. No período pós-parto, há uma melhoria da sintomatologia da AOS com retorno ao estado basal na maioria dos casos.
Agradecimentos
À minha família, pelo acompanhamento incondicional neste percurso exigente.
Aos meus amigos, que estando longe ou perto, mantiveram-se sempre presentes para me confortar à distância de um telefonema.
Ao meu orientador, o Doutor Marco Simão, pelo apoio, disponibilidade e confiança transmitidas. Ao coordenador, o Professor Doutor Óscar Dias pela amabilidade, por ter sido incansável a responder aos meus emails. Agradeço-lhe o entusiasmo que demonstrou desde o primeiro momento com o tema. Sem a ajuda de ambos este trabalho não teria sido possível.
Bibliografia
[1] Truong K and Guilleminault C 2018 Sleep disordered breathing in pregnant women: maternal and fetal risk, treatment considerations, and future perspectives Expert Rev. Respir. Med. 12 177–89
[2] Cain M A and Louis J M 2016 Sleep Disordered Breathing and Adverse Pregnancy Outcomes
Clin. Lab. Med. 36 435–46
[3] Beatmungs- S- and Hagen-ambrock H K 2018 Obstructive Sleep Apnea Syndrome and Pregnancy Pneumologie 72 187–96
[4] Pamidi S and Kimoff R J 2018 Maternal Sleep Apnea Chest 153 1052-1066
[5] Longworth H, McCallin K, Narayanan R P, Turner M A, Quenby S, Rycroft D, Charnley M, Abayomi J, Topping J, Weeks A D and Wilding J P H 2017 Screening methods for obstructive sleep apnoea in severely obese pregnant women Clin. Obes. 7 239–44
21
[6] Lee K A, Zaffke M E and McEnany G 2000 Parity and sleep patterns during and after pregnancy Obstet. Gynecol. 95 14–8
[7] Bazalakova M 2017 Sleep disorders in pregnancy Semnin Neurol 37 661–8 [8] Izci Balserak B 2015 Sleep disordered breathing in pregnancy Breathe 11 268–77
[9] LUNGEANU-JURAVLE L, , Natalia PATRASCU O C D and A M C 2016 The Role of Obstructive Sleep Apnea in Developing Gestational Hypertension and Preeclampsia Maedica
(Buchar). 11 330–3
[10] Edwards N and Middleton P G 2002 Sleep disordered breathing and pregnancy Thorax 57 555–8
[11] Bourjeily G, Fung J Y, Sharkey K M, Walia P, Kao M, Moore R, Martin S, Raker C A and Millman R P 2014 Airflow limitations in pregnant women suspected of sleep-disordered breathing Sleep Med. 15 550–5
[12] Carnelio S, Morton A and McIntyre H D 2017 Sleep disordered breathing in pregnancy: the maternal and fetal implications J. Obstet. Gynaecol. (Lahore). 37 170–8
[13] Khan N, Lambert-Messerlian G, Monteiro J F, Hodosy J, Tóthová Ľ, Celec P, Eklund E, Curran P and Bourjeily G 2018 Oxidative and carbonyl stress in pregnant women with obstructive sleep apnea Sleep Breath. 22 233–40
[14] Ravishankar S and Bourjeily G 2015 Evidence Of Placental Hypoxia In Maternal Sleep Disordered Breathing Pediatr Dev Pathol. 18 380–6
[15] Bourjeily G, Curran P, Butterfield K, Maredia H, Carpenter M and Lambert-Messerlian G 2015 Placenta-secreted circulating markers in pregnant women with obstructive sleep apnea J.
Perinat. Med. 43 81–7
[16] Fung A M, Wilson D L, Barnes M and Walker S P 2012 Obstructive sleep apnea and pregnancy : the effect on perinatal outcomes J. Perinatol. 32 399–406
[17] Reutrakul S and Mokhlesi B 2016 Obstructive Sleep Apnea and perinatal risk Rev Inves Clin.
68 3–6
[18] Facco F L, Parker C B, Reddy U M, Silver R M, Koch M A, Louis J M, Robert C, Chung J H and Pien G W 2017 Association Between Sleep-Disordered Breathing and Hypertensive Disorders of Pregnancy and Gestational Diabetes Mellitus Obs. Gynecol 129 31–41
[19] Brown N T, Turner J M and Kumar S 2018 The intrapartum and perinatal risks of Sleep-Disordered Breathing in pregnancy: a systematic review and meta-analysis. Am. J. Obstet.
Gynecol. 9378 30147-9
[20] Karaduman M, Sarı O, Aydoğan U, Akpak Y K, Semiz A, Yılanlıoğlu N C and Keskin U 2016 Evaluation of obstructive sleep apnea symptoms in pregnant women with chronic disease J. Matern. Neonatal Med. 7058 1–7
[21] Wallis A B, Saftlas A F, Hsia J and Atrash H K 2008 Secular trends in the rates of preeclampsia, eclampsia, and gestational hypertension, United States, 1987-2004 Am. J.
Hypertens. 21 521–6
[22] Hutcheon J A, Lisonkova S and Joseph K S 2011 Epidemiology of pre-eclampsia and the other hypertensive disorders of pregnancy Best Pract. Res. Clin. Obstet. Gynaecol. 25 391– 403
[23] Reutrakul S, Zaidi N, Wroblewski K, Kay H H, Ismail M, Ehrmann D A and Van Cauter E 2011 Sleep disturbances and their relationship to glucose tolerance in pregnancy Diabetes
22 Care 34 2454–7
[24] Bisson M, Sériès F, Giguère Y, Pamidi S, Kimoff J, Weisnagel S J and Marc I 2014 Gestational diabetes mellitus and sleep-disordered breathing Obstet. Gynecol. 123 634–41 [25] Blyton D M, Skilton M R, Edwards N, Hennessy A, Celermajer D S and Sullivan C E 2013
Treatment of Sleep Disordered Breathing Reverses Low Fetal Activity Levels in Preeclampsia
Sleep 36 15–21
[26] Abdullah H R, Nagappa M, Siddiqui N and Chung F 2016 Diagnosis and treatment of obstructive sleep apnea during pregnancy Curr. Opin. Anaesthesiol. 29 317–24
[27] Reid J, Glew R A, Skomro R, Fenton M, Cotton D, Olatunbosun F, Gjevre J and Guilleminault C 2013 Sleep Disordered Breathing and Gestational Hypertension: Postpartum Follow-up Study Sleep 36 717–21
[28] Holty J E C and Guilleminault C 2010 Surgical Options for the Treatment of Obstructive Sleep Apnea Med. Clin. North Am. 94 479–515
[29] Venkata C and Venkateshiah S B 2009 Sleep-Disordered Breathing During Pregnancy J Am
Board Fam Med 22 158–68
[30] Bourjeily G, Danilack V A, Bublitz M H, Lipkind H, Muri J, Caldwell D, Tong I and Rosene-montella K 2017 Obstructive sleep apnea in pregnancy is associated with adverse maternal outcomes: a national cohort Sleep Med. 38 50–7