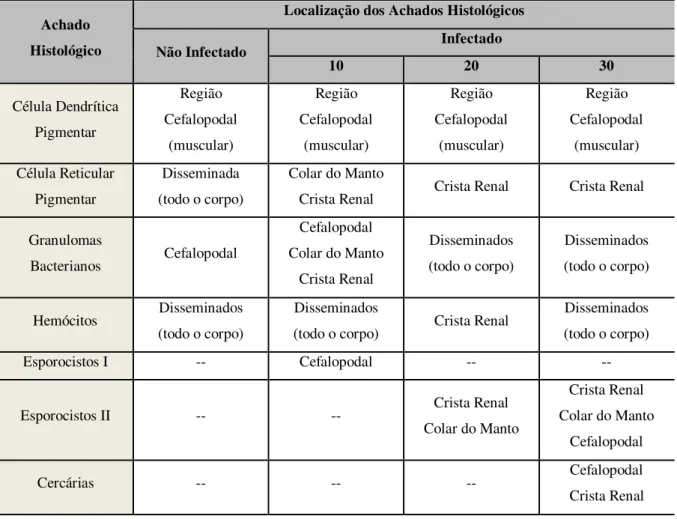
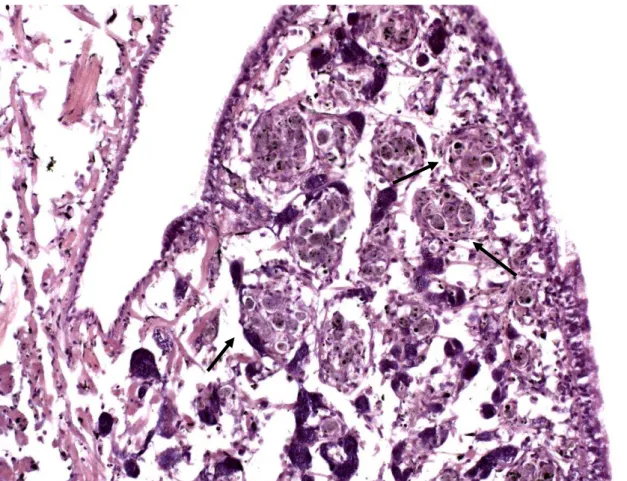
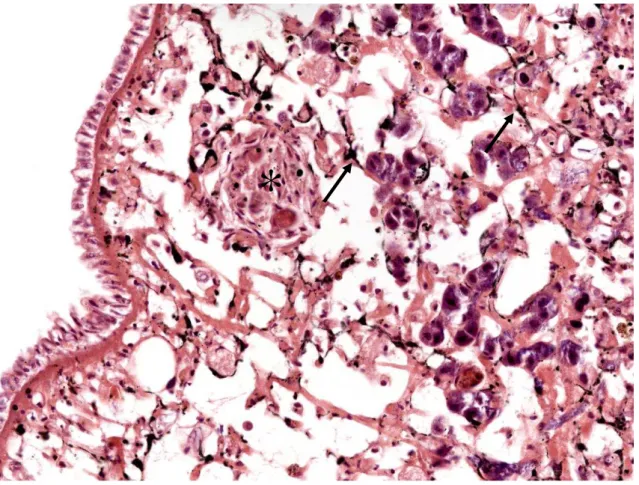
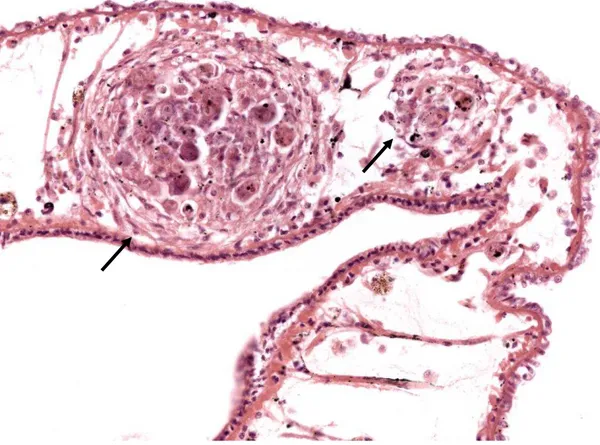
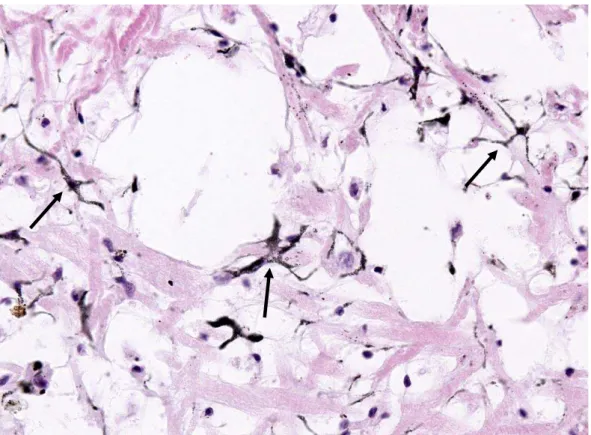
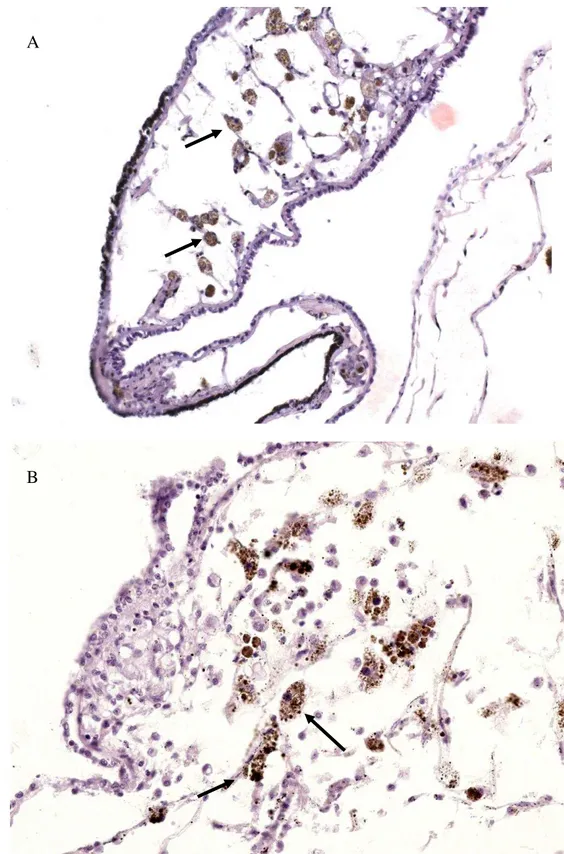
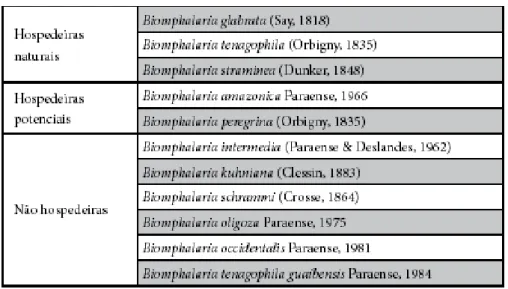
Sistema pigmentar de Biomphalaria glabrata infectada e não infectada pelo Schistosoma mansoni e as alterações histológicas ocorridas pósinfecção
Texto
Imagem


Documentos relacionados
Machado (2012) também faz utilização da cal para melhoramento de características mecânicas do solo, o autor conclui que apesar da literatura não recomendar
A utilização do fungo Pochonia chlamydosporia durante a fase de aclimatação das mudas de bananeira Prata Anã clone Gorutuba, produzidas em cultura de tecido,
It was observed an evident reduction in the score sum of the physical exam in all animals between days 0 (zero) and 30, 60, 90 and 120 days aft er the last session of shock wave
MELO NETO e FROES (1999, p.81) transcreveram a opinião de um empresário sobre responsabilidade social: “Há algumas décadas, na Europa, expandiu-se seu uso para fins.. sociais,
Crisóstomo (2001) apresenta elementos que devem ser considerados em relação a esta decisão. Ao adquirir soluções externas, usualmente, a equipe da empresa ainda tem um árduo
Ainda nos Estados Unidos, Robinson e colaboradores (2012) reportaram melhoras nas habilidades de locomoção e controle de objeto após um programa de intervenção baseado no clima de
8 Heidegger señala que este haber llegado a ser es a la vez un nuevo llegar a ser, no entendido como que los tesalonicenses no eran antes de recibir la Fe, sino como un haber llegado
Outros estudos de modelagem do incremento em área basal que retrataram espécies em locais com diferentes condições de crescimento incluem o diâmetro à altura do peito como uma