UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS EXATAS E DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
TRINCAMENTO INDUZIDO POR HIDROGÊNIO EM AÇOS INOXIDÁVEIS SUPERMARTENSÍTICOS MODIFICADOS PELA AÇÃO DE BORO PARA APLICAÇÃO EM EXPLORAÇÃO DE PETRÓLEO EM ÁGUAS PROFUNDAS
Daniel Brito Bertoldi
UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS EXATAS E DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
TRINCAMENTO INDUZIDO POR HIDROGÊNIO EM AÇOS INOXIDÁVEIS SUPERMARTENSÍTICOS MODIFICADOS PELA AÇÃO DE BORO PARA APLICAÇÃO EM EXPLORAÇÃO DE PETRÓLEO EM ÁGUAS PROFUNDAS
Daniel Brito Bertoldi
Dissertação apresentada ao Programa de Pós-Graduação em Ciência e Engenharia de Materiais como requisito parcial à obtenção do título de MESTRE EM CIÊNCIA E ENGENHARIA DE MATERIAIS
Orientador: Dr. Tomaz Toshimi Ishikawa
Coorientador: Dr. Paulo Sérgio Carvalho Pereira da Silva Agência Financiadora: CAPES
B546t Trincamento induzido por hidrogênio em aços inoxidáveis supermartensíticos modificados pela ação de boro para aplicação em exploração de petróleo em águas profundas / Daniel Brito Bertoldi. -- São Carlos : UFSCar, 2016.
136 p.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2015.
1. Aços inoxidáveis supermartensíticos. 2.
DEDICATÓRIA
À minha família, Jorge Luís, Heliana, Lílian e Milena, com carinho.
VITAE DO CANDIDATO
AGRADECIMENTOS
Ao professor Tomaz Ishikawa pela orientação e amizade concedida ao longo de todos esses anos.
Aos professores Claudemiro Bolfarini e Paulo Sérgio Carvalho Pereira da Silva pela excelente orientação, ensinamentos, oportunidades e conselhos dados durante toda a minha formação.
Aos técnicos Beto e José Luiz pela amizade e auxílio no desenvolvimento da parte experimental do trabalho.
Aos integrantes do Laboratório de Corrosão em Metais, Sílvia Midori Higa, Rodrigo da Silva e aos professores Carlos Rovere e Sebastião Kuri pelos ensinamentos e auxílio em parte dos experimentos.
À minha namorada e companheira em todos os momentos Mariana, pelo carinho, dedicação e apoio nos momentos mais difíceis.
Ao LCE e seus componentes pelos ensinamentos na área de microscopia e preparação de amostras.
Aos colegas de trabalho, principalmente ao Guilherme Zepon pela colaboração durante a pesquisa.
À minha família Jorge, Heliana, Lílian e Milena pela confiança depositada em mim e pelo apoio em todas as minhas conquistas.
Ao PPGCEM e ao DEMa por proporcionar a oportunidade de realizar uma pós-graduação de excelente qualidade.
RESUMO
HYDROGEN INDUCED CRACKING IN BORON MODIFIED
SUPERMARTENSITIC STAINLESS STEEL FOR APPLICATION IN OIL EXPLOITATION IN DEEP SEAWATER
ABSTRACT
The oil exploitation and production in deep water involves drilling risers with over 7 km deep. In this condition, the environments found in such wells are too adverse, acting under the exploration and production equipment, high pressures, low temperatures, severe conditions of corrosion, wear and enabling environments to hydrogen formation in the presence of H2S. Stainless steels, such as supermartensitic, duplex and super duplex have corrosion resistance and mechanical properties suitable for use in pipes in oil exploitation; however, such materials have low wear resistance. Recent studies in DEMa-UFSCar shown promising results related to supermartensitic stainless steel with boron addition, promoting the borides formation which, in turn, increases the wear resistance of these materials. In this situation, no studies have yet been performed in relation to another critical requirement in this type of request: the hydrogen permeation. It is known that hydrogen in its atomic form, when it diffuses through the steel is deleterious to the mechanical properties. Thus, a more detailed study is needed to assess the influence of this element in such properties, analyzing his performance in microstructural character. The materials produced were characterized by techniques with X-ray diffraction (XRD), optical microscopy (OM) and scanning electron microscopy (SEM). After this stage, tensile specimens were hydrogenated by electrolytic technique and tested with low strain rate. The results were compared with the same material without a prior hydrogenation and showed a major influence of the microstructure in relation to the reduction of the absolute value of some important mechanical properties.
PUBLICAÇÕES
Trabalhos submetidos para publicação:
ÍNDICE DE ASSUNTOS
FOLHA DE APROVAÇÃO ... i
AGRADECIMENTOS ... iii
RESUMO ... iv
ABSTRACT ... vii
PUBLICAÇÕES ... ix
SUMÁRIO ... xi
ÍNDICE DE TABELAS ... xv
ÍNDICE DE FIGURAS ... xvii
1 INTRODUÇÃO E JUSTIFICATIVA ... 1
2 OBJETIVOS ... 5
3 REVISÃO BIBLIOGRÁFICA ... 7
3.1 Aços inoxidáveis supermartensíticos ... 7
3.2 Conformação por Spray... 17
3.3 A interação do hidrogênio com os metais ... 22
3.4 A permeação do hidrogênio ... 24
3.5 Danos pelo hidrogênio ... 27
3.5.1 Trincamento (fissuração) induzido (a) por hidrogênio - FIH (“hydrogen induced cracking”, “HIC”, em inglês) ... 30
3.5.2 Empolamento (“hydrogen blistering”, do inglês) ... 33
3.5.3 Trincamento pelo hidrogênio orientado pela tensão - THOT (“stress oriented hydrogen induced cracking, SOHIC”, em inglês) ... 35
3.5.4 Trincamento sob tensão em presença de sulfeto –TTS (“sulfide stress cracking, SSC”, em inglês) /Fratura retardada (“delayedfracture/cracking”, em inglês) ... 38
3.6 Teorias de fragilização pelo hidrogênio ... 52
3.6.1 Teoria da interação com discordâncias ... 53
3.6.2 Transformação martensítica da austenita ... 53
3.6.3 Formação de hidretos ... 54
3.6.4 Teoria da pressão interna ... 54
3.6.5 Teoria da decoesão ... 55
3.7 Técnicas eletroquímicas para introdução de hidrogênio ... 57
4 COMENTÁRIOS SOBRE AS LIGAS TRABALHADAS ... 63
5 MATERIAIS E MÉTODOS ... 71
5.1 Matérias-primas utilizadas para elaboração das ligas ... 71
5.2 Conformação por spray ... 72
5.3 Análise química ... 74
5.4 Caracterização microestrutural ... 75
5.5 Ensaios de dureza ... 75
5.6 Ensaio de polarização potenciodinâmica ... 76
5.7 Ensaio de Hidrogenação Eletrolítica ... 79
5.8 Ensaio de tração uniaxial com baixa velocidade do travessão ... 82
5.9 Caracterização das superfícies de fratura ... 83
6 RESULTADOS E DISCUSSÃO ... 85
6.1 Conformação por spray ... 85
6.2 Análise química ... 86
6.3 Difração de Raios X ... 88
6.4 Análise microestrutural ... 90
6.5 Dureza Vickers ... 97
6.6 Ensaio de tração uniaxial em baixa velocidade ... 98
6.8 Caracterização das superfícies de fratura ... 112
7 CONCLUSÕES ... 127
8 SUGESTÕES PARA FUTUROS TRABALHOS ... 129
ÍNDICE DE TABELAS
ÍNDICE DE FIGURAS
Figura 3.1Seção do diagrama em 0,2%C no sistema ternário de Fe-Cr-C[8] ... 8 Figura 3.2 Região monofásica martensítica no sistema de 0,01% C-Fe-Cr-Mo [8,9] ... 10 Figura 3.3 Uma nova abordagem para melhorar a resistência ao trincamento sob tensão em presença de H2S ... 12 Figura 3.4 Efeito do teor de Mo na taxa de corrosão e na susceptibilidade ao trincamento sob tensão na presença de sulfetos de AIS apresentando CO2, H2S e NaCl (cloretos) [8] ... 13 Figura 3.5 Efeito do teor de Mo na taxa de corrosão e resistência a corrosão localizada em uma temperatura de 175ºC com NaCl e CO2[8] ... 14 Figura 3.6 Microscopia eletrônica de varredura da austenita retida (branco) entre as ripas de martensita no aço inoxidável supermartensítico. O teor de austenita é 29 % como resultado de dois estágios de têmpera (σe (limite de escoamento) = 638 MPa) [12] ... 15
Figura 3.7 (a) Ilustração mostrando o princípio do processo de conformação por spray (atomização e deposição) e (b) Ilustração mostrando as trocas térmicas existentes entre o gás inerte e as gotas do metal atomizado [15,16,17] ... 18 Figura 3.8 Modelo esquemático mostrando diferentes geometrias que podem ser obtidas pelo processo de conformação por spray [18] ... 18 Figura 3.9 Representação esquemática da etapa de deposição [2] ... 19 Figura 3.10 Fração volumétrica em função do diâmetro da gota (μm) para
Figura 3.25 Desenho esquemático mostrando a morfologia do TTS em uma zona afetada termicamente (ZAT) de elevada dureza [36] ... 41 Figura 3.26 Limite de concentração máxima de H2S para o comportamento em
falhas induzidas por hidrogênio têm sido relatados em águas marinhas ultraprofundas e oleodutos. O caso especial da exploração de petróleo em camadas do pré-sal envolve a perfuração de poços com mais de 7 km de profundidade. Nessa situação, os ambientes encontrados em tais poços são demasiadamente severos, exercendo nos equipamentos de exploração e produção, pressões elevadas, baixas temperaturas, condições severas de corrosão, desgaste e ambientes propícios à formação de hidrogênio na presença de H2S. As principais fontes de hidrogênio são proteção catódica e a sua presença no metal de solda.
O trincamento induzido por hidrogênio de uma proteção catódica é resultado de mecanismos interconectados envolvendo eletroquímica, difusão, metalurgia, micromecanismos de fratura e carga externa. Por se tratar de um elemento extremamente pequeno (raio atômico), ele pode ser encontrado em solução sólida na estrutura cristalina dos metais e suas ligas, movendo-se por difusão no estado sólido com certa velocidade. Alguns fatores contribuem para aumentar ou reduzir a facilidade com que o hidrogênio se difunde em materiais metálicos no estado sólido a temperatura ambiente: composição química, estrutura cristalina, microestrutura, presença de óxidos na superfície dos metais, temperatura e taxa de deformação [1].
Átomos de hidrogênio produzidos eletroquimicamente, assim como aqueles que são provenientes de outros meios de contaminação, podem ser incorporados na rede cristalina e difundir pelo metal. O hidrogênio, dessa maneira, altera negativamente a qualidade e as propriedades do aço, ao longo de sua fabricação e aplicação nas condições de uso.
e prematura dos componentes no ambiente de serviço com tensões aplicadas inferiores às de projeto, principalmente quando o material, no caso do aço ou liga a base de ferro apresentem elementos de liga responsáveis pelo aumento da fragilidade, como é o caso do boro. A fragilização por hidrogênio é caracterizada pela degradação das propriedades mecânicas dos aços; redução da ductilidade em tração; tendência a mudar de morfologia da fratura dúctil para frágil; redução da tenacidade à fratura (obtida em geral pelos ensaios de impacto), sendo mais crítica em situações de baixa taxa de deformação, ocorrendo, em geral, entre 173K e 373K, principalmente em temperaturas próximas a ambiente. Soma-se a isso o fato que o metal que contém hidrogênio necessita estar submetido a forças trativas locais. Como acontece com os aços inoxidáveis supermartensíticos, aços de alta resistência mecânica são bastante susceptíveis ao fenômeno [1]. Tal situação também está relacionada à existência de um ambiente rico em hidrogênio e ao surgimento de um potencial eletroquímico na superfície do metal adequado à reação de evolução do mesmo.
Na indústria do petróleo, os tubos usados na exploração e produção,
como, por exemplo, os “risers” e as colunas de perfuração também são
susceptíveis a essas condições severas de trabalho. Os “risers” são tubos que
fazem a ligação entre os poços de petróleo no solo marinho e as plataformas ou navios na superfície e são tratados como as partes críticas de um sistema
de exploração “off-shore”. Eles têm por função, orientar a coluna de perfuração
até o poço, retornando o fluido de perfuração e os detritos das rochas de volta à plataforma. Um dos problemas encontrados no processo envolvendo a perfuração de poços de exploração relaciona-se ao desgaste da parede interna
dos “risers” por intermédio do contato dos conectores da coluna de perfuração
em rotação. Tal desgaste pode propiciar a perda de espessura da parede do
“riser”, levando ao seu rompimento, seguido de vazamento do fluído de
perfuração e consequente desastre ambiental.
São Carlos (UFSCar), um projeto financiado com recursos da Petrobrás, denominado “Dureza e resistência ao desgaste de ligas de ferro
amorfas/nanoestruturadas para revestimento de equipamentos da indústria do
petróleo”que objetiva um estudo amplo e abrangente sobre as ligas resistentes
a corrosão e também ao desgaste para inserção em estruturas “offshore”
2 OBJETIVOS
O objetivo do presente trabalho foi estudar o efeito do boro (com diferentes teores) quando adicionado aos aços inoxidáveis supermartensíticos, em relação ao trincamento induzido por hidrogênio, além de medir os níveis do mesmo, comparando os efeitos antes e depois de sua adição, bem como avaliar os modos de fratura existentes. Essas ligas foram “carregadas” por
hidrogênio como ocorre, por exemplo, em proteção catódica e foi estudado o comportamento das mesmas em ensaio padronizado envolvendo tração com baixas taxas de deformação.
Para isso, tornou-se necessário o desenvolvimento de uma metodologia para a introdução de hidrogênio em ligas a base de ferro através de uma via eletroquímica.
3 REVISÃO BIBLIOGRÁFICA
3.1 Aços inoxidáveis supermartensíticos
Desde meados da década de 90, os aços inoxidáveis supermartensíticos tornaram-se disponíveis e vem sendo utilizados (em quantidades crescentes) quase que exclusivamente na produção de tubos para a indústria de óleo e gás. Muitos operadores já tinham presenciado experiências muito positivas com categorias não soldáveis (notavelmente o aço martensítico AISI 410), principalmente para aplicações em estruturas ultraprofundas. Até o início do ano 2002, mais de 600 km de tubos feitos com aços supermartensíticos tinham sido construídos ao longo do mundo [6]. Tal aumento deve-se em grande parte por conta da melhoria de suas propriedades em comparação aos aços inoxidáveis martensíticos convencionais como AISI 410 e 420 e por ser economicamente mais viável que os aços inoxidáveis ferríticos-austeníticos (duplex). Dessa forma, tal tipo de aço apresenta melhor resistência à corrosão, tanto quando se trata de localizada quanto de generalizada, melhor resistência à corrosão sob tensão em temperatura ambiente do que os aços AISI 410 e 420, possuindo além disso altos limites de escoamento e ruptura, com valores maiores que os aços inoxidáveis duplex [7,8]. O conceito básico de metalurgia física referente a esses aços está no aumento de teor de Cr efetivo em solução sólida pela redução no teor de carbono, somando-se a isso a adição de níquel para manter a fase martensítica sem a presença de ferrita δ e adição de Mo para melhorar a resistência à corrosão localizada e sob tensão, além do trincamento sob tensão em presença de H2S. A partir do momento em que ocorre a redução no teor de carbono, ocorre também a redução na dureza dos aços e a possibilidade de melhorar a soldabilidade também é esperada. Além do mais, a eficiente resistência à corrosão e boa tenacidade mesmo na zona afetada termicamente (ZAT) tem sido também atingida pela modificação química para teores de carbono ultrabaixos (em geral até 0,01% C), porque o aumento na dureza da ZAT é contido eficientemente [8].
também alta resistência devido à transformação martensítica. A fim de criar um novo projeto de aço com melhores propriedades com manutenção da estrutura martensítica é útil entender o diagrama de fases já que a importância crítica da composição pode ser percebida. O efeito do teor de cromo na relação de equilíbrio é descrito na Figura 3.1:
Figura 3.1 Seção do diagrama em 0,2%C no sistema ternário de Fe-Cr-C[8].
Com o intuito de se obter uma fase martensítica sem a presença de ferrita δ, um aço com composição química dentro da região monofásica
austenítica (chamada de γ-loop) na temperatura de solubilização (alta temperatura), é aquecido e austenitizado, então resfriado até a temperatura ambiente para se transformar em martensita. Têmpera ao ar é normalmente empregada por causa da susceptibilidade a trincas de têmpera ou fratura retardada e o resfriamento rápido é desnecessário devido à boa temperabilidade no aço alto Cr. A temperatura final de transformação martensítica (Mf) situa-se aproximadamente a 150ºC que é praticamente o ponto crítico onde não resta austenita retida. No entanto, o teor máximo de Cr
para o aço transformável sem a presença de ferrita δ foi determinado como
superiores a 13%p, a ferrita δ se forma na temperatura de solução e
permanece na estrutura, reduzindo demasiadamente a resistência, a trabalhabilidade a quente e a resistência a corrosão sob tensão.
Sabendo-se que o carbono é conhecido como estabilizador da austenita e também atua na expansão da região austenítica no diagrama de fases, Cr e C podem ser acrescidos simultaneamente a fim de se manter a microestrutura martensítica. No entanto, nesse caso o teor de cromo efetivo dificilmente cresce por causa do decréscimo do soluto Cr na matriz pelo aumento da precipitação do carboneto tipo M23C6, onde o principal constituinte de M tem sido relatado como sendo Cr, além disso, observa-se também a redução na tenacidade devido ao surgimento desses precipitados. Portanto, pode-se concluir que não faz sentido aumentar o teor de cromo com o aumento do teor
de carbono a fim de prevenir a formação de ferrita δ.
Partindo-se dessa discussão acima, o teor de carbono deve ser mantido baixo para aumentar o teor de cromo efetivo na matriz, reduzindo a formação dos carbonetos indesejáveis para as propriedades do aço. No caso da ferrita
δ, a mesma é formada em temperatura de solubilização (altas temperaturas) devido à carência de elementos estabilizadores da austenita. A fim de se obter uma região monofásica austenita nessas temperaturas de solução, alguns elementos estabilizadores de austenita, tais como Ni, Co, Mn e Cu podem ser adicionados ou aumentados em quantidade. O Ni, nesse caso, é o elemento mais apropriado, já que ele apresenta o efeito mais forte na formação de austenita quando comparado aos outros elementos. Em certas ocasiões, por causa do custo, o Mn também é muito utilizado para essa função em substituição ao Ni. Apesar de alguma modificação que pode ser disponível para essas ligas, a ideia básica para o aço aperfeiçoado, deve ser baixo C, aproximadamente 13%p Cr e Ni adicionado ao aço inoxidável martensítico.
Figura 3.2 Região monofásica martensítica no sistema de 0,01% C-Fe-Cr-Mo [8,9].
Isso foi verificado pela observação da microestrutura dos aços contendo entre 12 a 19%p. Cr, 2 a 14%p. Ni e 0 a 3%p Mo no trabalho realizado por Kondo et al.[8] Apesar da adição de Ni ser necessária para estabilizar a austenita e não formar ferrita-δ em altas temperaturas (solubilização), a adição em grande quantidade faz com que a fase austenítica se torne excessivamente estável, sendo que a austenita retida permanece na microestrutura final por causa que a temperatura final de transformação martensítica cai para valores bem inferiores à temperatura ambiente. Dessa forma, observa-se através da Figura 3.2, que teores de Ni entre 4 e 8%p. nos aços com 2% de Mo são necessários para estabilizar a austenita e não formar ferrita-δ na temperatura de solubilização (altas temperaturas). Já a adição em grande quantidade de Cr forma ferrita-δ, consequentemente apenas uma
Devido a essa estrutura martensítica primária, os aços inoxidáveis supermartensíticos são susceptíveis a fragilização por hidrogênio, ambas relacionadas à soldagem, H2S e proteção catódica. Os aços são especialmente sensíveis em condições não tratadas termicamente, contendo martensita não revenida e austenita retida instável. Isso é muitas vezes a causa em soldas nas zonas afetadas termicamente, onde a maioria dos incidentes de trincamentos induzidos por hidrogênio ocorre.
taxa de permeação de hidrogênio deve ser reduzida. Como destacado na Figura 3.3, a solução mais favorável para decrescer o teor de hidrogênio em aços alto Cr é abaixar a taxa de permeação do hidrogênio por intermédio da supressão do hidrogênio gerado na superfície pela corrosão, o que corresponde ao abaixamento da taxa de corrosão.
Abordagem para melhorar a resistência ao trincamento sob tensão em presença de H2S em aços baixa liga
Melhoria na susceptibilidade de resistir à fragilização por hidrogênio dos materiais
Decréscimo em elementos de impureza Refinamento do tamanho de grão Microestrutura homogeneizada
Abordagem para melhorar a resistência ao trincamento sob tensão em presença de H2S em aços inoxidáveis
martensíticos/supermartensíticos
Supressão da taxa de corrosão ↓
Decréscimo no hidrogênio gerado ↓
Decréscimo na taxa de permeação de hidrogênio ↓
Decréscimo no teor de hidrogênio no aço
Kondo et al. [8] investigaram a resistência a esse tipo de trincamento sob tensão de vários aços inoxidáveis supermartensíticos em solução de 5% de NaCl com 3.0 MPa CO2 e 0,001 MPa H2S em 25ºC. Os resultados dos testes de taxa de corrosão e susceptibilidade a corrosão sob tensão por H2S são mostrados na Figura 3.4. A taxa de corrosão foi notavelmente decrescida com o aumento no teor de Mo. O aço com 2%p. Mo ou com teor superior não sofreu trincamento sob tensão por sulfetos, enquanto que aços com 1%p. Mo ou sem adição sofreram fissura sob tensão na parte inferior dos pites, no ambiente exposto. Já a Figura 3.5 mostra o efeito do teor de Mo menor do que 1% na taxa de corrosão e na resistência a corrosão localizada no ambiente sem agentes agressivos. Pequena adição de Mo foi também efetiva para reduzir a taxa de corrosão e melhorar a resistência à corrosão localizada em ambientes normais com temperaturas elevadas.
Figura 3.5 Efeito do teor de Mo na taxa de corrosão e resistência a corrosão localizada em uma temperatura de 175ºC com NaCl e CO2[8].
A despeito de todos esses conceitos metalúrgicos apresentados, três classes principais e com composições diferentes foram desenvolvidas, quais sejam o aço inoxidável supermartensítico baixa liga (11Cr-2Ni), média liga (13Cr-4,5Ni-1,5Mo), além do alta liga (13Cr-6Ni-2,5Mo) [11]. A Tabela 3.1 que se segue destaca uma composição típica dessas ligas:
Tabela 3.1 Composição padrão dos aços inoxidáveis supermartensíticos [11]. Baixa liga Média liga Alta liga %p. (mássica) 11Cr-2Ni 13Cr-4,5Ni-1,5Mo 13Cr-6Ni-2,5Mo
C (% max) 0,015 0,015 0,015
Mn (% max) 2,0 2,0 2,0
P (% max) 0,030 0,030 0,030
S (% max) 0,002 0,002 0,002
Si (% max) 0,4 0,4 0,4
Cu (% max) 0,2 – 0,6 0,2-0,6 0,2-0,6
Ni (%) 1,5 – 2,5 4,0-5,0 6,0-7,0
Cr (%) 10,5 – 11,5 11,0-13,0 11,0-13,0
Mo (%) 0,1 1,0-2,0 2,0-3,0
A classe de alta liga apresenta a temperatura de início de transformação martensítica mais baixa Mi (aproximadamente 200º C) e, consequentemente a austenita retida mais estável. As propriedades mecânicas irão variar com a composição química e o procedimento de têmpera. As ligas com alto teor de níquel, dessa forma, abaixam a temperatura Ac-1 (início da transformação austenítica). Isso pode ser utilizado em tratamento de têmpera um pouco acima de Ac-1 fornecendo reaustenitização parcialmente sem transformação para martensita. O resultado é uma austenita retida estável entre as ripas de martensita, oferecendo melhoria em ductilidade e tenacidade. Com dependência em relação ao ciclo de têmpera, a porcentagem de austenita retida pode variar no intervalo de 5 a 30%. Altas temperaturas de têmpera (bem acima de Ac-1) podem ser evitadas devido a formação de austenita instável. A microestrutura de um aço inoxidável supermartensítico com 29 % de austenita retida é apresentada na Figura 3.6.
O acréscimo no teor de elementos de liga propicia aos aços inoxidáveis supermartensíticos propriedades mecânicas superiores, além de melhorias nas propriedades referentes à corrosão [8,11,13,14]. A Tabela 3.2 que se segue, ressalta propriedades mecânicas de ligas representativas de cada categoria dos aços inoxidáveis supermartensíticos:
Tabela 3.2 Propriedades mecânicas dos aços inoxidáveis supermartensíticos [13].
Liga escoamento Limite de (MPa)
Limite de Resistência à Tração (MPa)
Resistência ao impacto (J)
Charpy-V à -20 ºC
Resistência ao impacto (J)
Charpy-V à -40 ºC 11Cr-2,5Ni
(baixa liga) 598 753 129 120
12Cr-4,5Ni-1,5Mo
(média liga) 769 918 193 187
12Cr-6,5Ni-2,5Mo
3.2 Conformação por Spray
O processo de conformação por spray (CS), também denominado de deposição por spray ou fundição por spray está representado na Figura 3.7. Este acontece através de duas etapas: atomização e deposição. A atomização ocorre através da injeção de um gás inerte (em geral N2 ou Ar) em alta pressão, em um fluxo de metal líquido que passa pelo bocal atomizador (produzindo um spray cônico formado por gotas de diferentes tamanhos) sendo que as gotas do metal atomizado são depositadas sobre um substrato que pode ser de formatos diferenciados (geometrias), quais sejam discos, cilindros ou chapas, possibilitando a obtenção de depósitos coerentes e parcialmente densos nas formas de tubos, tarugos ou chapas (Figura 3.8), processo conhecido como deposição.
O bocal de atomização possui diversos furos concêntricos em que o direcionamento do fluxo de gás coincide com o centro do tubo em que o metal líquido flui. Dessa forma, quando o fluxo do metal líquido entra em contato com o gás inerte (alta velocidade), ocorre a formação de um spray cônico constituído por gotas de diversos tamanhos que são impulsionadas para baixo da região onde ocorre a atomização em alta velocidade. Dessa forma, as gotas impulsionadas para a câmara de atomização são submetidas a altas taxas de resfriamento (103-105 K/s). Tais gotas de metal líquido em pleno vôo podem ser dissociadas em gotas de tamanhos menores até a obtenção de um tamanho mínimo de equilíbrio. Assim passa a existir ao mesmo tempo no spray, gotas líquidas, parcialmente solidificadas e completamente sólidas, propiciando um spray de gotas apresentando dimensões micrométricas, que são impulsionadas rapidamente, em forma de cone, para baixo da região de atomização. A trajetória do spray só é parada, como citado anteriormente, por um substrato cerâmico ou metálico que é posicionado logo abaixo, coletando as gotas metálicas sólidas, parcialmente solidificadas e líquidas, gerando um depósito,
(a) (b)
Figura 3.7 (a) Ilustração mostrando o princípio do processo de conformação por spray (atomização e deposição) e (b) Ilustração mostrando as trocas térmicas existentes entre o gás inerte e as gotas do metal atomizado [15,16,17].
Figura 3.9 Representação esquemática da etapa de deposição [2].
O depósito obtido pode adquirir formas diversificadas (como já citado anteriormente e mostrado na Figura 3.8), dependendo do movimento do substrato relativo ao atomizador, gerando as geometrias esquematizadas. As gotas que por acaso não se depositarem no substrato, devido ao seu tamanho reduzido, afastando-se radialmente do centro do spray formam pós que podem ser utilizados em outras aplicações e são denominados de overspray [16,19].
Um grande benefício do processo é que ligas depositadas por meio de spray, geralmente possuem fases com solubilidade sólida estendida ou fases metaestáveis e microestrutura refinada por causa da alta taxa de resfriamento imposta. Possibilita dessa forma, o processamento de peças com até 1 tonelada e com velocidade de produção elevada (0,1 a 2,5 kg/s), sendo um processo ímpar na fundição, aliando os benefícios da solidificação rápida (minimização de macro e microssegregações, microestrutura refinada) em peças volumosas [16-19]. O processo possibilita ainda o emprego de uma vasta gama de materiais, até mesmo alguns de difícil processamento por métodos mais comuns, incluindo ligas a base de Al, Pb, Cu, Mg, Ni, Ti, Co e alguns aços [17,18].
matéria-prima para outros tipos de processos como ligas de cobre que possuem enormes problemas de segregações e ligas de alta resistência como Cu-Mn-Ni.
No entanto, o grande entrave inerente ao processo, relaciona-se à formação de porosidade no depósito (podendo atingir um valor de 10%), o qual tem que ser conformado mecanicamente por intermédio da laminação a quente/frio, extrusão ou prensagem isostática a quente para a compactação do material. Os baixos rendimentos (eficácia da conversão do metal fundido a atomizado para o depósito), que variam de 60 até a 80%, também merece destaque entre as desvantagens do processo [19,20].
O processo é bastante flexível, permitindo, por exemplo, a introdução de partículas de reforço cerâmico dispersas no metal por pulverização simultânea. A aplicação da conformação por spray a aços foi impulsionada depois do aumento das dimensões do maior semiacabado que pode ser processado de 150 mm para 500 mm. Tal alteração foi conseguida após o desenvolvimento do atomizador duplo (twin atomizer), sendo fundamental para os aços ferramenta empregados em barras e blocos de dimensões superiores a 200 mm. O processo também encontra aplicação em superligas e demais aços onde a homogeneidade é fundamental para o desempenho [20].
Vários são os parâmetros de processo que devem ser controlados, quais sejam temperatura de vazamento, forma e tamanho do bocal de atomização, tipo e pressão do gás e a distância do bocal de atomização ao substrato. Tais parâmetros foram estudados por Cáceres [20] em seu trabalho de mestrado, sendo feita uma modelagem matemática da etapa referente à deposição na conformação por spray e experimentos relativos à liga Fe-Si. Dessa maneira, a microestrutura resultante no final do processo de conformação por spray está relacionada tanto ao tamanho das gotas geradas na etapa de atomização, quanto ao estado das gotas (sólida, líquida e parcialmente sólida) durante a deposição.
maneira, as trocas térmicas entre o fundido e os extratores de calor, quais sejam, o gás de atomização e o substrato são controlados diretamente por essa razão. Assim, quanto maior o valor de G/M, maior também será a velocidade das gotas e a perda de calor por convecção para o gás de atomização e por consequência maior será a taxa de resfriamento. Pode-se inferir também que com o aumento da razão G/M ocorre a redução do tamanho médio das partículas, proporcionando um processo de deposição com uma fração maior de gotas completamente sólidas que chegam até o substrato. Tal constatação é relevante, pois indica que o fluxo mássico do metal se reduziu em relação ao mássico de gás, ou de outra forma que o fluxo de gás aumentou em relação ao mássico de metal, resultando então em uma maior energia potencial do gás para a quebra do fluxo metálico em partículas, como mostra a Figura 3.10 [15,16,20].
Figura 3.10 Fração volumétrica em função do diâmetro da gota (μm) para
Outro parâmetro importante do processo é o superaquecimento, que seria a diferença entre a temperatura de vazamento e a temperatura de fusão, propriamente dita, do material. Pode-se concluir desse parâmetro que quanto maior o superaquecimento, maior também será o calor contido no material, proporcionando uma fração maior de gotas líquidas quando ocorrer o processo de deposição [15,16,20].
Por fim, a distância do bocal de atomização e o substrato (distância de atomização) é outro parâmetro importante a ser destacado. Pode-se dizer que as gotas com diâmetros menores retiram-se radialmente da região central do spray, dessa forma, a distância entre o bocal e o substrato é fundamental para se determinar qual é o tamanho médio das partículas que chegarão ao último em determinadas posições do depósito e a entalpia do mesmo [19,20].
3.3 A interação do hidrogênio com os metais
A interação do hidrogênio com os materiais pode ser observada de várias formas, tendo influência do meio e do metal utilizado. Todas, porém, provocam danos internos e externos demasiadamente severos. Tais prejuízos são, em geral, denominados na literatura técnica como fragilização, empolamento, trincamento sob tensão em presença de H2S, fissuração induzida pelo hidrogênio e trincamento induzido pela tensão [21,22,23].
O hidrogênio, dessa forma, interage com a maioria dos materiais metálicos por diversos mecanismos, promovendo modificações nas propriedades mecânicas que resultam em fraturas frágeis (instáveis). Os problemas inerentes à presença de hidrogênio, apesar de serem descritos há bastante tempo, tiveram um grande impulso nas últimas décadas, sobretudo em relação aos aços, com o uso indiscriminado de estruturas soldadas e de aços que possuem alta resistência mecânica [23].
presença de contaminantes específicos com H2S ou proteção catódica excessiva, muito comum na indústria petrolífera.
Desta forma, qualquer processo que possibilite a produção de hidrogênio atômico (ou nascente) na superfície do metal poderá propiciar a absorção pelo mesmo. Uma grande quantidade do hidrogênio, no entanto, tende a se combinar na forma molecular, saindo na forma de bolhas de gás. Assim, a fração que penetra no material é determinada pela presença de substâncias que reduzem a formação de moléculas de hidrogênio. Estudos sustentam que exemplos dessas substâncias sejam o sulfeto, cianeto e arsênico, além, obviamente da extensão da superfície do metal exposta ao hidrogênio [9,12,21,34].
A solubilidade (em rigor seria a capacidade de absorção) do hidrogênio nos metais pode acontecer por intermédio da formação de hidretos ou de incorporação na malha cristalina. Dentre aqueles que formam hidretos incluem-se o zircônio, vanádio, paládio e titânio cuja capacidade de absorção do hidrogênio é elevada e reduz com a elevação da temperatura [21].
Soma-se a isso o fato de que é verificado por intermédio de análises que os aços possuem em grande parte das vezes concentrações em hidrogênio mais elevadas que às de equilíbrio, supondo-se que uma parte considerável da supersaturação seja aliviada por difusão para poros e vazios internos, em que se aloja na forma de gás à alta pressão [12,21,22].
O hidrogênio atômico, proveniente de reações de corrosão, ou surgido por polarização catódica (proteção catódica), é adsorvido na superfície do aço (Had), que ao depender das condições do meio em questão poderá se recombinar, segundo a reação química de Tafel (3.1) [23], pelas reações eletroquímicas de Heyrovsky (3.2 e 3.3) ou ainda ser absorvido pelo metal (3.4):
Had + Had (H2)ad (3.1) Had + H3O+ + e- (H2)ad + H2O (3.2) Had + H2O + e- (H2)ad + (OH)- (3.3)
Em soluções básicas (alcalinas) as reações eletroquímicas de Heyrovsky acontecem de maneira primordial, partindo-se das moléculas de água, com destaque para a reação 3.3 em detrimento da reação 3.2.
Já em solução ácida H2SO4 (0,1N), a deposição de hidrogênio acontece quase em sua totalidade por reações de descarga-recombinação (Tafel, 3.1), sendo a recombinação eletroquímica (Heyrovsky, 3.2 e 3.3) perceptível apenas em altas densidades de corrente e sobrepotenciais catódicos. Em soluções alcalinas, as duas maneiras de recombinação surgem de maneira efetiva em potenciais catódicos, sendo que a recombinação eletroquímica substitui a recombinação química em potenciais mais negativos que -1,02 V. Certos promotores de hidrogenação (SeO2, As2O3 e Na2S) surgem como inibidores das reações de recombinação de hidrogênio em grau muito superior aos que inibem as reações de Heyrovsky [23].
3.4 A permeação do hidrogênio
fina membrana de aço que separa dois compartimentos de uma célula eletroquímica dupla. Uma das faces é polarizada catodicamente, de forma a prover a redução do hidrogênio sobre a superfície. O hidrogênio ao receber elétrons difunde-se por intermédio da membrana, chegando a sua face oposta, que se trata de uma face metal/eletrólito polarizada anodicamente em um potencial onde o hidrogênio atômico é re-oxidado. Conforme a corrente anódica gerada pelo processo de re-oxidação ao longo do tempo possibilita determinar o fluxo de difusão do hidrogênio atômico através do material, permitindo determinar, por meio da primeira lei de Fick, seu coeficiente de difusão, já que a distância de difusão (espessura da membrana) e o fluxo estacionário são conhecidos. A Figura 3.11 mostra o dispositivo utilizado:
Figura 3.11 Desenho esquemático da célula dupla experimentada por Devanathan [23].
estes apresentam uma grande discrepância entre si. Tais diferenças são
relacionadas à presença de “armadilhas” no material, que aprisionam o hidrogênio em concentrações além daquelas existentes na rede cristalina. São consideradas armadilhas, defeitos cristalinos, quais sejam contornos de grãos, interfaces entre matriz e inclusões, discordâncias e outros lugares onde a energia de interação com o hidrogênio é superior àquela entre o hidrogênio e os espaços intersticiais da rede cristalina [23, 27, 30, 34].
Com o aumento da temperatura, a energia de interação das armadilhas com o hidrogênio tende a tornar-se desprezível se relacionada à energia cinética disponível, desaparecendo o efeito das mesmas.
Podem-se classificar as armadilhas, em relação à sua energia de interação, da seguinte maneira [1,22,23]:
Armadilhas reversíveis: estão relacionadas àquelas em que o hidrogênio tem curto tempo de residência na temperatura de estudo, ou de outra forma, apresentam baixa energia de interação;
Armadilhas irreversíveis: são aquelas com baixa taxa de liberação de hidrogênio e alta energia de interação.
3.5 Danos pelo hidrogênio
Oliveira [1] estudou uma metodologia para determinação da concentração crítica de hidrogênio necessária para a propagação de trincas causadas pela fragilização pelo hidrogênio. Utilizou-se nesse caso um aço API P-110 com duas microestruturas (como recebida e laminada 60% a frio) e testado em duas temperaturas. Os resultados da permeação obtidos mostraram que a cinética de permeação é mais rápida e o tempo para obter o estado estacionário é menor a 308 K que a 298 K, sendo que o fluxo de hidrogênio também é maior a 308 K. Assim, quanto maior a temperatura, maiores são a solubilidade e a difusibilidade do hidrogênio; ao passo que quanto mais se aumenta o nível de deformação a frio do aço, maior é a solubilidade e menor a difusibilidade do hidrogênio. Isso se deve, pois nesse trabalho, imaginou-se que o material deformado de 60% equivaleria a região adjacente à ponta da trinca. Tal região teria grande densidade de defeitos e, em consequência, grande solubilidade e baixa difusibilidade, condições imprescindíveis para o caso de material deformado a 60%. Parte dos resultados do trabalho, incluindo o caso do material deformado é mostrada na Tabela 3.3:
Tabela 3.3 Parâmetros de permeação de hidrogênio para o aço API P-110 em função do grau de deformação de temperatura [1].
Dentre as formas que o hidrogênio pode estar presente nos aços (após a absorção) e no momento em que causa o dano é possível citar:
Dissolvido intersticialmente com H átomo; Precipitado na forma de H2;
Precipitado como composto, por exemplo: CH4, H2O e TiH2. Já em relação ao mecanismo, é possível distinguir duas grandes classes de modalidades em que o hidrogênio fragiliza os metais e que são chamadas de irreversíveis e reversíveis [21,22,31].
No caso da fragilização irreversível abordam-se os casos que a presença de hidrogênio leva ao prejuízo da estrutura do metal comprometendo sua resistência mecânica, mesmo que todo o hidrogênio seja eliminado posteriormente. Desta forma, pode-se concluir que a fragilização irreversível tanto pode acontecer quando a exposição ao hidrogênio é anterior quanto simultânea com a aplicação da tensão. Neste caso estão incluídos metais que possuem uma fase não metálica dispersa e sofrem pelo ataque do hidrogênio em alta temperatura. O hidrogênio, por sua vez, reage com a fase não metálica no interior da estrutura metálica, produzindo produtos gasosos que aparecem com grande pressão e são aptos a dilatar os locais das inclusões, gerando vazios internos de dimensões consideráveis, ou que difundem e concentram-se em regiões onde existem defeitos na estrutura cristalina, quais sejam vazios, discordâncias (espiral, aresta ou mista), contornos de grão, maclas e falhas de laminação. Geram-se, dessa forma, defeitos internos que atuam não apenas por intermédio da destruição da continuidade do metal, como também através da intensificação de tensões aplicadas e geradores de tensões internas adicionais [21,22,31].
Já a fragilização reversível é caracterizada por exigir a presença simultânea de tensões e hidrogênio, tendo-se então a trincamento induzido por tensão na presença de hidrogênio (HISC – hydrogen induced stress cracking). A eliminação do hidrogênio, nesse caso, antes da aplicação de tensão restaura a ductilidade do material. A fragilização aumenta com a redução da velocidade de formação, ou seja, é preciso a ação conjunta de tensão e hidrogênio durante certo intervalo de tempo para que a falha aconteça. Por esse motivo o fenômeno é em grande parte das vezes denominado fratura retardada (delayed fracture/cracking).
Tais danos podem acontecer depois que a peça nessa situação esteja em serviço sob cargas estáticas, de certa forma, baixas, durante um grande intervalo de tempo, sem prejuízo aparente até o momento da fratura.
Dessa forma, a carga estática, tratando-se da forma limite de deformação lenta, auxilia o aparecimento do fenômeno. As baixas tensões necessárias não têm muitas vezes outra origem que as tensões internas e residuais do metal [21,30-34].
corrosão do H2S em solução aquosa pode provocar quatro mecanismos de
danos, quais sejam fissuração induzida por hidrogênio (FIH ou “hydrogen induced cracking (HIC) ”), empolamento, trincamento sob tensão em presença
de sulfeto (TTS, conhecida também como “sulfide stress cracking (SSC) ”) e
trincamento pelo hidrogênio orientado por tensão (“stress oriented hydrogen induced cracking (SOHIC) ”). Porém, empolamento, HIC e SOHIC não são necessariamente provocados por corrosão nesse meio [23,36,37]. Posteriormente outros mecanismos de danos por hidrogênio serão citados com o intuito de tornar mais explicativo e completo o trabalho.
3.5.1 Trincamento (fissuração) induzido (a) por hidrogênio - FIH
(“hydrogen induced cracking”, “HIC”, em inglês)
Nesse caso, a ação do hidrogênio pode ocasionar suas próprias tensões ao se recombinar internamente, propiciando ruptura, sem depender de esforços externos ou internos devidos a tratamentos térmicos ou outros procedimentos. Esse tipo de trincamento induzido por hidrogênio (também conhecido
como “FIH” em português) acontece em estágios avançados de carregamento
de hidrogênio, por tempo de exposição ou por taxa de carregamento em ambientes bastante corrosivos. No começo, tais fissuras acontecem ao longo de inclusões não metálicas internamente a chapa, em geral no sentido da laminação. O estágio inicial seria o descolamento da interface metal/inclusão, posteriormente seguido do aumento de microvazios ocasionados por intermédio de altas pressões geradas pelo H2 que ali se instala. Dessa maneira, a forma que se manifesta seria o H2 precipitado (no interior do material) em inclusões alongadas. Em uma etapa posterior do processo, o campo de tensões ocasionado pelas extremidades das trincas faz com que elas se interliguem mesmo que aconteçam em planos distintos. Tal acontecimento é
denominado de trincas em degraus (ou “step wise cracking”, em inglês), em
Figura 3.12 Fotografia em corte de uma chapa trincada induzida por hidrogênio. Amostra de Aço ASTM A 516 Gr. 60 de um vaso de alta pressão [23].
Figura 3.13 Seção transversal de uma chapa mostrando um dano de trincamento induzido por hidrogênio [36].
Figura 3.15 Fotomicrografia ampliada mostrando a natureza da trinca em degraus para o dano de trincamento induzido por hidrogênio [36].
Figura 3.16 Desenho esquemático enfatizando o dano de trincamento induzido por hidrogênio que se manifesta através de trincas embebidas e superficiais com ênfase para o detalhe da trinca em degraus [36].
são caracterizadas como “patas de cavalo” ou “marcas de ferradura” e são
provenientes da exposição diretamente observável de trincamentos internos. O carregamento do hidrogênio pode acontecer tanto em alta quanto em baixa temperatura e a manifestação do fenômeno, em geral, acontece entre 25ºC e 150ºC, porém pode ocorrer em temperaturas superiores [22,36]. Nesse tipo de dano, vale ressaltar que o hidrogênio atômico combina nas inclusões não metálicas ou outras imperfeições para formar moléculas que são muito extensas para difundir através do aço. As composições químicas dos aços bem como os métodos de fabricação também afetam a susceptibilidade e podem ser adaptados para produzir os aços resistentes ao HIC. Esse tipo de dano é muitas vezes encontrado em aços conhecidos por “sujos” pelo alto nível de
inclusões ou outras descontinuidades internas provenientes do processo de fabricação. Por fim, a fissuração induzida por hidrogênio não apresenta nenhuma relação com a dureza do aço.
3.5.2 Empolamento (“hydrogen blistering”, do inglês)
(formação de bolhas) na parte exterior pode ser identificado por inspeção visual, ou até mesmo por contato manual. Um exemplo desse caso está destacado na Figura 3.17 que se segue, sendo que o desenho esquemático mostrando o empolamento em uma junta soldada pode ser visto na Figura 3.18:
Figura 3.17 Empolamento superficial pelo hidrogênio passível de detecção pelo ensaio visual [21].
Bolhas interiores, ou seja, dentro do aço podem ser determinadas por ensaio de ultrassom. É possível a utilização, também, de um provador de pressão de hidrogênio, constituído de forma que uma determinada superfície metálica seja submetida ao meio corrosivo – o hidrogênio atômico liberado na superfície externa difunde através de uma parede de espessura reduzida (1 mm) e é coletado em um vazio, de volume pequeno, que se transmite com um manômetro.
Como afirmado na API 571 [36], o empolamento resulta do hidrogênio gerado pela corrosão (H2S), e não pelo gás hidrogênio do processo corrente. Assim como o caso anterior, sua manifestação se dá principalmente entre 25ºC e 150ºC (podendo chegar a valores um pouco maiores), porém o carregamento (permeação do hidrogênio atômico para o interior) pode acontecer tanto em alta quanto em baixa temperatura. Quanto à dureza do metal, ela não tem nenhuma relação com esse mecanismo de dano.
Figura 3.18 Desenho esquemático mostrando o empolamento por hidrogênio [36].
Burk [38] afirma em seu trabalho que tal tipo de dano ocorre predominantemente em aços com limite de escoamento inferior a 551,6 MPa (80 ksi), sendo observado comumente em vasos de pressão, tubos e tanques de armazenamento.
3.5.3 Trincamento pelo hidrogênio orientado pela tensão - THOT (“stress
oriented hydrogen induced cracking, SOHIC”, em inglês)
e 3.20. Elas geralmente aparecem no metal de base adjacente às zonas de solda afetadas termicamente (ZAT) onde podem iniciar a partir dos danos por HIC ou outras trincas ou defeitos, incluindo trincamento sob tensão em presença de sulfeto. A forma que o hidrogênio apresenta quando da ocorrência do dano é a molecular precipitada em inclusões alongadas e hidrogênio atômico dissolvido. As tensões geradas são uma associação das geradas pelo próprio hidrogênio e das aplicadas ou residuais. Grande parte dos casos desse tipo de dano ocorre entre a temperatura ambiente e 150ºC (ou pouco acima), assim como os dois casos citados anteriormente, bem como a ausência de sua relação com a dureza do material.
Figura 3.20 Desenho esquemático da THOT em um filete de solda que é geralmente uma combinação do trincamento sob tensão em presença de sulfeto e o THOT propriamente dito[36].
Figura 3.21 Representação de uma trincamento por hidrogênio em junta soldada [40].
3.5.4 Trincamento sob tensão em presença de sulfeto – TTS (“sulfide
stress cracking, SSC”, em inglês) /Fratura retardada (“delayed
fracture/cracking”, em inglês)
A maior ocorrência de casos de corrosão ou deterioração relacionados ao hidrogênio tem acontecido em indústrias, como a de refino de petróleo, em que se tem a presença de gás sulfídrico. Esse gás reage com ferro, constituindo películas de sulfeto de ferro, FeS e hidrogênio atômico. A presença de cianeto, selênio, fósforo, arsênico, antimônio e sulfeto retarda a passagem de hidrogênio atômico para molecular, tendo-se, então a possibilidade de ocorrer a penetração de hidrogênio atômico no metal.
Em relação ao trincamento sob tensão por sulfetos (TTS), pesquisadores consideravam ser um caso de corrosão sob tensão, porém recentemente mostrou-se se tratar de um dano por hidrogênio. Esse tipo de dano é também
conhecido do inglês por “sulfide stress cracking” e já foi introduzido no tópico
afetada termicamente (ZAT). No entanto, as trincas dificilmente são restritas a essa área, podendo chegar ao cordão e até mesmo o metal de base. Sua morfologia é similar ao trincamento a frio de juntas soldadas, em que o agente causador, o hidrogênio, seria o mesmo. Em regiões de solda de maior limitação, no caso de tampos, dispositivos auxiliares de montagem e conexões, o trincamento é praticamente inevitável quando existe um meio corrosivo favorável. Em geral, os equipamentos tratados termicamente (PWHT, tratamento térmico após soldagem) não possuem trincamento se as soldas possuírem durezas inferiores a 200 HB, conforme o procedimento da NACE RP 0472 [23]. Dependendo do ambiente de serviço, pequenas zonas de dureza acima de 22 HRC (237 HB) apresentam grande susceptibilidade ao TTS [36,37]. No entanto já foram constatados alguns casos em que apesar do tratamento térmico e do controle da dureza, aconteceram trincas sob tensão em presença de sulfeto, como pode-se observar no trabalho de Merrick [40] e mostrado na Figura 3.22.
Figura 3.22 Trincamento sob tensão em presença de sulfeto em uma junta soldada. É possível perceber regiões com durezas baixas da ordem de 101 BHN [40].
aquosa com H2S como já exposto. Alguns equipamentos susceptíveis podem falhar mesmo durante as excursões em águas ácidas como também durante as paradas de produção.
Em suma o trincamento sob tensão com sulfetos é definido com uma fissura do metal sob ação combinada da tensão de tração e corrosão na presença de água e H2S. É uma forma de trincamento de tensão por hidrogênio resultante da absorção do hidrogênio atômico que é produzido pelo processo de corrosão por sulfetos na superfície do metal, como ilustrado na Figura 3.23. O carregamento acontece em baixa temperatura e o aspecto pode ser notado nas Figuras 3.24 e 3.25 seguintes.
Figura 3.23 Ilustração do processo de absorção do hidrogênio produzido pelo processo de corrosão por sulfetos no metal.
Figura 3.25 Desenho esquemático mostrando a morfologia do TTS em uma zona afetada termicamente (ZAT) de elevada dureza [36].
Revie [34] mostra um gráfico (Figura 3.26) que ressalta os efeitos sinérgicos de aços de alta resistência e alta concentração de H2S no ambiente para causar TTS. Nas zonas afetadas termicamente (ZAT) adjacentes a soldas, muitas vezes há várias zonas duras muito estreitas combinadas com regiões de alta tensão de tração residual que podem tornar-se fragilizadas de tal forma pelo hidrogênio atômico dissolvido (Figura 3.27).
Figura 3.26 Limite de concentração máxima de H2S para o comportamento em
Figura 3.27 Seção metalográfica de tubo soldado, mostrando aparente SSC na zona soldada [34].
O trincamento sob tensão em presença de sulfeto também depende da composição, microestrutura, resistência e níveis de tensão total (tensão aplicada mais tensão residual) do aço [22,34].
Comparando com a fissuração induzida por hidrogênio (HIC ou FIH), a orientação desta última depende da morfologia e de inclusões não metálicas presentes, ao passo que o TTS (SSC) é perpendicular à tensão. O trincamento sob tensão em presença de sulfeto ocorre apenas em determinadas condições de tensão enquanto que a HIC pode acontecer sem a aplicação de uma tensão externa. O SSC ocorre em geral em aço de alta resistência, ao passo que a
A API 571 reserva a designação “hydrogen stress cracking” para o
trincamento causado por HF em solução aquosa. A literatura em geral usa esta designação como sinônimo de SSC. A Figura 3.28 ilustra esse exemplo.
Figura 3.28 Trincamento causado por HF em uma zona termicamente afetada próximo a solda em um aço de vaso de pressão A516-70 após exposição em água de serviço (Ampliação de 35x) [22].
Ainda na API 571, a presença de cianetos é discutida como sendo um agravante para o mecanismo de SSC. Na presença de sulfeto acontece a seguinte reação, retardando a passagem do hidrogênio atômico para o molecular:
Fe +H2S → FeS + 2H (3.5)
Havendo a presença de cianeto, HCN, ácido cianídrico, esse reage com a película protetora de sulfeto de ferro, regenerando o H2S[21,34,36].
FeS + 2HCN → Fe2+ + 2CN- + H2S (3.6)
fragilização do material metálico. Em meio alcalino, o íon cianeto, CN-, pode formar o íon ferrocianeto, Fe(CN)64-:
Fe5+ + 6 CN- → Fe(CN)64- + S2- (3.7)
Este reage com Fe3+ gerando um precipitado com forte cor azul, o ferrocianeto, de ferro (III), como pode ser notado na figura 3.29.
4Fe3+ + 3Fe(CN)64-→ Fe4[Fe(CN)6]3 (3.8) Com o intuito de evitar a ação do cianeto, é comum o emprego de polissulfeto de amônio (NH4)2Sx, que reage com o cianeto formando o tiocianato, SCN-, inofensivo, por meio da reação:
CN- + Sx2- → SCN- + S2-x-1 (3.9)
Figura 3.29 Produto de cor azul por causa da formação de ferrocianeto de ferro (III), quando ocorre o ataque do ferro por ácido sulfúrico e presença de cianeto [21].
solução aquosa contendo H2S, onde o hidrogênio é reduzido, na fratura retardada acontece uma redução catódica de redução de H+ através de processos como a eletrodeposição, decapagem e pites. O carregamento também ocorre em baixas temperaturas assim como a manifestação do fenômeno e a forma que o hidrogênio está quando ocorre o dano é a forma atômica dissolvida, da mesma maneira que ocorre com o SSC. Assim, é um fenômeno que exige a ação combina de tensões externas ou residuais com o hidrogênio durante certo intervalo de tempo para que a fratura ocorra, dependendo da difusão do mesmo para regiões que apresentem defeitos ou concentração de tensões. Em geral, para se observar esse fenômeno são exigidos ensaios estáticos e dificilmente é possível tirar conclusões esclarecedoras quando são feitos ensaios de tração com grandes taxas de deformação, bem como os ensaios de impacto. Quando solicitada por tração, para que o dano se manifeste, esse deve ser realizado com baixas velocidades a fim de que o hidrogênio se difunda para a região tracionada. A norma ASTM B839-04 [33], mostra um método de ensaio que avalia a fratura retardada que costuma ser catastrófica, acontecendo de maneira imprevisível. Em estruturas como parafusos, trata-se de uma falha comum, onde a pior região tracionada é o segundo filete rosqueado (70% da carga do parafuso é aplicada nessa região) como pode ser observado na Figura 3.30. Em geral, nesses tipos de estrutura, uma forma de se evitar a fratura retardada é manter a temperatura durante 4 horas em torno de 250°C, a fim de que o hidrogênio se difunda para fora das regiões que podem ocasionar a falha.
3.5.5 Demais mecanismos de danos pelo hidrogênio
Figura 3.31 Exemplo ilustrando um dano por hidrogênio através do mecanismo de hidretação [22].
Figura 3.32 Exemplo de casos envolvendo metanização, com destaque para a microestrutura de um tubo que sofreu ataque por hidrogênio, produzindo fissuras no contorno de grão [22].
Esse problema não ocorre abaixo de 200°C. Aços expostos à alta temperatura e alta pressão de hidrogênio aparentam não afetados por dias ou até meses e então subitamente perdem sua resistência e ductilidade. Esse tipo de dano por hidrogênio é mais comumente constatado em aços que estão sujeitos a elevadas temperaturas em equipamentos de plantas petroquímicas que muitas vezes manipulam hidrogênio e hidrocarbonetos em pressões da ordem de 21 MPa (3 ksi) e temperaturas superiores a 540° C. A severidade do ataque por hidrogênio depende da temperatura, pressão parcial de hidrogênio, nível de tensão, tempo de exposição e composição do aço. Adições de cromo e molibdênio na última melhoram a resistência ao ataque por hidrogênio.
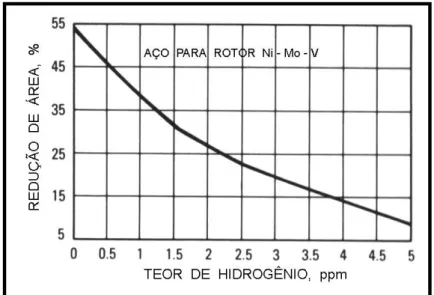
propriamente dita, ocasionada pela rápida redução da ductilidade com o aumento do teor de hidrogênio, como mostra a Figura 3.33.
Figura 3.33 Redução da ductilidade com o aumento do teor de hidrogênio (ppm) em um aço para rotor.
Tal tipo de dano é caracterizado pela fratura alveolar com regiões discretas intergranulares, observada na Figura 3.34.
Figura 3.34 Superfície de fratura mostrada para uma fragilização por hidrogênio propriamente dita.
Mais um dos mecanismos de danos induzidos pelo hidrogênio, comum
na indústria de fabricação dos aços são os chamados “flocos”. Nesse caso,
(“hairline cracks”) na parte central, sendo que essas fraturas recebem esse nome particular. Na superfície de fratura, flocos aparecem como pequenas áreas de trincas elípticas brilhantes. Eles são formados durante o resfriamento após o primeiro forjamento ou laminação e não durante o resfriamento após a solidificação. Flocos são causados por uma fragilização localizada por hidrogênio resultante do hidrogênio interno.
A fonte primária de hidrogênio na fabricação do aço é a umidade na atmosfera e nos aditivos, sendo que o teor de hidrogênio do aço fundido após o refino pode ser tão alto com 5 a 8 ppm [22]. Hidrogênio dissolve-se mais em estruturas cristalinas cúbicas de face centrada do que em estruturas cúbicas de corpo centrado e a solubilidade decresce exponencialmente com o decréscimo da temperatura. A solubilidade na rede do hidrogênio no aço é muito menor do que 0,1 ppm em temperatura ambiente. Consequentemente, no resfriamento, hidrogênio precipita na forma molecular em inclusões ou microporos e, visto que, essas regiões já são fragilizadas por hidrogênio, flocos são prontamente formados pela pressão de hidrogênio gasoso. É em geral reconhecido que os flocos se formam a temperaturas inferiores a 200°C (390°F). Eles são geralmente orientados dentro dos grãos de forjamento ou bandas segregadas. A susceptibilidade dos flocos cresce de acordo com o crescimento do teor de hidrogênio. A Figura 3.35 seguinte ilustra exemplos de flocos em peça fundida e em forjado.
(c)
Figura 3.35 (a) Ruptura interna em peça fundida; (b) “hairline cracks” em um forjado e (c) flocos em corpo de prova de tração de solda [22].
pois o hidrogênio é absorvido em alta temperatura. A forma evidente de trincas a frio pode ser vista na Figura 3.36.
Figura 3.36 Ilustração de trincas a frio na zona afetada termicamente.
3.6 Teorias de fragilização pelo hidrogênio
3.6.1 Teoria da interação com discordâncias
Esta teoria assume que a interação entre o hidrogênio e as discordâncias pode alterar a mobilidade das mesmas. Assim, o mecanismo de fragilização está relacionado com um efeito do hidrogênio na modificação das propriedades de microplasticidade do material, baseado em efeitos de endurecimento ou amolecimento local dependendo do material e dos elementos de liga presentes. Um dos princípios sugere que o hidrogênio restringe o movimento das discordâncias na região frente à ponta da trinca por causa do ancoramento de discordância por efeito de atmosferas de Cottrell. Esta redução na mobilidade das discordâncias dificulta a deformação na ponta da trinca, proporcionando que a propagação da trinca ocorra em menores níveis de tensão aplicada. Outro princípio sugere que o hidrogênio apresenta um efeito oposto, aumentando a mobilidade das discordâncias e, consequentemente, promovendo um amolecimento da região frente à ponta da trinca. Este fenômeno leva a uma propagação da trinca através de deformações localizadas, promovendo um processo de fratura plástica localizada pela redução da resistência do material.
Para Beachen [41], este propõe que o efeito do hidrogênio é o de acrescer a mobilidade de discordâncias em regiões de máximas concentrações de hidrogênio. Ele tirou essas conclusões ao observar superfícies de fratura ao hidrogênio de um aço SAE 1020. Entretanto, a fratura microdúctil apresentada pelo SAE 1020 não é, todavia, necessariamente uma evidência de aumento da mobilidade de discordâncias.
3.6.2 Transformação martensítica da austenita
![Figura 3.1 Seção do diagrama em 0,2%C no sistema ternário de Fe-Cr-C [8].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/38.892.173.544.301.681/figura-seção-do-diagrama-sistema-ternário-fe-cr.webp)
![Figura 3.2 Região monofásica martensítica no sistema de 0,01% C-Fe-Cr-Mo [8,9]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/40.892.162.659.147.492/figura-região-monofásica-martensítica-sistema-fe-cr-mo.webp)

![Figura 3.5 Efeito do teor de Mo na taxa de corrosão e resistência a corrosão localizada em uma temperatura de 175ºC com NaCl e CO 2 [8]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/44.892.183.612.145.430/figura-efeito-corrosão-resistência-corrosão-localizada-temperatura-nacl.webp)
![Figura 3.8 Modelo esquemático mostrando diferentes geometrias que podem ser obtidas pelo processo de conformação por spray [18]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/48.892.162.611.734.1044/figura-modelo-esquemático-mostrando-diferentes-geometrias-processo-conformação.webp)
![Figura 3.11 Desenho esquemático da célula dupla experimentada por Devanathan [23]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/55.892.155.753.486.1019/figura-desenho-esquemático-célula-dupla-experimentada-por-devanathan.webp)
![Figura 3.15 Fotomicrografia ampliada mostrando a natureza da trinca em degraus para o dano de trincamento induzido por hidrogênio [36]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/62.892.268.566.145.356/figura-fotomicrografia-ampliada-mostrando-natureza-trincamento-induzido-hidrogênio.webp)
![Figura 3.31 Exemplo ilustrando um dano por hidrogênio através do mecanismo de hidretação [22]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/77.892.258.659.143.560/figura-exemplo-ilustrando-dano-hidrogênio-através-mecanismo-hidretação.webp)
![Figura 3.37 Desenho esquemático das técnicas eletroquímicas [32].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15642712.619142/89.892.252.724.145.575/figura-desenho-esquemático-das-técnicas-eletroquímicas.webp)