Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
Avaliação do efeito hipocolesterolêmico da cuphea ingrata cham. & schltdl.
(sete-sangrias) em camundongos induzidos à hipercolesterolemia
Evaluation of the hypocolesterolemic effect of cuphea ingrata cham. & schltdl.
In mice induced to hypercolesterolemia
DOI:10.34117/bjdv6n8-461
Recebimento dos originais: 21/07/2020 Aceitação para publicação: 21/08/2020
Marlon de Carvalho Siqueira Graduado do Curso de Farmácia
Instituição: Centro Universitário de Barra Mansa
Endereço: Av. Presidente Tancredo Neves, 647, Vista Alegre, Barra Mansa, RJ – Brasil, E-mail: marloncarvalho_bm@hotmail.com
Evandro Toledo Gerhardt Stutz Mestre em Medicina Veterinária
Instituição: Universidade Federal Rural do Rio de Janeiro
Endereço: Centro Universitário de Barra Mansa, Biotério - UBM. , Vereador Pinho de Carvalho, 267, Centro, Barra Mansa, RJ - Brasil,
E-mail: evandro.tgs@gmail.com Tânia Cristina da Silva Especialista em PIGEAD
Instituição: Universidade Federal Fluminense, mestranda em Biologia Animal, Universidade Federal Rural do Rio de Janeiro,
Lab. de Ensino e Pesquisa em Morfologia de Animais Domésticos e Selvagens Departamento de Anatomia Animal e Humana Instituto de Ciências Biológicas e Saúde Universidade Federal Rural
do Rio de janeiro BR. 465, KM 07, s/ número - Seropédica - RJ – Brasil, E-mail: tania_colibri@yahoo.com.br
Jonathan Neves de Carvalho Alves
Especialista em Tecnologia de Alimentos – Faculdade Alfamérica, mestrando em Ciência dos Alimentos
Instituição: Universidade Federal de Lavras.
Endereço: Rua Sete de Setembro, 207, Lavras, MG –Brasil. E-mail: jonathan.alves@estudante.ufla.br
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761 RESUMO
No contexto atual muitos fármacos sintéticos têm sido complementados pelos fitoterápicos na farmacoterapia. A Cuphea ingrata (Sete-sangrias) tem se destacado como uma espécie com grande potencial no tratamento de dislipidemias. Além de pesquisas envolvendo modelos animais, há grande uso pela população. Nesta pesquisa avaliou-se o efeito hipocolesterolêmico da espécie em camundongos induzidos à hipercolesterolemia utilizando ração comum e ração modificada hiperlipidica. Foram utilizados grupos de animais que receberam tratamento com a tintura mãe da planta comparando os seus resultados com grupos controle. Foi dosado o colesterol e os triglicerídeos séricos, e a determinação do teor lipídico nas fezes dos animais com o objetivo de avaliar os efeitos da espécie sobre a absorção e redução do colesterol. Resultados significativos foram obtidos na redução do colesterol nas duas formas de tratamento. Não houve efeito significativo sobre a absorção do colesterol, pouco efeito sobre os triglicerídeos e diferença não significativa no teor de lipídios extraídos de determinados grupos. Os resultados confirmaram o potencial desta espécie na redução do colesterol sérico.
Palavras chave: Cuphea ingrata, sete sangrias, camundongos, colesterol.
ABSTRACT
In the current context many synthetic drugs have been complemented by herbal remedies in pharmacotherapy. Cuphea ingrata (Seven-blooded) has stood out as a species with great potential in the treatment of dyslipidemias. In addition to research involving animal models, there is great use by the population. In this research the hypocholesterolemic effect of the species was evaluated in mice induced to hypercholesterolemia using common and modified hyperlipidic feed. Groups of animals that received treatment with the mother tincture of the plant were used comparing their results with control groups. Serum cholesterol and triglycerides were dosed, and the determination of the lipid content in the animals' feces was done in order to evaluate the effects of the species on cholesterol absorption and reduction. Significant results were obtained in reducing cholesterol in both forms of treatment. There was no significant effect on cholesterol absorption, little effect on triglycerides and no significant difference in lipid content extracted from certain groups. The results confirmed the potential of this species to lower serum cholesterol.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761 1 INTRODUÇÃO
A mudança dos hábitos alimentares a partir do século XX contribuiu para o aumento do risco de doenças cardiovasculares (Pozzan et al., 2004). Segundo a Organização Mundial da Saúde (OMS, 2014) estas patologias foram às principais causas de mortes dentre as doenças não transmissíveis e estima-se que até 2030, 23,6 milhões de pessoas devem morrer devido a doenças cardiovasculares e suas complicações (Go et al., 2014).
Entre essas doenças, a aterosclerose se inicia devido a fatores de risco como dislipidemia, hipertensão arterial ou tabagismo (SBC, 2013) e caracteriza-se pelo depósito de colesterol nas artérias com formação de placas ateroscleróticas que obstruem a passagem do sangue (Robbins et
al., 2000). Moll (2006) destaca a necessidade de novos fármacos e mudanças no estilo de vida que
melhorem o perfil lipídico devido a estas patologias de grande influencia na qualidade de vida. Segundo Calixto (2000) apud Krepsky (2011) o uso de plantas medicinais tem sido aplicado em diversos países visando à substituição de tratamentos convencionais ou a complementação do tratamento farmacoterapêutico devido ao alto custo, reações adversas graves e a falta de acesso ao tratamento.
No Brasil, Cuphea ingrata CHAM. & SCHLTDL. (SETE-SANGRIAS) é utilizada para vários fins terapêuticos, entre eles diaforéticas, diuréticas, laxativas e, especialmente, no controle da hipertensão arterial, controle de dislipidemias e prevenção da arteriosclerose (Ballve Alice et al. 1995; Lorenzi & Matos 2002; Simpósio, 2016). Pizziolo et al. (2011) relataram esta planta como uma das mais citadas para estes fins e, além disto, estudos experimentais utilizando animais de laboratório comprovaram os efeitos da planta na redução do colesterol (Biavatti et al., 2004; Barboza et al., 2016;). Silva et al. (2016) compararam o resultado do efeito da Sete-sangrias (Cuphea ingrata) com o efeito da sinvastatina na redução dos níveis de colesterol em camundongos e obtiveram resultados satisfatórios.
O objetivo desta pesquisa foi esclarecer o quanto Sete-sangrias pode ser efetiva impedindo o aumento do colesterol por um possível efeito sobre a absorção ou somente ser efetiva na redução do colesterol em camundongos Mus musculus .
2 METODOLOGIA
Com base na metodologia utilizada por Cardozo et al. (2008) e Silva et al. (2016) se desenvolveu a metodologia para a avaliação do efeito hipocolesterolêmico da espécie Cuphea
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
gordura nas fezes dos animais. A atual pesquisa foi conduzida no biotério e suas análises nos laboratórios do Centro Universitário de Barra Mansa (UBM).
- Solução Cuphea ingrata 5% (SCI):
Diluição de 50 ml da tintura mãe (Cuphea ingrata) em 950 ml de água filtrada. A tintura foi adquirida em Farmácia de manipulação com respectivo laudo técnico de controle de qualidade juntamente com todas as informações do produto (lote, validade, armazenamento, data de fabricação). Também foi verificada a estabilidade da tintura para o preparo da solução. Fontes (2005) considera no âmbito da homeopatia a estabilidade de doses únicas (Diluições de tintura mãe em água) é de sete dias. Partindo deste principio, houve a troca das soluções semanalmente.
- Dieta:
Dieta comercial. Consistiu em ração específica para camundongos de laboratório, da marca Presence®, contendo os seguintes níveis de garantia: umidade (Max) 13,0%, proteína bruta (Min) 23,0%,extrato etéreo (Min) 4,0%, matéria fibrosa (Max) 5,0%, matéria mineral (Max) 10,0%, cálcio (Max) 1,3%, fósforo (Min) 0,85%.
Dieta hiperlipídica. Previamente padronizada por Estadella (2011) e também utilizada por Cardozo (2008), consistiu de uma mistura de alimentos hipercalóricos, na seguinte proporção (3:2:2:1): 15g de ração Presence® normocalórica, 10g de amendoim torrado; 10g de chocolate ao leite e 5g de bolacha maisena. Esses ingredientes foram moídos, misturados e oferecidos na forma de pellets. Esta dieta também foi utilizada em camundongos por Trindade et al. (2011) que notou aumento significativo dos níveis de colesterol sanguíneo em camundongos.
- Animais:
Foram utilizados 50 camundongos Mus musculus machos heterozigotos e de caráter sanitário convencional, oriundos do Biotério do Centro Universitário de Barra Mansa, com a devida aprovação da Comissão de Ética no Uso de Animais (CEUA), sob o número 07/2017. Os camundongos foram distribuídos em cinco grupos de 10 animais cada.
- Tratamentos:
Os grupos de animais foram mantidos em gaiolas de polipropileno, com cama de maravalha, na sala de ensaios especiais do biotério sob o controle de fotoperíodo (12 horas claro/12 horas escuro), temperatura (22 ± 2° C) e renovação de ar constante.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
Os animais receberam ração comercial para camundongos (Presence®) e dieta hiperlipídica
ad libitum, água filtrada e SCI conforme descrito:
Grupo Controle 1 (GC1): Durante 30 dias receberam dieta hiperlipidica e água filtrada. Grupo Controle2 (GC2): Foram submetidos à dieta normocalórica durante 30 dias ad libitum.
Grupo Controle 3 (GC3): Primeiros 30 dias foram submetidos à dieta hiperlipidica e água, após o 31º dia iniciou a dieta normocalórica por mais 30 dias sem tratamento com SCI. Totalizando 60 dias de experimento.
Grupo Tratamento 1 (GT1): Recebeu dieta hiperlipídica juntamente com o tratamento utilizando a SCI ambos ad libitum durante 30 dias. Neste período ocorreu a coleta e a analise das fezes.
Grupo Tratamento 2 (GT2): Durante os primeiros 30 dias recebeu apenas a dieta hiperlipídica e água ad libitum. No 31° dia iniciou-se a dieta normocalórica e os camundongos foram submetidos ao tratamento com a SCI ambos ad libitum. Isto se estendeu até o 60° dia, onde os camundongos foram anestesiados para coleta sanguínea e a posteriori foi realizada a etapa em que fizemos os procedimentos de eutanásia destes animais e coleta de resultados bioquímicos (Colesterol total e Triglicerídeos).
- Coleta e análise de material biológico:
Para coleta das fezes, os camundongos foram acondicionados em gaiolas sem maravalha por 20 minutos, sendo coletadas e armazenadas em recipientes estéril e mantidos à temperatura ambiente para posterior quantificação da gordura fecal.
Análise das fezes, as amostras foram coletadas do fundo das gaiolas com massas semelhantes entre si antes da eutanásia dos animais e foram armazenadas em recipientes adequadamente fechados, à temperatura ambiente para quantificação da gordura fecal. Foi utilizado o solvente orgânico (Hexano) seguido da sua evaporação através do extrator Soxhlet e baseando-se no conteúdo extraído no copo do extrator para analise do teor de lipídios nas fezes. Método utilizado por Cherem (2008)
Para as analise bioquímicas de colesterol e triglicerídeos totais, coletou-se as amostras no biotério, as quais foram centrifugadas e analisadas no Laboratório de Análises Clínicas. As análises do colesterol total foram realizadas pelo equipamento BT 3000 Analyser por meio do método enzimático colorimétrico seguindo as instruções do fabricante dos kits oferecidos pela Labtest®. A
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
coleta do plasma ocorreu após a eutanásia dos animais conforme a metodologia ilustrada na Figura 1.
- Análises estatísticas:
Os resultados obtidos foram tratados estatisticamente pelo teste T de Student por meio do software GraphPadPrism 4® onde p <0,05 foi considerado estatisticamente significativo.
3 RESULTADOS
Os efeitos sobre o colesterol plasmático foram significativos tanto pelos grupos Tratamento 1 (GT1) e Tratamento 2 (GT2) quando comparados aos seus respectivos grupos controle conforme
os resultados exibidos nas Figuras 1 e 2 respectivamente.
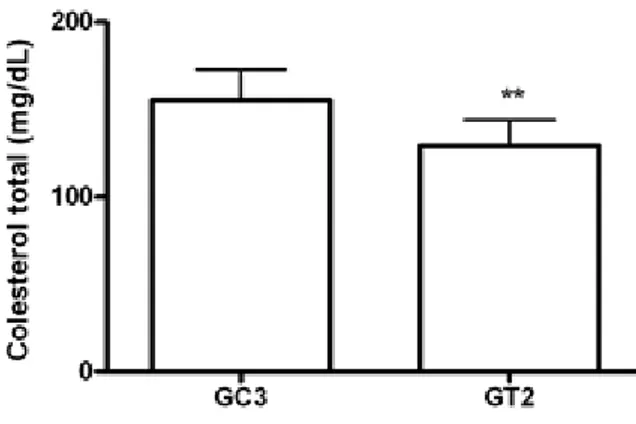
Figura 3. Colesterol plasmático, grupos Controle 3 e Tratamento 2. Médias: GC3 = 155,20 ± 17,68, GT2 = 129,30 ± 14,58. ** p<0,01.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
Figura 4. Triglicerídeos apresentados pelos grupos Controle 1 e Tratamento 1. Médias: GC1 = 359,30 ± 90,30, GT1 = 316,50 ±68,55. ns - Não significativo.
Figura 5. Triglicerídeos apresentados pelos grupos Controle 3 e Tratamento 2. Médias: GC3 = 217,3 ± 47,74, GT2 = 208,1 ± 42,71. ns - Não significativo.
Analisando as médias do colesterol total, o GT1 apresentou redução de 19% quando comparado ao GC1. Já o GT2 apresentou diferença de 16% em relação ao GC3. Os resultados dos triglicerídeos não foram significativos conforme os resultados apresentados a seguir:
FIGURA 6. Lipídios presentes nas fezes dos grupos Controle 1 e Tratamento 1. Médias: GC1 = 0,7921 ± 0,5103, GT1 = 0,7763 ±0,8076. ns - Não significativo. (n=2)
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
Na analises dos teores de lipídios presentes nas fezes dos animais, não foi confirmada a diferença no teor de lipídios entre os grupos GC1 e GT1. A Figura 6 apresenta os resultados das analises e as médias de porcentagens obtidas pela extração.
Simplificando o diagrama da Figura 1 e adicionando os resultados estatísticos da possível absorção e redução do colesterol, associado ao teor de lipídios extraído, a Figura 7 apresenta um primeiro raciocínio comparando os resultados grupo a grupo sobre os possíveis efeitos na redução e absorção da planta sobre o colesterol.
FIGURA 7. Diagrama simplificado contendo os resultados obtidos.
A ração hiperlipídica contribuiu para o aumento dos níveis do colesterol em 49,11% de acordo com os resultados de Grupo controle-1 (GC1) comparados com Grupo Controle 2 (GC2). Evidenciando a indução à hipercolesteremia.
Partindo do principio de que os animais são isogênicos e com base nos resultados obtidos no período de 30 dias do Grupo controle 1 (GC1), Grupo controle 2 (GC2) e Grupo controle 3 (GC3), os gráficos da fig. 8 representam possíveis níveis de colesterol dos Grupo tratamento 1 (GT1) e Grupo tratamento 2 (GT2) comparados com seus respectivos grupos controle durante o período amostral, de acordo com a média e o desvio padrão. Nota-se que os níveis de colesterol do Grupo tratamento 2 (GT2) foram reduzidos aos valores de Grupo controle 2 (GC2), sendo considerados normais, já que este não recebeu tratamento nem ração hiperlipídica durante o experimento.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761 FIGURA 8 – Possíveis níveis de colesterol de GT1 e GT2 de acordo com os resultados dos outros grupos.
Considerando os gráficos da Figura 8, o Grupo Tratamento 2(GT2) teve redução dos níveis de colesterol em 13,44% com diferença de 16,72% quando comparado com seu respectivo grupo controle. No Grupo Tratamento 1 (GT1), os resultados dos níveis de colesterol se diferenciaram em 19,59% quando comparados ao seu respectivo grupo controle.
4 DISCUSSÃO
Os resultados do Grupo Tratamento 1 (GT1) também foi influenciado pela redução dos níveis de colesterol (analisados em GT2). Considerando apenas o resultado obtido pela comparação com seu respectivo controle, não se pode afirmar que essa porcentagem (19,59%) se deve apenas ao efeito sobre a absorção de lipídios, sendo que estes poderiam sofrer a absorção normalmente e com o efeito da SCI 5% sobre a redução do colesterol total sérico levar a esta diferença no resultado final. Somado a isto, os resultados da extração de lipídios presentes nas fezes destes animais não
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
trouxeram diferenças significativas, diminuindo a possibilidade de que a planta tenha efeito sobre a absorção de colesterol.
O Grupo Tratamento 2 (GT2) analisado no gráfico da figura 8 teve os níveis de colesterol reduzidos quase ao valor natural dos animais no período de 30 dias. Sendo assim o potencial terapêutico da espécie Cuphea ingrata pôde ser confirmado com efeitos significativos unicamente na redução dos níveis do colesterol sérico, como afirmam Biavatti et al. (2004) e Silva
et al. (2016). Não deixando dúvidas de que o efeito desta espécie pode ser comparado com a
sinvastatina, fármaco consagrado na redução dos níveis de colesterol sérico.
Comparando os resultados obtidos por Silva et al. (2016) com os resultados da presente pesquisa nota-se:
1) Semelhança entre os grupos controle (132,33 mg/dL e 129,80 mg/dL).
2) Diferença de aproximadamente 20% nos níveis de colesterol em ambas pesquisas. Isto demonstra que os efeitos da Cuphea ingrata foram significativos independentes da dieta utilizada. Um indício de que o efeito seja exclusivamente sobre redução de colesterol sérica.
Barboza et al. (2016) notaram que a Cuphea ingrata levou ao aumento significativo do HDL (no sangue, isto demonstra que o efeito na redução do colesterol pode ser ocasionado pelo aumento desta lipoproteína que transporta o colesterol livre para o fígado. Este HDL-nascente é convertido em HDL3 que são partículas pequenas, mas ainda pobres em colesterol. A enzima LCAT (colesterol
aciltransferase) além de facilitar o transporte de colesterol livre das células periféricas para as
partículas de HDL, também promove a conversão do colesterol livre em ésteres de colesterol, facilitando uma maior aceitação pelas HDL3 que, progressivamente, aumentam de tamanho, transformando-se em HDL2. Estas partículas de HDL são captadas pelos receptores hepáticos SR-B1 (Scavenger Receptor) que removem seu conteúdo de colesterol, iniciando o processo de excreção do colesterol pela bile. (INEU, 2006).
Lusa & Bona (2011) através da caracterização histoquímica dos órgãos e dos tricomas secretores de Cuphea sp. estratificaram a intensidade de metabólitos presentes em cada parte da planta. A planta demonstrou grande teor de proantocianidinas (taninos condensados), compostos fenólicos gerais e polissacarídeos ácidos (substâncias pécticas). Terib et al. (1996) analisou o efeito de taninos de semente de uva sobre o colesterol plasmático em ratos, obteve resultados significativos e afirmou que essa substância foi capaz de manter os níveis de HDL e colesterol total em animais suplementados com dieta rica em colesterol. Estas informações pressupõe a forma como a SCI 5% tenha levado aos resultados alcançados. Pelo laudo de controle de qualidade da solução de Cuphea utilizada, sabemos que foram utilizadas partes aéreas da planta para o preparo da tintura. Sendo
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
assim, provavelmente os taninos condensados (segundo metabólito em maior quantidade nas folhas),sejam os responsáveis pelo efeito observado.
5 CONCLUSÃO
Efeitos importantes na redução do colesterol foram confirmados em ambas as formas de tratamento, seja durante a alimentação hiperlipidica ou após a indução à hipercolesteremia, tendo esta ultima mostrado a importância da mudança do habito alimentar no tratamento de dislipidemias. Não foi confirmado efeito desta espécie sobre a absorção de lipídios que sejam considerados significativos. Mesmo considerando maior diferença nos grupos tratados durante o experimento com aração hiperlipídica, não se pode considerar este efeito sobre a absorção, visto que a maior ingestão de lipídios não modificou o teor de gordura fecal.
Com os resultados obtidos e toda a revisão da literatura discutida na presente pesquisa a
Cuphea ingrata demonstra grande potencial como um novo fitofármaco no tratamento de
dislipidemias. Seu efeito sobre a redução dos níveis do colesterol mediante aos resultados bioquímicos confirmando os resultados encontrados por outros autores e possível aumento do HDL pode impulsionar experimentos mais aprofundados na área de farmacognosia com ênfase na quantificação e identificação das substâncias chamadas proantocianidinas (taninos condensados) presentes nesta espécie.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761 REFERÊNCIAS
BALLVE ALICE, C.; SARAIVA DE SIQUEIRA, N.C.; MENTZ, L.A.; SILVA, G.A.B.; JOSE, K.F.D. Plantas medicinais de uso popular (Atlas Farmacognóstico). Editora da ULBRA, Canoas, 1995, 205 pp.
BARBOZA, L.N.;Lívero, F.A.R.; PRANDO, T.B.L.; RIBEIRO,R.C.L.; LOURENÇO, E.L.B.; BUDEL, J.M.; SOUZA, L.M.; ACCO, A.; DALSENTER,P.R.; GASPAROTTO, A. AtheroprotectiveeffectsofCupheacarthagenensis (Jacq.) J. F. Macbr. in New Zealandrabbitsfedwithcholesterol-rich diet. Journal of Ethnopharmacology, V. 187, p. 134-145, 2016.
BIAVATTI, M.W.; FARIAS, C.; CURTIUS, F.; BRASIL, L.M.; HORT, S.; SCHUSTER, L.; LEITE, S.N.; PRADO, S.R.T. 2004. Preliminary studies on Campomanesiaxanthocarpa(Berg.) and Cupheacarthagenensis (Jacq.) J.F. Macbr. aqueous extract: weight control and biochemical parameters. Journal of Ethnopharmacology. 93 (2/3): 385-389.
BRASIL. Congresso. Senado. Constituição (2006). Decreto nº 5.813, de 22 de junho de 2006. Aprova A Política Nacional de Plantas Medicinais e Fitoterápicos e Dá Outras Providências. Brasília, DF, 22 jun 2006.
CALIXTO, J.B. Efficacy, safety, quality control, marketing and regulatory guidelines for herbal medicines (phytotherapeutic agents). Brazilian journal of medical and biological research, v. 33, n. 2, p. 179-189, 2000.
CARDOZO, S.; BONA L.R.; BARBOZA L.T.; ANDREOLLA H.F.; BOECK R.; VIEIRA V.; FRANTZ, M.A.; MORISSO, F.D.P.; COITINHO, A.S.; Tavares, R.G. 2008. Atividade hipolipidêmica do extrato de Cordiasalicifolia em camundongos submetidos à dieta hiperlipidêmica. Revista da Amrigs 52: 182-186.
CAVALCANTI, T.B. & GRAHAM, S. 2002. Lythraceae In: Wanderley, M.G.L., Shepherd, G.J., Giulietti, A.M., Melhem, T.S., Bittrich, V., Kameyama, C. (eds.) Flora Fanerogâmica do Estado de São Paulo. Instituto de Botânica, São Paulo, vol. 2, pp: 163-180.
CHEREM, A.R.; BRAMOSRKI, A. Excreção de gordura fecal de ratos (Rattusnorvegicus, Wistar), submetidos a dietas hiperlipídicas e hipercolesterolêmicas suplementadas com quitosana. Rev. Bras. Cienc. Farm., São Paulo, v. 44, n. 4, p. 701-706, Dez. 2008.
CORRÊA, P.M. Dicionário de plantas úteis do Brasil e das exóticas cultivadas. Rio de Janeiro: Ministério da Agricultura, IBDF, 1984.
ESTADELLA, D.; OYAMA, L. M.; BUENO, A. A.; HABITANTE, C. A.; SOUZA, G. I.; RIBEIRO, E. B.; MOTOYAMA, C. S. M.; NASCIMENTO, C. M.; OLLER. A palatable hyperlipidic diet causes obesity and affects brain glucose metabolism in rats. Lipids in Health and Disease, v. 10, 23 2011.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
GO, A. S. et al. Executive Summary: Heart Disease and Stroke Statistics-2014 Update. Circulation, v. 129, n. 3, p.399-410, jan. 2014. Ovid Technologies (Wolters Kluwer Health).
GRAHAM S. A.; Knapp, S.J.: Cuphea: A new plant source of medium‐chain fatty acids. Critical Reviews in Food Science and Nutrition,1989, 28:2, 139-173
INEU, Marcelo Lemos et al . Manejo da HDL: avanços recentes e perspectivas além da redução de LDL. Arq. Bras. Cardiol., São Paulo , v. 87, n. 6, p. 788-794, Dec. 2006.
TEBIB K.; BITRI, L.; BESANÇON, P.; ROUANET J.; Polymeric grape seed tannins prevent plasma cholesterol changes in high-cholesterol-fed rats. Food Chemistry. Volume 49, Issue 4, 1994, p. 403-406.
KREPSKY, PatríciaBaier. Composição química quantitativa e avaliação da potencial atividade vasodilatadora de Cupheacarthagenensis (Jacq.) MacBride. Tese. 2011. 211 f. Tese (Doutorado) - Curso de Ciências Farmacêuticas, Universidade Federal de Minas Gerais, Minas Gerais, 2011.
LORENZI, H. E.; MATOS, F.J. DE A. Plantas medicinais no Brasil/Nativas e exóticas. Nova Odessa: Instituto Plantarum. 2002. 512 p.
LUSA, MakeliGaribotti; BONA, Cleusa. Caracterização morfoanatômica e histoquímica de Cupheacarthagenensis (Jacq.) J.f. Macbr. (Lythraceae). Acta Bot. Bras., Feira de Santana, v. 25, n. 2, p. 517-527, Junho 2011.
MOLL, M.C.N. Antihiperlipemiantes de origen vegetal. Revista de Fitoterapia, v.6, p.11-26, 2006.
OMS, World Health Organization. Global status report on non-communicable diseases 2014. PIZZIOLO, V.R et al . Plantas com possível atividade hipolipidêmica: uma revisão bibliográfica de livros editados no Brasil entre 1998 e 2008. Rev. bras. plantas med., Botucatu, v. 13, n. 1, p. 98-109, 2011.
POZZAN, R. et al. Dislipidemia, Síndrome Metabólica e Risco Cardiovascular. Revista da Sociedade de Cardiologia do Estado do Rio de Janeiro (Socerj). Universidade do Estado do Rio de Janeiro. Rio de Janeiro, RJ. V. 17, n. 2, p. 97-104, Abr/Mai/Jun 2004.
ROBBINS, Stanley L. et al. Patologia estrutural e funcional.6.ed. Rio de Janeiro: Guanabara Koogan, 2000. 1251 p.
SBC, Sociedade Brasileira de Cardiologia, V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose. Arquivos Brasileiros de Cardiologia, v.101, n. 4, supl. 1, p.2-2, Out. 2013. TRINDADE, D.C.; MARINHO JUNIOR, A.; SOUZA JUNIOR, F.A.C.; STUTZ, E.T.G.; LEITE, M.O.; MONTEIRO, P.R.S. Influência do Chá Verde (Camelliasinensis) sobre o ganho de peso, consumo alimentar, glicemia e colesterolemia de camundongos adultos recebendo dieta hiperlípídica. Revista Científica do Centro Universitário de Barra Mansa, v. 13, p. 44-52, n. 2011.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p.60518-60531 aug. 2020. ISSN 2525-8761
XXIV SIMPÓSIO DE PLANTAS MEDICINAIS DO BRASIL, 2016, Santa Catarina, RS. Estudo Etnobotânico de Cupheacarthagenensis (Jacq.) J.Macbr. “Sete-sangrias” (Lythraceae) junto à Pastoral da Saúde, Santa Catarina. Belo Horizonte, MG: Centro Especializado em Plantas Aromáticas, Medicinais e Tóxicas (Ceplamt), 2016. 1 p. Disponível em: <xxivspmb.ceplamt.org.br/cd/trabalhos/BE-04.pdf>. Acesso em: 18 Mar. 2017.