outubro de 2014
Universidade do Minho
Escola de Engenharia
Teresa Catarina Faria Pinto
UMinho|20 14 Ter esa Catarina F aria Pint o
Avaliação da degradação de cloro
activo em, hipoclorito de sódio
Av aliação da degradação de cloro activo em, hipoclorito de sódio
Dissertação de Mestrado
Mestrado Integrado em Engenharia Biológica
Ramo Tecnologia Química e Alimentar
Trabalho efetuado sob a orientação do
Professor Doutor Armando Albino Dias Venâncio
e da
Engenheira Sofia Alexandra Oliveira
outubro de 2014
Universidade do Minho
Escola de Engenharia
Teresa Catarina Faria Pinto
Avaliação da degradação de cloro
activo em, hipoclorito de sódio
ii
Nome: Teresa Catarina Faria Pinto
Endereço electrónico: tc.pinto@hotmail.com
Número do Cartão de Cidadão: 13599556
Título da Dissertação: Avaliação da degradação de cloro activo em hipoclorito de sódio
Orientadores:
Armando Albino Dias Venâncio Sofia Alexandra Oliveira
Ano de conclusão: 2014
Dissertação de Mestrado Integrado em Engenharia Biológica – Ramo Tecnologia Química e Alimentar
Este documento não respeita as regras do novo acordo ortográfico
DE ACORDO COM A LEGISLAÇÃO EM VIGOR, NÃO É PERMITIDA A REPRODUÇÃO DE QUALQUER PARTE DESTA DISSERTAÇÃO.
Universidade do Minho, 31 de Outubro de 2014 ______________________________________
iii
Agradecimentos
“É o tempo da travessia: e, se não ousarmos fazê-la, teremos ficado, para sempre, à margem de nós mesmos.”
Fernando Pessoa
Tudo na vida, tem um início e um fim. E Eis que chega o fim do longo e atribulado caminho que me propus percorrer. Caminho esse que foi pautado por bons e maus momentos. E como tal, é chegada a hora de agradecer a todos aqueles que me ajudaram a ultrapassar todos os obstáculos e me encorajaram a seguir o meu objectivo sem nunca desvanecer.
Desta forma, quero deixar o meu agradecimento e um voto de profunda gratidão a todos quantos se cruzaram comigo, neste meu percurso, destacando assim:
Ao meu orientador, Professor Doutor Armando Venâncio, por tudo o apoio que me prestou ao longo deste projecto, pelo apoio incansável que me deu na fase mais complicada deste processo.
Ao, Professor Doutor João Peixoto, que muito me ajudou e que muito se empenhou para que eu pudesse realizar o meu estágio na RNM.
À minha orientadora, Engenheira Sofia Oliveira, responsável pelo Laboratório da RNM, que tudo fez para que eu pudesse realizar esta dissertação. Pelo tempo despendido, pela forma como me acolheu, pela liberdade que me deu para que eu pode-se desenvolver o meu trabalho e sobretudo por tudo aquilo que me ensinou.
À engenheira Eva Queirós, por todo o apoio, toda ajuda, por toda a paciência que teve para me aturar, com todas as minhas brincadeiras e parvoíces.
A toda a Equipa da RNM, que desde o primeiro dia sempre se mostraram disponíveis, para colaborar no meu projecto. Por toda a ajuda que, directa ou indirectamente me prestaram. E sobretudo por me terem feito sentir, “em casa“.
Por fim, chega o maior dos agradecimentos. Aos meus pais, por tudo aquilo que sempre fizeram por mim, pelo esforço que sempre fizeram para que pudesse alcançar todos os meus objectivos, mas sobretudo, por me amarem incondicionalmente. Ao meu irmão que sempre esteve presente em todas as etapas da minha vida e ao meu pequeno Rodrigo, pelos mimos e alegria que sempre me deu na hora de regressar a casa. Mostrando-me como tudo é simples e dando-me sempre força para continuar.
iv
Resumo
O hipoclorito de sódio, é um composto com muita procura, devido à sua eficácia ao nível da desinfecção e branqueamento. Uma vez que este produto demonstra elevada capacidade desinfectante a um custo relativamente baixo. No entanto devido a sua instabilidade e reactividade, facilmente perde as propriedades que o tornam comercialmente atractivo.
O Hipoclorito de sódio, ao perder cloro activo perde consequentemente o valor comercial, uma vez que as suas funções deixam de estar asseguradas. O que acarreta custos para as empresas, além do que afectando também a relação comercial entre empresa e cliente.
As devoluções e reclamações de Hipoclorito de sódio eram um dos problemas da empresa RNM, porque embora o produto fosse produzido em condições controladas para cumprir especificações, muitas das vezes acaba por perder cloro activo passando a estar não conforme. Pelo que existiu, a necessidade de perceber como é que ocorre a degradação do cloro neste tipo de produto e quais as condições que podem afectar essa degradação.
Para que se possam adoptar medidas que promovam a estabilização do hipoclorito de sódio dentro dos parâmetros referenciados nas especificações técnicas, foi realizada uma análise cuidada dos parâmetros que pudessem estar envolvidos com a perda de cloro activo.
Desta forma, avaliou-se a degradação do cloro presente no hipoclorito de sódio ao longo do prazo de validade do produto (aproximadamente 3 meses), bem como a influência do tipo de embalagem usada, da concentração do produto, dos factores ambientais e do estabilizante usado.
Os resultados obtidos foram conclusivos, evidenciando que a perda de cloro activo em hipoclorito de sódio é mais acentuada quando este é sujeito à exposição solar sob altas temperaturas, e que o tipo de embalagem usada acentua esta degradação que é intrínseca ao próprio produto. Por outro lado verificou-se ainda que para ambas as formas de produto (15 e 13% (w/w), não é possível manter o prazo de validade nos actuais 3 meses. Ao longo desta dissertação, são apresentados, os resultados dos ensaios laboratoriais realizados, bem como as melhorias a introduzir no processo.
v
Abstract
Sodium hypochlorite is a compound in great demand due to their effectiveness at the level of disinfection and bleaching. Since this product shows a high disinfecting capacity at a relatively low cost. However due to their instability and reactivity, easily loses the properties which make it commercially attractive. Sodium hypochlorite, chlorine consequently lost to lose commercial value, since their functions are no longer ensured. What is costly for companies, and would also affect the business relationship between company and customer. Returns and complaints of sodium hypochlorite were one of the problems the company RNM, because although the product was produced in subsidiaries to comply, conditions often ends up losing chlorine going to be non-compliant. At that existed, the need to realize is that as the conditions that may affect the degradation of chlorine degradation occurs in this type of product and whom. That they may adopt measures to promote the stabilization of sodium hypochlorite within the parameters referenced in the technical specifications, a careful analysis of the parameters that may be involved with the loss of active chlorine was performed. Thus, we evaluated the degradation present in sodium hypochlorite throughout the shelf life of the product (approximately 3 months) chlorine, as well as the influence of the type of packaging used, the concentration of the product of environmental factors
and stabilizing second hand.
The results were inconclusive, showing that special care with regard to such packaging and storage conditions so that the degradation of the active chlorine is not as effective
is needed.
Throughout of this dissertation, are presented, the results of laboratory tests performed, as well as improvements to the process.
vi
Índice
Agradecimentos……… iii
Resumo……… v
Abstract……… vii
Índice de Figuras……… viii
Índice de Tabelas……..……… ix
Simbologia e notações…..……… x
Capitulo 1: Introdução... 1
1. Contextualização histórica……….. 2
2. Propriedades do Hipoclorito de sódio………..……….. 3
3. Produção industrial de hipoclorito de sódio: Processo Hooker………... 4
4. Hipoclorito de sódio na RNM………... 7
5. Aplicações do hipoclorito de sodio………... 10
Capitulo 2: Apresentação da empresa RNM………. 11
1. Descrição da empresa……..……….. 12
2. Política da empresa……….. 13
3. Hierarquia da empresa………..………... 14
4. Mercados da empresa………... 15
Capitulo 3: Perspectiva económica……….………. 16
1. Análise económica mundial……..………. 17
2. Análise económica na RNM……..………. 18
Capitulo 4: Materiais e metodologias………..……….……… 20
Capitulo 5: Resultados e discussão……….. 27
1. Estudo da degradação de cloro activo, em hipoclorito de sódio……….. 28
2. Estudo da degradação do álcali-livre (NaOH), ao longo do tempo, em hipoclorito de sódio……….. 30
3. Estudo da Influência do estabilizante (álcali-livre), na degradação de cloro activo, em hipoclorito de sódio………. 31
4. Estudo do efeito da diluição do produto, na degradação de cloro activo em hipoclorito de sódio……… 33
vii
5.1
Estudo da degradação de cloro activo em hipoclorito de sódio sujeito às condições climatéricas e influência do tipo de embalagem………..
35 5.2 Estudo da degradação de cloro activo em hipoclorito de
sódio, em condições de refrigeração……… 37
6 Estudo da influência da presença de metais na degradação de cloro activo em hipoclorito de sódio……….. 38
6.1 Estudo da degradação de cloro activo, em hipoclorito de sódio 13% (w/w), em presença de metais……… 39
6.2 Estudo da influência do volume da amostra de hipoclorito de sódio em contacto com o metal……… 39
6.3 Estudo da influência do tamanho do metal, na degradação de cloro activo no hipoclorito de sódio em contacto com o metal……… 40 Capitulo 5: Estratégias de melhoria……… 41
1 Sugestões de melhoria………. 42 1.1 Tipos de embalagem……… 42 1.2 Condições de Armazenamento………. 43 1.3 Outras sugestões……… 43 Conclusões………. 44 Bibliografia……….……….. 45 Anexos………..… 47
1 Fichas de especificação Técnica ……….. 49
2 Tabelas com os dados experimentais obtidos e erros associados ………... 52
viii
Índice de Figuras
Figura 1 – Exemplo genérico de uma torre de absorção……….……… 5 Figura 2 – Diagrama de produção de hipoclorito de sódio... 5 Figura 3 – Fluxograma de produção de hipoclorito de sódio a 13% (w/w)………. 8 Figura 4 - Modelo de Excelência EFQM……… 14 Figura 5 - Hierarquia da empresa RNM……….. 15 Figura 6 – Mercados da empresa RNM……….. 15 Figura 7 – Distribuição da produção mundial de cloro-soda em 2012. ………….. 17 Figura 8 – Maiores produtores mundiais de cloro-soda em 2012……….. 18 Figura 9 – Degradação do cloro activo presente no hipoclorito de sódio 15% (w/w), ao longo do tempo……… 28 Figura 10 – Degradação do cloro activo presente no hipoclorito de sódio 13% (w/w), ao longo do tempo……… 29 Figura 11 – Perfil de concentração de álcali-livre, ao longo do tempo, em
hipoclorito de sódio 15% (w/w)……… 30 Figura 12 – Perfil de concentração de álcali-livre, ao longo do tempo, em hipoclorito de sódio 13% (w/w)……… 31 Figura 13 – Estudo da influência da concentração de estabilizante em
hipoclorito de sódio 15% (w/w)……… 32 Figura 14 – Estudo da influência da concentração de estabilizante em hipoclorito de sódio 13% (w/w)……… 33 Figura 15 – Influência da diluição do produto na degradação do cloro activo… 34 Figura 16 – Influência da temperatura e exposição solar na degradação de cloro activo em hipoclorito de sódio……… 35 Figura 17 – Influência do tipo de embalagem na degradação de cloro activo em hipoclorito de sódio 15% (w/w)……….. 36 Figura 18 – Influência do tipo de embalagem na degradação de cloro activo
em hipoclorito de sódio 13% (w/w)……… 36 Figura 19 – Fotografia da degradação de cor, resultante da exposição do hipoclorito de sódio à luz solar, em diferentes tipos de embalagem, após seis dias de exposição………
37 Figura 20– Fotografia da degradação de cor, resultante da exposição do
hipoclorito de sódio à luz solar, em diferentes tipos de embalagem, após quarenta e sete dias de exposição……….
37 Figura 21 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal……… 39 Figura 22 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal, em diferentes volumes de amostra………….. 40 Figura 23 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal, em diferentes tamanhos da placa metálica………. Figura 24 –Exemplo de embalagens opacas………
40 42
ix
Índice de Tabelas
Tabela 1 - Descrição e propriedades físico-químicas do hipoclorito de sódio….. 4 Tabela 2 – Valores das análises trimestrais realizadas ao hipoclorito de sódio, de acordo com a norma EN 901……….. 9 Tabela 3 – Planificação dos ensaios laboratoriais ……….. 25 Tabela 3 – Valores comparativos da perda de cloro activo no hipoclorito de
x
Simbologia e Notações
IBC – Contentor de armazenamento de produtos
SGI-QAS – Sistema de Gestão Integrado - Qualidade, Ambiente e Segurança QAS – Qualidade Ambiente Segurança
EFQM – European Foundation for Quality Management Redox - Reacção de Oxidação- redução
CUF – Companhia União Fabril MIE – Método Interno de Ensaio
AAS – Espectroscopia de absorção atómica ICP – Espectroscopia de emissão atómica
1
2
1. Contextualização histórica
No ano de 1774, Carl WilhelmScheele, identifica pela primeira vez, um composto químico semelhante ao hipoclorito. Atribui-lhe o nome de ácido muriático oxigenado, devido à sua obtenção ser a partir da reacção redox do então ácido muriático, o actual ácido clorídrico, com o dióxido de manganês. (eq.1)
Equação 1 – Reacção de obtenção do ácido muriático oxigenado.
Após a percepção das características do composto identificado por Scheele, que revelaria grande capacidade de desinfecção e branqueamento, foram-se iniciando novas pesquisas com o intuito de melhorar o processo e identificar novos compostos.
Foi então que, Claud Louis Berthollet, descobriu que o gás de cloro em água originaria principalmente HClO, o designado hipoclorito, de acordo com a seguinte equação química:
Equação 2 – Reacção de obtenção de hipoclorito, segundo Berthollet.
Após esta conclusão, Berthollet, continua os seus estudos, na busca de um processo de obtenção de hipoclorito, mais rentável. É então que surge pela primeira vez o composto designado por hipoclorito de sódio, como resultado da passagem pelo gás de cloro de uma solução de carbonato de sódio (Eq. 3). Este processo é posto em prática, pela primeira vez, no ano de 1789.
Equação 3 – Reacção de obtenção de hipoclorito de sódio, segundo Berthollet.
Ao contrário do que era espectável, e apesar de todos os esforços do seu mentor, este método não era eficiente, uma vez que a solução de hipoclorito de sódio resultante, era quimicamente fraca, não cumprindo os objectivos de branqueamento e desinfecção, para os quais o produto era pretendido.
O
H
Cl
MnCl
HCl
MnO
2
4
2
2
2
2HCl
HClO
O
H
Cl
2
2
2 3 3 2 22
Na
CO
NaCl
NaClO
CO
Cl
(Equação 1) (Equação 2) (Equação 3)3
Devido ao fracassar deste processo, a busca por novos métodos de produção e aperfeiçoamento de métodos já existentes, foi continuando. Pelo que no final do século XIX, E.S. Smith patenteia um novo método de produção de hipoclorito de sódio, baseado na electrólise da solução de sal (NaCl), para produção de hidróxido de sódio e gás de cloro, que posteriormente eram misturados. Desta mistura resultava a solução de hipoclorito de sódio.
Como todos os métodos, este também tinha as suas limitações, pelo que foi aperfeiçoado, dando origem ao processo industrial de produção de hipoclorito de sódio que se aplica actualmente. O processo de Hooker.
2. Propriedades do hipoclorito de sódio
O hipoclorito de sódio é um composto químico, obtido maioritariamente pelo processo de Hooker, como já foi referido anteriormente.
É um composto altamente instável e susceptível às condições do meio envolvente. A sua estabilidade é muito afectada pela luminosidade, temperatura, tipo de embalagem, presença de metais e outros compostos químicos.
Sendo que, devido à sua estabilidade e reactividade, perde facilmente as suas propriedades desinfectantes e branqueadoras, perdendo assim a sua principal funcionalidade.
Este composto, surge normalmente em três formas: em pó ou em solução de 13% e 15% de cloro activo.
Na tabela 1, é possível observar as propriedades físicas e químicas, do hipoclorito de sódio.
4
Tabela 1 - Descrição e propriedades físico-químicas do hipoclorito de sódio.[1] [2]
3. Produção industrial de hipoclorito de sódio: Processo Hooker
Actualmente, a maioria do hipoclorito de sódio produzido no mundo, é obtido pelo processo de Hooker. Este processo tem como base uma absorção gasosa, pelo que é interessante esclarecer alguns conceitos.
O processo de absorção gasosa consiste na “ transferência de um composto solúvel da fase gasosa para a fase líquida absorvente e não volátil”.[3] A absorção diz-se química, quando ocorre reacção entre o gás e o líquido absorvente.
Como é possível observar na figura 1, genericamente este tipo de processos é feito em contínuo e em regime permanente. Os fluxos operatórios são normalmente em contra corrente. Assim sendo, no fundo da coluna é alimentado o absorbato (gás) e no topo da mesma é alimentado o absorvente (líquido). A absorção só é possível, se existir uma força motriz, gradiente de concentração, entre a fase líquida e a fase gasosa, tendendo sempre para o equilíbrio das fases.
Desc
ri
çã
o
Nome químico Hipoclorito de sódio Nome comum Líquido alvejante, lixivia Fórmula Química NaOCl
Fórmula estrutural Número CAS 7681-52-9 Número EINECS 231-668-3 Pr o p ri ed ad es fí si ca
s Aparência e odor Líquido amarelo claro, com odor a acre Densidade 1.23 g/ml – 1.30 g/ml, a 20oC
Solubilidade em água Totalmente míscivel Pressão de vapor ≈2.5 kPa, 20oC Cristalização e ponto de
congelação -20
o
C a -30oC Calor específico 3.48 kJ/(kg.K) Viscosidade dinâmica 2.6 mPa.s, 20oC
Pr o p ri e d ad e s Q u ím ic
5
Figura 1 – Exemplo genérico de uma torre de absorção.
No que respeita, concretamente à produção de hipoclorito de sódio pelo processo de Hooker, verifica-se que este é obtido pela absorção a frio, do cloro gasoso numa solução de soda cáustica líquida, envolvendo uma reacção química entre o absorvente (soda cáustica) e o absorbato (cloro), como é possível observar na equação 4.
Equação 4 –Reacção de obtenção de hipoclorito de sódio, pelo processo de Hooker.
Na figura 2, é possível observar um diagrama de produção de hipoclorito de sódio, pelo processo anteriormente referido. Onde uma solução de soda cáustica 50% é diluída com água. Seguidamente é arrefecida e entra na coluna de absorção para formar o hipoclorito de sódio.
Figura 2 – Diagrama de produção de hipoclorito de sódio.
O
H
NaCl
NaOCl
NaOH
Cl
2
2
2 (Equação 4)6
À semelhança do que acontece noutros processos, neste também é muito importante ter em conta as condições operacionais, para que o produto final obtido seja o pretendido e esteja nas condições de concentração, pH, densidade, pretendidas. Por exemplo o processo, funciona com o excesso de soda cáustica, com o objectivo de manter o pH em valores entre 11 e 13. Uma vez que um dos requisitos principais é que a solução seja alcalina em todas as fases do processo.
Outro dos parâmetros essenciais deste processo, é a concentração da solução de soda cáustica, uma vez que a concentração do produto final depende da concentração inicial da solução referida. Desta forma, para produzir hipoclorito de sódio com concentração de 15% (w/w) é necessário garantir que a solução inicial de soda cáustica tenha cerca de 260/265 g (peso]) de hidróxido de sódio. Por sua vez, para produzir hipoclorito de sódio com concentração de 13% (w/w), é necessário que a solução de soda cáustica inicial tenha 220g (peso) de hidróxido de sódio. [3]
Sendo o hipoclorito de sódio, um composto químico muito instável, torna-se importante conhecer quais as decomposições possíveis deste produto, bem como quais os factores externos que o afectam.
Na equação 5 é possível observar a reacção de decomposição do hipoclorito de sódio, quando sujeito a temperatura e por efeito do tempo:
Equação 5 – Reacção de decomposição do hipoclorito de sódio por acção do tempo e da temperatura.
Na equação 6 é possível observar a reacção de decomposição do hipoclorito de sódio, quando sujeito a catálise metálica, temperatura e luz:
Equação 6 – Reacção de decomposição do hipoclorito de sódio por acção catalítica dos metais, da temperatura e da luz.
[3] Dados fornecidos pela CUF.
NaCl
NaClO
NaOCl
2
3
3
NaCl
O
NaOCl
2
2
2
(Equação 5) (Equação 6)7
4. Hipoclorito de sódio na RNM
A empresa RNM, comercializa essencialmente hipoclorito de sódio a 13% (v/v), salvo raras excepções em que este é comercializado a 15% (v/v). Assim, a empresa compra hipoclorito concentrado (15%), e procede à diluição nas suas instalações para posterior comercialização. O hipoclorito de sódio, comercializado pela RNM, cumpre com as especificações da norma europeia EN 901, podendo assim ser usado para tratamento de águas e outros produtos que se destinem ao consumo humano. Para que estas especificações sejam cumpridas, a empresa assegura a qualidade do produto adquirido, exigindo certificados de análise, sendo estes verificados em laboratório, antes de qualquer recebimento e expedição de produto.
Em análise ao fluxograma de produção do hipoclorito de sódio (figura 3), verifica-se que: o produto é recepcionado nas instalações da empresa, e é retirada uma amostra, que segue para o laboratório a fim de verificar se o produto cumpre ou não com as especificações impostas. Caso o produto esteja conforme, procede-se então à descarga do mesmo, que poderá ser feita, directamente para o depósito de diluição, e inicia-se logo o processo de produção de Hipoclorito de sódio a 13% (v/v), ou caso este esteja ocupado, o produto é armazenado em IBC onde pode também ser diluído. Após a diluição, retira-se nova amostra do produto obtido, e no laboratório é novamente verificado se o produto está conforme com as especificações e se pode ou não ser comercializado. Se o produto não estiver conforme as especificações, quer seja a chegada da matéria -prima quer seja no final de produção, é rejeitado. Sendo que se a não conformidade se verificar na primeira etapa, o produto é devolvido ao fornecedor. Se a não conformidade for detectada no produto resultante da produção interna, este pode regressar à produção e caso seja possível, rectificam-se os parâmetros não conformes.
Na tabela 2, estão evidenciados os valores das análises externas, realizadas trimestralmente ao hipoclorito de sódio. São estes resultados que indicam e garantem, que o hipoclorito de sódio comercializado pela RNM, é passível e ser usado em tratamento de águas e alimentos destinados ao consumo humano, de acordo com a norma europeia EN 901.
8
9
Tabela 2 – Valores das análises trimestrais realizadas ao hipoclorito de sódio, de acordo com a norma EN 901.
Designação da Característica
Unid Resultado Limite max. - EN901(2007)
Método de Controlo Tipo 1
Concentrção de Cloro Livre % 13,7 MIE 09
Fe mg/L 0,29 1
AAS
NaClO3 %(m/m) de cloro activo 1,2 5,4
Cromatografia Iónica
NaBrO3 g/kg de cloro activo 0,36 2,5
Cromatografia Iónica
Arsénio mg/kg de cloro activo < 0,6 1
ICP
Cádmio mg/kg de cloro activo < 0,6 2,5
ICP
Crómio mg/kg de cloro activo < 0,6 2,5
ICP
Mercúrio mg/kg de cloro activo < 0,1 3,5
AAS
Niquel mg/kg de cloro activo < 1,1 2,5
ICP
Chumbo mg/kg de cloro activo < 0,6 15
ICP
Antimónio mg/kg de cloro activo < 1,1 20
ICP
Selénio mg/kg de cloro activo < 1,1 20
10
5. Aplicações do hipoclorito de sódio
A principal função/ aplicação deste composto prende-se com a sua capacidade desinfectante, sendo aplicado nas mais diversas áreas. Esta capacidade foi reconhecida pelo instituto Pasteur, que evidencia o hipoclorito de sódio como sendo “o desinfectante mais eficaz contra a maioria das bactérias patogénicas, conhecidas, fungos e vírus”, uma vez que este composto tem a capacidade de inibir a reacção enzimática no interior das células dos microorganismos, tornando-os inactivos.
Desta forma a sua acção desinfectante pode ser usada: Desinfecção hospitalar;
Desinfecção doméstica;
Tratamento de águas para o consumo humano; Desinfecção no processamento de alimentos; Tratamento de águas de piscinas;
Tratamento de águas residuais; Endodontia.
O hipoclorito de sódio é ainda usado para branqueamento. Uma vez que este composto é um branqueador por excelência. Esta característica deve-se ao seu forte poder oxidante, que preconiza a remoção de manchas e maus odores. Além das suas capacidades branqueadoras, este produto torna-se muito atraente para o branqueamento porque permite bons resultados a baixas temperaturas, o que implica menor gastos energéticos e consequentemente maior economia dos processos.
A sua acção branqueadora é usada principalmente na indústria têxtil, indústria papeleira e nas lavandarias.
O hipoclorito de sódio é ainda usado em outros processos tais como:
Tratamento de resíduos de cianeto, resultantes do acabamento do metal; Recuperação de metais preciosos;
11
12
1. Descrição da Empresa
A empresa RNM, situada na rua da Fábrica, 123, Segade, 4765-080 Carreira, V.N.Famalicão, surge no ano de 1986, sob a designação de “Drovilusa”. A outrora Drovilusa, foi criada como uma sociedade comercial por quotas, sendo estas divididas em partes iguais pelos sócios Drogas Vigo SL. e Rosa, Ricardo e Nuno Machado.
Devido à grande expansão da empresa, observou-se a necessidade de associar à empresa de produtos químicos, uma empresa de transportes de químicos. Desta forma, no ano de 2006 é fundada a empresa de transportes químicos associada à até então Drovilusa.
É no ano de 2009, que a RNM, adquire a designação actual. Esta mudança deveu-se ao facto de os sócios Ricardo e Nuno Machado, terem adquirido a totalidade das quotas da empresa. Assim sendo é constituído o actual, grupo RNM, que engloba a RNM-Produtos Químicos e a RNM- Transportes Químicos.
A RNM, assenta a sua laboração principalmente na produção de produtos químicos, possuindo diversas linhas de laboração, entre as quais se destacam, as linhas de produção de solventes, detergentes, diluição de peróxido de hidrogénio e soda cáustica.
A maior parte da distribuição dos produtos produzidos, é da responsabilidade da empresa RNM-Transporte de Químicos, que possui uma frota devidamente equipada, assegurando assim a qualidade do transporte de modo a que o produto chegue nas melhores condições ao cliente final.
Actualmente a empresa, trabalha para as mais diversas indústrias como: indústria agro-alimentar, farmacêutica, automóvel, corticeira, detergentes, cosmética, petroquímica, têxtil, tintas, construção, entre outras. Fornecendo todo o tipo de produtos e tendo como objectivo principal a satisfação do cliente. Para que tal, seja possível, e para salvaguardar a política da qualidade, a RNM, tem ao seu dispor, uma equipa de excelência, na área química, segurança e qualidade.
De forma a garantir, a qualidade das suas produções, a empresa têm na sua estrutura um laboratório, equipado com equipamentos de primeira linha, de forma a
13
garantir a qualidade e fiabilidade de todos os produtos comercializados. Existe ainda integrado na empresa um sistema de gestão Integrado da qualidade, segurança e ambiente – SGI-QAS, de eficiência comprovada, permitindo obter e garantir pressupostos fundamentais da política da empresa.
A empresa é certificada pelas normas ISO 9001, ISO 14001 e OSHAS 18001.
2. Política da empresa
A política da RNM assenta em três princípios fundamentais: Fortes sinergias entre fornecedores e clientes;
Respeito pelo meio ambiente e segurança dos trabalhadores; Qualidade total.
Desta forma, a RNM assume um compromisso global, que visa a melhoria continua e excelência nos processos e produtos, protecção do ambiente e segurança saúde e higiene no trabalho.
Para garantir que a política da empresa seja cumprida, existe o SGI-QAS, que visa garantir o objectivo de “servir cada vez melhor”. Assim sendo para garantir o cumprimento da política QAS é necessário o envolvimento de todos os colaboradores no desenvolvimento dos seguintes princípios:
Satisfazer os clientes, fornecendo-lhes produtos de acordo com as suas especificações e exigências, ao menor custo possível e com rapidez na execução do pedido.
Satisfazer e envolver os colaboradores, motivando os para o trabalho em equipa e em simultâneo incentivá-los na valorização pessoal.
Produzir mais e melhor, tentando alcançar a excelência nos produtos e processos.
Produzir de forma sustentável, assegurando sempre o respeito ambiental e o cumprimento de toda na legislação aplicada ao sector.
14
Fomentar relacionamento com os fornecedores e clientes, de forma a conjugar e orientar todas as partes interessadas, com o objectivo de conseguir uma conjugação de interesses e benefícios mútuos.
Proporcionar um bom ambiente de trabalho, assegurando o bem-estar físico e emocional e social dos colaboradores, minimizando os riscos associados à laboração.
Assim, a política fundamental da RNM, visa a qualidade, pelo que pode ser traduzida pelo modelo de excelência da EFQM (Figura 4).
3. Hierarquia da empresa
De forma a cumprir os objectivos e a melhorar o seu funcionamento a empresa está organizada hierarquicamente. Sendo que para cada sector existem regras definidas acerca de competências e funções.
Como é possível observar na figura 5, no topo da hierarquia encontra-se a Gerência seguida pela direcção das diversas áreas: compras, vendas, logística, industria, qualidade e financeiro. A esta equipa compete planear, organizar liderar e controlar garantindo o funcionamento dos sectores subsequentes na hierarquia.
15
Figura 5 - Hierarquia da empresa RNM.
4. Mercados da empresa
A empresa RNM – Produtos Químicos, comercializa produtos para as mais diferentes zonas do globo. Sendo que a sua maior área de incidência de negócios se encontra na península ibérica. Na figura 6, é possível observar algumas das áreas do globo, com as quais a empresa tem relações comerciais.
16
17
Neste capítulo será apresentada uma breve análise económica do sector de produção de cloro e soda. Sector esse que origina a produção do hipoclorito de sódio.
1. Análise económica Mundial
Na impossibilidade de obter dados exactos acerca do mercado financeiro e transaccional do hipoclorito de sódio, optou-se por analisar o mercado de soda-cloro, uma vez que este afectará sempre, intrinsecamente o mercado do hipoclorito de sódio.
Os dados estatísticos aqui, apresentados são referentes ao ano de 2012.
Na figura 7, são apresentados os dados relativos à distribuição da produção mundial de Cloro-soda, assim verifica-se que o continente asiático é o maior contribuinte a nível produtivo, produzindo cerca de 43% do total da produção mundial. Logo de seguida situam-se os Estados Unidos da América, com 30% da produção mundial.
Figura 7 – Distribuição da produção mundial de cloro-soda em 2012.
No que respeita às empresas produtoras de cloro-soda, verifica-se que a maior responsável por assegurar este sector, é a norte americana Dow, com produção de 6.5 milhões de toneladas por ano (Figura 8).
18
Figura 8 – Maiores produtores mundiais de cloro-soda em 2012.
2. Análise Económica na RNM
O hipoclorito de sódio é o sexto produto mais transaccionado pela RNM –Produtos químicos, sendo movimentadas cerca de 3600 toneladas por ano.
Em média o preço de compra deste produto rondará os 120€/tonelada. Por sua vez o preço de venda rondará os 140€/tonelada.
Embora seja um produto relativamente barato, o volume de negócios que este assume na empresa, torna-o bastante importante economicamente. Por isso há que minimizar todo o tipo de perdas. Actualmente, a produção de hipoclorito de sódio, está afectada economicamente devido à grande quantidade de produto que se perde
Além das perdas, que normalmente ocorrem por erros de produção, contaminação de produto, tem existido um grande número de reclamações devido a perda de cloro activo por parte do produto. Em média, em cada quinze reclamações que a RNM recebe, cinco são devidas ao hipoclorito de sódio, ou seja um terço das reclamações são devidas ao hipoclorito de sódio. O que faz com que a empresa tenha prejuízo com este produto, uma vez que na maioria das vezes o produto tema que ser eliminado, ou então é usado internamente, para desinfecção e limpeza.
19
Para além da perda de produto, a cada reclamação acresce um custo de transporte, eliminação de produto e mão-de-obra.
Outro dos prejuízos para empresa, que esta instabilidade do hipoclorito de sódio, acarreta, é a perda de confiança na relação fornecedor cliente, uma vez que reclamações devidas a diferenças na concentração de produto, poderão sugerir no cliente, que tal facto não ocorre espontaneamente e acidentalmente, mas sim propositadamente.
É devida ao problema económico causado pelo hipoclorito de sódio, que surge a motivação para o desenvolvimento desta dissertação. Procurando assim, alternativas e melhorias a introduzir no processo que diminuam efectivamente o número de reclamações e consequentemente os prejuízos para a empresa
20
21
Neste capítulo, será apresentado o plano de ensaios e a forma como estes foram realizados. Serão ainda evidenciadas as metodologias de ensaio e os materiais usados.
1. Metodologias de ensaio:
1.1. Determinação do teor de cloro activo em hipoclorito de sódio (MIE09)
Princípio do método:
A determinação de cloro é feita em meio ácido, com uma solução padrão de tiossulfato de sódio 0,1N. Titula-se o iodo desprendido de uma solução de iodeto de potássio, usando como indicador uma solução de amido.
Equação 7 – Reacção do cloro com o iodo.
Limitações do método:
× Só é possível ler valores superiores a 1,8 mg/l como cloro activo.
× Todas as substâncias redutoras, como sulfuretos orgânicos e outros halogéneos (brometos e iodetos) são lidas como cloro.
× As soluções aquosas de cloro não são estáveis, e a concentração diminui com o tempo.
× As amostras devem ser analisadas o mais rápido possível.
Material e Equipamento:
× Material normal de laboratório × Balão de 500 ml × Pipetas de 10 ml × Pipetas graduadas de 0 a 5 ml × Bureta de 25 ou 50 ml graduada de 0,1 em 0,1 ml × Densímetro de 1.200 a 1.300 g/cm3 × Termómetro de 0 a 100º C 2 2 2KI 2KCl I Cl (Equação 7)
22 Reagentes: × Tiossulfato de sódio 0.1 N × Água desionizada × Iodeto de potássio 50% × Ácido sulfúrico 50%
× Solução indicadora de amido 1%
Procedimento:
× Ensaio:
Pipetar 10 ml de hipoclorito para um balão de 500 ml adicionar água desionizada até completar o volume. Agitar bem. Desta solução pipetar 10 ml para um matraz de 300 ml. Adicionar 2 a 2,5 ml de iodeto de potássio, 5 ml H2SO4 e titular com tiossulfato de sódio 0,1N, até que a solução fique amarelo palha. Neste momento, adicionar 3 gotas de amido e continuar a titulação até que a solução fique incolor. Anotar o volume gasto.
× Determinação da densidade:
Encher uma proveta de 250 ml seca com hipoclorito de sódio a analisar. Colocar um termómetro e um densímetro dentro da bureta e esperar 3 minutos antes de ler. Anotar os valores de densidade e temperatura (esta não deve diferir muito de 20 ºC).
Nota: Deve-se pressionar um pouco o densímetro para assegurar que ele se move livremente.
Procedimento de cálculo:
× Concentração do cloro activo ( g/l ) : (g/l) Cl2 = Vtitulante x 17.73
Fórmula geral:
(g/l) Cl2 = V titulante x 35.5 x N / Toma
Em que:
N - normalidade do tiossulfato de sódio
Toma – (Volume inicial de hipoclorito /volume do balão utilizado) * volume pipetado para a titulação
23
× Concentração do cloro activo (%) :
(%) Cl2 = ( (g/l) Cl2 / Peso especifico (g/l)) x 100
Em que:
Peso específico (Kg/l) = densidade (sem unidades)
1.2. Determinação do teor de alcáli-livre em soluções de hipoclorito de sódio (MIE16)
Princípio do método:
O teor de soda é determinado por titulação com ácido clorídrico, usando fenolftaleína como indicador. Este método tem por objectivo a determinação da alcalinidade, expressa como hidróxido de sódio, em amostras de Hipoclorito de sódio.
Limitações do método:
× À amostra junta-se uma solução diluída de peróxido de hidrogénio para reduzir o cloro do hipoclorito a cloreto.
Material e Equipamento:
× Material normal de laboratório × Balão de 500 ml × Pipetas de 10 ml × Pipetas graduadas de 0 a 5 ml × Bureta de 25 ou 50 ml graduada de 0,1 em 0,1 ml × Densímetro de 1.200 a 1.300 g/cm3 × Termómetro de 0 a 100º C Reagentes: × Ácido clorídrico 1N × Água desionizada × Fenolfetaleína 0.2% × Peróxido de hidrogénio 10%
24
Procedimento:
× Ensaio:
Pipetar 10 ml de hipoclorito para um matraz de 500 ml adicionar água desionizada até aproximadamente 100 ml. Com agitação forte, adicionar lentamente água oxigenada, até não produzir efervescência. Adicionar umas gotas de fenolftaleína e titular com HCl 1N até ficar incolor. No final da titulação, adicionar mais umas gotas de fenolftaleína para ver se a titulação foi completa. Se ficar rósea continuar a titulação. Anotar o volume gasto.
Procedimento de cálculo:
× Concentração de alcáli-livre ( g/l ) :
NaOH (g/l) =( V titulante x 40 x N) / Toma Fórmula a aplicar:
NaOH (g/l) = V titulante x 4 Em que:
N - normalidade do ácido cloridrico
Toma – (Volume inicial de hipoclorito /volume do balão utilizado) * volume pipetado para a titulação
2. Planificação dos ensaios:
Para perceber quais os factores que influenciavam e favoreciam a degradação de cloro activo em hipoclorito de sódio. E com o intuito de perceber em que medida e que esta influência se fazia sentir. Realizaram se diversos ensaios que serão explanados a seguir.
De modo a perceber como é que o cloro activo se degradaria ao longo do tempo, em condições normais de armazenamento e sem influência de factores externos extremos. Colocaram-se dois ibc’s com hipoclorito de sódio a 13 e 15% (w/w), exactamente nas mesmas condições, e foram analisados durante o período correspondente ao prazo de validade do produto. De salvaguardar que os ibc’s escolhidos para efectuar a análise foram escolhidos de forma a representar o pior dos cenários, uma vez que ao início do estudo já apresentavam uma acentuada perda de cloro.
Em simultâneo, nestas mesmas amostras foi traçado o perfil de degradação do alcáli-livre ao longo do período de análise de forma a perceber se a degradação de cloro afectaria a concentração deste parâmetro.
25
Em simultâneo procedeu-se ao estudo de possíveis factores que influenciassem a perda de cloro activo: exposição solar, exposição a temperaturas ambientais em pelo verão, exposição a refrigeração, factor de diluição, concentração de alcáli-livre, tipo de embalagem, e presença de metais. Nas análises efectuadas que seriam alvo de comparação, foi usado sempre a mesma matéria-prima e as condições de ensaio foram exactamente as mesmas.
De salientar ainda que as análises, para a determinação de cloro activo e de alcáli-livre presente nas amostras, foram realizadas em duplicado.
Na tabela 3 e possível, observar um resumo dos ensaios efectuados, bem como a periocidade das análises.
Tabela 3 – Planificação dos ensaios para avaliar a degradação de cloro activo em hipoclorito de sódio 13 e 15% (w/w).
Objectivo Amostras Analisadas Duração
do Ensaio Frequência das análises
Avaliar a manutenção ou rejeição do prazo de validade em vigor. (Quantificação do cloro activo presente ao longo do tempo)
IBC (1200kg)de Hipoclorito
15% (w/w) ≈3 meses
Amostra analisada 3 vezes por semana no 1º mês. Nos meses seguintes a amostra foi analisada uma vez por semana.
IBC (1200kg)de Hipoclorito
15% (w/w) ≈3 meses
Amostra analisada 3 vezes por semana no 1º mês. Nos meses seguintes a amostra foi analisada uma vez por semana.
Avaliar a influência de álcali livre presente no hipoclorito de sódio, na degradação de cloro activo.
Volume das amostras (3L)
15%
[álcali-livre]=6.2 g/L
1 mês
As amostras foram analisadas no início e no fim do ensaio. [álcali-livre]=6.7 g/L [álcali-livre]=7.2 g/L [álcali-livre]=7.7 g/L [álcali-livre]=8.7 g/L 13% [álcali-livre]=6.2 g/L [álcali-livre]=7.2 g/L [álcali-livre]=7.7 g/L [álcali-livre]=8.2 g/L [álcali-livre]=8.7 g/L
26
Objectivo Amostras Analisadas Duração do
Ensaio Frequência das análises
Avaliar a influência dos factores atmosféricos (exposição solar e temperatura) na degradação do cloro activo.
Volume das amostras (3L)
15%
Sujeito a exposição solar e temperatura
ambiente
47 dias Amostra analisadas 3 vezes por semana.
Sujeito a
refrigeração 1 mês
A amostra foi analisada no início e no fim do ensaio.
13%
Sujeito a exposição solar e temperatura
ambiente
47 dias Amostra analisadas 3 vezes por semana.
Sujeito a
refrigeração 1 mês
A amostra foi analisada no início e no fim do ensaio.
Avaliar a influência tipo de embalagem na degradação de cloro activo.
Volume das amostras (3L)
15%
Embalagem transparente
47 dias Amostra analisada 3 vezes por semana. Embalagem opaca 13% Embalagem transparente Embalagem opaca Avaliar a influência do factor de
diluição na degradação de cloro activo.
15% Bilha de 25kg
3 meses
Amostra analisada 3 vezes por semana no 1º mês. Nos meses seguintes a amostra foi analisada uma vez por semana.
13% Bilha de 25kg
Avaliar a influência da presença de metais na degradação de
cloro activo. 13%
Amostra de 3L em presença de uma placa metálica
24 horas Amostra analisada de hora em hora. Amostra de 3L em presença de diferentes áreas de placa metálica (25,100,150 cm2)
2 horas A amostra foi analisada no início e no fim do ensaio. Amostra de diferentes volumes (150, 500 ,800 mL) em presença da mesma placa metálica
2 horas A amostra foi analisada no início e no fim do ensaio.
27
28 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 0 20 40 60 80 100 Cl o ro ac tiv o ( % ) Tempo (d) Como fora referido anteriormente, a instabilidade e reactividade do hipoclorito de sódio, conduz a perda de funcionalidade deste produto. Ou seja, degradação do cloro activo. Este fenómeno ocorre por influência de diversos factores, alguns dos quais serão estudados em seguida.
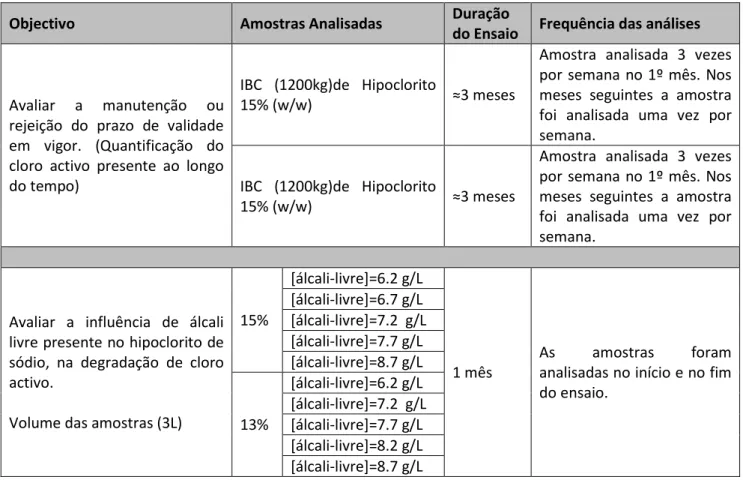
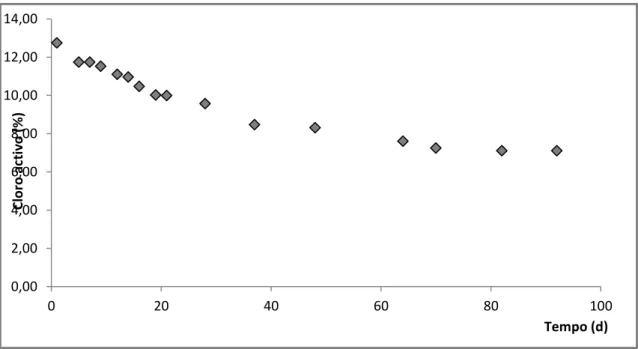
1. Estudo da degradação de cloro activo, em hipoclorito de sódio
A avaliação da degradação do cloro ao longo do tempo, estando o produto em IBC, não opaco, e em condições de armazenamento normais (interior do armazém), tinha por objectivo percepcionar, se o produto se manteria dentro dos valores das especificações técnicas, durante o seu prazo de validade (3 meses).
Para tal, esta análise foi realizada para ambas as concentrações do produto em questão (13 e 15% (w/w)), exactamente nas mesmas condições (embalagem, volume, temperatura, exposição à luz). No entanto, o tempo de observação deste fenómeno, é inferior no que respeita ao hipoclorito de sódio a 13% devido a uma contaminação acidental do produto em questão.
Nas figuras 9 e 10, é possível observar a degradação do cloro activo para hipoclorito de sódio a 15 e 13 % (w/w), respectivamente.
29
Figura 10 – Degradação do cloro activo presente no hipoclorito de sódio 13% (w/w), ao longo do tempo.
Ao analisar, os gráficos anteriores, verifica-se que o prazo de validade actualmente, atribuído pela empresa, não reflecte a realidade do produto. Uma vez que em ambos os casos, não é possível manter a percentagem de cloro activo dentro dos valores definidos nas especificações técnicas, durante o período estipulado de três meses. Desta forma, seria correcto reduzir o prazo de validade do produto em questão. No entanto se avaliarmos os resultados obtidos, observa-se que a degradação do cloro activo é praticamente imediata, uma vez que passados sete dias de análise o produto já se encontrava não-conforme. Logo a adopção de um prazo de validade tão curto, tornaria inviável a comercialização deste produto. Pelo que, a solução deste problema, terá que passar pela adopção de novas medidas que contrariem este fenómeno, medidas essas que serão apresentadas no capítulo seguinte.
Com o objectivo de encontrar soluções, para o problema levantado anteriormente, procedeu-se a análise dos possíveis factores, causadores da degradação do cloro, para além daqueles que são inerentes à própria instabilidade do produto. Assim como de possíveis erros internos que pudessem, também favorecer esta degradação.
0 2 4 6 8 10 12 14 16 0 10 20 30 40 50 60 70 Cl o ro ac tiv o ( % ) Tempo (d)
30 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 0 20 40 60 80 100 [OH -] (g/L) Tempo (d)
2. Estudo da degradação do álcali-livre (NaOH), ao longo do tempo, em
hipoclorito de sódio
O hidróxido de sódio, presente na solução de soda cáustica líquida, que é usada na produção de hipoclorito de sódio, tem como principal função, a estabilização deste produto. Uma vez que estabilizando o pH em valores continuamente alcalinos, consequentemente vai promover a estabilidade do produto e assim retardar a degradação do cloro activo.
Devido a este facto, entendeu-se importante perceber como é que o teor de hidróxido de sódio, se comporta com a diminuição do cloro activo. Para tal, traçou-se um perfil de degradação deste composto químico, ao longo do tempo de ensaio.
Ao observar as figuras 11 e 12, verifica-se que como seria de esperar, ocorre uma diminuição do teor de álcali-livre, ao longo do tempo, para ambas as formas de hipoclorito. Uma vez que, a degradação de cloro activo e a perda de estabilidade está intimamente relacionadas.
Esta relação entre teor em álcali-livre e degradação de cloro activo no hipoclorito, é bem visível através dos dados obtidos experimentalmente, uma vez que o valor final obtido para o teor em álcali-livre no hipoclorito de sódio 15% (w/w), é praticamente o dobro do obtido para o hipoclorito de sódio 13% (w/w), à semelhança do que acontece na degradação de cloro activo, onde esta proporção também é verificada.
Figura 11 – Perfil de concentração de álcali-livre, ao longo do tempo, em hipoclorito de sódio 15% (w/w).
31 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 0 10 20 30 40 50 60 70 [OH -] (g/L) Tempo (d)
Figura 12 – Perfil de concentração de álcali-livre, ao longo do tempo, em hipoclorito de sódio 13% (w/w).
3. Estudo da Influência do estabilizante (álcali-livre), na degradação de
cloro activo, em hipoclorito de sódio
Um dos parâmetros analisados, acerca da sua influência na degradação de cloro activo, foi precisamente o teor em álcali-livre (NaOH). Devido à constatação experimental, referida no ponto anterior, em que se verifica que ocorre perda de concentração do estabilizante, e associado ao facto de o teor, deste parâmetro, variar consoante o fornecedor do hipoclorito. Decidiu-se analisar a perda de cloro activo, para diferentes concentrações iniciais de álcali-livre.
Esta determinação tinha por objectivo, perceber se seria benéfico para o processo, aquando da diluição do produto para produção de hipoclorito de sódio 13” (w/w), aumentar a concentração de álcali- livre do produto em questão.
Foram assim realizados ensaios, exactamente nas mesmas condições de volume, temperatura, tipo de embalagem, para hipoclorito de sódio, em várias concentrações de álcali-livre: 6.2(ensaio em branco), 6.7,7.2,7.7,8.2,8.7 g/L. A decisão de estudar estas concentrações foi baseada nos dados enviados pelos fornecedores, relativamente ao teor do hipoclorito de sódio em álcali-livre.
32 0 2 4 6 8 10 12 14 16 18 0 10 20 30 40 Cl o ro ac tiv o ( % ] Tempo (d) 6.2 g/L 6.7 g/L 7.2 g/L 7.7 g/L 8.7g g/L
Assim, concluiu-se que o aumento do teor, em estabilizante, só é benéfico para hipoclorito de sódio 15% (w/w). Neste caso, observa-se que o benefício só é verificado para valores de concentração de álcali-livre acima do 7.7 g/L, nos valores de concentração inferiores, não se obteve qualquer benefício comparativamente com os valores obtidos no ensaio em branco. (Figura 13). Ou seja, quando o teor em NaOH, é inferior a 7.7 g/L, a perda de cloro activo, num período de aproximadamente um mês, é de 41.4%.
Por sua vez, se o teor em NaOH, for de 8.2 ou 8.7 g/L, a perda de cloro activo é de 30.3 e 25.3%, respectivamente. De salientar que não foram estudados os efeitos deste parâmetro para concentrações superiores a 8.7 g/L.
Figura 13 – Estudo da influência da concentração de estabilizante em hipoclorito de sódio 15% (w/w).
Ao olhar agora para o hipoclorito de sódio 13% (w/w),(Figura 14), verifica-se que a adição de NaOH, não trás qualquer beneficio para o processo, uma vez que a perda de cloro activo é de cerca de 15.4%, no período de aproximadamente um mês, para todas as concentrações testadas, incluindo o ensaio em branco
33 0 2 4 6 8 10 12 14 0 10 20 30 40 Cl o ro ac tiv o ( % ] Tempo (d) 6.2 g/L 7.2 g/L 7.7 g/L 8.2g/L 8.7g g/L
Figura 14 – Estudo da influência da concentração de estabilizante em hipoclorito de sódio 13% (w/w).
4. Estudo do efeito da diluição do produto, na degradação de cloro activo
em hipoclorito de sódio
O estudo do efeito da diluição na degradação do cloro activo do produto em análise, tinha por objectivo perceber em qual das formas do produto (13 e 15% (w/w)), a perda seria mais efectiva. Uma vez que existia a necessidade de verificar se a diluição do produto imediatamente após a recepção ou se seria mais vantajoso do que efectuar a diluição o mais próximo possível, da expedição do produto para o cliente.
Após os ensaios realizados, conclui-se que a diluição do produto, não afecta a perda de cloro activo, uma vez que a taxa de degradação deste é de 0.07%/dia, para ambas formas do produto (Figura 15).
34 0 2 4 6 8 10 12 14 16 0 20 40 60 80 100 Cl or o act iv o (% ) Tempo (d) 15% 13%
Figura 15 – Influência da diluição do produto na degradação do cloro activo.
5. Estudo da Influência da exposição a temperaturas ambientes elevadas,
luz, e tipo de embalagem na degradação de cloro activo em hipoclorito
de sódio
Após a constatação de que a maioria das reclamações /devoluções de hipoclorito de sódio, na empresa, se faziam sentir no mês de Setembro, mês coincidente normalmente com o fim do verão, ou seja, o produto alvo das reclamações fora produzido nos meses de onde as temperaturas são maiores. Juntando às condições climatéricas, o facto de este produto ser normalmente comercializado em embalagens permeáveis à luz solar, e muitas das vezes o seu armazenamento, não ser feito de forma a resguardar o produto dos factores externos ambientais. Foi o indicador para associar a degradação do cloro activo às condições de armazenamento (luz e temperatura e ao tipo de embalagem.
Desta forma, procedeu-se ao estudo da influência destes factores, através da realização de ensaios experimentais, com o hipoclorito de sódio sujeito as condições climatéricas e em diferentes tipos de embalagens.
35 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 0 10 20 30 40 50 Cl o ro ac tiv o ( % ) Tempo (d) 15% 13%
De forma a melhor perceber o efeito da temperatura na degradação de cloro activo, efectuou-se em simultâneo, um ensaio onde se colocou o hipoclorito de sódio em ambiente refrigerado.
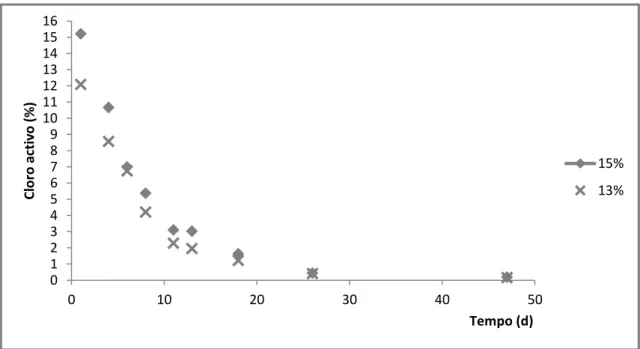
5.1. Estudo da degradação de cloro activo em hipoclorito de sódio sujeito às condições climatéricas e influência do tipo de embalagem.
Quando se sujeita o hipoclorito de sódio a condições climatéricas, onde a temperatura média rondou os 27 oC, e com total exposição à luz solar (figura 16), verifica-se, que estes factores, aceleram muito a percentagem de degradação de cloro activo. Uma vez que ao fim de 47 dias de exposição a perda de cloro activo é praticamente de 100%, quer para o hipoclorito de sódio 15 % (w/w), quer para o hipoclorito de sódio 13% (w/w) (Figura16).
Figura 16 – Influência da temperatura e exposição solar na degradação de cloro activo em hipoclorito de sódio
O mesmo estudo foi feito colocando dois tipos diferentes de embalagens (opacas e transparentes), sujeitas exactamente as mesmas condições climatéricas. Nas figuras 17 e 18 é possível observar os resultados obtidos para a degradação de cloro activo, em hipoclorito 15 e 13% (w/w), respectivamente.
Assim, no que respeita ao hipoclorito de sódio a 15% (w/w), a perda de cloro activo é de menos 15.4% quando se usam embalagens opacas.
36 0 2 4 6 8 10 12 14 16 0 5 10 15 20 25 30 35 40 45 50 Cl o ro ac tiv o ( % ) Tempo (d) Embalagem transparente Embalagem opaca 0 2 4 6 8 10 12 14 0 5 10 15 20 25 30 35 40 45 50 Cl o ro ac tiv o ( % ) Tempo (d) Embalagem transparente Embalagem opaca
Por sua vez, no hipoclorito de sódio a 13% (w/w), a perda de cloro activo é de menos 17.7 % quando se usam embalagens opacas.
Figura 17 – Influência do tipo de embalagem na degradação de cloro activo em hipoclorito de sódio 15% (w/w).
Figura 18 – Influência do tipo de embalagem na degradação de cloro activo em hipoclorito de sódio 13% (w/w).
Associada a degradação de cloro activo, existe uma degradação da cor do próprio produto, que é bem notória quando se usam tipos de embalagens diferentes. Degradação essa, que pode ser observada nas figuras 19 e 20.
37
Figura 19 – Fotografia da degradação de cor, resultante da exposição do hipoclorito de sódio à luz solar, em diferentes tipos de embalagem, após seis dias de exposição.
Figura 20– Fotografia da degradação de cor, resultante da exposição do hipoclorito de sódio à luz solar, em diferentes tipos de embalagem, após quarenta e sete dias de exposição.
5.2. Estudo da degradação de cloro activo em hipoclorito de sódio, em condições
de refrigeração
Ao colocar hipoclorito de sódio, sujeito a refrigeração, a uma temperatura média de 5 oC, verifica-se que a degradação de cloro activo é muito menos acentuada do que quando se expõe o produto a temperatura normal de armazenamento (18oC). Na tabela 3, é possível observar, as perdas de cloro activo para ambas as formas de hipoclorito de sódio analisadas.
Tabela 4 – Valores comparativos da perda de cloro activo no hipoclorito de sódio, com e sem refrigeração
Perda de cloro activo (%) Hipoclorito de sódio 15% (w/w) C/ Rerigeração) 8.25 S/Refrigeração 17.41 Hipoclorito de sódio 13% (w/w) C/ Rerigeração) 0.91 S/Refrigeração 15.03
38
6. Estudo da influência da presença de metais na degradação de cloro
activo em hipoclorito de sódio
Ao longo do período de observação da produção de hipoclorito de sódio, monitorização dos parâmetros em análise e avaliação das causas das reclamações deste produto, surgiu a possibilidade de ocorrer contaminação do produto por metais. Metais esses, que poderiam surgir de vários pontos, entre os quais se destacavam: existência de metais na água desmineralizada com a qual se procede à diluição do produto, ou a existência de alguma parte metálica do próprio IBC que estivesse em contacto directo com o produto.
A primeira hipótese foi descartada através da análise da qualidade da água desmineralizada produzida na RNM, que revelou, que a água não continha qualquer vestígio de metais, que pudessem assim influenciar o produto final.
Passou-se então para a segunda hipótese, e ao analisar cuidadosamente os IBC’s, constatou-se a presença, em alguns deles, de um pequeno parafuso, intrínseco a torneira do mesmo. Que embora de pequenas dimensões manteria contacto permanente com o produto, causando-lhe uma reacção e formação de um precipitado. Dos IBC’s que apresentavam esta reacção foi retirada uma amostra, que se mandou analisar externamente, para pesquisa da presença de ferro. A qual não foi detectada
Desta forma, para ter a percepção da influência na degradação de cloro activo, do contacto do hipoclorito de sódio com metais, realizou-se um estudo laboratorial, onde se avaliaram os seguintes parâmetros: degradação de cloro activo ao longo do tempo de contacto com uma placa metálica; influência da dimensão (área) do metal e influência do volume de amostra.
Este estudo apenas foi realizado para o hipoclorito de sódio 13% (w/w), de seguida serão apresentados os resultados.
39 0 0,51 1,52 2,53 3,54 4,55 5,56 6,57 7,58 8,59 9,510 10,511 11,512 12,513 13,514 14,515 15,516 0 2 4 6 8 10 Cl o ro ac tiv o ( % ) Tempo (h)
6.1. Estudo da degradação de cloro activo, em hipoclorito de sódio 13% (w/w), em presença de metais.
Para avaliar este parâmetro usou-se uma amostra de 150mL de hipoclorito de sódio 13% (w/w), em contacto com uma placa de metal cuja área era de 25 cm2.
Por análise da figura 21, verifica-se que ao fim de oito horas de contacto com o metal, a perda de cloro do hipoclorito de sódio é de praticamente 98.1%, sendo que esta degradação ocorreu a uma taxa de 1.1%/h.
Figura 21 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal.
6.2. Estudo da influência do volume da amostra de hipoclorito de sódio em contacto com o metal
Neste ensaio, foram testados três volumes de amostra (150/500/800 mL), em contacto com uma placa de metal de 25 cm2, por um período de contacto de 2h.
Foi possível concluir que em volumes menor a perda de cloro activo é mais acentuada. A diminuição da perda de cloro activo é gradual com o aumento de volume de amostra (Figura 22).
40
Figura 22 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal, em diferentes volumes de amostra.
6.3. Estudo da influência do tamanho do metal, na degradação de cloro activo
no hipoclorito de sódio em contacto com o metal
Neste ensaio, foram testados três tamanhos de placas metálicas (25,100,150 cm2), num volume de amostra de 800 mL e por um período de contacto de 2h.
Foi possível concluir que o tamanho da placa metálica, praticamente não influencia a perda de cloro uma vez que a percentagem de cloro activo final, ronda os 12,7% para os três casos (Figura 23)
Figura 23 – Estudo da degradação do cloro activo em hipoclorito de sódio 13% (w/w), em contacto com o metal, em diferentes tamanhos da placa metálica.
9,5 10 10,5 11 11,5 12 12,5 13 150 500 800 Cl o ro ac tiv o ( % ) Volume (mL) 12,6 12,62 12,64 12,66 12,68 12,7 12,72 25 100 150 Cl o ro ac tiv o ( % ) Área da placa (cm2)
41
42
Após o estudo sobre a instabilidade e degradação do coloro em hipoclorito de sódio produzido pela RNM, foi necessário delinear estratégias para melhorar o processo de produção e minimizar as perdas de cloro activo por parte do produto.
Assim, foi possível, constatar que factores como temperatura, luz, tipo e condição da embalagem, presença de contaminantes, aceleraram o processo de degradação de cloro activo já inerente ao próprio produto.
Então para melhorar o processo e minimizar as perdas, é necessário adoptar um conjunto de medidas, que tomadas em conjunto poderão permitir que o produto se mantenha de acordo com as especificações técnicas.
1. Sugestões de melhoria
1.1. Tipos de embalagem
Para obter uma melhor qualidade no produto final, é necessário adoptar o uso de embalagens opacas, (Figura 24) abdicando totalmente do uso de embalagem permeáveis à luz solar.
Figura 24 –Exemplo de embalagens opacas.
Para além, da escolha por embalagens opacas, é necessário garantir que estas são cuidadosamente lavadas, dedicadas, ou seja devem ser usadas sempre para o mesmo produto. Uma vez que, sendo o hipoclorito de sódio um produto tão reactivo,
43
ao usar embalagens dedicadas, minimiza-se muito o risco de contaminação. As embalagens têm ainda que ser inspeccionadas visualmente pelo operador antes do enchimento com o produto, para garantir que não haja qualquer componente metálico e contacto com o hipoclorito de sódio.
1.2. Condições de Armazenamento
Para que seja possível manter o hipoclorito de sódio com concentração de cloro activo de acordo com as especificações, é necessário ter muita atenção às condições de armazenamento.
Desta forma, este produto, deverá ser, impreterivelmente, armazenado ao abrigo da luz, em ambientes escuros, possível, e nunca em condições de temperatura superior aos 15oC. Idealmente o armazenamento deveria ser feito com recurso a refrigeração, no entanto, caso não seja possível, deverá ser armazenado num local bastante fresco
1.3. Outras sugestões:
Se porventura, for necessário comercializar algum hipoclorito de sódio a 15%(w/w),o teor em álcali-livre deverá ser ajustado, antes de expedir o produto, para valores no intervalo de 7.7 – 8.7 g/L.
No que respeita à manutenção do prazo de validade do hipoclorito de sódio (3 meses), importa salientar que nos moldes actuais de produção, um prazo tão alargado é inviável perante as constatações laboratoriais obtidas. No entanto após a aplicação das medidas de melhoria sugeridas, talvez seja possível.