Resistência à Colistina e sua Disseminação:
Implicações em Saúde Pública
Colistin Resistance and its Dissemination: Implications for Public
Health
Adriana Costa1, Gabriela Jorge da Silva1,2
1. Faculdade de Farmácia da Universidade de Coimbra, Coimbra, Portugal.
2. Centro de Neurociências e Biologia Celular da Universidade de Coimbra, Coimbra, Portugal.
Autor Correspondente:
Gabriela Jorge da Silva, gjsilva@ci.uc.pt
Faculdade de Farmácia da Universidade de Coimbra, Polo das Ciências da Saúde, Azinhaga Sta Comba, 3000-548 Coimbra, Portugal Recebido: 10/10/2017; Aceite: 10/01/2018
Resumo
A colistina é um antibiótico polipeptídico que foi extensivamente utilizado, a nível mundial, em medicina humana e veterinária, na década de 1960. Na medicina humana, a elevada incidência de nefrotoxicidade e de neurotoxicidade, desencadeou o declínio da utilização sistémica da colistina. Consequentemente, a colistina foi substituída por outros antibióticos menos tóxicos. No entanto, nas últimas décadas, o elevado número de surtos hospitalares provocados por bactérias Gram-negativo resistentes a múltiplos fármacos, levou os clínicos a re-introduzir a colistina sistémica, como fármaco de último recurso.
Até 2015, a resistência à colistina relacionava-se com a ocorrência de mutações cromossómicas, não havendo descrição da ocorrência de transferência horizontal de genes. Em novembro de 2015, na China, foi publicado, pela primeira vez, um caso de resistência à colistina codificado pelo gene mcr-1, localizado num plasmídeo. Em junho de 2016, na Bélgica, foi detetado outro gene de resistência à colistina mediada por plasmídeo, designado mcr-2. Após a sua divulgação, os genes foram detetados em amostras de animais produtores de alimentos, amostras clínicas humanas e fontes ambientais, em muitos países, o que indica uma disseminação global e ameaça ao tratamento de infeções multirresistentes.
Palavras-chave: Colistina/uso terapêutico; Farmacorresistência Bacteriana; Infecções por Bactérias Gram-Negativas/tratamento; Saúde Pública
Abstract
Colistin is a polypeptide antibiotic that was used extensively worldwide in human and veterinary medicine, in the 1960s. In human medicine, systemic colistin treatment has gradually declined due to the reported high incidence of nephrotoxicity and neurotoxicity. Consequently, colistin was replaced by other less toxic antibiotics. However, in the last few decades, the extensive number of hospital outbreaks as a result of the multidrug resistant Gram-negative bacteria, forced clinicians to re-introduce systemic colistin, as a last resort drug.
Until the year 2015, colistin resistance has involved chromosomal mutations but dissemination of colistin resistance has never been reported via horizontal gene transfer. Nonetheless, in November 2015, in China, it was published a colistin resistance case encoded by the mcr-1 gene located on a plasmid, for the
first time. In June 2016, in Belgium, it was detected another case of plasmid mediated colistin resistance gene, designated mcr-2. Since those descriptions, these genes have been detected in isolates recovered from
food producing animals, humans and environmental sources, in many countries, which indicates a global dissemination and a threat for the treatment of multiresistant infections.
Keywords: Colistin/therapeutic use; Drug Resistance, Bacterial; Gram-Negative Bacterial Infections/drug
therapy; Public Health
Introdução
Atualmente observa-se um número crescente de in-feções causadas por bactérias Gram-negativo multi--resistentes (BGN-MR), que resulta do facto de estas bactérias se apresentarem resistentes às opções tera-pêuticas existentes, como cefalosporinas, quinolonas e carbapenemos, e de durante as últimas duas déca-das não terem sido sintetizados novos antibióticos com ação contra estas bactérias.1 O aparecimento de BGN-MR, incluindo bactérias resistentes a carbape-nemos, desencadeou um interesse renovado por uma classe de antibióticos outrora utilizados: as polimixi-nas. A polimixina E ou colistina surge no século XXI como uma das últimas alternativas terapêuticas para tratar infeções causadas por bacilos Gram-negativo extremamente resistentes (XDR). Contudo, o recen-te aparecimento de resistência à colistina, que pode ser facilmente disseminada, levou a um aumento da preocupação relativamente ao tratamento de infeções causadas por microrganismos XDR. Este trabalho revê o mecanismo de ação, espetro bacteriano e uso da colistina e explica os mecanismos de resistência a este antibiótico e de disseminação da resistência, alertando para o uso racional deste antibiótico em produção animal, medicina veterinária e humana, com risco de se entrar numa era pós-antibiótica onde nenhum antibiótico comercializado é efetivo.
Colistina
Mecanismo de ação e espetro antibacteriano
A ação bactericida da colistina inicia-se pela sua liga-ção ao lípido A do lipopolissacarídeo (LPS) da mem-brana externa das bactérias Gram-negativo (BGN). A ligação ocorre através da interação eletrostática entre os grupos amina livres da colistina, carregados posi-tivamente, e os grupos fosfato do lípido A, carrega-dos negativamente. Esta interação desencadeia uma permuta catiónica, sendo que os catiões divalentes de cálcio e magnésio, imprescindíveis para assegurar a estrutura do LPS, são substituídos pela colistina, o que desencadeia uma alteração na estrutura do LPS. Deste modo, a integridade física da bicamada fosfoli-pídica da membrana citoplasmática é comprometida, levando à sua disrupção, com libertação do conteúdo intracelular e consequente morte celular.2,4 Além da potente atividade bactericida, a colistina apresenta, também, atividade anti-endotoxina, uma vez que o lípido A da molécula do LPS representa a endotoxina de BGN, ou seja, um importante fator de virulência.2-5 Contudo, o mecanismo de ação a nível do citoplasma ainda não é completamente conhecido.
O espetro de atividade antibacteriano engloba a maioria dos bacilos Gram-negativo aeróbios, ex-cluindo Proteus spp., Serratia spp., Providencia spp, Brucella spp., Edwardsiella spp., Pseudomonas mallei e o
complexo Burkholderia cepacia. Por sua vez, não inclui
bactérias anaeróbias, cocos Gram-negativo, bactérias Gram-positivo e fungos.5
A colistina possui duas formas de apresentação dis-poníveis no mercado, mais especificamente, o sulfato de colistina (CS) e o colistimetato de sódio (CMS). O CMS é um polianião a pH fisiológico, o que o impede de possuir atividade antibacteriana, sendo, por isso, um profármaco. No entanto, é muito instável, pelo que, a pH fisiológico é rapidamente hidrolisado, ad-quirindo, deste modo, atividade farmacológica.1 As vias de administração da colistina incluem a via parentérica, tópica, oral e inalatória. O profármaco CMS é utilizado quando se pretende uma adminis-tração por via parentérica ou inalatória. O CS é passí-vel de ser administrado por via oral, tópica ou inala-tória. A administração por via oral é exclusiva para o tratamento de infeções intestinais por BGN, uma vez que o CS não é absorvido no trato gastrointestinal, possuindo apenas efeito bactericida local.6
Utilização clínica
A utilização clínica da colistina no tratamento de in-feções causadas por BGN iniciou-se em 1950. A partir dos anos 80, observou-se um declínio da sua admi-nistração por via parentérica devido à notificação das reações adversas, de nefrotoxicidade e neurotoxici-dade, e ao aparecimento de agentes antibacterianos menos tóxicos. No entanto, a administração da colis-tina, por via oral e tópica, manteve-se na prática clí-nica em humanos, mas, essencialmente, em medicina veterinária, com fins terapêuticos, profiláticos, meta-filáticos e de promoção de crescimento nos animais destinados à produção de alimento.6-8
Entre 1990 e 2000, a utilização da colistina através da via parentérica foi re-introduzida nas indicações terapêuticas para o tratamento da fibrose quística provocada por BGN-MR.6
O aumento progressivo das infeções nosocomiais por BGN-MR, associado ao facto de as opções terapêu-ticas disponíveis atualmente não serem eficazes no tratamento destas infeções, desencadeou a sua re--introdução. Atualmente, a colistina é considerada a última linha de defesa contra as infeções causadas por BGN-MR, mais especificamente, por A. baumannii, P. aeruginosa e K. pneumoniae.6
Em 2015, foi identificado, pela primeira vez, um mecanismo de resistência plasmídico, com uma
elevada capacidade de disseminação.9 A colistina foi, por isso, incluída na lista de antibióticos criticamen-te importancriticamen-tes em medicina humana, por parcriticamen-te da Organização Mundial de Saúde (OMS) (Fig. 1).10
Figura 1 – Perspetiva histórica da colistina. A utilização da colistina iniciou-se em 1950, no tratamento de infeções provocadas por bactérias Gram-negativo, em medicina hu-mana e veterinária. No entanto, a notificação de reações adversas aliada ao aparecimento de alternativas terapêu-ticas mais seguras, desencadeou o declínio da utilização parentérica da colistina na medicina humana. O declínio na prática clínica em humanos, foi acompanhado por uma utilização crescente em veterinária. Em 1990, a utilização parentérica da colistina foi re-introduzida no tratamento da fibrose quística provocada por bactérias Gram-negativo multirresistentes. Em 2000, o aumento progressivo de in-feções nosocomiais provocadas por bactérias Gram-nega-tivo multirresistentes, associada ao facto de as opções terapêuticas disponíveis não se demonstrarem eficazes, desencadeou a re-introdução da colistina, como agente antibacteriano de último recurso. Em 2015, foi identificado um novo mecanismo de resistência à colistina, designada-mente, resistência mediada por plasmídeo com capacida-de capacida-de disseminação.
Utilização clínica em Portugal
As indicações terapêuticas da colistina, em medicina humana, são muito específicas e limitadas; incluem o tratamento de infeções nosocomiais graves por BGN-MR e infeções broncopulmonares em doentes com fibrose quística e pneumonias associadas à ven-tilação mecânica. A colistina é administrada através da via parentérica e da via inalatória.
Nos doentes com fibrose quística o tratamento da in-feção respiratória deve ser prescrito de acordo com o microrganismo isolado e as características do quadro clínico. A colistina é utilizada no tratamento da fibro-se quística e infeção respiratória por P. aeruginosa, na
fase de colonização crónica e na fase de exacerbação.
Na fase de colonização crónica, deve ser indicada a tera-pêutica com colistina por via inalatória, de forma contí-nua, e em casos mais graves, deve recorrer-se à terapêu-tica combinada, com alternância de dois antibióticos inalados, de entre os seguintes: colistina, tobramicina e aztreonam. Na fase de exacerbação, deve ser indicada em situações de multirresistência, através da via endo-venosa, durante um período mínimo de 2 semanas.11
Resistência à colistina
Até 2015, os mecanismos de resistência da colistina relacionavam-se com a ocorrência de mutações cro-mossómicas, ou seja, apenas se observava uma trans-missão vertical, incapaz de se disseminar para outras bactérias. O principal mecanismo de resistência cro-mossómico inclui a modificação do LPS, através da substituição dos grupos fosfato do lípido A, carrega-dos negativamente, por grupos de 4-amino-4-desoxi--L-arabinose (L-Ara4N) e fosfoetanolamina (PEtN), carregados positivamente. A síntese de L-Ara4N e PEtN é mediada por meio dos sistemas reguladores PmrA-PmrB e PhoP-PhoQ, cuja ativação é desenca-deada por mutações específicas nos próprios siste-mas ou perante a exposição a estímulos ambientais adversos, nomeadamente, a exposição a polipéptidos catiónicos antimicrobianos (CAPs), como a colistina. Estas moléculas reduzem, assim, a carga resultante do LPS e consequentemente, impedem a sua ligação à colistina, o que se traduz no desenvolvimento de re-sistência antibacteriana (Fig. 2).12
No entanto, em novembro de 2015, um estudo reali-zado na China no âmbito da avaliação da resistência antimicrobiana em isolados de E. coli provenientes de
animais produtores de alimento, documentou um rápi-do aumento da resistência à colistina nos últimos anos. Suspeitou-se que este rápido aumento da resistência fosse desencadeado por um mecanismo de resistência plasmídico, uma vez que os mecanismos cromossómi-cos dificilmente seriam os responsáveis por este au-mento tão acelerado. Deste facto, resultou a deteção de um plasmídeo, que foi totalmente sequenciado, o que permitiu identificar o gene responsável pela resistência à colistina, designado gene mcr-1.9
Mais recentemente, em junho de 2016, na Bélgica, foi efetuada uma análise a isolados de E. coli resistentes à
colistina provenientes de bezerros e suínos. O gene
mcr-1 foi detetado em 12,4% das amostras de E. coli.
Neste estudo, foram, ainda, analisadas as amostras resistentes à colistina que não apresentavam o gene
mcr-1 na sua constituição, tendo-se identificado um
novo gene de resistência, designado mcr-2.13
Figura 2 – Mecanismo de resistência à colistina. O mecanismo de resistência cromossómico mais comum é a modificação do lipopolissacarídeo. Este meca-nismo é desencadeado pela ocorrência de mutações nos sistemas reguladores ou pela exposição a estímulos ambientais adversos, culminando na ativação dos sistemas reguladores responsáveis pela síntese das moléculas 4-amino-4--desoxi-L-arabinose e fosfoetanolamina. Observa-se uma permuta dos grupos fosfato do lípido A, carregados negativamente, pelas moléculas anteriormen-te referidas, carregadas positivamenanteriormen-te. Esta substituição catiónica, traduz-se numa redução da carga negativa do lipopolissacarídeo, impedindo, assim, a interação eletrostática da colistina.
Disseminação da resistência
e consequências
Várias evidências sugerem que o principal reser-vatório do gene mcr-1 é de origem animal. A
exces-siva utilização da colistina em produção animal é apontada como a principal causa da amplificação e disseminação da resistência à colistina, que atua como uma pressão seletiva do plasmídeo portador do gene. Como consequência deste facto, a European Medicines Agency (EMA) recomendou uma redução na sua utilização em medicina veterinária, e clarificou que esta deve apenas ser utilizada com fins terapêuticos ou metafiláticos.8,14 Apesar do gene mcr-1 possuir origem animal, este, também, já foi identificado em alimentos de origem vegetal, amostras clinicas de origem humana e em amostras ambientais.14
A presença do gene mcr-1 foi detetada em
cin-co cin-continentes, mais especificamente, na Ásia, na Europa, em África, na América do Sul e na América do Norte. O gene mcr-1 tinha sido, inicialmente,
identifi-cado em E. coli, no entanto, a sua presença foi
deteta-da em diversas bactérias, nomeadeteta-damente, Enterobac-ter aerogenes, EnEnterobac-terobacEnterobac-ter cloacae, K. pneumoniae, Shigella somnei e Salmonella enterica subsp. enteri-ca serovars Anatum, Derby, 1,4,[5],12:i:2, Java, Paratyphi B, Rissen, Schwartzengrund, Typhimurium e Vir-chow.15
O gene mcr-1 possui, ainda, uma diversidade de vetores
de transmissão, sendo passível de ser transportado em
diversos tipos de plasmídeos. A presença do gene em plasmí-deos conjugativos, ou seja, com potencial de disseminação, é um dos fatores mais preocupantes, uma vez que pode ser transfe-rido através da cadeia alimen-tar para o microbiota humano e patogéneos.16 Além disso, o seu principal hospedeiro, E. coli,
é uma das espécies bacterianas mais amplamente distribuída na comunidade, estando presente no meio ambiente, nos animais e nos humanos, favorecendo, as-sim, a sua disseminação.17 Vários estudos verificaram que os plasmídeos transportadores do gene mcr-1 podem, também,
transportar genes de resistência a antibióticos beta-lactâmicos, incluindo os genes que codifi-cam beta-lactamases de largo espetro e carbapenema-ses,16 o que implica a disseminação da resistência a ou-tras importantes classes de antibióticos.
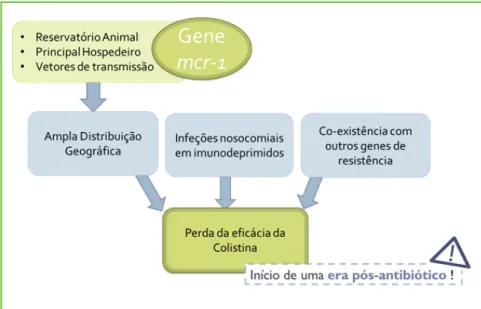
Este problema tem despertado uma enorme preocupa-ção a nível mundial, devido à possível perda de eficácia da colistina no tratamento de infeções provocadas por BGN-XDR. Aliando a elevada disseminação do gene
mcr-1 à coexistência de genes de resistência em infeções
nosocomiais graves, coloca-se a hipótese de um possível aparecimento de infeções intratáveis, desencadeando--se, assim, o início de uma era pós-antibiótico, sem alter-nativas terapêuticas (Fig. 3).17
Disseminação da resistência à colistina em Portugal
Em Portugal, o gene mcr-1 tem sido identificado em
amostras biológicas de origem animal, nomeadamente de animais produtores de alimentos, como porcos, ga-linhas e vitelos, e vários produtos alimentares, predomi-nantemente carne, mas também vegetais.18 O gene mcr-1 foi detetado em estirpes de Salmonella enterica isoladas de
alimentos de origem animal em 2011, tendo sido expe-rimentalmente comprovada a sua capacidade de disse-minação para E. coli.19 Mais recentemente, um estudo efetuado na região de Lisboa detetou o gene plasmídico
mcr-1 em estirpes de K. pneumoniae e E. coli isoladas do
tra-to intestinal de porcinos.20
Os dados divulgados pelo Centro Europeu de Prevenção e Controlo de Doenças, em novembro de 2016, permitem-nos concluir que, em 2015, em
Figura 3 – Disseminação do gene mcr-1. O facto do principal reservatório do
gene mcr-1 ser de origem animal, do seu principal hospedeiro ser E.coli e de
ter sido identificado numa diversidade de vetores de transmissão, têm sido apontados como os principais fatores responsáveis pela sua ampla distribuição geográfica. Aliando a elevada disseminação do gene mcr-1 à sua coexistência
com outros genes de resistência bacteriana, em bactérias responsáveis por infeções nosocomiais graves em indivíduos imunocomprometidos, coloca-se a hipótese da possível perda da eficácia da colistina no tratamento de infeções provocadas por bactérias Gram-negativo multirresistentes. Consequentemente, o risco do aparecimento de infeções intratáveis aumenta, desencadeando-se, assim, o início de uma era pós-antibiótico.
Portugal, se observou um aumento do número de infe-ções provocadas por K. pneumoniae resistentes a
carbape-nemos. Este agravamento contraria a situação geral na Europa em que se observou uma estabilização da resis-tência. Nestes casos, a alternativa terapêutica, é a utili-zação da última linha de tratamento, designadamente, a colistina. As evidências, anteriormente apresentadas, têm despertado uma enorme preocupação uma vez que foi, também, divulgada uma percentagem entre 1% e 5% de isolados de K. pneumoniae resistentes à terapêutica
combinada carbapenemos e colistina, em Portugal.21 Em Portugal, o isolamento de estirpes bacterianas re-sistentes à colistina em clínica humana é ainda raro. Contudo, têm vindo a ser isoladas em alguns hospi-tais, especialmente hospitais terciários, estirpes de A.
baumannii e K. pneumoniae resistentes à colistina (e a todos
os antibióticos existentes no mercado, com exceção da tigeciclina). O estudo genético efetuado aponta para re-sistência codificada a nível cromossomal, não tendo sido encontrado o gene mcr-1 em nenhumas das estirpes de K. pneumoniae estudadas (comunicação pessoal). Isso
im-plica que a disseminação da resistência é feita por pro-pagação da estirpe, e não de elementos genéticos móveis, e pode ser controlada por medidas efetivas de controlo
da infeção hospitalar. No entan-to, no final de 2017, foi reportado o gene mcr-1 numa estirpe de E. coli isolada de um doente, a quem
tinha sido administrada colistina, com capacidade de se propagar a outras espécies bacterianas.22 A importância crescente da co-listina na medicina humana, as-sociada à disseminação dos seus mecanismos de resistência, leva à necessidade de recentrar o foco da vigilância na monitorização dos microrganismos considera-dos “alerta”. Os microrganismos da família Enterobacteriaceae com
suscetibilidade intermédia ou resistência aos carbapenemos ou presumíveis produtoras de carbapenemases, P. aeruginosa e Acinetobacter spp. resistentes à
co-listina fazem parte da lista destes microrganismos. Deste modo, to-dos os laboratórios do sistema de saúde são obrigados a notificar a sua presença, num prazo máximo de 48 horas, à Direção-Geral da Saúde e ao Instituto Nacional de Saúde Doutor Ricardo Jorge. A gestão da resistência à colistina de acordo com a perspetiva deste programa é fundamental para assegu-rar ações de prevenção da disseminação da resistência à colistina.23
Conclusão
Com a realização do presente trabalho foi possível cons-tatar que a colistina passou de um antibiótico em desuso a uma molécula de enorme importância no tratamento de infeções por BGN-XDR. O paradigma da dissemina-ção muito limitada da resistência à colistina, devido à localização cromossomal dos genes de resistência, dei-xou de existir com a descoberta de genes de resistência em plasmídeos transferíveis entre diferentes estirpes e espécies bacterianas. Além disso, genes que codificam resistência a outros grupos de antibióticos, como beta--lactâmicos (incluindo carbapenemos), foram encontra-dos no mesmo plasmídeo, sugerindo que o uso de vários antibióticos pode selecionar estes plasmídeos multirre-sistentes. A importância crescente da colistina na medi-cina humana e a limitada perspetiva de novas substân-cias antimicrobianas alternativas num futuro próximo, leva à necessidade de desenvolver uma estratégia global
que vise preservar a eficácia de colistina no tratamento de infeções.8,14 Pode, assim, concluir-se que é fundamen-tal implementar ações de prevenção da disseminação da resistência ao nível da medicina humana, da medicina veterinária e do meio ambiente.
Responsabilidades Éticas
Conflitos de Interesse: Os autores declaram a
inexis-tência de conflitos de interesse na realização do presen-te trabalho.
Fontes de Financiamento: Não existiram fontes
exter-nas de financiamento para a realização deste artigo.
Ethical Disclosures
Conflicts of Interest: The authors report no conflict of
interest.
Funding Sources: No subsidies or grants contributed
to this work.
Referências
1. Loho T, Dharmayanti A. Colistin: an antibiotic and its role in multiresistant Gram-negative infections. Acta Med Indones. 2015;47:157-68.
2. Falagas ME, Kasiakou SK, Saravolatz LD. Colistin: the revival of polymyxins for the management of multidrug-resistant Gram-negative bacterial infections. Clin Infect Dis. 2005;40:1333-41. 3. Gallardo GA, Muldoon C, Becker B, Elliott AG, Lash LH, Huang JX, et al. Activity and predicted nephrotoxicity of synthetic antibiotics based on polymyxin B. J Med Chem. 2016;59:1068–77.
4. Velkov T, Thompson PE, Nation RL, Li J. Structure-activity relationships of polymyxins antibiotics. J Med Chem. 2010;53:1898-916. 5. Yahav D, Farbman L, Leibovici L, Paul M. Colistin: new lessons on an old antibiotic. Clin Microbiol Infect. 2012;18:18-29.
6. Gurjar, M. Colistin for lung infection: an update. J Intensive Care. 2015;3:1-3.
7. Michalopoulos AS, Karatza DC, Gregorakos L. Pharmacokinetic evaluation of colistin sodium. Drug Metab Toxicol. 2011;7:245-55. 8. European Medicines Agency (EMA). Updated advice on the use of colistin products in animals within the european union: development of resistance and possible impact on human and animal health. [acedido 20 julho 2017]. Disponível em: http://www.ema.europa. eu/docs/en_GB/document_library/Scientific_guideline/2016/07/ WC500211080.pdf
9. Liu YY, Wang Y, Walsh TR, Yi LX, Zhang R, Spencer J, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis. 2016;16:161-8.
10. World Health Organization. Critically important antimicrobial agents for human medicine - 3rd rev. Geneva, 2012. [acedido 15 julho 2017]. Disponível em: http://apps.who.int/iris/ bitstream/10665/77376/1/9789241504485_eng.pdf
11. Norma nº 032/2012 da Direção Geral de Saúde de 28/12/2012 atualizada a 09/06/2015. Tratamento e Seguimento da Fibrose Quística em Idade Pediátrica e no Adulto. [acedido: 2 janeiro 2018]. Disponível em: http://www.aenfermagemeasleis.pt/2015/06/09/ norma-dgs-tratamento-e-seguimento-da-fibrose-quistica-em-idade-pediatrica-e-no-adulto
12. Olaitan AO, Morand S, Rolain JM. Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria. Front Microbiol. 2014;5:643.
13. Xavier BB, Lammens C, Ruhal R, Kumar-Singh S, Malhotra-kumar S, Butaye P, et al. Identification of a novel plasmid-mediated colistin resistance gene, mcr-2, in Escherichia coli, Belgium, June 2016. Euro Surveill. 2016; 21:pii=30280.
14. Rhouma M, Beaudry F, Thériault1 W, Letellier, A. Colistin in pig production: chemistry, mechanism of antibacterial action, microbial resistance emergence, and one health perspectives. Front Microbiol. 2016;7:1-22.
15. Schwarz S, Johnson AP. Transferable resistance to colistin: a new but old threat. J Antimicrob Chemother. 2016;71:2066-70.
16. Al-Tawfiq JA, Laxminarayan R, Mendelson M. How should we respond to the emergence of plasmid-mediated colistin resistance in humans and animals? Int J Infect Dis 2017;54:77-84.
17. Nordmann P, Poirel L. Plasmid-mediated colistin resistance: an additional antibiotic resistance menace. Clin Microbiol Infect. 2016;22:308-400.
18. European Centre for Disease Control and Prevention. Plasmid-mediated colistin resistance in Enterobacteriaceae. 13 June 2016. [acedido 30 dezembro 2017]. Disponível em:https://ecdc. europa.eu/sites/portal/files/media/en/publications/Publications/ enterobacteriaceae-risk-assessment-diseases-caused-by-antimicrobial-resistant-microorganisms-europe-june-2016.pdf 19. Figueiredo R, Card RM, Nunez J, Pomba C, Mendonça N, Anjum MF, et al. Detection of a mcr-1 encoding plasmid mediating colistin resistance in Salmonella enterica from retail meat in Portugal. J Antimicrob Chemother. 2016;71:2338-40.
20. Kieffer N, Aires-de-Sousa M, Nordmann P, Poirel L. High Rate of MCR-1-Producing Escherichia coli and Klebsiella pneumoniae among Pigs, Portugal. Emerg Infect Dis. 2017 23: 2023-2029 21. European Centre for Disease Control and Prevention. Summary of the latest data on antibiotic resistance in the European Union. November 2017. [acedido 30 dezembro 2017]. Disponível em: https:// ecdc.europa.eu/sites/portal/files/documents/antibiotics-EARS-Net-summary-2016_0.pdf
22. Tacão M, Tavares RS, Teixeira P, Roxo I, Ramalheira E, Ferreira S, et al. mcr-1 and blaKPC-3 in Escherichia coli Sequence type 744 after meropenem and colistin Therapy, Portugal. Emerg Infect Dis. 2017; 23:1419-21.
23. Norma nº 004/2013 da Direção Geral de Saúde de 08/08/2013 atualizada a 13/11/2015. Vigilância Epidemiológica das Resistências aos Antimicrobianos. [acedido 2 janeiro 2018]. Disponível em: https://www.dgs.pt/upload/membro.id/ficheiros/i018609.pdf.