UNIVERSIDADE FEDERAL DE SÃO CARLOS
UNIVERSIDADE ESTADUAL PAULISTA “Júlio de Mesquita Filho” PROGRAMA INTERINSTITUCIONAL DE PÓS-GRADUAÇÃO EM
CIÊNCIAS FISIOLÓGICAS UFSCar/UNESP
CAMILA LINHARES TAXINI
A REGIÃO A5 E O CONTROLE RESPIRATÓRIO
DURANTE O DESENVOLVIMENTO
UNIVERSIDADE FEDERAL DE SÃO CARLOS
UNIVERSIDADE ESTADUAL PAULISTA “Júlio de Mesquita Filho” PROGRAMA INTERINSTITUCIONAL DE PÓS-GRADUAÇÃO EM
CIÊNCIAS FISIOLÓGICAS UFSCar/UNESP
CAMILA LINHARES TAXINI
A REGIÃO A5 E O CONTROLE RESPIRATÓRIO
DURANTE O DESENVOLVIMENTO
Araraquara 2017
Tese de Doutorado apresentada ao Programa Interinstitucional de Pós Graduação em Ciências Fisiológicas UFSCar/UNESP como parte dos requisitos para a obtenção do título de Doutor em Ciência Fisiológicas.
Orientadora: Profa. Dra. Luciane Helena Gargaglioni Batalhão
DEDICATÓRIA
AGRADECIMENTO
Agradeço a Deus por ter aberto os caminhos e me orientado nas minhas escolhas, me dando forças para seguir sempre.
Aos meus pais e minha família por nunca desistirem dos meus sonhos e por fazerem o impossível para eu chegar até aqui.
À Prof. Dra. Luciane Helena Gargaglioni Batalhão pelas oportunidades confiada a mim, e por ter acreditado em meu trabalho por tantos anos. Agradeço pela orientação, por ter me mostrado o caminho a seguir, pela amizade e por todo o suporte dentro e fora do ambiente de trabalho.
Ao Prof. Dr. Gregory Douglas Funk por ter me acolhido em seu pais e seu laboratório proporcionando experiências, profissionais e de vida, incríveis. Ter se tornado uns dos exemplos a seguir durante a vida, e também por toda paciência que teve comigo e com nosso projeto.
Ao Prof. Dr. Daniel Breseghello Zoccal pela colaboração, por ter cedido seu laboratório e o conhecimento, ter me ensinado novas técnicas e novos modos de trabalhar. Por todo o suporte durante o doutorado e pelas orientações.
À equipe do laboratório de Fisiologia Animal, à Prof. Dr. Kenia Cardoso Bícego, ao Euclides Secato, aos amigos de trabalho por ter dado toda assistência e ajuda durante os 12 anos de convivência.
Ao secretário da pós-graduação Alexandre Prata Vieira Chiva por todo auxilio e excelentes orientações no âmbito burocrático durante a pós-graduação.
A todos quem me acolheram com muito amor em Edmonton, por serem ajudadores nessa experiência incrível e longe de toda minha família.
Ao Tucaue Alvares pelos ensinamentos teóricos e técnicos, pela ajuda em fazer o projeto dar certo, pela amizade, pela ajuda antes mesmo de começas até o final com a tese.
RESUMO
O grupamento noradrenérgico A5 está localizado na ponte ventrolateral e contribui para a maturação do sistema respiratório antes do nascimento, em ratos. Esses neurônios estão conectados com a rede neural responsável pela ritmogênese respiratória, além de receber e enviar projeções de várias áreas do bulbo relacionadas com a regulação da ventilação. No presente estudo investigamos: (1) a influência da ativação dos neurônios noradrenérgicos da região A5, via receptores purinérgicos, na atividade do nervo frênico por meio de preparações in vitro; (2) a participação dos neurônios noradrenérgicos em neonatos (P7-8 e P14-15) no controle da ventilação em situações de hipóxia e hipercapnia em experimentos in vivo por meio da lesão química com anti-dopamina-beta hidroxilase saporina (Anti-DBH-Sap); (3) o envolvimento dos neurônios noradrenérgicos da região A5, na atividade do nervo frênico e simpático, durante a ativação do quimiorreflexo central e periférico em ratos juvenis na preparação in situ utilizando Anti-DBH-Sap na região A5. A ativação dos receptores purinérgicos nos neurônios noradrenérgicos da região A5 por meio da utilização de ATP (10 mM) diminuiu a atividade do frênico (C4), efeito reversível ao aplicar o antagonista purinérgico (Suramina 10 uM). Nos experimentos in vivo e in situ, a lesão dos neurônios noradrenérgicos da região A5 não promoveu alteração dos parâmetros ventilatórios em repouso, durante hipóxia e hipercapnia, porém a simpato-excitação em resposta à estimulação dos quimiorreceptores periféricos e centrais foi atenuada em ratos juvenis com neurônios da região A5 lesionados. Assim, nossos dados sugerem que o ATP atuando na região A5 reduz a atividade respiratória logo após o nascimento, via ativação de receptores purinérgicos, porém, a partir de P7 os neurônios noradrenérgicos da região A5 não participam do controle da ventilação em condições basais, ou no quimiorreflexo central e periférico. Adicionalmente, os neurônios noradrenérgicos da região A5 fazem parte dos circuitos recrutados para o processamento da resposta simpática à ativação dos quimiorreceptores periféricos e centrais em ratos juvenis não anestesiadas.
ABSTRACT
The noradrenergic group A5 is located in the ventrolateral pons and contributes to the maturation of the respiratory system before birth in rats. These neurons are connected to the neural network responsible for respiratory rhythmogenesis. In the present study, we investigated: (1) the influence of the activation of noradrenergic neurons of the A5 region, via purinergic receptors, on the phrenic nerve activity by using in vitro preparations; (2) the participation of A5 noradrenergic neurons in neonates (P7-8 and P14-15) in the control of ventilation during hypoxia and hypercapnia in in vivo experiments by using chemical lesion with anti-dopamine-beta hydroxylase saporin (Anti-DBH-Sap); (3) the involvement of noradrenergic neurons of the A5 region in phrenic and sympathetic nerve activity during the activation of central and peripheral chemoreflex in juvenile rats in in situ preparation using Anti-DBH-Sap into A5 region. Activation of purinergic receptors in noradrenergic neurons of the A5 region by ATP (10 mM) decreased phrenic activity (C4), a reversible effect by applying the purinergic antagonist (Suramin, 10 µM). In vivo and in situ experiments, lesion of the noradrenergic neurons of the A5 region did not promote alteration of resting ventilatory parameters and during hypoxia and hypercapnia, but the sympatho-excitation elicited by either the stimulation of peripheral or central chemoreceptors was attenuated in A5-lesioned rats. Thus, our data suggest that ATP acting in the A5 region reduces respiratory activity after birth, via activation of purinergic receptors. However, from P7, noradrenergic neurons of the A5 region do not participate in the control of ventilation at baseline, or at the central and peripheral chemoreflex. Additionally, the noradrenergic neurons of the A5 region are part of the circuits recruited for the processing of the sympathetic response to the activation of central and peripheral chemoreceptors in unanesthetized juvenile rats.
LISTA DE ILUSTRAÇÕES
Figura 1- Desenho esquemático da preparação in vitro ponte-bulbo- medula espinhal de ratos P0-P4...26
Figura 2 - Esquema de pletismografia de pressão utilizado para neonatos de mamíferos...30
Figura 3 - Esquema demonstrando a preparação in situ coração-tronco encefálico de ratos juvenis...34
Figura 4 - Preparação tronco-bulbo-medula espinhal para a aplicação local de agonista de receptores P2 nas células noradrenérgicas da região A5...38
Figura 5 - A influência dos receptores purinérgicos no drive inibitório durante a aplicação de ATP nos neurônios da região A5, em neonatos...39
Figura 6 - A influência dos receptores adrenérgicos e adenosinérgicos na atividade do quarto nervo cervical, em neonatos...41
Figura 7 - Efetividade da lesão química dos neurônios noradrenérgicos da região A5 em neonatos P7-8 e P14-15...43
Figura 8 - Parâmetros ventilatórios obtidos a partir do movimento da caixa torácica de neonatos, durante a exposição de 20 minutos à hipóxia (10% O2)...45
Figura 9 - Parâmetros ventilatórios obtidos a partir do movimento da caixa torácica de neonatos, durante a exposição de 20 minutos à hipercapnia (7% CO2)...47
Figura 11 - Atividade basal do nervo frênico e simpático nas preparações in situ de ratos juvenis controle e lesado...50
Figura 12 - Atividade do nervo frênico e simpático torácico nas preparações in situ de ratos juvenis controle e lesado durante a ativação do quimiorreflexo periférico...52
LISTA DE ABREVIATURAS
4V Quarto Ventrículo
A5 Região noradrenérgica na ponte ventrolateral AADC Aminoácido Aromático Descarboxilase aCSF Líquido Cérebro-espinhal artificial
ADO Adenosina
ADP Adenosina Difosfato
AMP Adenosina Monofosfato
AMS Atrofia Multi-Sistémica ANOVA Análise de Variância
Anti-DβH-SAP Saporina conjugada com anti Dopamina Beta-Hidroxilase ATP Adenosina Trifosfato
BötC Complexo Pré-Bötzinger
bpm Disparos por minutos
BVL Bulbo Ventrolateral
BVLc Bulbo Ventrolateral caudal BVLr Bulbo Ventrolateral rostral
C4 Quarto nervo Cervical
CaCl2 Cloreto de Cálcio
CEUA Comissão de Ética no Uso de Animais CIL Coluna Intermédio Lateral
CO2 Dióxido de Carbono
cpm Ciclos por minuto
DAB 3,3’ diaminobenzidina tetrahidrocloreto DBH Dopamina Beta-Hidroxilase
DPCPX 8-Ciclopentil-1,3-dipropilxantina
F Fluxômetro de entrada
F-S Fluxo de saída
fR Frequência Respiratória
gr Gramas
GRR Gerador do Ritmo Respiratório GRV Grupo Respiratório Ventral
IgG-SAP Saponina conjugada com Imunoglobulina G
im Intramuscular
ip Intraperitoneal
IX Nervo glossofaríngeo
KCl Cloreto de Potássio
KCN Cianeto de Potássio
KF Kölliker-Fuse
Kg Quilograma
KH2PO4 Fosfato Monopotássico
kHz Kilohertz
L Litros
L-DOPA 1-3, 4-diidroxifenilalanina
LC Locus coeruleus
M Molar
mg Miligrama
MgSO4 Sulfato de Magnésio
min Minutos
mL Mililitro
mm Milímetro
mM Milimolar
mmH Milímetro de mercúrio
ms Milissegundos
N2 Nitrogênio
NaCl Cloreto de Sódio NaH2PO4 Fosfato monossódico NaHCO3 Bicarbonato de Sódio
NCeA Núcleo Central da Amígdala
ng Nanogramas
nL Nanolitro
NPB Núcleo Parabraquial
NRT Núcleo Retrotrapezóide NTS Núcleo do Trato Solitário
O2 Oxigênio
P Pressão
P2Rs Receptores purinérgicos
P2Y Receptores Purinérgicos Ionotrópico P2Y Receptores Purinérgicos Metabotrópicos
PB Tampão Fosfato
PBS Tampão Fosfato-Salino
PBST Tampão Fosfato-Salino com Triton
PE Polietileno
PN Nervo Frênico
psi Libras por Polegada Quadrada
sc Subcutânea
SCP Substância Cinzenta Periaquedutal
SEM Erro padrão da média
SNC Sistema Nervoso Central
T Temperatura
TH Tirosina Hidroxilase
tSN Nervo Simpático torácico
V Nervo Trigeminal
VE VentilaçãoPulmonar
VI Nervo abducente
VII Nervo facial
VIII Nervo vestibulo-coclear
VT Volume corrente
X Nervo vago
XI Nervo acessório
XII Nervo hipoglosso
µL Microlitro
µM MicroMolar
µV MicroVolts
SUMÁRIO
INTRODUÇÃO ... 14
1.1 DESENVOLVIMENTO DO SISTEMA RESPIRATÓRIO ... 14
1.2 ONTOGENIA DA NEUROTRANSMISSÃO NORADRENÉRGICA E DA REGIÃO A5 ... 16
1.3 QUIMIORRECEPÇÃO E REGIÃO A5 ... 19
1.4 SISTEMA PURINÉRGICO ... 20
OBJETIVOS ... 23
2.1 OBJETIVO GERAL ... 23
2.2 OBJETIVOS ESPECÍFICOS ... 23
MATERIAIS E MÉTODOS ... 24
3.1 EXPERIMENTO IN VITRO, PREPARAÇÃO TRONCO ENCEFÁLICO PARA REGISTRO EXTRACELULAR DA ATIVIDADE DO NERVO C4 EM NEONATOS 24 3.1.1 ANIMAIS ... 24
3.1.2 PROCEDIMENTOS CIRÚRGICOS ... 24
3.1.3 FÁRMACOS UTILIZADOS ... 25
3.1.4 PROCEDIMENTOS EXPERIMENTAIS ... 25
3.1.5 PROTOCOLOS EXPERIMENTAIS ... 26
3.1.6 ANÁLISE HISTOLÓGICA ... 27
3.1.7 ANÁLISE DE DADOS ... 27
3.2 EXPERIMENTO IN VIVO PARA AVALIAÇÃO DA PARTICIPAÇÃO DOS NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5 NO CONTROLE RESPIRATÓRIO EM CONDIÇÕES BASAIS E DURANTE HIPERCAPNIA OU HIPÓXIA, EM NEONATOS ... 27
3.2.1 ANIMAIS ... 27
3.2.3 FÁRMACOS UTILIZADOS ... 28
3.2.4 PROCEDIMENTOS EXPERIMENTAIS ... 29
3.2.5 PROTOCOLOS EXPERIMENTAIS ... 30
3.2.6 ANÁLISE HISTOLÓGICA ... 30
3.2.7 ANÁLISE DE DADOS ... 31
3.3 EXPERIMENTO IN SITU PARA AVALIAÇÃO DA PARTICIPAÇÃO DOS NEURÔNIOS NORADRENÉRGIOS DA REGIÃO A5 SOBRE A ATIVIDADE RESPIRATÓRIA E SIMPÁTICA, EM RATOS JUVENIS, NAS CONDIÇÕES BASAIS E DURANTE HIPERCAPNIA OU HIPÓXIA. ... 32
3.3.1 ANIMAIS ... 32
3.3.2 PROCEDIMENTOS CIRÚRGICOS ... 32
3.3.3 FÁRMACOS UTILIZADOS ... 33
3.3.4 PROCEDIMENTOS EXPERIMENTAIS ... 33
3.3.5 PROTOCOLOS EXPERIMENTAIS ... 34
3.3.6 ANÁLISE HISTOLÓGICA ... 35
3.3.7 ANÁLISE DE DADOS ... 35
RESULTADOS ... 37
4.1 A PARTICIPAÇÃO DOS NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5, NO CONTROLE DA FREQUÊNCIA RESPIRATÓRIA EM NEONATOS, IN VITRO 37 4.1.1 PARTICIPAÇÃO DA REGIÃO A5 NA ATIVIDADE DO NERVO C4 VIA ATIVAÇÃO DOS RECEPTORES PURINÉRGICOS ... 37
4.1.2 PARTICIPAÇÃO DE RECEPTORES DE PURINÉRGICOS, ADENOSINÉRGICOS E ADRENÉRGICOS NA REGIÃO A5 SOBRE A ATIVIDADE RESPIRATÓRIA. ... 38
4.2 QUIMIORRECEPÇÃO CENTRAL E PERIFÉRICA EM NEONATOS, MODELO EXPERIMENTAL INVIVO ... 42
4.2.1 EFICÁCIA DAS LESÕES DOS NEURÔNIOS NORADRENÉRGICOS NA REGIÃO A5 ... 42
4.2.2 RESPOSTA DA VENTILAÇÃO EM NEONATOS DURANTE A ATIVAÇÃO DO QUIMIORREFLEXO PERIFÉRICO ... 44
4.3 A REGIÃO A5 E A QUIMIORRECEPÇÃO CENTRAL E PERIFÉRICA EM RATOS JUVENIS NA PREPARAÇÃO IN SITU ... 48
4.3.1 EFICÁCIA DAS LESÕES NORADRENÉRGICAS NA REGIÃO A5 ... 48 4.3.2 ATIVIDADE DO NERVO FRÊNICO E SIMPÁTICO DE RATOS JUVENIS EM CONDIÇÕES BASAIS ... 49 4.3.3 RESPOSTA DA ATIVIDADE DO NERVO FRÊNICO E SIMPÁTICO À
ATIVAÇÃO DE QUIMIORRECEPTORES PERIFÉRICOS ... 51 4.3.4 RESPOSTA DA ATIVIDADE DO NERVO FRÊNICO E SIMPÁTICO À
ATIVAÇÃO DE QUIMIORRECEPTORES CENTRAIS ... 53
DISCUSSÃO ... 55
5.1. NEUROTRANSMISSÃO PURINÉRGICA EM NEURÔNIOS DA REGIÃO A5 .. 55
5.2. NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5 E CONTROLE
RESPIRATÓRIO EM RATOS NEONATOS ... 57
5.3. NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5 E CONTROLE
RESPIRATÓRIO E SIMPÁTICO EM RATOS JUVENIS ... 58
REFERÊNCIAS BIBLIOGRÁFICAS ... 62
ANEXO I ... 77
ROLE OF A5 NORADRENERGIC NEURONS IN THE CHEMOREFLEX CONTROL OF RESPIRATORY AND SYMPATHETIC ACTIVITIES IN UNANESTHETIZED
14
INTRODUÇÃO
1.1 DESENVOLVIMENTO DO SISTEMA RESPIRATÓRIO
A maioria das células do sistema nervoso desenvolvem-se no período pré-natal, porém os componentes neuronais e musculares do sistema respiratório sofrem um significativo processo de maturação no período pós-natal (GREER et al., 2006). A atividade diafragmática, ou o movimento da caixa torácica registrada em humanos, começa no início do desenvolvimento fetal e consiste em uma forte atividade tônica irregular, e não só o diafragma está em atividade, mas também o musculo intercostal externo e oblíquo externo (IOFFE et al., 1987; BERGER e COOKE, 1988; COOKE e BERGER, 1988).
Em roedores, os movimentos respiratórios são detectados no 16,5o-17o dias embrionário de uma gestação de 21 dias (GREER et al. 1992; DIPASQUALE et al. 1992), embora o período de gestação em roedores seja relativamente curto, duas semanas de gestação são suficientes para que células responsáveis por controlarem a ritmogênese respiratória estejam parcialmente formadas e conectadas. A respiração fetal aumenta o débito cardíaco e o fluxo sanguíneo fetal para vários órgãos vitais como sistema nervoso central (SNC), coração e placenta (JANSEN et al., 1989), auxiliando também no desenvolvimento dos pulmões uma vez que o crescimento pulmonar fetal também depende do fluxo sanguíneo através das artérias pulmonares (KITTERMAN, 1988). Portanto, a respiração fetal pode ser um pré-requisito não apenas para o desenvolvimento normal do sistema respiratório, mas também para os demais sistemas.
15
PASQUALE et al., 1992; DI PASQUALE et al., 1994; DI PASQUALE et al., 1996; HILAIRE e DURON, 1999).
À medida que o feto desenvolve, pode ocorrer a atenuação da depressão ou o aumento da excitação da atividade respiratória (GREER et al., 2006), em roedores os movimentos respiratórios fetais aumentam 10 vezes entre o 17o e 20o dia embrionário (KOBAYASHI et al., 2001), assim como a amplitude e a duração da atividade respiratória também aumentam com a idade gestacional (GREER et al., 1996; ONIMARU e HOMMA, 2002; PAGLIARDINI et al., 2003; BALLANYI, 2004), concomitante ocorre a diminuição da variabilidade da frequência e da amplitude, tornando a atividade respiratória mais estável (GREER et al., 1992; DIPASQUALE et al., 1996; HILAIRE e DURON, 1999).
A respiração tem como principal função manter as pressões parciais de oxigênio (O2), dióxido de carbono (CO2) e o pH, no sangue, adequados para um bom funcionamento dos demais sistemas fisiológicos (HALDANE e PRIESTLEY, 1905), portanto ao nascer os neonatos têm que adaptar-se à mudanças ambientais e comportamentais da vida extrauterina. Apesar de ser funcional logo após o nascimento, a rede neural respiratória passa por um significativo processo de maturação no período pós-natal, como alterações nas propriedades eletrofisiológicas (NUNEZ-ABADES e CAMERON, 1995; IMBER et al., 2014), ajustes na ritmogênese respiratória (ONIMARU et al., 1997) e alterações funcionais e estruturais de neurotransmissores, neuromoduladores e receptores
(WONG-RILEY e LIU, 2005; GREER et al., 2006; ANJU et al., 2013; WONG-RILEY et al., 2013).
16
1.2 ONTOGENIA DA NEUROTRANSMISSÃO NORADRENÉRGICA E DA REGIÃO A5
Durante a ontogenia, os neurotransmissores e neuromoduladores sofrem síntese, degradação ou recaptação, e os receptores são expressos. A noradrenalina é um dos primeiros neuromoduladores a surgirem e tem um importante papel no desenvolvimento do SNC (THOMAS et al., 1995; CARSON e ROBERTSON, 2002; HILAIRE et al., 2004), para a maturação do sistema respiratório (BEZIN et al.,1994; LAGERCRANTZ et al., 1994), e para a modulação gerador do ritmo respiratório (ERRCHIDI et at. 1988; HILAIRE et al. 1989). Para a síntese de noradrenalina são necessárias a enzimas tirosina hidroxilase e dopamina beta-hidroxilase. Primeiramente, o aminoácido tirosina é hidroxilado convertendo-se em 1-3, 4-diidroxifenilalanina (L-DOPA) catalisada pela enzima tirosina hidroxilase (TH), e então a L-DOPA é descarboxilada em dopamina através da ação enzimática do aminoácido aromático descarboxilase (AADC). Finalmente, a dopamina é transformada em noradrenalina com auxílio da enzima dopamina beta-hidroxilase (DBH) (KAUFMAN, 1957; KEDA et al., 1967; WEMER et al., 1974, HILARIE, 2006).
Em camundongos, os primeiros neurônios noradrenérgicos aparecem no 9o e 10o dia embrionário. A sua importância é notada quando a ausência da enzima TH ocasiona a morte de camundongos no início do desenvolvimento, entre o 11o e 15o dia embrionário. A reposição de TH no 18o dia embrionário em camundongos deficientes para essa enzima não é eficaz, uma vez que 19% dos animais morrem, e os embriões sobreviventes nascem mas morrem antes do segundo dia de vida extrauterina (ZHOU et al., 1995). No 14o dia embrionário as fibras noradrenérgicas começam a distribuir-se por todo o sistema nervoso, fazendo conexões, as quais irão apresentar padrão mais estável a partir do 8o dia pós-natal (LAUDER e BLOOM 1974; LEVITT e MOORE 1979; ARAMANT et al., 1986; MARSHALL et al., 1991).
17
bulbares α1 promove excitação e ao ativar receptores adrenérgicos α2 promove inibição (ERRCHIDI, et al., 1990; HILAIRE et al., 2004).
Enquanto o ritmo respiratório é gerado por neurônios bulbares presentes no complexo Pré-Bötzinger (BötC), o grupamento respiratório pontinho é responsáveis pela modulação do padrão respiratório (FELDMAN, 1986; CORCORAN e MILSOM, 2009). O tronco encefálico contém diversos neurônios noradrenérgicos reunidos em vários núcleos interconectando núcleos bulbares com núcleos pontínos, entre eles estão os neurônios da região A5, um grupamento de neurônios noradrenérgicos localizada na ponte ventrolateral, entre a raiz do nervo facial e o núcleo olivar caudal superior (BYRUM e GUYENET, 1987; JANSEN et al., 1995).
No 20o dia gestacional, os neurônios da região A5 promovem a modulação inibitória no ritmo respiratório (DI PASQUALE et al., 1992; VIEMARI et al., 2003; VIEMARI et al., 2005). Durante o parto e nos primeiros minutos da vida extrauterina, várias mudanças drásticas ocorrem nos sistemas nociceptivo, quimiossensível, pulmonar e cardiovascular, sendo neste período a possível contribuição da região A5 para adaptar o ritmo respiratório à estas alterações (HILAIRE, et al., 2004). Nos primeiros minutos de vida extrauterina, os neonatos respiram 1-2 vezes por minuto através da respiração bucal profunda (VIEMARI et al., 2003, 2004) e em seguida, esse suspiro é substituído por uma respiração nasal normal (LIESKE et al., 2000). Fortes evidências sugerem que a alteração da respiração bucal para a nasal depende de projeções trigeminais provenientes da cavidade nasal, as quais inibem a região A5 (PANNETON 1990; PANNETON et al., 2000; CAOUS et al., 2001), portanto com a inibição do drive inibitório gerado pela região A5 o gerador do ritmo respiratório (GRR) torna-se ativo (VIEMARI et al., 2004).
18
ERRCHIDI et al., 1990, 1991; VIEMARI et al., 2003; HILAIRE et al., 2004), contudo, outros neurônios podem estar envolvidos na modulação inibitória da região A5, uma vez que há projeções dos neurônios noradrenérgicos da região A5 para o núcleo do trato solitário (NTS), bulbo ventrolateral caudal (BVLc), grupo respiratório ventral, e para os neurônios pré-motores respiratórios bulbo-espinhal (GUYENET et al., 1993; DOBBINS e FELDMAN, 1994).
Em animais adultos, os neurônios noradrenérgicos da região A5 enviam projeções diretas para a medula espinhal e também para áreas bulbares envolvidas com o controle cardiorrespiratório (BYRUM e GUYENET, 1987; JANSEN et al., 1995; MAIOROV et al., 2000). Marcação retrógrada e anterógrada da região A5 revelou projeções hipotalâmicas provenientes da área perifornical e núcleo paraventricular, como também do Kölliker-Fuse (KF), núcleo parabraquial (NPB), NTS caudal e intermediário, e de formações reticulares bulbar ventral como A1 e B1. Suas projeções estendem-se para o núcleo central da amígdala (NCeA), área perifornical do hipotálamo, substância cinzenta periaquedutal (SCP), parabraquial, NTS, núcleo paraventricular do tálamo, leito dos núcleos das estrias terminais, áreas hipotalâmicas dorsais, formação reticular ventrolateral do bulbo e para a coluna intermédio lateral (CIL) (BYRUM e GUYENET , 1987; GUYENET, 1991; GUYENET et al., 1993). Estudos recentes apontam que embora as conexões existam os neurônios da região A5 não participam do controle cardiorrespiratório basal em ratos adultos (TAXINI et al., 2011; TAXINI et al., 2017).
19
1.3 QUIMIORRECEPÇÃO E REGIÃO A5
Após o nascimento, existe um período crítico (CARROLL, 2003), as duas primeiras semanas pós-natais são as mais críticas (HENNING, 1981), no qual qualquer perturbação poderá interromper seriamente o desenvolvimento do animal. Dentre as possíveis perturbações as quais os neonatos podem sofrer estão a hipóxia (aguda, crônica ou intermitente), hiperóxia e hipercapnia. Ratos neonatos com 10-25 dias de vida extrauterina expostos à hipóxia intermitente apresentam prejuízo na aprendizagem espacial e hiperatividade motora quando jovens (ROW et al., 2002), a exposição de ratos à hiperóxia nas duas primeiras semanas pós-natais resulta em animais adultos com respostas ventilatórias e atividade do nervo frênico atenuadas (BAVIS et al., 2002; BISGARD et al., 2003), portanto, além das respostas imediatas alteradas, as perturbações podem influenciar outros comportamentos futuros.
Em ratos, a sensibilidade dos quimiorreceptores carotídeos à hipóxia imediatamente após o nascimento é mínima, a sensibilidade ao O2 aumenta progressivamente durante as duas primeiras semanas pós-natais, período no qual ocorre também a maturação dos nervos do seio carotídeo, maduros no 8o dia pós-natal (KHOLWADWALA e DONNELLY, 1992, BAMFORD et al., 1999, WASICKO et al., 1999). Já a resposta hipercápnica está bem desenvolvida no nascimento (BELEGU et al., 1999), contudo, a sensibilidade ao CO2 diminui progressivamente até o 8o dia pós-natal, chegando ao seu grau mínimo de sensibilidade, quando a partir deste ponto a sensibilidade aumenta novamente e mantém-se até a vida adulta (STUNDEN et al., 2001). Portanto, em ratos a janela crítica da sensibilidade à hipóxia ocorre desde o nascimento até o 8o pós-natal, enquanto da hipercapnia ocorre entre o 8o e 10o dia pós-natal.
Além de estarem conectados com neurônios relacionados ao sistema cardiorrespiratório, os neurônios da região A5 conectam-se com neurônios pré-motores respiratórios bulbo-espinhal, neurônios do grupo respiratório ventral (GRV), núcleo retrotrapezóide (NRT), Locus coeruleus (LC), KF, PB e participam das respostas quimiorreflexas à hipóxia e hipercapnia (GUYENET et al., 1993; DOBBINS e FELDMAN, 1994; COLES e DICK, 1996; SOULIER et al., 1997; ROUX et al., 2000; PEYRONNET et al., 2000; GAYTAN et al., 2002).
20
de todo o tronco encefálico, onde 78% dos neurônios noradrenérgicos da região A5 foram lesados, atenua a resposta ventilatória à hipercapnia (LI e NATTIE, 2006), contudo, quando apenas os neurônios noradrenérgicos da região A5 são lesados, a atenuação da ventilação em resposta à hipercapnia desapareceu, indicando que na modulação das respostas ventilatórias pode ser regida por outros núcleos noradrenérgicos da ponte, e a região A5 pode estar envolvida em outras respostas fisiológicas que não a ventilatória (TAXINI et al., 2017). Sob o efeito de anestesia, a região A5 participa do aumento da atividade do nervo frênico e das variáveis cardiovasculares, como no aumento da pressão arterial e atividade simpática, em resposta ao estímulo dos quimiorreceptores centrais em ratos adultos, (TAXINI et al., 2011).
A utilização da proteína Fos como indicador de ativação neuronal indica a participação dos neurônios da região A5 na resposta à hipóxia (ERICKSON e MILLHORN, 1994), adicionalmente, a secção do nervo do seio carotídeo diminui mas não elimina a atividade dos desses neurônios, sugerindo que os neurônios da região A5 podem ser inerentemente sensíveis à hipóxia (GUYENET et al., 1993). Interessantemente, quando ratos adultos são submetidos à hipóxia aguda, as respostas respiratórias não são alteradas após a eliminação dos neurônios noradrenérgicos da região A5 (KOSHIYA e GUYENET, 1994; TAXINI et al., 2011; TAXINI et al., 2017). Adicionalmente, a lesão de neurônios da região A5 não altera a simpato-excitação promovida pela hipóxia, em ratos adultos anestesiados (TAXINI et al., 2011).
1.4 SISTEMA PURINÉRGICO
A sinalização purinérgica foi proposta por Burnstock (1972) ao utilizar nucleotídeos de purina e nucleosídeos como mensageiros extracelulares, porém, o primeiro registro da liberação de adenosina trifosfato (ATP) como neurotransmissor ocorreu com a estimulação com marcação antidrômica de nervos sensoriais em coelhos (HOLTON, 1959).
O ATP pode modular ações fisiológicas por meio da ativação dos receptores purinérgicos P2 (BURNSTOCK, 1997), sendo esses metabotrópicos (P2Y) e ionotrópico (P2X), os quais estão distribuídos em diferentes regiões do encéfalo, tanto nos neurônios quanto em células da glia, no sistema nervoso periférico e central (BURNSTOCK, 1993, 1997).
21
formam canais seletivos para cátions (Na+, K+ e Ca2+) os quais dividem-se em sete subunidades (P2X1-P2X7) (NORTH, 2002; FIELDS e BURNSTOCK, 2006; NORTH e VERKHRATSKY, 2006).
Os receptores purinérgicos são expressos no SNC durante o início do desenvolvimento fetal e estão envolvidos na comunicação entre os neurônios, inclusive no tronco encefálico, sendo importantes no controle respiratório dos mamíferos (RALEVIC e BURNSTOCK, 1998, BURNSTOCK e KNIGHT, 2004, ILLES e RIBEIRO, 2004, BURNSTOCK, 2006; HUXTABLE et al., 2009). O ATP começa a atuar no gerador do ritmo respiratório de ratos entre o 19o-21o dia embrionário permanecendo até os quatros primeiros dias pós-natal, após esse período há um aumento no desenvolvimento da atividade das enzimas ectonucleotidases as quais degradarão mais rapidamente a molécula de ATP (HUXTABLE et al., 2009). As ectonucleotidases metabolizam a molécula de ATP em adenosina difosfato (ADP), adenosina monofosfato (AMP) e adenosina (ADO) (ZIMMERMANN, 2006; ROBSON et al., 2006; ABBRACCHIO et al., 2009; FUNK, 2013).
O ATP atua como neurotransmissor em áreas envolvidas no controle da ventilação (THOMAS e SPYER, 2000; THOMAS et al., 2001; GOURINE et al., 2002, 2005; ANTUNES et al., 2005; FUNK, 2010), incluindo o NTS e BVL, promovendo mudanças na frequência e na amplitude respiratória (THOMAS et al., 2001; GOURINE et al., 2003; GOURINE et al., 2005b; LORIER et al.,
2007; DOI e RAMIREZ, 2008). Os neurônios do tronco encefálicos, neurônios ritmogênicos do BötC
e motoneurônios respiratórios expressam receptores purinérgicos (P2Rs) e também são sensíveis à sua ativação (FUNK et al., 1997; MILES et al., 2002; LORIER et al., 2004, 2007, 2008).
Os receptores P2X3 estão amplamente presentes no tronco encefálico (KANJHAN et al., 1999; GOURINE et al., 2003; FIELDS e BURNSTOCK, 2006), e a ativação dos receptores P2X provocam a liberação de vários neurotransmissores, incluindo noradrenalina (BURNSTOCK e SNEDDON, 1985; NIEBER et al., 1997). O ATP pode ter um efeito duplo na liberação de noradrenalina, efeito facilitatório via ativação de receptores pré-sinápticos P2X ou efeito depressor via ativação de receptores pré-sinápticos P2Y (BOEHM, 1999).
22
23
OBJETIVOS
2.1 OBJETIVO GERAL
Entender a contribuição dos neurônios noradrenérgicos da região A5 no início da vida extrauterina e em ratos jovens.
2.2 OBJETIVOS ESPECÍFICOS
I) Averiguar a resposta da atividade respiratória após a ativação dos receptores purinérgicos da região A5 (P0-4);
II) Entender a participação dos neurônios noradrenérgicos de neonatos (P7-P8 e P14-P15) na ventilação em condições basais, e em resposta ao estímulo do quimiorreflexo central e periférico;
24
MATERIAIS E MÉTODOS
3.1 EXPERIMENTO IN VITRO, PREPARAÇÃO TRONCO ENCEFÁLICO PARA
REGISTRO EXTRACELULAR DA ATIVIDADE DO NERVO C4 EM NEONATOS
3.1.1 ANIMAIS
Todos os procedimentos experimentais foram aprovados pelo Comitê de Bem-Estar Animal da Faculdade de Medicina da Universidade de Alberta, Canadá. Todos procedimentos in vitro foram realizados de acordo com as diretrizes para cuidado, manuseio e tratamento de animais experimentais (Protocolos AUP255 e AUP256) no laboratório do Professor Dr. Gregory Douglas Funk. Foram utilizados Sprague–Dawley neonatos (P0-P2).
3.1.2 PROCEDIMENTOS CIRÚRGICOS
25
3.1.3 FÁRMACOS UTILIZADOS
Nas microinjeções na região A5 foi utilizado ATP (10 mM). No banho foi aplicado antagonistas adenosinérgicos seletivos para receptores A1 (8-Ciclopentil-1,3-dipropilxantina, DPCPX, 0,5 µM, Sigma), antagonista de receptores adrenérgicos α2 Idazoxano (100 µM, Tocris Bioscience, Ellisville, MO, USA), ou antagonista não seletivo de receptores P2X e P2Y Suramina (100 µM, Sigma).
3.1.4 PROCEDIMENTOS EXPERIMENTAIS
As microinjeções na superfície ventral da ponte na região A5 foram realizados com microesferas fluorescentes (1:200) através de pipetas de três vias (5 µm de diâmetro externo na ponta da pipeta feito através de capilares de vidro borossilicato - World Precision Instruments, Sarasota, FL). As pipetas de microinjeções foram conectadas à um microinjetor de pressão do modelo Spritzer 4 (Bioscience Tools, USA), as aplicações foram programadas e controladas à pressão de 10-20 psi (Master-8, AMPI Instruments, Jerusalém, Israel). A atividade relacionada com a inspiração foi obtida a partir de extremidades das raízes do nervo C4 utilizando elétrodos de sucção de vidro (80-120 µm de diâmetro) (Fig. 1). Os sinais foram amplificados, filtrados (band-pass 300 Hz a 1 kHz, AM Systems, Carlsborg), retificado e integrados utilizando um integrador (τ = 25 ou 50 ms), e exibido em um monitor de computador utilizando o software AxoScope 9.2 (pCLAMP Suite, Molecular Devices, Sunnyvale, CA, EUA). Os dados foram salvos no computador usando uma placa Digidata 1322 A/D (Molecular Devices) e software AxoScope para análise off-line. A frequência e a amplitude foram calculadas antes e após cada tratamento.
26
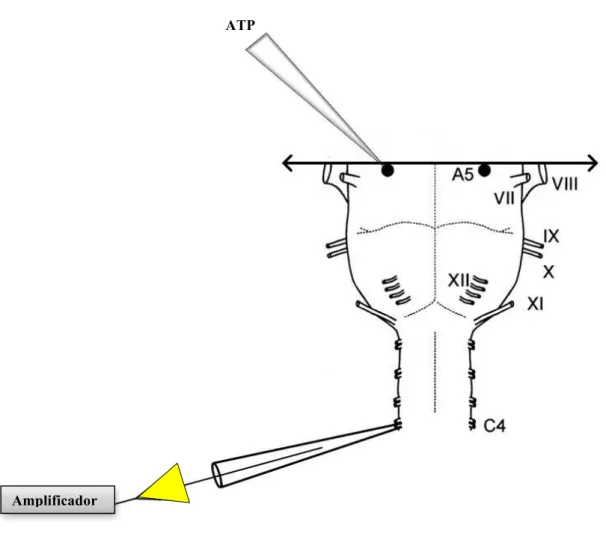
Figura 1: Desenho esquemático da preparação in vitro ponte-bulbo- medula espinhal de ratos P0-P4. O ATP foi injetado
na região A5 através da pipeta vidro, representada na parte superior da imagem. Na parte inferior da imagem, o eletrodo de sucção no nervo C4 para obtenção a atividade respiratória. O eletrodo de sucção é conectado ao amplificador. Legenda: Nervos V, trigeminal; VI, abducente; VII, facial; VIII, vestibulo-coclear; IX, glossofaríngeo; X, vago; XI, acessório; XII, hipoglosso; C4, frênico (quarta raiz ventral cervical). Fonte: Modificado de Viemari e colaboradores (2004).
3.1.5 PROTOCOLOS EXPERIMENTAIS
Os protocolos experimentais consistiram em registros basais, e após a aplicação de ATP (10mM) na região A5. Após 5 minutos da aplicação de ATP (10 mM) na região A5, o DPCPX (0,5µM), Idazoxano, (10 µM), ou Suramina (100 µM) foram aplicados no banho de aCSF. Então esperou-se 15 minutos para que todo o circuito fosse banhado com o antagonista ou agonista circulante para uma nova injeção de ATP na região A5. Após os registros, o sistema foi totalmente lavado com uma nova solução de aCSF, esperou-se então até que o registro voltasse ao basal para uma última aplicação do ATP após a recuperação (FUNK et al., 1997; HUXTABLE et al.,2010).
ATP
27
3.1.6 ANÁLISE HISTOLÓGICA
A preparação ponte-bulbo-medula espinhal foi fixada em uma base e cortada no criostato a 100µm, foram feitas fatias (slices) da ponte com a região A5. As referências anatômicas utilizadas foram o quarto ventrículo e a marcação do nervo facial (ANDRADE e AGHAJANIAN, 1982; BYRUM et al., 1984; BYRUM e GUYENET, 1987; TAXINI et al., 2011). Os cortes foram colocados nas lâminas e cobertos com lamínulas para verificação da localização da microinjeção.
3.1.7 ANÁLISE DE DADOS
Os dados foram avaliados off-line usando pCLAMP 9,2 (Clampfit) e Microsoft Excel. Os parâmetros estão relatados em termos absolutos ou relativos aos controles (pré e pós fármaco). Os valores estão apresentados dados com a média ± erro padrão da média (EPM).
Comparações entre os grupos no decorrer do tempo a análise de variância (ANOVA) foi utilizado em conjunto com a correção de Bonferroni para comparações múltiplas ou teste post hoc Newman-Keuls (Prisma 4.2, Software GraphPad, San Diego, CA, EUA) para comparar três ou mais grupos. Valores de P inferiores a 0,05 foram consideradas significativos.
3.2 EXPERIMENTO IN VIVO PARA AVALIAÇÃO DA PARTICIPAÇÃO DOS
NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5 NO CONTROLE RESPIRATÓRIO EM CONDIÇÕES BASAIS E DURANTE HIPERCAPNIA OU HIPÓXIA, EM NEONATOS
3.2.1 ANIMAIS
Foi utilizado ratos Wistar neonatos (P0-P15). Os protocolos foram aprovados pela Comissão de Ética no Uso de Animais (CEUA, Protocolo 7.609/16) e foram realizados de acordo com os Princípios Éticos de Experimentação Animal da Faculdade de Ciências Agrárias e Veter
inárias, no laboratório da professora Dra Luciane Helena Gargaglioni Batalhão.
28
3.2.2 PROCEDIMENTOS CIRÚRGICOS
Inicialmente, os animais foram induzidos à anestesia com isoflurano 5% (BioChimico® - RJ) e fixados em um estereotáxico (Kopf Instruments, Tujunga, Ca., EUA) com barras auriculares e inserção nasal adaptados para neonatos. O anestésico inalatório (isoflurano à 1%) e uma manta térmica (38°C) foram mantidos durante todo o procedimento cirúrgico (Bonther equipamentos – Ribeirão Preto, SP).
A pele do animal foi esterilizada para a aplicação da anestesia local vasoconstritora (lidocaína 2%, 0,1 mL, subcutânea, sc), e posterior secção. Uma seringa Hamilton (5 µL) com uma agulha (Mizzy, 200 µm de diâmetro externo) foi conectada à um tubo de polietileno PE-10 seguido de uma agulha gengival inoxidável 30G para a realização das microinjeções na região A5. As coordenadas utilizadas como parâmetros foram adaptadas de Paxinos e Watson (1998) após testes prévios com injeções de corante cresil violeta para cada idade estudada, utilizando estruturas anatômicas como referências. A cânula de microinjeção foi posicionada na região da sutura Lambda, e deslocada 1,3 mm ou 1,4 mm lateral da linha média e 3,9 mm ou 4,5 mm abaixo da superfície encefálica, respectivamente para P0-P1 e P7-P8. Os animais receberam 25 nL ou 40 nL de IgG-SAP (30% em solução tampão fosfato, PB, 0,01M, pH 7,4) para controle, ou anti-DBH-SAP (4,2 ng/100 nL) para lesão química dos neurônios noradrenérgicos, bilateralmente na região A5, para as idades P0-1 e P7-8 respectivamente (SCHREIHOFER e GUYENET, 2000; MADDEN e SVED, 2003; TAXINI et al., 2011). Para maior precisão, a microinjeção foi realizada por uma bomba de microinjeção (modelo 310, Stoelting Co., Il, EUA), ao longo de 2 minutos para minimizar a difusão da droga. Ao final, a incisão foi fechada com cola cirúrgica (Dermabond® Topical Skin Adhesive, Johnson & Johnson, Brasil). Foi administrado antibiótico enrofloxacina (10 mg/Kg, intramuscular, im, Mantecorp Ind. Quím. E Farm. Ltda, Rio de Janeiro- RJ) e analgésico flunixina meglumina 2,5 mg/Kg, sc, Ind. Quím. E Farmacêutica Schering-Plough S/A, Rio de Janeiro- RJ). Após a total recuperação o animal foi levado novamente para junto da mãe, e então acompanhado até o sétimo dia conseguinte.
3.2.3 FÁRMACOS UTILIZADOS
29
em solução PB, 0,01M, pH 7,4) para a lesão fictícia. A toxina anti-DBH-SAP é altamente específica para lesionar neurônios noradrenérgicos, pois liga-se as células que expressam a enzima dopamina beta-hidroxilase.
3.2.4 PROCEDIMENTOS EXPERIMENTAIS
A medida da ventilação pulmonar (VE) foi calculada indiretamente pelo método de pletismografia de pressão (MORTOLA, 1984; CUMMINGS et al., 2011; MORTOLA e FRAPPELL, 2013), a qual consiste em uma câmara de 0,22 L e 0,50 L para P7-8 e P14-15, respectivamente, onde o corpo do animal ficou acondicionado. O movimento da caixa torácica do animal foi registrado através de um sinal de pressão, o qual é diretamente proporcional ao volume corrente (VT). Para o sinal da pressão ser calibrado para VT foi injetado na câmara um volume conhecido, 0,2 mL e 0,4 mL para P7-8 e P14-15 respectivamente, portanto o sinal em Volts foi convertido em mL nas análises posteriores. A frequência respiratória (fR) também foi quantificada, e a partir do VT e fR obteve-se o valor da ventilação (VE), o qual foi normalizado com o peso de cada animal. Os sinais de um transdutor de pressão (TSD 160A, Biopac Systems, Santa Barbara, CA) foi coletado por um pré-amplificador (DA 100C, Biopac Systems) passando por um conversor analógico-digital. A aquisição de dados fez-se pelo software AcqKnowledge MP150 (BioPac Systems, Inc., Santa Barbara, CA, EUA), em uma frequência de amostragem de 200 Hz.
Um plástico filme (Parafilm®) com um orifício para separar a cabeça do neonato foi utilizado para vedar, juntamente com resina epóxi, a câmama posterior da câmara anterior. A câmara anterior de plástico resistente (30 mL), acoplada hermeticamente ao sistema de pletismografia de pressão, possui entrada para o ar ambiente ou para as misturas gasosas (hipercápnicas e hipóxicas) e uma saída. A entrada e a saída do fluxo de ar foram controladas por um fluxômetro acoplado à câmara anterior. A mistura gasosa para hipercapnia consistia em 7% CO2, 21% O2 em N2 balanço, e para o protocolo de hipóxia foi utilizado uma mistura hipóxica de 10 % O2 em N2 balanço, adquiridas da White Martins Gases Industriais Ltda (Osasco, SP) (Fig. 2).
30
para a realização dos experimentos é adaptada de acordo com a idade dos animais, 32ºC para P6-P7 e 30ºC para P14-P15 (JULIEN et al., 2008).
Figura 2: Esquema de pletismografia de pressão utilizado para neonatos de mamíferos. Legenda: P, pressão; T, temperatura da câmara; F, fluxômetro de entrada; F-S, fluxo de saída. Fonte: adaptado de Mortola e Frappel (2013).
3.2.5 PROTOCOLOS EXPERIMENTAIS
Com animal acomodado na câmara posterior, foi realizado o procedimento para separar as câmaras, e então a câmara anterior foi encaixada e vedada. A câmara anterior foi inicialmente ventilada com ar atmosférico (21% O2) por um período de aclimatação de no mínimo 15 minutos (min). Medidas do movimento da caixa torácica foram realizadas durante todo o experimento. Primeiramente foram realizadas medidas de ventilação durante normocapnia por 15 min, com fluxo contínuo. Em seguida, os animais foram submetidos à hipercapnia por 20 min. Após a hipercapnia, a câmara foi ventilada com ar atmosférico por 30 min. para recuperação dos valores basais de ventilação. Posteriormente o animal foi submetido à hipóxia por 20 min, seguida por um período de normocapnia de 15 min para recuperação. A ordem de exposição a hipercapnia e hipóxia foi feita randomicamente.
3.2.6 ANÁLISE HISTOLÓGICA
31
paraformoldeído 4% em PB. Os encéfalos foram cuidadosamente removidos da caixa craniana e armazenados no mesmo fixador à 4° C por 24 horas, posteriormente mantidos em solução de sacarose 30% (dissolvida em PB 0,01 M, pH 7,4) à 4° C por 48 horas. O tecido então foi imerso em isopentano resfriado (Sigma), congelando-se. O tecido congelado foi embebido em Tissue Tek O.C.T., e cortado no criostato (Leica CM 1850) à 30 µm. Os cortes foram lavados em PBS e incubado em uma solução de recuperação Antigênica (Target Retrieval Solution, S1700, Dako, Califórnia) por 30 min. em banho maria à 70oC. Os cortes foram montados em lâminas gelatinizadas, e em seguida para verificar a localização e a efetividade da lesão, foi realizado a imunorreatividade para a enzima TH (XU et al., 2003, TAXINI et al., 2011; TAXINI et al., 2017).
Para este fim, os cortes foram lavados 3 vezes com PBS, e após as lavagens incubados com soro normal de cavalo 5% em PBS com 0,3% de triton (PBST), por 1 hora. Em seguida, os cortes foram incubados por 24 horas com anticorpo primário (monoclonal anti-TH feito em camundongo, 1:10000, SIGMA) diluído em PBST (20%). No dia seguinte, os cortes foram lavados 3 vezes com PBS, e então foram incubados por 24 horas com anticorpo secundário biotinilado feito em coelho, anti-camundongo IgG (1:1000, Dako Cytomation, Dinamarca, Europa) diluído em PBST (20%). Finalmente, os cortes foram lavados 3 vezes com PBS e incubados em um complexo avidina-DH biotinilada peroxidase (código PK-4001, Vector Laboratories, Burlingame, CA, USA) por 1 hora em à temperatura ambiente. Após 3 lavagens em PBS, a marcação dos neurônios catecolaminérgicos foi visualizada com solução tampão adicionada com 0,05% de 3,3’ diaminobenzidina tetrahidrocloreto (DAB) e 0,004% de peroxido de hidrogênio em água destilada por 5 minutos, seguido de 3 lavagens rápidas em PBS. Todas incubações foram feitas à temperatura ambiente (22oC). Após secarem, os cortes foram desidratados através de concentrações graduais de álcool, diafanizados com xilol e cobertos com lamínula.
3.2.7 ANÁLISE DE DADOS
32
Todas as análises dos parâmetros ventilatórios foram realizadas a cada 5 min. VT foi analisado através da pressão exercida pela caixa torácica do neonato, a fR foi quantificada pelos números de eventos respiratório por minuto, utilizando o software AcqKnowledge MP150. A VE foi obtida pelo produto do VT e fR, normalizado pelo peso do animal.
Os valores foram expressos como média ± EPM. A eficácia das lesões foi analisada utilizando o teste t de Student não pareado. Alterações na ventilação foram avaliadas por análise de variância (ANOVA) para medidas repetidas, seguida pelo teste de múltiplas comparações de Tukey-Kramer. A análise estatística foi realizada utilizando SigmaStat (Systat Software, Point Richmond, CA. EUA), considerando P <0,05 como significativamente diferente. Os gráficos foram gerados usando Prism (GraphPad, La Jolla, EUA).
3.3 EXPERIMENTO IN SITU PARA AVALIAÇÃO DA PARTICIPAÇÃO DOS
NEURÔNIOS NORADRENÉRGIOS DA REGIÃO A5 SOBRE A ATIVIDADE
RESPIRATÓRIA E SIMPÁTICA, EM RATOS JUVENIS, NAS CONDIÇÕES BASAIS E DURANTE HIPERCAPNIA OU HIPÓXIA.
3.3.1 ANIMAIS
Experimentos in situ foram realizados em ratos machos Holtzman juvenis (75-80 gr). Os protocolos foram realizados de acordo com os Princípios Éticos de Experimentação Animal da Faculdade de Odontologia de Araraquara (Protocolo: 18/2014), no laboratório do Professor Dr. Daniel Breseguelho Zoccal. Os animais receberam alimento e água ad libitum, mantidos em condições de temperatura (22 ± 1o C) e umidade (50-55%) controladas, ciclo claro/escuro de 12/12h.
3.3.2 PROCEDIMENTOS CIRÚRGICOS
33
Paxinos e Watson (1998): 0,8 mm caudal ao lambda, 1,5 mm lateral à linha média e 9,0 mm abaixo da superfície óssea. O volume microinjetado foi de 50 nL/lado, realizado lentamente (durante 2 min.) para minimizar a difusão do fármaco ou lesão tecidual. Após as injeções, os tecidos foram suturados, foi administrado antibiótico (enrofloxacina, 10 mg/kg, im) e analgésico (flunixinmeglumina, 2,5 mg/kg, sc), e foram monitorados até recuperar a consciência. Os animais receberam água e alimento
ad libitum por um período de sete dias para recuperação e ação da toxina (TAXINI et al., 2011).
3.3.3 FÁRMACOS UTILIZADOS
Os fármacos utilizados seguem o protocolo 3.2.3, IgG-SAP (lesão fictícia, grupo controle) ou com anti-DBH-SAP (lesão química, grupo lesionado, Advanced Targeting Systems, San Diego, CA) (TAXINI et al., 2011).
3.3.4 PROCEDIMENTOS EXPERIMENTAIS
A preparação coração-tronco encefálico (PATON, 1996) foi realizada uma semana após as microinjeções na região A5, conforme descrito anteriormente por Zoccal e colaboradores (2008). O animal foi anestesiado profundamente com halotano (AstraZeneca, Cotia, SP, Brasil) até a perda do reflexo de retirada da pata, a transecção foi realizada caudalmente ao diafragma com o animal submerso em solução gelada de Ringer (125 mM NaCl, 24 mM NaHCO3, 3 mM KCl, 2,5 mM CaCl2, 1,25 mM MgSO4, 1,25 mM KH2PO4, 10 mM dextrose), e descerebrado a nível precolicular. Os pulmões foram removidos, e então, a preparação foi transferida para uma câmara de registro.
T10-34
T12 foram isolados e suas atividades foram registradas usando eletrodo de sucção de vidro bipolar mantido no micromanipulador (Narishige, Tóquio, Japão) (Fig. 5).
Os sinais foram amplificados, passados pela banda de passagem do sistema de filtros (0,1-3 kHz, Grass Technologies, Middleton, EUA) e adquiridos através de um conversor analógico/digital (CED 1401, Cambridge Electronic Design, Cambridge, Reino Unido) à um computador usando o software Spike2 (Versão 7, Cambridge Electronic Design, Cambridge, RU) a uma taxa de amostragem de 5 KHz. Os registros foram realizados em unidades absolutas (µV). No final dos experimentos, a bomba de perfusão foi desligada para determinar o ruído elétrico (após a morte da preparação).
Figura 3: Esquema demonstrando a preparação in situ coração-tronco encefálico de ratos juvenis. Legenda: KCN,
Cianeto de potássio. Fonte: Modificado de Zoccal e colaboradores (2009).
3.3.5 PROTOCOLOS EXPERIMENTAIS
Após um período de estabilização de 20-30 min., as atividades basais do nervo frênico e simpático foram registadas durante 15 min., para o registro basal. Em seguida, os quimiorreceptores periféricos foram estimulados com cianeto de potássio (KCN), ou os quimiorreceptores centrais com 7 ou 10% CO2, conforme descrito por Costa-Silva e colaboradores (2010) e Molkov e colaboradores (2011). Injetou-se KCN (0,05%) intra arterial (50 µL) enquanto
Amplificador
Ralo
Eletrodo de sucção
Amplificador
Nervo Motor Abdominal
Transdutor de pressão
Pressão de perfusão
Bomba de infusão Filtro
Troca de calor Papa bolhas
Amplificador
5% CO2
95% O2
KCN
Aorta Nervo Simpático
Torácico
35
que a hipercapnia foi obtida borbulhando no perfusato a 7% ou 10% de CO2 (equilibrado em O2) durante 5 minutos. Os testes foram realizados aleatoriamente com um intervalo de tempo de pelo menos 10 minutos entre estímulos consecutivos. Após o término dos protocolos experimentais, os animais foram perfundidos através do ventrículo esquerdo (corte no átrio direito) com PBS (0,01 M, pH de 7,4), seguido por paraformaldeído 4 % em PB. Assim como o protocolo 3.2.5, os encéfalos foram cuidadosamente removidos e armazenados em paraformaldeido 4% à 4° C por 24 horas, e posteriormente mantidos em solução de sacarose 30% dissolvida em PB (0,01 M, pH 7,4) à 4° C por 48 horas.
3.3.6 ANÁLISE HISTOLÓGICA
Os encéfalos foram cortados no criostato à 30 µm e lavados em PBS. Semelhante ao protocolo 3.2.6, a localização e efetividade da lesão foi obtida através da imunorreatividade para TH (XU et al., 2003; TAXINI et al., 2011; TAXINI et al., 2017), porém foi utilizado o pelo método free floating para o procedimento imunoistoquímico, onde os cortes ficam submersos nas soluções .
Inicialmente os cortes foram lavados 3 vezes em PBS e incubados por 48 horas com anticorpo policlonal de camundongo anti-TH (1:10.000, Chemicon, Temecula). O anticorpo primário foi detectado após a incubação com anticorpo secundário biotinilado (donkey anti-mouse 1:1000, Jackson) complexado com avidina-DH peroxidase biotinilada (código PK-4001, Vector Laboratories, Burlingame, CA, USA) por 1 hora à temperatura ambiente. Após 3 lavagens com PBS, o complexo foi revelado pela adição DAB e 0,004% de peroxido de hidrogênio em água destilada (WANG e GUYENET, 2002; KANG et al., 2007). Os cortes passaram por PBS para retirar o excesso de DAB e após secos foram desidratados através de concentrações graduais de álcool, diafanizados com xilol e cobertos com lamínula.
3.3.7 ANÁLISE DE DADOS
36
As análises foram realizadas em sinais retificados e filtrados (constante de tempo de 50 ms) realizados off-line através do software Spike 2 (CED, Cambridge, Reino Unido) após a eliminação do ruído. A atividade do nervo frênico e simpático foi avaliada pela frequência e amplitude do seu disparo. A frequência dos disparos foi derivada do intervalo de tempo entre picos consecutivos integrados da atividade dos nervos e expressos em disparos por minuto (bpm). Amplitude do disparo, dos nervos, integrada foi determinada (em µV) pela diferença do valor entre o pico do disparo e atividade mínima observada. A alteração na amplitude da atividade do nervo frênico e simpático, induzida pelo KCN e hipercapnia (7 e 10% CO2), foi expressa como valores percentuais em relação aos valores basais anteriores aos estímulos. As alterações nos outros parâmetros foram expressas nas suas unidades originais.
37
RESULTADOS
4.1 A PARTICIPAÇÃO DOS NEURÔNIOS NORADRENÉRGICOS DA REGIÃO A5, NO
CONTROLE DA FREQUÊNCIA RESPIRATÓRIA EM NEONATOS, IN VITRO
4.1.1 PARTICIPAÇÃO DA REGIÃO A5 NA ATIVIDADE DO NERVO C4 VIA ATIVAÇÃO DOS RECEPTORES PURINÉRGICOS
A atividade do C4 foi registrada antes, durante e após a ação do agonista purinérgico ATP (10 mM) na região A5, a atividade do C4 infere a atividade do nervo frênico, portanto, a atividade respiratória. A aplicação do ATP na região A5 (n=13) atenuou a frequência da atividade do C4, durante a aplicação foi possível visualizar de 0 a 2 disparos em 30 segundos (tempo da injeção indicado na parte inferior do registro da figura 4), obtendo uma redução de 80% dos disparos do nervo C4.
38
Figura 4: Preparação tronco-bulbo-medula espinhal para a aplicação local de agonista de receptores P2 nas células noradrenérgicas da região A5. Foto representativa à esquerda, e registro extracelular representativo do quarto nervo cervical (C4), à direita. O traço abaixo do registro indica a aplicação do ATP (10 mM). Legenda: LC, Locus coeruleus; 4V, quarto ventrículo.
4.1.2 PARTICIPAÇÃO DE RECEPTORES DE PURINÉRGICOS,
ADENOSINÉRGICOS E ADRENÉRGICOS NA REGIÃO A5 SOBRE A ATIVIDADE RESPIRATÓRIA.
O agonista ATP foi aplicado na região A5 perfundida por solução de perfusão controle aCSF (n=13) e solução de perfusão contendo os antagonistas Suramina (10 µM, n=6), DPCPX (0,5 µM, n=6), ou Idaxozano (10 µM, n=8).
Durante a perfusão de aCSF com Suramina, a frequência do nervo C4 retornou a taxa de disparos na segunda metade do tempo de aplicação do ATP na região A5. O bloqueio dos receptores purinérgicos P2X e P2Y eliminaram o efeito inibitório na frequência instantânea da atividade do C4 provocado pelo ATP, indicando que o drive inibitório da região A5 provocada pelo ATP foi bloqueado (4,6 ± 0,3 vs 7,0 ± 0,2 cpm, p<0,05, Fig. 5A). A amplitude do C4 não foi alterada
A5 A5
4V
LC LC
ATP 10mM
C4
39
durante a aplicação do ATP na região A5 perfundida com aCSF e Suramina (0,9 ± 0,3 vs 0,9 ± 0,5 Volt), representado na figura 5B.
30 60 90 120 150 180 210 240 270 300 330 360
0 2 4 6 8 10 ATP 10mM
*
aCSF + SURAMINA aCSF
Fr
e
q
u
ê
n
c
ia
i
n
st
â
n
ta
n
e
a
d
a
a
ti
v
id
a
d
e
d
o
C4
(
c
p
m
)
30 60 90 120 150 180 210 240 270 300 330 360
0.0 0.5 1.0 1.5 ATP 10mM Tempo (segundos)
Am
p
li
tu
d
e
da
a
ti
vi
da
de
C
4
(
V
o
lt
s)
A
B
Figura 5: A influência dos receptores purinérgicos no drive inibitório durante a aplicação de ATP nos neurônios da região A5, em neonatos. Os gráficos mostram os valores normalizados da frequência em ciclos por minuto (A) e amplitude instantânea em Volts (B) do nervo C4 a cada 15 segundos. A barra inferior no gráfico indica o momento da injeção do ATP (duranção de 30 segundos) na região A5. O grupo representado pelo círculo preto recebeu ATP na região A5 perfundida com aCSF (n=13), e o grupo representado pelo quadrado vermelho foi perfundido com aCSF contendo
suramina (10 µM, n=6) para o bloqueio dos receptores purinérgicos P2X e P2Y. * indica a diferença em relação ao
40
O possível envolvimento dos receptores adrenérgicos na resposta do C4 durante a aplicação do ATP na região A5 foi investigado. Para tal, utilizou-se Idazoxano (10 µM) um antagonista de receptores adrenérgicos alfa 2. O bloqueio dos receptores adrenérgicos alfa 2 promoveram um aumento significativo a frequência da atividade do C4 (6,4 ± 0,4 vs 8,2 ± 0,2 cpm, p<0,05, Fig. 6A), porém a amplitude não apresentou uma diminuição significativa (1,0 ± 0,3 vs 0,9 ± 0,3 Volt, p>0,05, Fig 6B). Durante a aplicação do ATP na região A5 a diminuição da frequência do C4 foi atenuada (4,6 ± 0,3 vs 6,8 ± 0,5 cpm, p<0,005, Fig. 6A) indicando que o bloqueio dos receptores adrenérgicos alfa 2 inibe o drive inibitório provocado pelo ATP na região A5. Contudo, nenhuma alteração foi observada na amplitude do nervo C4 quando os receptores adrenérgicos alfa 2 estavam bloqueados durante a aplicação do ATP (0.9 ± 0,3 vs 0,8± 0,5 Volt, p>0,05, Fig. 6B).
O DPCPX é um antagonista seletivo para o receptor de adenosina A1. O DPCPX foi aplicado no banho, e após circular por todo o sistema o ATP foi novamente aplicado na região A5 e nenhuma alteração na frequência e amplitude do nervo C4 foi observada (4,6 ± 0,3 vs
41
30 60 90 120 150 180 210 240 270 300 330 360 0 2 4 6 8 10 ATP 10mM aCSF+ IDAZOXANO aCSF
aCSF + DPCPX
*
*
Fr e q u ê n c ia i n st â n ta n e a d a a ti v id a d e d o C4 ( c p m )30 60 90 120 150 180 210 240 270 300 330 360 0.0 0.5 1.0 1.5 ATP 10mM Tempo (segundos) Am p li tu d e i n st â n ta n e a d a a ti v id a d e d o C4 ( V o lt s)
A
B
Figura 6: A influência dos receptores adrenérgicos e adenosinérgicos na atividade do quarto nervo cervical, em neonatos. Os gráficos mostram os valores normalizados da frequência em ciclos por minuto (A) e amplitude instantânea em Volts (B) do nervo C4 a cada 15 segundos. A barra inferior no gráfico indica o momento da injeção do ATP (duração de 30 segundos) na região A5. O grupo representado pelo círculo preto recebeu ATP na região A5 perfundida com aCSF
(n=13), e o grupo representado pelo losango vermelho foi perfundido com aCSF contendo idazoxano (10 µM, n=8) para
o bloqueio dos receptores adrenérgicos alfa 2, e o grupo representado pelo quadrado azul foi perfundido com aCSF
contendo DPCPX (0,5 µM, n=6) para o bloqueio de receptores de adenosina A1. * indica a diferença em relação ao
42
4.2 QUIMIORRECEPÇÃO CENTRAL E PERIFÉRICA EM NEONATOS, MODELO
EXPERIMENTAL INVIVO
4.2.1 EFICÁCIA DAS LESÕES DOS NEURÔNIOS NORADRENÉRGICOS NA REGIÃO A5
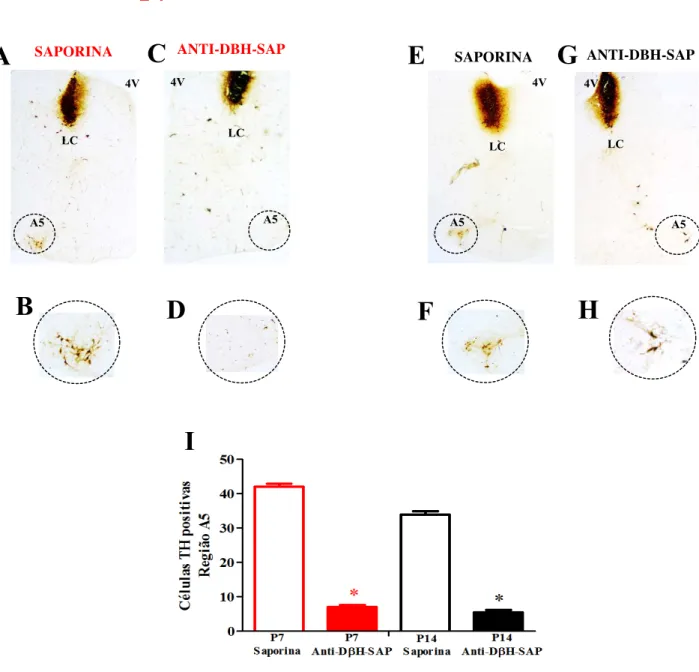
A lesão química com anti-DBH-SAP reduziu o número de neurônios noradrenérgicos na região A5 em neonatos com 7 dias de vida extrauterina (n=6) e com 14 dias de vida extrauterina (n=5), representados na figura 7. A eficácia da lesão química em neonatos P7-8 foi de 83% (42 ± 2,0
43
Figura 7: Efetividade da lesão química dos neurônios noradrenérgicos da região A5 em neonatos P7-8 e P14-15. A imunoistoquímica para tirosina hidroxilase revelou os neurônios marcados pela tirosina hidroxilase (TH). Os neonatos controles receberam IgG-SAP (30%) para a lesão fictícia, e o grupo de animais com neurônios noradrenérgicos da região A5 lesados receberam anti-DBH-SAP (4,2 ng/100 nL) para a lesão química. O volume injetado nos animais P7-8 foi de 25 nL, bilateralmente para ambos os tratamentos (n=6). Em A, imagem de um corte transversal na região da ponte, de um neonato P7 controle representativo do grupo, contendo a região A5 (indicada pela região pontilhada) na margem ventral e o Locus coeruleus dorsalmente no assoalho do quarto ventrículo. A figura B está representado os neurônios noradrenérgicos da região A5 marcados pela TH da figura 7A. Na figura C está representado um neonato P7 com os neurônios noradrenérgicos lesionados, com maior aumento em D. Já os animais do grupo P14-15 receberam 40 nL, bilateralmente, sendo n=6 para o grupo controle e n=5 para o grupo lesado. Em E, a imagem de um corte transversal na região da ponte, de um neonato P14 controle representativo, indicando os neurônios marcados para TH na região A5, em F a região A5 em maior aumento. Os neonatos P14 lesados estão representados na figura G, com maior aumento na
4V
C
4V
LC
4V
LC 4V
A
B
C
D
E
F
G
H
A5 A5 A5
LC
A5
LC
I
P7
P14
44
figura H. No gráfico I está representado a média da quantidade de neurônios de toda a extensão da região A5 marcadas com TH por secção, nas idades P7 (vermelho) e P14 (preto). * indica diferença significante em relação ao grupo controle
(p<0,05), A5: região noradrenérgica A5, LC: Locus coeruleus, 4V: quarto ventrículo.
4.2.2 RESPOSTA DA VENTILAÇÃO EM NEONATOS DURANTE A ATIVAÇÃO DO QUIMIORREFLEXO PERIFÉRICO
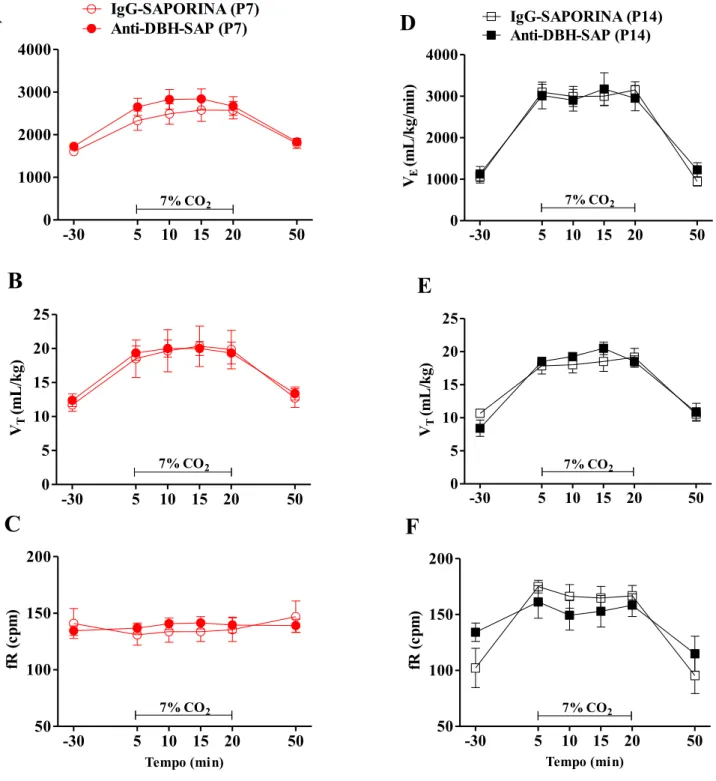
Não houve diferença entre os grupos controle (IgG-SAP, 30%) e lesado (Anti-DBH-Sap) durante a normocapnia (VE: 1817 ± 300 vs 1933 ± 280 mL/Kg/min; VT: 12 ± 2 vs 12 ± 3 mL/Kg; fR 146 ± 10 vs 144 ± 8 cpm) em P7, ou P14 (VE: 1082 ± 320 vs 1024 ± 230 mL/Kg/min; VT: 10 ± 1 vs 9 ± 2 mL/Kg; fR 104 ± 12 vs 105 ± 10 cpm). Posteriormente, os animais foram submetidos à 20 min. de hipóxia (10% O2) (Fig. 8). À direita estão os gráficos representando os neonatos P7-8 (vermelho) e à esquerda os gráficos contendo informações dos neonatos P14-15 (preto).
A ventilação dos neonatos P7-8 aumentou significantemente durante a hipóxia (VE: 1817 ± 300 vs 2693 ± 210 mL/Kg/min; VE: 1933 ± 280 vs 3034 ± 250 mL/Kg/min, p<0,001) nos animais controles e nos animais com os neurônios da região A5 lesionados, respectivamente (Fig.8A). O aumento o aumento do volume corrente persistiu durante os 20 minutos de exposição (VT: 12 ± 2 vs 16 ± 4 mL/Kg, p=0,01; VT:12 ± 3 vs 18 ± 1 mL/Kg, p=0,04, Fig. 8B), enquanto o aumento na frequência respiratória foi significante apenas nos 5 primeiros minutos (fR: 146 ± 10 vs
179 ± 13 cpm; fR:144 ± 8 vs 171 ± 9 cpm, p<0,001) controle e lesado, respectivamente (Fig. 8C). Não houve diferença significativa entre os grupos.
Em neonatos P14, o aumento da ventilação durante a hipóxia foi observado nos dois grupos (VE: 1082 ± 320 vs 1769 ± 350 mL/Kg/min; VE:1024 ± 230 vs 2055 ± 270 mL/Kg/min, p<0,001) controle e lesado respectivamente (Fig. 8D), devido ao aumento significante da frequência respiratória (Fig. 8F) nos neonatos do grupo controle e lesado (fR: 104 ± 12 vs 169 ± 11; fR 105 ± 10
vs 170 ± 14 cpm, p<0,001), porém nenhuma alteração foi encontrada no volume corrente (VT: 10 ± 1
vs 11 ± 1; VT: 9 ± 2 vs 12 ± 1 mL/Kg, p>0,05, Fig. 8E).
45
-30 5 10 15 20 50 0
1000 2000 3000 4000
10% O2
A
IgG-SAPORINA (P7)Anti-DBH-SAP (P7) VE (m L /k g/ m in )
-30 5 10 15 20 50 0 5 10 15 20 25
10% O2
B
VT (m L /k g )-30 5 10 15 20 50 50
100 150 200
10% O2
C
Tempo (min) fR ( c p m )-30 5 10 15 20 50 50
100 150 200
10% O2
F
Tempo (min) fR ( c p m )-30 5 10 15 20 50 0
1000 2000 3000 4000
10% O2
IgG-SAPORINA (P14) Anti-DBH-SAP (P14)
D
VE (m L /k g/ m in )-30 5 10 15 20 50 0 5 10 15 20 25
10% O2
E
VT (m L /k g )Figura 8: Parâmetros ventilatórios obtidos a partir do movimento da caixa torácica de neonatos, durante a exposição de
20 minutos à hipóxia (10% O2). À esquerda (em vermelho) estão representadas as variáveis respiratórias dos neonatos
P7-8, sendo círculo vazio a média do grupo de neonatos com lesão fictícia (IgG-SAP 30%) e círculo cheio a média do grupo de neonatos com os neurônios noradrenérgicos da região A5 lesionados (Anti-DBH-Sap). As variáveis ventilação (VE, A), frequência respiratória (fR, B) e volume corrente (VT, C) foram analisadas em 30 minutos de normocapnia (-30
min.), durante 20 minutos de exposição à 10% O2, e durante 30 minutos de recuperação em normocapnia (50 min.). Ao
lado direito estão representados VE (D), fR (E) e VT (F) dos neonatos P14-15, sendo os quadrados vazios a média dos