Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761
Rol Del propano en la reacción de deshidrogenación oxidativa de etano para
producir etileno
Papel do Propano na Reação de Desidrogenação Oxidativa do Etano na Produção
de Etileno
DOI:10.34117/bjdv6n10-645
Recebimento dos originais: 07/10/2020 Aceitação para publicação: 10/11/2020
Roberto Quintana Solórzano
Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas Norte 152, Col. San Bartolo Atepehuacan, Gustavo A. Madero, C.P. 7730, Ciudad de México, MEXICO.
E-mail: rquintana@imp.mx
Héctor Armendáriz Herrera
Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas Norte 152, Col. San Bartolo Atepehuacan, Gustavo A. Madero, C.P. 7730, Ciudad de México, MEXICO.
E-mail: harmenda@imp.mx
José Ramón Montiel López
Pemex Transformación Industrial, Marina Nacional 329, Col. Verónica Anzures, Miguel Hidalgo, C.P. 11300, Ciudad de México, MEXICO
E-mail: jframon_58@hotmail.com
Jaime Sánchez Valente
Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas Norte 152, Col. San Bartolo Atepehuacan, Gustavo A. Madero, C.P. 7730, Ciudad de México, MEXICO.
E-mail: jsanchez@imp.mx
RESUMEN
En este trabajo se investiga el efecto del propano, la impureza más prominente de las corrientes de etano que se procesan industrialmente en los hornos pirolíticos, en la reacción de deshidrogenación oxidativa de etano (DHO-E), siendo este último un proceso catalítico novedoso para producir etileno. El propano se hizo reaccionar con aire en un micro-reactor de lecho fijo, empacado con un catalizador a base de MoVSbOx utilizando condiciones de reacción empleadas típicamente en la DHO-E. La conversión de propano es de moderada a alta, con una distribución a productos tal en la que las especies de oxidación total (COx) dominan a las de oxidación parcial (propileno), un comportamiento que difiere de lo observado con etano. La producción de COx es relevante debido a la alta exotermicidad de las reacciones de combustión. La importancia relativa de las reacciones de oxidación parcial y total del propano a condiciones de la ODH-E es luego valorada formalmente mediante una cinética del tipo Ley de Potencias. La descripción cinética de la conversión del propano en la ODH-E es crucial para poder especificar el contenido máximo de propano en la corriente industrial de etano, desde la perspectiva térmica del reactor y seguridad de un proceso industrial.
Palabras clave: Etano, etileno, deshidrogenación oxidativa, MoVSbOx, cinética.
ABSTRACT
This paper reports on the effect of propane, the most prominent impurity contained in the ethane streams that are processed industrially in ethane crackers, on the oxy-dehydrogenation reaction of
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 ethane (DHO-E), a disruptive catalytic process to produce ethylene. Propane was reacted with air in a fixed-bed micro-reactor packed with a MoVSbOx-based catalyst developed for ODH-E, and using reaction conditions typical of ethane processing. Propane conversion is moderate-high, with a distribution to products in which total oxidation species (COx) dominate over those coming from partial oxidation steps (propylene), a behavior that differs from that exhibited by ethane. The production of COx is relevant as these are formed via very exothermic combustion reactions. The relative importance of partial and total oxidation reactions of propane conversion at ODH-E conditions is formally assessed by a Power Law kinetics. The kinetic description of the conversion of propane in ODH-E will be crucial to define specifications of the propane content in the industrial ethane stream from the thermal perspective of the reactor and safety of the industrial process.
Keywords: Ethane, ethylene, oxydehydrogenation, MoVSbOx catalyst, kinetics.
1 INTRODUCCIÓN
El etileno, la olefina más simple que existe es, indudablemente, la especie más demandada en la industria petroquímica al ser utilizada como materia prima para la síntesis de una gran cantidad de compuestos químicos y productos comerciales como los polímeros [1]. En México y otros países, el etileno se produce en los denominados hornos pirolíticos (crackers) de etano (CrE), unidades de proceso cuya operación demanda una cantidad extremadamente elevada de energía debido a la termodinámica que gobierna la química correspondiente. La alta temperatura requerida para incrementar la conversión al equilibrio en la operación de los CrE, así como la presencia de varios contaminantes de naturaleza diversa en la corriente de etano procesada, desencadenan una gran cantidad de reacciones colaterales y, por consecuencia, una alta diversidad de subproductos que deberán ser separados corriente abajo [2]. El esquema de separación suele ser relativamente complejo y con una alta inversión y elevados costos de operación asociados, aspecto que, junto con las altas emisiones de CO2 asociadas, son algunas de las características negativas de este proceso y que han motivado a la comunidad industrial y científica a buscar procesos alternos para producir etileno [3].
La deshidrogenación oxidativa catalítica del etano (ODH-E) ha sido identificada como una opción disruptiva, prometedora para producir etileno, atrayendo la atención de la comunidad industrial y científica [1,2]. A diferencia de la pirolisis de etano, la ODH-E no está limitada por el equilibrio termodinámico. En la presencia de catalizador, la DHO-E podría llevarse a cabo a temperaturas relativamente bajas, con una alta selectividad que conduciría a beneficios en el diseño y los costes de la sección de separación corriente arriba. Los óxidos mixtos basados en MoVTe(Sb) han mostrado altos niveles de actividad y selectividad a etileno en la ODH-E, al llevar a cabo la reacción en la presencia de aire y/o aire enriquecido con oxígeno, a temperaturas por debajo de 500 °C [4]. A estas condiciones, sin embargo, la producción de etileno está inevitablemente acompañada de la formación de productos
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 de oxidación totales, COx en particular, a través de reacciones muy exotérmicas con entalpías de reacción estándar (ΔH°R@298 K,1 atm) entre -758 y -1,430 kJ/mol.
Las corrientes industriales de etano procesadas en los CrE suelen ir acompañadas de una cantidad variable de impurezas, siendo el propano la especie más prominente, en concentraciones que típicamente varían entre 0.5 y 4.0 % vol. [5]. Durante la ODH-E, el propano también sería susceptible a reacciones de oxidación parcial y total produciendo propileno y COx como productos de reacción, incrementando la carga térmica del reactor en razón a la naturaleza exotérmica de estaos procesos. La combustión del propano es, de hecho, ca. 40 % más exotérmica (ΔH°R,298 K, 1 atm entre – 1,073 y - 2,043 kJ/mol) que la del etano. El efecto del propano en la ODH-E, por lo anterior, merece ser estudiado con detenimiento.
En este trabajo se investiga la reactividad del propano, la impureza más importante en la corriente de etano procesada en los CrE, en la DHO-E, proceso disruptivo para producir etileno. Se efectúan experimentos, en un micro-reactor, para cuantificar la reactividad y distribución a productos en la conversión del propano a condiciones de proceso típicas de la conversión de etano, utilizando un catalizador del tipo MoVSbOx diseñado para la DHO-E. Los resultados generados y presentados aquí son luego utilizados con fines de modelamiento cinético, permitiendo valorar la importancia relativa de las reacciones involucradas sirviendo como apoyo para definir las especificaciones del contenido de propano en la corriente de etano mediante trabajo de simulación.
2 EXPERIMENTAL
2.1 MATERIALES: CATALIZADOR Y REACTIVOS
El catalizador se preparó a partir de una solución acuosa conteniendo las fuentes metálicas respectivas, a saber, heptamolibdato de amonio, sulfato de vanadilo, cloruro de antimonio y oxalato de niobio, ajustando el pH entre 1.4 y 2.5. Esta solución se vertió en un rotavapor para ser tratada a 60 ° C y 72 mbar. Los sólidos resultantes se secaron a 100 ° C durante la noche, se calcinaron a 280 ° C y a continuación se trataron térmicamente a 550 ° C con N2. Para la evaluación catalítica, los polvos de catalizador se comprimieron en una prensa para formar una pastilla compacta, la cual fue molida en un mortero y luego cribada. Las partículas entre 150 y 250 micrones fueron colectadas, secadas a 110 °C por una hora para remover la humedad, y luego cargadas en el micro-reactor experimental.
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 2.2 EXPERIMENTOS CATALÍTICOS
Los experimentos catalíticos se efectuaron en un micro-reactor de 0.9 cm de diámetro interno hecho en cuarzo, cargado con 0.60 g de catalizador con un tamaño de partícula promedio de 200 micrones, lo anterior para minimizar los gradientes internos a nivel pellet [6,7]. El reactor, que fue alimentado con 40 - 100 cm3/min std. (25 °C y 1 atm) de una mezcla compuesta de propano, oxígeno y nitrógeno, se operó en forma isotérmica, isobárica y en el régimen integral. El efluente del reactor fue analizado en continuo y, para determinar la composición molar respectiva, se usó un cromatógrafo HP-7890A equipado con dos válvulas multi-puertos, dos detectores (FID y TCD) y tres columnas. Se generaron unos 50 puntos experimentales independientes encuadrados en las condiciones de proceso referidas en la Tabla 1.
La reacción fue seguida durante unos 3 h en continuo, periodo en el cual no se detectó desactivación del catalizador, con balances de carbono de 100 ± 4 %. Todos los resultados experimentales de comportamiento catalítico corresponden a valores en el estado estacionario.
Tabla1. Condiciones experimentales de los experimentos catalíticos con propano.
Variable Condicion es Temperatura, °C 360 - 420 Espacio velocidad (W/F°propano) 100 - 140 Presión, kPa-g 100 – 250 P° propano, kPa-g 10 - 20 P° oxígeno, kPa-g 25 - 40 Ppropanoo /Poxígenoo 0.4 - 0.5 2.3 MODELAMIENTO CINÉTICO
Se desarrolló un modelo cinético de Ley de Potencias, para representar la conversión del propano y su distribución a productos sobe el catalizador MoVSbOx diseñado para la DHO-E. La red de reacción asociada a la conversión del propano es el punto de partida en el desarrollo de la cinética, y corresponde al esquema de la Figura 1. En esta red, que fue sugerida sobre la base de lo observado experimentalmente, se observan cinco reacciones en las cuales el propano reacciona con el oxígeno para producir propileno, CO y CO2 (COx) como subproductos; mientras que el propileno generado en la primera reacción también es susceptible de ser reconvertido hacia CO y CO2. En todas estas reacciones se produce, invariablemente, agua como subproducto.
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 En términos del formalismo de Ley de Potencias, la velocidad de reacción depende de un coeficiente cinético, denotado por k, y de la presión parcial de los reactivos elevada a un exponente respectivo, referido como orden de reacción parcial. Así, la velocidad de las reacciones 1 - 5 de la red de reacción de la Figura 1, quedaría expresada mediante las ecs. (1) a (5), expresiones en las cuales los órdenes de reacción parciales se representan por alfa y beta, los cuales están asociados al hidrocarburo y oxígeno, respectivamente.
Figura 1. Red de reacción que describe las reacciones de oxidación de propano con oxígeno en su conversión vía deshidrogenación oxidativa.
r1 = k1Ppropanoalfa1 Poxígenobeta1 (1) r2 = k2Ppropanoalfa2 Poxígenobeta2 (2) r3 = k3Ppropanoalfa3 Poxígenobeta3 (3) r4 = k4Ppropileno alfa4 Poxígenobeta4 (4) r5 = k5Ppropilenoalfa5 Poxígenobeta5 (5)
Conociendo la velocidad de cada reacción es posible calcular velocidad de producción neta de cada especie considerada en la red de reacción, sabiendo que éstas pueden ser producidas y/o consumidas en más de una etapa. De acuerdo con la Figura 1, el propano, por ejemplo, se consume en las reacciones 1 (a propileno), 2 (a CO2) y 3 (a CO); mientras que el propileno se produce en la reacción 1 (del propano), y se consume en las reacciones 4 (a CO2) y 5 (a CO). Generalizando, la velocidad de producción neta de cada una de las especies considerada en la red de reacción de la Figura 1, representada por Rj, j, se calcula a través de la ec. (6).
Donde υi,j denota el coeficiente estequiométrico de la especie j en la reacción i cuya velocidad es ri:
Rj = ∑5i=1υi,jri (6) Propano Propileno CO2 CO k1 k2 k3 k4 k5
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 Los parámetros cinéticos de las ecuaciones de velocidad fueron estimados mediante una regresión no isotérmica, no lineal y multivariable, incluyendo los valores de conversión y rendimiento como las respuestas experimentales (Xij) y acoplando la ecuación del modelo del reactor integral en la predicción de dichas respuestas, ec. (7). Notar que la ec. (7) incluye la velocidad de producción neta de cada especie. Rij = dXij d(W/Fpropanoo ) i , CI: Xij =0.0 @ W/Fpropanoo =0.0 (7) 3 RESULTADOS Y DISCUSIÓN
3.1 CONVERSIÓN Y DISTRIBUCIÓN A PRODUCTOS
La reactividad del propano fue cuantificada midiendo su conversión, mientras que la distribución a productos respectiva fue valorada mediante la selectividad. En el curso de la reacción se detectaron como productos de reacción al propileno, CO y CO2. La importancia relativa de estos productos si bien dependió de las condiciones de proceso, se detectó que en general los productos de oxidación total (COx) fueron dominantes, mientras que el propileno, el producto de oxidación parcial, fue la especie menos abundante. En todos los casos la relación CO a CO2 fue mayor que la unidad. Este comportamiento difiere de lo observado al hacer reaccionar etano, cuya conversión claramente produce etileno, un producto de oxidación parcial, como especie dominante, ver refs. [4,8].
A las condiciones de proceso referidas arriba, las respuestas catalíticas mencionadas exhibieron los siguientes intervalos: 2–58 % conversión de propano, 4–88 % conversión de oxígeno, 4–39 % selectividad a propileno, 36–58 %C selectividad a CO y 25–38 %C selectividad a CO2. Estos resultados indicarían que, si bien el catalizador MoVSbOx tiene la capacidad para activar la conversión del propano, no puede prevenir la reconversión del propileno formado, como sucede en el caso de etileno producido del etano en la ODH-E [8], hacia productos de oxidación total.
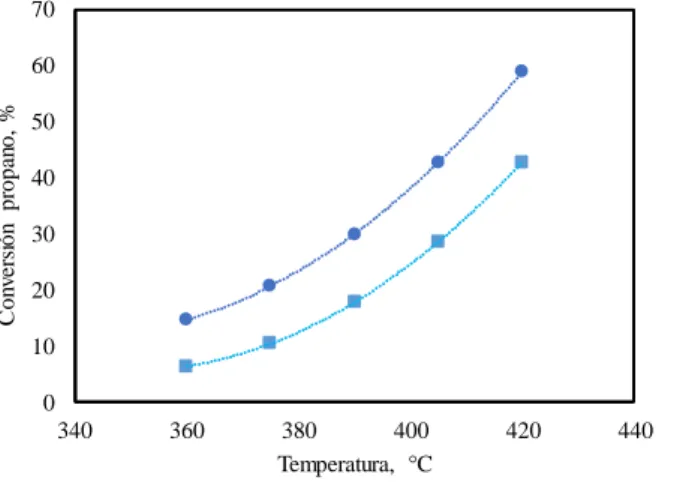
La Figura 2 muestra un gráfico de la conversión de propano como función de la temperatura de reacción a dos presiones de operación. Se observa que tanto la temperatura como la presión tiene un efecto positivo en la conversión. El efecto de la temperatura es no lineal, independientemente de la presión de operación. A la condición de mayor severidad, 420 °C y 200 kPa-g, cerca del 60 % del propano alimentado se convierte.
La Figura 3 presenta la selectividad a propileno y CO como función de la temperatura a dos presiones de operación. Se observa que la distribución a productos es fuertemente dependiente de la temperatura y presión. Claramente, la operación a una mayor severidad de reacción (temperatura y/o presión) favorece la selectividad a CO (y CO2 no mostrado por simplicidad) en detrimento de la
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 selectividad a propileno. A 420 °C y 200 kPa-g, por ejemplo, la selectividad a propileno apenas alcanzó 4 %C, con 58 %C de CO y 28 % de CO2.
Figura 2. Conversión de propano como función de la temperatura, entre 360 y 420 °C, a dos presiones diferentes: (●) 100 kPa -g y (■) 200 kPa – g.
Figura 3. Selectividad a propileno y CO como función de la temperatura, entre 360 y 420 °C, y dos presiones diferentes: (●,○) 100 kPa -g, y (■, □) 200 kPa – g.
3.2 CINÉTICA
Los resultados de la regresión no lineal para estimar los parámetros cinéticos del modelo mostraron valores de energía de activación en el intervalo 70 – 149 kJ/mol, notándose que la formación de propileno y su reconversión hacia CO2 son las reacciones con una menor demanda energética. Los procesos de oxidación profunda de propano, por el contrario, son los procesos más demandantes energéticamente y, por lo tanto, más sensibles a la variación en la temperatura de reacción.
La Tabla 2 contiene los valores de los coeficientes cinéticos (ki) calculados a 390 °C y los órdenes de reacción parciales (alfai y betai) asociados a la presión parcial del HC (propano o propileno) y
0 10 20 30 40 50 60 70 340 360 380 400 420 440 C on ve rs ión pr opa no, % Temperatura, C 0 10 20 30 40 50 60 70 0 10 20 30 40 50 340 360 380 400 420 440 S el ec tivi da d C O , % C S el ec tivi da d pr opi le no, % C Temperatura, C
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761 oxígeno. Apegados sólo al valor de los coeficientes cinéticos y la temperatura referida, la conversión de propano a propileno (reacción 1) sería la más rápida de las 5, seguida por la oxidación total del propileno (reacciones 4 y 5). Las reacciones de oxidación total del propano a COx serían los procesos más lentos. A esta temperatura, la reacción (1) exhibe el coeficiente cinético más grande, seguido por los coeficientes cinéticos de las reacciones (4) y (5), ver Fig. 1.
Notar también que todos los órdenes parciales asociados a las reacciones de conversión de propano fueron fraccionarios, y menores a 0.65. Los órdenes parciales obtenidos para las reacciones de reconversión del propano exhibieron, en general, mayores valores comparados con los del propano. La reconversión del propileno sería, en principio, más sensible a los cambios en la presión de operación.
Tabla 2. Coeficientes cinéticos (k) @ 390 °C y órdenes parciales (alfa y beta) asociados a las reacciones las reacciones de oxidación de propano con oxígeno vía deshidrogenación oxidativa.
Reacción k, alfa beta
(Fig. 1) mol/[gcat h kPa(alfa+beta)]-1 1 1.590 × 10 0.52 0.15 2 4.064 × 103 0.63 0.31 3 3.125 × 104 0.56 0.26 4 6.563 × 102 0.86 1.01 5 1.558 × 102 0.37 1.29 4 CONCLUSIONES
El propano contenido en corrientes comerciales de etano procesadas en los crackers de etano no es inerte a las condiciones del proceso de ODH-E en cuanto a catalizador y condiciones de reacción. El catalizador MoVSbOx de alta actividad y selectividad a etileno en la ODH-E, también tiene la capacidad para activar la conversión del propano, aunque no puede prevenir la reconversión del propileno a productos de oxidación total. Dado que las reacciones de oxidación total, que son extremadamente exotérmicas, dominan a las de oxidación parcial en la conversión del propano, las especificaciones del contenido del propano en las corrientes comerciales de etano deberán ser cuidadosamente definidas para prevenir un descontrol térmico en el reactor, así como para conservar la seguridad de un proceso catalítico a nivel industrial.
AGRADECIMIENTOS
Braz. J. of Develop.,Curitiba, v. 6, n. 11, p. 82885-82893, nov. 2020. ISSN 2525-8761
REFERENCIAS
[1] D. Lippe. Oil Gas J., 109 (2011) 94
[2] G. J. Maffia, A. M. Gaffney, O. M. Mason. Top. Catal., 59 (2016) 1573. [3] F. Cavani, N. Ballarini, A. Cercola A. Cat. Today, 127 (2007), 113
[4] J. S. Valente, H. Armendáriz-Herrera, R. Quintana-Solórzano, P. del Ángel P, N. Nava, A. Masso, J. M. López-Nieto, ACS Catalysis, 4-5 (2013) 1292.
[5] R. Quintana-Solórzano, H. Armendáriz -Herrera, J. S. Valente, Reporte Interno, Instituto Mexicano del Petróleo, 2015.
[6] J. S. Valente, R Quintana-Solórzano, H. Armendáriz-Herrera, G. Barragán-Rodríguez, J. M. López-Nieto, Ind. Eng. Chem. Res., 53-5 (2014) 1775
[7] R. Quintana-Solórzano, G. Barragán-Rodríguez G, H. Armendáriz-Herrera, J. M. López-Nieto, J. S. Valente, Fuel, 138 (2014) 15.
[8] J. S. Valente y col. US Patent 9409156B2. otorgada al Instituto Mexicano del Petróleo, Universidad Politécnica de Valencia and PEMEX-Petroquímica (2016)