Rui Miguel Correia de Almeida Pinto
Activação das vias de sinalização intracelular das ERKs 1 e 2 e
da p38 em carcinomas de células de transição da bexiga
Dissertação de candidatura a grau de Mestre em Medicina e Oncologia Molecular apresentada à Faculdade de Medicina da Universidade do Porto Porto, Fevereiro de 2009
Artigo 48º, § 3º
“A Faculdade não responde pelas doutrinas expendidas na dissertação” (Regulamento da Faculdade de Medicina do Porto, Decreto-Lei nº 19 337 de 29 de
C
ORPOC
ATEDRÁTICODAF
ACULDADEDEM
EDICINA DOP
ORTOProfessores Efectivos
Alberto Manuel Barros da Silva
Altamiro Manuel Rodrigues Costa Pereira Álvaro Jerónimo Leal Machado de Aguiar Amadeu Pinto de Araújo Pimenta
António Albino Coelho Marques Abrantes Teixeira António Carlos Freitas Ribeiro Saraiva
António José Pacheco Palha Belmiro dos Santos Patrício Cassiano Pena de Abreu e Lima Daniel Filipe Lima Moura
Deolinda Maria Valente Alves Lima Teixeira Francisco Fernando Rocha Gonçalves
Isabel Maria Amorim Pereira Ramos
João Francisco Montenegro Andrade Lima Bernardes Jorge Manuel Mergulhão Castro Tavares
José Agostinho Marques Lopes José Carlos Neves da Cunha Areias
José Eduardo Torres Eckenroth Guimarães José Henrique Dias Pinto de Barros
José Luís Medina Vieira
José Manuel Lopes Teixeira Amarante José Manuel Pereira Dias de Castro Lopes Manuel Alberto Coimbra Sobrinho Simões Manuel Jesus Falcão Pestana de Vasconcelos Manuel Maria Paula Barbosa
Maria Amélia Duarte Ferreira Maria Dulce Cordeiro Madeira
Maria Fátima Machado Henriques Carneiro Maria Isabel Amorim de Azevedo
Maria Leonor Martins Soares David
Patrício Manuel Vieira Araújo Soares Silva Rui Manuel Almeida Mota Cardoso
Rui Manuel Lopes Nunes
Professores Jubilados ou Aposentados
Abel José Sampaio da Costa Tavares Alexandre Alberto Guerra Sousa Pinto Amândio Gomes Sampaio Tavares António Augusto Lopes Vaz
António Carvalho Almeida Coimbra António Fernandes da Fonseca
António Fernandes Oliveira Barbosa Ribeiro Braga António Germano Pina Silva Leal
António Luís Tomé da Rocha Ribeiro António Manuel Sampaio Araújo Teixeira António Manuel Giesteira de Almeida Cândido Alves Hipólito Reis
Carlos Rodrigo Magalhães Ramalhão Daniel Santos Pinto Serrão
Eduardo Jorge Cunha Rodrigues Pereira
Fernando de Carvalho Cerqueira Magro Ferreira Fernando Tavarela Veloso
Francisco José Zarco Carneiro Chaves Francisco de Sousa Lé
Henrique José Ferreira Gonçalves Lecour de Menezes João Silva Carvalho
Joaquim Germano Pinto Machado Correia da Silva José Augusto Fleming Torrinha
José Carvalho de Oliveira
José Fernando Barros de Castro Correia José Manuel Costa Mesquita Guimarães
Luís Alberto Mrtins Gomes de Almeida Manuel Augusto Cardoso de Oliveira Manuel Machado Rodrigues Gomes Manuel Teixeira Amarante Júnior
Maria da Conceição Fernandes Marques Magalhães Mário José Cerqueira Gomes Braga
Serafim Correia Pinto Guimarães
Valdemar Miguel Botelho dos Santos Cardoso Waldemar Friedrich Alfred Osswald
A
BREVIATURASABC, “Avidin-Biotin Complex” (Complexo avidina-biotina) -HCG, Fracção da Gonadotrofina Coriónica
CCTB, Carcinomas de Células de Transição da Bexiga CEA, Antigénio Carcino-Embrionário
CIS, Carcinoma in situ DAB, Diaminobenzidina
EGF, Factor de Crescimento Epidérmico
ERK, “Extracellular signal regulated kinase” (Cínase regulada por sinais extracelulares)
et al, et alii
FGF, Factor de Crescimento Fibroblástico
MAPKs, “Mitogen activated protein kinase” (Cínase activada por mitogénios) NMP22, Proteina da Matriz Extracelular 22
PBS, “Phosphate Buffer Saline” (Solução tampão de fosfato) RTU-TV, Ressecção Transuretral de Tumor Vesical
TATI, Inibidor da Tripsina Associado a Tumores TGF-, Factor de Transformador do Crescimento TGF-ß, Factor de Transformador do Crescimento ß
TNM, Classificação Internacional Tumour Nodes Metastasis TPA, Antigénio Polipeptídico Tecidual
TPS, Antigénio Específico Tecidual
À
MINHAF
AMÍLIAPela empenho e carinho com que fui apoiado, pela vossa confiança, um
muito obrigado...
Í
NDICEPágina
I. Introdução
1. Os Carcinomas de Células de Transição da Bexiga 9
2. Factores de Prognóstico dos Carcinomas de Células de Transição 10
3. Outros Factores de Prognóstico dos Carcinomas de Células de Transição 13
4. Importância das vias de sinalização intracelulares nos Carcinomas de Células de
Transição 14
5. Objectivos 16
II. Material e Métodos
1. Recolha de amostra e procedimento de Imunohistoquimica 17
2. Análise em Microscopia Óptica 18
3. Análise estatística dos resultados obtidos 19
III. Resultados
1. Análise em Microscopia Óptica 20
2. Análise Semi-quantitativa em Microscopia Óptica 24
IV. Discussão
1. Sobre-activação das vias ERKs 1 e 2 e p38 em neoplasias uroteliais invasoras e mais
indiferenciadas 27
2. Sobre-activação das ERKs 1 e 2 em urotélio normal de bexigas com neoplasias
invasoras mais indiferenciados 29
3. Imunorreacção ERKs 1 e 2 e p38 nos neovasos tumorais 30
4. Conclusões 30
V. Resumo 31
VI. Summary 33
I. I
NTRODUÇÃO1. Os Carcinomas de Células de Transição da Bexiga
A Bexiga é um orgão do aparelho urinário, responsável pelo armazenamento de urina produzida pelos rins antes da sua excreção final. Histologicamente é constituída por várias camadas, sendo a mais superficial um epitélio específico do aparelho urinário, o epitélio de transição ou urotélio. É constituído por vários tipos celulares cujas características lhe conferem a capacidade de variar o número de camadas, consoante o estado de replecção vesical. Como todos os epitélios, apresenta uma taxa de renovação celular elevada, o que aumenta o risco de ocorrência de tumores (Bryan et al, 2005).
O Carcinoma de Células de Transição da Bexiga (CCTB) é um tumor maligno vesical que se desenvolve no urotélio e é a segunda causa de morte por neoplasia urológica (Pashos et al, 2002). O CCTB é mais frequente em países desenvolvidos e representa a 4ª causa de morte mais prevalente entre homens com idade superior a 80 anos. A sua incidência é superior em indíviduos caucasianos, do sexo masculino, geralmente a partir da 5ª década de vida (Pashos et al, 2002) e é o quinto tumor humano mais incidente (Greenlee et al, 2000). Os CCTB podem ser classificados em tumores superficiais ou não invasores e invasivos ou musculo-invasores. Os tumores superficiais correspondem a 67-79% dos tumores primários e comportam um risco de recidiva de 70% e de progressão de grau e/ou estadio de 30% (Gephardt et al, 1995; Wallace et al, 2002)). Entenda-se como recidiva, a detecção de CCTB num tempo inferior a seis meses após a última ressecção transuretral de tumor vesical (RTU-TV) e como progressão o desenvolvimento de CCTB num estadio mais avançado.
Os tumores invasivos correspondem a 15-30% dos tumores primários. Neste caso, a probabilidade da ocorrência de metástases ganglionares é elevada. Estas são observadas em 50% dos casos nos 2 primeiros anos mesmo após a realização cistectomia radical, a estratégia
terapêutica defendida para o tratamento dos tumores invasivos confinados à bexiga (Babjuk et al, 2008). Este acto cirúrgico é extremamente mutilante, agressivo e não garante a cura.
Por estas razões torna-se necessário identificar as características tumorais que nos permitirão orientar uma terapêutica neoadjuvante ou adjuvante à cirurgia, bem como analisar qual o grupo de doentes que beneficiará de uma estratégia cirúrgica agressiva mais precoce (Catto et al, 2005). É essencial que, aquando do diagnóstico, a avaliação real das características moleculares do tumor seja o mais precisa e completa possível, de modo a classificá-lo correctamente, assegurar a determinação do seu potencial de recidiva e/ou progressão, bem como orientar o tratamento mais adequado possível (Frazier e tal, 1993; Soloway et al, 1994; Trasher e tal, 1994; Stein e tal, 1998).
2. Factores de Prognóstico dos Carcinomas de Células de Transição
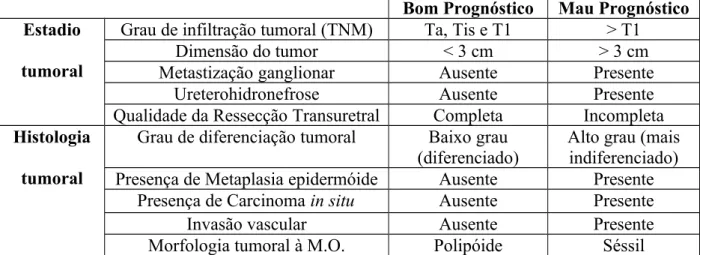
Na avaliação de um tumor podem ser consideradas diferentes características que, quando agrupadas, permitem definir e estratificar o prognóstico. Os factores de prognóstico usados correntemente na prática clínica são o estadio tumoral, no momento do diagnóstico, e as características histológicas do tecido tumoral (Pashos et al, 2002). Quer a avaliação do estadio tumoral, quer a apreciação das características histológicas compreendem vários parâmetros, apresentados brevemente na Tabela 1 (ver Anexo 1).
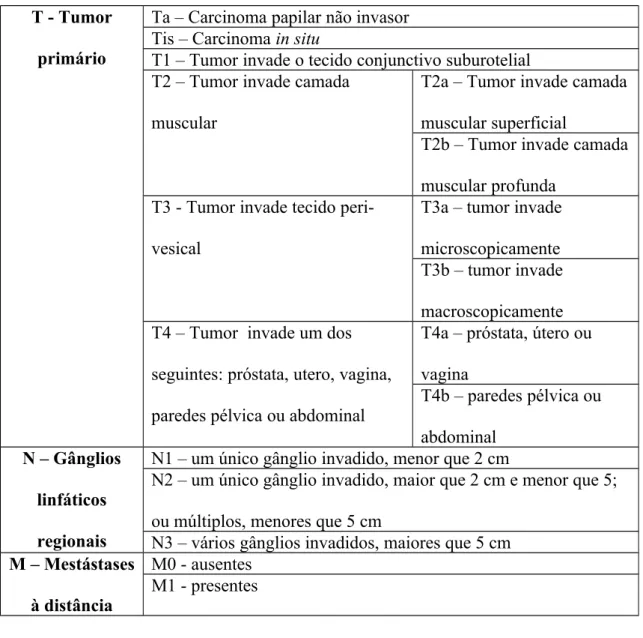
O estadio tumoral pode ser avaliado recorrendo a classificações como a TNM (do inglês Tumour Nodes Metastasis, ver Anexo 2) que avalia o tumor, a presença de metastização ganglionar e de lesões secundárias à distância. Esta classificação permite-nos prever o comportamento biológico do tumor bem como a sobrevida global do doente, correlacionando os diversos estadios com riscos de recidiva e/ou progressão (ver Anexo 3). Assim, alguns autores demonstraram que em tumores em estadio TNM T2 ou menores (ver Anexo 2) não é
provável a ocorrência de metástases à distância. Pelo contrário, em tumores em estadio T3 e T4 a prevalência destas metástases pode alcançar os 39% (Fung et al, 1991).
Para além da utilização da classificação TNM, outras características clássicas são utilizadas por si só ou em conjunto na actividade clínica, nomeadamente o grau de infiltração tumoral, a dimensão do tumor, a ocorrência de ureterohidronefrose, bem como a qualidade da RTU-TV a que o doente foi sujeito.
A infiltração tumoral é definida como o “grau” de profundidade de invasão nas várias camadas da parede vesical pelo tumor (representa o T da classificação TNM) e está significativamente associada à taxa de sobrevida aos 5 anos após cistectomia ou radioterapia (Jahnson et al, 1991, Trasher et al, 1994). A sobrevida é menor em doentes com invasão da camada detrusora vesical (Durdux et al, 1998). Por outro lado, a dimensão do tumor também é um factor importante do prognóstico. Segundo Fung et al (1991) até 59% dos doentes com tumores de diâmetro superior a 3 cm podem vir a apresentar metastização à distância durante a história natural do CCTB. Por outro lado, a existência de metástases à distância também condiciona a sobrevida e esta varia entre 5 e 15 % aos 5 anos, conforme exista uma única metástase ou múltiplas (Sengelov et al, 1997). Na presença de metastização ganglionar, a sobrevida também diminui aos 5 anos, chegando aos 24% segundo Stein et al em 1998.
A ureterohidronefrose, definida como uma dilatação do aparelho urinário alto, representa também um parâmetro importante. Este fenómeno ocorre devido à progressão muscular local do tumor, condicionando a estase a montante. Alguns estudos demonstram que a presença de hidronefrose é um factor independente de mau prognóstico em doentes com tumores invasores da bexiga tratados com cistectomia ou radioterapia (Kaufman et al, 1993, Mameghan et al 1992). Por último, a RTU-TV é uma técnica cirúrgica endoscópica diagnóstica e terapêutica. Em séries de doentes com tumores invasivos da bexiga tratados com radio e/ou quimioterapia, a resposta objectiva à terapêutica parece ser influenciada pela “qualidade” da
RTU-TV do tumor primário (Housset et al, 1993; Kaufman e tal, 1992). Esta qualidade pode ser avaliada pelas margens exigidas à ressecção, pela remoção de todas as lesões suspeitas e pela amostragem correcta de camada muscular.
No que diz respeito à histologia tumoral, esta é determinada pelo estudo anatomo-patológico das peças cirúrgicas obtidas por RTU-TV ou cistectomia radical. A correcta caracterização da mesma permite uma melhor avaliação do prognóstico do doente. Esta caracterização é realizada em função do grau de diferenciação tumoral, da presença concomitante de Carcinoma In Situ (CIS), da presença de metaplasia epidermóide, do grau de invasão vascular e da morfologia tumoral. O exame anatomo-patológico descreve também a vascularização do tumor e a presença de neovasos tumorais em tecidos circundantes normais. Classicamente, tem-se assumido que a presença de neovasos em zonas adjacentes ao tumor bem como a hiperplasia e/ou hipertrofia de vasos pré-existentes se associa à mestastização à distância. No entanto, estudos mais recentes revelam-se contraditórios: alguns autores negam o seu valor prognóstico (Larsen et al, 1990; Ramani et al, 1991), outros confirmam-no, demonstrando uma associação entre a presença de êmbolos vasculares e metástases à distância (Bell et al, 1971; Heney et al, 1983).
Por último, um tumor pode ser classificado conforme a sua forma papilar / polipóide ou sólida / séssil. Um tumor séssil tem maior probabilidade de crescer e invadir o tecido muscular que o rodeia (Fung et al, 1991). Já quando o tumor apresenta morfologia polipóide verifica-se que é susceptível de maior controlo local após RTU-TV (Shipley et al, 1985; Gospodarowicz et al, 1989), sendo mais frequentemente superficial e estando associado a maior sobrevida do doente (Bell et al, 1971; Slack et al, 1980).
3. Outros Factores de Prognóstico dos Carcinomas de Células de Transição
Hoje em dia é um facto assente que os factores de prognóstico clássicos são insuficientes para definir de uma forma correcta o comportamento biológico de uma neoplasia vesical após o diagnóstico histológico (Fossa et al, 1993). Com o objectivo de caracterizar o potencial de agressividade de um CCTB vários outros factores de prognóstico foram investigados (Tabela 4 - Anexo 4). Baseiam-se essencialmente num melhor conhecimento das características bioquímicas e genéticas das células tumorais. Estas características são classificadas em dois grupos: marcadores séricos e urinários e marcadores de biologia tumoral.
A expressão de marcadores séricos e urinários pode ser pesquisada em análises de rotina ao sangue ou à urina, respectivamente. A sua relação custo-benefício ainda se encontra longe da ideal. Porém, alguns marcadores parecem ser promissores na avaliação do comportamento biológico tumoral. Exemplos de marcadores séricos incluem citoqueratinas, metaloproteinases, ácido hialurónico e hialuronidase. Os marcadores urinários incluem o Antigénio Carcino-Embrionário (CEA), a Fracção da Gonadotrofina Coriónica (-HCG), a Proteina da Matriz Extracelular 22 (NMP 22), o Antigénio associado ao Cancro 19-9 (Ca 19-9) e a survivina. Por último, a análise de marcadores de biologia tumoral, que compreendem alterações genéticas, expressão de oncogenes, instabilidade dos microssatélites cromossómicos e actividade replicativa do tumor, permite estabelecer o prognóstico tumoral e caracterizar a agressividade dos CCTB. No entanto, mesmo a análise conjugada de marcadores clássicos e os novos marcadores bioquímicos, nem sempre permite estabelecer o melhor prognóstico nem delinear a estratégia terapêutica mais aconselhada.
4. Importância das vias intracelulares de sinalização envolvidas na tumorigénese nos Carcinomas de Células de Transição
Avanços recentes na investigação em biologia celular permitiram caracaterizar melhor o processo de carcinogénese tecidular. Nomeadamente, a importância de factores de crescimento na progressão da carcinogénese e metastização está agora bem estabelecida (Torben et al, 1998; Grossman et al, 2000; Pouyssegur et al, 2002). Os factores de crescimento são proteínas que em condições normais regulam eventos como a embriogénese, o crescimento celular, a diferenciação e morte celulares. Os factores de crescimento estão também envolvidos nas respostas celulares à lesão e inflamação e a alteração da sua expressão pelas células tumorais poderá contribuir para o crescimento celular desregulado e génese tumoral. De facto, é bem sabido que as células cancerosas apresentam auto-suficiência em relação aos factores de crescimento, bem como insensibilidade a factores que reprimem o crescimento celular. Crê-se que estas características são importantes para que ocorra inibição da apoptose celular, aumento do potencial replicativo celular, angiogénese sustentada, invasão tecidular e metastização das células tumorais (Hanahan e Weinberg, 2000).
Os factores de crescimento mais conhecidos incluem o Factor de Crescimento Epidérmico (EGF), o Factor de Crescimento Fibroblástico (FGF) e o Factor Transformador de Crescimento (TGF-) cuja importância em diversos tipos de tumores, incluindo a neoplasia vesical, foi já sobejamente demonstrada (Hussain et al, 2004). Os factores de crescimento ligam-se a receptores específicos, levando à activação citoplasmática de vias de sinalização intracelular. As vias de sinalização incluem várias proteínas que se activam de forma sequencial, regulando a resposta celular que ocorre em resposta à activação dos receptores de factores tróficos. Esta resposta pode passar pela indução da expressão de novos genes, alteração da actividade de canais e receptores membranares ou alteração da regulação do ciclo celular. A família de vias de sinalização mais conhecida é a família das Cínases Activadas por Mitogénios
(MAPKs). Esta famíla compreende várias vias de sinalização activadas por fosforilação em resíduos de serina e treonina, duas das quais, a via das Cínases Reguladas pos Sinais Extracelulares 1 e 2 (ERKs 1 e 2) e a via da p38, estão particularmente envolvidas na regulação do crescimento de diversas populações celulares em condições normais (Swiatkowski et al, 2003; Olson et al, 2004; Kaminska et al, 2005; Meloche et al, 2007). Em células tumorais de mama, ovário e pulmão, o papel destas vias parece ser também importante (Figura 1, Anexo 5). No que diz respeito à via das ERKs 1 e 2, foram já descritas mutações activadores de elementos desta cascata em diversos sistemas, causando um aumento de activação das ERKs 1 e 2 (Ikenoue et al., 2003; Jaworski et al., 2004). Em certos casos, parece mesmo haver uma correlação entre a agressividade tumoral e o nível de activação das ERKs (Kaladhar et al, 2003). É o caso do cancro da próstata, no qual a activação das ERKs pode estar aumentada até cerca de 15 vezes em relação ao normal (Price et al, 1999). Alguns inibidores específicos da activação desta via de sinalização têm sido utilizados com sucesso no tratamento do adenoma pulmonar e cancro colo-rectal (Kramer et al, 2004; Strumberg et al, 2004; Wilhelm et al., 2004; Sebolt-Leopold e Herrera, 2004). No entanto, em células epiteliais do intestino a activação das ERKs 1 e 2 pode funcionar como um supressor tumoral e não como agente tumorigénico (Boucher et al, 2004), o que quer dizer que a activação das ERKs 1 e 2 poderá ter significados diferentes consoante o tipo celular em questão.
No que diz respeito à via das p38, a sua contribuição na tumorigénese é ainda pouco claro. Em condições normais, a via da p38 é activada em resposta ao stress oxidativo e contribui para reorganização do citoesqueleto em situações de agressão celular, bem como activa proteínas de choque térmico (Huot et al, 1996, 1997). No cancro da próstata e da mama, a sua activação parece estar relacionada com a gravidade da doença (Chen et al, 2004; Kim et al, 2004). Por outro lado, a actividade da via da p38 também pode estar relacionada com a
“dormência” e inibição de proliferação de outros tipos de células tumorais (Aguirre-Ghiso et al, 2003).
A importância das vias ERKs 1 e 2 e da p38 nos CCTB continua por esclarecer. Poucos estudos obtiveram dados que permitam compreender a sua importância na progressão tumoral dos CCTB. Desconhece-se também se a activação destas vias de sinalização é relevante para a progressão tumoral.
5. Objectivos
Em doentes com CCTB verifica-se que os critérios de diagnóstico e prognóstico são manifestamente insuficientes (Frazier et al, 1993; Soloway et al, 1994; Trasher et al, 1994, Stein et al 1998; Oosterlink et al, 2002; Buscarini et al, 2005). Muitas vezes a combinação dos factores anteriormente descritos é insuficiente, podendo mesmo os dados serem contraditórios entre si.
Ainda hoje não sabemos quais os tumores que, uma vez caracterizados, poderão ser mais agressivos e por consequência ser tratados mais precocemente. De facto, a fiabilidade e reproductibilidade dos marcadores actuais permanece o principal obstáculo à sua introdução como gold standard no estadiamento dos CCTB. Tal advém do escasso conhecimento do comportamento biológico das células tumorais nos CCTB.
Mais ainda, o grau de actividade de vias de sinalização celular, que se sabe serem importantes noutros tipos neoplásicos, permanece por descrever.
Assim, o objectivo deste trabalho foi avaliar o nível de activação das ERK 1 e 2 e p38 em doentes com neoplasia vesical em diversos graus de diferenciação e estadio anatomo-patológico.
II. M
ATERIAL EM
ÉTODOS1. Recolha de amostra e procedimento de imuno-histoquímica
Recolheram-se amostras de tecido vesical de doentes submetidos a Cistectomia Radical e Linfadenectomia Ileo-obturadora e doentes submetidos a Ressecção Transuretral de Tumor Vesical. Como controlo, utilizaram-se amostras recolhidas de doentes submetidos a Cistectectomia Simples ou Prostatectomia Transvesical sem sinais da presença de CCTB. As amostras de tecido vesical de doentes com neoplasia compreendiam tecido, macroscopicamente, com e sem tumor. No total de 40 doentes (20 com neoplasia invasora, 10 com neoplasia superficial e 10 sem neoplasia), usaram-se 3 amostras com 1x2 cm por cada doente, sendo a maior dimensão a da profundidade. Este material biológico foi colhido e fixado em formol a 10%. Posteriormente foi desidratado em sequência com alcóois com concentração ascendente até ao xilol e depois incluído em blocos de parafina que se cortaram a 6 µm em micrótomo de parafina (Leica). As lâminas foram armazenadas até todo material ter sido recolhido.
Uma vez realizados cortes de todos os blocos, aqueles foram re-hidratados numa sequência descendente de alcóois, após o que foram lavados abundantemente com água destilada. Os cortes foram então levados a ebulição em tampão citrato (10 mM, pH 3.6) por 10 minutos para revelação antigénica. Quando frios, os cortes foram lavados de novo abundantemente com água destilada por 10 minutos. Depois, procedeu-se a inibição da actividade da peroxidade endógena, incubando-se os cortes com solução de água oxigenada em metanol durante 10 minutos. Após várias lavagens com tampão fosfato salino 0.1 M (PBS, do inglês phosphate buffer saline) o bloqueio de cada corte foi realizado com 100-400 l de solução de bloqueio (soro de porco, 10% em PBS) por 1 hora, à temperatura ambiente. De seguida, a solução de bloqueio foi removida e os cortes incubados durante 18 horas a 4ºC com
100-400 l de anticorpo primário (produzido em coelho - Cell Signaling Technologies, diluído a 1:200 em solução de bloqueio, ou seja 25 microl de ATC primário diluídos em 5 ml de solução de bloqueio).
No dia seguinte, removeu-se o anticorpo primário e depois de várias lavagens em água destilada, os cortes foram incubados durante 30 minutos à temperatura ambiente com o anticorpo secundário biotinilado (porco, anti-coelho) diluído (1:200) no PBS tween 20 0.1%. O anticorpo secundário foi removido e os cortes lavados várias vezes em PBS. Os cortes foram então incubados durante uma hora numa solução que continha o complexo Avidina-Biotina (do inglês “ABC”, diluição a 1:200, ou seja 20 microl de A e B em 4 ml de PBS Tween) conjugado com peroxidase de rábano. Após várias lavagens, os cortes foram incubados numa solução com 10 ml de PBS, 10 mg de DAB e 7,5 l de água oxigenada a 30%, enquanto foi monitorizada atentamente o desenvolvimento de cor castanha. Após várias lavagens, os cortes foram contracorados com Hematoxilina. As lâminas foram de seguida desidratadas numa ordem crescente de alcóois até xilol e montadas.
2. Análise em Microscopia Óptica
As lâminas foram analisadas com a colaboração do Serviço de Anatomia Patológica. As alterações da Imunomarcação das vias de sinalização foram observadas num Microscópio Óptico (Nikon Optiphot) com objectiva 20 x. Em cada lâmina foram analisados 8 campos aleatórios que continham tecido normal e células tumorais. Estas alterações foram correlacionadas com as características histológicas das peças processadas.
A avaliação de intensidade da imunomarcação foi analisada de acordo com a tabela (0, 1+, 2+, 3+):
0 – Sem imunomarcação
2+ - Imunomarcação em 5 a 25 células por campo 3+ - Imunomarcação em mais de 25 células por campo
3. Análise estatística dos resultados obtidos
A correlação clínico-patológica dos níveis de activação das ERKs e da p38 com o grau e estadio da neoplasia foi avaliada no software SigmaStat.
Foi efectuada a correlação da activação das ERKs e da p38 com o comportamento tumoral no decurso do follow-up da doença.
III. R
ESULTADOS1. Análise em Microscopia Óptica
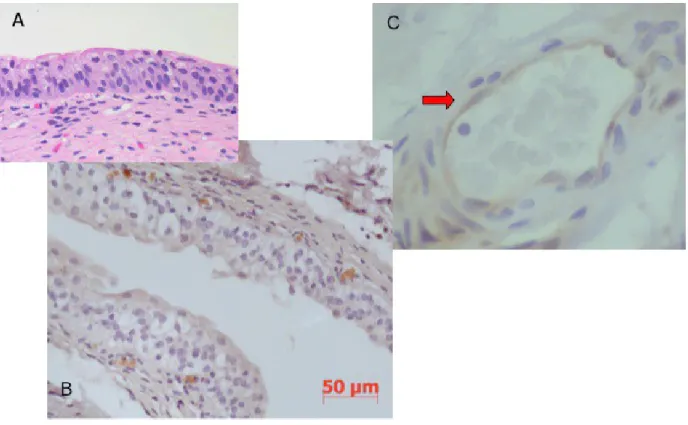
No urotélio usado como controlo não se observou sobre-activação das ERKs. A única estrutura com sobre-activação desta via nestes tecidos era o endotélio vascular (controlo) – Figura 1.
A activação da p38 foi confirmada com resultados sobreponíveis à sobre-activação de ERK 1 e 2 – Figura 2.
Figura 1. Activação das ERK 1 e 2 no urotélio utilizado como controlo. A – Urotélio de controlo (Hematoxicilina + Eosina).
B – Urotélio de controlo sem sobre-activação das ERKs (Imunorreacção Erk 1 e 2; Hematoxicilina).
Figura 2. Activação da p38 no urotélio utilizado como controlo.
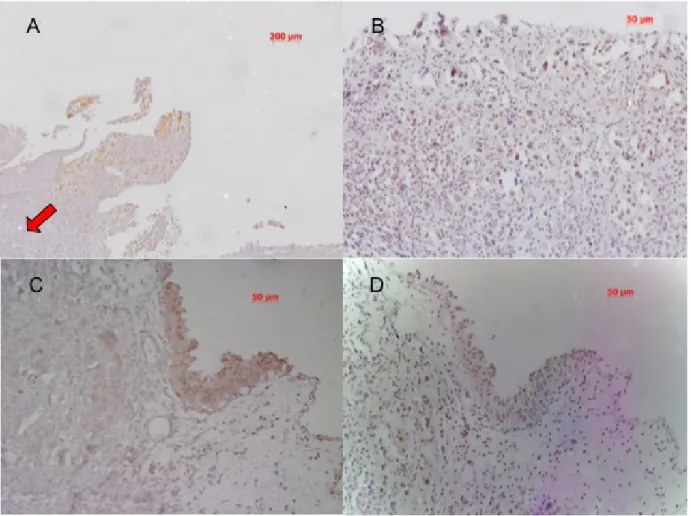
Nos doentes com CCTB de alto grau (mais indiferenciados) observou-se uma sobre-activação das ERKs 1 e 2 no tecido tumoral com uma atenuação da sobre-activação no sentido da profundidade. Ao mesmo tempo, e após avaliação anátomo-patológica, pudemos confirmar que a diferenciação celular aumenta no sentido da profundidade, mesmo em tumores de alto grau.
No caso da p38, uma via de sinalização envolvida em sinais pró-apoptóticos, constatou-se uma sobre-activação, mas que constatou-se estendeu a todas as camadas de tecido vesical – Figura 3.
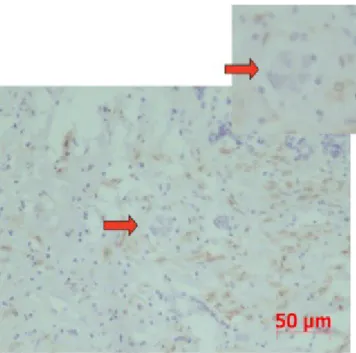
Figura 3. Activação das ERK 1 e 2 e p38 no urotélio de doentes com CCTB, macroscopicamente tumor.
A – Sobre-activação das ERKs (ERK 1 e 2) em CCTB invasor com uma atenuação da activação no sentido da profundidade (seta).
B – Sobre-activação da p38 por todas as camadas CCTB invasor de forma regular. C – Padrão de Sobre-activação de ERKs em CCTB não invasor.
D – Padrão de Sobre-activação de p38 em CCTB não invasor.
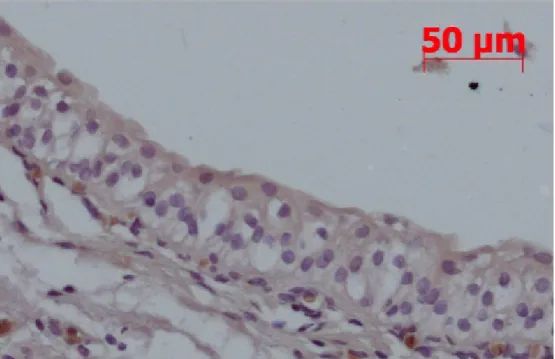
No urotélio macroscopicamente normal de doentes com CCTB de alto grau, e apenas nestes, também ocorria uma forte activação das ERKs. A p38 não se encontrava sobre-expressa neste urotélio normal vizinho de áreas tumorais – Figura 4.
Figura 4. Activação das ERK 1 e 2 no urotélio macroscopicamente normal de doentes com CCTB.
À esquerda – Sobre-activação das ERKs no tecido tumoral (ERK 1 e 2).
À direita - Ausência de sobre-activação da p38 por todas as camadas do tecido tumoral de forma regular.
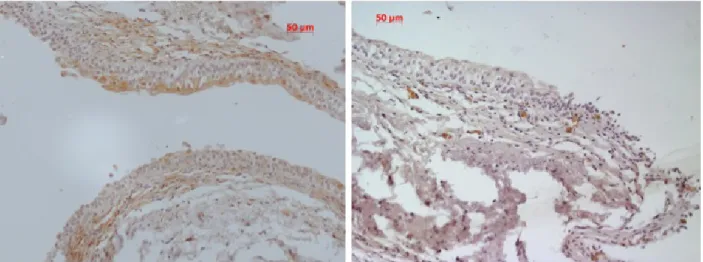
Outro dado encontrado caracteriza o comportamento biológico dos neovasos peri e intra-tumorais. Após Imunorreacção estes não sobre-expressam nem ERKs 1 e 2, nem p38 – Figuras 5.
Figura 5. Ausência de activação das ERK 1 e 2 nos neovasos tumorais de doentes com CCTB.
2. Análise Semi-quantitativa em Microcopia Óptica
A avaliação semiquantitiva de intensidade da Imunomarcação foi analisada de acordo com a tabela (0, 1+, 2+, 3+):
0 – Sem Imunomarcação
1+ - Imunomarcação em menos de 5 células por campo 2+ - Imunomarcação em 5 a 25 células por campo 3+ - Imunomarcação em mais de 25 células por campo
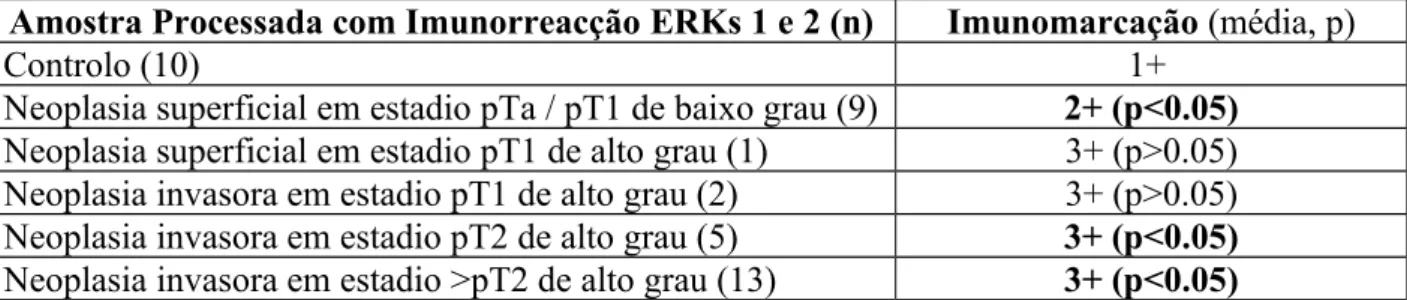
Na tabela 1 apresentam-se os resultados da Imunorreacção ERKs 1 e 2, ordenados por estadio anatomo-patológico nas peças de controlo e tumorais.
Amostra Processada com Imunorreacção ERKs 1 e 2 (n) Imunomarcação (média, p)
Controlo (10) 1+
Neoplasia superficial em estadio pTa / pT1 de baixo grau (9) 2+ (p<0.05) Neoplasia superficial em estadio pT1 de alto grau (1) 3+ (p>0.05) Neoplasia invasora em estadio pT1 de alto grau (2) 3+ (p>0.05) Neoplasia invasora em estadio pT2 de alto grau (5) 3+ (p<0.05) Neoplasia invasora em estadio >pT2 de alto grau (13) 3+ (p<0.05)
Tabela 1. Quantificação de intensidade de Imunorreacção ERKs 1 e 2 nos diversos estadios encontrados das peças tumorais. Os resultados foram comparadas com os controlos e a sua significância estatística apresentada.
Da mesma forma, comparámos semi quantititativamente a activação ERKs 1 e 2 em Urotélio normal de doentes com CCTB invasores versus controles (Tabela 2).
Amostra Processada com Imunorreacção ERKs 1 e 2 (n) Imunomarcação (média, p)
Controlo (10) 1+
Neoplasia superficial em estadio pTa / pT1 de baixo grau (9) 1+ (p>0.05) Urotélio normal de neoplasia de urotelial pT1 ou 2 de alto
grau (8)
2+ (p<0.05) Urotelio normal de neoplasia de urotelial >pT2 de alto grau
(13)
3+ (p<0.05)
Tabela 2. Quantificação de intensidade de Imunorreacção ERKs 1 e 2 no Urotélio normal. Os resultados foram comparadas com os controlos e entre si e a sua significância estatística apresentada.
Em relação à Imunorreacção p38 a nossa avaliação semiquantitativa demonstrou também diferenças estatisticamente significativas conforme as tabelas em anexo:
Amostra Processada com Imunorreacção p38 (n) Imunomarcação (média, p)
Controlo (10) 1+
Neoplasia superficial em estadio pT1 de alto grau (1) 2+ (p>0.05) Neoplasia invasora em estadio pT1 de alto grau (2) 3+ (p>0.05) Neoplasia invasora em estadio pT2 de alto grau (5) 3+ (p<0.05) Neoplasia invasora em estadio >pT2 de alto grau (13) 3+ (p<0.05)
Tabela 3. Quantificação de intensidade de Imunorreacção p38 nos diversos estadios encontrados.
Não existiram diferenças na profundidade tumoral no que à activação de p38 diz respeito, sendo a sua sobre-activação evidente ao longo de todas as camadas tumorais.
A Activação de p38 em Urotélio normal de doentes com CCTB quando comparada com os controles foi sobreponível ou seja detectámos 5 ou menos células marcadas por campo (1+) em todas as amostras processadas.
A Imunorreacção nos neovasos não foi quantificada, no entanto todas as lâminas analisadas com neovascularização em tumores vesicais invasores confirmam a ausência de activação de ERKs 1 e 2 nestas estruturas.
IV. D
ISCUSSÃODurante o nosso trabalho pudemos demonstrar que em doentes com CCTB a via de sinalização das ERKs 1 e 2 se encontra sobre-activada quer em áreas tumorais quer em zonas de urotélio vizinho normal. Verificámos também que a via de sinalização da p38 se encontra sobre-activada nos CCTB, embora neste caso a sobre-activação se limita à área tumoral.
Apesar da atenuação da Imunorreacção ERKs 1 e 2 na profundidade tumoral observou-se observou-sempre uma sobre-activação destas vias de sinalização nos tecidos mais indiferenciados apesar de superficiais.
1. Sobre-activação das vias ERKs 1 e 2 e p38 em neoplasias uroteliais invasoras e mais indiferenciadas
A sobre-activação das ERKs em neoplasias invasoras mais indiferenciadas corrobora o papel desta via de sinalização na carcinogése urotelial, confirmando o excesso de sinais anti-apoptóticos nestas células uroteliais tumorais.
Na tentativa de explicar estes dados, Medema et al, em 1993, concluiu que mutações nos componentes destas vias de sinalização das ERKs proporcionam a libertação de sinais mitóticos sem regulação exógena por intermédio da sua actividade tirosina cínase nos seus domínios citoplasmáticos. As células CCTB podem ter assim uma menor dependência de factores de crescimento exógenos, quer pela sua auto-suficiência em factores de crescimento, quer pelo seu menor limiar de activação perante os mesmos factores (Hanahan e Weinberg, 2000).
Também Pouyssegur et al, em 2002, concluiu que a invasão tecidular e metastização à distância nos CCTB era mais frequente em tumores com estas vias de sinalização sobre-activadas. Aparentemente a sobre-activação das MAPKs nos CCTBs altera alguns domínios
das integrinas (receptores transmembranares com funções de adesão e sinalização interferindo no crescimento e diferenciação celular) que deixam de ser eficientes. Estas alterações estão associadas ao carácter mais invasor da neoplasia (Grossman et al, 2000). Para que uma colónia de células tumorais cresça com sucesso e se fixe em novos locais / orgãos, outros factores poderão também estar envolvidos: a expressão das caderinas e cateninas, o suporte no citosqueleto celular, encontra-se alterada nos CCTB mais indiferenciados, sendo responsável por uma maior ancoragem e adesão das células tumorais (Bryan et al, 2003). Estas alterações também são correlacionáveis com a sobre-activação das MAPKs (Vihinen et al, 2002).
Outras alterações também responsáveis pela inibição da apoptose foram descritas por Cooke et al em 1999, estando frequentemente associadas ao carácter invasor da neoplasia. As proteínas apoptóticas descritas como o p53, CD 40 e Fas encontram-se alteradas nestes tumores, seja por mutação (p53) seja por diminuição da expressão do seu ligando (CD40).
Para além da auto-suficiência em factores de crescimento e da inibição da apoptose, os CCTB apresentam insensibilidade a factores inibidores do crescimento, como por exemplo a proteína do retinoblastoma (pRB) e o TGF- (Factor de Transformador do Crescimento ). Muitas vezes a expressão destes factores inibidores de crescimento encontra-se diminuída por mutações ou inibida por proteinas como as cínases dependentes das ciclinas (Kubota et al, 1995). Estas alterações estão associadas a tumores mais indiferenciados, com índices de progressão maiores e menor sobrevida (Kim et al, 2001).
Como assinalámos atrás a sobre-activação das ERKs atenuava-se na profundidade do tumor. Este aspecto é de difícil interpretação no momento, mas pode ter correlação com a diferenciação tumoral que por critérios anatomo-patológicos se observou nas nossas amostras de CCTB.
Pelo contrário, no caso da p38 observou-se uma sobre-activação que se estendeu a todas as camadas de tecido vesical. Este achado é novo e não há sequer estudos noutros tecidos
tumorais que permitam uma correlação das nossas observações. Uma explicação possível poderá ser a de que os mecanismos pró-apoptóticos permanecem preservados nas células tumorais e se sobre-expressam na tentativa ainda que insuficiente de compensar o desenvolvimento tumoral. Uma ajuda importante para a explicação deste nosso achado foi descrito por Lancelin et al em 2000. Este autor relacionou a sobre-activação da p38 e a manutenção dos telómeros estáveis, ou seja da estabilidade cromossómica.
2. Sobre-activação das ERKs 1 e 2 em urotélio normal de bexigas com neoplasias invasoras mais indiferenciados
Os nossos resultados demonstraram uma forte activação das ERKs em urotélio normal de doentes com CCTB.
Como já pudemos argumentar previamente o comportamento biológico destes tumores parece estar associado a alterações nesta via de sinalização. Correlacionando estes dados com os anteriores poderemos até supor que estas possuem um comportamento “parácrino”, representando a influência de estruturas tumorais sobre as vizinhas normais. Este achado é novo, mas parece indicar que as células uroteliais aparentemente normais dos doentes portadores de CCTB apresentam já alterações das vias de sinalização que irão facilitar a carcinogénese. Este facto está de acordo com a ideia antiga que os CCTB são uma doença de campo e não uma doença localizada. A ser assim a activação das ERKs em células uroteliais normais poderá ter interesse como um importante e novo factor de prognóstico. De facto, se estudos posteriores vierem a demonstrar que a taxa de recidiva e/ou progressão de doença é superior em doentes com CCTB e com ERKs sobre-activadas em urotélio normal, tal poderá significar a necessidade de uma terapêutica mais agressiva neste grupo de doentes.
3. Imunoreacção ERKs 1 e 2 e p38 nos neovasos tumorais
A ausência de sinais anti-apoptóticos em neovasos tumorais é difícil de compreender à luz das explicações anteriormente dadas para a sobre-activação destas vias no Urotélio. Contudo a ausência de sobre-activação das MAPKs já foi observada por outros autores (Bochner et al, 1995; Streeter et Harris, 2002). Estes dados são de difícil interpretação e parecem indicar que a proliferação celular facilitada pela sobre-activação das ERKs no urotélio não é um mecanismo relevante para a neoangiogénese tumoral.
As causas responsáveis por esta “neoangiogénese permanente” estão já descritas: hipóxia; aumento da expressão de VEGF (Factor de Crescimento Vascular Endotelial) e FGF (Factor de Crescimento Fibroblástico); diminuição da expressão de trombospondina 1 (inibidor da angiogénese regulado pela p53) (Hussain et al, 2004). A neovascularização foi já há muito associada a mau prognóstico, maior risco de recorrência e menor sobrevida (Bochner et al, 1995).
4. Conclusão
Em conclusão os nossos dados indicam que as ERKs estão envolvidas no processo de proliferação urotelial e desenvolvimento dos CCTB.
Apesar da limitação da nossa reduzida amostra, estes resultados parecem demonstrar que a sobre-activação das ERKs se associa a uma menor diferenciação tumoral.
Estes factos associados à sobre-activação das ERKs em urotélio normal de doentes com CCTB fazem supor que no futuro a investigação desta via de sinalização possa vir a ser integrada na avaliação prognóstica e decisão terapêutica.
V. RESUMO
Activação das vias de sinalização intracelular das ERKs 1 e 2 e da p38 em carcinomas de células de transição da bexiga
Introdução
Os factores de prognóstico mais usados nos Carcinomas de Células de Transição da Bexiga (CCTB) são o estadio tumoral na altura do diagnóstico e suas características histológicas. Estes critérios são insuficientes na avaliação da história natural de uma neoplasia vesical, tornando-se necessário um conhecimento mais aprofundado da carcinogénsese urotelial.
De entre as várias cínases activadas por mitogénios, é já sabido que as cínases reguladas por sinais extracelulares 1 e 2 (ERKs) e p38 estão associadas a receptores membranares regulados por factores de crescimento e envolvidos na auto-suficiência tumoral. Participam na carcinogénese de neoplasias hematológicas, do ovário, esófago, mama e cólon. A importância das ERKs nos CCTB é ainda pouco conhecida, mas parece ser importante em estadios precoces da carcinogénese urotelial. O objectivo deste estudo foi avaliar o grau de activação das ERKs em diversos graus e estadios de neoplasias uroteliais.
Material e Métodos
Foram recolhidas amostras de tecido vesical de doentes submetidos a cistectomia radical ou Ressecção Transuretral de Tumor Vesical por CCTB (n= 20 e n=10, respectivamente) e urotélio colhido durante prostatectomia transvesical (n=10), estas últimas usadas como controlos.
A presença de ERKs e p38 (fosfo-ERKs e fosfo-p38) activas foi avaliada por imuno-histoquímica. Para tal, as amostras foram imunorreagidas com um anticorpo que reconhece
especificamente as fosfoERKs. A imunorreacção positiva foi visualizada utilizando o método do ABC-peroxídase. O cromogénio usado foi a DAB. Por fim, as lâminas foram observadas ao microscópio óptico e a activação de ERKs nas diferentes camadas de tecido vesical avaliada qualitativamente, correlacionando-se a intensidade da imunorreacção com o estadio tumoral.
Resultados
No urotélio usado como controlo não se observou activação das ERKs. A única estrutura positiva nestes tecidos era o endotélio vascular. Na bexiga dos doentes com CCTB observou-se uma sobre-activação das ERKs no tecido tumoral com uma atenuação da activação no sentido da profundidade. No urotélio macroscopicamente normal de doentes com CCTB indiferenciados também ocorria uma forte activação das ERKs. A imunorreacção p38 em doentes com CCTB demonstrou uma sobre-activação em tecido tumoral embora em tecido normal não existissem alterações.
Conclusões
Os nossos resultados indicam que a sobre-activação das ERKs e p38 é importante na carcinogénese urotelial, embora por vias diferentes. A descrição da sobre-activação das ERKs em urotélio normal de doentes com CCTB constitui uma novidade e poderá no futuro constituir uma ferramenta prognóstica importante nos CCTB para definir o risco de recorrência e progressão tumorais.
VI. SUMMARY
Phosphorylation levels of ERK 1 / 2 and p38 in the Urothelium of patients with Transitional Cell Carcinoma
Introduction
The most commonly used strategy to manage Transition Cell Carcinomas (TCC) consists in evaluating the histology and tumour stage of biopsies. However, currently this approach is thought to be not 100% reliable and recent studies have forwarded other prognostic factors. Among these, several growth factors seem to be of interest.
Growth factors stimulate signalling pathways belonging to the Mitogen-Activated Protein Kinases family (MAPKs). Among MAPKs, it is already known that Extracelular Related Kinases 1 and 2 (ERK) and p38 are important for haematological, gynaecological and digestive tumour self-sufficiency. In what concerns TCC (transitional cell carcinoma), the few available reports describe over-activation of ERK and p38 only in early stages of cancer development. Thus, the present study aimed to evaluate the activation of these signalling pathways in different stages and grades of TCC.
Material and Methods
Bladder samples were collected from patients with TCC grade 1-3, who underwent radical cistectomy (n=20), transurethral ressection of bladder tumour (n=10) and from patients with benign prostatic hyperplasia (BPH), who underwent transvesical prostatectomy (n=10). This latter group served as controls. All samples were immunoreacted against phosphoERK 1 and 2 (pERK) and phospho-p38 (p-p38) with using specific antibodies against the
phosphorylated (i.e., active) forms of the kinases. The standard ABC method was followed with DAB as chromogen. All sections were then observed and evaluated under the light microscope.
Results
In TCC cells, intense immunostaining of both phosphoMAPKs were found whereas the reaction was faint or absent in the urothelium from BPH patients used as control. The immunoreaction was more intense in high grade, high stage tumours, in which no difference between the two immunoreactions could be detected. In contrast, in low grade tumours, while pERK expression was stronger in more superficial urothelial layers, p-p38 immunoreaction was evenly distributed. In the vicinity of the high grade TCC areas and in normal looking urothelium when labelled with hematoxicilin a eosin, immunoreaction for pERK was also found.
Conclusions
Our results strongly indicate that overactivation the ERK and p38 pathways are involved in urothelial carcinogenesis, although possibly in distinct ways, as it occurs in distinct urothelial layers. In addition, the occurrence of ERK overactivation in healthy-looking urothelium from patients with TCC patients, constitutes an important novelty. In fact, this finding forwards the assessment of ERK and p38 activation in the normal urothelium of TCC patients to define the risk of tumor recurrence and progression.
ANEXO 1
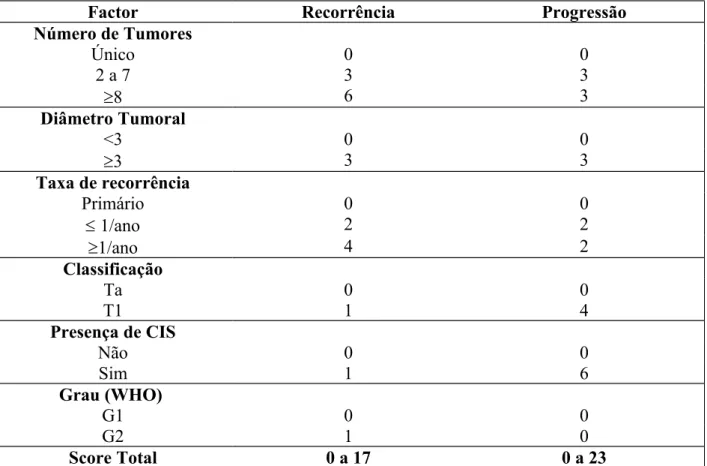
Tabela 1. Factores de prognóstico clássicos envolvidos no estadiamento tumoral vesical. Os tumores de melhor prognóstico estão associados a menor probabilidade de recorrência e progressão.
Bom Prognóstico Mau Prognóstico Estadio
tumoral
Grau de infiltração tumoral (TNM) Ta, Tis e T1 > T1
Dimensão do tumor < 3 cm > 3 cm
Metastização ganglionar Ausente Presente
Ureterohidronefrose Ausente Presente
Qualidade da Ressecção Transuretral Completa Incompleta Histologia
tumoral
Grau de diferenciação tumoral Baixo grau
(diferenciado) Alto grau (maisindiferenciado)
Presença de Metaplasia epidermóide Ausente Presente
Presença de Carcinoma in situ Ausente Presente
Invasão vascular Ausente Presente
ANEXO 2
Tabela 2 – Classificações TNM (2002).
T - Tumor primário
Ta – Carcinoma papilar não invasor Tis – Carcinoma in situ
T1 – Tumor invade o tecido conjunctivo suburotelial T2 – Tumor invade camada
muscular
T2a – Tumor invade camada muscular superficial
T2b – Tumor invade camada muscular profunda
T3 - Tumor invade tecido peri-vesical
T3a – tumor invade microscopicamente T3b – tumor invade macroscopicamente T4 – Tumor invade um dos
seguintes: próstata, utero, vagina, paredes pélvica ou abdominal
T4a – próstata, útero ou vagina T4b – paredes pélvica ou abdominal N – Gânglios linfáticos regionais
N1 – um único gânglio invadido, menor que 2 cm
N2 – um único gânglio invadido, maior que 2 cm e menor que 5; ou múltiplos, menores que 5 cm
N3 – vários gânglios invadidos, maiores que 5 cm M – Mestástases
à distância
M0 - ausentes M1 - presentes
ANEXO 3
Factor Recorrência Progressão
Número de Tumores Único 0 0 2 a 7 3 3 8 6 3 Diâmetro Tumoral <3 0 0 3 3 3 Taxa de recorrência Primário 0 0 1/ano 2 2 1/ano 4 2 Classificação Ta 0 0 T1 1 4 Presença de CIS Não 0 0 Sim 1 6 Grau (WHO) G1 0 0 G2 1 0 Score Total 0 a 17 0 a 23
Risco de Recorrência - Baixo – 0; Intermédio – 1 a 9; Alto – 10 a 17. Risco de Progressão – Baixo – 0 a 1; Intermédio – 2 a 6; Alto – 7 a 23.
Tabela 3. Tabela usada para avaliação do risco de progressão / recorrência perante várias características tumorais (in EORTC, 2008).
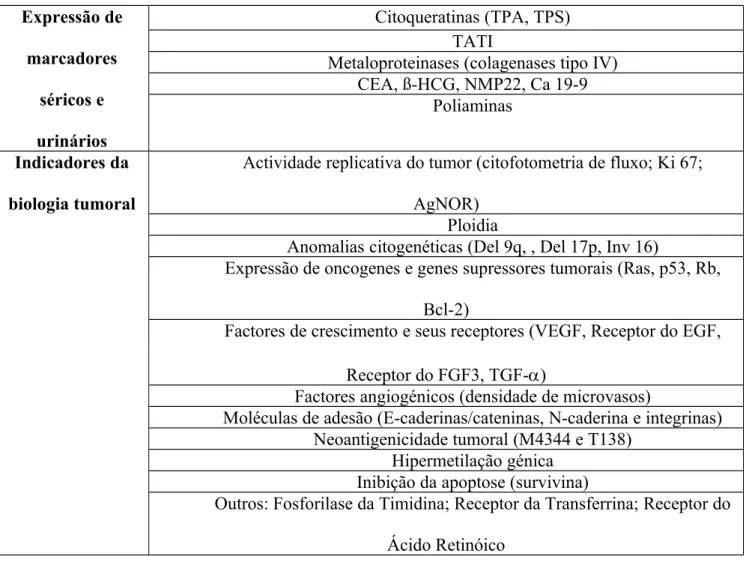
ANEXO 4
Tabela 4. Outros Factores de Prognóstico investigados nos CCTBs ao longo dos últimos anos (in Palou et al, 2008).
Expressão de marcadores séricos e urinários Citoqueratinas (TPA, TPS) TATI
Metaloproteinases (colagenases tipo IV) CEA, ß-HCG, NMP22, Ca 19-9
Poliaminas
Indicadores da biologia tumoral
Actividade replicativa do tumor (citofotometria de fluxo; Ki 67; AgNOR)
Ploidia
Anomalias citogenéticas (Del 9q, , Del 17p, Inv 16)
Expressão de oncogenes e genes supressores tumorais (Ras, p53, Rb, Bcl-2)
Factores de crescimento e seus receptores (VEGF, Receptor do EGF, Receptor do FGF3, TGF-)
Factores angiogénicos (densidade de microvasos)
Moléculas de adesão (E-caderinas/cateninas, N-caderina e integrinas) Neoantigenicidade tumoral (M4344 e T138)
Hipermetilação génica Inibição da apoptose (survivina)
Outros: Fosforilase da Timidina; Receptor da Transferrina; Receptor do Ácido Retinóico
ANEXO 5
Figura 1. ERK 1 e 2 na Neoplasia Vesical (adaptado de Bryan et al, 2005).
EGFR + TGF EGF Outros c-met + HGF Módulo
MAPK Sobreactivaçã
o Síntese de nucleotídeos Transcrição génica Síntese proteica Activação do ciclo celular Proliferação, migração e invasão de células neoplásicas uroteliais Progressão no estadio e grau de indiferenciação, recidiva precoce, morte Raf cínases Tpl2, Mos MEKK 1-5 TAK 1 ASK 1 MLK 1-4 TAK 1 ASK 1 MEKK4 DK JNK 1-3 MKK 1,2 MKK 3, 4, 6 MKK 4, 7 p38 (, , , ) Jun RSK MEF 1 ATF 2 CHOP ERK 1, 2 Inflamação
Stress osmótico Factores de crescimentoCitoquinas Citoquinas pró-inflamatórias (TNF, IL-1) Radiação UV RAC 1 RAS GTP TRAF 6 TAB 1,2 Apoptose
Inibição do crescimento Sobrevivência celular,Crescimento e Diferenciação
Apoptose Inibição do crescimento
V. Bibliografia
1. Aguirre-Ghiso JA, Estrada Y, Liu D e Ossowski L. ERKMAPK activity as a determinant
of tumor growth and dormancy; Regulation by p38SAPK. Canc Res 2003; 63: 1684-1695.
2. Bell JT, Burney SW, Friedell GH. Blood invasion in human bladder cancer. J Urol 1971; 105: 675-8.
3. Bochner BH, Cote RJ, Weidner N, Groshen S, Chen SC, Skinner DG, Nichols PW. Angiogenesis in bladder cancer: relationship between microvessel density and tumor prognosis. J Natl Cancer Inst 1995; 87 (21): 1603-12.
4. Boucher MJ, Jean D, Vezina A e Rivard N. Dual role of MEK/ERK signaling in senescence and transformation of intestinal epithelial cells. Am J Physiol Gastrointest Liver Physiol 2004; 286(5): G736-746.
5. Bryan RT, Hussain SA, James ND, Jankowski JA, Wallace DMA. Molecular pathways in bladder cancer: part 1, BJU International 2005; 95: 485-490.
6. Bryan RT, Hussain SA, James ND, Jankowski JA, Wallace DMA. Molecular pathways in bladder cancer: part 2, BJU International 2005; 95: 491-496.
7. Buscarini M, Marcus L. Quek, Parkash Gill, Guangbin Xia, David I. Quinn, John P. Stein. Molecular prognostic factors in bladder cancer, BJU International 2005; 95, 739-742.
8. Cancer Research UK, CancerStats, December 2002.
9. Chen L, He HY, Li HM, Zheng J, Heng WJ, You JF e Fang WG. ERK1/2 and p38 pathways are required for P2Y receptor-mediated prostate cancer invasion. Cancer Lett 2004; 215(2): 239-247.
10. Cooke PW, James ND, Ganesan R, Wallace DMA, Burton A, Young LS. CD40 expression in bladder cancer. J Pathol 1999; 188: 38–43.
11. Durdux C, Housset M. Facteurs pronostiques des tumeurs infiltrantes de vessie. Cancer/Radiother 1998; 2: 491-8.
12. Eble JN, Young RH. Carcinoma of the urinary bladder: a review of its diverse morphology. Semin Diagn Pathol 1997; 14: 98–108.
13. Fossa SD, Whire H, Aass N. Bladder cancer definitive radiation therapy of muscle-invasive bladder cancer. Cancer 1993; 72: 3036-43.
14. Frazier HA, Robertson JE, Dodge RK, Paulson MS, Aans DF. The value of pathologic factors in predicting cancer specific survival among patients treated with radical cystectomy for transitional cell carcinoma of the bladder and prostate. Cancer 1993; 71: 3993-4001.
15. Fung CY, Shipley WU, Young RH et al. Prognostic factors in invasive bladder carcinoma in a prospective trial of preoperative adjuvant chemotherapy and radiotherapy. J Clin Oncol 1991; 9: 1533-42.
16. Gospodarowicz MK, Hawkins NV, Rawlings GA. Radical radiotherapy for muscle invasive transitional cell carcinoma of the bladder: failure analysis. J Urol 1989; 136: 1448-54.
17. Greenlee RT, Murray T, Bolden S, Wingo PA. Statistics 2000. CA Cancer J Clin 2000; 50: 7–33.
18. Grossman HB, Lee C, Bromberg J, Liebert M. Expression of the alpha-6-beta-4 integrin provides prognostic information in bladder cancer. Oncol Rep 2000; 7: 13–6.
19. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57–70.
20. Heney NM, Proppe K, Prout GR, Griffin PP, Shipley WU. Invasive bladder cancer: tumor configuration, lymphatic invasion and survival. J Urol 1983; 130: 897-7.
21. Housset M, Maulard C, Chrétien Y, Dufour B. Combined radiation and chemotherapy for invasive transitional-cell carcinoma of the bladder: a prospective study. J Clin Oncol 1993; 11: 2150-7.
22. Huot J, Houle F, Marceau F e Landry J. Oxidative stress-induced actin reorganization mediated by the p38 mitogen-activated protein kinase/heat shock protein 27 pathway in vascular endothelial cells. Circ Res 1997; 80:383-392.
23. Huot J, Houle F, Spitz DR e Landry J. HSP27 phosphorylation-mediated resistance against actin fragmentation and cell death induced by oxidative stress. Cancer Res 1996; 56: 273-279.
24. Ikenoue T, Hikiba Y, Kanai F, Tanaka Y, Imamura J, Imamura T, Ohta M, Ijichi H, Tateishi K, Kawakami T, Aragaki J, Matsumura M, Kawabe T e Omata M. Functional analysis of mutations within the kinase activation segment of B-Raf in human colorectal tumors. Cancer Res 2003; 63(23): 8132-8137.
25. Jahnson S, Pederson J, Westman G. Bladder carcinoma:a 20 year review of radical radiation therapy. Radiother Oncol 1991; 22: 111-7.
26. James M. Olson, Andrew R. Hallahan. P38 MAP kinase: a convergence point in câncer therapy, Trends in Molecular Medicine 2004; 10 (3).
27. Jaworski M, Buchmann A, Bauer P, Riess O e Schwarz M. B-Raf and Ha-ras mutations in chemically induced mouse liver tumors. Oncogene 2004; December.
28. Kaladhar B. Reddy, Sanaa M. Nabha, Natasha Atanaskova. Role of MAP kinase in tumor progression and invasion, Câncer and Metastasis Reviews 2003; 22: 395-403. 29. Kaminska K. MAPK signalling pathways as molecular targets for anti-inflamatory
therapy – from molecular mechanisms to therapeutic benefits, Biochimica et Biophysyca Acta 2005; 1754: 253-262.
30. Kaufman DS, Shipley WU, Althausen AF. Radiotherapy and chemotherapy in invasive bladder cancer with potential bladder sparing. Hematol Oncol clin North Am 1992; 6: 179-94.
31. Kaufman DS, Shipley WU, Griffin PP. Selective bladder preservation by combined modality treatment of invasive bladder cancer. N Engl J Med 1993; 329: 1377-81. 32. Kim TI, Jin SH, Kim WH, Kang EH, Choi KY, Kim HJ, Shin SK, Kang JK. Prolonged
activation of mitogen-activated protein kinases during NSAID-induced apoptosis in HT-29 colon cancer cells. Int J Colorectal Dis 2001; 16 (3):167-73.
33. Kramer BW, Gotz R e Rapp UR. Use of mitogenic cascade blockers for treatment of C-Raf induced lung adenoma in vivo: CI-1040 strongly reduces growth and improves lung structure. BMC Cancer 2004; 4 (1): 24.
34. Lancelin F, Anidjar M, Villette JM, Soliman A, Teillac P, Le Duc A, Fiet J, Cussenot O. Telomerase activity as a potential marker in preneoplastic bladder lesions. BJU Int 2000; 85 (4): 526-31.
35. Larsen MP, Steinberg GD, Brendler CB, Epstein JI. Use of Ulex europaeus agglutinin I (UEA) to distinguish vascular and pseudovascular invasion in transitional-cell carcinoma of bladder with lamina propria invasion. Mod Pathol 1990; 3: 83-88.
36. Mameghan H, Fisher RJ, Watt WH. The management of invasive transitional cell carcinoma of the bladder: results of definitive and preoperative radiation therapy in 390 patients treated at the Prince of Walles Hospital, Sydney, Australia. Cancer 1992; 69: 2771-8.
37. Medema RH, Bos JL. The role of p21-ras in receptor tyrosine kinase signalling. Crit Rev Oncog 1993; 4: 615–61.
38. Meloche S, Pouysségur J. The ERK1/2 mitogen-activated protein kinase pathway as a master regulator of the G1- to S-phase transition. Oncogene 2007; 26: 3227–3239.
39. ONS Report. Registrations of cancer diagnosed in 1993–96, England and Wales. Health Statistics Quarterly (Office for National Statistics) Winter, 1999.
40. Oosterlinck W, Lobel B, Jakse G, Malmstrom P, Stocklec M, Sternberg C. Guidelines on Bladder Cancer, Eur Urol 2002; 41:105-112.
41. Palou J, Bohle A, Witjes A, Colombel M, Brausi M, Lamm D, Persad R, Buckley, Akaza H, Soloway M. Diagnosis of Non-Muscle Invasive Bladder Cancer. Eur Urol Sup 2008; 7: 627-36.
42. Pashos CL, Botteman MF, Laskin MF, Redaelli A. Bladder Câncer: Epidemiology, Diagnosis, and Management. Cancer Practice 2002; 10 (6): 311-322.
43. Pouyssegur J, Volmat V, Lenormand P. Fidelity and spatio-temporal control in MAP kinase (ERKs) signalling. Biochem Pharmacol 2002; 64: 755–63.
44. Price DT, Rocca GD, Guo C, Ballo MS, Schwinn DA e Luttrell LM. Activation of extracellular signal-regulated kinase in human prostate cancer. J Urol 1999; 162 (4): 1537-1542.
45. Ramani P, Birch BRP, Harland SJ, Parkinson MC. Evaluation of endothelial markers in detecting blood and lymphatic channel invasion in pT1 transitionl carcinoma of the bladder. Hystopathology 1991; 19: 551-4.
46. Sebolt-Leopold J e Herrera R. Targeting the mitogen-activated protein kinase cascade to treat cancer. Nat Rev Canc 2004; 4: 937-947.
47. Sengelov L, Horn T, Steven K. p53 nuclear immunoreactivity as a predictor of response and outcome following chemotherapy for metastatic bladder cancer. J Cancer Res Clin Oncol 1997; 123: 565-70.
48. Shipley WU, Prout GR, Kaufman DS, Perone TL. Invasive bladder carcinoma: the importance of initial transurethral surgery and other significant prognostic factors for improved survival with full-dose irradiation. Cancer 1987; 60: 514.
49. Slack NH, Prout GR Jr. The heterogeneity of invasive bladder carcinoma and different responses to treatment. J Urol 1980; 123: 644-652.
50. Soloway MS, Lopez AE, Patel J, Lu Y. Results of radical cystectomy for transitional cell carcinoma of the bladder and the effect of chemotherapy. Cancer 1994; 73: 1926-31.
51. Stein JP, Grossfel GD, Ginsberg DA et al. Prognostic markers in bladder cancer: a contemporary review of the literature, J Urol 1998; 160 (3.1): 645-59.
52. Strumberg D, Richly H, Hilger RA, Schleucher N, Korfee S, Tewes M, Faghih M, Brendel E, Voliotis D, Haase CG, Schwartz B, Awada A, Voigtmann R, Scheulen ME, Seeber S. Phase I Clinical and Pharmacokinetic Study of the Novel Raf Kinase and Vascular Endothelial Growth Factor Receptor Inhibitor BAY 43-9006 in Patients With Advanced Refractory Solid Tumors. Clin Oncol 2004; December.
53. Swiatkowski S, Seifert HH, Steinhoff C, Prior A, Thievessen I, Schliess F, Schulz WA. Activities of MAP-Kinase Pathways in Normal Uroepithelial Cells and Urothelial Carcinoma Cell Lines, Experimental Cell Research 2003; 282: 48-57.
54. Torben F. Orntoft, Hans Wolf. Molecular alterations in bladder cancer, Urol Res 1998; 26, 223-233.
55. Trasher JB, Frazier HA, Robertson JE, Dodge RK, Paulson DF. Clinical variables which serve as predictors of cancer-specific survival among patients treated with radical cystectomy for transitional cell carcinoma of the bladder and prostate. Cancer 1994; 73: 1708-15.
56. Vihinen P, Kähäri VM. Matrix metalloproteinases in cancer: prognostic markers and therapeutic targets. Int J Cancer 2002 May; 99 (2): 157-66.
57. Wilhelm SM, Carter C, Tang L, Wilkie D, McNabola A, Rong H, Chen C, Zhang X, Vincent P, McHugh M, Cao Y, Shujath J, Gawlak S, Eveleigh D, Rowley B, Liu L,
Adnane L, Lynch M, Auclair D, Taylor I, Gedrich R, Voznesensky A, Riedl B, Post LE, Bollag G e Trail PA. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004 ; 64(19): 7099-7109.