FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
LUIS RAFAEL LEITE SAMPAIO
EFEITOS COMPORTAMENTAIS E NEUROQUÍMICOS DA
CLORPROMAZINA E CLOZAPINA NO MODELO DE ESQUIZOFRENIA INDUZIDO PELA CETAMINA EM CAMUNDONGOS
LUIS RAFAEL LEITE SAMPAIO
EFEITOS COMPORTAMENTAIS E NEUROQUÍMICOS DA
CLORPROMAZINA E CLOZAPINA NO MODELO DE ESQUIZOFRENIA INDUZIDO PELA CETAMINA EM CAMUNDONGOS
Dissertação apresentada como parte das exigências do Programa de Pós-Graduação em Farmacologia da Universidade Federal do Ceará, para obtenção do título de mestre em Farmacologia.
Orientadora: Profa. Dra. Silvânia Maria Mendes de Vasconcelos.
S184e Sampaio, Luis Rafael Leite
Efeitos comportamentais e neuroquímicos da clorpromazina e clozapina no modelo de esquizofrenia induzido pela cetamina em camundongos/ Luis Rafael Leite Sampaio. – Fortaleza, 2011.
84 f. : il.
Orientadora: Profa. Dra. Silvânia Maria Mendes de Vasconcelos Dissertação (Mestrado) - Universidade Federal do Ceará. Programa de Pós-Graduação em Farmacologia. Fortaleza, Ceará.
1. Esquizofrenia 2. Agentes Antipsicóticos 3. Ketamina 4. Comportamento 5. Estresse Oxidativo I. Vasconcelos, Silvânia Maria Mendes de (orient.) II. Título.
LUIS RAFAEL LEITE SAMPAIO
EFEITOS COMPORTAMENTAIS E NEUROQUÍMICOS DA
CLORPROMAZINA E CLOZAPINA NO MODELO DE ESQUIZOFRENIA INDUZIDO PELA CETAMINA EM CAMUNDONGOS
Dissertação submetida à coordenação do Programa de Pós-Graduação em Farmacologia da Universidade Federal do Ceará como requisito parcial para obtenção do título de mestre em farmacologia.
Dissertação aprovada com louvor em 26 de maio de 2011
BANCA EXAMINADORA
_______________________________________
Profa. Dra. Silvânia Maria Mendes Vasconcelos (Orientadora) Universidade Federal do Ceará
_________________________________________________ Profa. Dra. Danielle Silveira Macêdo
Universidade Federal do Ceará
__________________________________________________ Profa. Dra. Luiza Kalyne Almeida Moreira Leal
Dedico este trabalho a Deus pela iluminação necessária para sempre trilhar pelos caminhos do bem, justo e correto.
À minha família e, especialmente, aos meus pais por serem o título mais precioso oferecido gratuitamente por Deus para mim.
Ao amigo Antonio Mendonça pela convivência e força nos momentos de dificuldades e desânimo.
AGRADECIMENTOS
À Profa. Dra. Silvânia Maria Mendes de Vasconcelos, minha orientadora, pela qual tenho grande admiração e carinho. Obrigado por ter me oportunizado esse feito essencial em minha vida.
À Profa. Dra. Thereza Maria Magalhães Moreira pelo apoio, confiança, amizade e, principalmente, o incentivo para realização deste sonho.
À Profa. Ms. Márcia Calheiros e a Profa. Ms. Rita Neuma Dantas meu sincero agradecimento por me terem acolhido no laboratório e pelo período de convivência. Ao Prof. Ms. Eduardo pela gentileza de ter me orientado os primeiros passos com a pesquisa experimental.
À Profa. Dra. Danielle Silveira Macedo pelas orientações durante a realização deste trabalho e por gentilmente ter aceitado participar da minha banca examinadora.
À Profa. Dra. Luiza Kalyne Almeida Moreira Leal por gentilmente ter aceitado participar da minha banca examinadora.
Ao Prof. Dr. Krishnamurti de Morais Carvalho por gentilmente ter aceitado participar da minha banca examinadora.
À Profa. Dra. Lissiane Magna Vasconcelos de Aguiar pelas excelentes aulas na especialização em Enfermagem Clínica pela Universidade Estadual do Ceará e por gentilmente ter aceitado participar da minha banca de qualificação.
Ao Paulo Victor que muito me ajudou na realização deste trabalho.
Meus sinceros agradecimentos aos bolsistas de Iniciação Científica-Júnior, Thais,
Laísa e Gabriel, que sem eles este trabalho teria sido muito mais árduo.
A todos os bolsistas do laboratório pela ajuda em alguns experimentos.
Ao Valmor Carvalho pela amizade e seu excelente trabalho junto aos pós-graduandos da Neurofarmacologia e no laboratório.
À Vilani e Arnaldo por muito colaborarem para organização do laboratório. Às secretarias Áurea e Márcia pela ajuda e amizade.
A todos os professores e funcionários do Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará.
“Às vezes, construímos sonhos em cima de grandes pessoas...
O tempo passa... e descobrimos que grandes mesmo eram os
sonhos e as pessoas pequenas demais para torná-los reais!”
RESUMO
Efeitos neurocomportamentais e neuroquímicos da clorpromazina e clozapina no modelo de esquizofrenia induzido pela cetamina em camundongos. LUIS RAFAEL LEITE SAMPAIO. Orientadora: Profa. Dra. Silvânia Maria Mendes de Vasconcelos. Dissertação. Programa de Pós-Graduação em Farmacologia. Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará, para obtenção do título de mestre em Farmacologia, UFC, 2011.
A esquizofrenia é um transtorno mental crônico, grave e incapacitante que afeta cerca de 1% da população mundial, cujos sintomas podem ser induzidos pela Cetamina. Neste sentido, há evidências de que o estresse oxidativo tenha importante papel na patogênese desta doença. Desta forma, o presente estudo avaliou os efeitos neurocomportamentais e neuroquímicos, através da determinação de parâmetros do estresse oxidativo, após administração aguda da Clorpromazina (Cp) ou Clozapina (Cz), no modelo de esquizofrenia induzido pela Cetamina (Ket) em camundongos. Este estudo examinou alterações neurocomportamentais, após administração de Cp (1 ou 5mg/Kg, ip) ou Cz (5 ou 10mg/Kg, ip), sozinhos ou 30 minutos antes da Ket (10mg/kg, i.p) em camundongos, e no estresse oxidativo após administração de esquema anterior incluindo Vitamina E (Vit E) (400 mg/kg) sozinha ou 30 minutos antes da Ket. Os resultados mostraram que a Cetamina induziu a hiperlocomoção e aumentou o número de rearring e grooming no teste de campo aberto. No teste de suspensão de cauda, a Cetamina diminuiu o tempo de imobilidade. Sendo esses efeitos bloqueados pela Cp ou Cz nos testes neurocomportamentais. Em adição as mudanças comportamentais, a cetamina induziu aumento na peroxidação lipídica, atividade da catalase e concentração de nitrito. A Cp ou Cz reverteram os efeitos da Cetamina sobre estresse oxidativo. Em conclusão, os resultados confirmam efeitos semelhantes à Esquizofrenia, atividade antidepressiva e pro-oxidativa pela cetamina e reversão destes efeitos pela Cp ou Cz.
Palavras - chave: Esquizofrenia. Antipsicóticos. Cetamina. Comportamento.
Neurobehavioral and neurochemical effects of chlorpromazine and clozapine in the model of schizophrenia induced by ketamine in mice. LUIS RAFAEL LEITE SAMPAIO.Supervisor: Profa. Dra. Silvânia Maria Mendes de Vasconcelos. Dissertation. Program of post-graduation in pharmacology. Departament of physiology and pharmacology, UFC, 2011.
Schizophrenia is a serious and debilitating chronic mental disease, affecting about 1% of the world population and whose symptoms can be induced by ketamine. In this sense, evidences show that oxidative stress has an important role in the pathogenesis of this condition. Thus, this study evaluated the neurobehavioral and neurochemical effects, through the dosage of oxidative stress, after acute administration of Chlorpromazine (Cp) or Clozapine (Cz), in a model of schizophrenia induced by ketamine (Ket) in mice. Neurobehavioral changes were examined after administration of Cp (1 or 5 mg/Kg, ip) or Cz (5 or 10 mg/Kg, ip), either alone or 30 minutes before Ket (10mg/kg, ip) in mice, and during oxidative stress after administration of the previous scheme including Vitamin E (Vit E) (400 mg/Kg) alone or 30 minutes before the Ket. Results showed that ketamine induced hyperlocomotion and increased the number of rearring and grooming events in the open field test and decreased the immobility time in the tail suspension test. Interestingly, these effects were blocked by Cp or Cz administration in the neurobehavioral tests. In addition to the behavioral changes, ketamine induced increase in lipid peroxidation, catalase activity and nitrite concentration. Again, either Cp or Cz reversed the effects of ketamine, this time on oxidative stress. In conclusion, these findings demonstrate effects similar to schizophrenia, antidepressant activity and pro-oxidative conditions induced by ketamine and reversal of these effects by Cp or Cz.
LISTA DE FIGURAS
1 Vias Centrais de Dopamina... 18
2 Funções das Vias Centrais de Dopamina... 19
3 Famílias de receptores de dopamina... 22
4 Síntese do glutamato via -cetoglutarato... 23
5 Síntese do glutamato via células da glia... 24
6 Representação gráfica do receptor NMDA... 25
7 Imagem representativa de encéfalo humano em corte coronal, indicando possíveis alterações morfológicas ocorridas em indivíduos com esquizofrenia, dentre as quais, dilatação dos ventrículos, volume do córtex e hipocampo reduzidos e alargamento dos sulcos corticais... 28
8 Representação hipotética associando a hipofunção cortical (redução da atividade de receptores NMDA) e os sintomas da esquizofrenia 29 9 Esquema alusivo ao controle irregular do sistema dopaminérgico na esquizofrenia... 30
10 Esquema representativo de circuitos neuroniais e neurotransmissores que participam na gênese da esquizofrenia... 31
11 Tratamento dos grupos experimentais para estudo comportamental 44 12 Tratamento dos grupos experimentais para estudo neuroquímico... 45
13 Arena para teste de campo aberto... 46
14 Barra para teste de Rota Rod... 47
15 Barra horizontal para teste de catalepsia... 47
16 Plataforma para teste de suspensão de cauda... 48
17 Efeito das drogas antipsicóticas e cetamina no teste de catalepsia em camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg)... 56
18 Efeito das drogas antipsicóticas e cetamina no teste de suspensão de cauda em camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg)... 58
19 Peroxidação lipídica no córtex pré-frontal (CPF) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg)... 60
21 Peroxidação lipídica no corpo estriado (CE) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina
(5 ou 10 mg/kg)... 62 22 Atividade da catalase no córtex pré-frontal (CPF) de camundongos
tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina
(5 ou 10 mg/kg)... 64 23 Atividade da catalase no hipocampo (HC) de camundongos tratados
com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10
mg/kg)... 65 24 Atividade da catalase no corpo estriado (CE) de camundongos
tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina
(5 ou 10 mg/kg)... 66 25 Concentração de Nitrito no córtex pré-frontal (CPF) de
camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5
mg/kg) ou clozapina (5 ou 10 mg/kg)... 68 26 Concentração de Nitrito no hipocampo (HC) de camundongos
tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina
(5 ou 10 mg/kg)... 69 27 Concentração de Nitrito no corpo estriado (CE) de camundongos
tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina
LISTA DE TABELAS
1 Efeitos do pré-tratamento com antipsicóticos sob a hiperlocomoção induzida pela cetamina no teste de campo aberto em
camundongo... 52 2 Efeitos dos antipsicóticos e cetamina no teste de rota Rod em
LISTA DE ABREVIATURAS E SIGLAS
AMPA - ácido -amino-3-hidroxi-5-metil-4-isoxazol propiônico AMP - adenosina monofosfato
ASP - aspartato
ATP - adenosina trifosfato CE - corpo estriado
cGMP - guanina monofosfato cíclica COMT - Catecolamina O-metiltransferase Control - controle
Cp - clorpromazina CPF - córtex pré-frontal Cz - clozapina
DA – dopamina DAG - diacilglicerol
DOPAC - ácido 3, 4-dihidroxifenilacético GABA - ácido gama-amino-butírico GABA-T- GABA transaminase
GAD - descarboxilase do ácido glutâmico GLN – glutamina
GMPc - Guanosina monofosfato cíclico GLU – glutamato
GPX - glutationa peroxidase H2O - água
HC - hipocampo
HCLO4 - ácido perclórico HVA - ácido homovanílico IP3 - inositol-trifosfato Ket - cetamina
NE - norepinefrina
NMDA - N-metil-D-aspartato NO – óxido nítrico
NOS - óxido nítrico sintetase PKC – proteína cinase C RL - radical livre
RNS - espécies reativas de nitrogênio ROS – espécies reativas de oxigênio SNC - sistema nervoso central
SOD – superóxido dismutase
SSADH - desidrogenase do semi-aldeído succínico TBARS – substancias reativas ao ácido tiobarbitúrico UFC - Universidade Federal do Ceará
SUMÁRIO
1 INTRODUÇÃO... 16
1.1 Esquizofrênia... 16
1.1.1 Fisiopatologia da Esquizofrenia... 17
1.1.1.1 Sistema Dopaminérgico... 17
1.1.1.2 Sistema Glutamatérgica... 20
1.2 Principais Estruturas Cerebrais Relacionadas à Esquizofrenia 26 1.3 Tratamento da Esquizofrenia... 32
1.4 Modelo Farmacológico de Esquizofrenia... 34
1.5 Estresse Oxidativo e Esquizofrenia... 36
2 RELEVÂNCIA E JUSTIFICATIVA... 39
3 OBJETIVOS... 41
3.1 Geral... 41
3.2 Específicos... 41
4 METODOLOGIA... 42
4.1 Animais... 42
4.2 Drogas e Tratamento... 42
4.3 Procedimento... 42
4.4 Estudo Comportamental... 46
4.4.1 Teste de Campo Aberto... 46
4.4.2 Teste de Rota Rod... 46
4.4.3 Teste de Catalepsia... 47
4.4.4 Teste de suspensão de cauda... 48
4.5 Estudo Neuroquímico... 49
4.5.1 Mensuração da Peroxidação Lipídica... 49
4.5.2 Avaliação da Atividade da Catalase... 49
4.5.3 Determinação de Nitrito/Nitrato... 49
4.6 Análise Estatística... 50
5 RESULTADOS... 51
5.1 Estudo Comportamental... 51
5.1.2 Teste de Rota Rod... 53
5.1.3 Teste de Catalepsia... 55
5.1.4 Teste de Suspensão de Cauda... 57
5.2 Estudo Neuroquímico... 59
5.2.1 Determinação da Peroxidação Lipídica (TBARS)... 59
5.2.2 Avaliação da Atividade da Catalase... 63
5.2.3 Concentração de Nitrito/nitrato... 67
6 DISCUSSÃO... 71
7 CONCLUSÃO... 76
1.1 Esquizofrenia
A Esquizofrenia é um transtorno mental crônico, grave e incapacitante que afeta cerca de 1% da população mundial (MCGRATH et al., 2008; HARRISON; WEINBERGER, 2005) aproximadamente 24 milhões de pessoas em todo o mundo, principalmente na faixa etária dos 15-35 anos (WHO, 2010). O surgimento da psicose ocorre na idade adulta (DO et al., 2009). Estudos mostram que a prevalência ocorre em partes iguais entre homens e mulheres, embora o início tenda a ser mais tarde nas mulheres, que também tendem a ter um melhor curso para esta desordem (WHO, 2009).
O termo Esquizofrenia foi utilizado inicialmente pelo psiquiatra suíço, Eugen Bleuler em 1911, aplicando-o para pacientes que apresentavam uma desconexão entre os processos de pensamentos e respostas emotivas, substituindo o termo de “Demência Precoce” definido por Kraeplin, para um quadro com psicoses associadas com a perda das capacidades previamente adquiridas, ocorrendo em adultos jovens (precocemente) (VALLS, 2010).
Seu diagnóstico depende da exclusão de doença cerebral orgânica e da ocorrência de sintomas característicos, que são variáveis em cada indivíduo. Os subtipos de esquizofrenia são definidos por seus sintomas predominantes, classificando-os de acordo com DSM-IV ou a CID-10 em: hebefrênico, catatônico, desorganizado, paranóide, indiferenciado e simples (FALKAI et al., 2006).
1.1.1 Fisiopatologia da Esquizofrenia
A compreensão da fisiopatologia da esquizofrenia avançou no último século, evoluindo de teorias etiológicas unicausais para modelos mais complexos (ARARIPE NETO et al., 2007). Pesquisas têm procurado determinar o papel de variáveis biológicas específicas, tais como os fatores genéticos e bioquímicos e as alterações sutis na morfologia cerebral (FALKAI et al., 2006). No entanto, várias são as teorias que tentam explicar a esquizofrenia, dentre essas a hipótese dopaminérgica e glutamatérgica têm sido as mais estudadas.
1.1.1.1 Sistema Dopaminérgico
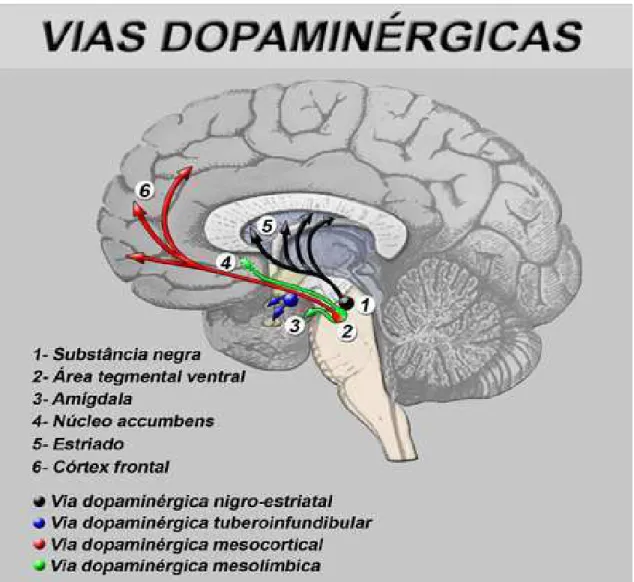
A dopamina é uma catecolamina que exerce importantes funções no sistema nervoso (SILVA, 2006). É encontrada no corpo estriado, no sistema límbico e hipotálamo, sendo sintetizada por neurônios cujos corpos localizam-se no tronco cerebral e se projetam por diferentes vias (mesolímbica, mesocortical, nigroestriatal, sistema tubero infundibular, medular-periventricular e incerto-hipotalâmica) (fig. 01), sendo que as duas primeiras vias estão alteradas na esquizofrenia e as três últimas encontram-se normais. As funções destas vias encontram-se descritas na figura 02 (MOREIRA; GUIMARÃES, 2007).
Figura 1: Vias Centrais de Dopamina
Figura 2: Funções das Vias Centrais de Dopamina
É metabolizada pelas enzimas monoamina oxidase (MAO) no meio intracelular, e pela catecolamina O-metiltransferase (COMT) no meio extracelular (MOREIRA; GUIMARÃES, 2007). Os principais produtos do metabolismo são: ácido diidroxifenilacético (DOPAC) e o ácido homovanílico (HVA) (RANG et al., 2007).
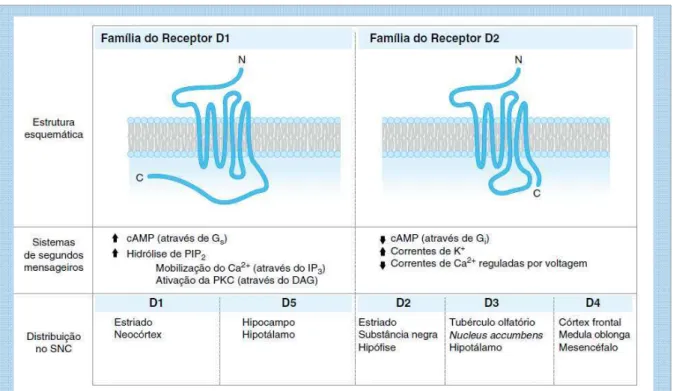
Atualmente, são conhecidos cinco subtipos de receptores dopaminérgicos (fig. 03), todos eles acoplados a uma proteína G, estes compõe duas famílias D1-like (formada pelos receptores D1 e D5) e D2-like (constituída pelos receptores D2, D3 e D4) (JONES; PILOWSKY, 2002). Os receptores da família D1-like seu mecanismo de transdução é responsável pela ativação de adenilato ciclase (MOREIRA; GUIMARÃES, 2007) gerando o aumento do nível intracelular AMP cíclico. Enquanto a famíla D2-like inibem a adenilato ciclase e diminuem o AMP cíclico intracelular (MATTOS; MATTOS, 1999).
A relação do sistema dopaminérgico com a esquizofrenia é fundamentada em uma série de observações, sendo que a hipótese mais importante é de que todos os atuais antipsicóticos estão vinculados ao bloqueio do receptor dopaminérgico D2 (MIYAMOTO et al., 2002).
1.1.1.2 Sistema Glutamatérgico
O glutamato é o aminoácido neurotransmissor mais abundante no cérebro de mamíferos. Existem dois tipos de receptores de glutamato: receptores ionotrópicos e metabotrópicos (LIN; LANE; TSAI, 2011).
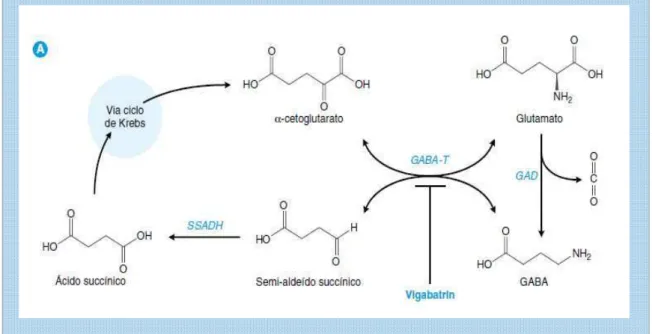
A síntese do Glutamato ocorre através de duas vias distintas. Em uma das vias, -cetoglutarato produzido pelo ciclo de Krebs atua como substrato para a enzima GABA transaminase (GABAT), que transamina de modo redutivo o -cetoglutarato intraneuronal a glutamato. Alternativamente, o glutamato é convertido em GABA pela enzima descarboxilase do ácido glutâmico (GAD), transformando o principal neurotransmissor excitatório no principal transmissor inibitório. A GABA-T converte o GABA em semialdeído succínico e este é convertido em ácido succínico pela enzima desidrogenase do semi-aldeído succínico (SSADH) (fig. 4) (GOLAN et al., 2009).
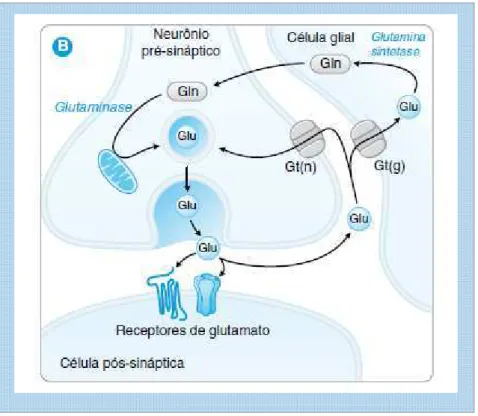
para suas respectivas células. Na célula glial, a enzima glutamina sintetase transforma o glutamato em glutamina (Gln). A seguir, a glutamina é transferida para o neurônio, que a converte novamente em glutamato através da glutaminase associada às mitocôndrias (fig. 5) (GOLAN et al., 2009).
Evidências sobre o envolvimento do sistema glutamatérgico na esquizofrenia centra-se nos receptores ionotrópicos que são subdivididas em três subtipos:N-metil-D aspartato (NMsubtipos:N-metil-DA), ácido -amino-3-hidroxi-5-metil-4-isoxazol propiônico (AMPA) e cainato (LODGE, 2009). Sendo o receptor NMDA o subtipo mais estudado e relevante para entender a fisiopatologia da esquizofrenia (LIN; LANE; TSAI, 2011).
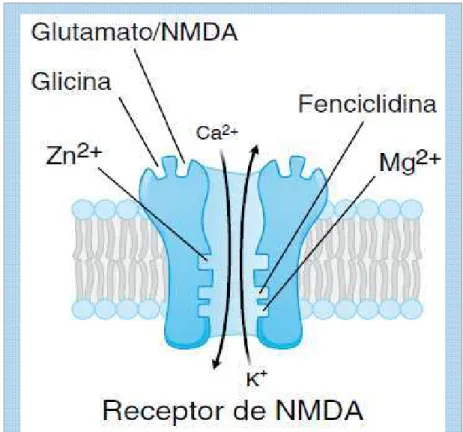
Os receptores NMDA consistem em complexos transmembrana oligoméricos, compostos de múltiplas subunidades incluindo NR1 e um dos dois, NR2 (NR2 A-D) ou NR3 (NR3 A-B) (LAURIE; SEEBURG, 1994 apud LIN; LANE; TSAI, 2011), (GOLAN, 2008). São expressos primariamente no hipocampo, no córtex cerebral e na medula espinhal. A ativação deste receptor exige a ligação simultânea de glutamato e glicina, abre um canal que permite o efluxo de K+, bem como o influxo de Na+ e Ca2+ (fig. 6) (GOLAN et al., 2009).
Não só glutamato, mas vários outros aminoácidos excitatórios estão envolvidos na neurotransmissão do glutamato via receptores NMDA. Glicina (um aminoácido não essencial que funciona como um co-agonista obrigatória nos receptores NMDA), serina (um co-agonista que aumenta a atividade do receptor NMDA através de ligação para o sítio glicinaB), e alanina (um agonista que se liga ao sítio de glicina nos receptores NMDA) também são considerados envolvidos na hipofunção de receptores NMDA, em pacientes com esquizofrenia. Estes aminoácidos têm sido estudados em detalhe em vivo e in vitro para melhor compreensão da fisiopatologia e identificação de um marcador biológico para a esquizofrenia (OHNUMA; ARAI, 2011).
A teoria da hipofunção dos receptores NMDA é fundamentada pela evidência de que antagonistas dos receptores NMDA como a PCP e a cetamina, induzem a mudanças comportamentais que se assemelham a esquizofrenia (LIN; LANE; TSAI, 2011; ARRUDA et al., 2008).
Figura 3: Famílias de receptores de dopamina
Figura 4: Síntese do glutamato via -cetoglutarato
Figura 5: Síntese do glutamato via células da glia
Figura 6: Representação gráfica do receptor NMDA
A Esquizofrenia é um transtorno do neurodesenvolvimento, resultando em controle irregular, principalmente, do pré-frontal, hipocampo e região cortical associada à atividade dopaminérgica aumentada (LODGE; GRACE, 2008).
As áreas mais consistentemente implicadas têm sido as porções mediais dos lobos temporais, sobretudo hipocampo e giro para-hipocampal (SILVA, 2006) córtex
pré-frontal e o sistema límbico (GOTHELF et al., 2000). Estudos em encéfalos post
mortem de indivíduos com esquizofrenia, mostram alterações morfológicas, como
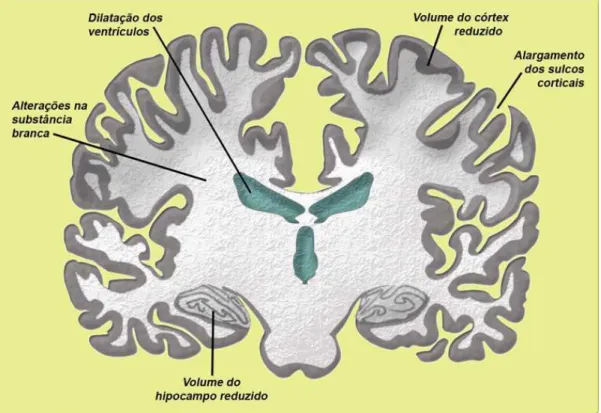
dilatação do terceiro ventrículo e ventrículos laterais, diminuição do volume e área, particularmente nos lobos temporais mediais (formação hipocampal, subiculum e giro parahipocampal) e redução no número e tamanho de células no hipocampo, giro parahipocampal e córtex entorrinal. Existe também evidência de redução moderada do lobo frontal nas regiões pré-frontal e orbitofrontal (fig. 07) (GUIZZO, 2009; SILVA,
2006; ARARIPE NETO et al., 2007; FATEMI; FOLSOM, 2009).
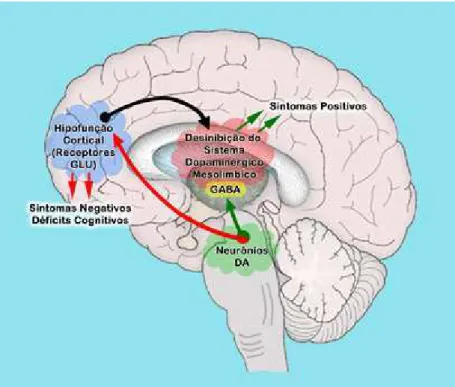
A hipofunção cortical glutamatérgica repercute sobre o trato mesolímbico dopaminérgico (originários da área tegmental ventral do mesencéfalo e com projeções para regiões límbicas) determinando a desinibição do sistema mesolímbico e o consequente aparecimento dos sintomas positivos (fig. 8) (DAVIS et al., 1991).
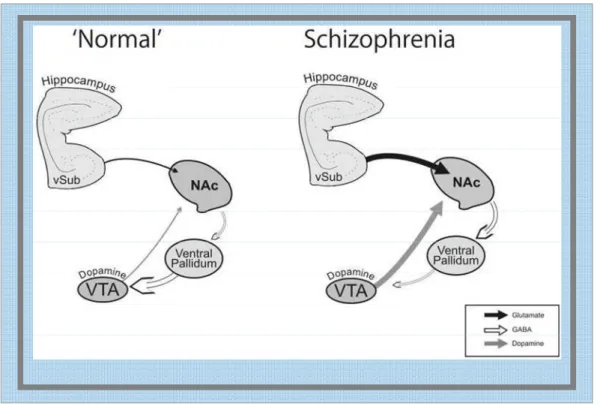
Neste sentido, a diminuição da atividade glutamatérgica pode ter efeito na atividade da via dopaminérgica (desinibição do sistema dopaminérgico mesolímbico) e consequentemente causar os sintomas psicóticos. Na verdade, o subiculum ventral (vSub) do hipocampo é uma região que modula a atividade dos neurônios do sistema dopaminérgico (fig. 9) (LODGE; GRACE, 2006). Estudos em roedores têm demonstrado que a ativação do NMDA subiculum ventral aumenta significativamente a atividade da população de neurônios dopaminérgicos, que está correlacionada com o aumento de efluxo de dopamina no núcleo accumbens. Como o hipocampo não inerva diretamente a Área Tegumentar Ventral (VTA), tem sido sugerido que a modulação do vSub e a atividade dos neurônios dopaminérgicos é dependente de uma projeção polisinaptica (vHipp-NAC-VP) (fig. 9) (FLORESCO et al., 2003; LODGE; GRACE, 2006).
cognitivos) determina o predomínio da atividade dopaminérgica no sistema límbico (sintomas positivos). Isto pode explicar o surgimento sequencial de sintomas positivos e negativos no curso da esquizofrenia (fig. 8) (GUIZZO, 2009).
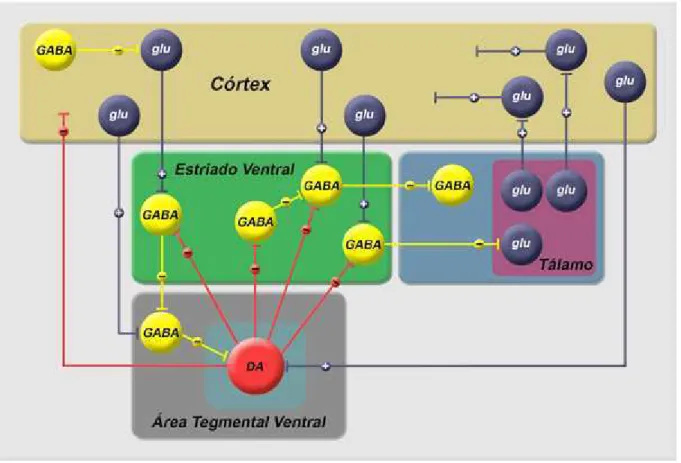
Projeções glutamatérgicas corticais (excitatórias) ativam as vias dopaminérgicas na área tegmental ventral. A dopamina atua inibindo o estriado ventral e este o tálamo, estrutura que transmite as informações sensoriais para o córtex. Se um excesso da transmissão tálamocortical ocorrer, devido à diminuição da atividade glutamatérgica e aumento da função dopaminérgica (desinibição da via dopaminérgica mesolímbica), sintomas positivos podem aparecer (fig. 10) (MOORE; WEST; GRACE, 1999; GUIZZO, 2009).
Figura 7: Imagem representativa de encéfalo humano em corte coronal, indicando possíveis
alterações morfológicas ocorridas em indivíduos com esquizofrenia, dentre as quais, dilatação dos
ventrículos, volume do córtex e hipocampo reduzidos e alargamento dos sulcos corticais.
Figura 8: Representação hipotética associando a hipofunção cortical (redução da atividade de
receptores NMDA) e os sintomas da esquizofrenia.
Figura 9: Esquema alusivo ao controle irregular do sistema dopaminérgico na esquizofrenia
Figura 10: Esquema representativo de circuitos neuroniais e neurotransmissores que participam na
gênese da esquizofrenia.
1.3 Tratamento da Esquizofrenia
Até a introdução dos antipsicóticos na prática clínica o tratamento para a Esquizofrenia consistiu em fornecer aos pacientes um ambiente seguro e de suporte, como as longas estadias em hospitais psiquiátricos, esperando a remissão espontânea (TANDON; NASRALLAH; KESHAVAN, 2010).
A descoberta dos neurolépticos, em 1952, marca o início da psicofarmacologia contemporânea. Nessa época, o cirurgião francês Henri Laborit utilizava uma mistura de drogas, que denominava “coquetel lítico”, para abrandar reações neurovegetativas de pacientes submetidos a cirurgias prolongadas realizadas a baixas temperaturas – a assim chamada “hibernação artificial”. Desta mistura participava o composto anti-histamínio prometazina. Ao observar os efeitos de seu análogo químico, clorpromazina, Laborit notou que os pacientes ficavam em estado peculiar, que passou a ser conhecido como síndrome neuroléptica, caracterizada por indiferença emocional, sem diminuição importante da vigilância. Esta observação casual despertou a curiosidade de Laborit, que sugeriu a dois colegas psiquiatras, Jean Delay e Pierre Deniker, o uso experimental da droga em pacientes mentais. Surpreendentemente, muitos desses pacientes apresentaram melhora considerável, e puderam mesmo retornar ao convívio social. A notícia logo se propagou, e o uso da clorpromazina e de seus análogos difundiu-se pelo mundo (SILVA, 2006).
Atualmente, o tratamento da Esquizofrenia implica em múltiplas abordagens, incluindo desde medicamentos a intervenções psicossociais. Sendo que os objetivos gerais do tratamento são reduzir a mortalidade e morbidade da doença, diminuindo a freqüência e severidade dos episódios de exacerbação psicótica e melhorar a capacidade funcional e a qualidade de vida dos indivíduos afetados com a doença (TANDON; NASRALLAH; KESHAVAN, 2010).
Esses fármacos são classificados em antipsicóticos típicos ou de primeira geração e antipsicóticos atípicos ou de segunda geração (KEEFE et al., 2007). Os antipsicóticos de primeira geração são classificados em fenotiazinas (clorpromazina, levomepromazina, promazina, pericyazine, pipotiazine, flufenazina, proclorperazina, perfenazina e trifluoperazina), butirofenonas (haloperidol e benperidol), difenilbutilpiperidinas (pimozida), thioxantenes (flupentixol e zuclopentixol) e benzamidas substituídas (sulpirida). Antipsicóticos de segunda geração incluem amisulprida, clozapina, aripiprazol, olanzapina, risperidona, quetiapina, ziprasidona, sertindol, zotepina (WHO, 2009).
Os antipsicóticos típicos e atípicos parecem ser igualmente eficazes para o tratamento dos sintomas positivos, via inibição do sistema mesolímbico dopaminérgico. São diferentes no que diz respeito à ocorrência de efeitos colaterais neurológicos. Entretanto, os atípicos parecem ser mais eficazes nos sintomas negativos e de deterioração cognitiva (KEEFE et al., 2007).
Todos os antipsicóticos apresentam capacidade de interagir com os receptores de dopamina D2, um componente que é considerado essencial para a atividade destes fármacos (KAPUR, 2004). Desta forma, as decisões sobre o tratamento antipsicótico implicam num processo de tentativa e erro, com monitorização cuidadosa da resposta clínica e efeitos adversos e avaliação do risco-benefício (TANDON; NASRALLAH; KESHAVAN, 2010).
Neste contexto, as medicações antipsicóticas causam uma série de alterações neurológicas, metabólicas, cardiovasculares, gastrintestinais, hematológicos, genito-urinário, músculo-esquelético, endócrino e outros efeitos colaterais (TANDON; NASRALLAH; KESHAVAN, 2010).
antagonismo do receptor 5HT2A contribui para a menor incidência dos sintomas extrapiramidais (EPS) encontrados com os antipsicóticos atípicos. Por outro lado, o bloqueio dos receptores H1 da histamina ou serotonina 5HT2C tem sido associada com o ganho de peso observado com alguns atípicos, como a clozapina e a olanzapina (KIM et al., 2007).
Alterações fatais pelo uso de antipsicóticos de segunda geração, especialmente a síndrome metabólica, limitam o uso clínico desses agentes (NEWCOMER, 2007; SIMON et al., 2009).
Desta forma, para início da terapêutica com antipsicóticos, faz-se necessário a verificação do peso e da pressão arterial, monitoramento do eletrocardiograma (obrigatória em alguns países para antipsicóticos específicos, por exemplo, haloperidol), hemograma completo, uréia e eletrólitos, creatinina fosfoquinase, testes de função hepática, glicemia, perfil lipídico e prolactina. Se estes exames laboratoriais não são viáveis, os prestadores de cuidados devem investigar sobre a existência de anomalias cardiovasculares, renais ou hepáticas (WHO, 2009). Para clozapina, torna-se indispensável e/ou obrigatório, em muitos países, a solicitação de hemograma completo. Caso não seja possível, este fármaco não deve ser prescrito (WHO, 2009).
1.4 Modelo Farmacológico de Esquizofrenia
Um modelo é definido como qualquer preparação experimental para estudar condições particulares ou fenômenos na mesma ou em diferentes espécies (GEYER; MOGHADDAM, 2002). Podendo ser desenvolvido em indivíduos humanos, em animais de laboratório ou mesmo em culturas de células e até em simulações matemáticas no computador. Nos modelos de transtornos mentais, o efeito produzido lembra apenas distante ou maneira indireta o que acontece no indivíduo (SALGADO et al., 2006).
modelo animal para o estudo da doença psiquiátrica no laboratório. Infelizmente no grupo da esquizofrenia, devido à heterogenicidade da doença e a sua complexidade clínica, existe uma multiplicidade de fatores que não podem ser reproduzidos na realidade dos animais (GEYER; MOGHADDAM, 2002).
Diversos modelos experimentais são utilizados tanto em humanos como em animais para se investigar as bases neuroquímicas e neurofisiológicas de sintomas desta desordem, assim como dos efeitos colaterais dos antipsicóticos (SALUM et al., 2008). Os modelos farmacológicos e alterações neuroquímicas da esquizofrenia consistem: na hiperatividade da transmissão de dopamina resultando em sintomas positivos, na hipótese glutamatérgica, sugerindo uma deficiência na função dos receptores de glutamato e gabaérgica (BECKER et al., 2003).
Nesta perspectiva, a pesquisa em animais representa uma abordagem para o estudo das bases neurobiológicas do cérebro e dos distúrbios comportamentais relevantes para a Esquizofrenia, e para estabelecer e avaliar novas terapias farmacológicas para seu tratamento (MEYER; FELDON, 2010). O uso de modelos animais permite um controle experimental rigoroso e facilita a identificação de fatores neurobiológicos relacionados com a Esquizofrenia e outras anormalidades comportamentais (MEYER; FELDON, 2010).
O modelo farmacológico da esquizofrenia consiste na administração aguda ou crônica de antagonista de receptores de NMDA, causando hipofunção desses receptores. Fundamentando-se, desta forma, na hipótese glutamatérgica da esquizofrenia, a qual presume que a inibição dos receptores de NMDA modula o sistema dopaminérgico mesolímbico levando ao quadro de psicose (BUBENÍHOVÁ-VALESOVÁ et al., 2008).
método econômico para simular domínios específicos dos sintomas deste transtorno em roedores para triagem de drogas potencialmente antipsicótica (CHATTERJEE; GANGULY et al., 2010). Seu uso altera o comportamento em humanos e animais e induz Esquizofrenia-smile (COYLE et al., 2004; CHATTERJEE et al., 2010). Seus efeitos sistêmicos ocorrem, principalmente, devido ao bloqueio dos receptores glutamatérgicos NMDA (VASCONCELOS et al., 2003). Dados de estudo anterior demonstraram que doses sub-anestésica de cetamina (4 e 10 mg / kg) aumentaram a peroxidação lipídica, produto que contribui para instalação do estresse oxidativo (OLIVEIRA et al., 2009). Neste contexto, sugere-se que a inibição dos receptores NMDA pode está relacionada à cascata oxidativa que possui papel importante na patogênese da esquizofrenia.
1.5 Estresse Oxidativo e Esquizofrenia
Radical livre (RL) é um átomo ou molécula com orbital mais externo não emparelhamento que lhe confere alta reatividade. Nos mamíferos são produzidos RL de diferentes átomos, mas os que ganham destaque em razão de sua reatividade e dos danos que podem causar são os radicais derivados do oxigênio (AGUIAR et al., 2010).
Nesse sentido, o estresse oxidativo e nitrosativo são resultado de um desequilíbrio entre o excesso de produção de espécies reativas de oxigênio (ROS) e espécies reativas de nitrogênio (RNS) de um lado e a deficiência de antioxidantes enzimáticos e não-enzimática do outro lado (VALKO et al., 2007; BERK et al., 2008). Conduzindo a oxidação de lipídios, proteínas e DNA (VALKO et al., 2007) e o resultado desse processo encontra-se no dano oxidativo celular e seqüelas relacionadas que variam de disfunção celular à morte celular (BERK et al., 2008).
catalase e os antioxidantes não enzimáticas que incluem GSH, ácido ascórbico (vitamina C), -tocoferol (vitamina E), carotenóides e flavonóides (DO et al., 2009).
Como a medição direta da concentração de radicais livres não é viável por causa da sua meia-vida curta e em baixas concentrações, o estresse oxidativo é avaliado por meio de ensaios de metabólitos reativos de espécies (por exemplo, metabólitos do óxido nítrico), enzimas antioxidantes (por exemplo, superóxido dismutase, catalase e glutationa peroxidase), antioxidantes (por exemplo, GSH, vitaminas C e E, albumina, bilirrubina) e produtos de oxidação (produtos de peroxidação lipídica por exemplo) (BERK et al., 2008).
Estudos mostram que o estresse oxidativo tem papel importante na fisiopatologia da esquizofrenia (CHITTIPROL et al.; 2009, PADURARIU et al., 2010) e de outras alterações mentais, uma vez que o cérebro é particularmente vulnerável ao dano oxidativo devido à sua alta utilização de oxigênio, seu alto teor de oxidáveis ácidos graxos polinsaturados e a presença de metais redox-ativa (Cu e Fe) (DO et al., 2009).
Outra importante antioxidante em sistemas biológicos é o NO, que é uma molécula mensageira envolvida em muitos processos fisiológicos e patológicos no organismo de mamíferos, benéficos e prejudiciais (MUSTAFA et al., 2009; SHAHANI; SAWA, 2011). Estudos post-mortem têm demonstrado níveis elevados de NO e NOS em tecidos cerebrais de indivíduos com esquizofrenia e têm sugerido que a NOS pode ser ativada na doença (BABA et al., 2004; YAO et al., 2004; XU et al., 2005).
A hipótese dopaminérgica da esquizofrenia clássica postula uma hiperatividade da transmissão dopaminérgica no receptor D2. É de interesse que o metabolismo enzimático da dopamina leve a geração de peróxido de hidrogênio, que, através da auto-oxidação da dopamina, leva à produção de ROS, como dopamina quinonas e superóxido (FLECKENSTEIN et al., 2007; HASTINGS, 1995 apud BITANIHIRWE; WOO, 2010; FLECKENSTEIN et al., 2007 apud
BITANIHIRWE; WOO, 2010). Estes ROS podem interagir com superóxido dismutase e glutationa, levando a uma redução nos níveis dos antioxidantes disponíveis (BITANIHIRWE; WOO, 2011).
estresse oxidativo e alterações nas defesas antixodantes cerebrais (SILVA et al., 2010; OLIVEIRA et al., 2009).
O efeito exato induzida por diferentes medicamentos típicos ou atípicos nas enzimas antioxidantes superoxido desmutase (SOD) e Glutationa peroxidase (GPX) e a concentração de peroxidação lipídica ainda não é bem elucidado (ZHANG et al., 2006). Estudo com pacientes esquizofrênicos e indivíduos saudáveis mostrou que os antipsicóticos, incluindo haloperidol, risperidona e clozapina, não alteraram significativamente o nível sérico de TBARS após quatro semanas de tratamento (HUANG; LIOU; LIN, 2010).
Entretanto, outra investigação com pacientes esquizofrenicos antes e após o tratamento com risperidona, olanzapina e flupenthixol por três meses, em comparação aos controles saudáveis, apresentaram significativamente concentrações mais elevadas de neopterina e nitritos e concentrações significativamente mais baixos de antioxidantes antes do tratamento. Após o tratamento com antipsicóticos, houve uma diminuição significativa nos níveis de neopterina e aumento significativo dos níveis de anti-oxidantes. Observando-se, então, aumento do estresse oxidativo em esquizofrenia, que melhora com antipsicóticos. Sendo que o mecanismo pelo qual os antipsicóticos diminuir o estresse oxidativo pode envolver modulação de regulação molecular na expressão de enzimas anti-oxidantes (CHITTIPROL et al., 2010).
2 RELEVÂNCIA E JUSTIFICATIVA
Desde a introdução dos psicofármacos, tenta-se elucidar o mecanismo de ação dessas drogas, como também introduzir novos agentes com maior seletividade e menor latência de ação, toxicidade e efeitos colaterais, além de utilizá-los como instrumento de geração de hipóteses biológicas sobre a fisiopatologia dos transtornos mentais (GORENSTEIN; SCAVONE, 1999). Desta forma, o tratamento farmacológico repousa na utilização de drogas antipsicóticas, estabilizadores de humor e antidepressivos (QUARANTINI et al., 2005). Sendo essa uma doença crônica e a utilização destes fármacos é prolongada, conseqüentemente, é comum o surgimento de efeitos colaterais.
Os modelos experimentais em animais têm procurado estabelecer um paralelo entre os efeitos comportamentais induzidos pelos psicofármacos com sinais clínicos e/ou neurofisiológicos em humanos, com o intuito de contribuir para a elucidação das bases etiológicas das várias doenças mentais (GORENSTEIN; SCAVONE, 1999).
A cetamina é um antagonista não competitivo de NMDA (STONE et al., 2007), capaz de produzir um provável aumento na liberação de glutamato na fenda sináptica, e possivelmente uma superestimulação de receptores glutamatérgicos não-NMDA (BRESSAN; PILOWSKY, 2003). Antagonistas de receptores glutamatérgicos NMDA (como fenciclidina e cetamina) produzem efeitos psicomiméticos similares aos sintomas positivos em pessoas sadias e pioram os sintomas negativos em pacientes esquizofrênicos. Além disso, em modelos animais esses antagonistas conseguem reproduzir sintomas positivos, negativos e déficit cognitivo (POWEL; MIYAKAWA, 2006).
A utilização do modelo de esquizofrenia induzido por cetamina em animais é fundamentado para o entendimento da hipótese glutamatérgica da esquizofrenia, na qual relaciona a hipofunção do receptor de NMDA ao aparecimento de sintomas compatíveis com a esquizofrenia. A partir deste modelo é possível avaliar as respostas da utilização dos antipsicóticos como clorpromazina e clozapina, através de testes comportamentais e análises neuroquimicas.
3 OBJETIVOS
3.1 Geral
Avaliar os efeitos comportamentais e neuroquímicos, através da avaliação do estresse oxidativo, após administração aguda da Clorpromazina (antipsicótico típico) e Clozapina (antipsicótico atípico), no modelo de Esquizofrenia induzido pela Cetamina em camundongos.
3.2 Específicos
Verificar as alterações neurocomportamentais, provocadas pela administração aguda de Clorpromazina e Clozapina, no modelo de Esquizofrenia induzido pela Cetamina em camundongos, através dos testes comportamentais de campo aberto, rota rod, catalepsia e suspensão da cauda;
4.1 Animais
Os experimentos foram realizados em camundongos fêmeas (Mus musculus), 25-30 gramas, divididos em grupos de 5-10 animais. Os animais foram mantidos a uma temperatura controlada (23 ± 1 ° C), com um ciclo de 12h claro / escuro e livre acesso à água e alimentos. Todos os procedimentos experimentais foram realizados em conformidade com o parecer do Comitê de Ética da Universidade Federal do Ceará (N. 92/2009).
4.2 Drogas e tratamento
Cloridrato de cetamina (Ketalar - ampola de 50 mg/ml, Lab. Parke-Davis, Brasil), clorpromazina (Longactil - ampola 5 mg/ml, Lab. Cristália) e clozapina (Leponex - 25 mg/comprimido, Lab. Novartis) foram dissolvidas em solução salina 0,9% e administrado por via intraperitoneal (i.p), em volumes de 10 ml/kg de peso corporal. A vitamina E (DL=acetato de alfa-tocoferol) foi adquirida do laboratório Teuto, Brasil, e diluída em 2% de tween 80 em solução salina 0,9% e administrado por via intraperitoneal (i.p), em volumes de 10 ml/kg de peso corporal.
Clorpromazina (Cp, 1 mg/kg ou 5 mg/Kg), clozapina (Cz, 5 mg/kg ou 10 mg/kg) ou Vitamina E (Vit E, 400mg/kg) foram administrados isoladamente ou trinta minutos antes de cetamina (Ket, 10 mg/kg). Os animais controle receberam solução salina 0,9% no mesmo período.
4.3 Procedimento
Figura 11: Tratamento dos grupos experimentais para estudo comportamental. G
GRRUUPPOO0011
30’
G
GRRUUPPOO0022
Solução Salina (ip)
Ket (10mg/kg) (ip)
30’
G
GRRUUPPOO0033
30’
Cp (1 ou 5mg/kg) (ip)
G
GRRUUPPOO0044
Cz (5 ou 10mg/kg) (ip)
G
GRRUUPPOO0055
Cp (1 ou 5mg/kg) (ip)
30’
Ket (10mg/kg) (ip)
G
GRRUUPPOO0066
Cz (5 ou 10mg/kg) (ip) Ket (10mg/kg) (ip)
Figura 12: Tratamento dos grupos experimentais para estudo neuroquímico. G
GRRUUPPOO0011
Solução Salina (ip)
30’
Ket (10mg/kg) (ip)
G
GRRUUPPOO0066
G
GRRUUPPOO0077
G
GRRUUPPOO0055
G
GRRUUPPOO0044
G
GRRUUPPOO0033
G
GRRUUPPOO0022
Vit E (400 mg/kg) (ip)
Cp (1 ou 5mg/kg) (ip)
Cz (5 ou 10mg/kg) (ip)
G
GRRUUPPOO0088
Vit E (400 mg/kg) (ip)
Cp (1 ou 5mg/kg) (ip)
Cz (5 ou 10mg/kg) (ip)
30’ 30’ 30’ 30’ 30’ 30’ 30’
Ket (10mg/kg) (ip)
Ket (10mg/kg) (ip)
Ket (10mg/kg) (ip)
4.4.1Teste de campo aberto
A arena de campo aberto foi feita de paredes de acrílico (transparente e piso preto, 30cm x 30cm x 20cm) e dividida em nove quadrados de área igual (fig. 13). O campo aberto foi utilizado para avaliar atividade exploratória dos animais. Os parâmetros observados foram: número de quadrados cruzados (com as quatro patas) e número de grooming e rearing, durante cinco minutos, após um minuto de adaptação (MONTGOMERY, 1955).
Figura 13: Arena para teste de campo aberto.
4.4.2 Rota Rod
Figura 14: Barra para teste de Rota Rod.
4.4.3Teste de Catalepsia
Os animais foram colocados em uma barra horizontal com 0.5cm de diâmetro e 5 cm de altura, com suas patas dianteiras na barra (fig. 15). Foi registrado o tempo que o animal passou nesta posição (máximo 150s). Foram realizadas no máximo até três tentativas, caso o animal saísse da barra. O estado cataléptico foi considerado positivo quando o animal ultrapassava o tempo de 60 segundos na barra (AHLENIUS; HILLEGAART, 1986; JORGENSEN; ANDREASSEN; HOLE, 1994).
Para o teste de suspensão de cauda, os animais foram suspensos pela cauda na borda de uma plataforma 58cm acima de uma mesa com fita adesiva colocados cerca de 1cm da ponta da cauda (fig. 16). A duração da imobilidade foi registrada durante um período de cinco minutos (STERU et al., 1985).
4.5 Estudo Neuroquímico
4.5.1 Mensuração da Peroxidação Lipídica
A peroxidação lipídica foi analisada determinando-se a concentração de malonildialdeído, uma das substâncias reativas ao ácido tiobarbitúrico (TBARS), em homogenatos (HUONG et al., 1998). As amostras foram adicionadas a um sistema catalisador de formação de radicais livres (FeSO4 0,01 mM e ácido ascórbico 0,1 mM), e então mantidas a 37ºC por 30 min. A reação foi interrompida pela adição de ácido tricloroacético 10%, posteriormente as amostras foram centrifugadas (3000 rpm/15 min), sendo o sobrenadante retirado e acrescido de ácido tiobarbitúrico 0,8%, sendo colocado depois em banho-maria por 15 minutos. Após resfriamento, foi medida a absorbância em 535nm. A peroxidação lipídica foi expressa em µmol de malonildialdeído (MDA)/mg proteína.
4.5.2 Avaliação da Atividade da Catalase
A atividade da enzima catalase foi medida através do método que emprega a geração H2O e O2 a partir do peróxido de hidrogênio (MAEHLY; CHANCE, 1954). A atividade da enzima foi medida pelo grau desta reação. Uma alíquota das amostras (20 l) foi adicionada a 980 l de meio reativo (H2O2 15%, Tampão Tris-HCl 1 M; EDTA 5 mM pH 8,0; H2O Milli-Q). As absorbâncias inicial e final foram gravadas a 230 nm após o 1º e 6º minuto, respectivamente. Uma curva padrão foi estabelecida utilizando catalase pura (Sigma, MO, USA) sob condições idênticas. Todas as amostras foram diluídas com 0,1 mmol/l de tampão fosfato (pH 7.0) para provocar 50% de inibição da taxa de diluente. Os resultados foram expressos em mmol/min/mg de proteína.
4.5.3 Determinação de Nitrito/Nitrato
foi incubado com 100µL do reagente de Griess (sulfanilamine em 1% H3PO4/0.1% N-(1-naftil) etilenodiamina-dicloridrato / 1% H3PO4 / água destilada, 1:1:1:1) em temperatura ambiente por 10 min. A absorbância foi medida em leitor de microplaca a 550nm. A curva padrão foi preparada com vários concentrações de NaNO2 (variando de 0,75-100 µM) e os resultados foram expressos em µmol / g de proteína.
4.6 Análise Estatística
5 RESULTADOS
5.1 Estudo Comportamental
5.1.1 Teste de Campo Aberto
A atividade locomotora, no teste de campo aberto, foi aumentada pela cetamina (65,7±5,6) e diminuída pela clorpromazina (Cp 1: 19,5±2,0 ou Cp 5: 4,3±2,1) ou clozapina (Cz: 8,0± 1,3) quando comparado ao controle (44,0±2,9). A hiperlocomoção induzida pela cetamina foi revertida pela administração da cetamina associada aos antipsicóticos [Cp 1 + Ket: 22,0±4,6; Cp 5 + ket: 0,0±0,0; Cz 5 + ket: 29,8± 5,8; Cz 10 + Ket: 5,1± 1,3], como mostrou a tabela 01 [F (9,70) = 35,99; p<0.0001].
O rearing foi aumentado após administração da cetamina (24,2±4,9) e reduzido com a clorpromazina (Cp 1: 2,3±0,8 ou Cp 5: 0,0±0,0) ou pela clozapina (Cz 10: 0,0±0,0) comparado com o controle (13,7±1,7). A associação da cetamina com clorpromazina (Cp 1 + Ket : 0,0±0,0; Cp 5 + ket: 0,0±0,0) ou com a clozapina (Cz 5 + Ket:18,0±2,4; Cz 10 + Ket: 0,5±0,2) [F (9,72) = 62,09; p<0.0001], reverteram o efeito da cetamina sob o rearing (Tabela 01).
induzida pela cetamina no teste de campo aberto em camundongo.
Grupo Atividade
Locomotora
Rearing Gromming
Controle 44,0±2,9 13,7±1,7 2,1±0,4
Ket 65,7±5,6a 24,2±4,9a 11,5±0,4a
Cp 1 19,5±2,0 a 2,3±0,8 a 1,8± 0,3
Cp 5 4,3±2,1a 0,0±0,0a 0,0±0,0
Cz 5 33,7±4,8 15,0±3,0 2,2± 1,5
Cz 10 8,0± 1,3 a 0,0±0,0a 0,4±0,1
Cp 1 + Ket 22,0±4,6b 0,0±0,0b 0,6± 0,2b
Cp 5 + ket 0,0±0,0b 0,0±0,0b 0,0±0,0b
Cz 5 + Ket 29,8± 5,8 b 18,0±2,4 b 6,2±1,1 b,e Cz 10 + Ket 5,1± 1,3b 0,5±0,2b 11,0±1,3 f
5.1.2 Teste de Rota Rod
A clorpromazina (Cp 5: 46,0±2,0) reduziu do tempo de permanência do animal sob a barra, no teste de rota rod, quando comparado ao controle (60,0±0,0). A associação da clorpromazina (Cp 5 + ket: 50,1±2,4) ou da clozapina (Cz 10 + Ket: 52,1±3,0)com cetamina apresentaram resultado sobre o tempo de permanência na barra significativamente diferente dos efeitos induzidos pela cetamina sozinha (60,0±0,0). Foi observado, ainda, que a clozapina associada à cetamina (Cz 10 + Ket) foi estatisticamente diferente da clozapina (Cz 10) sozinha, [F (9,82) = 23,14; p<0.0001] (Tabela 2).
Foi verificado que a clorpromazina (Cp 5: 1,7±0,2) aumentou o número de quedas da barra, em relação ao controle (0,0±0,0). A associação da clorpromazina (Cp 5 + ket: 1,5± 0,3) ou da clozapina (Cz 10 + Ket: 0,8±0,3) com cetamina foi significativamente diferente dos efeitos induzidos pela cetamina sozinha (0,0±0,0) sobre o número de falhas. Foi averiguado, ainda, que a clozapina (Cz 10 + Ket) associada à cetamina foi estatisticamente diferente da clozapina (Cz 10) sozinha, [F (9,87) = 16,96; p<0.0001] (Tabela 2).
camundongo.
Grupo Tempo de permanência (s) Número de quedas
Control 60,0±0,0 0,0±0,0
Ket 60,0±0,0 0,0±0,0
Cp 1 60,0±0,0 0,0±0,0
Cp 5 46,0±2,0 a 1,7±0,2 a
Cz 5 60,0±0,0 0,0±0,0
Cz 10 60,0±0,0 0,0±0,0
Cp 1 + Ket 60,0±0,0 0,0±0,0
Cp 5 + ket 50,1±2,4 b 1,5± 0,3 b
Cz 5 + Ket 60,0±0,0 0,0±0,0
Cz 10 + Ket 52,1±3,0 b,f 0,8±0,3 b,f
5.1.3 Teste de Catalepsia
Con
trol Ket Cp 1 Cp 5 Cz 5 Cz
10
Cp 1+ K
et
Cp 5 +
Ket
Cz 5 + K
et
Cz 10 +
Ket 0 100 200 300 400
a
a
b
a
f
C a ta le p s y / 5 m inFigura 17 - Efeito das drogas antipsicóticas e cetamina no teste de catalepsia em camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
5.1.4 Teste de Suspensão de Cauda
Con
trol Ket Cp 1 Cp 5 Cz 5 Cz
10
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 +
Ket
Cz 10 +
Ket 0 100 200 300
a
a
b,d
b
a
c
T
im
e
o
f
im
m
o
b
il
it
y
(
S
)
Figura 18 - Efeito das drogas antipsicóticas e cetamina no teste de suspensão de cauda em camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
5.2 Estudo Neuroquímico
5.2.1 Determinação da Peroxidação Lipídica (TBARS)
As figuras 19, 20 e 21 mostram os efeitos da administração aguda de cetamina, clorpromazina, clozapina sozinhos ou associados com cetamina sobre os níveis de TBARS no CPF, HC ou CE, respectivamente. Também foi demonstrado o efeito da vitamina E como controle positivo.
O tratamento com cetamina sozinha (ket: 3,4±0,1) elevou a concentração de MDA no CPF quando comparada ao grupo controle (1,5±0,1) ou vitamina E (2,1±0,1) (fig. 19). As associações (vit E + ket: 2,4±0,2; Cp 1 + ket: 2,1±0,1; Cp 5 + ket: 2,4±0,2; Cz 10 + ket: 1,9±0,1) reduziram o efeito da cetamina sozinha sobre o teor de MDA. Foi observado que clorpromazina (Cp 5: 2,7±0,1) elevou a concentração de MDAquando comparada ao grupo controle [F(11,76) = 8.837, p < 0.0001], (fig. 19).
A cetamina sozinha (ket: 2,7±0,0) elevou a concentração de MDA no HC quando comparada ao grupo controle (1,5±0,1) ou vitamina E (1,9±0,1) (fig. 20). As associações (vit E + ket: 1,9±0,1; Cp 1 + ket: 1,6±0,1; Cp 5 + ket: 1,7±0,2; Cz 10 + ket: 1,5±0,1) reduziram o efeito da cetamina sozinha sobre MDA. Sendo que a Cz 10 + Ket foi significativamente diferente da Cz 10 (0,5±0,0) sobre a concentração de MDA[F(11,82) = 14.50, p < 0.0001], (fig. 20).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz
10
Vit E +
Ket
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 +
Ket
Cz 10 +
Ket 0 1 2 3 4 a,b a c c c c
CPF
T B A R S µ m o l M D A /m g o f p ro te inFigura 19 - Peroxidação lipídica no córtex pré-frontal (CPF) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz 1
0
Vit E +
Ket
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 + K
et
Cz 10 + K
et 0 1 2 3 a,b a c
c c c,g
HC
T B A R S µ m o l M D A /m g o f p ro te inFigura 20 - Peroxidação lipídica no hipocampo (HC) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Cont rol
Vit E Ke t
Cp 1 Cp 5 Cz 5 Cz 1 0
Vit E +
Ket
Cp 1 + K
et
Cp 5 + K
et
Cz 5 + K
et
Cz 1 0 +
Ket 0.0 0.5 1.0 1.5 2.0 2.5 a,b
a a b,c
c c c c
CE
T B A R S µ m o l M D A /m g o f p ro te inFigura 21 - Peroxidação lipídica no corpo estriado (CE) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
5.2.2 Avaliação da Atividade da Catalase
Um aumento na atividade da catalase no CPF foi visto na administração de cetamina sozinha (2,8±0,2) quando comparada ao grupo controle (1,4±0,1) ou a vitamina E (1,4±0,0) (fig. 22). Por outro lado, os grupos em associação com cetamina (vit E + ket: 1,4±0,1; Cp 5 + ket: 1,9±0,2; Cz 10 + ket: 1,5±0,2) reverteram o efeito da cetamina sozinha sobre a atividade da catalase. Foi observado, ainda, que a clozapina (Cz 5: 2,2±0,1) elevou a atividade da catalase quando comparada ao grupo controle [F(11,76) = 11.53, p < 0.0001], (fig. 22).
Para o HC, um aumento na atividade da catalase foi visto na administração de cetamina sozinha (2,4±0,1) quando comparada ao grupo controle (1,3±0,0) ou a vitamina E (1,2±0,1) (fig. 23). Entretanto, os grupos em associação com cetamina (vit E + ket: 1,6±0,1; Cp 1 + Ket: 1,6±0,1; Cp 5 + ket: 1,7±0,1; Cz 5 + Ket: 1,1±0,0; Cz 10 + ket: 1,5±0,1) reverteram o efeito da cetamina sozinha sobre a atividade da catalase [F(11,83) = 5.764, p < 0.0001], (fig. 23).
Cont rol
Vit E Ke t
Cp 1 Cp 5 Cz 5 Cz 10
Vit E +
Ket
Cp 1 + K
et
Cp 5 + K
et
Cz 5 + K
et
Cz 1 0 +
Ket 0 1 2 3 4 a,b
CPF
a c c c C a ta la s e a c ti v it y µ M /m in /µ g o f p ro te inFigura 22 - Atividade da catalase no córtex pré-frontal (CPF) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz
10
Vit E +
Ket
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 + K
et
Cz 10 +
Ket 0 1 2 3
HC
a,bc c c
c c C a ta la s e a c ti v it y µ M /m in /µ g o f p ro te in
Figura 23 - Atividade da catalase no hipocampo (HC) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz 10
Vit E +
Ket
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 +
Ket
Cz 10 +
Ket 0.0 0.5 1.0 1.5 2.0 2.5
CE
a,bc c c
c c C a ta la s e a c ti v it y µ M /m in /µ g o f p ro te in
Figura 24 - Atividade da catalase no corpo estriado (CE) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
5.2.3 Concentração de nitrito/nitrato
A cetamina sozinha (1,5±0,1) elevou a concentração de nitrito no CPF quando comparada ao grupo controle (1,2±0,0) ou a vitamina E (1,2±0,0) (Fig. 25). Entretanto, os grupos em associação com cetamina (vit E + ket: 1,1±0,0; Cp 1 + Ket: 0,9±0,0; Cp 5 + ket: 0,8±0,0; Cz 5 + Ket: 1,3±0,0; Cz 10 + ket: 1,3±0,0) reverteram o aumento no teor de nitrito induzido pela cetamina. Foi encontrado, ainda, que a clorpromazina (Cp 5: 0,9±0,0) diminuiu e a clozapina (Cz 5: 1,4±0,0) elevou a concentração de nitrito quando comparada ao grupo controle [F(11,83) = 22.22, p < 0.0001], (fig. 25).
Para o HC, a cetamina sozinha (2,7±0,2) elevou a concentração de nitrito quando comparada ao grupo controle (1,2±0,0) ou a vitamina E (1,8±0,1) (fig. 26). Contudo, os grupos em associação com cetamina (vit E + ket: 1,0±0,0; Cp 1 + Ket: 0,9±0,0; Cp 5 + ket: 0,8±0,0; Cz 5 + Ket: 1,4±0,0; Cz 10 + ket: 1,2±0,0) reverteram o aumento no teor de nitrito induzido pela cetamina. Foi observado que a clozapina (Cz 5: 2,1±0,1) elevou a concentração de nitrito quando comparada ao grupo controle, sendo esse aumento não observado na associado com cetamina (Cz 5 + ket). Vale destacar, ainda, que o controle positivo associado (vit E + ket), apresentou concentração de MDA menor que ele sozinho (vit E) [F(11,94) = 28.61, p < 0.0001], (fig. 26).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz
10
Vit E +
Ket
Cp 1 +
Ket
Cp 5+ K
et
Cz 5 +
Ket
Cz 10 +
Ket 0.0 0.5 1.0 1.5 2.0
CPF
a,b a a c c c c c N it ri te C o n te n t µ m o l/ g o f ti s s u eFigura 25 – Concentração de Nitrito no córtex pré-frontal (CPF) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz
10
Vit E + K
et
Cp 1 +
Ket
Cp 5+ K
et
Cz 5 +
Ket
Cz 10 +
Ket 0 1 2 3 4
HC
a,b a b,c c c c,f c N it ri te C o n te n t µ m o l/ g o f ti s s u eFigura 26 – Concentração de Nitrito no hipocampo (HC) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).
Con
trol Vit E Ket Cp 1 Cp 5 Cz 5 Cz
10
Vit E +
Ket
Cp 1 +
Ket
Cp 5 +
Ket
Cz 5 +
Ket
Cz 10 +
Ket 0 1 2 3 4 5
CE
a,b ab,c c c
c c,f N it ri te C o n te n t µ m o l /g o f ti s s u e
Figura 27 – Concentração de Nitrito no corpo estriado (CE) de camundongos tratados com cetamina (10 mg/kg) sozinha ou associada com vitamina E (400 mg/kg), clorpromazina (1 ou 5 mg/kg) ou clozapina (5 ou 10 mg/kg).