1. INTRODUÇÃO
A bacia do rio Piracicaba abrange 55 municípios do Estado de São Paulo com população aproximada de 3.000.000 habitantes (INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA -IBGE, 2002). Recentemente tem recebido atenção especial, pois apresenta grandes problemas no aproveitamento de suas águas (BALLESTER, 1997).
Integrante da bacia do rio Piracicaba, a bacia do rio Corumbataí é uma alternativa de abastecimento de água para vários municípios, mostrando-se importante regionalmente, não só porque ainda possui águas de boa qualidade, mas também por apresentar ecossistemas pertencentes a fragmentos situados na topografia acidentada da cuesta do arenito Botucatu, com elementos raros na paisagem do interior do Estado (MERLI, 1997; VIANA; MENDES, 1997). Esta bacia tem sofrido crescente deterioração na qualidade e quantidade de água ofertada para o abastecimento público, além de um empobrecimento da sua diversidade biológica (BALLESTER, 1997).
Existem na literatura muitos trabalhos propondo técnicas de reabilitação de rios europeus e norte americanos, já que estes sofreram grandes alterações devido ao processo de desenvolvimento urbano. A complexidade biológica dos ambientes tropicais impede a aplicação direta de protocolos de diagnóstico ambiental para determinar o grau de alteração do ambiente, exigindo uma adaptação ou mesmo a criação de novas metodologias. A melhor opção é evitar que os ambientes naturais tropicais cheguem ao estado em que se encontram os ambientes temperados. Para isto, torna-se necessário um melhor conhecimento da área e proposição de estratégias de conservação e reabilitação nos sistemas que já se encontram degradados.
A integridade biológica de um ecossistema aquático pode ser vista como um reflexo de seus componentes:
• Qualidade da água: temperatura, turbidez, oxigênio dissolvido, química orgânica e inorgânica, metais
pesados e substâncias tóxicas;
•
Estrutura do habitat: tipo de substrato, profundidade da coluna d’água, velocidade da corrente, complexidade estrutural e temporal do habitat físico;• Regime do fluxo: volume de água, distribuição temporal do fluxo;
• Fonte de energia: tipo, quantidade e tamanho da partícula da matéria orgânica que entra no sistema, padrão sazonal da disponibilidade de energia;
• Interações biológicas: competição, predação, doenças, parasitismo.
Qualquer atividade humana que degrade um ou mais destes componentes, interfere na qualidade do recurso aquático. Durante muito tempo os esforços para a manutenção da qualidade dos recursos hídricos ficaram restritos à manutenção da qualidade da água sem considerar a estrutura do habitat e os organismos que ali vivem que são tão importantes quanto a qualidade da água. O termo habitat define o local onde uma espécie vive, fornecendo uma variedade de condições, mas sem especificar a quantidade, disponibilidade ou utilização dos recursos que satisfazem as necessidades da espécie, ou seja, seu nicho ecológico (BEGON; HARPER; TOWNSEND, 1996).
Os recursos de um organismo vivo correspondem à matéria prima da qual seus corpos são formados, à energia que está envolvida em suas atividades e o espaço no qual ele atua ou passa todo seu ciclo de vida ou parte dele (BEGON; HARPER; TOWNSEND, 1996).
Diagnósticos ambientais baseados em estudos de assembléias de peixes apresentam numerosas vantagens devido à disponibilidade de informações sobre o ciclo de vida de grande número de espécies e por incluírem uma variedade de hábitos alimentares (onívoros, herbívoros, insetívoros, planctófagos, carnívoros) compreendendo alimentos tanto de origem aquática como terrestre. Outra vantagem é a possibilidade de encontrar este grupo animal no topo da cadeia alimentar, diferente de outros indicadores de qualidade de água, como diatomáceas e invertebrados, o que favorece uma visão integrada do ambiente aquático (HARRIS, 1995).
Durante seu ciclo de vida, os peixes requerem diferentes habitats ou unidades funcionais que fornecem condições de microhabitat para cada estágio específico de sua vida como: período de crescimento ou residência em lagoas marginais isoladas do canal principal; período de reprodução e desova; períodos larval e juvenil (COWX; WELCOMME, 1998).
O microhabitat é o local onde o peixe é encontrado em um determinado instante de tempo e é diretamente influenciado pela complexidade estrutural do riacho, intensidade luminosa, variáveis hidráulicas, variáveis físico-químicas (WHITESIDE; McNATT, 1972), substrato e variáveis bióticas (ZARET; RAND, 1971; FAUSCH; WHITE, 1981; SCHLOSSER; EBEL, 1989).
Para completar seu ciclo de vida muitos peixes necessitam desovar em ambientes com características muito diferentes das quais os adultos vivem, necessitando subir o rio ou encontrar um ambiente mais calmo, muitas vezes distante dos locais onde passam a maior parte de sua vida se alimentando (COWX; WELCOMME, 1998).
McCONNELL, 1999).
Vannote, Minshall, Cummins, Sedell e Cushing (1980) desenvolveram o conceito de rio contínuo (“the river continuum concept”), estabelecendo que os rios são gradientes físicos onde os diversos habitats estão ligados ao longo de um contínuo e a distribuição dos organismos é estabelecida de maneira a conformar-se às condições físicas do canal, que por sua vez são previsíveis a partir de sua posição na rede de drenagem. Portanto, ambiente e processos biológicos devem estar integrados de maneira previsível.
Para Matthews (1998), a variedade de habitats ocupados pelos peixes é tão grande quanto o próprio grupo taxonômico. O ambiente físico por eles selecionado depende de processos geológicos, morfológicos e hidrológicos que influenciam a vegetação marginal que forma um mosaico ao longo do canal. Este canal pode ser concebido como uma estrutura de quatro dimensões: longitudinal, lateral, vertical e temporal (WARD, 1989; COWX; WELCOMME, 1998).
A dimensão lateral relaciona a mata de galeria com o canal do rio (COWX e WELCOMME, 1998). Esta interação fornece diferentes habitats, não só como locais para alimentação e refúgio como também para desova. Em riachos de cabeceira, ou seja, de baixa ordem, a diversidade de habitats aquáticos depende muito dos troncos de madeira caídos, que passam a funcionar como ecótonos, modeladores da geomorfologia do canal fornecendo mais fontes de recursos para os peixes.
A dimensão vertical refere-se a interação entre o canal e sua profundidade. Esta dimensão tem muita importância para aquelas espécies que põem seus ovos em depressões rochosas, conhecidas como poções (DIDIER; KESTEMONT, 1996).
longo do canal (ANGERMEIER; SCHLOSSER, 1989; OSBORNE; WILEY, 1992).
Tendo em vista a alta complexidade de um sistema natural e sua multidimensionalidade, utilizar apenas um simples atributo, como índice de diversidade ou medidas de qualidade da água, no caso de sistemas aquáticos, é limitado na avaliação de todas as formas de degradação desses ambientes.
2. OBJETIVOS
O objetivo deste trabalho foi apresentar uma caracterização das assembléias de peixes na
bacia do rio Corumbataí e fornecer ferramentas para a avaliação de seu status ambiental. Diante
disto, foram levantados argumentos que possibilitem responder as seguintes questões:
1. A análise linear de covariância (ANCOVA), utilizando a riqueza de espécies e variáveis
ambientais, é capaz de revelar a variação espaço-temporal das assembléias de peixes?
2. Alterações na relação espécie-área refletem as ações do processo de urbanização e uso da terra
sobre as assembléias de peixes?
3. Existe algum padrão de associação entre a riqueza de espécies e o estado de conservação da
mata ciliar?
4. As espécies de peixes podem ser utilizadas como indicadoras do estado de conservação do
3. MATERIAL E MÉTODOS
3.1. Área de estudo
A bacia do rio Corumbataí abrange os municípios de Rio Claro, Corumbataí, Analândia, Santa Gertrudes, Ipeúna e Charqueada com 168.218, 3.794, 3.582, 15.906, 4.340 e 13.037 habitantes, respectivamente (IBGE, 2000).
Esta bacia faz parte da primeira zona hidrográfica do Estado de São Paulo que abrange a parte superior do rio Tietê desde suas cabeceiras até a barragem de Barra Bonita num percurso de 592 km. Esta zona é responsável pela drenagem de 32.710 km2 e compreende dez bacias hidrográficas, dentre elas, a bacia do rio Piracicaba que é composta pelas bacias dos rios Jaguari com 4.339 km2, Corumbataí com 1.710 km2 e Atibaia com 1.030 km2 (CETESB, 1984).
Figura 1: Bacia hidrográfica do Corumbataí (VIADANA, 1992).
As informações que se seguem são referentes à geologia, geomorfologia, pedologia, clima, precipitação, balanço hídrico da bacia, ocupação e uso da terra encontradas no ATLAS ambiental da bacia do rio Corumbataí (2002).
No fundo dos vales dos rios Corumbataí e Passa Cinco ocorrem afloramentos de várias rochas sedimentares de origem no Carbonífero (grupo Itararé) e em diversas partes dos leitos desses rios e do Cabeça e Ribeirão Claro existem muitas ocorrências de diques e soleiras de diabásio, geneticamente relacionados aos basaltos da Formação Serra Geral de origem no Cretáceo inferior (rochas magmáticas intrusivas) (Figura 2).
A ocorrência de folhelhos acinzentados e intercalações de calcários dolomíticos e folhelhos pirobetuminosos sustenta a extração de calcário dolomítico, que serve de corretor da acidez de solos, nas pedreiras de Assistência, Ipeúna e Piracicaba. Esta formação (Irati) ocorreu no Permiano e seus sedimentos são a matriz de fósseis de répteis mesossaurídeos que ocorrem também em sedimentos semelhantes na África, sugerindo que as regiões eram próximas na época em que estes animais nadavam nas águas de um corpo marinho fechado, à semelhança de um golfo.
A ocorrência de siltitos e argilitos cinza-avermelhados e arroxeados fornece matéria-prima para as indústrias do pólo cerâmico da região. Esta formação (Corumbataí) ocorreu também no Permiano e nela podem ser encontrados fósseis de conchas bivalves e dentes e escamas de peixes apontando para um ambiente marinho costeiro, pantanoso e eventualmente lacustre. O clima desta época devia ser mais quente e seco.
A região também foi palco de situações flúvio-desérticas, com migração de dunas de areia e regiões interdunas mais úmidas, que foram responsáveis pela formação Pirambóia que ocorreu no Triássico.
A origem de rochas magmáticas intrusivas estão relacionadas ao extenso fenômeno de magmatismo de fissura ocorrido no início do período Cretáceo, como uma resposta intra-placa frente aos esforços referentes à separação da América do Sul da África, fenômeno este que foi um dos maiores de seu gênero em toda a história da Terra.
Figura 2: Mapa geológico da bacia do rio Corumbataí (ATLAS..., 2002).
Serra do Cuscuzeiro com 1058 m e se deslocam para o sul indo alimentar o rio Piracicaba que se apresenta com 470 m de altitude (KOFFLER, 1994) (Figura 3).
Figura 3: Modelo tridimensional do relevo da bacia do rio Corumbataí (ATLAS..., 2002).
Figura 4: Mapa pedológico da bacia do rio Corumbataí (ATLAS..., 2002).
Segundo Troppmair (1975) o regime de chuvas, quanto à distribuição anual, é tropical, com duas estações definidas: período seco que se estende pelos meses de março a setembro, com menos de 20% das precipitações totais, correspondendo às médias próximas de 250 mm em 20 dias e período chuvoso que se prolonga de outubro a fevereiro, sofrendo a influência da massa tropical, com mais de 80% das precipitações anuais, que atingem a média de 1100 mm de 60 a 70 dias.
Zavatini e Cano (1993) estudaram as variações do ritmo pluvial na área da bacia e arredores durante o período de 1962 a 1991, segundo estes autores, os maiores índices de pluviosidade se encontram na porção noroeste, cujos níveis de altitude estão entre 800 e 1000m. Isso demonstra a existência de um certo “efeito orográfico”, principalmente nos períodos de verão e primavera. Este efeito quase se extingue durante o inverno e outono tornando a porção central da bacia mais chuvosa, nesse período.
O balanço hídrico estudado por Koffler e Moretti (1991) mostrou que na região a evapotranspiração real (1100 mm) é muito próxima da potencial (1193 mm). Os déficits concentram-se no período de abril a agosto e, considerando-se apenas o balanço hídrico, estão disponíveis cerca de 9 meses de precipitação satisfatória para o desenvolvimento de grande parte das culturas agrícolas.
Apesar da crise econômica, a partir da década de 80, acarretar diminuição no desenvolvimento econômico e populacional, a região da bacia do rio Piracicaba apresentou crescimento populacional acima da média estadual. Houve decréscimos absolutos da população rural que migrou para a bacia do Piracicaba aumentando em 92% a sua taxa de urbanização (ATLAS..., 2002).
Quanto ao uso da terra, na bacia ocorre o predomínio de áreas ocupadas por pastagem e cana-de-açúcar. As áreas de reflorestamento e silvicultura (Eucaliptus e Pinus) superam a de vegetação natural: mata e cerrado. As duas áreas de reflorestamento de eucalipto mais extensas são a Floresta Estadual Navarro de Andrade e o Horto de Camacuã, entre Rio Claro e lpeúna. A cultura de laranja está presente nas regiões de cabeceira do rio Corumbataí. Koffler (1993) constatou a invasão das culturas de ciclo longo, como a da cana-de-açúcar, em áreas adequadas para culturas de ciclo curto e observou a ocupação por pastagem em áreas recomendadas para silvicultura e em grande parte das áreas onde a vegetação natural deveria ter sido mantida (Figura 5).
Figura 5: Uso e ocupação do solo na bacia do rio Corumbataí em 2000 (ATLAS..., 2002).
destaque como o de Viadana (1992) que estudou os perfis ictiobiogeográficos, Leonel (1992) que apresentou estudos relacionados com anfíbios e Rozelli e Abe (1994) que apresentaram dados da fauna de mamíferos não voadores.
3.2. Locais de coleta
As coletas foram realizadas em 4 rios principais da bacia: Passa Cinco, Corumbataí, Ribeirão Claro e Cabeça, sendo amostrados trechos de cerca de 150m em três diferentes altitudes em cada riacho. Foram realizadas duas expedições em cada ponto, uma durante o período de março a junho e outra entre setembro e dezembro de 2001, totalizando 24 coletas (Figura 6).
3.2.1. Rio Passa Cinco
O rio Passa Cinco apresenta uma área de drenagem com 525 km2 e percorre cerca de 60 km desde a sua nascente, com altitude de 1000 m, até sua foz no rio Corumbataí, com altitude de 480 m (Figura 7).
O primeiro ponto de coleta 22º22’S 47º46’W apresenta um relevo característico de “cuesta” com afloramento rochoso e barrancos bem estáveis. A vegetação marginal é responsável por um sombreamento entre 51 e 75% e apresenta-se parcialmente desmatada com estrato arbóreo, arbustivo e herbáceo com áreas cobertas por capim. Seu leito é pedregoso com cascalhos e pouca quantidade de areia. Este ponto apresentou uma variação grande de mesohabitats, dentre eles se destacaram poças, rio corrente e corredeiras. Devido à existência de poças, este ponto é muito freqüentado por pescadores esportivos à procura de lambaris (Astyanax spp.).
O segundo ponto 22º25’S 47º43’W possui um relevo composto por áreas suavemente onduladas. A vegetação marginal proporciona um sobreamento de 0 a 25%, apresentando-se desmatada. A vegetação é composta por capim, cana-de-açúcar e eucalipto. O leito é constiuído por areia e cascalho. Neste ponto foi possível encontrar os três mesohabitats: poça, rio corrente e corredeira. À cerca de 100 m abaixo deste ponto observou-se pescadores à procura de lambaris.
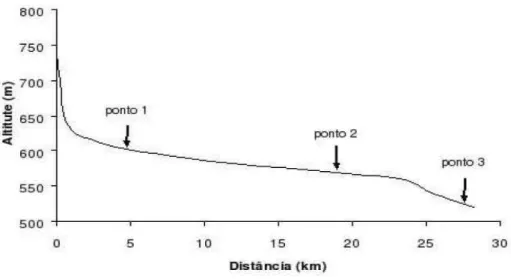
Figura 7: Perfil longitudinal e localização dos pontos de coleta no rio Passa Cinco.
3.2.2. Rio Corumbataí
O rio Corumbataí apresenta uma área de drenagem com 1710 km2 e percorre cerca de 110 km desde a sua nascente, com altitude de 1058 m, até sua foz no rio Piracicaba, com altitude de 470 m (Figura 8).
O primeiro ponto de coleta 22º10’S 47º39’W localiza-se à cerca de 3 km abaixo da cidade de Analândia. Para chegar a este ponto existe um declive acentuado no relevo. Na margem encontram-se barrancos estáveis sem afloramento rochoso. A vegetação marginal apresenta brejo, pastagem, capoeira, bambu e eucalipto sem a vegetação natural preservada, fornecendo um sombreamento de 0 a 25%. O leito apresenta-se arenoso com exceção da área onde há uma corredeira, com fundo pedregoso.
O terceiro ponto 22º38’S 47º40’W está localizado cerca de 40 km acima da região de confluência dos rios Corumbataí e Piracicaba. Apresentou os mesohabitats rio corrente e corredeira. O trecho apresenta um leito pedregoso com cascalho e areia. A vegetação marginal é composta por pastagem, capoeira, agricultura e mata ciliar que se encontra desmatada. A cobertura vegetal fornece um sombreamento de 0 a 25%. Neste local verifica-se uma intensa atividade de pescadores à procura de tilápias.
Figura 8: Perfil longitudinal e localização dos pontos de coleta no rio Corumbataí.
No primeiro período de coleta (março a junho) o rio Corumbataí apresentou vazão média muito próxima do segundo período (setembro a dezembro) (Figura 9). Isto pode ser confirmado pela pequena flutuação que ocorreu na profundidade dos diferentes rios nos dois períodos.
3.2.3. Ribeirão Claro
O Ribeirão Claro apresenta uma área de drenagem com 291 km2 e percorre cerca de 43 km desde a sua nascente, com altitude de 720 m, até sua foz no rio Corumbataí, com altitude de 520 m (Figura 10).
O primeiro ponto 22º21’S 47º30’W localiza-se à cerca de 2 km acima da ponte que liga Rio Claro a Araras. O relevo é levemente ondulado com visíveis áreas de planície. Neste ponto, a margem direita do rio apresenta um barranco estável com vegetação natural. A vegetação marginal é caracterizada por mata de galeria em bom estado de conservação com estrato arbóreo, arbustivo e herbáceo fornecendo um sobreamento acima de 75%. O leito do rio é formado por areia e cascalho.
O segundo ponto 22º23’S 47º32’W está localizado atrás do câmpus da Bela Vista da UNESP/Rio Claro. As características deste ponto são muito semelhantes à descrita anteriormente, ou seja, o relevo é levemente ondulado com visíveis áreas de planície. A vegetação marginal é caracterizada por mata de galeria em bom estado de conservação com estrato arbóreo, arbustivo e herbáceo, fornecendo sobreamento acima de 75%. Seu leito é formado por areia e cascalho. Neste local foram encontradas várias trilhas feitas por pescadores dos bairros vizinhos.
Figura 10: Perfil longitudinal e localização dos pontos de coleta no Ribeirão Claro.
3.2.4. Rio Cabeça
O rio Cabeça apresenta uma área de drenagem com 211 km2 e percorre cerca de 28 km desde a sua nascente, com altitude de 740 m, até sua foz no rio Passa Cinco, com altitude de 520 m (Figura 11).
O primeiro ponto 22º18’S 47º42’W possui um relevo composto por áreas suavemente onduladas. A vegetação marginal apresenta-se parcialmente desmatada, composta por mata de galeria, capim e eucalipto, fornecendo um sombreamento de 26 a 50%. Este ponto está localizado entre dois portos de areia evidenciando que seu leito é arenoso. Esta atividade comercial faz com que este trecho não apresente áreas de refúgio para os peixes.
O terceiro ponto 22º26’S 47º39’W está localizado à cerca de 300 m da confluência entre os rios Cabeça e Passa Cinco. A vegetação marginal é formada por pastagem, agricultura e mata ciliar parcialmente desmatada, com estrato arbóreo, arbustivo e herbáceo, fornecendo um sombreamento de 26 a 50%. Neste ponto não foi possível encontrar o mesohabitat poça. O seu leito é pedregoso com areia e cascalho. Neste trecho há uma grande corredeira com cerca de 150 m a qual termina na junção dos dois rios formando um lago muito visitado por pescadores e com uma bonita paisagem.
Figura 11: Perfil longitudinal e localização dos pontos de coleta no rio Cabeça.
3.3. Variáveis ambientais
Foram anotadas 13 variáveis ambientais:
• Variáveis físicas: profundidade média, comprimento e largura média do canal, velocidade superficial
média e temperatura da água.
•
Estrutura do habitat: porcentagem de cobertura no ambiente, estado de preservação da vegetaçãomarginal, tipo de substrato e tipo de mesohabitat encontrado.
• Variáveis químicas: turbidez, oxigênio dissolvido, pH e condutividade da água.
centímetros. O comprimento e a largura do canal foram medidos com trena de 30 m. A velocidade superficial de correnteza foi registrada através de bóias. Para a porcentagem da cobertura vegetal da mata ciliar utilizou-se uma escala arbitrária com 4 classes: 0-25%, 26-50%, 51-75% e acima de 76%. O estado de preservação seguiu a mesma estratégia da porcentagem da cobertura vegetal sendo agrupada em três classes: mata preservada, parcialmente desmatada e totalmente desmatada. O tipo de substrato foi classificado em: areia, pedras, cascalho, lodo e suas possíveis combinações. Os mesohabitats foram divididos em corredeira, poça, rio corrente e lagoa marginal. Os parâmetros físico-químicos da água como temperatura, turbidez, oxigênio dissolvido, pH e condutividade foram medidos com analisador de água eletrônico.
3.4.Coleta da ictiofauna
Foram realizadas coletas com redes de espera variando de 3 a 9 cm entre nós opostos e três pares de covos. As redes e armadilhas foram colocadas no meio da tarde (entre 15h e 18h), permanecendo até a manhã seguinte (entre 7h e 9h). A seqüência de redes em cada local foi determinada após um sorteio e foram distribuídas ao longo das margens. Os covos foram distribuídos aos pares (pequeno e médio) nos seguintes mesohabitats: corredeira, rio corrente e poça, quando ocorriam.
3.5.Análises dos dados
3.5.1. Ocorrência das espécies
3.5.1.1. Constância
Visando identificar qualitativamente as espécies residentes foi aplicado o método de constância de ocorrência (Dajoz, 1973).
c= c
i
C
∗100
onde: c = valor de constância da espécie; ci = número de coletas com a espécie; C = número total de coletas.
As espécies com c ≥ 50 foram consideradas constantes, com 25 ≤ c < 50, acessórias e com c < 25, ocasionais.
3.5.1.2. Tabela de contingência
Através da freqüência observada das espécies numericamente mais abundantes: Bryconamericus stramineus, Astyanax sp., Hypostomus strigaticeps, Astyanax altiparanae, Astyanax fasciatus, Serrapinnus notomelas, Astyanax scabripinis e Pimelodella gracilis; e das mais importantes quanto ao peso: Rhamdia quelen, Hoplosternum littorale, Hoplias malabaricus, Leporinus friderici, Salminus hilarii e Schizodon nasutus foi possível testar a hipótese de independência entre a ordem do rio e a época de coleta utilizando-se a estatística χ2.
3.5.2. Estimativa da riqueza da bacia ( S )
S=s
n−1 n
konde: S = estimativa “jackknife” para a riqueza;
s = número total de espécies observadas em cada amostra; n = número total de amostras;
k = número de espécies únicas.
A variância desta estimativa é dada por:
var S=
n−1n
[
∑
j=1 s
j2 f J
−k2
n
]
onde: var(S ) = variância da estimativa “jackknife”;
fJ = número de amostras contendo a espécie única j (j = 1, 2, 3, ..., s);
k = número de espécies únicas; n = número total de amostras.
3.5.3. Curva de rarefação
Para comparar a riqueza das assembléias dos diferentes rios foi aplicado o método da rarefação (KREBS, 1989).
3.5.4. Medidas de diversidade de peixes
3.5.4.1. Índice de Margalef (DMg)
Esta medida simples utiliza a combinação do número de espécies amostradas e a abundância total encontrada:
DMg = (S-1)/ln N
onde: S = número total de espécies encontradas; N = número total de indivíduos.
3.5.4.2. Índice de Shannon (H’)
O índice de Shannon (H’) é baseado na teoria da informação e mede o grau de incerteza em predizer qual a espécie do indivíduo, tomado ao acaso, de uma coleção de S espécies e N indivíduos. A incerteza aumenta conforme aumenta o número de espécies e a distribuição dos indivíduos entre as espécies torna-se igual, portanto, H’ = 0 quando existe uma única espécie na amostra e H’ é máximo quando todas as espécies são representadas pelo mesmo número de indivíduos. Este índice é bastante sensitivo a alterações nas espécies raras amostradas. Apesar deste índice ser bastante utilizado é difícil de ser interpretado.
H'=
∑
i=1 s
pi
log2pi
onde: H’ = informação contida na amostra (bits/indivíduo); S = número total de espécies;
pi = proporção da iésima espécie na amostra.
3.5.4.3. Índice de Simpson (1/D)
D
=
1
∑
n
i
n
i−
1
N
N
−
1
onde: D = índice de dominância de Simpson; ni = número de indivíduos na iésima espécie; N = número total de indivíduos na amostra; 1/D = índice de diversidade de Simpson.
3.5.4.4. Índice de eqüabilidade de Simpson (E1/D)
Esta medida relaciona o índice de diversidade de Simpson (1/D) com o número de espécies amostradas.
E1
/ D=
1/ D s
onde: E1
/ D = eqüabilidade de Simpson;
D = diversidade de Simpson;
s = número de espécies na amostra.
3.5.4.5. Índice de Berger-Parker (1/d)
Esta é uma medida simples de dominância, muito simples de ser calculado e de fácil interpretação. d = Nmáx/N
onde: d = índice de dominância de Berger-Parker;
Nmáx = número de indivíduos da espécie mais abundante; N = número total de indivíduos;
3.5.4.6. Método “jackknife”
Este método foi aplicado nos índices anteriormente citados para reduzir o efeito amostral.
3.5.4.7.Modelos espécie-abundância
Além da visualização gráfica das espécies em ordem de importância (“Whittaker plot”), foi examinado o ajuste dos 4 modelos da relação espécie abundância: série geométrica, série logarítmica, modelo lognormal e modelo “broken stick”. Para avaliar o ajuste dos modelos foi utilizado o teste de 2 com nível de significância = 0.05.
3.5.5.
Coeficiente de similaridade de Morisita-Horn (CH):Antes da aplicação do coeficiente de similaridade de Morisita-Horn excluiu-se da matriz de dados as espécies raras ou pouco freqüentes para diminuir os efeitos provocados pela pouca consistência destas informações ou pela grande quantidade de zeros na matriz (BEAUMORD, 1991).
ID=
N i∗Pi
∑
N i∗Pi
∗100
onde: ID = índice ponderal de dominância (%); Ni = número de indivíduos na iésima espécie; Pi = peso da íésima espécie
Para este trabalho foi adotado um critério duplo, baseado no ID e na proporção do número de indivíduos (pi = Ni/N), onde N é o número total de indivíduos. Entraram na análise as espécies com:
(i) ID > 0.05%;
(ii)
pi > 0.5%.C
H
=
2
∑
X
ij
X
ik[
∑
X
ij 2
/
N
j 2
∑
X
ik 2
/
N
k 2
]
N
j
N
konde: CH = índice de similaridade de Morisita-Horn;
Xij, Xik = número de indivíduos da espécie i na amostra j e k; Nj = Xij = número total de indivíduos na amostra j; Nk = número total de indivíduos na amostra k.
3.5.6. Teste de linearidade
Para determinar a relação entre ordem do rio e riqueza de espécies aplicou-se uma regressão linear, porém, se trata de uma situação especial, pois, para uma determinada ordem do rio foram encontradas diferentes riquezas. Para verificar se existe linearidade nesta regressão, foi testada a hipótese para uma regressão onde existem múltiplos valores de Y para um dado valor de X (ZAR, 1999).
3.5.7. Análise de covariância
Para testar a hipótese da existência de padrões espaciais e temporais, bem como para testar diferenças na estrutura das assembléias nos diferentes rios e ordens, foi ajustado o seguinte modelo:
Yij = µ + αi + γj + βij + ∑βij (Xij - X ) + εij onde: Yij = número de espécies (variável dependente);
µ = grande média;
αi = efeito do i-ésimo nível do fator rio (i = 1, 2, 3, 4);
γj = efeito do j-ésimo nível do fator ordem do rio (j = 1, 2, 3);
βij = efeito linear das covariáveis;
Xij = covariáveis ambientais;
O fator rio possui quatro níveis: rios Passa Cinco, Corumbataí, Ribeirão Claro e Cabeça; o fator ordem do rio possui 3 níveis: 4, 5 e 6. As covariáveis utilizadas foram temperatura e logaritmo natural do número de indivíduos.
3.5.8. Análises multivariadas
3.5.8.1.Análise de variância multivariada (MANOVA)
Quando mais de uma variável é medida em um experimento, elas podem ser analisadas através de uma MANOVA. Este caso ocorreu quando as variáveis ambientais foram coletadas, pois, em um único ponto coletou-se 4 variáveis físicas: profundidade e largura do canal, velocidade superficial e temperatura da água; e 4 variáveis químicas: turbidez, oxigênio dissolvido, pH e condutividade da água.
A hipótese nula é: H0 : µ1 = µ2 = ... = µk
onde: µk (k = 1, 2, ..., K) é o centróide da késima população, ou seja:
µ’k = [ µ1k, µ2k, ..., µpk], onde p é o número de variáveis dependentes.
Através de operações matriciais, que seguem os princípios de uma ANOVA, computa-se um valor de probabilidade de Wilks que será transformado num valor R de Rao que segue uma distribuição F (NESSELROADE e CATTELL, 1988).
3.5.8.2.Análise de correspondência (DCA)
3.5.8.3.Análise de componentes principais (PCA)
Foi aplicada a análise de componentes principais (PCA) visando diminuir a multidimensionalidade dos dados da paisagem dos pontos de coleta. Estes dados foram: ordem dos rios (4, 5 e 6); estado de preservação da mata ciliar: preservada, parcialmente desmatada e totalmente desmatada; sombreamento: 0-25%, 26-50%, 51-75%, acima de 76%; presença ou não de eucalipto; presença ou não de cana-de-açúcar; presença ou não de pasto; presença ou não de esgoto; estabilidade do barranco ao redor: baixa ou alta.
3.5.8.4. Análise espécie-ambiente
4. RESULTADOS
4.1.Ictiofauna capturada
Foram coletados em toda a bacia do rio Corumbataí cerca de 56 kg de peixes com 2474 indivíduos pertencentes a 35 espécies. Destas, 22 (63%) são Characiformes e 9 (26%) são Siluriformes. Cyprinodontiformes (2 espécies, 6%), Perciformes (1 espécie, 2.5%) e Gymnotiformes (1 espécie, 2.5%) também estão representadas. A família com o maior número de espécies é Characidae (12 espécies, 34%), seguida por Loricariidae (4 espécies, 11%) e Anastomidae (3 espécies, 8.5%).
A lista taxionômica abaixo foi elaborada com base em Buckup e Menezes (2002).
Classe ACTINOPTERYGII
Ordem CHARACIFORMES Família CHARACIDAE
Oligosarcus paranensis Menezes & Géry, 1983 Astyanax altiparanae Garutti & Britski, 2000 Astyanax sp.
Astyanax fasciatus (Cuvier, 1819) Astyanax scabripinnis Eigenmann, 1914 Bryconamericus stramineus Eigenmann, 1908 Hyphessobrycon eques (Steindachner, 1882) Salminus hilarii Valenciennes, 1850
Serrapinnus heterodon (Eigenmann, 1915) Serrapinnus notomelas Eigenmann, 1915 Triportheus angulatus (Spix & Agassiz, 1829) Serrasalmus spilopleura Kner, 1858
Família CRENUCHIDAE
Characidium aff. zebra Eigenmann, 1909 Família CURIMATIDAE
Cyphocharax modestus (Fernandez-Yepes, 1948) Cyphocharax nagelii (Steindachner, 1881) Família PROCHILODONTIDAE
Prochilodus lineatus (Valenciennes, 1836) Família ANASTOMIDAE
Leporinus friderici (Bloch, 1794)
Família PARODONTIDAE
Apareiodon piracicabae (Eigenmann, 1907) Parodon tortuosus Eigenmann & Norris, 1900 Família ERYTHRINIDAE
Hoplias malabaricus (Bloch, 1794)
Ordem GYMNOTIFORMES Família GYMNOTIDAE
Gymnotus carapo Linnaeus, 1758
Ordem SILURIFORMES
Família LORICARIIDAE
Hypostomus ancistroides (Ihering, 1911) Hypostomus strigaticeps (Regan, 1908) Hypostomus regani (Ihering, 1905)
Rineloricaria latirostris (Boulenger, 1900) Família CALLICHTHYIDAE
Corydoras paleatus (Jenys, 1842) Hoplosternum littorale (Hancock, 1828) Família PIMELODIDAE
Pimelodus maculatus Lacèpede, 1803 Família HEPTAPTERIDAE
Pimelodella gracilis (Valenciennes, 1836) Rhamdia quelen (Quoy & Gaimard, 1824)
Ordem CYPRINODONTIFORMES Família POECILIIDAE
Phalloceros caudimaculatus (Hensel, 1868) Poecilia vivipara Bloch & Schneider, 1801
Ordem PERCIFORMES Família CICHLIDAE
Geophagus brasiliensis Kner, 1865
Com relação às espécies dominantes, destacam-se: Bryconamericus stramineus, Astyanax sp.,
Ao se levar em consideração o peso capturado Hypostomus strigaticeps, Hoplias malabaricus, Salminus hilarii, Rhamdia quelen, Astyanax altiparanae, Leporinus friderici, Hoplosternum littorale, Prochilodus lineatus e Schizodon nasutus contribuem com mais de 80% das capturas.
Dezoito espécies de pequeno porte (L < 15 cm) dominaram numericamente as coletas (cerca de 75%). Corydoras paleatus, Phalloceros caudimaculatus, Oligosarcus paranensis e Poecilia vivipara, além de raras são menores que 5 cm. Espécies de médio porte (L > 30 cm) foram representadas por Leporinus friderici, Prochilodus lineatus, Salminus hilarii e Hoplias malabaricus as quais respondem por 30% do peso capturado. O maior indivíduo capturado foi uma traíra Hoplias malabaricus com 40.9 cm e o menor foi um espécime de Corydoras paleatus com 3.7 cm.
Tabela 1: Espécies capturadas, número de indivíduos (N) e contribuição (N(%)), peso (Wt), contribuição (W (%)) e amplitude do peso (W(g)) e comprimento (L(cm)).
Espécie N N(%) Wt W(%) W(g) L(cm)
Bryconamericus stramineus 484 19.60 571.75 1.038 0.14-3.37 2.7-6.8
Astyanax sp. 437 17.66 906.11 1.631 0.27-6.82 3.0-8.8
Hypostomus strigaticeps 350 14.14 18977.4 34.167 0.24-371.04 3.5-31.0 Astyanax altiparanae 291 11.76 4144.11 7.461 1.03-39.95 4.2-14.0 Astyanax fasciatus 181 7.31 1538.03 2.769 1.46-35.49 5.2-13.2 Serrapinnus notomelas 142 5.74 126.54 0.228 0.22-2.77 2.8-6.6 Astyanax scabripinnis 103 4.16 121.47 0.219 0.09-7.26 2.5-8.4 Pimelodella gracilis 76 3.07 489.32 0.881 1.27-17.66 2.4-13.2 Cyphocharax modesta 46 1.86 556.67 1.002 0.43-37.20 3.2-13.7 Serrapinnus heterodon 46 1.86 56.46 0.102 0.52-1.92 4.3-5.7 Cyphocharax nagelii 43 1.74 1008.68 1.816 12.10-42.66 9.7-14.6 Rhamdia quelen 40 1.62 3590.79 6.465 0.88-264.26 4.9-29.9 Hypostomus ancistroides 39 1.58 1367.47 2.462 10.45-81.84 9.5-19.2 Hoplosternum littorale 37 1.49 2442.14 4.397 17.94-185.28 10.3-29.5 Hoplias malabaricus 27 1.09 6123.27 11.024 18.32-926.40 11.4-40.9 Geophagus brasiliensis 20 0.81 521.05 0.938 2.02-162.4 5.2-23.8 Leporinus friderici 16 0.65 2542.06 4.577 37.6-434.75 14.6-32.7 Hyphessobrycon eques 16 0.65 7.2 0.013 0.28-0.77 2.9-3.8 Salminus hilarii 13 0.53 4264.88 7.679 63.45-650.20 18.3-37.2 Characidium aff. zebra 13 0.53 29.84 0.054 0.9-6.1 4.7-8.3 Triportheus angulatus 12 0.48 1322.74 2.381 92.94-140.54 18.8-21.8 Schizodon nasutus 9 0.36 1643.25 2.959 63.2-368.30 18.9-29.2 Leporinus octofasciatus 7 0.28 592.31 1.066 18.67-158.00 11.9-22.6 Rineloricaria latirostris 6 0.24 75.98 0.137 8.15-16.97 12.0-19.2 Prochilodus lineatus 5 0.20 1837.54 3.308 157.54-675.00 23.0-36.2 Gymnotus carapo 3 0.12 201.09 0.362 31.2-104.91 19.8-29.4 Serrasalmus spilopleura 2 0.08 185.61 0.334 92.47-93.14 14.8-15.6 Parodon tortuosus 2 0.08 47.52 0.086 20.93-26.59 12.1-12.3 Apareiodon piracicabae 2 0.08 42.89 0.077 18.62-24.27 11.3-12.6
Pimelodus maculatus 1 0.04 151.82 0.273 21.6
Hypostomus regani 1 0.04 49.59 0.089 16.2
Oligosarcus paranensis 1 0.04 0.81 0.001 4.6
Corydoras paleatus 1 0.04 0.76 0.001 3.7
Poecilia vivipara 1 0.04 0.71 0.001 4.7
Phalloceros caudimaculatus 1 0.04 0.39 0.001 4.5
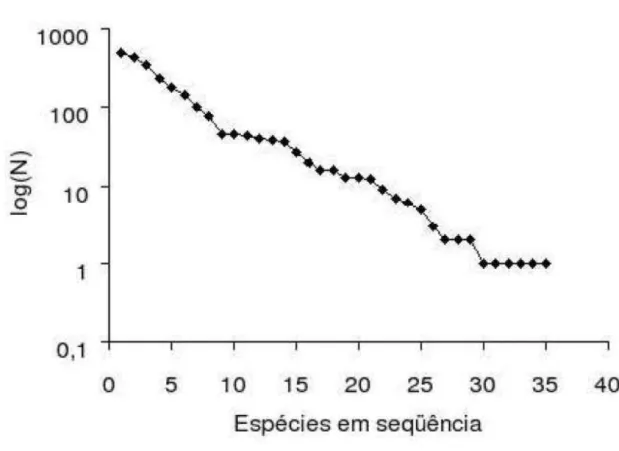
Figura 12: Distribuição das espécies em ordem de importância para a bacia do Corumbataí.
4.2. Ocorrência das espécies
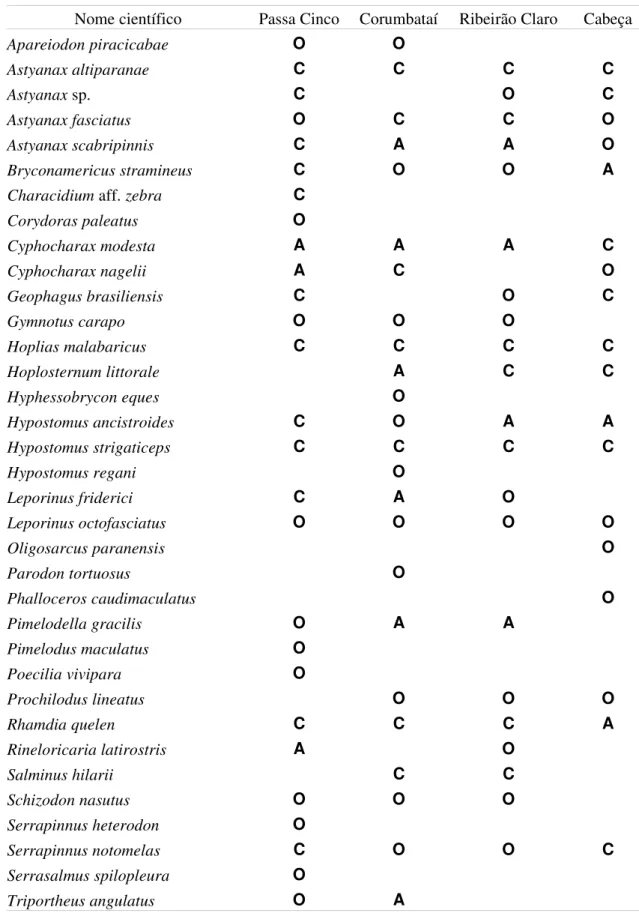
Tabela 2: Relação das espécies capturadas nos diferentes rios e sua classificação baseada na persistência das espécies nas coletas: constante (C), acessória (A) e ocasional (O).
Nome científico Passa Cinco Corumbataí Ribeirão Claro Cabeça
Apareiodon piracicabae O O
Astyanax altiparanae C C C C
Astyanax sp. C O C
Astyanax fasciatus O C C O
Astyanax scabripinnis C A A O
Bryconamericus stramineus C O O A
Characidium aff. zebra C
Corydoras paleatus O
Cyphocharax modesta A A A C
Cyphocharax nagelii A C O
Geophagus brasiliensis C O C
Gymnotus carapo O O O
Hoplias malabaricus C C C C
Hoplosternum littorale A C C
Hyphessobrycon eques O
Hypostomus ancistroides C O A A
Hypostomus strigaticeps C C C C
Hypostomus regani O
Leporinus friderici C A O
Leporinus octofasciatus O O O O
Oligosarcus paranensis O
Parodon tortuosus O
Phalloceros caudimaculatus O
Pimelodella gracilis O A A
Pimelodus maculatus O
Poecilia vivipara O
Prochilodus lineatus O O O
Rhamdia quelen C C C A
Rineloricaria latirostris A O
Salminus hilarii C C
Schizodon nasutus O O O
Serrapinnus heterodon O
Serrapinnus notomelas C O O C
Serrasalmus spilopleura O
4.2.1. Bryconamericus stramineus
O piquira Bryconamericus stramineus, a espécie mais abundante nas coletas, apresentou comprimento máximo L = 6.8 cm e peso máximo W = 3.4 g. Ocorreu em todos os rios: de forma constante no Passa Cinco; acessória no Cabeça; e ocasional no Ribeirão Claro e Corumbataí (Tabela 2). Este peixe foi muito abundante na junção do Cabeça com o Passa Cinco durante a primeira coleta e no trecho intermediário do Passa Cinco na segunda coleta. O número de indivíduos capturados está estatisticamente relacionado com a ordem do rio, ambiente e período de coleta (X2 = 265.9; gl = 12; p < 0.01). O piquira foi muito abundante nos trechos de ordem 5 (97%), no segundo período de coleta (78%) e com grande ocorrência em ambientes de corredeira (44%) (Tabela 3).
Tabela 3: Número de indivíduos observados e esperados (entre parêntesis) de Bryconamericus stramineus de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4 0 (1) 0 (0.47) 10 (0.73) 0 (3.49) 0 (1.7) 0 (2.66)
5 93 (45.1) 0 (22) 1 (34.37) 122 (164.62) 103 (80.39) 153 (125.57)
6 0 (0.19) 0 (0.09) 0 (0.15) 0 (0.7) 2 (0.34) 0 (0.53)
Total 93 (46.29) 0 (22.56) 11 (35.25) 122 (168.81) 105 (82.43) 153 (128.76)
4.2.2. Astyanax sp.
Tabela 4: Número de indivíduos observados e esperados (entre parêntesis) de Astyanax sp. de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4 0 (0.1) 3 (0.49) 0 (0.87) 0 (0.1) 0 (0.51) 0 (0.91)
5 28 (13.38) 43 (65.56) 138 (115.96) 2 (13.94) 86 (68.32) 101 (120.84) 6 0 (1.32) 0 (5.93) 2 (10.49) 0 (1.26) 15 (6.18) 19 (10.93) Total 28 (14.8) 46 (71.98) 140 (127.32) 2 (15.3) 101 (75.01) 120 (132.68)
4.2.3. Hypostomus strigaticeps
O cascudo Hypostomus strigaticeps, apresentou comprimento máximo L = 31 cm e peso máximo W = 371.0 g. Ocorreu em todos os rios de forma constante (Tabela 2). Este cascudo foi muito abundante no ponto 1 do Passa Cinco que apresenta cobertura vegetal entre 51 e 75% e no ponto 3 do Corumbataí que apresenta de 0 a 25% de cobertura vegetal. O número de indivíduos capturados está estatisticamente relacionado com a ordem do rio e cobertura vegetal (X2 = 263.3; gl = 17; p < 0.01). Foi muito abundante nos trechos de ordem 5 (56%) e em locais onde a cobertura vegetal estava entre 0 a 25% (71%), porém, não apresentou diferenças significativas na abundância capturada nos diferentes períodos de coleta (Tabela 5).
Tabela 5: Número de indivíduos observados e esperados (entre parêntesis) de Hypostomus strigaticeps de acordo com a ordem dos rios, períodos de coleta e cobertura vegetal (1: 0-25%, 2: 26-50%, 3:51-75% e 4: acima de 76%).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Cobertura Cobertura
1 2 3 4 1 2 3 4
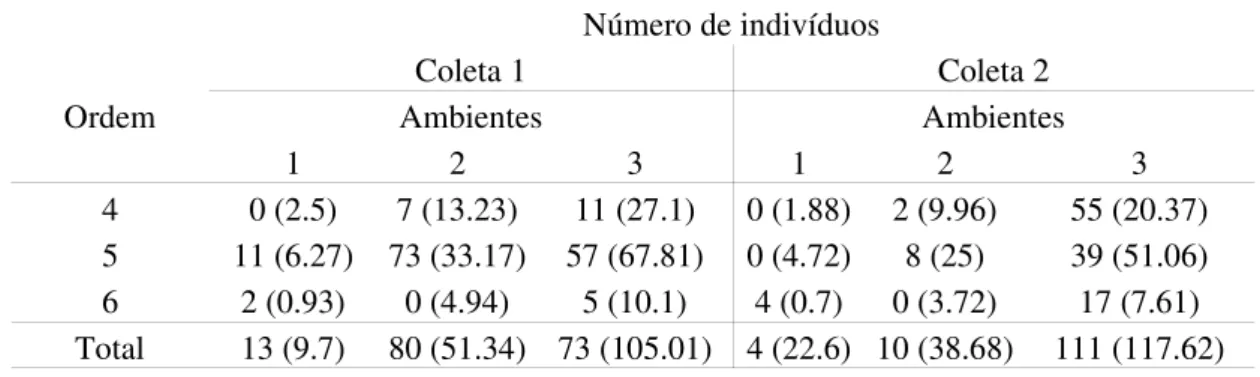
4.2.4. Astyanax altiparanae
O lambari de rabo amarelo Astyanax altiparanae apresentou comprimento máximo L = 14 cm e peso máximo W = 40 g. Esta espécie ocorreu em todos os rios de forma constante (Tabela 2). O lambari de rabo amarelo foi muito abundante no ponto 1 durante a primeira coleta no Passa Cinco. O número de indivíduos capturados está estatisticamente relacionado com a ordem do rio, ambiente e período de coleta (X2 = 163.9; gl = 12; p < 0.01). Foi muito abundante nos trechos de ordem 5 (65%), no primeiro período de coleta (57%) e com grande ocorrência em ambientes de rio corrente (63%) (Tabela 6).
Tabela 6: Número de indivíduos observados e esperados (entre parêntesis) de Astyanax altiparanae de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4 0 (2.5) 7 (13.23) 11 (27.1) 0 (1.88) 2 (9.96) 55 (20.37) 5 11 (6.27) 73 (33.17) 57 (67.81) 0 (4.72) 8 (25) 39 (51.06) 6 2 (0.93) 0 (4.94) 5 (10.1) 4 (0.7) 0 (3.72) 17 (7.61) Total 13 (9.7) 80 (51.34) 73 (105.01) 4 (22.6) 10 (38.68) 111 (117.62)
4.2.5. Astyanax fasciatus
Tabela 7: Número de indivíduos observados e esperados (entre parêntesis) de Astyanax fasciatus de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4 0 (0.03) 1 (1.93) 12 (0.47) 0 (0.19) 2 (13.98) 5 (3.4) 5 1 (0.21) 5 (15.09) 0 (3.67) 0 (1.51) 136 (109.03) 14 (26.5) 6 1 (0.01) 0 (0.48) 2 (0.12) 0 (0.05) 0 (3.49) 2 (0.85) Total 2 (0.25) 6 (17.5) 14 (4.26) 0 (1.75) 138 (128.25) 21 (30.75)
4.2.6. Serrapinnus notomelas
O Serrapinnus notomelas apresentou comprimento máximo L = 6.6 cm e peso máximo W = 2.8 g. Ocorreu em todos os rios: de forma constante no Passa Cinco e Cabeça e ocasional no Corumbataí e Ribeirão Claro (Tabela 2). O Serrapinnus notomelas foi muito abundante no ponto 1 durante o segundo período de coleta nos rios Passa Cinco e Cabeça. O número de indivíduos capturados está estatisticamente relacionado com a ordem do rio e período de coleta (X2 = 44.8; gl = 12; p < 0.01). Foi muito abundante nos trechos de ordem 5 (93%), no segundo período de coleta (85%), porém, não apresentou diferenças significativas na abundância capturada nos diferentes tipos de ambiente (Tabela 8).
Tabela 8: Número de indivíduos observados e esperados (entre parêntesis) de Serrapinnus notomelas de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4.2.7. Astyanax scabripinnis
O lambari Astyanax scabripinnis apresentou comprimento máximo L = 8.4 cm e peso máximo W = 7.3 g. Ocorreu em todos os rios: de forma constante no Passa Cinco, acessória no Cabeça e ocasional no Corumbataí e Ribeirão Claro (Tabela 2). Este lambari foi muito abundante no ponto 2 durante o primeiro período de coleta no Ribeirão Claro e no ponto 1 durante o segundo período no Passa Cinco. O número de indivíduos capturados está estatisticamente relacionado com o ambiente (X2 = 121.2; gl = 7; p < 0.01). Foi muito abundante em ambientes de rio corrente (63%), porém, não apresentou diferenças significativas na abundância capturada nas diferentes ordens do rio e períodos de coleta (Tabela 9).
Tabela 9: Número de indivíduos observados e esperados (entre parêntesis) de Astyanax scabripinnis de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça e 3 – rio corrente).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 3 1 2 3
4 5 (1.84) 0 (8.14) 39 (17.06) 1 (1.43) 0 (6.31) 3 (13.23) 5 1 (2.11) 4 (9.32) 9 (19.55) 0 (1.63) 27 (7.23) 14 (15.16) Total 6 (3.95) 4 (21.41) 48 (36.61) 1 (3.06) 27 (13.54) 17 (28.39)
4.2.8. Pimelodella gracilis
Tabela 10: Número de indivíduos observados e esperados (entre parêntesis) de Pimelodella gracilis de acordo com a ordem dos rios, períodos de coleta e ambientes (1 – corredeira, 2 – poça).
Ordem
Número de indivíduos
Coleta 1 Coleta 2
Ambientes Ambientes
1 2 1 2
4 5 (0.97) 1 (0.45) 0 (3.13) 0 (1.45)
5 2 (11.34) 10 (5.24) 45 (36.55) 13 (16.87)
Total 7 (12.31) 11 (5.69) 45 (39.68) 13 (18.32)
4.2.9. Rhamdia quelen
O bagre Rhamdia quelen apresentou comprimento máximo L = 29.9 cm e peso máximo W = 264.3 g. Ocorreu em todos dos rios. No Passa Cinco, Corumbataí e Ribeirão Claro ocorreu de forma constante e no Cabeça foi acessória (Tabela 2). A maior contribuição em peso ocorreu no ponto 3 do Corumbataí no segundo período com 1367.8 g proveniente de 11 indivíduos capturados. O número de indivíduos capturados em um determinado período de coleta é estatisticamente dependente da ordem do rio (X2 = 3.4; gl = 2; p = 0.18), é evidente que a captura foi maior no segundo período (87.5%) (Tabela 11).
Tabela 11: Número de indivíduos observados e esperados (entre parêntesis) de Rhamdia quelen de acordo com a ordem dos rios e períodos de coleta.
Ordem
Número de indivíduos
Coleta 1 Coleta 2 Total
4 2 (1.63) 11 (11.37) 13
5 3 (1.62) 10 (11.37) 13
6 0 (1.75) 14 (12.26) 15
4.2.10. Hoplosternum littorale
O caborja Hoplosternum littorale apresentou comprimento máximo L = 29.5 cm e um peso máximo W = 185.3 g. Não ocorreu no Passa Cinco. No Ribeirão Claro e Cabeça ocorreu de forma constante e no Corumbataí foi espécie acessória (Tabela 2). O caborja foi mais abundante no ponto 3 do Ribeirão Claro onde foram capturados 19 indivíduos. A maior contribuição em peso ocorreu no ponto 3 no segundo período de coleta tanto no Corumbataí, com 812.4 g e 8 indivíduos quanto no Ribeirão Claro, com 726.7 g e 18 indivíduos. Estes locais apresentaram baixos valores de oxigênio dissolvido. O número de indivíduos capturados em um determinado período de coleta é estatisticamente dependente da ordem do rio (X2 = 3.3; gl = 2; p = 0.19), é evidente que a captura foi maior no segundo período (81%) (Tabela 12).
Tabela 12: Número de indivíduos observados e esperados (entre parêntesis) de Hoplosternum littorale de acordo com a ordem dos rios e períodos de coleta.
Ordem
Número de indivíduos
Coleta 1 Coleta 2 Total
4 3 (3.98) 18 (17.02) 21
5 3 (1.32) 4 (5.68) 7
6 1 (1.7) 8 (7.3) 9
Total 7 30 37
4.2.11. Hoplias malabaricus
Tabela 13: Número de indivíduos observados e esperados (entre parêntesis) de Hoplias malabaricus de acordo com a ordem dos rios e períodos de coleta.
Ordem
Número de indivíduos
Coleta 1 Coleta 2 Total
4 1 (1.63) 3 (2.38) 4
5 8 (6.93) 9 (10.07) 17
6 2 (2.44) 4 (3.55) 6
Total 11 16 27
4.2.12. Leporinus friderici
A piava Leporinus friderici, apresentou um comprimento máximo L = 32.7 cm e um peso máximo W = 434.8 g. Não ocorreu no Cabeça. A piava foi constante no Passa Cinco, ocasional no Ribeirão Claro e acessória no Corumbataí (Tabela 2). A maior contribuição em peso ocorreu no ponto 1 do Ribeirão Claro durante o primeiro período de coleta com 873.2 g e 9 indivíduos, e no ponto 2 do Passa Cinco durante os dois períodos de coleta com 936.9 g e 4 indivíduos. O número de indivíduos capturados em um determinado período de coleta é estatisticamente dependente da ordem do rio (X2 = 6.7; gl = 2; p = 0.035). Foi muito abundante nos trechos de ordem 4 (56%), no primeiro período de coleta (81%) (Tabela 14).
Tabela 14: Número de indivíduos observados e esperados (entre parêntesis) de Leporinus friderici de acordo com a ordem dos rios e períodos de coleta.
Ordem
Número de indivíduos
Coleta 1 Coleta 2 Total
4 9 (7.31) 0 (1.69) 9
5 3 (3.25) 1 (0.75) 4
6 1 (2.44) 2 (0.56) 3
4.2.13. Salminus hilarii
A tabarana Salminus hilarii, apresentou comprimento máximo L = 37.2 cm e peso máximo W = 650.2 g. Ocorreu de forma constante nos rios Corumbataí e Ribeirão Claro (Tabela 2). A maior contribuição em peso ocorreu no ponto 2 do Corumbataí com 1958 g e 4 indivíduos, e no ponto 1 do Ribeirão Claro durante o segundo período de coleta com 1067.2 g e 4 indivíduos. O número de indivíduos capturados em um determinado período de coleta é estatisticamente independente da ordem do rio (X2 = 1.04; gl = 2; p = 0.308) (Tabela 15).
Tabela 15: Número de indivíduos observados e esperados (entre parêntesis) de Salminus hilarii de acordo com a ordem dos rios e períodos de coleta.
Ordem
Número de indivíduos
Coleta 1 Coleta 2 Total
4 5 (4.15) 4 (4.85) 9
5 1 (1.85) 3 (2.15) 4
Total 6 7 13
4.2.14. Schizodon nasutus
Tabela 16: Número de indivíduos observados e porcentagem do total (entre parêntesis) de Schizodon nasutus de acordo com a ordem dos rios.
Ordem
Número de indivíduos Coleta 2 4
5 6
3 (33.33) 1 (11.11) 5 (55.56)
Total 9 (100)
4.2.15. Prochilodus lineatus
O curimbatá Prochilodus lineatus, apresentou comprimento máximo L = 36.2 cm e peso máximo W = 675 g. O curimbatá ocorreu de forma ocasional nos rios Corumbataí, Ribeirão Claro e Cabeça (Tabela 2). Só ocorreu no primeiro período de coleta e em rios de ordem 5 e a maior contribuição em peso ocorreu no ponto 2 do Corumbataí com 2 indivíduos pesando 843g.
4.3.Curvas de rarefação
Figura 13: Curvas de rarefação para os diferentes rios da bacia do Corumbataí.
Para utilizar a riqueza como uma medida de diversidade fixou-se o tamanho da amostra em 2, 10, 50, 100 e 150 indivíduos (Tabela 17 e Figura 14). Pelo método da rarefação estimou-se que para um tamanho amostral de 150 indivíduos o Ribeirão Claro possui maior riqueza (19 espécies), seguido pelo rio Corumbataí (17), Cabeça (15) e finalmente o rio Passa Cinco com 14 espécies.
Tabela 17: Número esperado de espécies (desvio padrão) por rio para amostras com N indivíduos.
N Passa Cinco Corumbataí Ribeirão Claro Cabeça
2 1.80 (0.40) 1.82 (0.38) 1.86 (0.35) 1.84 (0.37)
10 5.05 (1.12) 5.45 (1.19) 6.23 (1.24) 5.67 (1.19)
Figura 14: Curva de rarefação com N = 150 indivíduos.
4.4.Medidas de diversidade
Tabela 18: Riqueza de espécies (S), abundância (N), índice de Margalef (DMg), índice de Berger-Parker (1/d), índice de Simpson (1/D), índice de Shannon para abundância (H’N), índice de Shannon para peso (H’P) e eqüabilidade de Simpson (E1/D) para os diferentes trechos (1, 2 e 3) e épocas de coleta (1: março-junho e 2: setembro-dezembro) na bacia do rio Corumbataí.
Rio Trecho Época S N DMg 1/d 1/D H’N H’P E1/D
C
abe
ça
1 1 5 6 2.23 3.03 14.29 2.25 0.94 0.90
2 4 53 0.76 1.20 1.45 0.92 0.55 0.36
2 1 9 63 1.93 3.45 5.88 2.68 1.91 0.59
2 7 53 1.51 2.13 3.70 2.22 2.16 0.50
3 1 7 130 1.23 1.39 1.87 1.49 2.46 0.27
2 13 89 2.67 4.00 7.69 3.19 2.75 0.57
C
or
umb
at
aí
1 1 6 34 1,42 2.00 3.33 1.98 1.53 0.52
2 4 16 1.08 2.00 2.78 1.53 1.11 0.63
2 1 9 33 2.29 3.33 6.67 2.79 1.87 0.27
2 10 247 1.63 1.64 2.33 1.67 2.57 0.40
3 1 11 62 2.42 1.82 3.12 2.33 2.21 0.63
2 12 105 2.36 2.56 5.00 2.76 2.56 0.23
P as sa C inc o
1 1 12 385 1.85 2.38 3.70 2.19 1.63 0.31
2 13 375 2.02 2.33 4.00 2.58 2.51 0.31
2 1 8 106 1.50 2.38 4.00 2.34 2.03 0.49
2 12 354 1.87 1.27 1.59 1.28 1.76 0.13
3 1 4 6 1.67 3.03 7.69 1.92 1.59 0.90
2 17 122 3.33 2.86 4.76 2.84 2.59 0.27
R ib ei rã o C la ro
1 1 9 39 2.18 4.35 4.14 2.87 2.34 0.70
2 10 32 2.60 5.26 11.11 3.16 2.30 0.83
2 1 7 60 1.47 1.61 2.44 1.83 1.07 0.34
2 6 13 1.95 3.23 6.67 2.35 1.32 0.76
3 1 6 21 1.64 1.32 1.75 1.34 2.31 0.28
2 5 70 0.94 1.43 1.82 1.13 1.55 0.36
Tabela 19: Riqueza de espécies (S), abundância (N) e índices com intervalo de confiança obtido através do método “jackknife” ( = 0.05 e n = 6) dos quatro rios: índice de riqueza de espécies de Margalef (DMg), índice de Berger-Parker (d), índice de Simpson (D), índice de Shannon (H’), eqüabilidade de Simpson (E1/D) e índice da série logarítmica ( ).
Passa Cinco Corumbataí Ribeirão Claro Cabeça Diversidade
S 27 24 21 18
N 1348 497 235 395
DMg 4.54
(3.00 a 6.08)
4.61 (3.78 a 5.43)
4.62 (3.56 a 5.67)
3.41 (2.68 a 4.14)
d 0.20
(0.01 a 0.38)
0.10 (0.00 a 0.27)
0.10 (0.00 a 0.22)
0.13 (0.05 a 0.21)
D 0.14
(0.08 a 0.20)
0.09 (0.01 a 0.17)
0.05 (0.00 a 0.11)
0.11 (0.04 a 0.18)
H' 3.17
(2.84 a 3.51)
3.52 (2.80 a 4.24)
4.22 (3.57 a 4.87)
3.46 (2.79 a 4.13)
E1/D 0.59
(0.51 a 0.67)
0.68 (0.52 a 084)
0.85 (0.74 a 0.96)
0.74 (0.62 a 0.86) 4.80
(4.02 a 5.57)
5.34 (4.27 a 6.42)
5.69 (4.23 a 7.15)
4.26 (3.29 a 5.22)
Figura 15: Distribuição das espécies em ordem de importância.
A baixa dominância que ocorreu no Ribeirão Claro está refletida no ajuste do modelo “broken stick”. Os dados do rio Cabeça se ajustaram aos modelos série logarítmica, lognormal e “broken stick”. As assembléias dos rios Passa Cinco e Corumbataí mostraram um padrão lognormal (Tabela 20).
Tabela 20: Ajuste dos modelos de distribuição espécie-abundância, através do teste de X2 com P > 0.05. Modelos Passa Cinco Corumbataí Ribeirão Claro Cabeça
Série logarítmica sim sim sim sim
Log normal sim sim sim sim
Broken stick não não sim sim
Série geométrica não não sim não
As assembléias de peixes dos rios Passa Cinco e Cabeça apresentaram maior similaridade quanto a composição das espécies que àquelas encontradas nos rios Corumbataí e Ribeirão Claro (Tabela 21). O mesmo aconteceu com relação à classificação trófica, porém, a assembléia de peixes do Ribeirão Claro apresentou-se dissimilar a qualquer outro levantamento (Tabelas 22 e 23).
Tabela 21: Matriz de similaridade entre a composição de espécies dos rios da bacia do Corumbataí, utilizando-se o índice de Morisita-Horn.
Passa Cinco Corumbataí Ribeirão Claro Cabeça
Passa Cinco 1.0000
Corumbataí 0.0103 1.0000
Ribeirão Claro -0.0654 0.1618 1.0000
Tabela 22: Classificação trófica das espécies, número total de indivíduos após a aplicação do índice de dominância e porcentagem de piscívoros para a bacia do rio Corumbataí.
Classificação trófica Passa Cinco Corumbata í Ribeirão Claro Cabeç a
Detritívoros 0 0 13 2
Herbívoros Bentônicos 203 121 14 64
Insetívoros Bentônicos 476 87 33 231
Insetívoros Generalistas 598 51 102 39
Onívoros 0 167 38 19
Piscívoros 0 14 12 10
Total 1277 426 200 355
Porcentagem de
piscívoros 0,00 3,29 6,00 2,82
Tabela 23: Matriz de similaridade entre a composição por grupo trófico dos rios da bacia do Corumbataí, utilizando-se o índice de Morisita-Horn.
Passa Cinco Corumbataí Ribeirão Claro Cabeça
Passa Cinco 1.0000
Corumbataí 0.0329 1.0000
Ribeirão Claro -0.2782 -0.0223 1.0000
Cabeça 0.5517 0.2030 -0.0167 1.0000
4.5. Variáveis físico-químicas
Tabela 24: Trecho do rio, classificação hierárquica (Ordem), altitude (m) e comprimento (C) em (m) em diferentes épocas (1: março-junho e 2: setembro-dezembro). Variáveis físicas: profundidade (Prof) e largura (Larg) em (m); velocidade (Veloc) em (m/s) e temperatura (T) em (ºC).
Rio Trecho Ordem Altitude C Época Prof Larg Veloc T
C
abe
ça
1 5 613 84 1 1.03 4.10 0.93 26.40
2 0.87 4.10 0.54 24.13
2 5 563 127 1 1.35 17.00 0.61 23.00
2 0.97 17.00 0.37 22.70
3 5 537 200 1 1.25 13.33 0.52 19.77
2 1.25 13.33 0.39 26.23
C
or
umb
at
aí
1 4 636 88 1 1.07 9.00 0.78 24.57
2 0.80 8.90 0.57 21.20
2 5 574 180 1 1.53 11.90 0.78 23.83
2 1.53 13.30 0.75 22.60
3 6 466 155 1 1.15 35.00 0.47 20.83
2 1.28 35.00 0.42 26.63
P as sa C inc o
1 5 627 150 1 1.07 6.25 0.74 24.00
2 0.76 5.50 0.40 18.10
2 5 565 138 1 0.77 11.60 1.00 24.77
2 0.67 11.60 0.85 25.23
3 6 523 200 1 0.88 15.30 1.02 18.13
2 0.88 10.00 0.67 29.70
R ib ei rã o C la ro
1 4 600 102 1 1.40 7.20 0.72 24.57
2 1.17 3.00 0.84 20.50
2 4 571 150 1 1.00 6.90 0.22 18.33
2 0.75 6.90 0.27 21.73
3 4 563 160 1 2.00 15.33 0.15 19.87
Figura 16: Amplitude (E.P.: erro padrão) e média das variáveis físicas nos diferentes rios da bacia do Corumbataí (CA: Cabeça, CO: Corumbataí, PC: Passa Cinco e RC: Ribeirão Claro).
Tabela 25: Trecho do rio em diferentes épocas (1: março-junho e 2: setembro-dezembro). Variáveis químicas: turbidez (Turb), oxigênio dissolvido (O2) em (mg/ml), grau de acidez (pH) e condutividade (Cond) em (µS/s).
Rio Trecho Época Turb O2 pH Cond
C
abe
ça
1 1 56.87 10.30 6.06 0.029
2 90.67 7.99 7.35 0.018
2 1 126.67 11.20 6.60 0.030
2 78.00 10.86 6.43 0.040
3 1 90.33 9.17 6.68 0.017
2 233.00 7.74 7.87 0.025
C
or
umb
at
aí
1 1 54.43 10.29 6.67 0.028
2 54.67 8.69 7.62 0.017
2 1 49.33 10.13 6.73 0.030
2 161.00 8.37 7.55 0.021
3 1 24.00 6.95 5.82 0.080
2 165.67 7.66 6.53 0.011
P as sa C inc o
1 1 15.33 7.81 7.20 0.047
2 5.33 9.17 8.16 0.035
2 1 28.67 10.45 6.88 0.039
2 8.33 9.85 7.23 0.060
3 1 22.00 9.41 6.89 0.028
2 28.00 7.31 8.05 0.047
R ibe ir ão C la ro
1 1 46.73 10.17 7.29 0.058
2 35.33 8.25 7.69 0.037
2 1 26.00 9.31 5.89 0.023
2 54.00 7.67 7.49 0.035
3 1 19.33 5.17 6.30 0.076
Figura 17: Amplitude (E.P.: erro padrão) e média das variáveis químicas nos diferentes rios da bacia do Corumbataí (CA: Cabeça, CO: Corumbataí, PC: Passa Cinco e RC: Ribeirão Claro).
Os diferentes rios da bacia não apresentaram diferenças significativas quanto às variáveis físicas e químicas (Tabela 26).
Tabela 26: Análise de variância multivariada (MANOVA). Variável dependente: físicas (profundidade, largura, velocidade superficial e temperatura) e químicas (turbidez, oxigênio dissolvido, pH e condutividade); variável independente: rios Passa Cinco, Corumbataí, Ribeirão Claro e Cabeça.
Variável dependente n R de Rao p
Físicas 24 1.927 0.056
4.6. Análise de covariância
O número de espécies aumentou significativamente conforme a ordem do rio (n = 24; r = 0.456; r2 = 0.208; p = 0.025) (Figura 18). Esta regressão apresentou linearidade Fcalc = 0.07 < F.05;1,21 = 4.3248 (Tabela 27).
y = -2.221 + 2.235x
Figura 18: Ordem do rio versus riqueza (S).
Tabela 27: Análise de variância para verificar a linearidade dos pontos da regressão entre número de espécies e ordem dos rios: SQ (soma de quadrados), gl (graus de liberdade), QM (quadrado médio) e teste F.
Fonte de variação SQ gl QM F
Total 271.83 23
Entre grupos 57.04 2
Regressão linear 56.63 1
Desvio da linearidade 0.41 1 0.41 0.04 Dentro dos grupos 214.79 21 10.23
y = -1.717 + 0.448x
Figura 19: Temperatura da água versus riqueza (S).
A temperatura da água assumiu dois tipos de informação, um deles que é a atuação sobre o
metabolismo dos peixes e um outro que mostra o efeito temporal. Como as coletas foram realizadas ao
longo do tempo, conforme as doze primeiras aconteceram a temperatura diminuiu (n = 12; r = 0.815; r2 =
0.663; p = 0.001), ao passo que, ao longo das doze últimas a temperatura aumentou (n = 12; r = 0.796; r2 =
0.634; p = 0.002) (Figura 20).
y = 26.458 – 0.634x y = 10.379 + 0.709x
Existe uma relação linear entre o logaritmo natural do número de indivíduos e o número de espécies
capturadas (n = 24; r = 0.667; r2 = 0.465; p = 0.0002) (Figura 21).
y = 0.376 + 2.022x
Figura 21: Logaritmo natural do número de indivíduos (ln N) versus riqueza (S).
Ao se plotar o logaritmo natural do número de indivíduos contra a riqueza de espécies para os
diferentes rios da bacia, observou-se que o Ribeirão Claro apresentou um padrão muito distinto (Figura 22).
Retirando-se as coletas do Ribeirão Claro, ficou evidente que os diferentes rios não apresentam riquezas distintas, portanto a cerca de 78% da variabilidade do número de espécies na bacia pode ser explicada em função da variação no espaço, representado pela ordem dos rios; tempo e fisiologia,
representados pela temperatura; e tamanho da amostra, representado pelo logaritmo natural do número de indivíduos (Tabelas 28 e 29) (Figuras 23, 24 e 25).
Tabela 28: Análise de variância para a riqueza (S), considerando os diferentes rios, ordem, temperatura e número de indivíduos (ln N) sem o Ribeirão Claro. Variável dependente: S (n = 18; r = 0.881; r2 = 0.776).
Fonte de variação
SQ gl QM F p
Rio 0.950 2 0.475 0.099 0.907
Ordem 27.893 2 13.947 2.896 0.098
Temperatura 22.079 1 22.079 4.584 0.056
ln(N) 68.180 1 68.180 14.156 0.003
Erro 52.981 11 4.816
Tabela 29: Análise de variância para a riqueza (S) considerando ordem do rio, temperatura e número de indivíduos (ln N) sem o Ribeirão Claro. Variável dependente: S (n = 18; r = 0.879; r2 = 0.772).
Fonte de variação
SQ gl QM F p
Ordem 36.849 2 18.425 4.441 0.034
Temperatura 21.267 1 21.267 5.126 0.041
R2N 103.851 1 103.851 25.033 0.000
Figura 23: Valor médio e amplitude do número de espécies por ordem dos rios após o ajuste do modelo de covariância.
Figura 25: Histograma dos resíduos calculados a partir do modelo de covariância com número de espécies. Coeficiente de assimetria (g1 = -0.202; ns) e coeficiente de curtose (g2 = 0.455; ns).
4.7. Análises multivariadas
4.7.1. Análise de correspondência
Figura 26: Projeção dos “scores” dos 12 pontos de coleta obtidos através da análise de correspondência “detrended” (DCA). Autovalor do eixo 1 = 0,713 e eixo 2 = 0,319.
4.7.2. Análise de componentes principais
A análise de componentes principais das variáveis ambientais da paisagem no entorno do ponto de coleta indica uma associação entre o primeiro eixo com a ordem do rio, segundo eixo com cobertura vegetal e estado de preservação da mata ciliar e terceiro eixo com a presença de pasto (Tabela 30).
Tabela 30: Análise de componentes principais das variáveis ambientais da paisagem do ponto de coleta. Os valores maiores que 0.5 estão representados em negrito.
Autovetores
1 2 3
Autovalor 2.858 2.237 1.003
% de explicação 35.722 27.962 12.541
% acumulada 35.722 63.684 76.225
Variáveis
Ordem do rio 0.523 0.045 -0.275
Cobertura vegetal -0.238 0.544 -0.197
Preservação da mata ciliar -0.336 0.507 -0.115 Presença de eucalipto -0.277 -0.356 -0.052 Presença de cana-de-açúcar 0.345 0.416 0.262
Presença de pasto -0.272 -0.141 -0.746
Esgoto -0.286 -0.294 0.388
Estabilidade do barranco -0.453 0.194 0.305
4.7.3. Análise espécie-ambiente
A estrutura primária das assembléias de peixes dos diferentes rios da bacia, resumidas nos eixos 1 e 2 da análise de correspondência (DCA), mostraram-se estatisticamente semelhantes (Tabela 31).
Tabela 31: Análise de variância não-paramétrica (Kruskal-Wallis) para os eixos 1 e 2 da DCA considerando os diferentes rios.
Eixo X2 Graus de
liberdade
p
DCA1 7.308 3 0.063
Existe uma relação linear entre o eixo 2 da análise de componentes principais (PCA2), que representou a cobertura vegetal e estado de preservação da mata ciliar e o número de espécies coletadas (n = 12; r = 0.661; r2 = 0.437; p = 0.019) (Figura 28).
5. DISCUSSÃO
5.1. Diversidade de espécies
A América do Sul possui a ictiofauna continental mais rica e diversificada do planeta contendo aproximadamente 8000 espécies (SCHAEFER, 1998). Este número representa cerca de 24% de todas as espécies de peixes do mundo e contribui com 12,5% de toda a biodiversidade de vertebrados, tudo isto contido em somente 0,003% da água do mundo (VARI; MALABARBA, 1998).
Esta fauna é predominantemente composta por espécies da superordem Ostariophysi e as famílias Characidae da ordem Characiformes e Loricariidae da ordem Siluriformes representam, respectivamente, 22% e 10% do número total de espécies descritas da fauna ictiológica Neotropical (SCHAEFER, 1998).
A bacia do Paraná, em seu trecho brasileiro, é composta por mais de 250 espécies, das quais cerca de 40% são Characiformes e 36% Siluriformes (AGOSTINHO; JÚLIO JR., 1999). No Estado de São Paulo, segundo Castro e Menezes (1998), o sistema do alto Paraná contém 22 famílias e aproximadamente 170 espécies de peixes descritas. Riachos e cabeceiras são habitados por espécies de pequeno porte (SL < 12 cm), respondendo por aproximadamente 50% do total de espécies. Estes padrões foram encontrados nas coletas realizadas no sistema Corumbataí, pois apresentou maior contribuição de caraciformes seguida por siluriformes e das 35 espécies capturadas 18 são de peixes pequenos (L < 15 cm), representando cerca de 75% dos indivíduos coletados (Tabela 1).