UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS DE RIBEIRÃO PRETO
Produtos naturais de micro-organismos marinhos: estudo químico e
biológico de fungos endofíticos associados à alga vermelha
Bostrychia
radicans
Bárbara Boretti Galizoni
UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS DE RIBEIRÃO PRETO
Produtos naturais de micro-organismos marinhos: estudo químico e
biológico de fungos endofíticos associados à alga vermelha
Bostrychia
radicans
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas para obtenção do Título de Mestre em Ciências
Área de Concentração: Produtos Naturais e Sintéticos
Orientada: Bárbara Boretti Galizoni Orientadora: Hosana Maria Debonsi
Versão corrigida da Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas no dia 22/09/2014. A versão original encontra-se disponível na Faculdade de Ciências Farmacêuticas de Ribeirão Preto/USP.
AUTORIZO A REPRODUÇÃO E DIVULGAÇÃO TOTAL OU PARCIAL DESTE TRABALHO, POR QUALQUER MEIO CONVENCIONAL OU ELETRÔNICO, PARA FINS DE ESTUDO E PESQUISA, DESDE QUE CITADA A FONTE.
Galizoni, Bárbara Boretti
Produtos naturais de micro-organismos marinhos: estudo químico e biológico de fungos endofíticos associados à alga vermelha Bostrychia radicans. Ribeirão Preto, 2014.
103p.; 30cm.
Dissertação de Mestrado, apresentada à Faculdade de Ciências Farmacêuticas de Ribeirão Preto/USP – Área de concentração: Produtos Naturais e Sintéticos.
Orientadora: Hosana Maria Debonsi.
FOLHA DE APROVAÇÃO
Bárbara Boretti Galizoni
Produtos naturais de micro-organismos marinhos: estudo químico e biológico de fungos endofíticos associados à alga vermelha Bostrychia radicans.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas para obtenção do Título de Mestre em Ciências.
Área de Concentração: Produtos Naturais e Sintéticos.
Orientadora: Hosana Maria Debonsi
Aprovado em:
Banca Examinadora
Prof. Dr. ____________________________________________________________ Instituição: _____________________________ Assinatura:____________________
Prof. Dr. ____________________________________________________________ Instituição: _____________________________ Assinatura:____________________
Agradecimentos
A Deus, por me conceder saúde e sabedoria para trilhar meus caminhos e alcançar meus objetivos.
A minha orientadora Profa. Dra. Hosana Maria Debonsi pelos ensinamentos, amizade e acolhimento.
A Faculdade de Ciências Farmacêuticas de Ribeirão Preto e a Universidade de São Paulo.
Aos professores, técnicos, alunos e demais funcionários do Núcleo de Pesquisa em Produtos Naturais e Sintéticos (NPPNS) pelo auxílio e ensinamentos.
Aos queridos amigos do Laboratório de Química Orgânica do Ambiente Marinho, pelo companheirismo, amizade e apoio.
À FAPESP pela bolsa concedida e apoio financeiro.
A CAPES e CNPq pelo apoio financeiro.
Aos técnicos José Carlos Tomaz, Daniela Ricardo Engracia Caluz, Isabel Cristina Turatti, Ms. Jacqueline Nakau Mendonça, Maria Angélica, Ms. Vinícius Palaretti, Dr. Nivaldo Boralle e Clóvis Reis da Silva Júnior.
Às professoras Profa. Dra. Niege Araçari Jacometti Cardoso Furtado, Profa. Dra. Letícia Veras Costa-Lotufo e Profa. Dra. Maria Cláudia Marx Young pela colaboração científica.
Aos meus amigos, em especial a Marina, Lívia, Alyne e Ju, que fizeram meus momentos em Ribeirão mais alegres.
i
RESUMO
GALIZONI, B. B. Produtos naturais de micro-organismos marinhos: estudo químico e biológico de fungos endofíticos associados à alga vermelha Bostrychia radicans. 2014.
103f. Dissertação (Mestrado). Faculdade de Ciências Farmacêuticas de Ribeirão Preto – Universidade de São Paulo, Ribeirão Preto, 2014.
O ambiente marinho tem sido reconhecido como uma importante fonte de metabólitos secundários biologicamente ativos. Neste contexto, fungos endofíticos associados a algas ganharam importância nas últimas décadas, como alvos alternativos para a pesquisa de produtos naturais. O presente trabalho teve como o objetivo o estudo químico e biológico de duas linhagens de fungos endofíticos associados à alga vermelha Bostrychia radicans. Inicialmente foi realizada a triagem química e biológica (atividade antitumoral e antimicrobiana) dos extratos brutos das duas linhagens selecionadas, linhagens M20 (Hypocrea lixii) e M23 (Eutypella sp), obtidos a partir de cultivos em escala piloto, tanto variando-se os meios de cultivo e bem como períodos de crescimento. O extrato da linhagem M20 cultivada em arroz apresentou potencial citotóxico interessante quando submetido a ensaios utilizando células tumorais HCT-116. Ainda, após a análise química, esta linhagem foi selecionada para o cultivo em escala ampliada, visando o isolamento e elucidação estrutural dos metabólitos secundários presentes neste fungo. O estudo químico em escala ampliada da linhagem M20, espécie Hypocrea lixii, proporcionou o isolamento e identificação de quatro metabólitos: ácido 3-hidroxi-5-metóxi-6-metil-1,3-diidro-isobenzofurano-4-carboxílico (S1), 3,7-dimetóxi-6-metil-1-oxo-1,3-diidro-isobenzofurano-4-carbaldeído (S3), galactitol (S4), convolvulol (S5), além do isolamento de dois metabólitos que ainda não foram completamente elucidados, S2 e S6. Os metabólitos S1 e S3 são metabólitos inéditos como produtos naturais. Além disso, foi possível a identificação de 14 substâncias via cromatografia gasosa acoplada à espectrometria de massas (CG-EM), entre elas hidrocarbonetos, ácidos graxos, inclusive insaturados, aldeídos, aldeídos α,β-insaturados e esteróide. As substâncias
S1 e S4 foram submetidas à avaliação de atividade biológica (atividade antibacteriana, antifúngica, anticolinesterásica e antitumoral), porém nenhum resultado positivo foi constatado. Foi realizada avaliação da atividade tumoral das frações da linhagem M20, e as frações M20F e M20H apresentaram atividade citotóxica seletiva para linhagens de células tumorais. Em um segundo momento foi realizado o cultivo em escala ampliada da linhagem M23 (Eutypella sp) que proporcionou o isolamento da R-5-metilmeleína (S7). Dessa forma, o estudo químico de fungos endofíticos associados à alga Bostrychia radicans mostrou-se promissor na busca de novas estruturas químicas, visto que já foram isoladas e identificadas duas estruturas inéditas como produtos naturais.
ii
ABSTRACT
GALIZONI, B. B. Natural products from marine microorganisms: chemical and biological study of endophytes associated to red algae Bostrychia radicans. 2014. 103f.
Dissertation (Master). Faculdade de Ciências Farmacêuticas de Ribeirão Preto – Universidade de São Paulo, Ribeirão Preto, 2014.
The marine environment has been recognized as an important source of biologically active secondary metabolites. In this context, endophytic fungi associated with algae gained importance in recent decades, as alternative to natural products research targets. The present work had as goal the chemical and biological study of two strains of endophytic fungi associated with red algae Bostrychia radicans. The chemical and biological screening (antimicrobial and antitumor activity) of the crude extracts of two selected strains, M20 (Hypocrea lixii) and M23 (Eutypella sp), were obtained from pilot-scale cultivation, by means of culture media and growth period variation. The M20 strain extract, grown in rice, showed an interesting cytotoxic potential front HCT -116 tumor cells and after chemical analysis, this strain was selected for cultivation on a large scale, with the purpose of secondary metabolites isolation. Chemical studies of M20 species strain Hypocrea lixii, performed on an enlarged scale, afforded the isolation and identification of four metabolites: 3-hydroxy-5-methoxy-6- methyl-1,3-dihydro-isobenzofuran-4-carboxylic acid (S1), 3,7 dimethoxy-6-methyl-1-oxo-1,3-dihydro-isobenzofuran-4-carbaldehyde (S3), galactitol (S4), convolvulol (S5), in addition the isolation of two metabolites which have not yet been fully elucidated, S2 and S6. The S1 and S3 metabolites are novel metabolites as natural products. Furthermore, it was possible to identify 14 compounds by gas chromatography coupled to mass spectrometry (GC-MS), including hydrocarbons, fatty acids, besides unsaturated ones, aldehydes, α,β–unsaturated
aldehydes and steroid. The S1 and S4 compounds were subjected to biological activity evaluation (antibacterial, antifungal, antitumor and acetylcholinesterase potential), but without any positive result. Assessment of tumor activity of fractions of the M20 strain was performed, and the M20F and M20H fractions showed selective cytotoxicity to tumor cell lines. In a second step, the M23 strain (Eutypella sp) was grown on a large scale, resulting in the R-5-metilmeleina (S7) isolation. Thus, the chemical study of endophytic fungi associated to Bostrychia radicans algae proved to be promising concerning the search for new chemical compounds discovery, since it yielded two new structures as natural products.
iii
LISTA DE FIGURAS
Figura 1. Origem dos fármacos aprovados por agências reguladoras entre os anos de
1981 a 2010 (adaptado de NEWMAN; GRAG, 2012). 1
Figura 2. Metabólitos secundários isolados de fungos do gênero Eutypella spp 7 Figura 3. Esquema geral de cultivo das linhagens de fungos endofíticos selecionadas 13 Figura 4. Fluxograma geral de obtenção dos extratos de fungos endofíticos cultivados
nos diferentes meios de cultura 13
Figura 5. Fluxograma do isolamento das substâncias S1-S6 a partir do extrato bruto do fungo Hypocrea lixii, cultivado em arroz por 21 dias 17 Figura 6. Esquema geral dos extratos obtidos do cultivo em escala piloto das duas linhagens selecionadas para a triagem química e biológica 21 Figura 7. Cromatogramas dos extratos da linhagem M20 cultivada em Arroz. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
dias; em verde – cultivo por 28 dias 22
Figura 8. Cromatogramas dos extratos da linhagem M20 cultivada em Czapek. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
dias; em verde – cultivo por 28 dias 23
Figura 9. Cromatogramas dos extratos da linhagem M20 cultivada em PDB. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
dias; em verde – cultivo por 28 dias 23
Figura 10. Cromatogramas dos extratos da linhagem M23 cultivada em Arroz. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
dias; em verde – cultivo por 28 dias 24
Figura 11. Cromatogramas dos extratos da linhagem M23 cultivada em Czapek. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
dias; em verde – cultivo por 28 dias. 24
Figura 12. Cromatogramas dos extratos da linhagem M23 cultivada em PDB. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1 ml/minuto. Detecção em 254 nm.
Em preto – cultivo por 7 dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21
iv
Figura 13. Espectro de RMN de 1H do extrato M20A21d, CDCl3, 400 MHz 26
Figura 14. Espectro de RMN de 1H do extrato M20C28d, CDCl3, 400 MHz 26
Figura 15. Espectro de RMN de 1H do extrato M20P28d, CDCl3, 400 MHz 27
Figura 16. Espectro de RMN de 1H do extrato M23A28d, CDCl3, 400 MHz 27
Figura 17. Espectro de RMN de 1H do extrato M23C28d, CDCl3, 400 MHz 28
Figura 18. Espectro de RMN de 1H do extrato M23P28d, CDCl3, 400 MHz 28
Figura 19. Cromatograma da Fração M20D. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x
5µm). Vazão 1ml/minuto. Detecção em 220 nm 34
Figura 20. Cromatograma da Fração M20E. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x
5µm). Vazão 1ml/minuto. Detecção em 254 nm 35
Figura 21. Cromatograma da Fração M20F. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x
5µm). Vazão 1ml/minuto. Detecção em 254 nm 35
Figura 22. Cromatograma da Fração M20G1. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x
5µm). Vazão 1ml/minuto. Detecção em 254 nm 36
Figura 23. Cromatograma da Fração M20G2. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x
5µm). Vazão 1ml/minuto. Detecção em 254 nm 36
Figura24. Cromatograma da Fração H. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm).
Vazão 1ml/minuto. Detecção em 220 nm 37
Figura 25. Cromatograma da Fração I. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm).
Vazão 1ml/minuto. Detecção em 254 nm 37
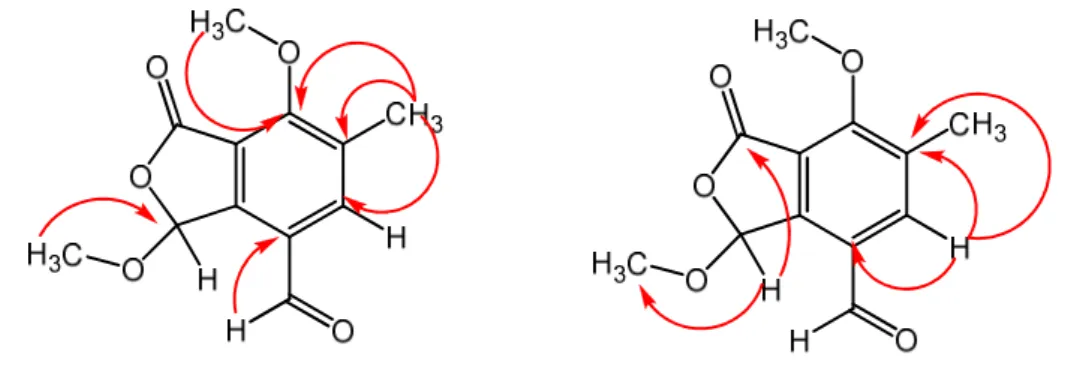
Figura 26. Proposta estrutural para substância S1 38
Figura 27. Correlações observadas no mapa de contorno HMBC para a substância S1 39 Figura 28. Espectro de RMN de 1H do composto S1, CD
3OD, 400 MHz 40
Figura 29. Espectro de RMN de 13C do composto S1, CD
3OD, 100 MHz 40
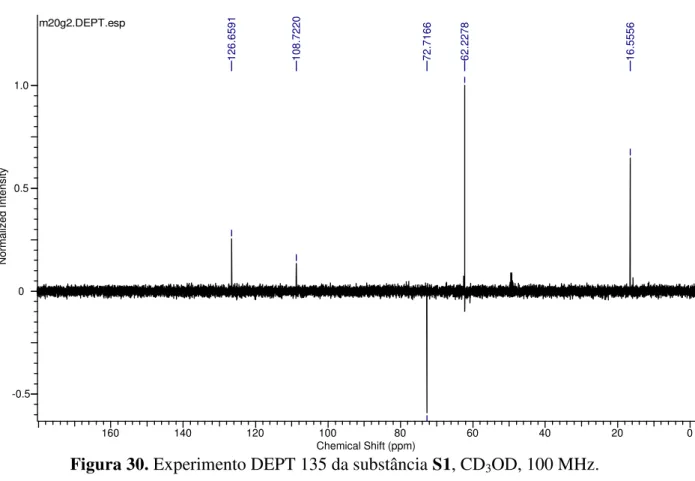
Figura 30. Experimento DEPT 135 do composto S1, CD3OD, 100 MHz 41
Figura 31. Mapa de contorno HMQC da substância S1, CD3OD, 100-400 MHz 41
Figura 32. Mapa de contorno HMBC da substância S1, CD3OD, 100-400 MHz 42
v
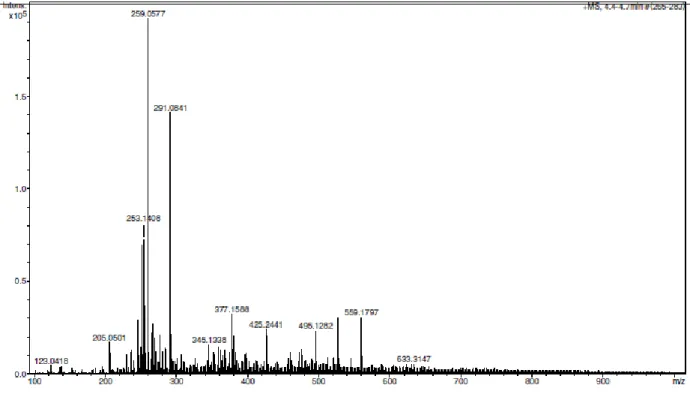
Figura 34. Espectro de massas de alta resolução (EM-ESI), da substância S1, obtido
em modo negativo 43
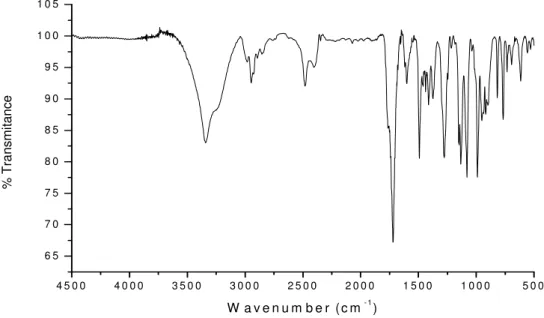
Figura 35. Espectro de absorção na região do Infravermelho, em KBr, da substância
S1 43
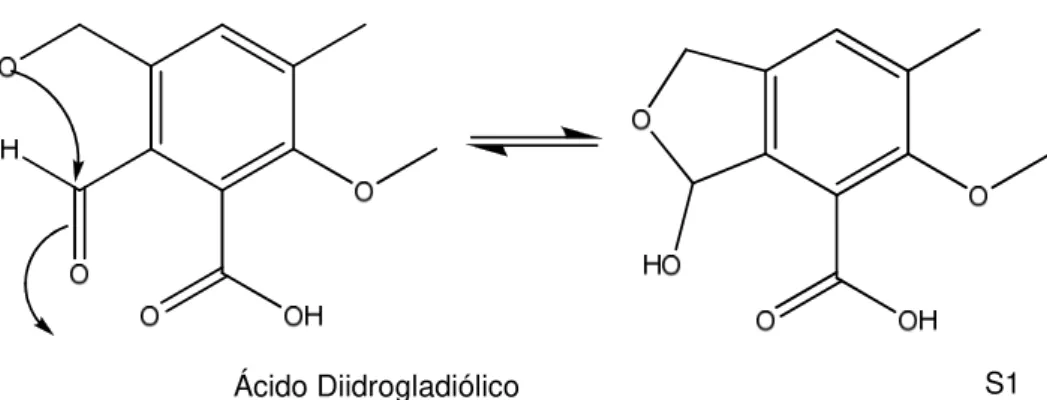
Figura 36. Reação intramolecular do ácido diidrogladiólico formando a substância S1 44 Figura 37. Cromatograma da Fração M20E escala semi-preparativa. Fase Móvel gradiente exploratório: 5 – 50% de Acetonitrila em Água (40 minutos) e 50-100% Acetonitrila em água (5minutos). Coluna semi-preparativa Supelcosil LC-18 (25cm x
10mm x 5µm). Vazão 4ml/minuto. Detecção em 245 nm 44
Figura 38. Proposta estrutural para substância S3 45
Figura 39. Correlações observadas no mapa de contorno HMBC para a substância S3 46 Figura 40. Espectro de RMN de 1H da substância S3, CDCl3, 400 MHz 47
Figura 41. Espectro de RMN de 13C do composto S3, CDCl3, 100 MHz 48
Figura 42. Experimento DEPT 135 do composto S3, CDCl3, 100 MHz 48
Figura 43. Mapa de contorno HMQC da substância S3, CDCl3, 100-400 MHz 49
Figura 44. Mapa de contorno HMBC da substância S3, CDCl3, 100-400 MHz 49
Figura 45. Espectro de absorção na região do Infravermelho, em KBr, da substância
S3 50
Figura 46. Espectro de massas de alta resolução (EM-ESI), da substância S3, obtido
em modo positivo 50
Figura 47. Proposta estrutural para a substância S4 (Galactitol) 51 Figura 48. Espectro de RMN de 1H da substância S4, D2O, 400 MHz 52
Figura 49. Espectro de RMN de 13C da substância S4, D2O, 100 MHz 53
Figura 50. Espectro de absorção na região do Infravermelho, em KBr, da substância
S4 53
Figura 51. Espectro de massas de alta resolução (EM-ESI), da substância S4, obtido
em modo negativo 54
Figura 52. Espectro de massas de alta resolução (EM-ESI), da substância S4, obtido
em modo positivo 54
Figura 53. Cromatograma da Fração M20F obtido em escala semi-preparativa. Fase Móvel gradiente exploratório: 5 – 20% de Acetonitrila em Água (10 minutos), 30-50% Acetonitrila em água (30 minutos) e 50-100% Acetonitrila em água (10 minutos). Coluna semi-preparativa Supelcosil LC-18 (25cm x 10mm x 5µm). Vazão 4ml/minuto.
Detecção em 210 nm 55
vi
Figura 55: Correlações observadas no mapa de contorno HMBC para a substância S5 57 Figura 56. Espectro de RMN de 1H da substância S5, CD3OD3, 600 MHz 58
Figura 57. Mapa de contorno HMQC da substância S5, CD3OD3, 150-600 MHz 58
Figura 58. Mapa de contorno HMBC da substância S5, CD3OD3, 150-600 MHz 59
Figura 59. Mapa de contorno COSY da substância S5, CD3OD3, 600 MHz 59
Figura 60. Espectro de massas de alta resolução (EM-ESI), da substância S5, obtido
em modo positivo 60
Figura 61: Espectro de RMN de 1H da substância S2, CD3OD3, 600 MHz 61
Figura 62. Mapa de contorno HMQC da substância S2, CD3OD3, 150-600 MHz 61
Figura 63. Mapa de contorno HMBC da substância S2, CD3OD3, 150-600 MHz 62
Figura 64. Espectro de massas de alta resolução (EM-ESI), da substância S2, obtido
em modo positivo 62
Figura 65. Espectro de massas de alta resolução (EM-ESI), da substância S2, obtido
em modo negativo 63
Figura 66: Espectro de RMN de 1H da substância S5, CD3OD3, 600 MHz 63
Figura 67. Mapa de contorno HMQC da substância S5, CD3OD3, 150-600 MHz 64
Figura 68. Mapa de contorno HMBC da substância S5, CD3OD3, 150-600 MHz 64
Figura 69. Mapa de contorno COSY da substância S5, CD3OD3, 600 MHz 65
Figura 70. Espectro de massas de alta resolução (EM-ESI), da substância S5, obtido
em modo positivo 65
Figura 71. Espectro de massas de alta resolução (EM-ESI), da substância S5, obtido
em modo negativo 66
Figura 72. CCDP da fração M23B, com destaque para a mancha 3 (placa de sílica gel, fase móvel uma mistura de hexano e acetato de etila na proporção (7:3) e revelação
com UV 254 nm). 68
Figura 73. Cromatograma da Fração M23B3 escala semi-preparativa. Fase Móvel gradiente exploratório: 70 – 100% de Acetonitrila em Água (25 minutos). Coluna semi-preparativa Supelcosil LC-18 (25cm x 10mm x 5µm). Vazão 5ml/minuto.
Detecção em 195 nm 69
Figura 74. Proposta estrutural para a substância S7 (R-5-metilmeleina) 69 Figura 75: Correlações observadas no mapa de contorno HMBC para a substância S7 71 Figura 76. Espectro de RMN de 1H da substância S7, CDCl3, 400 MHz 72
vii
Figura 78. DEPT 135 da substância S7, CDCl3, 100 MHz 73
Figura 79. Mapa de contorno HMQC da substância S7, CDCl3, 100-400 MHz 73
Figura 80. Mapa de contorno HMBC da substância S7, CDCl3, 100-400 MHz 74
Figura 81. Mapa de contorno COSY da substância S7, CDCl3, 400 MHz 74
Figura 82. Espectro de massas de alta resolução (EM-ESI), da substância S7, obtido
viii
LISTA DE TABELAS
Tabela 1. Produtos naturais de origem marinha aprovados como fármacos (adaptado de
GERWICK; MOORE, 2012) 2
Tabela 2. Estrutura química de metabólitos secundários isolados de fungos associados a algas marinhas e respectiva atividade biológica, segundo BLUNT e colaboradores, 2012
e 2014 4
Tabela 3. Metabólitos isolados de fungos do gênero Hypocrea spp 6 Tabela 4. Percentual de inibição da proliferação celular (%) das amostras M20A21d, M20C28d, M20P28d, M23A28d, M23C28d e M20P28d, frente à linhagem tumoral HCT-116. Valores são médias ± desvio padrão da média. Em destaque estão as amostras que apresentaram inibição da proliferação celular ≥75%. 30
Tabela 5. Rendimento das frações de CLV 31
Tabela 6. Principais substâncias encontradas nas frações apolares analisadas via
CG-EM, com similaridade maior que 90%, de acordo com banco de dados do equipamento. 32 Tabela 7. Estrutura das substâncias encontradas frações apolares analisadas via CG-EM. 33
Tabela 8. Dados de RMN de 1H e 13C em CD3OD da substância S1 38
Tabela 9. Dados de RMN de 1H e 13C em CDCl
3 da substância S3 45
Tabela 10. Dados de RMN de 1H e 13C em D2O da substância S4 e comparação com
dados já descritos para o Galactitol, segundo Parameswaran e colaboradores, 1996. 51 Tabela 11. Dados de RMN de 1H e 13C em CDCl3 da substância S5 56
ix
LISTA DE ABREVIATURAS E SIGLAS
AcOEt Acetato de Etila
ATCC American type culture collection BDA Batata dextrose ágar
BDC Batata dextrose caldo
CBM Concentração bactericida mínima
CCDC Cromatografia em camada delgada comparativa CCDP Cromatografia em camada delgada preparativa
CG-EM Cromatografia gasosa acoplada à espectrometria de massas CIM Concentração inibitória mínima
CLAE Cromatografia líquida de alta eficiência acoplada a detector de arranjo de diodos CLV Cromatografia líquida a vácuo
COSY Homonuclear correlation spectroscopy
d Dupleto
dd Duplo dupleto
DEPT Distortionless Enhancement by Polarization Transfer DMSO Dimetilsulfóxido
EM Espectrometria de massas
FM Fase Móvel
Hex Hexano
HMBC Heteronuclear multiple bond correlation HMQC Heteronuclear multiple quantum correlation IES Ionização por eletrspray
J Constante de acoplamento (em Hz)
m Multipleto
MeOH Metanol
RMN Ressonância Magnética Nuclear
s simpleto
TMS tetrametilsilano UV Ultra violeta
SUMÁRIO
RESUMO i
ABSTRACT ii
LISTA DE FIGURAS iii
LISTA DE TABELAS viii
LISTA DE ABREVIATURAS E SIGLAS ix
1. INTRODUÇÃO 1
1.1. Produtos Naturais e o Ambiente Marinho 1
1.2. Fungos Endofíticos 3
1.3. Fungo Hypocrea lixii 6
1.4. Fungo Eutypella sp 7
2. OBJETIVOS 8
3. MATERIAL e MÉTODOS 10
3.1. Especificações do material e equipamentos utilizados 11
3.2. Métodos 12
3.2.1. Obtenção das culturas dos micro-organismos 12
3.2.2. Obtenção dos extratos brutos 13
3.2.3. Triagem química dos extratos brutos obtidos do cultivo em escala piloto 14 3.2.4. Ensaio para avaliação da atividade antibacteriana 14
3.2.5. Ensaio para avaliação da atividade antitumoral 14
3.2.6. Identificação da linhagem M20 15
3.2.7. Fracionamento dos extratos obtidos do cultivo em escala ampliada 15
3.2.8. Análise das frações apolares via CG-EM 16
3.2.9. Análise das frações de média e alta polaridade via CLAE-DAD 16
3.2.10. Isolamento das substâncias S1 a S6 16
3.2.11. Isolamento da substância S7 17
4. RESULTADOS E DISCUSSÃO 20 4.1. Cultivo dos fungos e obtenção dos extratos em escala piloto 21 4.2. Triagem química dos extratos obtidos a partir do cultivo em escala piloto 21 4.3. Triagem biológica dos extratos obtidos a partir do cultivo em escala piloto 29
4.3.1. Avaliação da atividade antibacteriana 29
4.3.2. Avaliação da atividade antitumoral 29
4.4. Identificação da linhagem M20 30
4.5. Obtenção dos extratos em escala ampliada 30
4.6. Estudo químico e biológico do fungo Hypocrea lixii (linahgem M20 – cultivo em
escala ampliada) 31
4.6.1. Fracionamento do extrato bruto via CLV – linhagem M20 (H. lixii) 31
4.6.2. Análise das frações apolares via CG-EM 32
4.6.3. Análise das frações M20E – M20I via CLAE-DAD 34
4.6.4. Elucidação estrutural da substância S1 36
4.6.5. Isolamento das substâncias S2 e S3 44
4.6.6. Elucidação estrutural da substância S3 45
4.6.7. Determinação estrutural da substância S4 51
4.6.8. Isolamento das substâncias S5 e S6 54
4.6.9. Determinação estrutural da substância S5 55
4.6.10. Determinação estrutural das substâncias S2 e S6 60 4.6.11. Avaliação da atividade antitumoral do extrato e frações 66 4.6.12. Avaliação da atividade biológica das substâncias S1 e S4 67 4.7. Estudo químico do fungo Eutypella sp (linhagem M23 – escala ampliada) 68
4.7.1. Isolamento da substância S7 68
4.7.2. Determinação estrutural da substância S7 69
5. CONCLUSÃO 76
1 Introdução
1.
Introdução
1.1. Produtos Naturais e o Ambiente Marinho
Na constante busca por novos compostos com atividade biológica e terapêutica, os produtos naturais apresentam um papel importante como fonte de diversidade química para substâncias candidatas a novos fármacos (CIAVATTA et al., 2008; LI; VEDERAS, 2009). Muitos produtos naturais apresentam estrutura química complexa e com estereoquímica definida. Estas substâncias evoluíram de tal forma que interagem de maneira eficiente com alvos biológicos, e, assim, representam um ponto de partida valioso para a descoberta de novos fármacos. (MONTASER; LUESCH, 2011). Prova disso, como mostra a Figura 1, é que aproximadamente 64% dos fármacos aprovados por agências reguladoras entre os anos de 1981 e 2010 apresentam algum tipo de relação com produtos naturais, seja na totalidade da estrutura, derivados semi-sintéticos, sintéticos miméticos de produtos naturais, ou mesmo puramente sintéticos com grupos farmacofóricos encontrados em produtos naturais (NEWMAN; CRAGG, 2012).
Figura 1. Origem dos fármacos aprovados por agências reguladoras entre os anos de 1981 a 2010 (adaptado de NEWMAN; GRAG, 2012).
2 Introdução
Ainda neste cenário de grande diversidade estrutural, muitos metabólitos do ambiente marinho apresentam um interessante potencial biológico, o que tem inspirado o desenvolvimento de novos fármacos a partir dessas substâncias (GERWICK; MOORE, 2012; LI; VEDERAS, 2009; NEWMAN, 2008). Atualmente existem sete medicamentos comercializados nos quais o princípio ativo consiste em uma substância de origem marinha (Tabela 1). A finalidade terapêutica desses fármacos é variada, incluindo tratamento de câncer (citarabina - Cytosar-U® e a trabectedina - Yondelis®), antiviral (vidarabina - Vira-A®), analgésico (ziconotide - Prialt®) (GERWICK; MOORE, 2012; MAYER et al., 2010).
Tabela 1. Produtos naturais de origem marinha aprovados como fármacos (adaptado de GERWICK; MOORE, 2012).
Fármaco Estrutura Alvo terapêutico
Citarabina (Ara-C) Leucemia mielóide Tratamento
aguda
Vidarabina (Ara-A) Antiviral
Ziconotide
Analgésico
Eribulina Tratamento câncer
de mama H3C
HN OO OH NH O NH OH HN OHN NH O HN
NH NH2 O N H O H N O NH NH2 NH2 O OH S S HN
OHN O NH2
HN O O NH2 N H O H N CH3 O HN O S S O N H OH O HN O NH NH H2N
3 Introdução
Dentre os seres que habitam o ambiente marinho, recentes descobertas enfatizam os micro-organismos marinhos como uma fonte potencialmente produtiva de metabólitos secundários biologicamente ativos. Mais de 30 substâncias derivadas de micro-organismos marinhos estão em estudos clínicos ou pré-clínicos para o tratamento de diferentes tipos de câncer (BLUNT et al., 2013; BLUNT et al., 2014; HU et al., 2011; XIONG et al., 2013).
1.2. Fungos Endofíticos
Um micro-organismo endofítico é aquele que passa ao menos parte de seu ciclo de vida dentro de tecidos saudáveis de um hospedeiro, sem causar-lhe nenhum prejuízo, em uma relação que pode variar de fitopatogênese latente ao mutualismo (ALY; DEBBAB; PROKSCH, 2011; SOUZA et al., 2011; STROBEL et al., 2004).
Diversos estudos relatam que a interação com um endófito pode proporcionar diversos benefícios ao hospedeiro, tais como adaptação ao estresse ambiental, sinalização celular, produção de hormônios e antibiose (ALY et al., 2010; SCHULZ; BOYLE, 2005). Porém um ponto em comum entre todas as interações endófito-hospedeiro é o fornecimento de nutrientes e proteção contra o estresse ambiental externo e contra a competição microbiana para o micro-organismo endofítico (SCHULZ; BOYLE, 2005).
Fármaco Estrutura Alvo terapêutico
Trabectedina (Yondelis ®)
Tratamento de sarcoma de tecido
mole e câncer de ovário reincidente
Brentuximabe vedotina
Tratamento de linfoma de
Hodgkin
Ésteres do ácido
4 Introdução
Os micro-organismos endofíticos receberam uma maior atenção a partir da descoberta da produção de paclitaxel (Taxol ®) pelo fungo endofítico Taxomyces andreanae. Este
endófito foi isolado da planta Taxus brevifolia, sendo esta planta o primeiro organismos no
qual o paclitaxel foi encontrado (ALY et al., 2010). O paclitaxel é um agente anti-microtúbulo com atividade antitumoral, utilizado no tratamento de diversos tipos de câncer, como câncer de mama, ovário, pulmão entre outros (ALY et al., 2010; VELDHOEN et al., 2012).
Neste trabalho duas espécies de fungos endofíficos associados à alga marinha Bostrychia radicans, a linhagem M20 (Hypocrea lixii) e a linhagem M23 (Eutypella sp), foram estudadas com o objetivo de conhecer a química do micro-organismo, buscando o isolamento de novos metabólitos secundários e/ou metabólitos bioativos.
Recentes trabalhos já descreveram alguns metabólitos isolados de fungos associados a algas marinhas que apresentaram interessantes atividades biológicas. Como demonstra a Tabela 2, já foram isoladas substâncias com atividade antitumoral, antibacteriana, antifúngica e inibidor da elastase leucocitária (BLUNT et al., 2012; BLUNT et al., 2014). Até 2010, número total de novos produtos naturais marinhos de derivados de fungos já havia ultrapassado 1.000 substâncias (SUN et al., 2012).
Tabela 2. Estrutura química de metabólitos secundários isolados de fungos associados a algas marinhas e respectiva atividade biológica, segundo BLUNT e colaboradores, 2012 e 2014.
Metabólito Estrutura Atividade Biológica
Penicisteróide A Antifúngico
Cereolactama leucocitária humana Inibidor de elastase
5 Introdução
1.3. Fungo Hypocrea lixii
O gênero Hypocrea é a forma telomórfica do gênero Trichoderma, constituído por fungos oportunistas encontrados em uma grande variedade de ecossistemas, como terrestre, marinho e de água doce (GAL-HEMED et al., 2011; HERMOSA et al., 2012; SCHUSTER; SCHMOLL, 2010; ZHANG et al., 2013).
Algumas espécies do gênero Hypocrea apresentam relevância no controle biológico contra fitopatógenos, protegendo plantas contra doenças e estimulando seu crescimento e produtividade (HERMOSA et al., 2012; ZHANG et al., 2013). Essa proteção se deve ao
Esclerodinol Antibacteriano
albican-11,14-diol Antibacteriano
Conioscleroderolida Inibidor elastase
leucocitária humana
Helicascolidio C Fungicida
6 Introdução
elevado potencial de micoparasitismo, antibiose e competição do gênero (GAL-HEMED et al., 2011; HERMOSA et al., 2012; SOLANKI et al., 2011). Neste contexto, eficientes espécies de Hypocrea spp estão sendo utilizadas como fungicidas biológicos (SCHUSTER; SCHMOLL, 2010; SOLANKI et al., 2011).
Algumas espécies marinhas de Hypocrea apresentaram atividade larvicida e antitumoral (ZHANG et al., 2013). Como ilustrado na Tabela 3, há relatos de isolamento de metabólitos diversificados e com atividade biológica interessante (LIU et al., 2011; OHKAWA et al., 2010; ZHAO et al., 2013).
Tabela 3. Metabólitos isolados de fungos do gênero Hypocrea spp.
Em estudos recentes, extratos orgânicos do fungo Hypocrea lixii apresentaram atividade antibacteriana, antioxidante, citotóxica frente linhagens de células tumorais e atividade anti-Trichomonas vaginalis (BHIMBA et al., 2012; CUI; GUO; XIAO, 2011; SCOPEL et al., 2013). Portanto, estes dados nos motivam a prosseguir com os estudos quanto a conhecer o metabolismo secundário deste fungo sob condições de cultivos diversas.
1.4. Fungo Eutypella sp
Espécies do gênero Eutypella spp apresentam uma grande diversidade de habitats, incluindo desde solos da Antártica até florestas tropicais da Austrália e Tailândia. No
Metabólito Estrutura Atividade Biológica Referência
2-metilimidazo [1,5-
b]isoquinolina-1,3,5(2H)-triona
N
O O
O
- LIU et al, 2011
Hypocromina B O
O OH OH
HO
O HO
OH
O
OH O
Antiangiogênico OHKAWA et al, 2010
Cajonol
O O OH
HO
OH OH
7 Introdução
ambiente marinho, espécies de Eutypella spp já foram isoladas do molusco pulmonado Onchidium sp e de sedimento marinho (SUN et al., 2012; SUN et al., 2012).
Diferentes metabólitos de espécies do gênero Eutypella spp já foram isolados, incluindo diterpenos, derivados de citocalasinas, lactonas, sesquiterpenos e derivados de citosporina (CIAVATTA et al., 2008; ISAKA et al., 2009; ISAKA et al., 2011; PONGCHAROEN et al., 2006; SOUZA et al., 2011; SUN et al., 2012; SUN et al., 2012).
Portanto, a pesquisa dos diferentes organismos que habitam o ambiente marinho torna-se importante para a descoberta de substâncias estruturalmente diferenciadas e com possível atividade biologia e terapêutica. Mesmo com a enorme biodiversidade brasileira, a pesquisa científica sobre o ambiente marinho no Brasil é recente e os estudos nesta área são ainda escassos.
8
9 Objetivos
2.
Objetivos
Cultivo em escala piloto de dois fungos endofíticos associados à alga marinha Bostrychia radicans (Linhagens M20 e M23), com variação de meio de cultivo e período de crescimento;
Triagem química (CCDC, CLAE-DAD e RMN de 1H) dos extratos obtidos da cultura em escala piloto das linhagens selecionadas;
Triagem biológica (atividade antibacteriana e atividade antitumoral) dos extratos brutos obtidos da cultura em escala piloto das linhagens selecionadas;
Adequação em escala ampliada da cultura do fungo que apresentar atividade biológica significativa e/ou perfil químico mais interessante;
Isolamento e elucidação estrutural das substâncias obtidas a partir da cultura em escala ampliada;
10
11 Material e Métodos
3.
Material e Métodos
3.1. Especificações do material e equipamentos utilizados
Solventes
Solventes para extração, fracionamento e isolamento: solventes orgânicos grau técnico (purificados por destilação fracionada) e de grau analítico.
Solventes deuterados: CDCl3 (Aldrich contendo TMS como padrão interno) e CD3OD
(Aldrich).
Solventes grau cromatográfico da marca Merck e J.T. Backer.
Meios de Cultivo
Meios sólidos: BDA (Batata Dextrose Agar) marca Himedia; arroz parboilizado Uncle Bean’s Agroparr Alimentos Ltda.
Meios líquidos: BDC (Batata Dextrose Caldo) marca Himedia; meio líquido Czapek, marca Himedia.
Cromatografia em Camada Delgada
Placas de alumínio impregnadas com sílica Micro TLC/AL com indicador de fluorescência no UV da marca Silicycle.
Reveladores: câmara saturada com iodo ressublimado, irradiação com UV nos comprimentos de onda de 254 e 366 nm, iodo platinado e anisaldeído.
Cromatografia líquida a vácuo
Colunas de vidro com placa sinterizada Sílica gel fase normal 60H (Merck) Bomba de vácuo
Equipamentos
Cromatógrafo Shimadzu, modelo SCL-10AVP, equipado com detector de arranjo de diodos UV-Vis DAD Shimadzu, modelos SPD-M10AVP e sistema de integração computadorizado com software CLASS-VP;
12 Material e Métodos
Polarímetro Jasco P-2000;
Espectrômetro de Infravermelho por Transformada de Fourier FTIR Shimadzu IR-Prestige 21;
Espectrofotômetros de RMN BRUKER DRX 400, BRUKER DRX 500 e BRUKER DRX 600, operando respectivamente em 400, 500 e 600 MHz para experimentos de
1H e em 100, 125 e 150 MHz para os experimentos de 13C;
Espectrofotômetro de massas ESI-MS MicrO-TOF Bruker-daltonics; Rotaevaporador Buchi R-210;
Cromatógrafo a gás Shimadzu, modelo QP 2010, com detector de massas por impacto de elétrons (70eV) com injetor split (250°C).
3.2. Métodos
3.2.1. Obtenção das culturas dos micro-organismos
Para o estudo piloto foram selecionadas as linhagens M20 e M23, ambas isoladas da alga marinha Bostrychia radicans, coletadas no manguezal do Rio Escuro, em Ubatuba-SP (23o29´30,0´´S/ 45o09´46,2´´W), em setembro de 2008. As linhagens em questão estão preservadas e mantidas em óleo mineral no Laboratório de Química Orgânica do Ambiente Marinho - NPPNS da FCFRP-USP.
A fim de reativar a linhagem microbiana, foram transferidas amostras das linhagens preservadas em óleo mineral para placas de Petri com meio sólido BDA (Batata Dextrose Agar). As placas foram mantidas a 25°C, acompanhando até o crescimento do micro-organismo por toda a placa de Petri. Após esse período, foram transferidos 10 plugs de cada linhagem para três frascos tipo Erlenmeyer com os meios de cultura. O esquema geral do cultivo dos fungos endofíticos está ilustrado na Figura 3. Vale ressaltar que todos os procedimentos envolvendo a manipulação do micro-organismo foram realizados em capela de fluxo laminar e com material esterilizado, e que todos os meios de cultura foram preparados com água do mar.
Linhagens selecionadas para cultivo em escala piloto: - M20: identificada como Hypocrea lixii
- M23: identificada em trabalhos anteriores como Eutypella sp.
13 Material e Métodos
condição de cultivo). Já para o cultivo em escala ampliada, a linhagem M20 foi cultivada em arroz (10 frascos tipo Erlenmeyer) e a linhagem M23 foi cultivada em meio líquido PDB (60 frascos tipo Erlenmeyer). Para ambos os cultivos, escala piloto e escala ampliada, foram utilizados frascos tipo Erlenmeyer de 500 mL, com 100 mL de meio líquido ou 200 g de arroz.
Figura 3. Esquema geral de cultivo das linhagens de fungos endofíticos selecionadas.
3.2.2. Obtenção dos extratos brutos
Os extratos foram obtidos a partir da trituração do micélio em ambiente asséptico, seguido por três extrações do meio com CH2Cl2:MeOH (2:1) (Figura 4). O micélio foi
removido por filtração a vácuo e o filtrante foi separado em funil de separação, sendo que a fase aquosa, proveniente do meio de cultura, foi descartada. A fase orgânica foi concentrada a pressão reduzida, obtendo-se os extratos brutos. O micélio foi descartado após esterilização em autoclave. A massa obtida para cada extrato está descrita no item 4.1, na Figura 6 (página 24).
Figura 4. Fluxograma geral de obtenção dos extratos de fungos endofíticos cultivados nos diferentes meios de cultura.
1. Reativação da linhagem selecionada em meio sólido BDA
2. Inoculação dos plugs no meio de cultivo escolhido para crescimento
(BDC, Czapek ou arroz)
3. Período de cultivo: 7, 14, 21 ou 28 dias
14 Material e Métodos
3.2.3. Triagem química dos extratos brutos obtidos do cultivo em escala piloto Os extratos obtidos foram submetidos à análise através de cromatografia em camada delgada comparativa (CCDC) em fase normal e a revelação foi realizada sob luz UV (254 e 365 nm), em câmara saturada de iodo sublimado, com solução de anisaldeído e iodo platinado.
Para as análises por cromatografia líquida de alta eficiência em fase reversa foi utilizada coluna analítica C18 Supelco (5µm x 4,4mm x 25cm), como fase móvel gradiente de
acetonitrila em água e fluxo de 1 ml/min. Foi utilizado o cromatógrafo Shimadzu, modelo SCL-10AVP, equipado com detector de arranjo de diodos UV-Vis DAD Shimadzu, modelos SPD-M10AVP e sistema de integração computadorizado com software CLASS-VP.
As análises de RMN de 1H foram realizadas nos espectrofotômetros BRUKER DRX 400 E BRUKER DRX 500, operando respectivamente em a 400 e 500 MHz para experimentos de 1H e em 100 e 125 MHz para os experimentos de 13C. Ambos os equipamentos estão localizados no Departamento de Química da Faculdade de Filosofia Ciências e Letras de Ribeirão Preto, USP.
3.2.4. Ensaio para avaliação da atividade antibacteriana
Os experimentos para a avaliação de atividade antibacteriana foram realizados no Departamento de Ciências Farmacêuticas da Faculdade de Ciências Farmacêuticas de Ribeirão Preto, USP, no laboratório de Farmacognosia, sob supervisão da Profa. Dra. Niege A.J.C. Furtado.
As bactérias utilizadas no experimento foram: Staphylococcus aureus ATCC 25923 (gram positiva) e Escherichia coli ATCC 25922 (gram negativa). Para determinação da concentração inibitória mínima (CIM) foi utilizado o método de microdiluição em microplaca segundo a metodologia preconizada pelo “National Committee for Clinical Laboratory Standards” (NCCLS, 2003), com adaptações. Para determinação da Concentração Bactericida Mínima (CBM), após a revelação das placas de MIC, amostras dos poços da microplaca foram transferidas para Placas de Petri contendo Meio Ágar Mueller Hinton e observou-se o crescimento bacteriano após incubação a 37°C por 24 horas.
3.2.5. Ensaio para avaliação da atividade antitumoral
15 Material e Métodos
Foram realizados testes de citotoxicidade através do método do MTT, utilizando a linhagem celular: HCT-116 (cólon humano), em concentração única de 50 µg/mL, para a seleção dos extratos mais ativos. Os extratos e frações ativas frente à linhagem HCT-116, foram também testadas nas seguintes linhagens: HL-60 (leucemia); OVCAR-8 (câncer de ovário); SF-295 (gliobastoma); PC-3M (câncer de próstata) e uma linhagem de célula normal MRC-5 (célula normal de pulmão), para verificação da seletividade e especificidade da atividade citotóxica da amostra.
As células serão cultivadas em meio de cultura contendo 10% de soro fetal bovino e 1% de antibióticos, mantidas a 37ºC em atmosfera de 5% de CO2. As células foram
plaqueadas na concentração 0,5 x 105 cél/mL. As placas foram incubadas por 72 horas em estufa a 5% de CO2 a 37°C. Como controle positivo foi utilizado a doxorubicina na
concentração de 0,3µg/mL.
Ao término do período de incubação, o meio foi aspirado e em seguida, foram adicionados 150 µL da solução de MTT (sal de tetrazolium), e as placas foram incubadas por 3h. A absorbância foi lida após dissolução do precipitado com 150 µL de DMSO puro em espectrofotômetro de placa a 595nm.
3.2.6. Identificação da linhagem M20
A identificação da linhagem M20 foi realizada pela empresa Genotyping Biotecnologia LTDA., utilizando sequenciamento automático por eletroforese capilar no equipamento ABI 3500 Genetic Analyzer (Applied Biosystems) e alinhamento das sequências de nucleotídeos produzidas com as sequências de referência depositadas no banco de dados GenBank.
3.2.7. Fracionamento dos extratos obtidos do cultivo em escala ampliada
O extrato bruto do cultivo em escala ampliada foi submetido à análise por Cromatografia Líquida a Vácuo (CLV) em fase normal e fase móvel com gradiente crescente de polaridade, obtendo-se 9 frações, de A a I.
- Fração A: 100% Hexano
16 Material e Métodos
- Fração F: 20%Hexano e 80% Acetato de etila - Fração G: 100% Acetato de etila
- Fração H: 25% Acetato de etila e 75% Metanol - Fração I: 100% Metanol
3.2.8. Análise das frações apolares via CG-EM
Nas análises via CG-EM foi utilizada uma coluna DB-5 (30m x 0,25mm x 0,25 mm), gás hélio como gás carreador, com fluxo de 1,41 ml/min, pressão de 87,1 kPa e aquecimento com programação de temperatura de 60-240°C a 3°C/min e a fibra foi mantida exposta na câmara de injeção por 3 minutos.
3.2.9. Análise das frações de média e alta polaridade via CLAE-DAD
Nas análises das frações via CLAE-DAD foi utilizada coluna analítica C18 Supelco
(5µm x 4,4mm x 25cm), como fase móvel gradiente de acetonitrila em água e fluxo de 1
ml/min. Foi utilizado o cromatógrafo Shimadzu, modelo SCL-10AVP, equipado com detector de arranjo de diodos UV-Vis DAD Shimadzu, modelos SPD-M10AVP e sistema de integração computadorizado com software CLASS-VP.
3.2.10. Isolamento das substâncias S1 a S6
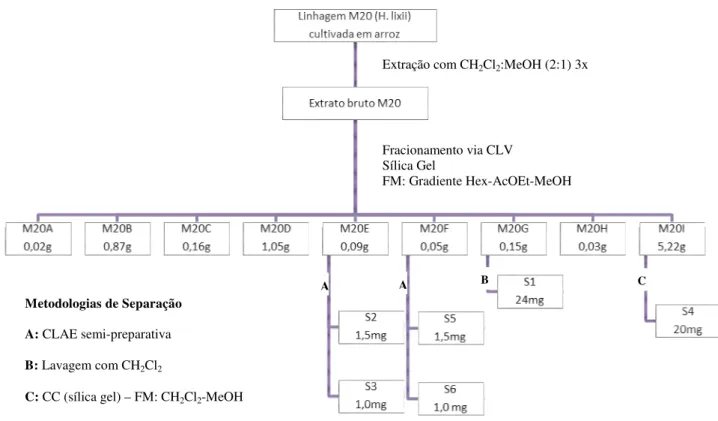
As substâncias S1 a S6 foram isoladas do extrato da linhagem Hypocrea lixii (M20) cultivada em arroz por 21 dias. A substância S1 foi isolada a partir da fração M20G, através de lavagem do precipitado formado com Diclorometano, uma vez que a substância S1 se mostrou insolúvel neste solvente.
As substâncias S2 e S3 foram isoladas a partir da fração M20E via CLAE em escala semi-preparativa. Utilizou-se coluna Coluna Supelcosil LC-18 (25cm x 10mm x 5µm) e fase
móvel com gradiente exploratório 5-50% de Acetonitrila em água, por 40 min, seguido de 50-100% de Acetonitrila em água por 5 minutos e vazão 4ml/minuto.
Já a substância S4 foi isolada da fração M20I após realização de uma coluna clássica, com sílica gel e fase móvel gradiente de diclorometano-metanol. Na última etapa, as substâncias S5 e S6 foram isoladas a partir da fração M20F via CLAE em escala semi-preparativa. Utilizou-se coluna Coluna Supelcosil LC-18 (25cm x 10mm x 5µm) e fase móvel
17 Material e Métodos
Figura 5. Fluxograma do isolamento das substâncias S1-S6 a partir do extrato bruto do fungo Hypocrea lixii, cultivado em arroz por 21 dias.
3.2.11. Isolamento da substância S7
A substância S7 foi isolada a partir do extrato da linhagem Eutypella sp (M23) cultivada em meio líquido PDB por 28 dias. Após o fracionamento via CLV, a fração M23B (90% Hexano: 10% Acetato de Etila) foi submetida à CCDP em placas de sílica e fase móvel Hexano : Acetato de Etila (7:3), o que possibilitou a separação de três manchas.
A mancha 3 (amostra M23B3) foi submetida a separação via CLAE semi-preparativa, resultando no isolamento da substância S7. Para a realização da CLAE, foi utilizada coluna Coluna Supelcosil LC-18 (25cm x 10mm x 5µm) e fase móvel com gradiente exploratório
70-100% de Acetonitrila em água, por 25 min e vazão 5ml/minuto.
3.2.12. Identificação estrutural das substâncias isoladas
Para a elucidação estrutural das substâncias isoladas foram utilizadas as seguintes técnicas espectrométricas: RMN uni e bidimensional, Espectrometria de massas de alta resolução, Espectroscopia de absorção na região do infravermelho.
A
Extração com CH2Cl2:MeOH (2:1) 3x
Fracionamento via CLV Sílica Gel
FM: Gradiente Hex-AcOEt-MeOH
Metodologias de Separação
A: CLAE semi-preparativa
B: Lavagem com CH2Cl2
C: CC (sílica gel) – FM: CH2Cl2-MeOH
18 Material e Métodos
3.2.13. Ensaio para avaliação da atividade antifúngica frente espécies de
Candida spp
Os experimentos para a avaliação de atividade antifúngica foram realizados no Departamento de Ciências Farmacêuticas da Faculdade de Ciências Farmacêuticas de Ribeirão Preto, USP, no laboratório de Farmacognosia, sob supervisão da Profa. Dra. Niege A.J.C. Furtado.
Foram utilizadas as seguintes cepas: Candida albicans ATCC, Candida tropicalis ATCC 750, Candida krusei ATCC 34135, Candida parapsilosis ATCC 22019, Candida glabrata ATCC 2001. Como controle positivo utilizou-se Fluconazol. Para determinação da concentração inibitória mínima (MIC) foi utilizado o método de microdiluição em microplaca segundo a metodologia preconizada pelo “National Committee for Clinical Laboratory Standards” (NCCLS, 2003), com adaptações. Este ensaio foi realizado para as substâncias isoladas S1 e S4.
3.2.14. Ensaio para avaliação da atividade anticolinesterásica por bioautografia Os ensaios para avaliação da atividade anticolinesterásica foram realizados no Instituto de Botânica de São Paulo, sob supervisão da Dra. Maria Cláudia Marx Young. Para a realização do ensaio de atividade anticolinesterásica, amostras das substâncias S1 e S4 (50 µg) foram analisadas em CCDC de sílica gel 60 F254 (Merck). Como controle positivo foi utilizado fisostigmina (0,05 µg).
Após o desenvolvimento da cromatografia, a placa foi borrifada com uma solução de enzima acetilcolinesterase (6,66 U) acrescida de albumina bovina fração V (0,1%). Logo após, a placa cromatográfica foi incubada em uma câmara úmida fechada a 37°C por 20 minutos, e em seguida borrifada com uma mistura da solução etanólica de acetato de 1-naftila (5 mL; 0,25%) e aquosa do sal Fast Blue B (20 mL; 0,25%). Uma coloração roxa aparece em aproximadamente 2 minutos.
O aparecimento de mancha branca, sobre o fundo de coloração roxa indica inibição da atividade da enzima acetilcolinesterase. As cromatoplacas obtidas foram observadas em (λ)
19 Material e Métodos
3.2.15. Ensaio para avaliação da atividade antifúngica por bioautografia
Os ensaios para avaliação da atividade antifúngica em placas de sílica-gel foram realizados no Instituto de Botânica de São Paulo, sob supervisão da Dra. Maria Cláudia Marx Young. Para isso, cepas dos fungos Cladosporium sphaerospermum, obtidos da micoteca do Instituto de Botânica de São Paulo, foram incubadas em meio de cultura BDA a 25ºC por 14 dias. Após esse período foi feita a extração dos esporos com solução de sais e glicose (6:1). A suspensão foi filtrada e armazenada a -18ºC para posterior nebulização nas cromatofolhas.
20
21 Resultados e Discussão
4.
Resultados e Discussão
4.1. Cultivo dos fungos e obtenção dos extratos em escala piloto
Com a finalidade de estabelecer as melhores condições de cultivo dos fungos para produção de metabólitos secundários, foram analisadas as seguintes variações: meio de cultura e tempo de cultivo.
- Meios de cultura analisados: arroz, Czapek e BDC - Tempos de cultivo analisados: 7, 14, 21 e 28 dias
Ao final do cultivo e extração foram obtidos 12 extratos brutos de cada linhagem, como demonstrado na figura 6, a seguir.
Figura 6. Esquema geral dos extratos obtidos do cultivo em escala piloto das duas linhagens selecionadas para a triagem química e biológica.
Nota-se que o cultivo em arroz fornece maiores quantidades de extrato bruto. A utilização de meios sólidos favorece o crescimento de fungos filamentosos, pois além da fonte de nutrientes, a matriz sólida fornece apoio para o crescimento das hifas e com isso alcança uma maior área de crescimento, concentração de nutrientes e circulação de oxigênio. Há relatos que até mesmo micro-organismos marinhos preferem o crescimento em matrizes sólidas, uma vez que mais de 98% dos isolados de ambiente marinho têm sido obtidos a partir de superfícies de substratos sólidos, encontrados em habitats marinhos (SINGHANIA et al., 2009).
4.2.Triagem química dos extratos obtidos a partir do cultivo em escala piloto
22 Resultados e Discussão
extratos considerados mais promissores para posterior isolamento de metabólitos foram os extratos M20 cultivados em arroz por 21 dias e M23 cultivados em meio PDB por 28 dias.
Nos espectros de RMN de 1H (Figuras 13-18), os diferentes extratos mostraram-se semelhantes, com sinais de deslocamentos químicos na região entre 3,0 e 6,0 ppm, sugerindo a presença de açúcares e/ou ligações duplas, e sinais de deslocamento químico entre 6,7 a 7,8 ppm sugerindo a presença de substâncias aromáticas. Mas vale ressaltar que muitos sinais observados nos espectros de RMN de 1H podem ser referentes aos constituintes do meio de cultura.
Cromatografia Líquida de Alta Eficiência
Todos os extratos obtidos, tanto da linhagem M20 como da linhagem 23, foram submetidos à análise por Cromatografia Líquida de Alta Eficiência com detector de arranjo de diodos (CLAE-DAD), em fase reversa com coluna analítica RP-18, fase móvel com gradiente exploratório (5-100% de Acetonitrila em água) e fluxo de 1 ml/min.
Figura 7. Cromatogramas dos extratos da linhagem M20 cultivada em Arroz. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
23 Resultados e Discussão
Figura 8. Cromatogramas dos extratos da linhagem M20 cultivada em Czapek. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21 dias; em verde – cultivo por 28 dias.
Figura 9. Cromatogramas dos extratos da linhagem M20 cultivada em PDB. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
24 Resultados e Discussão
Figura 10. Cromatogramas dos extratos da linhagem M23 cultivada em Arroz. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21 dias; em verde – cultivo por 28 dias.
Figura 11. Cromatogramas dos extratos da linhagem M23 cultivada em Czapek. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
25 Resultados e Discussão
Figura 12. Cromatogramas dos extratos da linhagem M23 cultivada em PDB. Fase Móvel gradiente exploratório: 5 – 100% de Acetonitrila em Água. Coluna analítica Supelcosil LC-18 (25cm x 4,6mm x 5µm). Vazão 1 ml/minuto. Detecção em 254 nm. Em preto – cultivo por 7
dias; em azul – cultivo por 14 dias; em rosa – cultivo por 21 dias; em verde – cultivo por 28 dias.
Ressonância Magnética Nuclear de 1H
Para a análise de RMN de 1H, foram selecionados os extratos com maior potencial de produção de metabólitos secundários, de acordo com as análises de CCDC e CLAE-DAD:
26 R es u lt a d os e D is cu ss ã o M 2 0 A 2 1 d.e sp 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0.0
5 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45 0.50
Normalized Intensity 7.4986 7.2700 7.2656 7.2466 5.3828 5.3791 5.3652 5.3620 5.3563 5.3475 5.3424 5.3330 4.3196 4.2899 4.2792 4.1725 4.1574 4.1428 4.1277 3.7419 2.7911 2.7608 2.3700 2.3352 2.3232 2.3169 2.2980 2.0625 2.0448 1.6205 1.3055 1.2575 0.9121 0.9014 0.8945 0.8907 0.8850 0.8774 0.8673 0.6356 F ig u ra 1 3. E sp ec tro d e R M N d
e 1
H d o e xtr ato M 20 A 21 d, C D C l 3 , 4 00 M H z. M 20 C 28 d.e sp 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0.0
5 0.10 0.15 0.20
Normalized Intensity 7.7246 7.5579 7.5194 5.3506 4.1018 4.0848 3.7419 3.6737 3.0569 2.3731 2.3542 2.3352 2.0631 1.6224 1.5706 1.3055 1.2588 1.0031 0.9866 0.9020 0.8951 0.8850 0.8780 0.8679 0.0838 0.0655 F ig u ra 1 4. E sp ec tro d e R M N d
e 1
27 R es u lt a d os e D is cu ss ã o m 20 p2 8.0 01 .e sp 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0 0.0
5 0.10 0.15 0.20 0.25 0.30 0.35
Normalized Intensity 7.4240 7.2125 7.1955 5.3083 5.3051 5.2944 5.2906 5.2868 5.2761 5.2729 5.2704 4.6504 4.0266 4.0096 3.7899 3.6667 3.1800 2.9817 2.8940 2.7014 2.6862 2.2967 2.2777 2.2594 1.9715 1.5630 1.5447 1.2480 1.2391 1.2303 1.2227 1.2133 1.1836 1.1735 0.8269 0.8199 0.8098 0.0004 F ig u ra 1 5. E sp ec tro d e R M N d
e 1
H d o e xtr ato M 20 P 28 d, C D C l 3 , 4 00 M H z. m 23 a2 8.0 01 .e sp 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0 0.0
5 0.10 0.15 0.20 0.25 0.30
Normalized Intensity 7.2669 5.3608 5.3570 5.3513 5.3425 5.3399 5.3374 4.3430 4.3152 4.3045 4.2856 4.2748 4.1681 4.1530 4.1385 4.1233 3.7363 3.2609 2.7703 2.3378 2.3308 2.3189 2.3119 2.0581 2.0404 1.3005 1.2904 1.2834 1.2758 1.2531 0.8970 0.8901 0.8863 0.8800 0.8629 0.0005 F ig u ra 1 6. E sp ec tro d e R M N d
e 1
28 R es u lt a d os e D is cu ss ã o m 23 c2 8.0 01 .e sp 11 10 9 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0 0.0
5 0.10 0.15 0.20 0.25 0.30 0.35
Normalized Intensity 10.9355 7.1959 5.3050 5.2911 5.2873 5.2760 5.2703 5.2589 4.2159 4.0985 4.0833 3.6666 2.7012 2.6861 2.2959 2.2776 2.2587 1.5446 1.2857 1.2308 1.2207 1.2131 1.1841 0.8273 0.8204 0.8103 0.7926 0.0003 -0.0692 F ig u ra 1 7. E sp ec tro d e R M N d
e 1
H d o e xtr ato M 23 A 28 d, C D C l 3 , 4 00 M H z. m 2 3p 2 8.0 0 1.e sp 8 7 6 5 4 3 2 1 0 C he m ic al S hif t ( pp m ) 0.0
5 0.10 0.15 0.20 0.25 0.30 0.35 0.40
Normalized Intensity 7.6489 7.4822 7.1993 5.3040 5.2901 5.2869 5.2813 5.2743 5.2674 5.2579 4.2155 4.2048 4.0981 4.0829 4.0684 4.0532 4.0261 4.0090 3.6656 3.5747 2.7002 2.2602 2.2482 2.2419 1.9874 1.9704 1.3826 1.2304 1.2197 1.1830 0.9280 0.9109 0.8263 0.8194 0.8156 0.8099 0.7922 0.0087 0.0005 -0.0702 F ig u ra 1 8. E sp ec tro d e R M N d
e 1
29 Resultados e Discussão
4.3. Triagem Biológica dos extratos obtidos a partir do cultivo em escala piloto 4.3.1. Avaliação da atividade antibacteriana
A atividade antibacteriana foi realizada através da determinação da concentração inibitória mínima (CIM) pelo método de microdiluição em microplaca, segundo a metodologia preconizada pelo “National Committee for Clinical Laboratory Standards” (NCCLS, 2003).
Para a revelação das placas foi utilizado o substrato resarzurina (7-hidroxi-10-óxido-3H-fenoxazin-3-ona). A resarzurina é um corante redox, que apresenta uma alteração colorimétrica relacionada com a atividade metabólica celular. O ensaio é baseado na capacidade de células metabolicamente viáveis em reduzir a resazurina (coloração azul) em resorufina (coloração vermelha). Esta conversão ocorre intracelularmente, pela atividade de enzimas mitocondriais (VEGA-AVILA; PUGSLEY, 2011). Dessa forma, a coloração azul indica que houve uma inibição do crescimento bacteriano, e a coloração vermelha indica presença de células bacterianas viáveis.
Para experimento de CBM, foram coletadas pequenas amostras dos poços com resultado positivo (inibição do crescimento – coloração azul) no experimento de CIM. O experimento de CBM verifica se há crescimento bacteriano após o tratamento e incubação e com isso pode-se analisar a possível ação bactericida ou bacteriostática da amostra.
Foram realizados ensaio de atividade antibacteriana com os extratos brutos das duas linhagens, M20 e M23, faixa de concentrações de 400µg/ml a 0,2µg/ml. Apenas na
concentração de 400µg/ml, houve inibição do crescimento bacteriano, com ação
bacteriostática no experimento de CBM. Para uma ação antibacteriana efetiva, é interessante que o extrato apresente atividade em concentrações menores que 100µg/ml (RIOS; RECIO,
2005). Sendo assim, nenhum dos extratos analisados apresentou potencial atividade antibacteriana.
4.3.2. Avaliação da atividade antitumoral
Com base no estudo químico dos extratos brutos, foram selecionados os seguintes extratos para o ensaio antitumoral: M20A21d, M20C28d, M20P28d, M23A28d, M23C28d e M23P28d. Foram consideradas amostras com potencial citotóxico relevante os extratos que apresentaram inibição ≥ 75% na concentração de 50 µg/mL. Extratos da linhagem M20
30 Resultados e Discussão
do crescimento celular, um valor ainda maior que o controle positivo utilizado (Doxorubicina), como descrito na Tabela 4.
Tabela 4. Percentual de inibição da proliferação celular (%) das amostras M20A21d, M20C28d, M20P28d, M23A28d, M23C28d e M20P28d, frente à linhagem tumoral HCT-116. Valores são médias ± desvio padrão da média. Em destaque estão as amostras que apresentaram inibição da proliferação celular ≥75%.
4.4. Identificação da linhagem M20
A identificação da linhagem M20 foi realizada pela empresa Genotyping Biotecnologia LTDA., uma incubadora localizada em Botucatu-SP. Foi utilizado sequenciamento automático por eletroforese capilar no equipamento ABI 3500 Genetic Analyzer (Applied Biosystems) e alinhamento das sequências de nucleotídeos produzidas com as sequências de referência depositadas no banco de dados. O resultado do sequenciamento demonstrou maior identidade da linhagem M20 com o fungo Hypocrea lixii, apresentando 100% de identificação com esta espécie.
A linhagem M23 já havia sido identificada anteriormente, como pertencente ao gênero Eutypella, não sendo possível a identificação da espécie.
4.5. Obtenção dos extratos em escala ampliada
Com base nos resultados de análise química dos extratos obtidos a partir do experimento piloto, primeiramente, foi selecionada a linhagem M20 cultivada em Arroz para o crescimento em escala ampliada, sendo que os critérios utilizados para a escolha foram:
- Massa do extrato bruto
- Perfil cromatográfico obtido via CLAE-DAD - Resultado da triagem biológica
Amostras Inibição da proliferação celular (%)
M20A21d 98,39 ± 3,13
M20C28d 87,00 ± 2,12
M20P28d 83,37 ± 7,33
M23A28d 30,08 ± 3,27
M23C28d 39,06 ± 0,43
M23P28d 9,36 ± 1,26
31 Resultados e Discussão
Foi escolhido o período de 21 dias de cultivo, uma vez que as análises cromatográficas do extrato da linhagem M20 em arroz não diferem significativamente entre os períodos de 21 e 28 dias. Além disso, o extrato bruto da linhagem M20 cultivado em arroz apresentou um interessante potencial citotóxico frente células tumorais HCT-116 (câncer de cólon humano). Assim, após a reativação, cultivo (10 frascos tipo Erlenmeyer) e extração, foi obtido o extrato bruto com massa de 14,98g.
Em um segundo momento, foi realizado o cultivo em escala ampliada da linhagem M23 (Eutypella sp) em meio PDB por 28 dias, e a massa do extrato obtido foi de 1,04g.
4.6.Estudo químico e biológico do fungo Hypocrea lixii (linhagem M20 – cultivo em
escala ampliada)
4.6.1. Fracionamento do extrato bruto via CLV – linhagem M20 (H. lixii)
O fracionamento do extrato bruto teve início com a cromatografia líquida a vácuo (CLV) em fase normal e fase móvel com gradiente crescente de polaridade (100% hexano – 100% acetato de etila – 100% metanol). Foram utilizados 9,0g do extrato bruto da linhagem M20A cultivada em arroz em escala ampliada, resultando em nove frações, M20A a M20I (Tabela 5). Todas as frações foram concentradas em rotaevaporador e armazenadas.
Após a concentração, a fração M20G apresentou uma porção líquida amarelada e um precipitado branco, sendo o precipitado insolúvel em diclorometano. Essas porções foram separadas, sendo a porção líquida denominada M20G1 e o precipitado M20G2. O precipitado foi lavado com diclorometano, obtendo-se um cristal branco.
Tabela 5. Rendimento das frações de CLV
Fração Fase Móvel Massa Obtida
M20A 100% H 0,016g
M20B 90%H : 10%A 0,875g
M20C 80%H: 20%A 0,163g
M20D 60%H: 40%A 1,056g
M20E 40%H : 60%A 0,096g
M20F 20%H: 80%A 0,055g
M20G1 100%A 0,112g
M20G2 100%A 0,038g
M20H 25%A : 75%M 0,029g
M20I 100%M 5,218g
32 Resultados e Discussão
4.6.2. Análise das frações apolares via CG-EM
As frações apolares (frações M20A, M20B, M20C, M20D) foram analisadas via CG-EM. Em todas as frações analisadas o sinal majoritário foi referente ao ácido n-hexadecanóico (ácido palmítico). Foram observados sinais de hidrocarbonetos e outros ácidos graxos. Na fração B observa-se que as principais substâncias são aldeídos. Os sinais majoritários, com área maior que 3%, de cada fração são apresentados nas Tabelas 6 e 7.
Tabela 6. Principais substâncias encontradas nas frações apolares analisadas via CG-EM, com similaridade maior que 90% quando comparado com banco de dados do equipamento.
Substância Similaridade Índice de Índice de Retenção obtido retenção da Índice de literatura* Fração M20 A
Heptadecano 97% 1707 1711
Octadecano 97% 1924 1810
Ácido palmítico 96% 1967 1968
Ácido oleico 95% 2142 2175
Tetracosano 97% 2414 2407
Tetratetracontano 97% 4436 4395
Fração M20 B
Nonanal 94% 1128 1102
2-decenal 95% 1270 1212
2-undecenal 95% 1372 1311
Ácido palmítico 96% 1970 1968
Fração M20 C
Ácido palmítico 97% 1994 1968
Ácido oleico 96% 2159 2175
Ácido esteárico 97% 2185 2167
Fração M20 D
Ácido palmítico 96% 1990 1968
Ácido oleico 96% 2155 2175
Ácido octadecanóico 96% 2175 2167
Estigmasterol 95% 4450 4456