PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
CARLOS ALBERTO GALEANO SUAREZ
OTIMIZAÇÃO DA PRODUÇÃO DE ETANOL 2G A PARTIR DE HEXOSES E PENTOSES
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
CARLOS ALBERTO GALEANO SUAREZ
OTIMIZAÇÃO DA PRODUÇÃO DE ETANOL 2G A PARTIR DE HEXOSES E PENTOSES
Tese de Doutorado apresentada ao Programa de Pós-Graduação em Engenharia Química da Universidade Federal de São Carlos como parte dos requisitos necessários à obtenção do título de Doutor em Engenharia Química, área de concentração em Pesquisa e Desenvolvimento de Processos Químicos.
Orientador: Profa. Dra. Teresa Cristina Zangirolami Co-orientador: Prof. Dr. Ruy de Sousa Jr. Co-orientador: Prof. Dr. Antônio Carlos Luperni Horta
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária/UFSCar
G152op
Galeano Suarez, Carlos Alberto.
Otimização da produção de etanol 2G a partir de hexoses e pentoses / Carlos Alberto Galeano Suarez. -- São Carlos : UFSCar, 2014.
165 f.
Tese (Doutorado) -- Universidade Federal de São Carlos, 2014.
1. Engenharia química. 2. Hidrólise enzimática. 3. Celulose. 4. Bagaço de cana. 5. Bioreatores. 6. Batelada alimentada. 7. Xilulose. 8. S. cerevisiae. I. Título.
Agradeço a Deus por dar-me a vida e forças para não desistir.
À minha orientadora, Profa. Dra. Teresa Cristina Zangirolami pelos ensinamentos, ajuda e a confiança depositada na realização deste projeto.
Ao meu co-orientador, Prof. Dr. Ruy de Sousa Jr. por todas as orientações, ensinamentos, paciência e dedicação brindados ao longo destes anos.
Ao meu co-orientador, Prof. Dr. Antônio Carlos Luperni Horta pela colaboração e ajuda brindados na realização deste trabalho.
Ao Prof. Dr. Roberto de Campos Giordano e à Prof. Dra. Raquel de Lima Camargo Giordano por toda a ajuda e conhecimento compartilhado.
À Profa. Dra. Isabel Rocha e ao Prof. Dr. Eugénio Campos Ferreira da Universidade do Minho (Portugal), que gentilmente colaboraram neste doutorado sanduíche.
A todos os meus companheiros dos Laboratórios de Desenvolvimento e Automação de Bioprocessos (LaDABio) e de Engenharia Bioquímica do DEQ/UFSCar pela amizade e ajuda oferecida. Agradeço especialmente a Adilson, Ana Maria, Claudinha, Cíntia, Dasciana, Edson, Guilherme, Gilson, Marcelo, Mirella, Patrícia, Ursula, Felipe, Renata, Renan, Luciano, aos alunos da turna J da disciplina Desenvolvimento de Processos Químicos 2 (DPQ2), pelos conselhos e amizade que foram muito importantes para a realização deste
doutorado.
À minha esposa Inti por todo o apoio, compreensão carinho e ajuda incondicional. A minha família por sua confiança e apoio.
Aos técnicos, Amadeus, Thaís, Thiago e Aline pela ajuda nas análises dos experimentos.
À CAPES e ao CNPq pelo apoio financeiro.
RESUMO
A produção industrial de etanol combustível e de açúcar gera como principal subproduto o bagaço de cana de açúcar, que é queimado nas caldeiras para geração de energia. Entretanto, por ser um material lignocelulósico (constituído basicamente por três polímeros: celulose, hemicelulose e lignina), o bagaço pode ser reaproveitado para a produção de bioetanol de segunda geração (2G), que é um biocombustível renovável e ambientalmente amigável. Para que a produção industrial de etanol 2G se torne economicamente viável, é necessário o aproveitamento de todas as frações fermentescíveis presentes no bagaço de cana: fração C6 (celulose) e fração C5 (hemicelulose). Estas frações são submetidas a processos de hidrólise que geram como principais açúcares glicose e xilose respetivamente. É importante, portanto, que o microrganismo empregado para a produção de etanol 2G seja capaz de utilizar todos os açúcares gerados no processo de hidrólise. Neste trabalho foi escolhida a levedura
Saccharomyces cerevisiae por ser o principal microrganismo utilizado na produção industrial
de álcool combustível, embora, infelizmente, esta levedura seja incapaz de fermentar xilose. No entanto, embora S. cerevisiae não utilize xilose, pode fermentar a xilulose obtida pela
isomerização de xilose pela enzima xilose isomerase conhecida industrialmente como glicose isomerase. Assim, o objetivo do presente trabalho foi desenvolver e avaliar alternativas tecnológicas para a produção de etanol 2G a partir de hexoses e pentoses, utilizando S. cerevisiae selvagem. Em relação à Fração C6, neste trabalho foram abordados dois aspectos
importantes: i) estudo da operação em regime de batelada alimentada de um reator de hidrólise enzimática da fração C6 do bagaço de cana de açúcar, obtendo-se valores de concentração final de glicose de cerca de 200 g.L-1, superiores aos 45 g.L-1 alcançados em reator operado em bateladas simples; ii) modelagem cinética de sistemas complexos (hidrólise enzimática de substratos lignocelulósicos), no qual foi desenvolvido um interpolador utilizando a lógica fuzzy como uma ferramenta importante para representar os
processos de hidrólise enzimática de materiais lignocelulósicos de forma robusta e confiável. Já em relação à Fração C5, inicialmente aplicou-se técnicas simples de Engenharia Evolutiva, levando à seleção de uma linhagem diferenciada de S. cerevisiae, adaptada à assimilação de
xilulose em meio mínimo e caracterizada por reduzida formação de xilitol, a qual apresentou uma seletividade de ~7 getanol.gxilitol-1, valor significativamente superior à seletividade
alcançada pela linhagem selvagem, de ~2 getanol.gxilitol-1. A linhagem selecionada foi então
condição seletividades em torno de 4 getanol.gxilitol . Para fluxos de oxigênio nulo (cultivo
anaeróbio) ou acima de 0,3 mmol.gMS-1.h-1, a produção de etanol é drasticamente reduzida,
independentemente do fluxo de xilulose assimilado pelas células.
ABSTRACT
The industrial production of fuel ethanol and sugar generates the main byproduct of sugarcane bagasse, which is burned in boilers for power generation. However, as a lignocellulosic material (consisting basically of three polymers: cellulose, hemicellulose and lignin), bagasse can be reused for the production of second generation bioethanol (2G), which is a renewable and environmentally friendly biofuel. For industrial 2G bioethanol production becomes economically feasible, the use of all fermentable fractions present in the bagasse is required: C6 fraction (cellulose) and C5 fraction (hemicellulose). These fractions are subjected to hydrolysis processes that generate as main sugars glucose and xylose respectively. It is important, therefore, that the microorganism employed for the production of ethanol 2G is able to utilize all the sugars generated during the hydrolysis process. In this work we chose the yeast Saccharomyces cerevisiae to be the main microorganism used in the
industrial production of ethanol, although unfortunately, this yeast is unable to ferment xylose. However, while S. cerevisiae does not use xylose, can ferment xylulose obtained by
isomerization of xylose by the enzyme glucose isomerase. The objective of this study was to develop and evaluate technological alternatives for the production of ethanol 2G from hexoses and pentoses using wild S. cerevisiae. In relation to the C6 fraction, in this work two
important aspects have been addressed: i) study of the operation regime of a fed-batch reactor enzymatic hydrolysis of the C6 fraction of bagasse from sugarcane, yielding values of final glucose concentration of 200 g.L-1, higher than 45 g.L-1 achieved in batch reactor; ii) kinetic modeling of complex systems (enzymatic hydrolysis of lignocellulosic substrates), in which an interpolator was developed using fuzzy logic as an important tool to represent the processes of enzymatic hydrolysis of lignocellulosic materials for rugged and reliable manner. Now, in relation to the C5 fraction initially applied simple techniques of Evolutionary Engineering, leading to the selection of a different strain of S. cerevisiae,
adapted to assimilate xylulose in minimal medium and characterized by reduced formation of xylitol, which demonstrated a selectivity of ~7 getanol.gxilitol-1, significantly higher than the
selectivity achieved by the wild strain of ~2 getanol.gxilitol-1. The selected strain was studied in
ethanol production is drastically reduced , regardless of the flow xylulose assimilated by the cells.
LISTA DE ILUSTRAÇÕES
Figura 1.1 – Estrutura microscópica do bagaço de cana de açúcar. ... 26 Figura 1.2 - Estrutura da celulose, parte central da cadeia molecular. ... 27 Figura 1.3 – Estrutura da xilana. ... 28 Figura 1.4 - Micrografia eletrônica de varredura (MEV) para um material lignocelulósico com diferentes pré-tratamentos: (A) Sem pré-tratamento, (B) Hidrotérmico, (C) Ácido, (D) Alcalino. ... 29 Figura 1.5 – Representação esquemática da hidrólise enzimática da celulose ... 31 pela endoglucanase, exo-1,4-β-glucanase (CBH) e β-glicosidase (BG). Os quadrados cheios representam as extremidades redutoras e os quadrados abertos extremidades não redutoras. 31 Figura 1.6 – Exemplos de diferentes formas de cluster. a) círculos cheios, b) linhas, c) círculos ocos, d) elipse oca. ... 35 Figura 1.7 – Rotas do metabolismo da D-xilose e da D-xilulose em leveduras. ... 37 Figure 2.1 – Experimental apparatus for enzymatic hydrolysis... 50 Figure 2.2 – Comparison of experimental and simulated data of batch operation. Michaelis-Menten with inhibition parameters: k.e=0.112 g.L-1.min-1, km=15 g.L-1 and ki=4.5 g.L-1. Error bars are standard errors of independent triplicate experiments. Operating conditions are 50º C, pH 4.8, initial enzyme concentration e(0) = 7.8 g.L-1 842.4 FPU.Lsolutio-1 and initial
potential glucose concentration of 44 gpotential_glucose.Lsolution-1. ... 55
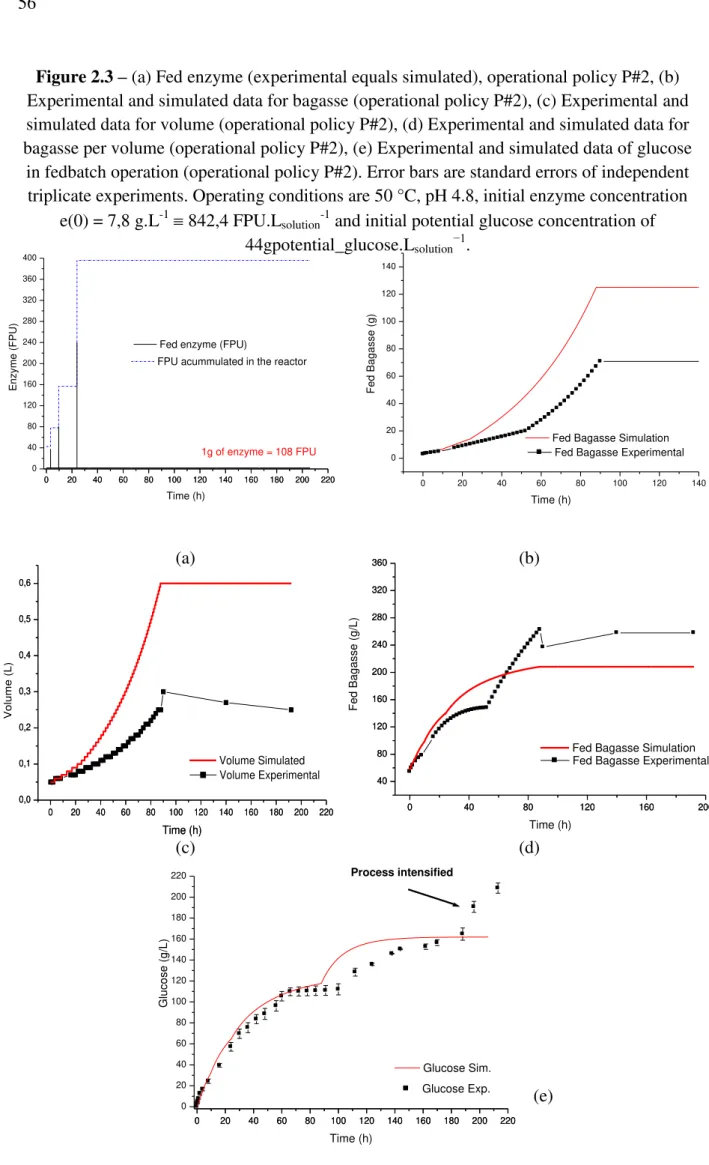
Figure 2.3 – (a) Fed enzyme (experimental equals simulated), operational policy P#2, (b) Experimental and simulated data for bagasse (operational policy P#2), (c) Experimental and simulated data for volume (operational policy P#2), (d) Experimental and simulated data for bagasse per volume (operational policy P#2), (e) Experimental and simulated data of glucose in fedbatch operation (operational policy P#2). Error bars are standard errors of independent triplicate experiments. Operating conditions are 50 °C, pH 4.8, initial enzyme concentration e(0) = 7,8 g.L-1 842,4 FPU.Lsolution-1 and initial potential glucose concentration of
44gpotential_glucose.Lsolution−1. ... 56
Figure 2.4 – (a) Experimental and simulated data for bagasse feeding for optimal control theory, (b) Experimental and simulated data for glucose during fed batch with optimal control. Operating conditions are 50 °C, pH 4.8, initial enzyme concentration e(0) = 73,4 g.L
-1 7927.2 FPU.L
solution-1 and initial potential glucose concentration of 44
7% de sólidos. (a) Enzima alimentada, (b) alimentação de bagaço pré-tratado, (c) Concentração de produto. As barras de erro referem-se a desvios padrões de experiências independentes em triplicata. As condições de operação são 50ºC, pH 4,8, concentração inicial de enzima e(0) = 13,05 g.L-1 1.409,4 FPU.Lsolução-1 e concentração inicial de glicose
potencial de 77,77 gglicose_potencial.Lsolução-1. ... 67
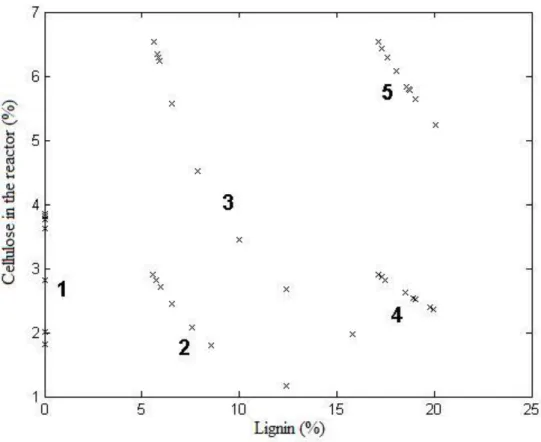
Figure 3.1 - Percentage of cellulose in the reactor versus percentage of lignin with regard to the substrate composition, during the hydrolysis processes, for the experimental data of Carvalho (19-20). The data are for five different lignocellulosic substrates (filter paper (1); exploded bagasse treated with 4% NaOH, low (2) and high load (3); bagasse treated with 1% H2SO4 and 4% NaOH, low (4) and high load (5))... 80 Figure 3.2 - First output for the clustering process. (∆) Center of the cluster for filter paper;
Figure 3.8 - Experimental data (percentage of cellulose in the reactor and percentage of lignin with regard to the substrate composition) for the validation experiment, in relation to cluster centers... 86 Figure 3.9 - Potential glucose concentration profiles. Comparison of experimental and simulated data for synthetic substrate. Error bars are standard errors of independent triplicate experiments. Operating conditions are 50°C, pH 4.8, enzyme concentration of 1200 FPU.Lsolution-1 and initial potential glucose concentration of 66.66 gpotential_glucose.Lsolution-1. ... 87
Figure 3.10 - Product concentration profiles. Comparison of experimental and simulated data for synthetic substrate. Error bars are standard errors of independent triplicate experiments. Operating conditions are 50°C, pH 4.8, enzyme concentration of 1200 FPU.L solution −1 and
initial potential glucose concentration of 66.66 gpotential_glucose.L solution−1... 87
Figure 4.1 - (a) Colonies observed in Itaiquara baker’s yeast YPD plates, (b) Yeast cells and other microorganisms observed in microscope (200x magnification) for Itaiquara baker’s
yeast suspension, (c) Colonies observed in YPD plates for the isolated wild-type strain, (d) Yeast cells observed in microscope (200x magnification) the isolated wild-type strain. ... 104 Figure 4.2 - (a) Growth of mutant strains on minimal defined medium with D-xylulose; (b) Growth of wild-type strain on YP medium with D-xylulose. ... 105 Figure 4.3 - Time evolution of cell concentration, consumption of D-xylulose and formation of metabolites during cultivation of S. cerevisiae under fermentative conditions, minimal defined medium. Temperature of 30 °C and pH 5.2 (a) selected colony 1, (b) selected colony 9, (c) selected colony 11 (experiments in duplicate). ... 109 Figure 4.4 - Evolution of cell concentration, consumption of D-xylulose and formation of products during cultivation of S. cerevisiae under fermentative conditions. Temperature of 30
°C and pH 5.2 (a) selected colony 11 with minimal medium. (b) selected colony 11 with YNB medium. ... 111 Figure 4.5 - Evolution of cell concentration, D-xylulose consumption and products formation during cultivation of wild-type S. cerevisiae under fermentative conditions. Temperature of
30 °C and pH 5.2 with minimal medium. Experiment in triplicate. ... 114 Figure 4.6 - Comparison of yeasts on bromocresol agar after two days of incubation. (a) Top: Mutant strain and Bottom: Wild strain. (b) Left: Mutant strain and Right: Wild strain. ... 115 Figura 5.1 – (a) Evolução da concentração celular, consumo de D-xilulose e formação de metabólitos durante o cultivo de S. cerevisiae em condições aeróbias, (b) Fluxos em xilitol,
arabitol e etanol em função do fluxo de assimilação de xilulose. Temperatura de 31 ºC e pH 5,0... 136 Figura 5.3 – (a) Batelada B3, Cultivo M1. Evolução da concentração celular, consumo de D-xilulose e formação de metabólitos durante o cultivo de S. cerevisiae em condições de
limitação de oxigênio yo2=0,047 (b) Fluxos em xilitol e etanol em função do fluxo de
assimilação de xilulose. Temperatura de 31 ºC e pH 5,0. ... 138 Figura 5.4 – (a) Batelada B4, Cultivo M2. Evolução da concentração celular, consumo de D-xilulose e formação de metabólitos durante o cultivo de S. cerevisiae em condições de
limitação de oxigênio com yo2= 0,02 (b) Fluxos em xilitol, arabitol e etanol em função do
fluxo de assimilação de xilulose. Temperatura de 31 ºC e pH 5,0. ... 140 Figura 5.5 – Bateladas B5, B6 e B7, Cultivo M2. Evolução da concentração celular, consumo de D-xilulose e formação de metabólitos durante o cultivo de S. cerevisiae em
condições de limitação de oxigênio: (a) yo2= 0,024; (c) yo2 = 0,004; (e) yo2 = 0,010. Fluxos
de metabólitos em função do fluxo de assimilação de xilulose para condições de limitação de oxigênio com: (b) yo2 = 0,024; (d) yo2= 0,004; (f) yo2 = 0,010. Temperatura de 31 ºC e pH
5,0... 142 Figura 5.6 – (a) Batelada B8, Cultivo M3. Evolução da concentração celular, consumo de D-xilulose e formação de metabolitos durante o cultivo de S. cerevisiae em condições de
limitação de oxigênio com yo2= 0,003 (b) Fluxos de xilitol, arabitol e etanol em função do
fluxo de xilulose para condições de limitação de oxigênio com yo2 = 0,003. ... 144
Figura 5.7 – Bateladas B9 e B10, Cultivo M3. Evolução da concentração celular, consumo de D-xilulose e formação de metabólitos durante o cultivo de S. cerevisiae em condições de
limitação de oxigênio (a) yo2 = 0,001. (c) yo2 = 0,002. Fluxos em xilitol, arabitol e etanol
em função do fluxo de assimilação de xilulose para condições de limitação de oxigênio (b)
yo2 = 0,001. (d) yo2 = 0,002. Temperatura de 31 ºC e pH 5,0. ... 146
Figura 5.8 – Viabilidade celular ao longo dos cultivos em condições de oxigênio limitado M1, M2 e M3. ... 147 Figura 5.9 – Valores de seletividade (mmoletanol.mmolxilitol-1) em função dos fluxos de
xilulose e oxigênio, obtidos a partir de: (a) Dados experimentais durante fermentações em batelada, anaeróbia e micro aeróbia (b) Dados in silico simulados com o software Optflux.
LISTA DE TABELAS
Tabela 1.1 – Experimentos de evolução adaptativa em laboratório com leveduras. ... 40
Table 2.1 - Characterization of pretreated sugarcane bagasse. ... 49
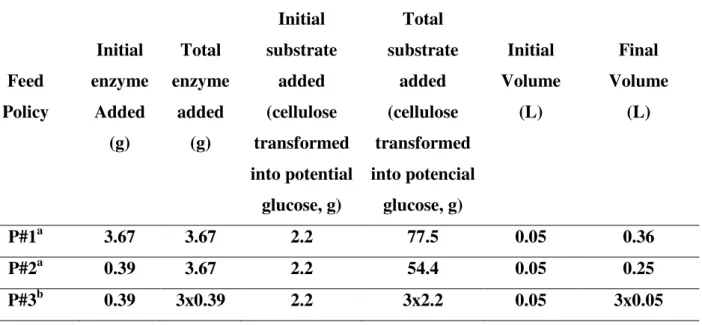
Table 2.2 - Added enzyme and substrate for P#1, P#2 and P#3. ... 51
Table 2.3 - Comparison of simulated and experimental data. ... 60
Table 3.1 - Semimechanistic kinetic models and kinetic parameters used to develop the fuzzy interpolator for the enzymatic hydrolysis of lignocellulosic materials (Carvalho, 19-20). ... 76
Table 4.1– Major applications of evolutionary engineering in Saccharomyces cerevisiae. ... 98
Table 4.2 - Main results from SIF experiments carried out with different S. cerevisiae strains. T = 35 oC; initial xylose concentration = ~ 65 g.L-1; initial biomass concentration = ~ 50 gDCW.L-1 (yeast cells immobilized in calcium alginate beads). Adapted from Moraes, 2013. ... 103
Table 4.3 - Evolutionary engineering experiments with minimal medium adapted mutants: overall variation of optical density, D-xylulose consumption and xylitol formation for cultivations under fermentative conditions. Temperature of 30 °C and pH 5.2. ... 106
Table 4.4 - Cultures performance indexes: specific growth rates (μ), cell/D-xylulose yields (Yx/s), D-xylulose assimilation rate (µD-xylulose), specific productivity (PrEtOH), ethanol/D-xylulose yields (YEtOH/S) and xylitol/D-xylulose yields (YXOH/S) for 3 colonies selected in shake cultures. Temperature 30 °C, pH 5.2. ... 110
Table 4.5 - Cultures performance indexes: cell/D-xylulose yields (Yx/s), D-xylulose assimilation rate (µD-xylulose), specific productivity (PrEtOH), ethanol/D-xylulose yields (YEtOH/S) and xylitol/D-xylulose yields (YXOH/S) for wild-type and selected S. cerevisiae (colony 11) in shake cultures. Temperature 30 °C, pH 5.2... 114
Tabela 5.1 - Sequência de experimentos em biorreator sob condições de limitação por oxigênio... 129
Tabela 5.2 – Indicadores de desempenho para o cultivo de S. cerevisiae M2 e M3 sob condições de limitação de oxigênio, tendo xilulose como substrato. ... 143
CNTP Condições normais de temperatura e pressão CX Concentração celular, (gmassa seca .L-1)
D Taxa de diluição (Ffeed/V), (min-1)
DO Densidade óptica
e Concentração de enzima, (g.L-1)
eacumulada Enzima acumulada no reator, (FPU)
ealim Enzima a ser adicionada no reator, (FPU)
Falim Vazão de alimentação de substrato, (L.min-1)
fi Fluxo de caixa do processo, (US$)
fi2 Fluxo de caixa do processo por kg de bagaço tratado (US$.kg-1 de bagaço tratado)
gMS Peso de massa seca (g)
H Hamiltoniano
J Índice de desempenho
k Taxa constante da hidrólise de celulose, (min-1) kI Constante de inibição competitiva, (g.L-1)
km Constante de Michaelis-Menten, (g.L-1)
Macumulada Massa acumulada de bagaço consumido, (g) mx Massa celular, (g)
ms Massa de substrato, (g)
mp Massa de produto, (g)
Mols de CO2 produzidas (mol.h-1)
NAD Nicotinamida Adenina Dinucleótido
NADH Nicotinamida Adenina Dinucleótido Hidreto NADP Nicotinamida Adenina Dinucleótido Fosfato
NADPH Nicotinamida Adenina Dinucleótido Fosfato Hidreto P Concentração de produto, (g.L-1)
P0 Concentração inicial do produto, (g.L-1)
Qe Vazão do gás de entrada, (L.h-1) Qs Vazão do gás de saída, (L.h-1)
R Constante dos gases ideais, (atm.L.mol-1.K-1)
r Velocidade de reação, (g.L-1.min-1)
rinicial Velocidade reação inicial, (g.L-1.min-1)
rset Velocidade reação set, (g.L-1.min-1)
S Celulose (transformada na concentração de glicose potencial), (g.L-1) S0 Concentração inicial de glicose potencial, (g.L-1)
Salim Concentração de substrato na alimentação, (g.L-1)
SIF Fermentação e isomerização simultâneas t Tempo, (s, min ou h)
t0 Tempo inicial, (s, min ou h)
tf Tempo final, (s, min ou h)
Te Temperatura do gás de entrada, (K) Ts Temperatura do gás de saída, (K) u Variável de controle
V Volume de reação, (L)
VPF Via Pentose Fosfato
V0 Volume inicial de reação, (L)
x Variável de estado X Conversão de substrato
Fração molar de CO2 na entrada
Fração molar de CO2 na saída
Fração molar de N2 na entrada
Fração molar de N2 na saída
YX/S Fator de conversão de substrato a células, (gmassa seca.gsubstrato-1)
YX/P Fator de rendimento de células a produto, (gproduto.gmassa seca-1)
INTRODUÇÃO ... 21
CAPÍTULO 1 ... 26
REVISÃO BIBLIOGRÁFICA ... 26
1.1 BAGAÇO DE CANA-DE-AÇÚCAR ... 26
1.1.1 CELULOSE ... 27
1.1.2 HEMICELULOSE ... 27
1.1.3 LIGNINA ... 28
1.2 PRÉ-TRATAMENTO ... 28
1.3 HIDRÓLISE ENZIMÁTICA DE CELULOSE ... 30
1.4 ETANOL DE SEGUNDA GERAÇÃO (2G)... 32
1.5 INTELIGENCIA ARTIFICIAL EM ETANOL 2G ... 33
1.5.1 LÓGICA FUZZY (NEBULOSA) ... 33
1.5.2 AGRUPAMENTO DE DADOS (CLUSTERING) ... 34
1.6 METABOLISMO DE XILULOSE EM S. cerevisiae ... 35
1.7 ENGENHARIA EVOLUTIVA... 38
CAPÍTULO 2 ... 43
APROVEITAMENTO DA FRAÇÃO C6 DO BAGAÇO DE CANA-DE-AÇUCAR ... 43
CAPÍTULO 3 ... 68
MODELAGEM CINÉTICA DE SISTEMAS COMPLEXOS: HIDRÓLISE ENZIMÁTICA DE SUBSTRATOS LIGNOCELULÓSICOS ... 68
CAPÍTULO 4 ... 92
ELEVADA SELETIVIDADE ETANOL/XILITOL EM LINHAGEM DE Saccharomyces cerevisiae ADAPTADA À ASSIMILAÇÃO DE XILULOSE... 92
CAPÍTULO 5 ... 121
PRODUÇÃO DE ETANOL 2G A PARTIR DA FRAÇÃO HEMICELULÓSICA POR S. cerevisiae ADAPTADA: INFLUÊNCIA DOS FLUXOS DE OXIGÊNIO E XILULOSE ... 121
CONCLUSÕES E SUGESTÕES PARA A CONTINUIDADE DO TRABALHO ... 157
CONCLUSÕES ... 157
SUGESTÕES PARA TRABALHOS FUTUROS ... 159
INTRODUÇÃO
A produção de etanol de segunda geração a partir de biomassa lignocelulósica tem sido estudada intensivamente. Essa biomassa é essencialmente composta de lignina (20–
30%), celulose (33–51%) e hemicelulose (19–34%) (VAN MARIS et al., 2006). As duas
últimas frações são polissacarídeos cuja hidrólise (química e/ou enzimática) gera principalmente hexoses a partir da celulose (majoritariamente glicose), e pentoses a partir da hemicelulose (majoritariamente xilose). O bagaço de cana de açúcar é do ponto de vista técnico-econômico, uma das mais promissoras matérias-primas para produção de etanol 2G, pois já foi coletado no campo, estando disponível no sítio industrial para processamento (FURLAN et al., 2013).
O processo de produção de etanol de segunda geração (2G) começa com o pré-tratamento do material segido da hidrólise enzimática do bagaço (fração C6 da biomassa), a qual envolve a ação sinérgica de vários tipos de celulases. As enzimas que hidrolisam a celulose são divididas em três grupos principais: endoglucanases, celobiohidrolases e β -glicosidases. Sinergismo é geralmente definido como o aumento da atividade exibido por uma mistura de enzimas comparada com a soma das atividades das enzimas individuais (AL-ZUHAIR, 2008). A hidrólise enzimática é complexa, sendo afetada por vários fatores como: estabilidade e diferença nas propriedades da enzima, adsorção improdutiva da enzima, principalmente sobre a lignina ainda presente após o pré-tratamento, efeitos inibitórios dos produtos, resistência ao transporte de massa e superlotação das enzimas sobre a matriz de substrato, dentre outros (ROTHSCHILD, 1998; WILLIAMS, 2001). Assim, como descrito em Sousa Jr. et al. (2011) o modelo cinético do processo está longe de ser trivial.
Estabelecidas as condições de hidrólise, a fermentação alcoólica da glicose é trivial, havendo linhagens da levedura Saccharomyces cerevisiae adaptadas ao ambiente industrial, robustas e
aptas a suplantar a competição com microrganismos contaminantes. Assim, no contexto da produção de etanol a partir da celulose, um grande desafio reside na etapa de hidrólise dessa fração, e o presente trabalho pretende contribuir para a sua otimização por meio da utilização de ferramentas computacionais e da realização de ensaios experimentais.
predominantemente xilose e glicose, além de outras pentoses. Análises econômicas do processo de produção de etanol 2G publicadas recentemente (MACRELLI et al., 2012; FURLAN et al., 2012; DIAS et al., 2013), mostram que o aproveitamento parcial da fração
hemicelulósica da biomassa é essencial para viabilizar economicamente a produção industrial de bioetanol. Porém, o grande desafio para a implementação de um processo industrial de obtenção de etanol a partir de pentoses reside justamente na etapa de fermentação, já que S. cerevisiae não metaboliza xilose naturalmente (CHU; LEE, 2007).
Para viabilizar a fermentação alcoólica de pentoses em nível industrial, basicamente três abordagens são encontradas na literatura ou em patentes:
a) utilizar microrganismos naturalmente etanologênicos como, por exemplo, as leveduras Pichia stipitis, Pachysolen tannophilus ou Candida shehate. A
aplicação desta abordagem, entretanto, apresenta dificuldades: baixa tolerância a etanol desses microrganismos, baixas velocidades de fermentação, inibição por subprodutos originados do pré-tratamento da matéria prima e necessidade de operação em microaerobiose, ou seja, demanda controle muito fino dos níveis de oxigênio dissolvido, em biorreatores de grande porte (OLOFSSON et al., 2008);
b) aplicar técnicas de biologia molecular, modificando a levedura S. cerevisiae (ou, menos frequentemente, algum outro microrganismo), de forma a
incorporar genes das enzimas da rota catabólica da xilose. Essa é de longe a alternativa em que mais se vem investindo na literatura e na indústria há cerca de duas décadas (WALFRIDSSON et al., 1996), como demonstra o número de patentes depositadas/concedidas sobre o assunto (busca em outubro de 2013 na base Derwent, revelou 128 patentes sobre diferentes OGMs desenvolvidos com esse propósito – a grande maioria usando S. cerevisiae como plataforma). Esta abordagem, entretanto, tem
também sérias restrições, quando se pensa em sua aplicação para produzir uma
commodity como o álcool etílico combustível (com baixo preço de mercado e grande
escala de produção): dificuldade em se manter a estabilidade genética das linhagens recombinantes; baixos rendimentos em etanol e longos tempos de fermentação; competição com cepas selvagens e/ou com microrganismos contaminantes (bactérias e fungos) em um ambiente industrial não asséptico, em reatores de até 106 m3; restrições do marco regulatório para aplicação de OGMs, encarecendo procedimentos no processo industrial;
levedura, largamente empregada para produção de etanol de primeira geração, ao mesmo tempo em que evita os inconvenientes do uso de OGMs (RAO et al., 2008; SILVA et al.,
2012). Desta forma, utiliza-se a enzima glicose (ou xilose) isomerase (EC 5.3.1.5) para catalisar a isomerização (reação reversível que, entretanto, tem o equilíbrio químico deslocado no sentido da xilose, na razão 5:1), e a levedura selvagem para fermentar a xilulose a etanol (e, dependendo das condições operacionais e da linhagem, em xilitol). Essa ideia foi lançada em 1984, na patente US 4,490,468 (GONG et al. 1984). Nessa patente, os inventores propõem utilizar dois reatores independentes, com recirculação entre eles: um para isomerização enzimática xilose-xilulose (com enzima glicose isomerase, GI, livre ou imobilizada) e outro para a fermentação alcoólica da xilulose por
S. cerevisae.
A operação em reatores independentes, como proposto por Gong et al., (1984) permite superar uma dificuldade operacional importante: enquanto que xilose isomerases comerciais têm pH ótimo entre 7 e 8, e temperatura ótima ao redor de 70oC, a condição industrial para fermentação alcoólica tem pH entre 4 e 5 (para minimizar riscos de contaminação) e temperaturas entre 30 e 35oC. Mas, por outro lado, como a conversão de equilíbrio é baixa, há necessidade de grande recirculação entre os biorreatores, aumentando os custos de equipamentos e operacionais.
Alternativamente, a isomerização de xilose usando a enzima GI simultânea à fermentação de xilulose (processo SIF – Simultânea Isomerização e Fermentação), em alguns casos, com a levedura coimobilizada em suporte insolúvel é um processo já reportado na literatura. Tem a vantagem de utilizar a fermentação para deslocar o equilíbrio químico in situ: a xilulose produzida é metabolizada imediatamente, permitindo o prosseguimento da
reação até conversão total da xilose. Com esta técnica, intensifica-se o processo, que ocorre em um único reator. Silva et al., (2012) propõem a estabilização da enzima a pHs inferiores através de ligações covalentes multipontuais, com a GI suportada em quitosana, e esta envolvida por gel de alginato com a levedura nele imobilizada.
O processo SIF mencionado acima foi estudado em detalhes no âmbito do
Projeto Temático “BIOPROCESS SYSTEMS ENGINEERING (BSE) APPLIED TO THE
PRODUCTION OF BIOETHANOL FROM SUGARCANE BAGASSE” (2008/56246-0),
subproduto xilitol, reduzindo o rendimento em etanol a valores em torno de 0,3 getanol.gsubstrato -1. Assim, no contexto do desenvolvimento do processo SIF, o presente trabalho pretende
contribuir especificamente para o melhor entendimento do metabolismo da D-xilulose por S. cerevisiae, buscando identificar condições que levem a um melhor rendimento em etanol.
Assim, sendo o objetivo principal deste doutorado o estudo, de forma integrada, da produção de bioetanol a partir das duas principais fontes de açúcares fermentáveis presentes no bagaço de cana de açúcar, fração celulósica (C6) e hemicelulósica (C5), foi adotada a estrutura descrita a seguir para a presente tese.
O Capítulo 1 apresenta a “REVISÃO BIBLIOGRÁFICA”, onde são abordados os principais conceitos relacionados ao bagaço de cana, pré-tratamento e hidrólise. Apresentam-se também, neste capítulo, os conceitos mais importantes da lógica fuzzy e
clustering, além de uma revisão relacionada ao metabolismo de xilulose em S. cerevisiae pela
Via Pentose Fosfato (PPP – Pentose Phosphate Pathway).
No Capítulo 2, “APROVEITAMENTO DA FRAÇÃO C6 DO BAGAÇO DE
CANA-DE-AÇUCAR” é apresentado um artigo no qual, utilizando reatores em escala de bancada operados em regime de batelada aliementada, foram avaliadas duas políticas de alimentação diferentes. A primeira política fez uso da alimentação de substrato e enzima, para sustentar altas taxas de produção de glicose. A segunda só considera a alimentação de substrato ao reator em batelada alimentada, e foi definida utilizando a teoria clássica do controle ótimo.
O Capítulo 3, “MODELAGEM CINÉTICA DE SISTEMAS COMPLEXOS: HIDRÓLISE ENZIMÁTICA DE SUBSTRATOS LIGNOCELULÓSICOS” descreve a
criação de uma metodologia baseada num sistema “global” de cálculo de velocidades de
reação para a hidrólise enzimática da fração C6 do bagaço. Essa nova metodologia incorpora modelos ajustados em distintas condições de operação, utilizando uma técnica associada à
lógica nebulosa chamada técnica FCM (do inglês, “Fuzzy C-Means”).
O Capítulo 4, “ELEVADA SELETIVIDADE ETANOL/XILITOL EM LINHAGEM DE Saccharomyces cerevisiae ADAPTADA À ASSIMILAÇÃO DE XILULOSE” apresenta a metodologia utilizada para a seleção de uma levedura potencialmente produtora de etanol a partir de uma cepa comercial de S. cerevisiae assim
como os resultados obtidos em experimentos realizados em câmara rotativa com a linhagem selecionada.
O Capítulo 5, “PRODUÇÃO DE ETANOL 2G A PARTIR DA FRAÇÃO HEMICELULÓSICA POR S. CEREVISIAE ADAPTADA: INFLUÊNCIA DOS FLUXOS
biorreator, nos quais os fluxos de assimilação de D-xilulose, de produção de etanol e xilitol assim como de formação de biomassa para linhagem de S. cerevisiae previamente adaptada ao
crescimento em xilulose, foram avaliados em condições aeróbias, anaeróbias e de limitação de oxigênio.
CAPÍTULO 1
REVISÃO BIBLIOGRÁFICA
1.1 BAGAÇO DE CANA-DE-AÇÚCAR
O bagaço de cana-de-açúcar é um resíduo lignocelulósico que resulta do processo de produção industrial de açúcar e do etanol de primeira geração, constituído basicamente pelos polímeros: celulose, hemicelulose e lignina, em proporções que variam segundo as condições climáticas, o tipo de microrganismos a que esteve exposta a cana, idade e período de coleta (RABELO, 2007; REDDY; YANG, 2005; BANERJEE; PANDEY, 2002). Segundo Banerjee e Pandey (2002) a composição química do bagaço apresenta valores de celulose entre 32-48%, hemicelulose 19-24%, lignina 23-32%, e 3,2 a 5,5 % para as cinzas. O bagaço é formado por partículas de diferentes tamanhos, com valor médio de 20 mm, contendo em torno de 50% de umidade (SCHLITTLER, 2006). A Figura 1.1 mostra a microscopia eletrônica de varredura da estrutura da fibra do bagaço.
Figura 1.1 – Estrutura microscópica do bagaço de cana de açúcar.
1.1.1 CELULOSE
A celulose é um polímero natural linear de cadeia longa e fórmula geral (C6H10O5)n, composto por subunidades de D-glicose (β-D-glicopiranose) ligadas entre si por
ligações glicosídicas do tipo β-1,4, formando moléculas de celobiose como mostra a Figura
1.2 (RABELO, 2007). A celulose pode se apresentar na forma cristalina ou amorfa. Nesta última conformação, a celulose encontra-se mais suscetível à degradação enzimática (FENGEL e WEGENER, 1989). Devido às fortes ligações presentes na sua estrutura, a celulose é praticamente insolúvel em água e em solventes orgânicos comuns (HON, 1996).
Figura 1.2 - Estrutura da celulose, parte central da cadeia molecular.
Fonte: http://pt.wikipedia.org/wiki/Ficheiro:Cellulose_Sessel.svg
1.1.2 HEMICELULOSE
Figura 1.3 – Estrutura da xilana.
Fonte: http://www.sigmaaldrich.com/life-science/metabolomics/enzyme-explorer/learning-center/carbohydrate-analysis/carbohydrate-analysis-ii.html
1.1.3 LIGNINA
A lignina é um material hidrofóbico com estrutura tridimensional ramificada de natureza aromática (SILVA et al., 2009). É a substância que confere rigidez à parede das células, sendo responsável pelo seu suporte estrutural, impermeabilidade e resistência ao ataque microbiano (FENGEL; WEGENER, 1989). A presença da lignina reduz a eficiência da hidrólise de materiais lignocelulósicos, devido principalmente â perda das enzimas adicionadas em função da adsorção das mesmas na lignina. Por isso, é recomendável realizar inicialmente um processo de pré-tratamento para promover a deslignificação do material. Então, para que o bagaço de cana possa ser hidrolisado mais eficientemente, é preciso que o mesmo passe primeiramente por etapas de pré-tratamento, onde ocorre a separação da celulose, hemicelulose e lignina (CAVALCANTI, 2013).
1.2 PRÉ-TRATAMENTO
podendo-se destacar as que utilizam processos físicos, químicos, biológicos ou uma combinação destes (SUN; CHENG, 2002).
Dentre os diversos métodos existentes para realizar o pré-tratamento de materiais lignocelulósicos, os mais comumente utilizados são:
Termohidrólise: o processo consiste, em se colocar o material sob condições de
alta temperatura e pressão, utilizando-se geralmente água quente a pressões acima do ponto de saturação para hidrolisar a hemicelulose (HAMELINCK et al.,2005).
Hidrólise ácida: neste pré-tratamento a biomassa é tratada com ácidos
concentrados ou diluídos (ácido sulfúrico, clorídrico ou nítrico) para conseguir a solubilização da hemicelulose e obter uma celulose mais accessível (HENDRIKS; ZEEMAN, 2009).
Hidrólise alcalina: o pré-tratamento é conduzido com a utilização geralmente
de hidróxido de sódio, amônia, ureia ou hidróxido de cálcio. Este processo requer condições de reação mais amenas quando comparado com outros tipos de pré-tratamento (RABELO, 2007). A Figura 1.4 apresenta alterações morfológicas causadas a um material lignocelulósico após vários tipos de pré-tratamento.
Figura 1.4 - Micrografia eletrônica de varredura (MEV) para um material lignocelulósico com diferentes pré-tratamentos: (A) Sem pré-tratamento, (B) Hidrotérmico, (C) Ácido, (D)
Alcalino.
Outros pré-tratamentos também comumente utilizados são: deslignificação oxidativa, explosão a vapor, AFEX (ammonia fiber explosion), explosão de CO2, ozonólise e
processo organosolv (GÁMEZ et al., 2006; SUN; CHENG, 2005).
Para a realização deste trabalho foi escolhida a hidrólise alcalina, realizada com hidróxido de sódio por utilizar temperaturas e pressões baixas quando comparadas com outras tecnologias de pré-tratamentos. Na hidrólise alcalina, o efeito da base depende do conteúdo de lignina no material. Durante a ativação da celulose com hidróxido de sódio, a água penetra nas fibras da biomassa provocando um inchaço das fibras, rompendo as ligações de hidrogênio entre a hemicelulose e a lignina, aumentando a porosidade e diminuindo a cristalinidade do material (RABELO, 2007; BALAT et al, 2008).
1.3 HIDRÓLISE ENZIMÁTICA DE CELULOSE
No processo de hidrólise enzimática, o material lignocelulósico passa primeiramente por etapas de pré-tratamento para remover parte da lignina e/ou aumentar a acessibilidade ao ataque enzimático. Durante este processo e dependendo do pré-tratamento utilizado, a maior parte dos açúcares da hemicelulose são solubilizados. Após o pré-tratamento é necessária uma etapa de hidrólise da celulose para obtenção de açúcares fermentescíveis. No processo enzimático, a hidrólise da celulose é catalisada por enzimas específicas denominadas de celulases (EKLUND et al., 1990).
As celulases são altamente específicas em relação ao substrato, reduzindo a produção de subprodutos indesejáveis durante a reação, levando assim, a uma diminuição dos custos em tratamentos complementares para remoção de produtos que podem ser tóxicos para a levedura. Estes complexos enzimáticos são produzidos principalmente utilizando fungos filamentosos do gênero Trichoderma, Aspergillus e Penicillium por fermentação submersa,
sendo Trichoderma reesei o microrganismo mais utilizado industrialmente (WYMAN, 2003;
SHEN; XIA, 2004).
Figura 1.5 – Representação esquemática da hidrólise enzimática da celulosepela endoglucanase, exo-1,4-β-glucanase (CBH) e β-glicosidase (BG). Os quadrados cheios representam as extremidades redutoras e os quadrados abertos extremidades não redutoras.
Fonte: LYND et al., 2002
As endoglicanases ou endo-1,4-β-glucanases atuam aleatoriamente ao longo da molécula de celulose, hidrolisando as ligações internas, preferencialmente da região amorfa (região de baixa cristalinidade), criando cadeias com extremidades livres, atacando interna e aleatoriamente a cadeia de carboidrato, sendo menos efetivas contra celulose cristalina (SUN; CHENG, 2002).
gerando principalmente celobiose (que é um dissacarídeo composto por duas moléculas de glicose).
As β-glicosidases ou celobiases são responsáveis por clivar a celobiose e outros celo-oligossacarídeos curtos produzidos pelas celobiohidrolases, produzindo duas moléculas de glicose (ver Figura 1.5) (THONGEKKAEW, 2008).
1.4 ETANOL DE SEGUNDA GERAÇÃO (2G)
A capacidade de produção de biocombustíveis líquidos de primeira geração, produzidos principalmente a partir de alimentos de consumo da população, como cereais, açúcar e oleaginosas, se encontra limitada. O etanol de milho nos EUA e o etanol do caldo de cana de açúcar no Brasil, dentre outros, precisariam ter sua produção aumentada para atender à crescente demanda global de combustíveis, que quadruplicou entre 2000 e 2008 (SIMS et al., 2010). No entanto, biocombustíveis de primeira geração apresentam desvantagens como impacto negativo nos preços de alimentos e redução pouco significativa dos principais gases do efeito estufa (SIMAS, 2010).
Essas questões têm estimulado o interesse no desenvolvimento de biocombustíveis de segunda geração, produzidos a partir de biomassa não alimentar, um tema de pesquisa que tem sido bastante explorado ao longo das últimas três décadas. Essa biomassa lignocelulósica inclui subprodutos tais como palha de cereais, bagaço de cana-de-açúcar, resíduos florestais, dentre outros, excluindo-se do aparente dilema: combustível versus alimentos (SIMS et al., 2010).
Os combustíveis de segunda geração podem ser produzidos usando materiais lignocelulósicos via dois principais caminhos: rota bioquímica ou termoquímica. A primeira conta com enzimas e/ou microorganismos dedicados que podem quebrar celulose e hemicelulose para obter os açúcares contidos na biomassa e convertê-los em etanol. Este caminho produz “etanol celulósico”. O etanol celulósico tem um balanço de carbono excelente e pode reduzir emissões de gás carbônico em até 90% quando comparado aos combustíveis de petróleo. A rota termoquímica converte a biomassa através de processos como gasificação e pirólise rápida (BiodieselBR, 2008).
precisa, a concorrência direta é com o seu uso para geração de energia elétrica (BRASILAGRO, 2013).
1.5 INTELIGENCIA ARTIFICIAL EM ETANOL 2G
A inteligência artificial atualmente é uma ciência voltada para à resolução de problemas complexos em um vasto campo da pesquisa, esta técnica tem sido empregada com sucesso em diversas aplicações na área da engenharia e dos processos de produção. Uma aplicação que está perfeitamente inserida nesse contexto se refere ao processo de hidrólise de bagaço de cana para gerar etanol 2G, processo que tem como objetivo a retirada de todo o açúcar presente no material lignocelulósico para a produção de álcool, e resulta ser complexo devido as diferentes variáveis e os fenômenos envolvidos, por esta razão, buscou-se investigar o uso de ferramentas baseadas na inteligência artificial, como a lógica fuzzy, com o objetivo
de desenvolver um interpolador que permita descrever o processo de hidrolise de forma robusta e confiável.
1.5.1 LÓGICA FUZZY (NEBULOSA)
A lógica fuzzy proposta por Zadeh, (1965), é uma extensão da lógica
binária, admitindo valores intermediários entre 1 e 0 (e não somente 1 ou 0). A um dado elemento de um conjunto nebuloso é atribuído um grau de pertinência em relação ao conjunto. Tal grau de pertinência trata-se de valor numérico entre 0 e 1 (sendo 0 e 1 valores limites de pertinência: 0 = não e 1 = sim).
É importante, também, recuperar o conceito de variável linguística, que corresponde a variáveis descritas por valores linguísticos (conjuntos nebulosos) como “alto”,
“baixo”, etc. Tome-se como exemplo uma variável linguística denominada temperatura, cujos
valores linguísticos poderiam ser “baixa”, “média” e “alta”. Considerando um valor numérico de 25°C, por exemplo, poderia se dizer que 25°C é uma temperatura “baixa” com grau de pertinência 0,2, uma temperatura “média” com grau de pertinência 0,6, ou uma temperatura
de pertinência em relação a valores linguísticos (conjuntos nebulosos) de variáveis linguísticas é a noção básica de sistemas nebulosos.
A lógica fuzzy tem sido aplicada em muitos campos, desde teoria de controle a
áreas como entretenimento, finanças, indústria, sismologia, medicina e transporte (NUCCI, 2003). No campo da biotecnologia, como no caso dos processos fermentativos (que envolvem muitas reações biológicas que tornam o processo mais difícil de se controlar), o controle pode ser configurado pela experiência dos operadores humanos. Tal experiência pode ser descrita, geralmente, em termos de regras lingüísticas (de variáveis lingüísticas) do tipo
“SE-ENTÃO” (HONDA; KOBAYASHI, 2004), como no seguinte exemplo: “SE a
temperatura é “alta”, ENTÃO aumente o fluxo de refrigerante”.
Entre alguns trabalhos reportados na literatura sobre o uso da lógica fuzzy em
bioprocessos, podem ser citados Sousa e Almeida (2001), que desenvolveram um algoritmo
fuzzy para controle supervisório de um bioreator na produção de Cefalosporina C, Horiuchi e
Hiraga (1999), que aplicaram um controle fuzzy durante a produção em grande escala de uma
vitamina recombinante (VB2) e Fonseca et al., (2013), que propuseram um controlador fuzzy
-PI e uma estratégia de controle para regular a temperatura numa cuba de fermentação. Estes trabalhos fazem parte dos resultados bem sucedidos durante pesquisas em bioprocessos.
1.5.2 AGRUPAMENTO DE DADOS (CLUSTERING)
Figura 1.6 – Exemplos de diferentes formas de cluster. a) círculos cheios, b) linhas, c) círculos ocos, d) elipse oca.
O usuário deve definir que tipos de clusters serão procurados, definindo um critério de semelhança. O mais usual é considerar que esta medida de similaridade seja a distância de todos os dados até o centro do cluster. Neste caso, o centro do cluster representa o cluster e, portanto, é chamado de protótipo do cluster. Para outros critérios de similaridade, o protótipo do cluster pode ser diferente, como por exemplo, uma linha na Figura 1.6b ou um centro de círculo/elipse e seu raio nas Figuras 1.6c e 1.6d. Normalmente, o usuário deve especificar qual será o critério de similaridade e o número de clusters a serem detectados. De forma resumida, as técnicas de agrupamento podem ser distinguidas de acordo com propriedades como: tipo de variáveis às quais elas podem ser aplicadas (contínuas, inteiras, binárias); critério de similaridade; número de clusters fixo ou auto-adaptativo, partições
“rígidas” ou nebulosas (Nelles, 2001).
1.6 METABOLISMO DE XILULOSE EM S. cerevisiae
A levedura Saccharomyces cerevisiae principal microrganismo utilizado na
produção industrial de etanol não é capaz de fermentar xilose. Porém, pode fermentar o seu isômero xilulose, a etanol. A isomerização é catalisada pela enzima xilose (ou glicose) isomerase que é utilizada comercialmente no processo de produção de xarope de alto teor de frutose (SENAC; HAHN-HÄGERDAL, 1990; GONG et al. 1981).
Figura 1.7 – Rotas do metabolismo da D-xilose e da D-xilulose em leveduras.
Fonte: HAHN-HÄGERDAL et al., 2004.
Chiang et al. (1981a) constataram que S. cerevisiae e outras leveduras
fermentativas produzem etanol, xilitol e glicerol a partir de D-xilose e D-xilulose, indicando que estas leveduras possuem as enzimas responsáveis pela oxidorredução de pentoses.
Jeppson et al. (2002) explicaram que uma das principais causas da excreção de xilitol é um desequilíbrio redox provocado pelas duas primeiras enzimas da rota do metabolismo de xilose (xilose redutase e xilitol desidrogenase) que possuem cofatores diferentes, redutases com preferência por NADPH e desidrogenases que utilizam apenas NAD+.
Senac e Hahn-Hägerdal (1990) realizaram cultivos anaeróbios de S. cerevisiae
em batelada usando glicose ou xilulose como fontes de carbono, obtendo concentrações celulares de 0,74 e 0,37 gMS.L-1, respectivamente, e taxa de consumo de açúcar de 3,94 mmol.
cultivos usando glicose, o balanço de carbono fechou, enquanto que nos cultivos usando xilulose, em torno de 25% do carbono consumido não pôde ser contabilizado. Yu et al. (1995) explicaram que o carbono não contabilizado foi provavelmente perdido como dióxido de carbono na via das pentoses fosfato, uma vez que não foram detectados outros compostos carbônicos nas análises de HPLC, e não foi observada nenhuma perda notável de etanol por meio de evaporação ou de oxidação. O trabalho relata também, que sob a limitação de oxigênio, o carbono não contabilizado aumenta de 50% a 65%. A atividade aumentada da cadeia respiratória gera dióxido de carbono adicional em comparação com a fermentação anaeróbica.
Jeppsson et al. (1996) cultivaram S. cerevisiae em quimiostato sob condições
anaeróbias usando como substrato glicose e uma mistura de glicose/xilulose. A co-utilização de xilulose foi acompanhada por formação de etanol, acetato e arabitol. A atividade da enzima xiluloquinase estava ausente durante o metabolismo em glicose, mas foi detectada durante a utilização simultânea de xilulose e glicose.
1.7 ENGENHARIA EVOLUTIVA
A evolução é o conjunto de transformações biológicas ou mudanças das características hereditárias de populações ao longo de gerações sucessivas. Os processos evolutivos dão origem à diversidade em todos os níveis de organização biológica, incluindo espécies, organismos e moléculas como o DNA e as proteínas (KUTSCHERA; NIKLAS 2004). Segundo Klipp et al. (2009) a evolução é um processo aberto, sem uma meta pré-definida e que não necessariamente leva aos fenótipos desejados. No entanto, muitas características dos seres vivos se assemelham a um ideal teórico ou a uma solução hipotética que um engenheiro iria projetar.
Um exemplo da aplicação da engenharia evolutiva na produção de etanol é o trabalho realizado por Kuyper et al. (2005), no qual uma linhagem de S. cerevisiae modificada
geneticamente foi cultivada em quimiostato prolongado sob condições anaeróbias, obtendo uma estirpe que apresentava melhores taxas de consumo de glicose e xilose, e, um aumento na capacidade de transporte (Vmax) e na constante de afinidade para xilose (Km) , quando
comparada com a linhagem inicial.
Wisselink et al. (2009) realizaram fermentações com uma linhagem de S. cerevisiae modificada geneticamente, utilizando três diferentes tipos de misturas como
substrato (glicose/xilose/arabinose, xilose/arabinose e só arabinose). A estratégia utilizada consistia em bateladas repetidas com repetidos ciclos de crescimento, o que permitiu obter uma linhagem com melhores taxas específicas de consumo de xilose e arabinose, além de reduzir em até 40% o tempo de cultivo.
Sanchez et al. (2010) aplicaram as técnicas da engenharia evolutiva em cultivos em quimiostato, sob condições aeróbias e anaeróbias, usando xilose/arabinose como fonte de carbono, durante 400 h, para evoluir uma cepa de S. cerevisiae modificada geneticamente,
conseguindo aumentar a taxa de consumo de xilose e arabinose e melhorar a produção de etanol.
Cadière et al. (2011) realizaram bateladas de longa duração usando gluconato como fonte de carbono. Gluconato é um substrato de difícil assimilação pela S. cerevisiae,
sendo metabolizado pela via das pentoses fostato. Linhagens que evoluíram, apresentando maior capacidade de consumo do gluconato foram selecionadas. Uma análise dos fluxos metabólicos com glicose marcada revelou um aumento de 6% na via das pentoses fosfato na cepa evoluída, além de outras alterações metabólicas como: redução na produção de acetato, aumento nas taxas de fermentação e na produção de compostos de aroma. Características que combinadas representam um valor agregado na vinificação moderna.
Sonderegger e Sauer (2003) aplicaram a engenharia evolutiva para a seleção de uma linhagem de S. cerevisiae modificada geneticamente capaz de crescer eficientemente sob
condições anaeróbias. Para isto, foi necessário realizar uma adaptação lenta, na qual foram realizados cultivos em quimiostato inicialmente sob condições microaeróbias, e posteriormente novas linhagens da levedura foram submetidas a condições anaeróbias. Este procedimento totalizou 260 gerações de seleção, sendo um forte indicativo das múltiplas mutações necessárias para obter um novo fenótipo.
estudos biológicos para obter informações sobre os mecanismos da evolução e as mudanças adaptativas acumuladas em populações microbianas durante a seleção em longo prazo sobre condições de crescimento especificadas. Um fator importante durante a procura por novos fenótipos é o intervalo de tempo para o experimento de seleção. Na Figura 1.8, é possível observar diferentes experiências de EAL realizadas entre 100 e 2000 gerações, trabalho que toma geralmente algumas semanas ou até alguns meses.
Tabela 1.1 – Experimentos de evolução adaptativa em laboratório com leveduras.
Espécie, linhagem Tipo de cultivo Tempo de seleção Referencia Limitação por Nutrientre
S. cerevisiae Quimiostato
(limitação de glicose)
250 gerações Ferea et al., 1999
S. cerevisiae Quimiostato
(limitação de glicose)
500 gerações Duham et al., 2002
S. cerevisiae capable Quimiostato
(meio mínimo, anaeróbio,xilose)
170 gerações Sonderegger and Sauer, 2003
S. cerevisiae Quimiostato
(limitação de maltose)
25 gerações Jansen et al., 2005
S. cerevisiae CEN
PK ∆PDC156 Quimiostato e shaker (meio sintético,
indenpendencia C2)
Nd Jansen et al., 2005
S. cerevisiae Quimiostato
(limitação de glicose)
200 gerações Jansen et al., 2005
S. cerevisiae RWB
217 Quimiostato e batelada (xilose) Nd Kyuper et al., 2005
S. cerevisiae Arabinose, meio
sintetico
3500 horas Wisselink et al., 2007
S. cerevisiae Quimiostato e bateladas
sequenciais (glicose, xilose e
arabinose)
40 dias Wisselink et al., 2009
S. cerevisiae
DBY11331
Quimiostato (limitação de sulfato)
188 gerações Araya et al., 2010
S. cerevisiae
TMB3061 (meio sintetico, xilose e Quimiostato arabinose)
20 a 65 gerações Garcia Sanchez et al., 2010
S. cerevisiaeCEN-PK Galactose, meio mínimo 400 gerações Hong et al., 2011
S. cerevisiae
CEN.JB27 ∆PYC1
Meio mínimo, seleção de crescimento em
glicose
Nd Zelle et al., 2010
S. cerevisiae, sfca*
Pyc (limitação de nitrogênio) Quimiostato e batelada 30 dias Zelle et al., 2011
S. cerevisiae Fermentação em xilose Nd Shen et al., 2012 S. cerevisiae Quimiostato e batelada
(uso de xilose, produção de etanol)
120 gerações Zhou et al., 2012
S. cerevisiae
CMB.GSOD1
Cultivo aeróbio em xilose
10 ciclos Scalcinati et al., 2012
S. cerevisiae ∆jen1 Meio mínimo, lactato. 10 transferências De Kok et al., 2012 S. cerevisiae Meio YNB, tolerância a
hidrolisados lignocelulósicos
463 gerações Almario et al., 2013
Condição ambiental de estrese
S. cerevisiaeCEN-PK Quimiostato e batelada (múltiplos abiotic
estrese)
> 68 gerações Cakar et al., 2005
S. cerevisiaeCEN-PK Continuos pulsos de CoCl2
256 transferências Cakar et al., 2009
C. albicans Fluconazole 330 gerações Seimeckl et al., 2009
S. cerevisiae
BY4741 Meio YP Galactose 0,5 M NaCl 300 gerações Dhar et al., 2011
S. cerevisiae BL7 Meio YP,
0 – 25 g.L-1 CuSO4
Nd Adamo et al., 2012
S. cerevisiae Meio SD,
1,17% NaCl, 37 °C
25 gerações Gray and Goddard 2012
S. cerevisiae W303 Meio YP, 6- 8% de
etanol
14 gerações Avrahami;Moyal et al., 2012
S. cerevisiae Sais e estrese oxidativo 300 gerações Dhar et al., 2013
Miscellaneous
S. cerevisiae ∆myol Estrese cytokinesis
lactato.
Nd Rancati et al., 2008
S. cerevisiae EC1118 Meio SD, gluconato e
propriedades enological 240 gerações Cadiere et al., 2011, 2012
Fonte: DRAGOSITS et al., 2013.
Em resumo, a engenharia evolutiva ou a EAL é uma técnica que pode ser aplicada para melhorar a diversidade e as propriedades das espécies microbianas, como por exemplo, o uso de diferentes substratos, tolerância a maiores concentrações de etanol ou de inibidores e ainda temperatura mais altas, trazendo várias vantagens para a Engenharia de Bioprocessos, assim como avanços significativos na obtenção de produtos pelas chamadas
“fábricas de células microbianas”.
Finalmente, a maioria dos estudos encontrados na literatura utilizando engenharia evolutiva, foi realizado empregando linhagens de S. cerevisiae modificadas
de S. cerevisiae selvagens e tendo xilulose como fonte de carbono para melhorar a produção
CAPÍTULO 2
APROVEITAMENTO DA FRAÇÃO C6
DO BAGAÇO DE CANA-DE-AÇUCAR
Neste capítulo é apresentado um artigo no qual são descritas duas formas de operação de reatores de hidrólise de celulose – sequência de bateladas simples e batelada alimentada – esta última comprendendo duas políticas de alimentação diferentes. Estas políticas foram desenvolvidas com base em equações cinéticas simples, validadas usando reatores em escala de bancada. A primeira política fez uso da alimentação de substrato e enzima, para sustentar altas taxas de produção de glicose. O equacionamento inclui um modelo cinético de Michaelis-Menten pseudo-homogêneo, com inibição pelo produto. A segunda estratégia, por sua vez, considerou somente a alimentação de substrato ao reator em batelada alimentada, e foi definida utilizando a teoria clássica do controle ótimo. As simulações das estratégias de alimentação descritas neste capítulo foram realizadas pela doutoranda em Engenharia Química do PPG-EQ/UFSCar, Inti Doraci Cavalcanti Montano, utilizando o software MATLAB. Para maiores detalhes de como foram obtidos os perfis de alimentação Cavalcanti (2013).
Artigo: POLÍTICAS OPERACIONAIS ÓTIMAS EM REATOR PARA A HIDRÓLISE ENZIMÁTICA DE BAGAÇO DE CANA-DE-AÇÚCAR
OPTIMAL BIOREACTOR OPERATIONAL POLICIES FOR THE ENZYMATIC HYDROLYSIS OF SUGAR CANE BAGASSE
Inti Doraci Cavalcanti-Montaño, Carlos Alberto Galeano Suarez, Ursula Fabiola Rodríguez-Zúñiga, Raquel de Lima Camargo Giordano, Roberto de Campos Giordano
and Ruy de Sousa Júnior*
Department of Chemical Engineering – Federal University of São Carlos Rod. Washington Luís – Km 235 – CEP 13565-905 – CP 676 - São Carlos/SP – Brazil
Phone: +(55) (16) 3351 8713, Fax: +(55) (16) 3351-8266 * ruy@ufscar.br
ABSTRACT
which used economical criteria for comparing the performance of the reactor operating in successive batches and in fed-batch modes. Fed-batch mode was less sensitive to enzyme prices than successive batches. Process intensification in the fed-batch reactor led to glucose final concentrations around 200 g.L-1.
Keywords: enzymatic hydrolysis; cellulose; bagasse; sugar cane; bioreactor; fed-batch.
NOMENCLATURE
D is the dilution Ffeed/V (min-1)
e is enzyme concentration (g.L-1);
eaccumulated is enzyme accumulated in the reactor (FPU);
efeed is enzyme to be added into the reactor (FPU);
Ffeed is substrate feeding flow rate (L.min-1);
fi is process cash flow (US$);
fi2 is process cash flow per kg of treated bagasse (US$/kg bagasse treated); H is the Hamiltonian;
J is the performance index;
k is the rate constant of cellulose hydrolysis (min-1); ki isa (competitive) glucose inhibition constant (g.L-1); km is the Michaelis-Menten constant (g.L-1);
Maccumulated is accumulated mass of bagasse consumed (g);
P is the product concentration (g.L-1);
P0 is the initial product concentration (g.L-1);
r is reaction rate (g.L-1.min-1);
rinitial is initial reaction rate (g.L-1.min-1);
Sfeed is substrate concentration in the feed (g.L-1);
S0 is the initial potential product concentration (g.L-1);
t is time (s, min or h);
t0 is initial time (s, min or h);
tf is final time (s, min or h); u is control variable;
V is reaction volume (L);
V0 is initial reaction volume (L);
x is state variable;
X is substrate conversion.
λ is Lagrange multiplier.
INTRODUCTION
Cellulosic residues (among them sugar cane bagasse) have an important
positive feature as raw materials for liquid biofuels: they do not impact significantly the “food versusfuels” competition. An example is the production of second generation (2G) bioethanol
from sugar cane bagasse by the biochemical route, via the enzymatic hydrolysis of the biomass.
Sugar cane bagasse is a byproduct from the sugar and alcohol industry in Brazil. It consists of particles having a mean size of 20 mm, containing approximately 40% of the cane mass and humidity around 50% [1]. The bagasse composition depends on weather conditions and on the type of microorganisms to which the cane was exposed in the field. Banerjee and Pandey [2] report that sugarcane bagasse contains 32-48% of cellulose, 19-24% of hemicellulose, 23-32% of lignin and 3.2 to 5.5% of ash.
non-reducing ends), releasing cellobiose. This, ultimately, has its β-1→4 bonds hydrolyzed by β -glucosidase. This process is extremely complex, and is affected by several factors: inhibitory effects by the products, non-productive adsorption of the enzyme, mainly on the lignin still present after the pretreatment, resistance to mass transport, steric and "jamming" effects [5-6], among others. Thus, the kinetic modeling of the process is far from trivial, as described in Sousa Jr et al. [7]. Many kinetic models have been developed for the enzymatic hydrolysis of cellulose, but few are currently used in optimization or process control. Engineering practice for design and optimization has been based mainly on different empirical and semi-empirical approaches (non-mechanistic and semi-mechanistic models), including simple kinetic equations. Pseudo-homogeneous models, with two or three parameters, are frequently applied. They describe in very a simplified way the phenomena occurring in this complex system, but may show a good adherence to experimental data [7].
Cellulose hydrolysis using high loads of solids is an attractive alternative, reducing operation costs and water demands, and increasing the concentration of product [8]. Besides, the reduction of the impact of enzyme costs is still an important issue for the feasibility of the 2G-biochemical route, despite the recent progress towards cheaper enzyme cocktails.
Fed-batch reactors may minimize process costs. Yields and productivities may be increased using rational feed policies of substrates and catalysts to the reactor. Hodge et al. [9] developed an optimization strategy for cellulose hydrolysis for solid percentages higher than 15%, when inefficient stirring and mixing in tank reactors may become a problem. Starting from a previously developed model for batch operation [10], and considering modifications to account for effects of feeding in fed-batch operation, a feeding policy (profile) was developed (based on optimal control theory) to maintain the insoluble solids concentration at a manageable level. Therefore, sugar concentration within the tank reactor may be increased without using a high initial load of insoluble solids.
In the work by Morales-Rodríguez et al. [11], three different feedback (PI) control strategies were developed and evaluated using a first-principles model of the hydrolysis process. A (re-calibrated) model of Kadam et al. [10] was used to test the performance of three control strategies.
beginning of the reaction. Accessibility is a key factor governing the ability of the cellulases to catalyze the hydrolysis, and addition of a xylanase resulted in significant improvements in both hydrolysis yields and measured accessibility. The authors conclude that addition of ancillary enzymes or use of pretreatments that create more accessible substrates are required for an efficient hydrolysis at low enzyme loadings and high loads of solids.
More recently, Gupta et al. [13] carried out enzymatic hydrolyses at elevated solid loads (up to 20% w/v). A fed-batch strategy was implemented to enhance the final sugar concentration to 127 g.L-1. Batch and fed-batch enzymatic hydrolysates were fermented with
Saccharomyces cerevisiae and ethanol production of 34.78 g.L-1 and 52.83 g.L-1, respectively,
were achieved.
In this work, two different feeding policies were designed, based on simple kinetic equations, and validated using bench-scale reactors. The first one feeds only the substrate to the semi-continuous reactor, and was defined using classical, off-line optimal control theory (here called policy P#1). The second policy (P#2) made use of both substrate and enzyme feeding, for sustaining high rates of glucose production.
Cash flows for these two strategies were assessed and compared with a series of sequential batches (policy P#3), taking into account the costs of the feedstock, of the catalyst and the prices of ethanol (in 2012, in Brazil). The methodology allowed evaluation of the best operational mode of the reactor (batch versus fed-batch) using this metrics, for
different scenarios with respect to the price of the enzyme.
MATERIALS AND METHODS Enzyme and substrate
The commercial complex of cellulases Accellerase ® 1500, from Trichoderma reesei, donated by Genencor ® (Palo Alto, CA), was used. According to the manufacturer,