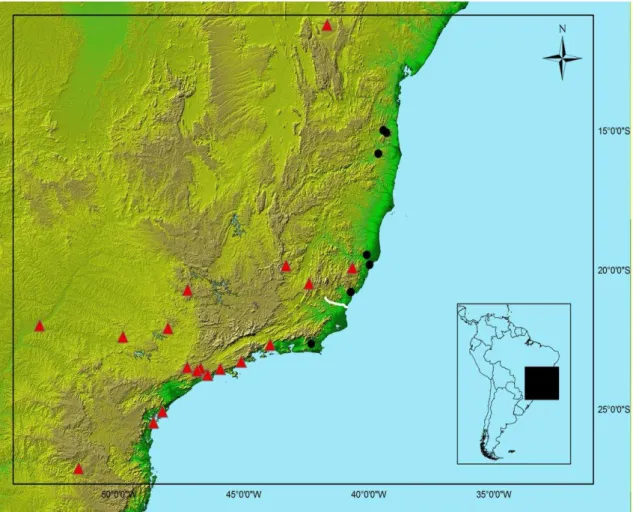
Relações biogeográficas entre comunidades de aves suportam diferentes histórias na mata atlântica
Texto
Imagem


Documentos relacionados
◦ Os filtros FIR implementados através de estruturas não recursivas têm menor propagação de erros. ◦ Ruído de quantificação inerente a
No latossolo (LEa), como houve cresci- mento máximo em altura e diâmetro aos seis me- ses após o plantio, foram determinados os níveis críticos de fósforo nas folhas para estes
O objetivo do curso foi oportunizar aos participantes, um contato direto com as plantas nativas do Cerrado para identificação de espécies com potencial
Cândida Fonseca Duração e local: 11/09/2017 a 03/11/2017 – Hospital São Francisco Xavier Objectivos e actividades desenvolvidas: Os meus objectivos centraram-se na
• A existência de bloqueio por devolução, seja na conta empresa ou na conta vinculada do trabalhador, impossibilita a informação da movimentação pelo empregador via
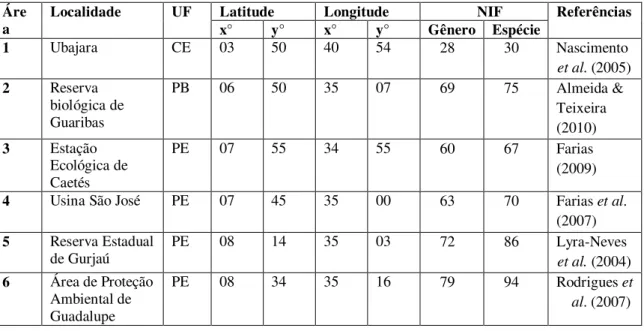
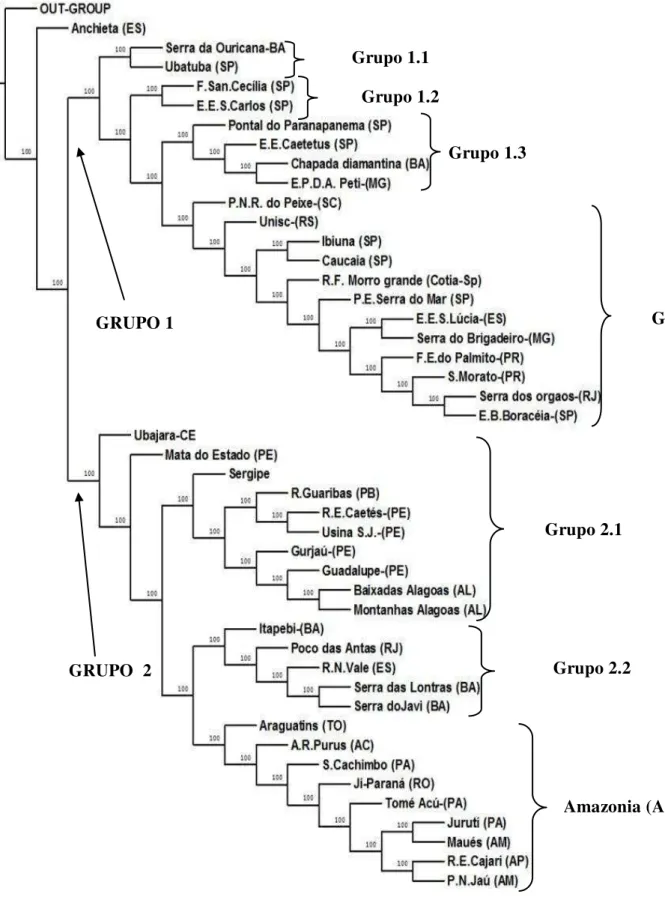
Espécies com registros apenas nas áreas limítrofes da Mata Atlântica, bem como espécies com ocorrência errante, não foram consideradas pertencentes ao
32 Figura 4 - Massa seca da parte aérea de mudas de Handroanthus ochraceus (Cham.) Mattos, produzidas com diferentes doses de adubação nitrogenada de cobertura
Em relação ao Currículo Tecnológico, McNeil (2001) afirma que a educação consiste na transmissão de conhecimentos, comportamentais éticos, práticas, sociais e